Karla Itzel Gutiérrez Riveroll1, Lizzette Corral Kassian1, Juan Manuel Rodríguez Zepeda2, Pedro Alberto Pimentel Ortega3, Bernardo Ramírez García4, Karla Guadalupe Lozada5
Recibido: 22-01-2024
Aceptado: 04-06-2024
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 5 pp. 670-678|https://doi.org/10.25237/revchilanestv54n5-24
PDF|ePub|RIS
Assessment of pain with ultrasound-guided femoral nerve and sciatic nerve blocks in pediatric patients with osteosarcomas
Abstract
Background: Osteosarcoma is the most common malignant primitive bone tumor. With the characteristic of bone formation. It frequently metastasizes to the lung. Interventional pain management techniques are often an important component in these patients for pain control. Objective: To assess pain control with ultrasound-guided femoral and sciatic nerve blocks in pediatric patients with osteosarcomas at baseline, at 24 hours and at 2 months. Material and Methods: A descriptive, retrospective, analytical, risk-free study was carried out, in which 21 patients with a diagnosis of osteosarcoma who were admitted to the pediatric oncology service of the CMN La Raza General Hospital will be included, who underwent surgery depending on the affected nervous territory an ultrasound-guided block of the femoral nerve, sciatic nerve or both to control pain without suspending drug management. Results: The correlation of the baseline VAS pain scale and 24-hour VAS with a value of p < 0.0005, in turn the baseline VAS scale compared with VAS at 2 months (p < 0.0005). This shows us adequate pain control during this period of time (p < 0.077). Conclusions: Femoral or sciatic block in osteosarcomas have become a formidable tool to offer quality of life and have another tool for pain control. It is a preventive alternative to reduce opioid consumption and the presentation of phantom limbs.
Resumen
Antecedentes: El Osteosarcoma es el tumor óseo primitivo maligno más frecuente. Con la característica de formación de hueso. Metastatiza con frecuencia al pulmón. Las técnicas intervencionistas de manejo del dolor son a menudo un componente importante en estos pacientes para el control del dolor. Objetivo: Valorar el control del dolor con bloqueos de nervio femoral y ciático ecoguiados en pacientes pediátricos portadores de osteosarcomas basal, a las 24 h y a los 2 meses. Material y Métodos: Se realizó un estudio descriptivo, retrospectivo, analítico, sin riesgo, en el cual se incluirán 21 pacientes con diagnóstico de osteosarcoma que ingresaron al servicio de oncología pediátrica del Hospital General del CMN La Raza a los cuales se les realizó dependiendo del territorio nervioso afectado un bloqueo ecoguiado de nervio femoral, nervio ciático o ambos para control del dolor sin suspender el manejo fármacos. Resultados: La correlación de la escala de dolor EVA basal y EVA de 24 h con un valor de p < 0,0005, a su vez la escala EVA Basal comparada con EVA a los 2 meses (p < 0,0005). Lo que nos demuestra el adecuado control del dolor durante este período de tiempo (p < 0,077). Conclusiones: El bloqueo femoral o ciático en osteosarcomas se han convertido en una herramienta formidable para ofrecer calidad de vida y contar con una herramienta más para el control del dolor. Es una alternativa preventiva para disminuir el consumo de opioides y la presentación de miembro fantasma.
-
Introducción
La Asociación Internacional para el Estudio del Dolor (IASP, por sus siglas en inglés) define el dolor como una experiencia sensorial y emocional desagradable asociada o similar a la asociada con daño tisular real o potencial[1].
Un cambio central en esta definición es el reemplazo de terminología que se basaba en la capacidad de la persona para describir experiencia, como un requisito para que sea calificado como dolor, excluyendo a cierta población pediátrica, ancianos y otros individuos incapaces de verbalizar su dolor[2].
El dolor agudo es una respuesta fisiológica normal a una noxa química, mecánica o térmica, que usualmente acompaña a una injuria traumática, proceso inflamatorio o procedimiento quirúrgico. Se caracteriza por ser autolimitado, resolviéndose en días o semanas con la resolución del mecanismo desencadenante. La IASP define al dolor crónico como aquel dolor sin aparente valor biológico, persiste más allá del tiempo normal de curación de los tejidos (mayor a tres meses)[3],[4].
Diferentes estudios muestran que la prevalencia del dolor agudo en pacientes pediátricos se encuentra entre 30% y 60%[5],[6]. Datos similares han sido observados para el dolor crónico en población pediátrica, con prevalencia de entre 15 hasta 80% según diferentes trabajos[7],[8].
Actualmente está demostrado que las vías nociceptivas están presentes desde la semana 24 de gestación. Esta claramente demostrado que los niños experimentan dolor, tienen memoria de este, y presentan mecanismos de sensibilización central y periférica[9].
Según el mecanismo fisiopatológico, el dolor se clasifica en nociceptivo y neuropático. El primero es causado por estimulación de los nociceptores como resultado de una injuria tisular e inflamación. Este se subclasifica en somático, con receptores en piel, tejidos blandos, músculo esquelético y huesos; y visceral por estimulación de los receptores viscerales. Este tipo de dolor tiene amplia distribución medular, y sus aferencias comparten las vías del sistema nervioso autónomo, esto hace que su localización sea imprecisa[9].
El dolor neuropático, según la IASP, es una afección neurológica que aparece como consecuencia de alteraciones del sistema nervioso, periférico (dolor neuropático periférico) como central (dolor neuropático central).
Es un dolor lancinante, paroxístico con parestesias y disestesias entre otras manifestaciones clínicas, muchas veces muy difícil de caracterizar por el paciente pediátrico. Existen también dolores como sucede en el paciente oncológico que coexisten ambos mecanismos del dolor[10].
-
Fisiopatología del dolor
El estímulo nociceptivo es transportado a través de los nervios periféricos aferentes, ingresando a la médula espinal a través del asta dorsal de la médula, para luego ser transmitido por la vía nociceptiva ascendente espinotalámica, espinorreticular y espinomesencefálica, al tálamo, sistema límbico y corteza cerebral. A su vez existen sistemas inhibitorios descendentes desde la corteza cerebral encargados de la modulación de estas vías nociceptivas a nivel medular y periférico.
Los aferentes sensoriales neuronales se clasifican según el tamaño de la fibra en 3 grupos (A, B, C). Las fibras involucradas en la transmisión del estímulo doloroso son las A Delta de pequeño calibre y mielínicas, y las fibras C finas no mielínicas. La estimulación repetida de los nociceptores lleva a disminución del umbral excitatorio, resultando en sensibilización periférica. A su vez, la estimulación mantenida de la fibras aferentes puede determinar un aumento gradual en las descargas neuronales a novel del asta dorsal de la médula hasta alcanzar un estado de descarga continua, fenómeno conocido como sensibilización central o “wind up”. Estos dos fenómenos de sensibilización central y periférica contribuyen a un estado de hipersensibilidad responsable de un descenso en el umbral del dolor, tanto en el sitio de la injuria (hiperalgesia primaria) como en el tejido circundante (hiperalgesia secundaria), lo cual puede determinar que el dolor se mantenga más allá de la duración esperada luego de la injuria[11].
-
Consideraciones pediátricas y del neurodesarrollo
Las vías nociceptivas están presentes y son fundamentales a partir de la semana 24 de edad gestacional. Si bien la transmisión a través de los nervios periféricos es más lenta por mielinización incompleta en la primeras etapas de vida, la mayor parte de las aferencias nociceptivas periféricas, tanto en niños como adultos, se realiza a través de las fibras amielínicas C[12].
Las vías inhibitorias descendentes maduran más tardíamente, lo que favorece las aferencias nociceptivas. Además, las neuronas del asta posterior de la médula espinal (segunda neurona de las vías del dolor) tienen campos nociceptivos más amplios, y sus umbrales son menores en el momento del nacimiento que en niños mayores o adultos. Esta demostrada la existencia de sensibilización central (con fenómenos de “winp up”) y periférica en niños desde el momento del nacimiento, incluso con menor umbral frente a nuevos estímulos[12],[13].
-
Dolor de origen oncológico en pacientes pediátricos
El reporte del INEGI 2022 en el intervalo de edad de los 5 – 14 años de los pacientes pediátricos el diagnóstico de tumores malignos como segunda causa de muerte en este grupo etario.
En el 2021, la Organización Mundial de la Salud (OMS) determinó que en el mundo, el 13% de las muertes, es decir 7,6 millones, fueron a causa del cáncer, 13% de todas las muertes, y con base en proyecciones, se estima que para el año 2030 la cifra se elevará a 13,1 millones. La causa más frecuente de cáncer en hueso es de origen metastásico[13].
El dolor óseo inducido por el cáncer es un estado de dolor de mecanismo mixto que exhibe elementos de dolor neuropático e inflamatorio, pero con modificaciones distintivas en el tejido y los nervios en la periferia, así como cambios neuroquímicos únicos a nivel de la médula espinal. Por lo tanto, es un síndrome complejo que involucra mecanismos inflamatorios, neuropáticos, isquémicos y específicos del cáncer, que a menudo ocurren en más de un sitio[14],[15]. La infiltración inflamatoria se produce como resultado del daño tisular causado por el crecimiento del tumor, así como la liberación de mediadores del dolor por parte de las células cancerosas. El componente neuropático del dolor puede resultar del daño inducido por el cáncer a los nervios sensoriales causado por la infiltración y/o compresión por las células tumorales, hiperinervación inducida por el tumor, y estiramiento o denervación a medida que el hueso se expande y se degrada. A medida que avanza la enfermedad, las células cancerosas inducen daño y deformación de los nervios periféricos en el hueso. El hueso está inervado por una estrecha red de neuronas simpáticas y sensoriales, y aunque el periostio se ha considerado durante mucho tiempo la parte del hueso más densamente inervada, cuando se considera el volumen total, la mayor cantidad de fibras nerviosas se encuentran en la médula ósea, seguido de la parte mineralizada del hueso y finalmente el periostio. Se ha establecido la inervación del hueso por varias fibras nerviosas, y se ha demostrado que el tamaño, la neuroquímica y la distribución segmentaria de la proyección neuronal desde el hueso hasta los ganglios de la raíz dorsal (GRD) y el asta dorsal son consistentes con funciones funcionales en la nocicepción[16].
Hay cambios neuroquímicos únicos en los GRD y el asta dorsal durante el dolor inducido por el cáncer, lo que sugiere que los cambios periféricos impulsan estados de hipersensibilidad espinal central de las neuronas que se proyectan a las partes del cerebro involucradas en la sensación de dolor. Mientras que el dolor inflamatorio y neuropático induce cambios en los niveles de la sustancia P y del péptido relacionado con el gen de la calcitonina (PRGC) en el asta dorsal y los ganglios de la raíz dorsal, estos cambios están ausentes en el dolor óseo inducido por el cáncer[16]. Las neuronas de la médula espinal en modelos de dolor óseo inducido por cáncer muestran respuestas mejoradas a los estímulos evocados, lo que refleja una hiperexcitabilidad general de las neuronas, como también se ha visto en estados inflamatorios y neuropáticos. Además, las neuronas espinales muestran una mayor excitabilidad; aquí, un factor importante es el receptor N-metil-D-aspartato (NMDA) para el glutamato, donde un estímulo constante provoca respuestas aumentadas cuatro o cinco veces, aunque la entrada periférica sigue siendo la misma[16].
-
Tumores óseos en edad pediátrica
Los tumores óseos algunas veces son difíciles de diagnosticar, estos se dividen en benignos y malignos, los benignos son lo más frecuente y entre de ellos el osteocondroma es el principal. Los malignos a pesar de su baja frecuencia tienen importancia por su alta mortalidad, que varía entre 80% a 95%, y las graves secuelas físicas y emocionales para la familia. En 2014, se estima que se diagnosticarán 15.780 nuevos casos de cáncer y se producirán 1.960 muertes por cáncer entre niños y adolescentes desde el nacimiento hasta los 19 años. La tasa de incidencia anual de cáncer en niños y adolescentes es de 186,6 por millón de niños desde el nacimiento hasta los 19 años. Aproximadamente 1 de cada 285 niños será diagnosticado con cáncer antes de los 20 años[17].
Enfocándonos a los tumores malignos del hueso son relativamente poco frecuentes y en general de evolución muy rápida. El osteosarcoma es el tumor óseo primitivo maligno más frecuente. Aparece entre los 7 y los 20 años y se localiza en la porción metafisaria de los huesos largos muy frecuente alrededor de la rodilla. Da metástasis en pulmón, y la supervivencia es del 25% a los 5 años. En la actualidad combinando la quimio, la radioterapia y la cirugía hay una supervivencia superior al 65% a los 10 años[17].
Razón por la cual las técnicas intervencionistas para manejo del dolor pueden ofrecer un gran calidad de vida a estos pacientes de la mano con su tratamiento farmacológico.
-
Técnicas intervencionista para el manejo del dolor del osteosarcoma
El osteosarcoma es el tumor óseo maligno más frecuente, con una incidencia dos veces superior a la del condrosarcoma. Los principales sitios de afectación son las metáfisis del fémur distal (40%), la tibia proximal (16%) y el húmero proximal (15%)[18].
El osteosarcoma del fémur proximal representa menos del 5% de los casos. Por lo tanto, pueden surgir desafíos diagnósticos, en particular debido a la alta incidencia de trauma y enfermedad metastásica en este sitio. La edad en el momento del diagnóstico del osteosarcoma varía de 10 a 30 años. La presentación típica combina dolor con una mezcla de inflamación y patrón temporal mecánico y una tumefacción sobre la lesión[19].
La mayoría de los osteosarcomas se clasifican como tumores convencionales de alto grado. Antes de 1970, la amputación era el único tratamiento para un osteosarcoma de alto grado, y el 80% de los pacientes morían por enfermedad metastásica, más comúnmente en los pulmones[20]. En el pasado durante tres décadas, los protocolos efectivos de quimioterapia de inducción (neoadyuvante/preoperatoria) y adyuvante (posoperatoria) han mejorado la capacidad de realizar resecciones seguras para preservar las extremidades, y han aumentado las tasas de supervivencia general y sin enfermedad. Hoy en día, del 90% al 95% de los pacientes con osteosarcoma pueden tratarse con cirugía conservadora de extremidades, y del 60% al 80% de los pacientes con enfermedad localizada son sobrevivientes a largo plazo[20].
Más del 50% de los pacientes ambulatorios de cáncer pediátrico experimentan dolor sin tratamiento, lo que afecta el bienestar emocional, psicológico y social de los pacientes[21]. La severidad de las consecuencias del manejo insuficiente del dolor para la calidad de vida de un niño ha llevado a una mayor consideración de los enfoques multidisciplinarios para el manejo del dolor pediátrico[22].
Los bloqueos de nervios periféricos se han utilizado en el tratamiento de varios cánceres pediátricos. Si bien la analgesia sistémica a menudo se usa primero en esta población, puede ser vuelto ineficaz o severamente limitado por efectos adversos, incluyendo náuseas, vómitos, prurito y sedación, que puede ser profunda[23].
El bloqueo de los nervios periféricos implica la administración de medicamentos anestésicos locales, ocasionalmente con adyuvantes, como alfa-2 agonistas o corticosteroides, en la proximidad de un nervio periférico para producir un sensor sensorial específico.
Un estudio retrospectivo con 108 pacientes pediátricos (edad 2-18) pacientes sometidos a cirugía tumoral ortopédica demostraron la eficacia del bloqueo de los nervios periféricos en esta población[24]. El estudio incluyó femoral, ciático, bloqueos nerviosos axilares, supraclaviculares, infraclaviculares e interescalénicos para pacientes tratados quirúrgicamente patología, como osteosarcoma, sarcoma de Ewing, rabdomiosarcoma, tumores de células gigantes, y otros tumores ortopédicos pediátricos. Los autores informaron puntuaciones de dolor más bajas, más tiempo duración hasta el inicio del dolor en el posoperatorio y menor consumo total de analgésicos en el población que recibió bloqueos nerviosos[25].
Aunque estos estudios examinaron principalmente la utilidad de los bloqueos nerviosos periféricos en períodos posoperatorios a corto plazo, se puede observar una eficacia similar en entornos más crónicos. Complicaciones potenciales de bloqueo de nervios periféricos incluyen hemorragia, lesión nerviosa y toxicidad sistémica. Sin embargo, el uso generalizado de la ultrasonografía mitiga estos riesgos a través de la detección de anatomía relevante y visualización directa de la propagación del anestésico local[26].
Recientemente, el fenómeno del dolor de rebote después de la anestesia regional se ha descrito cada vez más en la literatura. Sin embargo, se asocia más a menudo con los anestésicos regionales utilizados para producen anestesia quirúrgica y no están bien descritos en la literatura sobre dolor crónico. Evidentemente, el bloqueo de los nervios periféricos puede jugar un papel en manejo del dolor para pacientes pediátricos con cáncer, particularmente aquellos con tumores que afectan los huesos[27].
Las técnicas propuestas en el caso de los osteosarcomas de miembro pélvico son: bloqueo de nervio femoral y nervio ciático.
Bloqueo del nervio ciático: este bloqueo se ha descrito como una opción terapéutica eficaz para reducir el SDRC (síndrome doloroso regional complejo) relacionado con el dolor neuropático, relacionado con el cáncer y dolor de miembro fantasma en las extremidades inferiores[28]. Actualmente, la terapia más utilizada para el tratamiento del dolor crónico es a través del ultrasonido, seguida de la administración de anestésico local en varias concentraciones, junto con posibles adyuvantes como los agonistas alfa-2, basados en la naturaleza y la intensidad del dolor[29].
El bloqueo del nervio femoral ha sido descrito como una medio eficaz de proporcionar analgesia a la extremidad inferior para facilitar la participación en fisioterapia para pacientes con SDRC tipo I. Además, se ha utilizado con éxito para tratar el dolor refractario en un niño con luxación crónica de cadera tras tratamiento médico fallido[30].
-
Descripción de la técnica de bloqueo femoral (Figura 1)
La sonda lineal se coloca justo debajo y paralela al ligamento inguinal. Usando una presión mínima del transductor para evitar el colapso de los vasos, el Doppler se usa para identificar la arteria ilíaca circunfleja superficial, ya que esta arteria pasa con frecuencia superficialmente al nervio femoral. La aguja se introduce en un plano desde la dirección lateral a la medial, con el objetivo de «hacer estallar» la fascia ilíaca a medida que se extiende sobre el nervio femoral[31],[32].
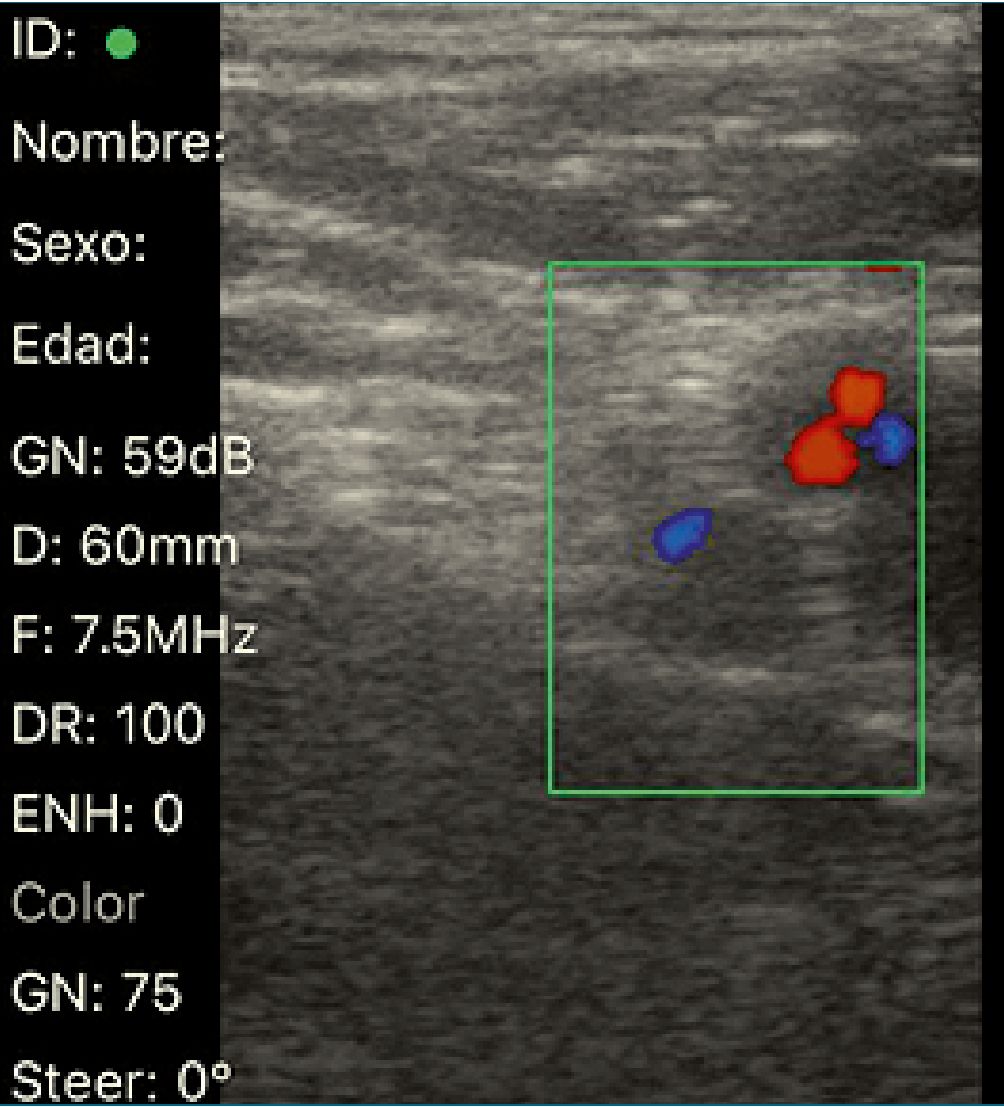
Figura 1. Bloqueo de nervio femoral guiado por ultrasonido.
-
Técnica de abordaje de nervio ciático
Nervio ciático el plexo sacro comprende el nervio ciático y proporciona inervación a la parte posterior del muslo, la pierna y la mayor parte del pie, excepto la porción medial, que está inervada por el nervio femoral. En los niños se utilizan varias técnicas para el bloqueo del nervio ciático. Al elegir a qué nivel bloquear el nervio, es fundamental elegir el abordaje más distal[33].
-
Técnica de bloqueo del nervio ciático subglúteo
Se puede realizar en posición lateral o en decúbito supino con la extremidad elevada. Se marca la línea subglútea donde está presente el pliegue glúteo. Se identifica el tendón del bíceps femoral y se delinea un punto inferior al pliegue glúteo, justo medial al tendón del bíceps femoral.
-
Técnica guiada por ultrasonido
Una sonda lineal es suficiente en todos menos en el adolescente más grande. La aplicación de presión con la sonda mejora la imagen ecográfica, ya que acerca el nervio ciático a la sonda. Una vez identificado el nervio ciático, gire la sonda de vuelta al plano transversal. Como alternativa, se rastrea distalmente hasta la fosa poplítea e identifique el nervio antes de volver sobre sus pasos. Con la ecografía, a menudo es posible ver la rama cutánea posterior del muslo, medial y superficial al nervio ciático, y es importante asegurarse de que la anestesia local la cubra. Se recomienda una técnica en el plano para inyecciones únicas, mientras que una técnica fuera del plano suele ser mejor para la colocación del catéter[33].
-
Bloqueo nervio ciático de fosa poplítea (Figura 2)
La fosa poplítea es un área en forma de diamante con el triángulo superior formado por los tendones del semitendinoso y semimembranoso medialmente y el tendón del bíceps femoral lateralmente. El nervio ciático se divide en el nervio peroneo común y el nervio tibial. El nervio peroneo común sale de la fosa poplítea lateralmente y el nervio tibial sale medialmente. La ramificación del nervio ciático tiene lugar en varios niveles por encima del pliegue poplíteo[33].
-
Técnica guiada por ultrasonido
El paciente se coloca en decúbito supino, en muchos niños con parálisis cerebral, la pierna rotará externamente lo suficiente como para permitir que los nervios se acerquen medialmente. Para una sola inyección, se recomienda una técnica en el plano, ya sea desde la cara medial o lateral de la pierna. Con la ecografía, se puede identificar el nivel exacto de ramificación del nervio ciático; en este punto, la circunferencia combinada de los dos nervios será mayor que la circunferencia del nervio “ciático”; un bloqueo en esta ubicación proporciona un mayor contacto entre el anestésico local y el nervio[33].
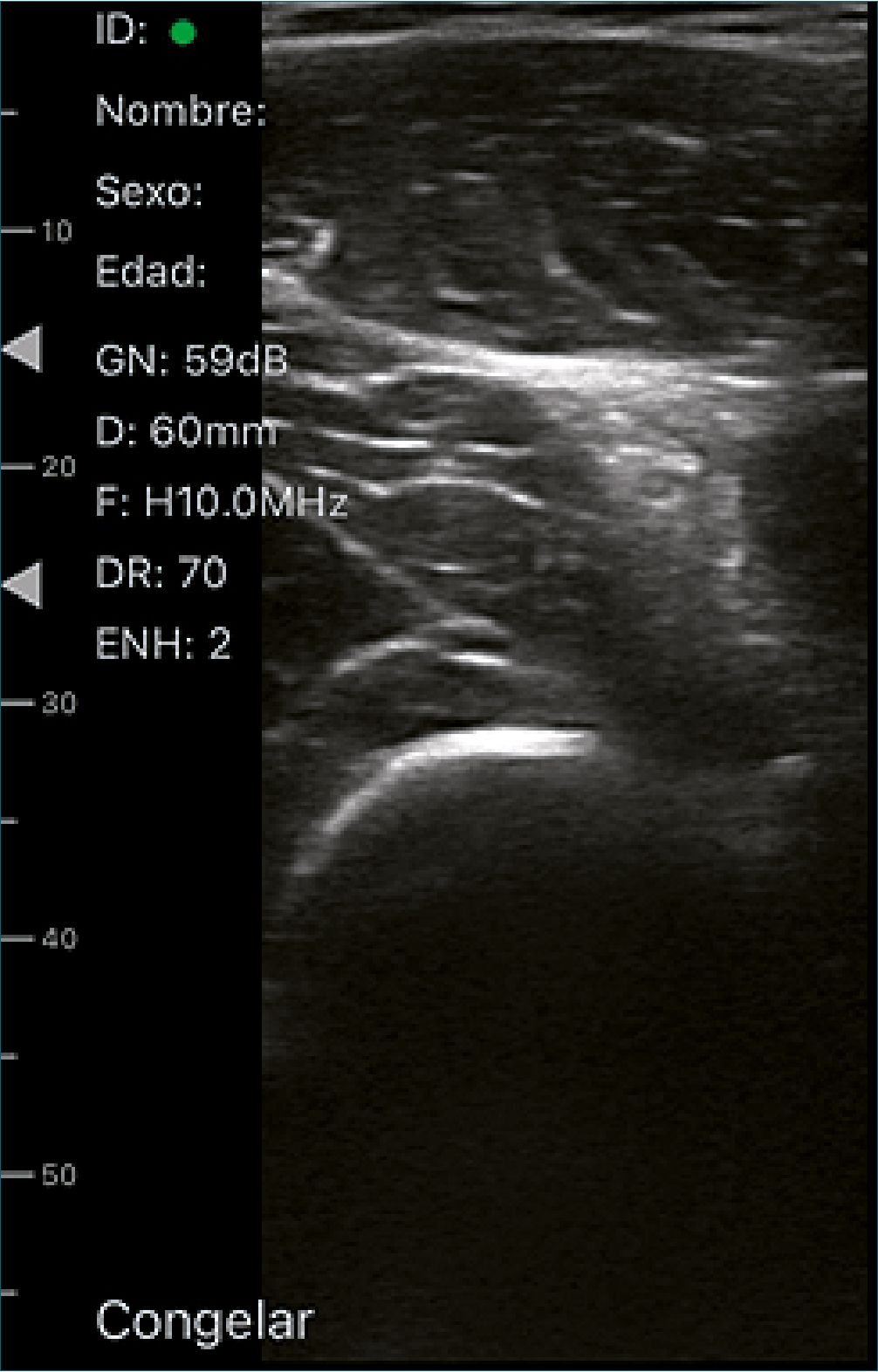
Figura 2. Bloqueo nervio ciático de fosa poplítea.
-
Escala de valoración EVA y manejo del dolor
La OMS ha establecido una escalera de alivio del dolor de tres escalones para controlar el dolor relacionado con el cáncer de intensidad creciente. En el paso 1, se recomiendan analgésicos no opioides, como aspirina y paracetamol. Si es necesario, se pueden administrar opioides débiles, como tramadol y codeína, en el paso 2. Finalmente, en el paso 3 se administran opioides más potentes, como morfina, fentanilo, buprenorfina e hidromorfona. La elección depende de la severidad del dolor y puede ser desde acetaminofén hasta opioides. La meta es obtener un balance entre analgesia y efectos secundarios. medicamentos, los opioides no tienen dosis límite analgésica, la dosis adecuada es la necesaria para aliviar los síntomas[34].
Para mantener la ausencia de dolor, la OMS recomienda concentraciones plasmáticas estables de analgésico para proporcionar un alivio del dolor eficaz y duradero, evitar concentraciones excesivamente altas para minimizar los efectos adversos, una acción de larga duración y una formulación de liberación inmediata para un alivio rápido del dolor[34].
El uso de opioides para tratar el dolor neuropático sigue siendo controvertido, pero cada vez hay más pruebas de que los diferentes opioides afectan diferentes vías del dolor y que la buprenorfina puede ser particularmente útil para controlar este tipo de dolor. En particular, parece ser eficaz en el tratamiento de estados y síndromes hiperalgésicos caracterizados por una sensibilización central pronunciada. A diferencia de la morfina y el fentanilo, la buprenorfina no tiene efecto inmunosupresor, lo que ofrece una ventaja potencial cuando las personas ya están inmunodeprimidas[34].
De la mano en los pacientes con cáncer y principalmente en los pacientes con osteosarcomas se agregan neuromodula- dores como la gabapentina, carbamazepina e Imipramina, por tal razón debido a la polifarmacia se consideró importante en nuestro hospital considerar las técnicas intervencionistas que disminuyan las dosis y número de fármacos para manejo del dolor mixto en este tipo de pacientes[35].
Estudios recientes han publicado pirámides de atención del dolor agudo y crónico proponiendo técnicas intervencionista de manejo del dolor. Por tal razón es importante considerar las técnicas en pacientes con cáncer que demuestren adecuado manejo del dolor y menor consumo de fármacos, aportando una mejor calidad de vida a este grupo vulnerable como son los niños[36] (Figura 3).
-
Objetivo
Valorar el control del dolor con bloqueos de nervio femoral y ciático ecoguiados en expedientes de pacientes pediátricos portadores de osteosarcomas basal, a las 24 h y a los 2 meses.
-
Objetivos específicos
1. Conocer los fármacos usados para el tratamiento del dolor adyuvantes a los bloqueos de nervio femoral y ciático eco- guiados en el expediente del paciente pediátrico.
2. Corroborar si existe una disminución en las dosis de fármacos adyuvantes para el manejo del dolor en paciente portadores de osteosarcomas en el expediente del paciente pediátrico.
-
Material y Métodos
-
Lugar de estudio
El presente estudio se realizó en el servicio de clínica del dolor del Hospital General “Dr. Gaudencio González Garza”, del Centro Médico Nacional La Raza del Instituto Mexicano del Seguro Social, revisando expedientes de pacientes pediátricos atendidos en el período comprendido de junio de 2022 a junio de 2023.
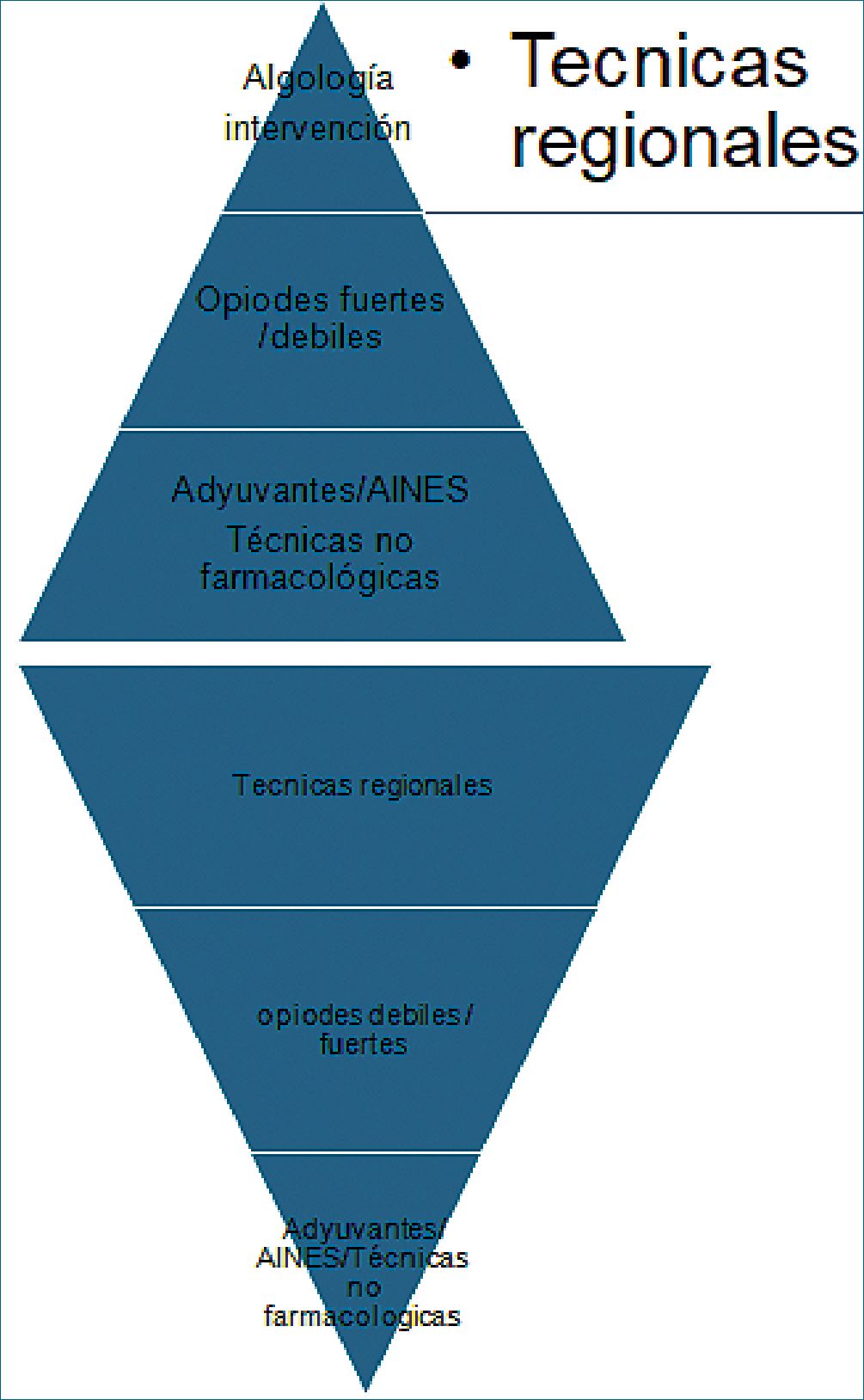
Figura 3. Algoritmo dolor crónico y dolor agudo.
1. Fuente: Elaboración propia con base en Vicencio-Rosas E., Pérez- Guillé MG., Flores Pérez C., Flores-Pérez J., Trujillo-Jiménez F., Chávez- Pacheco JL. Buprenorphine and pain treatment in pediatric patients: an update. J Pain Res [Internet]. 2018;11:549-59. Available from: https://dx.doi.org/10.2147/jpr.s153903
-
Tipo de estudio
Descriptivo observacional, analítico, retrospectivo
-
Grupo de estudio
Expedientes de pacientes pediátricos de entre 6 y 17 años con diagnóstico de osteosarcoma sometidos a bloqueos eco- guiados de nervio femoral y ciático que se encuentren en seguimiento por la clínica del dolor ingresados al servicio de oncología pediátrica del Hospital de General “Dr. Gaudencio González Garza”, del Centro Médico Nacional La Raza del Instituto Mexicano del Seguro Social.
-
Criterios de selección
Criterios de inclusión:
• Expedientes de pacientes pediátricos de entre 7 y 17 años.
– Expedientes de pacientes pediátricos con diagnóstico de osteosarcoma con tratamiento de bloqueo femoral ecoguiado.
– Expedientes de pacientes pediátricos con diagnóstico de osteosarcoma con tratamiento de bloqueo ciático ecoguiado.
Criterios de exclusión:
• Expedientes de pacientes con falta de seguimiento por la clínica de dolor del Hospital General de la Raza.
• Expedientes de pacientes portadores de osteosarcoma, pero no sometidos a bloqueos de nervio femoral y ciático ecoguiados.
El proyecto de investigación se sometió a evaluación y aprobación por parte del Comité de ética e investigación y con número de registro ante el Sirelcis:
• F-2023-3502-120.
Y se continuó con la búsqueda de aquellos expedientes de pacientes pediátricos de edades de entre 7 y 17 años que cuenten con un seguimiento por parte de la Clínica del Dolor y Cuidados Paliativos del Hospital General de la Raza “Dr. Gaudencio González Garza” por diagnóstico de osteosarcoma a los cuales se les realizó bloqueo de nervio femoral y ciático ecoguiados. Los datos se recabaron mediante la base de datos extraída de los censos diarios de la clínica del dolor y la revisión de las notas del expediente clínico electrónico de los meses de junio de 2022 a junio del año 2023 asignando un folio en la hoja de recolección de datos.
En todas las notas de los expedientes electrónicos se encuentra registrada la intensidad del dolor que reportaron los pacientes previa realización de bloqueos ecoguiados mediante la Escala Visual Análoga (EVA) para lo cual se les pidió a los pacientes señalaran en la escala el nivel del dolor que presentaban en ese momento del 1 al 10.
Posteriormente, se analizaron los expedientes y se identificó la intensidad del dolor reportada mediante la escala EVA a las 24 y a los dos meses, por medio del análisis de los censos diarios y por parte del expediente clínico electrónico de los pacientes. Se analizó si el paciente reporto algún efecto secundario a la aplicación de los bloqueos ecoguiados de nervio femoral y ciático. Los procedimientos se realizaron en el área de la clínica del dolor y a pie de cama con USG portátil con TCI remifentanilo en un rango de concentraciones sitio efecto guiado por simulador i TIVA de 3,5 – 5 ng. Verificando previamente las condiciones adecuadas de la citometría hemática, tiempos de coagulación, función hepática y química sanguínea. El tiempo de realización del procedimiento intervencionista se realizó en la mayoría de los pacientes antes de iniciar la quimioterapia.
-
Resultados
Se analizaron un total de 21 pacientes pediátricos con diagnóstico de osteosarcoma de los cuales 52% fueron de género femenino y 38% masculino. Con un rango de edad mínimo de 6 años y máximo de 16 años, peso mínimo de 12 kg y máximo de 57 kg. Sin observar diferencias significativas con respecto a la edad y género (Tabla 1).
El tratamiento adyuvante después de realizar el procedimiento intervencionista fue el siguiente: (Figura 4).
Donde podemos observar que la cantidad de opioides fue menor después de las técnicas intervencionista.
El control del dolor se llevó a cabo a través de la escala de EVA donde se reportó un valor máximo de 7 y mínimo de 1 a las 24 h y a los dos meses después del intervencionismo. Todos los pacientes son protocolizados en trauma y ortopedia/ el manejo se inicia en el momento de diagnóstico como procedimiento de algología intervencionista preventivo. Evitando el uso de opioides antes de la desarticulación e iniciando el manejo de neuromoduladores para prevenir miembro fantasma en esta población pediátrica. El uso de los opioides se inició dos meses después en la mayoría de los pacientes captados de primera vez en nuestra unidad. Los pacientes referidos de otras unidades portadores (2 pacientes) con parche de buprenorfina se logró la reducción del mismo en 50%. La mayoría de los rescates se manejaron con tramadol y paracetamol, sin suspender los neuromoduladores.
La correlación de la Escala EVA basal y EVA de 24 h fue estadísticamente significativa con un valor de p < 0,0005, a su vez la escala EVA Basal comparada con EVA a los 2 meses (p < 0,0005), utilizando la prueba estadística t de student para pruebas relacionadas.
Y realizando un análisis de varianzas ANOVA no hubo diferencias significativas con respecto al dolor entre el EVA de 24 h y 2 meses. Lo que nos demuestra el adecuado control del dolor durante este período de tiempo (p < 0,077).
Tabla 1. Datos demográficos al ingreso previo a procedimiento
| Mediana | Mínimo | Máximo | *IQR | **p valor | ||
| Edad | Masculino | 13,5 | 6 | 16 | 4 | 0,387 |
| Femenino | 12 | 8 | 16 | 4 | ||
| Peso | Masculino | 41 | 12 | 57 | 15 | 0,173 |
| Femenino | 37 | 30 | 54 | 8 | ||
| EVA basal | Masculino | 6 | 5 | 7 | 0,5 | 0,282 |
| Femenino | 7 | 5 | 7 | 1 |
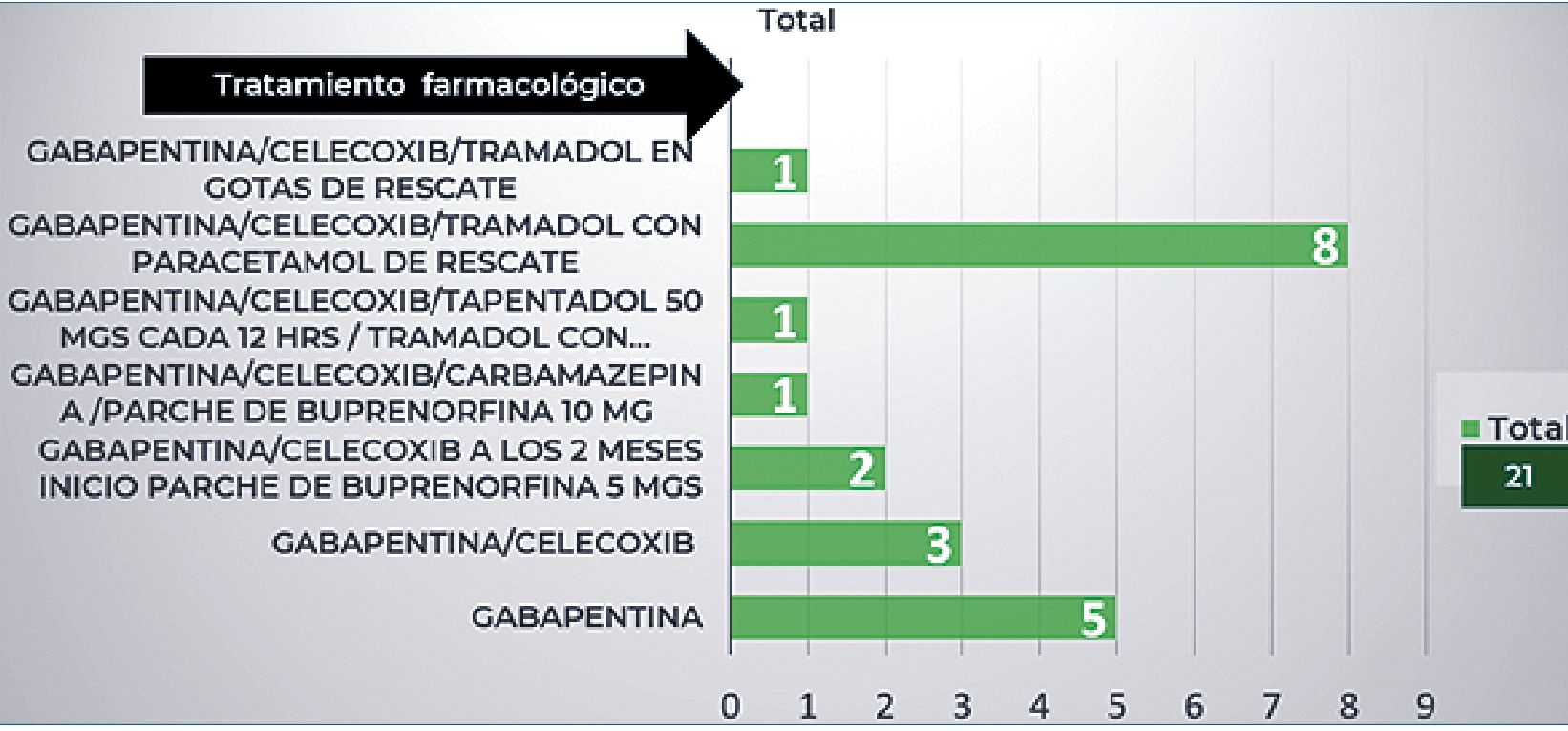
Figura 4. El tratamiento adyuvante después de realizar el procedimiento intervencionista.
El manejo del dolor se demostró estadísticamente que se mantuvo bajo control durante los dos meses del tratamiento de algología intervencionista. No se demostraron cambios significativos en después del control del dolor.
A pesar de que la ubicación del osteosarcoma es más común en el fémur, han aumentado otras localizaciones: tobillo, humero, peroné y tibia. Razón por la cual se agregaron durante la captación de pacientes otros bloqueos periféricos y los más comunes fueron bloqueo del nervio peroneo superficial y tibial posterior principalmente por la región anatómica dolorosa que refería el paciente pediátrico. Es muy común en estos pacientes que el territorio del nervio peroneo superficial se vea afectado y genere dolor incapacitante en el pie.
No se reportó ningún efecto adverso durante los procedimientos de intervencionismo.
-
Discusión
Actualmente en nuestro país la mayoría de las clínicas del dolor pediátrico no realizan intervencionismo en niños, la resistencia farmacológica va en aumento y principalmente en los pacientes oncológicos. La población pediátrica es aún más compleja y la supervivencia de un osteosarcoma puede ser hasta de 10 años después del diagnóstico lo que nos limita el control del dolor únicamente con fármacos.
Los procedimientos intervencionista en estos pacientes de múltiples nervios periféricos nos permite retrasar el uso de opioides desde el inicio del tratamiento y mantener los neuro- moduladores de manera más prolongada para contribuir a la prevención del síndrome doloroso de miembro fantasma antes de la desarticulación. Es una herramienta formidable para la población pediátrica para otorgarles calidad de vida y control del dolor por un tiempo prolongado, con rescates de opioides débiles e incluso con neuromoduladores.
Los niños que captamos después de a desarticulación regresaron a nuestro hospital para control y quimioterapia solo con neuromoduladores y rescates con tramadol y paracetamol. No se desarrollaron síndrome doloroso de miembro fantasma.
-
Conclusiones
De acuerdo con las recomendaciones de la literatura nosotros en el hospital decidimos iniciar los neuromoduladores que controlaron el dolor sin necesidad del uso de opioides en 75% de nuestros pacientes sometidos a intervencionismo.
Otro servicio muy importante que se requiere para realizar intervencionismo en pediatra en el servicio de psiquiatría que no siempre tenemos disponible para esta población.
Es importante continuar el estudio 3 meses después para valorar el control del dolor después de la desarticulación. Y que tanto podemos disminuir el consumo de opioides.
Sería una gran oportunidad para esta población pediátrica realizar una guía clínica que norme el uso de neuromoduladores e intervencionismo para prevenir el desarrollo de síndrome doloroso de miembro fantasma.
-
Referencias
1. Vidal Fuentes J. Versión actualizada de la definición de dolor de la IASP: un paso adelante o un paso atrás. Rev Soc Esp Dolor; 2020.[Internet]. https://doi.org/10.20986/resed.2020.3839/2020.
2. Anwar K. Pathophysiology of pain [Internet]. Dis Mon. 2016 Sep;62(9):324–9. https://doi.org/10.1016/j.disamonth.2016.05.015 PMID:27329514
3. Stevens BJ, Hathway G, Zempsky WT, editors. Oxford textbook of pediatric pain. 2nd ed. London, England: Oxford University Press; 2021. https://doi.org/10.1093/med/9780198818762.001.0001.
4. Organización Mundial de la Salud. Directrices de la OMS sobre el tratamiento farmacológico del dolor persistente en niños con enfermedades médicas. Ginebra: OMS, 2012. Disponible en: https://apps.who.int/iris/handle/10665/77943. Consultado: 9/Mayo/ 2023
5. Cristiani F, Hernández A, Sálice I, Orrego P, Aráujo M, Oliveral, et al. Prevalencia de dolor en niñoshospitalizados en el Centro Hospitalario Pereira Rossell. Anest Analg Reanim. 2013;26(1):3–16.
6. Kulkarni R, Das G. Management of Chronic Pain in Children. J Recent Adv Pain. 2016;2(3):99–101. https://doi.org/10.5005/jp-journals-10046-0052.
7. Perquin CW, Hazebroek-Kampschreur AA, Hunfeld JA, Bohnen AM, van Suijlekom-Smit LW, Passchier J, et al. Pain in children and adolescents: a common experience [Internet]. Pain. 2000 Jul;87(1):51–8. https://doi.org/10.1016/S0304-3959(00)00269-4 PMID:10863045
8. Monitto CL, Kost-Byerly S, Yaster M. Pain Management. Smith’s Anesthesia for Infants and children. 8th ed. Elsevier.
9. Ingelmo PM, Fumagalli R. Neuropathic pain in children. Minerva Anestesiol. 2004 May;70(5):393–8. PMID:15181421
10. Bibliomédica Ediciones – Montevideo – Uruguay [Internet]. Com.uy. [cited 2023 Jun 3]. Available from: https://www.bibliomedica.com.uy/?c=5&l=197899159356
11. Pattinson D, Fitzgerald M. The neurobiology of infant pain: development of excitatory and inhibitory neurotransmission in the spinal dorsal horn [Internet]. Reg Anesth Pain Med. 2004;29(1):36–44. https://doi.org/10.1097/00115550-200401000-00009 PMID:14727277
12. Ririe DG, Bremner LR, Fitzgerald M. Comparison of the immediate effects of surgical incision on dorsal horn neuronal receptive field size and responses during postnatal development [Internet]. Anesthesiology. 2008 Oct;109(4):698–706. https://doi.org/10.1097/ALN.0b013e3181870a32 PMID:18813050
13. Falk S, Dickenson AH. Pain and nociception: mechanisms of cancer-induced bone pain [Internet]. J Clin Oncol. 2014 Jun;32(16):1647–54. https://doi.org/10.1200/JCO.2013.51.7219 PMID:24799469
14. Berger E. Growing pains: report notes pediatric emergencies need greater emphasis [Internet]. Ann Emerg Med. 2006 Aug;48(2):143–4. https://doi.org/10.1016/j.annemergmed.2006.06.024 PMID:16953527
15. Bannister K, Bee LA, Dickenson AH. Preclinical and early clinical investigations related to monoaminergic pain modulation [Internet]. Neurotherapeutics. 2009 Oct;6(4):703–12. https://doi.org/10.1016/j.nurt.2009.07.009 PMID:19789074
16. Ward E, DeSantis C, Robbins A, Kohler B, Jemal A. Childhood and adolescent cancer statistics, 2014 [Internet]. CA Cancer J Clin. 2014;64(2):83–103. https://doi.org/10.3322/caac.21219 PMID:24488779
17. Bielack SS, Kempf-Bielack B, Delling G, Exner GU, Flege S, Helmke K, et al. Prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1,702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols [Internet]. J Clin Oncol. 2002 Feb;20(3):776–90. https://doi.org/10.1200/JCO.2002.20.3.776 PMID:11821461
18. Dahan M, Anract P, Babinet A, Larousserie F, Biau D. Proximal femoral osteosarcoma: diagnostic challenges translate into delayed and inappropriate management [Internet]. Orthop Traumatol Surg Res. 2017 Nov;103(7):1011–5. https://doi.org/10.1016/j.otsr.2017.05.019 PMID:28647623
19. Wittig JC, Bickels J, Priebat D, Jelinek J, Kellar-Graney K, Shmookler B, et al. Osteosarcoma: a multidisciplinary approach to diagnosis and treatment. Am Fam Physician. 2002 Mar;65(6):1123–32. PMID:11925089
20. Tutelman PR, Chambers CT, Stinson JN, Parker JA, Fernandez CV, Witteman HO, et al. Pain in children with cancer: Prevalence, characteristics, and parent management [Internet]. Clin J Pain. 2018 Mar;34(3):198–206. https://doi.org/10.1097/AJP.0000000000000531 PMID:28678061
21. Wren AA, Ross AC, D’Souza G, Almgren C, Feinstein A, Marshall A, et al. Multidisciplinary pain management for pediatric patients with acute and chronic pain: A foundational treatment approach when prescribing opioids [Internet]. Children (Basel). 2019 Feb;6(2):33. https://doi.org/10.3390/children6020033 PMID:30795645
22. Shah RD, Cappiello D, Suresh S. Interventional procedures for chronic pain in children and adolescents: A review of the current evidence [Internet]. Pain Pract. 2016 Mar;16(3):359–69. https://doi.org/10.1111/papr.12285 PMID:25753547
23. Raphael J, Hester J, Ahmedzai S, Barrie J, Farqhuar-Smith P, Williams J, et al. Cancer pain: part 2: physical, interventional and complimentary therapies; management in the community; acute, treatment-related and complex cancer pain: a perspective from the British Pain Society endorsed by the UK Association of Palliative Medicine and the Royal College of General Practitioners [Internet]. Pain Med. 2010 Jun;11(6):872–96. https://doi.org/10.1111/j.1526-4637.2010.00841.x PMID:20456069
24. Argun G, Çayırlı G, Toğral G, Arıkan M, Ünver S. Are peripheral nerve blocks effective in pain control of pediatric orthopedic tumor surgery? [Internet]. Eklem Hastalik Cerrahisi. 2019 Apr;30(1):46–52. https://doi.org/10.5606/ehc.2019.62395 PMID:30885108
25. Rork JF, Berde CB, Goldstein RD. Regional anesthesia approaches to pain management in pediatric palliative care: a review of current knowledge [Internet]. J Pain Symptom Manage. 2013 Dec;46(6):859–73. https://doi.org/10.1016/j.jpainsymman.2013.01.004 PMID:23541741
26. Muñoz-Leyva F, Cubillos J, Chin KJ. Managing rebound pain after regional anesthesia [Internet]. Korean J Anesthesiol. 2020 Oct;73(5):372–83. https://doi.org/10.4097/kja.20436 PMID:32773724
27. Everett A, Mclean B, Plunkett A, Buckenmaier C. A unique presentation of complex regional pain syndrome type I treated with a continuous sciatic peripheral nerve block and parenteral ketamine infusion: a case report [Internet]. Pain Med. 2009 Sep;10(6):1136–9. https://doi.org/10.1111/j.1526-4637.2009.00684.x PMID:19744217
28. Ivani G, Codipietro L, Gagliardi F, Rosso F, Mossetti V, Vitale P. A long-term continuous infusion via a sciatic catheter in a 3-year-old boy [Internet]. Paediatr Anaesth. 2003 Oct;13(8):718–21. https://doi.org/10.1046/j.1460-9592.2003.01130.x PMID:14535912
29. Nayak S, Roberts S, Cunliffe M. Management of intractable pain from a chronic dislocated hip in an adolescent [Internet]. Paediatr Anaesth. 2008 Apr;18(4):357–8. https://doi.org/10.1111/j.1460-9592.2008.02483.x PMID:18315664
30. Ríos-Medina AM, Caicedo-Salazar J, Vásquez-Sadder MI, Aguirre-Ospina OD, González MP. Anestesia regional en pediatría – Revisión no sistemática de la literatura. Rev Colomb Anestesiol. 2015;43(3):204–13. https://doi.org/10.1016/j.rca.2015.02.005.
31. Oberndorfer U, Marhofer P, Bösenberg A, Willschke H, Felfernig M, Weintraud M, et al. Ultrasonographic guidance for sciatic and femoral nerve blocks in children [Internet]. Br J Anaesth. 2007 Jun;98(6):797–801. https://doi.org/10.1093/bja/aem092 PMID:17449890
32. Hadzic A, Nysora VP. Ultrasound-Guided Single Shot Femoral Nerve Block. 2012.
33. Kusnik S, Likar R, Sittl R. Transdermal buprenorphine in chronic pain: indications and clinical experience [Internet]. Expert Rev Clin Pharmacol. 2008 Nov;1(6):729–36. https://doi.org/10.1586/17512433.1.6.729 PMID:24410602
34. Vicencio-Rosas E, Pérez-Guillé MG, Flores-Pérez C, Flores-Pérez J, Trujillo-Jiménez F, Chávez-Pacheco JL. Buprenorphine and pain treatment in pediatric patients: an update [Internet]. J Pain Res. 2018 Mar;11:549–59. https://doi.org/10.2147/JPR.S153903 PMID:29588613
35. Chou R, Gordon DB, de Leon-Casasola OA, Rosenberg JM, Bickler S, Brennan T, et al. Management of postoperative pain: A clinical practice guideline from the American Pain Society, the American Society of Regional Anesthesia and pain medicine, and the American Society of Anesthesiologists’ committee on Regional Anesthesia, executive committee, and administrative council [Internet]. J Pain. 2016 Feb;17(2):131–57. https://doi.org/10.1016/j.jpain.2015.12.008 PMID:26827847
36. Thong IS, Jensen MP, Miró J, Tan G. The validity of pain intensity measures: what do the NRS, VAS, VRS, and FPS-R measure? [Internet]. Scand J Pain. 2018 Jan;18(1):99–107. https://doi.org/10.1515/sjpain-2018-0012 PMID:29794282

 ORCID
ORCID