Juan Sebastián Cabrera Hernández1,2,3*, Alexander Casallas Vega4, Juan Carlos Castro Enriquez1,2, Carlos Arturo Laverde Rodríguez1,2
Recibido: 17-01-2025
Aceptado: 10-03-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 6 pp. 878-884|https://doi.org/10.25237/revchilanestv54n6-14
PDF|ePub|RIS
Cardiac power delta and morbimortality in postoperative cardiac surgery: a historical cohort
Abstract
Introduction: Cardiac power (CP) lower than 0.6 W is associated with increased morbidity and mortality. This study aims to establish the relationship between cardiac power delta and morbimortality in postoperative cardiovascular surgery patients. Methods: Historical cohort study that included patients who underwent cardiovascular surgery between January 1, 2023 and September 30, 2024 in a high complexity hospital. The delta of cardiac power at 24 hours of ICU admission was determined and compared with clinical outcomes. Descriptive analysis, measures of association, correlation were performed using Spearman’s coefficient. x test was performed. Results: 40 patients were enrolled. Patients with cardiac power at ICU admission and at 24 hours less than 0.6 W had more days of hospitalization and the mean number of days on mechanical ventilation was 3.11. Those patients who died were 2.4 times more exposed to cardiac power less than 0.6 W (OR 2.48. CI 1.07 – 4.9). There was correlation between pump time and PC at 24 hours (r: -0.398, p 0.049) and between CP at 24 hours and creatinine at 48 hours (r: -0.505, p 0.014). Patients who had a CP lower than 0.6 W on admission to the ICU and at 24 hours, regardless of risk, died. Conclusions: The cardiac power on admission to the cardiovascular intensive care unit is a variable susceptible to intervention; since, when this is less than 0.6 W or during the first 24 postoperative hours decreases to less than 0.6 W is associated with adverse outcomes.
Resumen
Introducción: El poder cardíaco (PC) inferior a 0,6 W se asocia a una mayor morbimortalidad. Este estudio pretende establecer la relación entre el delta de poder cardíaco y la morbimortalidad en pacientes posoperados de cirugía cardiovascular. Métodos: Estudio de cohorte histórica que incluyó pacientes sometidos a cirugía cardiovascular entre el 1 de enero de 2023 y el 30 de septiembre de 2024 en un hospital de alta complejidad. Se determinó el delta de poder cardíaco a las 24 h de ingreso a UCI y se comparó con los resultados clínicos. Se realizó análisis descriptivo, medidas de asociación, correlación mediante coeficiente de Spearman. Se realizó la prueba de x. Resultados: Se incluyeron 40 pacientes. Los pacientes con poder cardíaco al ingreso en UCI y a las 24 h inferior a 0,6 W tuvieron más días de hospitalización y la media de días con ventilación mecánica fue de 3,11. Los pacientes con un poder cardíaco inferior a 0,6 W tuvieron 2,4 veces más chance de fallecer (OR 2,48. IC 1,07 – 4,9). Hubo correlación entre el tiempo de bomba y el poder cardíaco a las 24 h (r: -0,398; p 0,049) y entre el poder cardíaco a las 24 h y la creatinina a las 48 h (r: -0,505; p 0,014). Los pacientes que tenían un PC inferior a 0,6 W al ingreso en la UCI y a las 24 h, independientemente del riesgo, fallecieron. Conclusiones: El poder cardíaco al ingreso en la unidad de cuidados intensivos cardiovasculares es una variable susceptible de intervención; ya que, cuando éste es inferior a 0,6 W o durante las primeras 24 h posoperatorias disminuye a menos de 0,6 W se asocia a resultados adversos.
-
Introducción
Debido a la alta morbimortalidad de las enfermedades cardiovasculares se ha estudiado la utilidad pronóstica de los parámetros hemodinámicos[1]. Así mismo, el tratamiento de los pacientes posoperatorios de cirugía cardíaca mayor representa un gran reto para los sistemas de salud de Colombia, dada la imperiosa necesidad de optimizar y racionalizar el uso de recursos especializados[2].
Así mismo, los registros de los parámetros hemodinámicos se han utilizado frecuentemente con el fin de estratificar e identificar el riesgo de los pacientes con falla ventricular izquierda grave; y en especial, en aquellos que presentan el síndrome de estado de choque cardiogénico. Como también, se han aplicado con el propósito de guiar eficientemente el tratamiento y conocer el pronóstico de los pacientes a corto plazo[3].
La determinación del poder cardíaco se remonta al año 1969 cuando Bergel et al., hace su comunicación de la valoración de la energía mecánica empleada durante la función de bomba de los ventrículos[4]; sin embargo, su uso clínico no tuvo auge puesto que se estimaba como una variable aislada o como un índice propuesto ideal de la contractilidad o de la capacidad de la función ventricular[3].
En el año 1987, Tan LB, formuló la hipótesis en la que señalaba que “cuando la función mecánica del corazón se ha deteriorado a tal grado y éste es estimulado, su máximo poder no llega a exceder el valor considerado normal en la situación de reposo (que es de 1 watt para un adulto promedio)”[5]; que, en el contexto del choque cardiogénico, ese estado de la función contráctil del corazón es habitualmente incompatible con la vida[3].
Ahora bien, el poder cardíaco, entendido como la energía producida por el corazón, se basa en que la potencia necesaria para empujar un fluido a través de un tubo es el producto de la presión en ese tubo por el flujo a través de él; lo cual, relaciona una variable de presión que corresponde a la presión arterial media y una de flujo que corresponde al gasto cardíaco[6]. En consecuencia, el poder cardíaco de reposo que se ha estimado para un adulto normal es aproximadamente de 1 Watt[3].
Es así, como en la disfunción ventricular izquierda aguda, el paciente se torna inestable hemodinámicamente y el poder cardíaco de reserva se reduce con el objetivo de sostener o mantener la vida[3]; por lo tanto, determinar el poder cardíaco en esta condición representa la reserva que tiene el corazón para soportar estados agudos de falla y refleja la severidad de la condición patológica imperante[3].
El punto de corte para el poder cardíaco es de 0,53 Watts, límite que predice la mortalidad a corto plazo de forma bastante razonable[3]; así como, un incremento en el poder cardiaco indexado por encima de 0,30 W/m2 es el reflejo de una adecuada respuesta al tratamiento del choque cardiogénico. También, hay evidencia de que aquellos pacientes que a las 12 h posoperatorias obtuvieron un poder cardiaco menor a 0,7 W tienen 2,5 veces mayor riesgo de presentar complicaciones cardiovasculares y estancia prolongada en UCI[7]; y que el delta de poder cardíaco ha resultado ser un parámetro hemodinámico importante con un OR de 0,6 (p = 0,002. IC95% 0,44 – 0,83) por cada incremento de 0,2 Watts[8].
En la actualidad, establecer parámetros hemodinámicos como el acople ventrículo arterial y el trabajo cardíaco pueden ser mediciones dispendiosas que requieren métodos invasivos; o, tener la disponibilidad en las unidades de cuidado de intensivo de la ecocardiografía al pie de la cama del paciente requiere de entrenamiento especial y puede ser de difícil interpretación para el equipo de trabajo; por lo que, contar con mediciones hemodinámicas dinámicas, como el poder cardíaco, y lograr medir su desempeño predictivo, capaz de aportar información a los clínicos para ajustar intervenciones de cuidado y de tratamiento, resulta ser valioso para la estructura estándar de cuidado del paciente en el posoperatorio de cirugía cardiovascular.
Por lo tanto, este estudio tiene como objetivo establecer la relación del delta de poder cardíaco y la morbimortalidad de pacientes en posoperatorio de cirugía cardiovascular con asistencia de circulación extracorpórea en un Hospital de alta complejidad.
-
Métodos
Estudio de cohorte histórica que recibió aval por el comité de ética en investigación con seres humanos y el comité de investigaciones de la Fundación Universitaria de Ciencias de la Salud (FUCS), Bogotá, Colombia; así como, del comité de ética e investigación del hospital de alta complejidad en el que se desarrolló la investigación, en sesión virtual del 17 de octubre de 2024. Además, se ajustó a los principios éticos fundamentales establecidos por la Declaración de Helsinki, se tuvieron en cuenta las consideraciones éticas de la resolución N°8.430 de 1993 del Ministerio de Salud y protección social, y se garantizó el cumplimiento de la Ley 1.581 de 2012, que regula la protección de datos personales en Colombia.
Se revisaron los registros de la historia clínica digital de los pacientes en posoperatorio de cirugía cardiovascular con asistencia de circulación extracorpórea entre el 01 enero de 2023 y el 30 septiembre de 2024 en un hospital de alta complejidad referente en patologías cardiovasculares, tanto de patologías de origen coronario, valvular o aórtico; en quienes, se determinó el poder cardíaco al ingreso a la unidad de cuidado intensivo cardiovascular y a las 24 h de estancia en la misma; y se buscó su relación con los desenlaces clínicos, tales como la mortalidad, días de ventilación mecánica, falla renal aguda y el uso de soporte hemodinámico farmacológico.
Se incluyeron todos los pacientes que cumplían con los criterios de selección; tales como: pacientes mayores de 18 años, diagnóstico de patología cardiovascular (enfermedad coronaria, valvulopatías, patología aórtica) que requirió manejo quirúrgico cardiovascular en los años 2023 y 2024, y uso de catéter de arteria pulmonar para la monitoria hemodinámica invasiva posoperatoria; así mismo, se excluyeron los pacientes que les falto la medición de variables necesarias para determinar el delta de poder cardíaco y los desenlaces estudiados, paciente cardiovascular con patología neoplásica activa y paciente crítico por patologías no cardiovasculares que requirieron catéter de arteria pulmonar para la monitoria hemodinámica.
Se realizó una búsqueda activa de las variables del estudio (Contenido suplementario 1. Definición de variables), se ingresaron a la base de datos y posteriormente se analizaron.
Con relación al instrumento de medición, para las variables contempladas en la etapa prequirúrgica se usó el Euroscore II[9], Cleveland score[10] y el ACTA PORT score[11]. Así mismo, para las variables contempladas en la etapa quirúrgica se tomaron medidas oficiales de tiempo de bomba y tiempo de pinza- miento aórtico; y para las variables contempladas en la etapa posquirúrgica se midieron marcadores bioquímicos, marcadores hemodinámicos estándar, la mortalidad y el requerimiento de soporte ventilatorio y hemodinámico.
El procesamiento de los datos se llevó a cabo mediante una estructuración, codificación y registro sistemático de la información. El sesgo se controló a través de la revisión de los registros clínicos y la base de datos, se escogió 10% de la muestra y se verificaron las variables recolectadas; de tal forma que, cuando se encontró un dato no válido se volvió a revisar la fuente de información. Durante la recolección, aquel paciente que no tuvo más del 50% de las variables se descartó. Posteriormente, se utilizó Stata 18 para realizar los análisis estadísticos respectivos.
Para los análisis se usaron técnicas descriptivas. Se calcularon frecuencias y proporciones para las variables categóricas. En el caso de las variables continuas se calcularon medidas de tendencia central (media, moda, mediana) y de dispersión (varianza, desviación estándar, rango, rango intercuartílico) y de localización (percentiles, deciles, cuartiles). Además, se realizaron representaciones gráficas mediante tablas de frecuencia, así como diagramas de caja para variables continuas. Para identificar patrones se usaron diagramas de Alluvial. Además, se usó la prueba de correlación de Spearman para analizar la relación entre el delta del poder cardíaco y otras variables clínicas continuas. Se realizó una prueba binomial con diferencia de proporciones para las variables categóricas; además, se realizó prueba de x2 para ver la relación entre el delta de poder cardíaco a las 24 h y la mortalidad.
-
Resultados
Se revisaron 800 registros de historia clínica digital de los pacientes que ingresaron a la unidad de cuidado intensivo cardiovascular de un hospital de alta complejidad referente en patologías cardiovasculares entre el 01 de enero de 2023 y el 30 de septiembre de 2024; de los cuales, 94 pacientes fueron monitorizados durante el perioperatorio con catéter de arteria pulmonar. De estos últimos, se excluyeron 54 pacientes que no tenían los registros de las variables necesarias para determinar el poder cardíaco al ingreso o a las 24 h; por lo que, para el análisis se usaron los datos de 40 pacientes que cumplieron con todos los criterios de inclusión.
Se realizó un análisis descriptivo encontrando que el 67,5% de los participantes eran de sexo masculino, para los que el cambio de válvula mitral fue la cirugía que más se realizó (40%), seguida de la revascularización miocárdica (22,5%) y el cambio valvular aórtico y mitral (12,5%). Así como, el promedio para la edad en los pacientes fue 60,3 años con DS 12 años.
Además, se relacionaron las variables categóricas a través de un cuadro binominal producto de la prueba de diferencia de proporciones; en el cual, se observó que la diferencia entre los grupos tuvo significancia estadística (Tabla 1).
Además, se buscaron patrones o tendencias comparando las variables categóricas encontrando que a menor edad el poder cardíaco tendía a ser menor al ingreso a la unidad de cuidado intensivo y a las 24 h; así como, que los pacientes con un poder cardíaco menor a 0,6 W a las 24 h tuvieron más días de ventilación mecánica (PC menor 0,6 W – media 3,11 Vs PC mayor 0,6 W – media 1,56). También, al analizar los días hasta el egreso hospitalario, aquellos pacientes con un poder cardíaco al ingreso y a las 24 h menor de 0,6 W tuvieron mayor estancia hospitalaria; y con relación a los días hasta la muerte, aquellos pacientes con un poder cardíaco menor de 0,6 W al ingreso, la mayoría fallecieron los primeros 20 días de hospitalización (Figura 1). Llama la atención, que los 4 pacientes que fallecieron tempranamente tenían un poder cardíaco al ingreso mayor de 0,6 W, pero durante las primeras 24 h presentaron un descenso de más de 0,2 W e inferior a 0,6 W.
Por otra parte, se realizó una prueba de x2 entre el poder cardíaco y la mortalidad encontrando que aquellos pacientes que se murieron estuvieron 2,4 veces más expuestos a un poder cardiaco menor de 0,6 W (OR 2,48, IC 1,07 – 4,9).
También, se realizó un coeficiente de Spearman sin encontrar correlación entre el poder cardíaco al ingreso o a las 24 h con los desenlaces como el lactato y el delta de la creatinina; sin embargo, esto puede deberse al tamaño de la muestra, que si bien, a pesar de no determinar correlaciones, si mostró unos claros patrones y tendencias del poder cardiaco con los desenlaces, especialmente para el poder cardíaco a las 24 h. No obstante, es importante mencionar que hubo una correlación negativa entre el tiempo de bomba y el poder cardíaco a las 24 h (Rho de Spearman -0,398, p 0,049), una correlación positiva entre el tiempo de bomba y el lactato de ingreso (Rho de Spearman 0,421, p 0,007), una correlación negativa entre el poder cardíaco a las 24 h y la creatinina a las 48 h (Rho de Spearman -0,505, p 0,014), y una correlación positiva entre el lactato a las 24 h y la creatinina a las 48 h (Rho de Spearman 0,442, p 0,010).
Ahora bien, con relación al delta de poder cardíaco a las 24 h se encontró que el aumento o disminución de esta variable durante las primeras horas de estancia en la unidad de cuidado intensivo tiene un impacto estadísticamente significativo con el delta del lactato a las 24 h y el requerimiento de soporte vasopresor a las 48 h (Tabla 2); además, que los pacientes con una disminución de 0,2 W o más del poder cardíaco durante las primeras 24 h tienen una media mayor de días de ventilación mecánica en comparación con los que no tuvieron variación o aumentó su poder cardiaco (3,5 días vs 1,83 días vs 1,55 días). Por otra parte, no se encontró una relación entre la disminución del poder cardíaco a las 24 h y el aumento de la creatina; al contrario, los pacientes que tuvieron un aumento de 0,3 mg/dl en la creatinina fueron aquellos en los que su poder cardíaco no tuvo cambios o tuvieron un aumento de 0,2 W o más a las 24 h.
Tabla 1. Variables categóricas
| Nivel | Frecuencia | Total | Proporción | P | |
| Sexo | Mujer | 13 | 40 | 0,325 | 0,038 |
| Hombre | 27 | 40 | 0,675 | 0,038 | |
| Bajo | 12 | 40 | 0,300 | 0,017 | |
| Euro Score II | Intermedio | 13 | 40 | 0,325 | 0,038 |
| Alto | 15 | 40 | 0,375 | 0,154 | |
| Muy bajo | 7 | 40 | 0,175 | < ,001 | |
| Cleveland score | Bajo | 22 | 40 | 0,550 | 0,636 |
| Alto | 11 | 40 | 0,275 | 0,006 | |
| Bajo | 5 | 40 | 0,125 | < ,001 | |
| Acta port score | Intermedio | 5 | 40 | 0,125 | < ,001 |
| Alto | 30 | 40 | 0,750 | 0,002 | |
| Poder cardíaco al ingreso | < 0,6 | 16 | 40 | 0,400 | 0,268 |
| > 0,6 | 24 | 40 | 0,600 | 0,268 | |
| Poder cardíaco 24 H | < 0,6 | 9 | 25 | 0,360 | 0,230 |
| > 0,6 | 16 | 25 | 0,640 | 0,230 | |
| Lactato de ingreso | < 4 | 36 | 40 | 0,900 | < ,001 |
| > 4 | 4 | 40 | 0,100 | < ,001 | |
| Lactato 24 H | < 4 | 34 | 40 | 0,850 | < ,001 |
| > 4 | 6 | 40 | 0,150 | < ,001 | |
| SVP Ingreso | Requirió | 6 | 40 | 0,150 | < ,001 |
| No requirió | 34 | 40 | 0,850 | < ,001 | |
| SVP 24 H | No requirió | 17 | 39 | 0,436 | 0,522 |
| Si requirió | 22 | 39 | 0,564 | 0,522 | |
| SVP 48 H | No requirió | 27 | 38 | 0,711 | 0,014 |
| Si requirió | 11 | 38 | 0,289 | 0,014 | |
| SINO Ingreso | No requirió | 7 | 40 | 0,175 | < ,001 |
| Si requirió | 33 | 40 | 0,825 | < ,001 | |
| SINO 24 H | No requirió | 20 | 39 | 0,513 | 1,000 |
| Si requirió | 19 | 39 | 0,487 | 1,000 | |
| SINO 48 H | No requirió | 28 | 38 | 0,737 | 0,005 |
| Si requirió | 10 | 38 | 0,263 | 0,005 | |
| Traqueostomía | No | 39 | 40 | 0,975 | < ,001 |
| Si | 1 | 40 | 0,025 | < ,001 | |
| Mortalidad | Muerte | 8 | 40 | 0,200 | < ,001 |
| Vivo | 32 | 40 | 0,800 | < ,001 |
Fuente: Elaboración propia; Nota. Ha es proporción * 0,5; SVP: Soporte vasopresor; SINO: Soporte inotrópico.
Por otro lado, la clasificación del riesgo prequirúrgico realizada a los paciente con el Euroscore II, Cleveland score y ACTA PORT score, al ser cotejada con el poder cardíaco al ingreso y a las 24 h, así como con la mortalidad, muestra que los pacientes que tuvieron un poder cardíaco inferior a 0,6 W al ingreso y a las 24 h, independientemente del riesgo, murieron; así como, los pacientes de alto riesgo que ingresaron con un poder cardiaco mayor de 0,6 W pero que durante las 24 h siguientes empeoraron y quedaron con un poder cardíaco inferior a 0,6 W, también murieron. Especialmente para el Euroscore II, llama la atención que los pacientes independientemente del riesgo que ingresaron con un poder cardíaco menor a 0,6 W pero que durante las primeras 24 h de estancia en la unidad de cuidado intensivo aumentaron su poder cardíaco a más de 0,6 W, sobrevivieron (Figura 2).
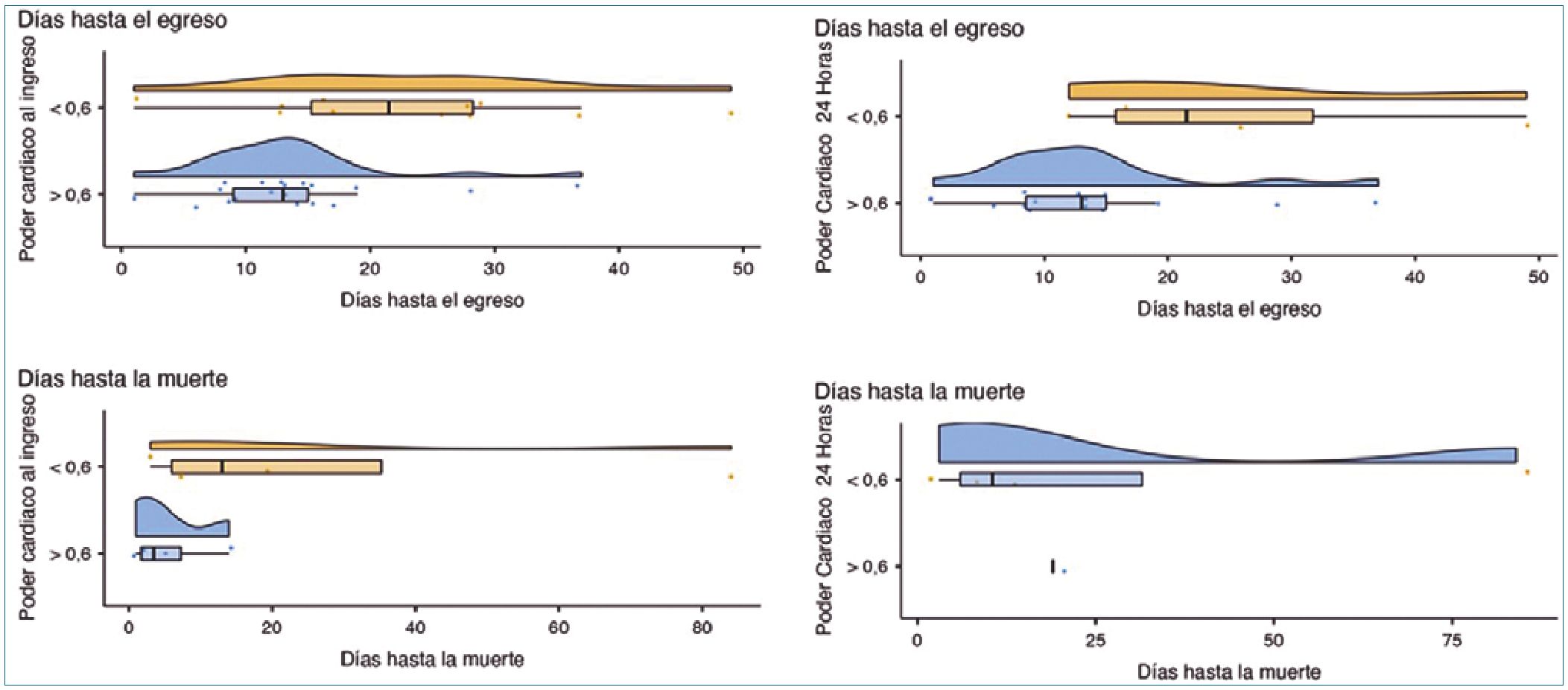
Figura 1.
Tabla 2. Delta de poder cardíaco y días de ventilación mecánica y soporte vasopresor a las 48 h
| Delta de poder cardíaco | |||||
| n | Sin cambios | – 0,2 o + | + 0,2 o + | Test Statistic | |
| Delta lact | 23 | (n = 6)
-0,2 -0,6 -1,5 |
(n = 6)
-3,1 -0,8 -0,3 |
(n = 11)
-1,8 -0,6 -0,3 |
F2,20 = 3,94, P = 0,041 |
| SVP 48 H | 23 | 0,8 5/6 | 0,3 2/6 | 0,2 2/11 | x 22 = 7,03, P = 0,032 |
-
Discusión
Este trabajo de investigación tenía como objetivo establecer la relación del poder cardíaco y el delta de poder cardíaco a las 24 h con la morbimortalidad de pacientes en posoperatorio de cirugía cardiovascular con asistencia de circulación extracorpórea en un Hospital de alta complejidad referente en patologías cardiovasculares, específicamente para desenlaces como mortalidad al egreso, días de ventilación mecánica, falla renal, aclaramiento del lactato y requerimiento de soporte hemodinámico farmacológico; por lo que, los resultados aportan a la construcción del conocimiento frente a la importancia y utilidad de esta variable como una potente medida hemodinámica para el pronóstico de los paciente sometidos a cirugía cardiovascular[6].
Inicialmente, en la literatura se reporta que de acuerdo con las características de los pacientes el poder cardíaco tiene cierto comportamiento, ya que hay una correlación inversa entre el poder cardíaco y la edad (Coeficiente de correlación – 0,334, p menor 0,001)[8]; no obstante, en este trabajo de investigación se evidencia una tendencia contraria, en la que a menor edad el poder cardíaco tendió a ser menor a 0,6 W al ingreso a la unidad de cuidado intensivo y a las 24 h posoperatorias.
Ahora bien, parte de la identificación y gestión del riesgo de los pacientes sometidos a cirugía cardíaca se realiza a través de la aplicación rutinaria y sistemática de escalas como el Euroscore II con muy buen rendimiento predictivo[9]; que, dentro del marco de este trabajo de investigación, a la luz del poder cardíaco, sugiere su uso complementario para la rápida identificación del paciente en riesgo de deterioro posoperatorio con el fin de priorizar su manejo terapéutico, especialmente durante las primeras 24 h de posoperatorio en la unidad de cuidado intensivo cardiovascular; esto, teniendo en cuenta que el poder cardiaco está documentado en la literatura como una herramienta impactante en la identificación de pacientes con diversas afecciones cardiacas críticas con mayor riesgo de mortalidad[1].
De igual forma, la mortalidad como desenlace fuerte de medición al momento de establecer la capacidad predictiva del poder cardíaco, en estudios como el SHOCK trial[8] y la National Cardiogenic Shock Iniciative[12], han centrado su atención en el choque cardiogénico en paciente no quirúrgico; así como, otros estudios han determinado que en pacientes en estado posterior a un paro cardíaco el poder cardíaco a las 8 h (PC menor 0,54 W. S: 55%. E: 75%. VPP 82%. VPN 37%) es un factor independiente para mortalidad debido a falla cardiovascular en UCI[13]. Por lo que, los resultados de este trabajo de investigación realizado en pacientes en posoperatorio de cirugía cardíaca son innovadores al mostrar un nuevo escenario de utilidad para esta variable hemodinámica, especialmente la relación del poder cardíaco al ingreso y a las 24 h cuando es menor de 0,6 W (OR 2,48. IC 1,07 – 4,9), o al deterioro del mismo durante las primeras 24 h, relacionándolo con mayor mortalidad, así como con mayores días de estancia hospitalaria; lo cual, es consecuente con lo reportado en la literatura.
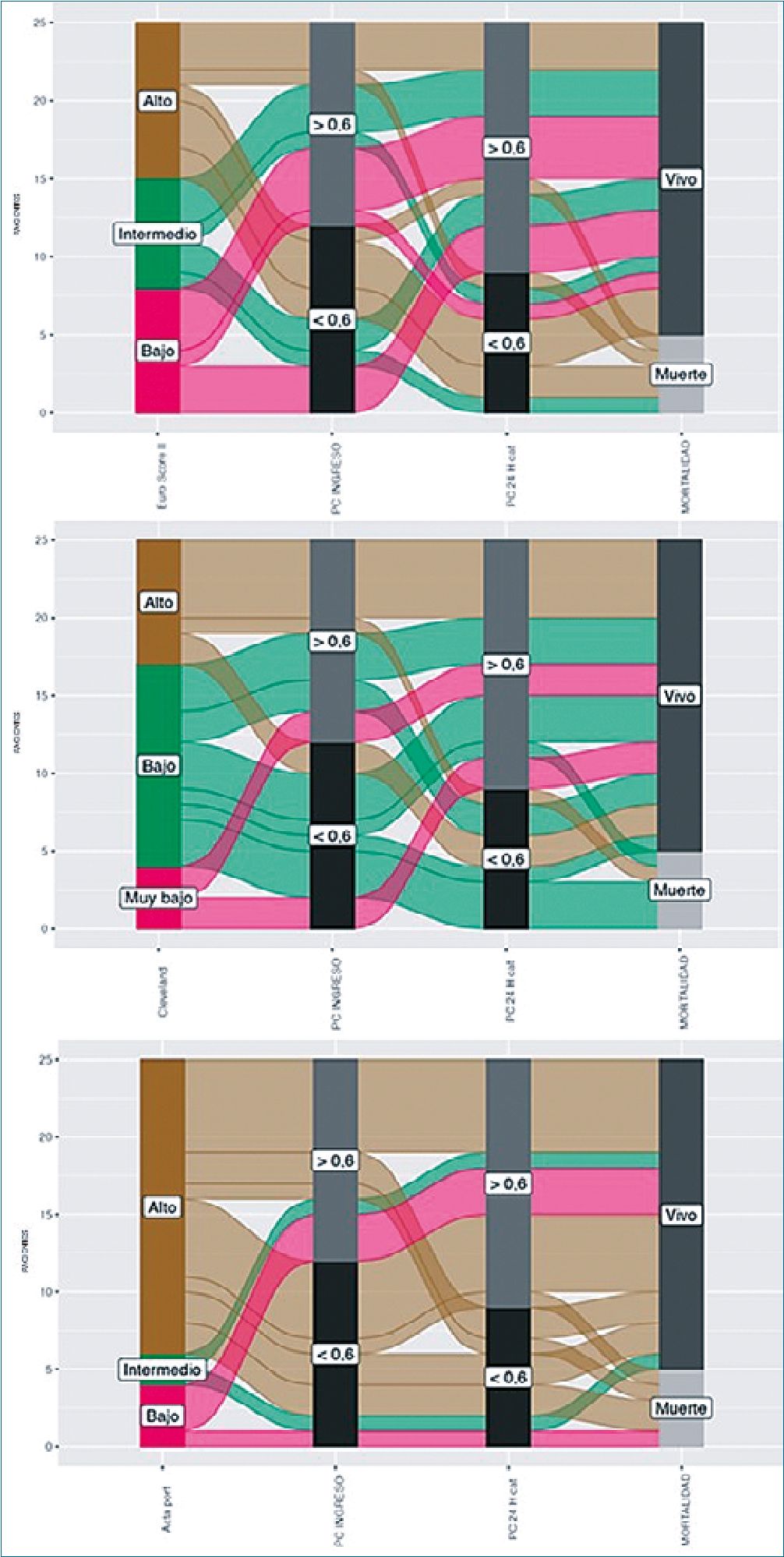
Figura 2.
En primer lugar, en un estudio realizado en una unidad de cuidado intensivo cardiovascular en donde se midió el gasto cardíaco por ecocardiografía, se determinó que un poder cardiaco alto estaba asociado con menores tasas de mortalidad (OR 0,960 por cada 0,1 W. IC 0,092 – 0,96. P = 0,03), así como que la mortalidad es mayor cuando el poder cardíaco es bajo asociado a una fracción de eyección reducida, aumento del soporte vasopresor o valores de lactato altos al ingreso[14]; y en segundo lugar, otro estudio realizado a 59 pacientes en posoperatorio de revascularización miocárdica, en el que se concluyó que un poder cardiaco igual o mayor a 0,7 W a 12 h del posoperatorio predice una evolución favorable a corto plazo y una menor estancia hospitalaria[15]; que para esta cohorte de pacientes tuvo una media de 3,5 días de ventilación mecánica para aquellos pacientes que tuvieron una disminución de 0,2 W o más durante las primeras 24 h posoperatorias.
Es llamativo como, el poder cardíaco a las 24 h y su progresión durante las primeras horas del posoperatorio en pacientes sometidos a cirugía cardíaca en circulación extracorpórea muestra una tendencia a relacionarse con desenlaces adversos, especialmente cuando es menor a 0,6 W; no obstante, abre la puerta a explorar esta variable en otros escenarios del ámbito cardiovascular, como el de hemodinamia; tal como es referen- ciado en la literatura, en donde pacientes llevados a reemplazo de válvula aórtica transcateter que en el posoperatorio tienen un poder cardíaco bajo, se relaciona con una menor tendencia a la supervivencia (Log Rank test, p = 0,043) y con una menor fracción de eyección del ventrículo izquierdo[16].
Por otra parte, la limitación de este estudio fue el tamaño de muestra que se vio limitado por el número de pacientes a los cuales se les insertó un catéter de arteria pulmonar para la monitoria perioperatoria y medición del gasto cardiaco posoperatorio como gold standard; no obstante, a pesar de tener poca muestra hay unos patrones que se correlacionan con los hallazgos en la literatura, y se sugiere que para el reclutamiento de un mayor número de participantes en futuros trabajos de investigación en los que el poder cardíaco sea la variable de medición, la alternativa puede ser el ecocardiograma transtorácico (Correlación de Pearson 0,65 a 0,78 – ICC 0,65 a 0,76) [17]; tal como, lo han realizado en trabajos de investigación con un diseño metodológico similar a este[14]. Además, otra limitación fue la falta de variables en los registros clínicos digitales; lo cual, acotó la muestra estudiada, por lo que derivado de este estudio se hace explicita la necesidad de hacer seguimiento a los pacientes con mayor precisión y de documentar variables hemodinámicas tan relevantes como el poder cardíaco, que ha demostrado en la literatura y en este estudio su valor pronóstico de morbimortalidad.
En conclusión, esta es una cohorte histórica con un gran componente analítico descriptivo que identificó tendencias y patrones entre el comportamiento del poder cardíaco y los desenlaces adversos posoperatorios; tal como que, cuando el poder cardíaco de ingreso a la UCI es inferior a 0,6 W o durante las primeras 24 h posoperatorias disminuye en 0,2 W o más hasta menos de 0,6 W, es el punto de quiebre para una mayor mortalidad, un mayor número de días de ventilación mecánica, una mayor estancia hospitalaria, mayor requerimiento de soporte vasopresor y menor depuración del lactato. Por otra parte, se evidenció un grado de asociación, en el que un sujeto que tiene un poder cardíaco a las 24 h por debajo de 0,6 W tiene 2,4 veces más chance de morir. De esta manera, el poder cardiaco de ingreso a la unidad de cuidado intensivo cardiovascular es una variable susceptible de ser intervenida con el objetivo de mejorarla, ya sea evitando su disminución durante el intraoperatorio o aumentándola durante las primeras horas de recuperación en la UCI; o de lo contrario, predice peores desenlaces.
Contribución de los autores:
Autor 1 (CHJS): Planificación del estudio, obtención de datos, interpretación de los resultados, análisis de los datos y redacción del manuscrito.
Autor 2 (CVA): Planificación del estudio, interpretación de los resultados, análisis de los datos.
Autor 3 (CEJC): Planificación del estudio, obtención de datos, redacción del manuscrito.
Autor 4 (LRCA): Planificación del estudio.
Conflicto de intereses Ninguno.
Financiamiento
Ninguno
-
Referencias
1. Farshadmand J, Lowy Z, Hai O, Zeltser R, Makaryus AN, editors. Utility of Cardiac Power Hemodynamic Measurements in the Evaluation and Risk Stratification of Cardiovascular Conditions. Healthcare. MDPI; 2022. https://doi.org/10.3390/healthcare10122417.
2. Gómez-Mesa JE, Saldarriaga C, Jurado AM, Mariño A, Rivera A, Herrera Á, et al. Consenso colombiano de falla cardíaca avanzada: capítulo de Falla Cardíaca, Trasplante Cardíaco e Hipertensión Pulmonar de la Sociedad Colombiana de Cardiología y Cirugía Cardiovascular. Rev Colomb Cardiol. 2019;26:3–24. https://doi.org/10.1016/j.rccar.2019.06.001.
3. Herrera EL, Valenzuela EC, Pacheco HG, Velasco BM, Mendoza AA, Sánchez CR. “El poder cardíaco” un instrumento del pasado, posiblemente una herramienta moderna en la valoración: clínica, terapéutica y pronóstica del choque cardiogénico por síndrome isquémico coronario agudo. Archivos de Cardiología de México. 2006;76(1):95-108. versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940.
4. Bergel D, Clark C, Schultz DL, Pedoe DS. The determination of the mechanical energy expenditure during ventricular pumping. J Physiol. 1969 Oct;204(2):70P–1P. PMID:5824658
5. Tan LB. Clinical and research implications of new concepts in the assessment of cardiac pumping performance in heart failure. Cardiovasc Res. 1987 Aug;21(8):615–22. https://doi.org/10.1093/cvr/21.8.615 PMID:3328649
6. Del Castillo C, Juárez M. Catéter de arteria pulmonar en shock cardiogénico: novedades acerca de su valor pronóstico y marcadores derivados. Rev Chil Cardiol. 2023;42(1):39–47. https://doi.org/10.4067/S0718-85602023000100039.
7. Dogan A, Mansuroglu D, Konukoglu O, Ozdemir E, Sarilar M, Guler A, et al. Impact of invasively determined cardiac power index on survival in patients with advanced chronic heart failure. Cor Vasa. 2023;65(3):485–8. https://doi.org/10.33678/cor.2022.100.
8. Fincke R, Hochman JS, Lowe AM, Menon V, Slater JN, Webb JG, et al.; SHOCK Investigators. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: a report from the SHOCK trial registry. J Am Coll Cardiol. 2004 Jul;44(2):340–8. https://doi.org/10.1016/j.jacc.2004.03.060 PMID:15261929
9. Nashef SA, Roques F, Sharples LD, Nilsson J, Smith C, Goldstone AR, et al. EuroSCORE II. Eur J Cardiothorac Surg. 2012 Apr;41(4):734–44. https://doi.org/10.1093/ejcts/ezs043 PMID:22378855
10. Thakar CV, Arrigain S, Worley S, Yared JP, Paganini EP. A clinical score to predict acute renal failure after cardiac surgery. J Am Soc Nephrol. 2005 Jan;16(1):162–8. https://doi.org/10.1681/ASN.2004040331 PMID:15563569
11. Klein AA, Collier T, Yeates J, Miles LF, Fletcher SN, Evans C, et al.; Contributors. The ACTA PORT-score for predicting perioperative risk of blood transfusion for adult cardiac surgery. Br J Anaesth. 2017 Sep;119(3):394–401. https://doi.org/10.1093/bja/aex205 PMID:28969306
12. Basir MB, Kapur NK, Patel K, Salam MA, Schreiber T, Kaki A, et al.; National Cardiogenic Shock Initiative Investigators. Improved outcomes associated with the use of shock protocols: updates from the National Cardiogenic Shock Initiative. Catheter Cardiovasc Interv. 2019 Jun;93(7):1173–83. https://doi.org/10.1002/ccd.28307 PMID:31025538
13. Magni F, Soloperto R, Farinella A, Bogossian E, Halenarova K, Pletschette Z, et al. Cardiac power output is associated with cardiovascular related mortality in the ICU in post-cardiac arrest patients. Resuscitation. 2024 Jan;194:110062. https://doi.org/10.1016/j.resuscitation.2023.110062 PMID:38030115
14. Burstein B, Anand V, Ternus B, Tabi M, Anavekar NS, Borlaug BA, et al. Noninvasive echocardiographic cardiac power output predicts mortality in cardiac intensive care unit patients. Am Heart J. 2022 Mar;245:149–59. https://doi.org/10.1016/j.ahj.2021.12.007 PMID:34953769
15. Fausto Ovando SR, Bucio Reta E. Valor del poder cardíaco como factor pronóstico en pacientes postoperados de cirugía de revascularización coronario. Rev guatem cardiol(Impresa). 2012:12-8. LILACS | ID: biblio-869879.
16. Miyahara D, Izumo M, Sato Y, Shoji T, Yamaga M, Kobayashi Y, et al. Cardiac power output is associated with adverse outcomes in patients with preserved ejection fraction after transcatheter aortic valve implantation. Eur Heart J Imaging Methods Pract. 2024 May;2(2):qyae048. https://doi.org/10.1093/ehjimp/qyae048 PMID:39045467
17. Mehmood M, Tchorz K, Markert R, Chandra M, McCarthy M. CARDIAC POWER OUTPUT IN CRITICALLY ILL SURGICAL PATIENTS: A SIMULTANEOUS PULMONARY ARTERY CATHETERIZATION AND TRANSTHORACIC ECHOCARDIOGRAPHY STUDY. Journal of the American College of Cardiology [Internet]. 2013 Mar;61(10):E1126. Available from: http://dx.doi.org/10.1016/s0735-1097(13)61126-2

 ORCID
ORCID