Ricardo Fuentealba R.1,2*, Javiera Cruces M.3, Francisca Pérez V.3, Darío Arenas A.4, Carla Muñoz V.3, Alfredo Villarroel5
Recibido: 07-07-2025
Aceptado: 15-08-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 6 pp. 964-967|https://doi.org/10.25237/revchilanestv54n6-27
PDF|ePub|RIS
Takotsubo syndrome associated with perioperative anaphylaxis: An unusual variant. Case report
Abstract
A case is reported of a 53-year-old woman with a history of hypertension and insulin resistance who experienced sudden hemodynamic instability during a radical thyroidectomy. After advanced resuscitation, she was transferred to intensive care with diagnosis of anaphylactic shock. As part of the hemodynamic assessment, a POCUS echocardiogram was performed, identifying apical dyskinesia. EKG with anterolateral ST elevation and elevated ultrasensitive troponins, therefore a coronary angiography was performed, revealing normal vascular bed, concluding the diagnosis of Takotsubo syndrome associated with anaphylaxis. It is suggested that both stress secondary to catecholamines and allergic reactions could trigger this condition. The diagnosis of exclusion is supported by biochemical markers, coronary angiography, and echocardiogram. Its treatment includes the management of heart failure and life support as needed. The condition is self-limited, and monitoring in critical care is recommended along with cardiac follow-up.
Resumen
Se reporta el caso de una mujer de 53 años con antecedentes de hipertensión e insulinorresistencia, que experimentó súbita inestabilidad hemodinámica durante tiroidectomía radical. Tras reanimación avanzada, fue trasladada a cuidados intensivos con el diagnóstico de shock anafiláctico. Como parte del estudio hemodinámico se realizó ecocardiograma POCUS, identificándose disquinesia apical. Electrocardiograma con supradesnivel ST anterolateral y elevación de troponina ultrasensible, por lo que se realizó coronariografía que reveló lecho vascular normal, concluyendo con el diagnóstico de síndrome de Takotsubo asociado a anafilaxia. Se sugiere que tanto el estrés secundario a catecolaminas como las reacciones alérgicas podrían gatillar esta condición. El diagnóstico de descarte se apoya en marcadores bioquímicos, coronariografía y ecocardiograma. Su tratamiento incluye el manejo de insuficiencia cardíaca y soporte vital según necesidad. El cuadro es autolimitado y se recomienda monitorización en cuidados críticos junto al seguimiento cardiológico.
-
Descripción del caso
Se reporta el caso de una paciente femenina de 53 años, con antecedentes de hipertensión arterial, resistencia a la insulina, esteatosis hepática y múltiples cirugías previas, con hábito tabáquico suspendido hace 6 años y alergia notificada a ergometrina.
La paciente ingresó a pabellón electivo para una tiroidectomía radical por sospecha de neoplasia tiroidea. Se realizó inducción con preoxigenación con O2 al 100%, lidocaína 60 mg, se inició anestesia total endovenosa con remifentanilo y propofol, rocuronio 50 mg y dexametasona 8 mg. Se instaló tubo endotraqueal trivantage emg número 6 Medtronic®.
Aproximadamente a los 10 minutos de iniciada la cirugía, inicia súbitamente taquicardia sinusal hasta 160 lpm, hipotensión hasta 60/20 mmHg e hipocapnia severa (12 cmH20). Se observó eritema y edema generalizado por lo que se sospechó shock anafiláctico. Se realizó reanimación con suero ringer lac- tato (500 cc + 500 cc + 500 cc), fenilefrina (90 mcg + 180 mcg + 180 mcg + 180 mcg + 180 mcg), adrenalina (0,5 mg + 0,5 mg 0,5 mg + infusión), betametasona (4 mg) y clorfenamina (10 mg), logrando estabilización hemodinámica a los 30-40 min de iniciado el shock. Se trasladó a la paciente a cuidados intensivos en ventilación mecánica invasiva, ingresando con frecuencia cardíaca 72 lpm, presión arterial 144/88 mmHg, saturación de O2 100% con FiO2 de 100% e infusión de adrenalina a 0,3 mcg/kg/min, con erupción cutánea en regresión. Durante su hospitalización en Unidad de Paciente Crítico (UPC) fue mantenida bajo sedación profunda, se realizó vigilancia hemodinámica con monitor de gasto cardíaco por línea arterial; adrenalina, hidrocortisona, famotidina, clorfenamina, paracetamol, ondansetrón y nebulización con broncodilatadores por horario.
Como parte del estudio hemodinámico, se realizó ecocardiograma transtorácico POCUS, informado como ventrículo izquierdo no dilatado, con disquinesia, función sistólica global levemente deprimida y fracción de eyección de ventrículo izquierdo (FEVI) 47%. Luego de 6 h de reanimación, se realizó nuevo control ecocardiográfico (Figura 1) por cardiólogo de imágenes, que confirmó hipoquinesia del ventrículo izquierdo, dilatación apical y evidencia de disfunción diastólica. Se tomó electrocardiograma (ECG) (Figura 2) que evidenció supradesnivel del segmento ST anterolateral. Se solicitarón niveles séricos de troponina ultrasensible, que resultaron elevados,10 ng/ml (valor ref 0,01 ng/ml), por lo que se realizó estudio angiográfico coronario, que evidenció lecho vascular normal con flujo TIMI 3. Debido a la evolución clínica y a los hallazgos imagenológicos, se planteó en reunión multidisciplinaria, el diagnóstico de síndrome de Takotsubo (STT) asociado a anafilaxia.
La paciente fue extubada sin incidentes, sin compromiso hemodinámico, ni necesidad de drogas vasoactivas (DVA). Se mantuvo bajo monitorización en cuidados intensivos las siguientes 72 h, se constató disminución de troponina ultrasensible y reversión de los cambios electrocardiográficos, con evolución favorable hasta la resolución espontánea.
-
Metodología
Se realizó una búsqueda bibliográfica durante julio y agosto del año 2024, para complementar caso clínico, mediante el uso de motores de búsqueda indexados, utilizando palabras clave en relación directa con el tema en discusión. La búsqueda fue realizada utilizando los criterios descritos en la Tabla 1. Los estudios seleccionados se basarón en seres humanos, estudios observacionales y reportes de casos.
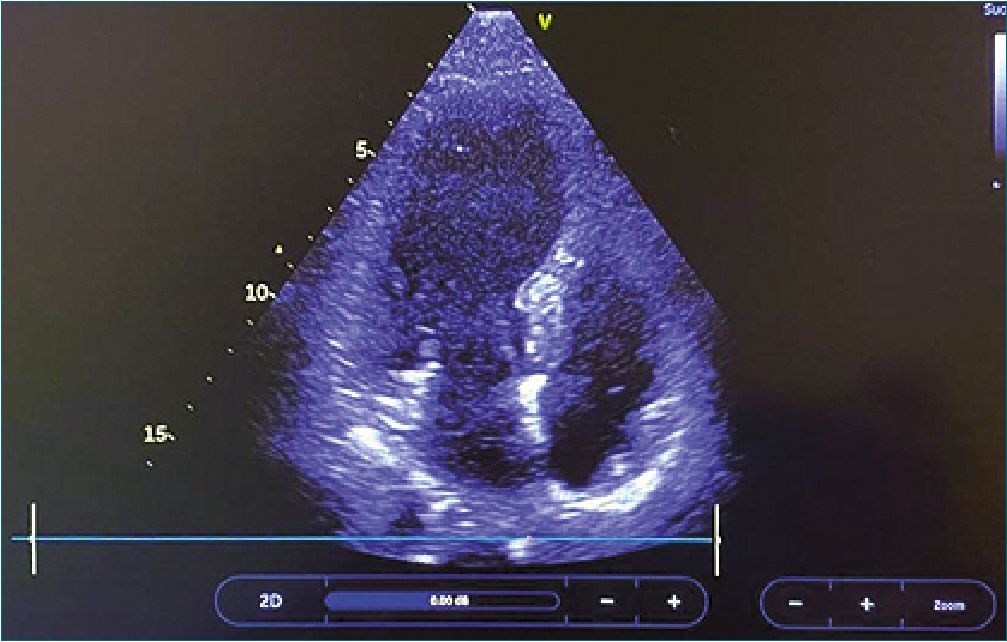
Figura 1. Hipoquinesia y dilatación vértice del ventrículo izquierdo.
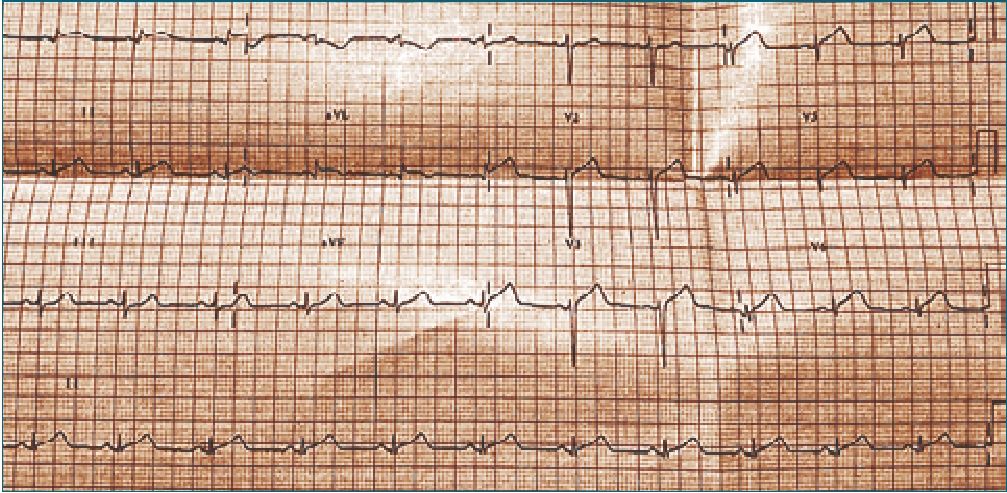
Figura 2. ECG SDST anterolateral.
-
Discusión
El síndrome de Takotsubo, es una enfermedad poco frecuente, aún más, asociado a anafilaxia, no encontrándose epidemiología de la asociación entre ambas entidades patológicas. Solo se reportan casos aislados y editoriales en publicaciones médicas.
El síndrome aislado alcanza una prevalencia de 0,02% en hospitalizados de Estados Unidos, en Chile, entre 1 y 2,5% de los SCA son en realidad un STT, en un estudio publicado por Ugalde y cols. En 2017, en una serie de 4.443 pacientes, reportó que 0,83% del total de los pacientes con síndrome. Coronario Agudo (SCA) cumplían criterios para STT. En esta serie no se encontró ningún caso asociado a anafilaxia[1].
Dentro de los principales factores de riesgo destaca el género femenino, siendo la edad postmenopáusica la de mayor incidencia. La frecuencia de STT asociada a anafilaxia es rara, no existiendo suficientes datos cuantitativos para determinar su prevalencia. Desde la década del 90 Kounis y Zavras describen un síndrome que compartía clínica con la patología isquémica miocárdica, pero en el contexto de un cuadro anafiláctico, denominado angina alérgica[2] Kounis y Filippatos en una publicación en 2007, posteriormente agruparon los distintas presentaciones como síndrome de Kounis (tipo 1, 2, 3)[3], durante el 2017, Abdelghany y cols., reportó 175 casos, que compartían la clínica y el laboratorio, todos en contexto de una respuesta alérgica[4].
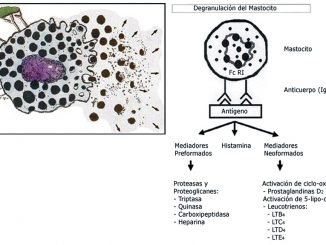
El mecanismo del STT es aún incierto, en una revisión narrativa publicada por Singh, durante el 2022, se asoció al estrés emocional, postulando que señales corticales serían moduladas a través del sistema límbico y dirigidas hacia el hipotálamo, conduciendo a la activación del eje corticosuprarrenal, resultando en un aumento de la liberación de catecolaminas séricas en las terminales simpáticas[5]. Esto se suma al estado deficitario de estrógenos postmenopáusico, potenciando así el aumento del tono simpático y una desregulación del flujo microvascular miocárdico, este exceso de catecolaminas causarían, a nivel cardiaco, vasoespasmo coronario, alteración microvascular y falla en la contractilidad[6]. Estos fenómenos podrían también estar presentes en un contexto de crisis anafiláctica, donde la liberación de mediadores inflamatorios y la activación de mastocitaria, podrían conducir al espasmo coronario y cardiomiopatía transitoria[7]. Es de especial relevancia el rol de la adrenalina como uno de los principales mediadores involucrados en la patogénesis del STT, al ser además, el principal fármaco utilizado durante el manejo del shock anafiláctico. Un artículo publicado el 2023 por Calogiuri y cols., cuestiona la utilización rutinaria de adrenalina en dosis altas para el manejo de la anafilaxia, planteando que la administración de catecolaminas exógenas sería una posible causa de complicaciones cardíacas[8]. Kounis, en una editorial publicada también durante el 2023, relaciona fisiopatológicamente los procesos de anafilaxia, STT, adrenalina exógena y síndrome de Kounis, dentro de un complejo sindromático denominado ATAK[7].
El STT es una afección aguda, autolimitada y benigna, que se caracteriza por precordialgia de carácter opresivo, asociado a alteraciones electrocardiográficas típicamente encontradas en SCA. En ciertos casos el cuadro clínico puede cursar con falla cardíaca aguda, shock cardiogénico e incluso falla multiorgánica. En una publicación realizada en Chile durante el 2017, estas complicaciones llegaron hasta el 19% con una mortalidad de hasta 9%[1].
Tabla 1. Criterios de búsqueda bibliográfica
| Motor de búsqueda | Tipo de artículo | Año | Palabras clave | Resultados | Selección |
| Revisión | > 2010 | (Takotsubo) | 8 | 1 | |
| Scielo | Revisión, Reporte de caso, Cartas | > 2010 | (Takotsubo) and (anafilaxia) | 0 | – |
| Revisión, Reporte de caso, Cartas | > 2010 | (ATAK) | 0 | – | |
| Revisión | > 2010 | (Takotsubo) | 90 | 3 | |
| Pubmed | > 2010 | (Takotsubo) and (ATAK) or (Kounis) or (anaphylaxis*) | 102 | 3 |
Tabla 2. Criterios internacionales de síndrome de Takotsubo[9]
| Criterios diagnósticos internacionales de Takotsubo (criterios diagnósticos InterTAK)[9] |
| 1. Los pacientes muestran disfunción ventricular izquierda transitoria (hipoquiinesia, aquinesia o disquinesia), que se presenta como abombamiento apical o anomalías del movimiento de la pared ventricular medial, basal o focal. Puede haber afectación del ventrículo derecho. Además de estos patrones regionales de movimiento de la pared, pueden existir combinaciones entre todos los tipos. La anomalía del movimiento de la pared regional suele extenderse más allá de una única distribución vascular epicárdica; sin embargo, pueden existir casos raros en los que la anomalía del movimiento regional de la pared está presente en el territorio miocárdico subtendido de una única arteria coronaria (TTS focal) |
| 2. Un desencadenante emocional, físico o combinado puede preceder al síndrome de Takotsubo (no es excluyente) |
| 3. Los trastornos neurológicos (p. ej., hemorragia subaracnoidea, accidente cerebrovascular/ataque isquémico transitorio o convulsiones), así como el feocromocitoma, pueden actuar como desencadenantes del síndrome de Takotsubo |
| 4. Se presentan nuevas anomalías en el ECG (elevación del segmento ST, depresión del segmento ST, inversión de la onda T y prolongación del QTc); sin embargo, existen casos raros sin cambios en el ECG |
| 5. Los niveles de biomarcadores cardíacos (troponina y creatinquinasa) están moderadamente elevados en la mayoría de los casos. Es común una elevación significativa del péptido natriurético cerebral |
| 6. La enfermedad arterial coronaria significativa no es una contradicción en el síndrome de Takotsubo |
| 7. Los pacientes no tienen evidencia de miocarditis infecciosa |
| 8. Las mujeres postmenopáusicas se ven predominantemente afectadas |
El diagnóstico de STT es desafiante, considerando que clínicamente se comporta como un SCA típico, sin embargo, para su diagnóstico oportuno, es necesaria la sospecha, determinación precoz de enzimas cardíacas particularmente troponina ultrasensible y pro BNP, evaluación de la función ventricular izquierda y de la circulación coronaria. Para apoyar la decisión clínica se establecieron durante 2022 criterios diagnósticos (Tabla 2)[9].
Considerando estos elementos anteriormente discutidos, la presencia de un paciente crítico cursando anafilaxia sugiere la toma de electrocardiograma, marcadores de isquemia miocárdica y ecocardiografía precoz.
Este tipo de pacientes debe ser idealmente manejado en una unidad de cuidados intensivos, con el objetivo de monitorizar la función ventricular y la eventual aparición de arritmias. En el caso de presentarse falla cardíaca aguda con edema pulmonar agudo, la recomendación es el uso de diuréticos endovenosos y vasodilatadores del tipo nitratos. Los pacientes cursando con obstrucción del tracto de salida del ventrículo izquierdo podrían beneficiarse del uso de beta bloqueo[7]. La terapia de fluidos debe realizarse de manera conservadora y guiada por metas de perfusión[2].
Una vez resuelto el cuadro, los pacientes deberían tener seguimiento cardiológico con el fin de evaluar el impacto en el mediano a largo plazo sobre la función ventricular.
-
Conclusión
El STT es una entidad clínica de baja prevalencia, que, sin embargo, debe ser considerada como diagnóstico diferencial en pacientes cursando anafilaxia asociada a SCA. La sospecha clínica y las herramientas de imagen, como la ecocardiografía son esenciales para el diagnóstico y seguimiento. A pesar de la recuperación completa de la función ventricular en la mayoría de los casos, la posibilidad de recurrencia subraya la necesidad de una vigilancia continua y un manejo integral de estos pacientes, por lo que el seguimiento debe ser en unidad de paciente crítico con monitorización hemodinámica. Además, la reciente aparición en la literatura, del complejo sindromático ATAK hace pensar que las presentaciones de STT en contextos de anafilaxia, podrían tratarse de variantes de una misma enfermedad o al menos que compartan características fisiopatológicas. Instamos a que la investigación futura se centre en reportar la asociación entre STT y estados anafilacticos, así como en desarrollar estrategias de pesquisa diagnóstica y seguimiento para mejorar los resultados a largo plazo.
-
Referencias
1. Ugalde H, Yubini MC, Sanhueza MI, Ayala F, Chaigneau E, Dussaillant G, et al. Síndrome de tako-tsubo, caracterización clínica y evolución a un año plazo. Rev Med Chil. 2017 Oct;145(10):1268–75. Available from: https://www.revistamedicadechile.cl/index.php/rmedica/article/view/5981 https://doi.org/10.4067/S0034-98872017001001268 PMID:29488567
2. Kounis NG, Zavras GM. Histamine-induced coronary artery spasm: the concept of allergic angina. Br J Clin Pract. 1991;45(2):121–8. https://doi.org/10.1111/j.1742-1241.1991.tb10251.x PMID:1793697
3. Kounis NG, Filippatos GS. Takotsubo and Kounis syndrome: is there any association? Circ J. 2007 Jan;71(1):170. https://doi.org/10.1253/circj.71.170 PMID:17205665
4. Abdelghany M, Subedi R, Shah S, Kozman H. Kounis syndrome: A review article on epidemiology, diagnostic findings, management and complications of allergic acute coronary syndrome. Int J Cardiol. 2017 Apr;232:1–4. https://doi.org/10.1016/j.ijcard.2017.01.124 PMID:28153536
5. Pelliccia F, Kaski JC, Crea F, Camici PG. Pathophysiology of Takotsubo Syndrome. Circulation. 2017 Jun;135(24):2426–41. https://doi.org/10.1161/CIRCULATIONAHA.116.027121 PMID:28606950
6. Singh T, Khan H, Gamble DT, Scally C, Newby DE, Dawson D. Takotsubo syndrome: Pathophysiology, emerging concepts, and clinical implications. Circulation. 2022 Mar;145(13):1002–19. https://doi.org/10.1161/CIRCULATIONAHA.121.055854 PMID:35344411
7. Kounis NG, Mplani V, de Gregorio C, Koniari I. Attack the ATAK; A Challenging Contemporary Complex: Pathophysiologic, Therapeutic, and Preventive Considerations. Balkan Med J. 2023 Sep;40(5):308–11. https://doi.org/10.4274/balkanmedj.galenos.2023.2023-4-96 PMID:37218727
8. Calogiuri G, Savage MP, Congedo M, Nettis E, Mirizzi AM, Foti C, et al. Is adrenaline always the first choice therapy of anaphylaxis? An allergist-cardiologist interdisciplinary Point of View. Curr Pharm Des. 2023;29(32):2545–51. https://doi.org/10.2174/0113816128257514231019165809 PMID:37877509
9. Assad J, Femia G, Pender P, Badie T, Rajaratnam R. Takotsubo Syndrome: A Review of Presentation, Diagnosis and Management. Clin Med Insights Cardiol. 2022 Jan;16:11795468211065782. https://doi.org/10.1177/11795468211065782 PMID:35002350

 ORCID
ORCID