Joel Fernando Gámez Monge1, Eduardo Martín Rojas Pérez2, Tomás Ruiz Duran32 0, Fernanda Muñoz Garibi4
Recibido: 29-08-2025
Aceptado: 23-09-2025
©2026 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 55 Núm. 1 pp. 128-133|https://doi.org/10.25237/revchilanestv55n1-19
PDF|ePub|RIS
Double anterior descending coronary artery: Case report
Abstract
Coronary anatomy presents multiple congenital variants, some of which are rare and clinically relevant. One of these is the double anterior descending artery, whose type IV variant, according to the Spindola-Franco classification, is the least common. Its incidence is extremely low and is usually diagnosed incidentally through imaging studies. We present the case of a pediatric patient with tetralogy of Fallot, in whom this anomaly was identified during the perioperative evaluation protocol. Given the limited literature available and the increasing number of pediatric patients with congenital heart disease in highly specialized centers, we consider it essential to document this finding to contribute to the understanding and adequate clinical management of these entities.
Resumen
La anatomía coronaria presenta múltiples variantes congénitas, algunas de las cuales son raras y clínicamente relevantes. Una de ellas es la arteria descendente anterior doble, cuyo variante tipo IV, según la clasificación de Spindola-Franco, es la menos frecuente. Su incidencia es extremadamente baja y suele diagnosticarse incidentalmente mediante estudios de imagen. Presentamos, el caso de un paciente pediátrico con tetralogía de Fallot, en quien se identificó esta anomalía durante el protocolo de evaluación perioperatoria. Dada la escasa literatura disponible y el creciente número de pacientes pediátricos con cardiopatías congénitas en centros de alta especialidad, consideramos fundamental documentar este hallazgo para contribuir al conocimiento y adecuado abordaje clínico de estas entidades.
-
Introducción
La anatomía normal de las arterias coronarias incluye una serie de variantes respecto a su origen, distribución y recorrido, que hacen que no existan 2 pacientes con coronarias exactamente iguales. En cuanto al desarrollo embriológico, los peces y los anfibios presentan únicamente una arteria corona-
ria. En contraste, aproximadamente el 60% de las aves y mamíferos suelen tener dos arterias coronarias, lo que sugiere que la aparición de una segunda arteria coronaria es una característica adquirida más tardíamente en la evolución animal. En las primeras etapas del desarrollo embrionario, la irrigación cardíaca proviene de sinusoides intramiocárdicos[1]. A medida que el corazón se vuelve más compacto, a partir de estos sinusoids se desarrollan las arterias, venas y capilares. Las arterias coronarias extramurales aparecen en el embrión humano entre los días 44 y 46, cuando los embriones miden entre 16 y 19 mm, coincidiendo con la formación completa de las valvas semilunares aórticas. En los senos de valsalva derecho e izquierdo se identifican los primeros indicios de las arterias coronarias. Estos brotes primitivos se extienden hacia el ápex del corazón, generando ramificaciones que penetran el miocardio primitivo y se conectan con el sistema de sinusoides. Tanto los senos aórticos como los pulmonares tienen la capacidad de formar arterias coronarias, evidenciada por la presencia de múltiples primordios coronarios. Sin embargo, solo dos de estos alcanzan un desarrollo completo y funcional, mientras que los demás tienden a desaparecer progresivamente[1].
Existe una amplia variación anatómica de las arterias coronarias, hay una serie de variantes comunes que se aceptan como normales pero que pueden tener importancia si se desarrolla enfermedad en las coronarias (ejemplo ateroma en una sola arteria coronaria) o si se realiza una cirugía de la región (donde los vasos intramurales o colocados inusualmente pueden ser más propensos a lesionarse), cabe destacar que la función fisiológica de las arterias coronarias y del corazón suele ser normal en estas variaciones[2], La incidencia de anomalías coronarias es del 0,2% al 1,2% de la población. Desde el siglo XVIII se han descrito diversas anomalías, tanto clínicamente como en estudios patológicos, pero el primer artículo fundamental, que intentó una clasificación exhaustiva, fue el de Ogden en 1969, al que se refieren la mayoría de los autores y del que se derivan las numerosas modificaciones de la nomenclatura. Variaciones congénitas de la arteria coronaria[3].
La anatomía coronariana normal consta de un sistema de 2 arterias, una derecha y una izquierda que a su vez se bifurca siendo un total de 3 de las cuales se mencionan las siguientes características:
Tronco principal de la coronaria izquierda: El tronco principal de la arteria coronaria izquierda nace de la porción superior del seno aórtico posterior izquierdo, por debajo del borde seno tubular de la aorta, con un diámetro (3-6 mm) y longitud (0-20 mm) variables. En un porcentaje bajo el tronco principal es muy corto y se bifurca casi inmediatamente (Figura 1).
Arteria descendente anterior: Pasa a la izquierda del tronco de la arteria pulmonar y transcurre a lo largo de la cara epicárdi- ca del surco interventricular anterior hasta el ápex cardíaco. Las ramas principales que aporta en su recorrido son las septales y diagonales.
Arteria circunfleja: Tiene su origen en el tronco principal de la arteria coronaria izquierda. Transcurre por el surco auricu- loventricular posterior izquierdo hacia el surco interventricular inferior, con un tamaño y longitud variables. En su recorrido se ramifica en un número variable de ramas marginales.
Arteria coronaria derecha: Se origina en el seno aórtico anterior derecho, ligeramente por debajo del nacimiento de la arteria coronaria izquierda. Transcurre a lo largo del surco auri- culoventricular derecho hacia la cruz, donde convergen el surco auriculoventricular anterior derecho, el surco auriculoventricular posterior izquierdo y el surco interventricular inferior[4],[5],[6].
La arteria descendente anterior normalmente constituye la continuación del tronco coronario izquierdo y se extiende a través del surco interventricular anterior, hasta la punta del corazón; pero puede tener variantes anatómicas, como las describe Spindola-Franco y clasifica en 4 grupos basados en sus ca- racterísticas[7], cabe mencionar que independientemente de la anomalía presentada esta afecta el aporte normal de sangre al territorio miocárdico correspondiente a diferencia de anomalías como el grupo de fístulas arteriovenosas coronarias.
Tuncer y cols., en un análisis de 70.850 angiografías coronarias de adultos encontraron 171 casos con anomalías coronarias de los cuales 12 pacientes (0,017%) correspondieron a la arteria coronaria doble[12].
A lo largo de los años, en el Instituto Nacional de Cardiología “Dr. Ignacio Chávez” se ha observado un aumento en la demanda y atención de pacientes pediátricos con cardiopatías congénitas, por lo que resulta fundamental contar con un conocimiento adecuado sobre esta rara entidad.
Nos motivó a redactar este artículo la atención de un paciente con una cardiopatía congénita cianógena (tetralogía de Fallot), en quien se identificó este hallazgo durante su protocolo de estudio en el período perioperatorio. Consideramos fundamental documentarlo y compartirlo en la literatura médica, dado que la evidencia disponible sobre esta entidad es limitada y existen pocos casos descritos hasta la fecha.
-
Caso clínico
Paciente masculino de 5 años, originario y residente de Morelos, católico y escolar.
Antecedentes perinatales: Madre de 23 años, con control prenatal desde el primer mes y 9 consultas, 3 ultrasonidos sin alteraciones. Recibió ácido fólico, sulfato ferroso, toxoide tetánico y vacuna anti-influenza. Amenaza de aborto en segundo mes con tratamiento y reposo. Curso con cervicovaginitis tratada. Producto nacido a término, vía vaginal, 37 semanas, peso 2.720 g, talla 51 cm, APGAR 8/9. Egresado a las 24 h junto a madre.
Antecedentes personales patológicos: Sin alergias, transfusiones o traumatismos.
Cirugía previa: Fístula sistémico-pulmonar (2021) bajo anestesia general sin complicaciones.
Historia cardiovascular: A los 8 meses presentó infección respiratoria; al auscultar soplo cardíaco fue referido para eco- cardiograma que diagnosticó tetralogía de Fallot. Inició tratamiento con propranolol y fue transferido al Instituto Nacional de Cardiología en 2020. En 2021, se realizó fístula sistémico- pulmonar tipo Blalock-Taussig izquierda con injerto de 5 mm vía toracotomía. En enero de 2024, presentó deterioro funcional (NYHA ROSS II: diaforesis al esfuerzo), por lo que se protocolizó perioperatorio.
Exploración física: Peso 18 kg, talla 100 cm, saturación 83% al aire ambiente. Estado general adecuado, consciente y orientado. Cuello sin plétora yugular, tórax con murmullo vesicular conservado, precordio normodinámico con soplo eyectivo paraesternal izquierdo. Abdomen blando, peristalsis presente, sin megalias. Extremidades con llenado capilar inmediato y pulsos presentes.
Medicamentos: Ácido acetilsalicílico 60 mg oral desde los 10 meses. Paraclínicos: Hb 14,9 g/dL, Hto 42%, plaquetas 260.000, leucocitos 9,1, glucosa 95 mg/dL, urea 12 mg/dL, creatinina 0,3 mg/dL, electrolitos normales. TP 9,7 s, INR 1,08, TPTa 34,5 s.
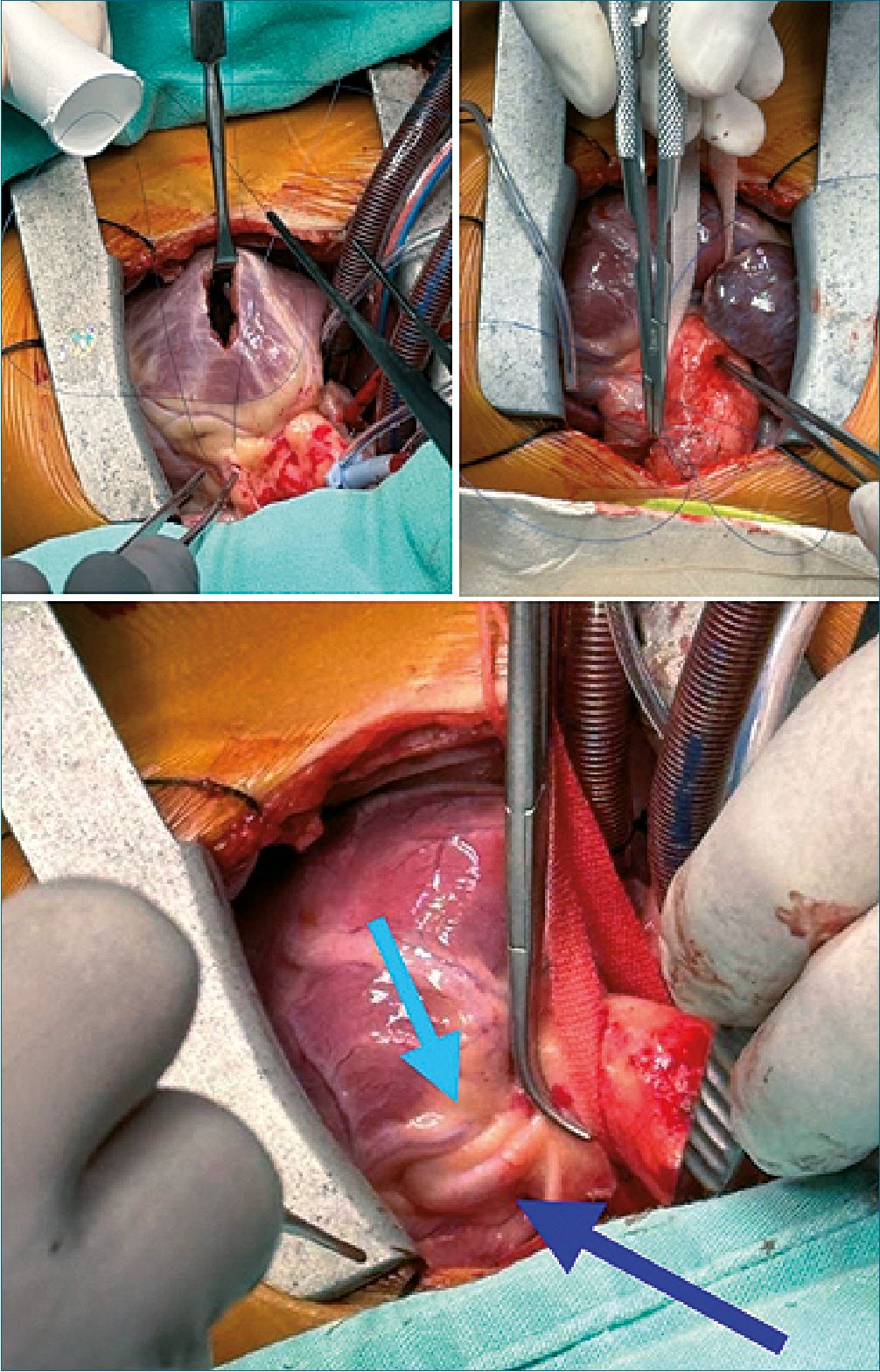
Figura 1. Imagen macroscópica durante procedimiento quirúrgico de rastelli donde se identifica doble coronaria descendente.
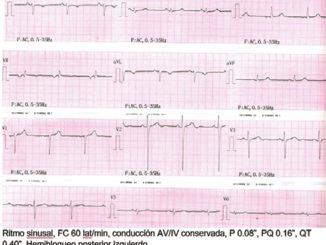
Electrocardiograma: Ritmo sinusal, FC 100, PR 120 ms, QRS 80 ms, QT 360 ms, bloqueo incompleto de rama derecha e hipertrofia ventricular derecha.
Radiografía de tórax: Situs solitus abdominal y bronquial con levocardia y levoápex, arco aórtico izquierdo, botón pulmonar izquierdo excavado, crecimiento de cavidades derechas, índice cardiotorácico 0,57, hiperflujo pulmonar.
Ecocardiograma transtorácico: Tetralogía de Fallot posoperado de fístula sistémico-pulmonar izquierda. Comunicación interventricular de 13×12 mm, válvula pulmonar hipoplásica con estenosis pulmonar mixta, ventrículo derecho hipertrófico con fístula permeable, dilatación del anillo y senos de valsalva. Ventrículo izquierdo con función conservada (FEVI 62%), ventrículo derecho con función sistólica conservada y disfunción diastólica tipo II.
Tomografía computarizada de tórax contrastada: Situs so- litus abdominal y atrial, levocardia, conexión atrioventricular concordante con 40% modo perforado cabalgado. Válvula aórtica trivalva, arterias coronarias con doble sistema de descendente anterior tipo Spindola-Franco IV. Aorta dilatada en unión sino-tubular, arco aórtico izquierdo con origen habitual. Fístula sistémico-pulmonar permeable, anillo pulmonar hipoplásico, válvula pulmonar engrosada, estenosis supra valvular mínima de 11 mm antes de bifurcación. Comunicación interventricular perimembranosa de 8,3×10 mm.
Intervenciones terapéuticas: Se discutió el caso de un paciente con tetralogía de Fallot, aumento de gradiente valvular y doble sistema de arteria coronaria descendente anterior, proponiéndose cirugía de Rastelli. Las escalas de riesgo fueron ASA III, NYHA ROSS II, RACHS-1: 3, aristóteles 7,5, STS-EACTS morbilidad 3 y mortalidad 2. En el día programado, se realizó anestesia general balanceada con monitoreo invasivo (línea arterial, PVC, PAI) y neurológico (BIS y NIRS somático y cerebral). La premédicación incluyó midazolam oral 10 mg. En sala, signos vitales: FC 95 lpm, ritmo sinusal, saturación 86%, BIS 90, NIRS 81/84. Se indujo anestesia con sevofluorano al 8%, colocaron vías periféricas y se realizó coinducción endovenosa con midazolam 4 mg, fentanilo 100 mcg y vecuronio 1 mg IV, asistiendo ventilación con FiO2 al 100%. Tras latencia, se realizó laringoscopia con hoja MAC 2, visualizando Cormack-Lehane 1, intubando al primer intento con cánula orotraqueal 5,5 con globo, verificando posición clínica y capnografía. La ventilación mecánica fue controlada por volumen: volumen tidal 160 ml, frecuencia 23/min, PEEP 0, I:E 1:2, FiO2 60%. Se colocó línea arterial femoral derecha (catéter 22G) y catéter venoso central yugular interno derecho bajo técnica de Seldinger, con PVC inicial 10 mmHg y presión arterial 90/55 mmHg. El mantenimiento anestésico incluyó fentanilo 5 mcg/kg/h, dexmedetomidina 0,3 mcg/kg/h, sulfato de magnesio 30 mg/kg/h y lidocaína 1 mg/ kg/h, con protección neurológica mediante cerebrolisina 1,8 mg IV. Durante la anestesia, BIS se mantuvo entre 40-45 y NIRS 80/82. El procedimiento quirúrgico fue tolerado adecuadamente. Se inició perfusión de dopamina (3 mcg/kg/min) y norepin- efrina (0,02 mcg/kg/min) antes de la derivación cardiopulmonar (Figura 2). Se administraron 450 ml de cardioplejía anterógrada hasta asistolia y se realizó bypass sin complicaciones con presión de perfusión entre 45-55 mmHg. Se ejecutó la cirugía de Rastelli y cierre de fístula sistémico-pulmonar. Durante la hipotermia (30°C) y el calentamiento gradual, se usaron levosi- mendán (1 mcg/kg/min) y nitroglicerina (0,1 mcg/kg/min). Al despinzar la aorta, el ritmo sinusal se mantuvo con marcapasos en modo centinela. El destete de circulación extracorpórea fue exitoso, sin descenso significativo en NIRS ni alteración ácido- base. Ecocardiograma transesofágico mostró buena movilidad segmentaria y global, con insuficiencia pulmonar libre de tubo de Rastelli. El paciente fue trasladado a cuidados intensivos pediátricos para vigilancia y tratamiento.
-
Resultados
Evolución postquirúrgica satisfactoria, sin aumento en va- sopresores, con extubación temprana. Fue dado de alta a los 7 días. En control de junio de 2025, clase funcional I, asintomático, con tratamiento de furosemida 10 mg diario. La resonancia mostró tubo de Rastelli permeable con insuficiencia grave, ventrículo izquierdo con función limítrofe (FEVI 55%), ventrículo derecho dilatado con función conservada, y doble sistema coronario descendente anterior con dominancia derecha. No requiere válvula pulmonar biológica y sigue control cardiológico semestral.
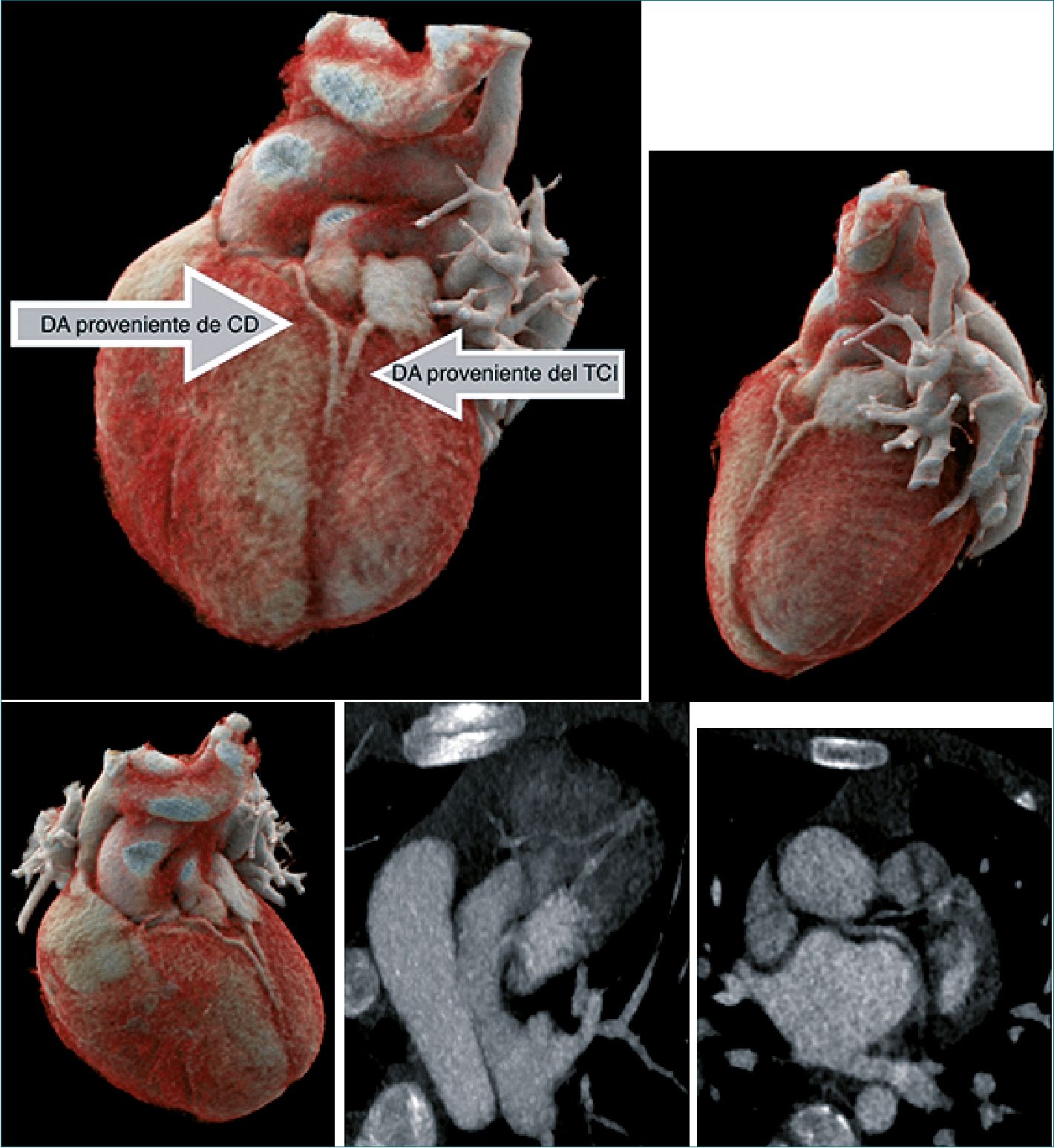
Figura 2. Imágenes: Reconstrucción en 3D de tomografía axial computarizada donde se evidencia el doble sistema de descendente anterior tipo IV según clasificación de Spindola-Franco así como corte transversal con medio de contraste.
-
Discusión
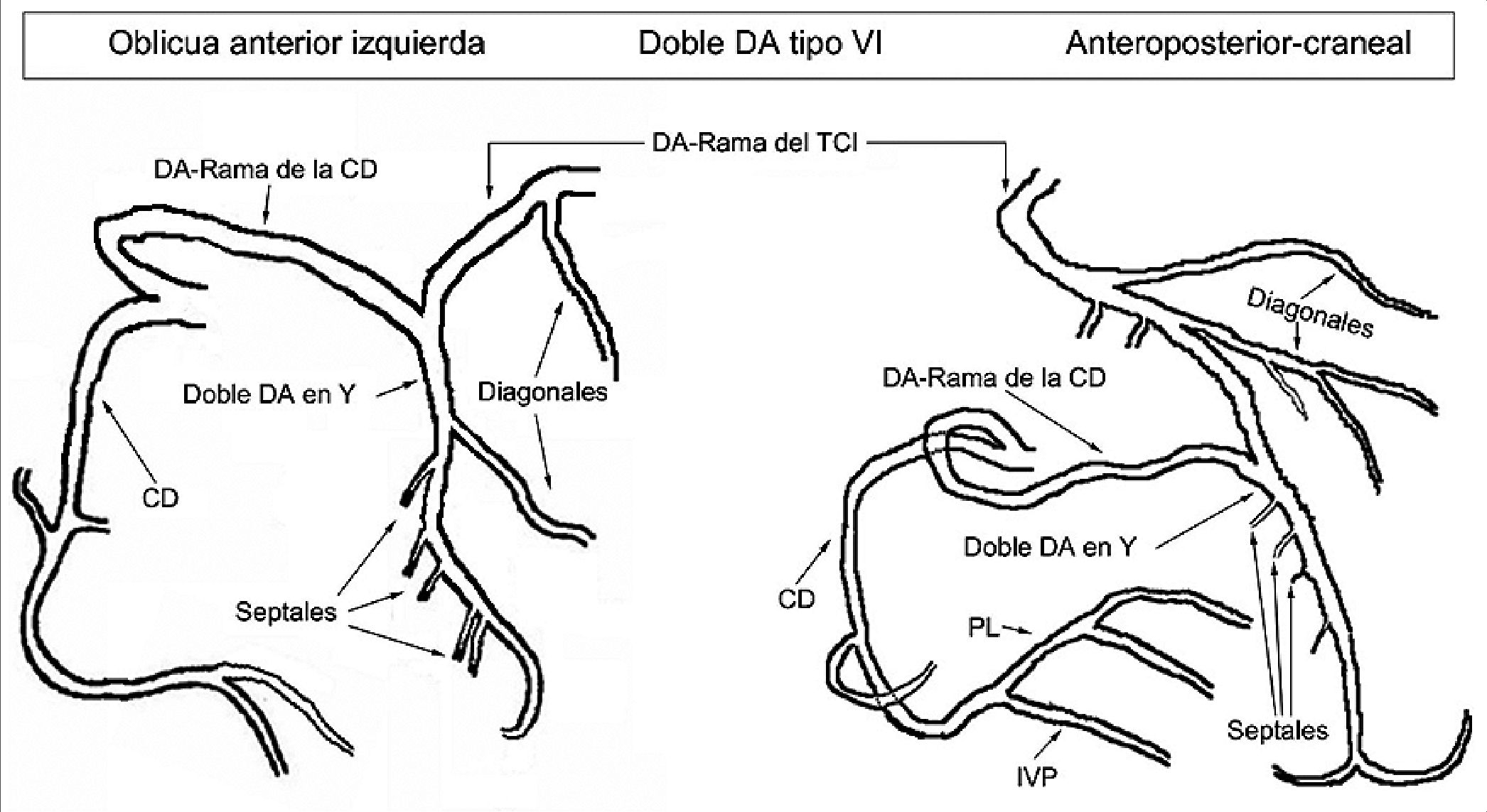
En la serie publicada por Spindola-Franco, la prevalencia de arteria descendente anterior doble es del 1% (23 casos en 2.140 personas). En 1983, este grupo describió cuatro tipos de doble arteria descendente anterior: en tres de ellos, la arteria se divide en una rama corta que irriga el tercio proximal del septum y una rama larga que discurre inicialmente por el surco interventricular. El tipo 1 pasa sobre el ventrículo izquierdo, el tipo 2 sobre el derecho, y el tipo 3 es intramiocárdico, llegando al ápex cardíaco. El tipo 4, el menos común, se caracteriza porque la arteria descendente anterior larga se origina en la arteria coronaria derecha en lugar del tronco coronario izquier- do[7],[8].
Las anomalías congénitas del origen coronario son poco frecuentes, con una incidencia estimada entre 0,64% y 1,3%, aunque algunos estudios sugieren hasta 5,6%. Dentro de estas, la arteria descendente anterior doble representa entre el 1,2% y 6,1%. El tipo IV, en particular, tiene una prevalencia extremadamente baja: 0,004% según Tuncer y entre 0,01% y 0,03% según Talanas. Aunque el 80% de estas variantes son clínicamente benignas, el 20% restante puede provocar síntomas. La relevancia clínica depende del trayecto de la arteria anómala; si pasa entre la raíz aórtica y el tracto de salida del ventrículo derecho, puede generar angina, síncope o muerte súbita durante el esfuerzo físico. La mayoría de estas anomalías se detectan incidentalmente mediante coronariografía, tomo- grafía o en autopsias, ya que no suelen presentar síntomas. Los trayectos retroaórticos o anteriores al infundíbulo derecho suelen considerarse benignos[9].
Ante el incremento en estudios por imágenes, se ha propuesto una nueva clasificación que agrupa los sistemas duales de la arteria descendente anterior en tres categorías. Sin embargo, la clasificación de Spindola-Franco sigue siendo la más utilizada y reconocida[10].
La tomografía computarizada ofrece una visualización más precisa del trayecto arterial que la angiografía coronaria tradicional, gracias a su capacidad para generar imágenes multiplanares[11].
-
Conclusiones
Históricamente, las anomalías coronarias se identificaban en angiografías o estudios post mortem. Sin embargo, el complejo árbol coronario tridimensional dificulta su evaluación solo con angiografía. Por ello, estudios como la ecocardiografía transesofágica, tomografía computarizada y resonancia magnética son cada vez más necesarios para definir con precisión la anatomía coronaria (Figura 3).
Aunque generalmente estas anomalías cursan de manera benigna y no se han descrito implicaciones anestésicas, es crucial que los centros de alta especialidad conozcan esta entidad y su clasificación para asegurar un manejo adecuado en pacientes con cardiopatías congénitas o adquiridas.
Figura 3. Representación esquemática de la variante anatómica tipo IV según Spindola- Franco. CD: coronaria derecha; DA: descendente anterior; IVP: interventricular posterior; PL: posterolateral; TCI: tronco coronario izquierdo.
El caso presentado es poco común, pues corresponde al tipo IV de Spindola-Franco, el menos frecuente. Además, el paciente tenía tetralogía de Fallot y fue sometido a cirugía de Rastelli con buena evolución posoperatoria. Es importante resaltar que esta anomalía suele diagnosticarse en adultos durante estudios angiográficos, por lo que es rara en pediatría.
-
Referencias
1. Gabriel F. Diaz Gongora Nestor Sandoval Reyes Juan Fernando Velez Moreno Gustavo Carrillo angel. Cardiologia Pediatrica. Herrera EA, editor. Nueva York, NY, Estados Unidos de América: McGraw-Hill; 2003.
2. Dran B Andropoulos Emad B. Mossad Erin A. Gottlieb. Anesthesia for congenital heart disease. Wiley J, editor. Hoboken, NJ, Estados Unidos de América: Wiley-Blackwell; 2023.
3. Dodge-Khatami A, Mavroudis C, Backer CL. Congenital heart surgery nomenclature and database project: anomalies of the coronary arteries. Ann Thorac Surg. 2000 Apr;69(4 Suppl):S270–97. https://doi.org/10.1016/S0003-4975(99)01248-5 PMID:10798435
4. Bastarrika Alemañ G, Alonso Burgos A, Azcárate Agüero PM, Castaño Rodríguez S, Pueyo Villoslada JC, Alegría Ezquerra E. Anatomía normal, variantes anatómicas y anomalías del origen y trayecto de las arterias coronarias por tomografía computarizada multicorte. Radiologia. 2008;50(3):197–206.
5. Rodríguez-Blanco S, Valdés-Recarey M, Leyva Quert AY. Arteria coronaria descendente anterior superdominante. Rev Esp Cardiol. 2017;70(11):1006.
6. Saxton A, Chaudhry R, Maná B. Anatomía, Tórax, Corazón, Arterias Coronarias Derechas. En: STAT PEARLS [Internet]. 2025. Disponible en:
7. Spindola-Franco H, Grose R, Solomon N. Doble arteria coronaria descendente anterior izquierda: descripción angiográfica de variantes importantes e implicaciones quirúrgicas. Am Heart J. 1983;105(3):445–55.
8. Flox Camacho A, Salguero Bodes R, Hernández Hernández F. Doble arteria descendente anterior tipo IV. Rev Esp Cardiol. 2003 Sep;56(9):915–915. Available from: https://www.revespcardiol.org/es-doble-arteria-descendente-anterior-tipo-articulo-13051619 https://doi.org/10.1157/13051619 PMID:14519279
9. Moreno-Martínez FL, Aladro-Miranda IF, Ibargollín-Hernández RS, Vega-Fleites LF, Nodarse-Valdivia JR, Lara-Pérez NR, et al. Angioplastía de circunfleja en paciente con doble arteria descendente anterior tipo IV. Propuesta para actualizar la clasificación de Spindola-Franco. Arco Cardiol Mex. 2012;82(4):297–302.
10. Jariwala P, Jadhav KP, Koduganti S. Doble arteria descendente anterior izquierda: criterios diagnósticos y nueva clasificación. Indian J Thorac Cardiovasc Surg. 2021;37(3):285–94. https://doi.org/10.1007/s12055-020-01102-z PMID:33967416
11. Agarwal PP, Kazerooni EA. Doble arteria coronaria descendente anterior izquierda: Hallazgos en la Tomografia Computarizada. AJR Am J Roentgenol. 2008;191(6):1698–701. https://doi.org/10.2214/AJR.08.1193 PMID:19020238
12. Tuncer C, Batyraliev T, Yilmaz R, Gokce M, Eryonucu B, Koroglu S. Origin and distribution anomalies of the left anterior descending artery in 70,850 adult patients: multicenter data collection. Catheter Cardiovasc Interv. 2006 Oct;68(4):574–85. https://doi.org/10.1002/ccd.20858 PMID:16969852

 ORCID
ORCID