Ricardo Bustamante B. 1
Rev Chil Anest Vol. 40 Núm. 1 pp. 41-51|doi:
PDF|ePub|RIS
Los bloqueadores neuromusculares no despolarizantes (BNMND), por tratarse de antagonistas competitivos de los receptores nicotínicos de la acetilcolina, generalmente deben ser revertidos al final de la cirugía o después de un período de ventilación mecánica, para prevenir el bloqueo residual.
Hasta ahora, los antagonistas usados habían sido inhibidores de la acetilcolinesterasa (neostigmina, piridostigmina y edrofonio), que revierten indirectamente el efecto de los BNMND impidiendo la destrucción de la acetilcolina y aumentando así su concentración en la unión neuromuscular 1 , 2 . La aparición de nuevos antagonistas del bloqueo neuromuscular, parece deseable.
Una serie de intentos han fracasado, como es el caso de la 4-aminopiridina, gelantamina, germina, y suramin, porque sus efectos colaterales o su efectividad en el antagonismo no han logrado desplazar a los clásicos anticolinesterásicos y eran inaceptables para su uso clínico rutinario 3 . La mayoría de ellos pretendía una inhibición más rápida y más efectiva de la colinesterasa, con excepción del suranim, un antagonista P2-purinoreceptor, y por lo tanto, producía similares efectos muscarínicos que los anticolinesterásicos en uso 4 ,5 .
El más reciente intento es una ciclodextrina, el sugammadex, desarrollado en Organon Laboratories por Anton Bon y colaboradores, ya incorporado en nuestro arsenal anestesiológico, y que revierte el efecto de los BNMND del grupo aminoesteroide, especialmente el rocuronio, en forma más rápida y sin los efectos secundarios de los anticolinesterásicos. De este modo, puede transformarse en la droga más atractiva, introducida en farmacología neuromuscular desde hace muchos años, no sólo por su gran eficacia, sino también por lo novedoso de su mecanismo de acción 6 , 7 .
Necesidad de nuevos antagonistas
Existen varias razones por las que pudieran necesitarse nuevos antagonistas de los bloqueadores neuromusculares (BNM):
-
Efectos colaterales de los anticolinesterásicos:
El aumento de la concentración de acetilcolina que causan los anticolinesterásicos no sólo se limita a la unión neuromuscular, sino que también genera una activación no selectiva de la neurotransmisión de todas las sinapsis (somáticas y autonómicas) en las que está involucrada en diferentes partes del organismo, dando origen a efectos secundarios que ocurren durante la reversión de los BNMND 8 .
La acumulación de acetilcolina en los receptores colinérgicos nicotínicos produce un desplazamiento competitivo del bloqueo de los BNMND, y en los receptores colinérgicos muscarínicos, algunos efectos farmacológicos que, dependiendo de la indicación de la administración de anticolinesterásicos, pueden ser considerados terapéuticos o no deseados. En el caso de la reversión farmacológica del bloqueo, los efectos nicotínicos de estos agentes son deseables para revertir el bloqueo neuromuscular, y sus efectos muscarínicos sobre los sistemas digestivo, respiratorio y cardiovascular pueden constituir un problema. Entre ellos destacan:
-
Sobre el corazón ocurre probablemente el efecto muscarínico más pronunciado: un efecto vagotónico que se traduce en bradicardia y otras bradiarritmias tales como escapes nodales y ventriculares e incluso asistolías 9 . También puede ocurrir una prolongación del intervalo QT, un evento del cual en estos tiempos hay mucha preocupación por parte de la FDA 10 .
-
A nivel del sistema digestivo, el efecto muscarínico de los anticolinesterásicos se manifiesta con un aumento de la secreción de jugo gástrico y de la motilidad de todo el tracto gastrointestinal, particularmente del intestino grueso. También se reportan dolores abdominales y diarrea que son enmascarados por la anestesia. Algunos autores han demostrado aumento de la incidencia de náuseas y vómitos postoperatorios, aunque la evidencia actual es insuficiente 11 ,12 .
-
Sobre el sistema respiratorio, el efecto muscarínico de los anticolinesterásicos se manifiesta con un aumento de las secreciones de las glándulas bronquiales. También pueden producir broncoconstricción por estimulación colinérgica 13 . El efecto neto de administrar anticolinesterásicos con anticolinérgicos sobre la resistencia de la vía aérea es impredecible, especialmente en pacientes con hiperreactividad bronquial.
-
Otras glándulas exocrinas, como lagrimales, salivales y sudoríparas, pueden manifestar también efecto muscarínico aumentando su secreción.
Estos efectos no deseables, hacen necesario el uso de antagonistas de los receptores muscarínicos como la atropina o el glicopirrolato. Éstos a su vez también pueden ocasionar efectos colaterales: taquicardia, visión borrosa, sequedad de mucosas, etc. La mezcla de anticolinesterásicos y anticolinérgicos puede afectar la conducción cardíaca y se ha reportado una serie de arritmias: inversión de onda P, bloqueo AV de segundo grado, extrasistolía auricular, ritmo nodal, disociación AV, extrasistolía ventricular.
El glicopirrolato, que produce menos taquicardia y disminuye significativamente la incidencia de arritmias tanto al ser usado con neostigmina, edrofonio o piridostigmina 14 , 15 , 16 , especialmente en pacientes cardiópatas 17 , nunca se ha introducido en Chile. Tampoco se ha comercializado el edrofonio, con menos efectos muscarínicos que otros anticolinesterásicos, probablemente por razones fármaco-económicas.
-
Efectos de los anticolinesterásicos sobre la unión neuromuscular:
Los anticolinesterásicos per se producen cierto grado de bloqueo neuromuscular si se administran a pacientes que se han recuperado en forma espontánea 18 , 19 . De este modo, si se ha producido una recuperación espontánea satisfactoria, hay poderosas razones para no administrar anticolinesterásicos en forma innecesaria.
La neostigmina y la piridostigmina pueden producir desensibilización de receptores nicotínicos postsinápticos previamente activados por acetilcolina 20 . Es posible que el exceso de acetilcolina en la unión neuromuscular, producido por la inhibición de la acetilcolinesterasa, cause desensibilización de los receptores postsinápticos 21 .
-
Incapacidad de los anticolinesterásicos de revertir bloqueos profundos:
Clínicamente, la eficacia y velocidad del antagonismo de los anticolinesterásicos depende principalmente de la profundidad del bloqueo a partir del que se efectúa la reversión 22 , 23 , 24 . Deben ser administrados cuando haya ocurrido por lo menos un 10% de recuperación del bloqueo (1 respuesta al tren de 4 estímulos [TOF]), aunque es más recomendable hacerlo con 2 a 3 respuestas al TOF. Cuando los antilcolinesterásicos son administrados en un nivel profundo de bloqueo, puede ocurrir una reversión inadecuada.
Con una dosis de 0,07 mg·kg-1 de neostigmina o de 1 mg·kg-1 de edrofonio ocurre un “efecto techo” por sobre el cual la reversión va a depender más de la recuperación espontánea de cada relajante (metabolismo y redistribución), que de la reversión farmacológica. Una vez que la inhibición de la acetilcolinesterasa se completa, la administración de más neostigmina no tiene ningún propósito 25 . Dosis mayores sólo incrementan los efectos no deseados. Esta es una gran limitación, pues por una parte existe una gran variabilidad en la respuesta a los BNMND y por otra, algunos procedimientos quirúrgicos requieren de un bloqueo profundo.
-
Interacción con los BNM:
El uso de succinilcolina después de haber realizado el antagonismo de un bloqueo no despolarizante, puede ocasionar una prolongación del bloqueo. El resultado del uso de un BNMND es incierto si se necesita relajación después de la reversión. En la medida en que exista un exceso de acetilcolina en la unión neuromuscular, ni los BNM despolarizantes ni los no despolarizantes funcionarán normalmente. Los anticolinesterásicos son inhibidores específicos de la colinesterasa plasmática, e indudablemente afectan la evolución del bloqueo por succinilcolina, dependiendo si es predominante el bloqueo en fase I o en fase II: en el primer caso prolongan significativamente la duración del bloqueo y en el segundo caso lo antagonizan 26 –27 .
-
Breve duración de acción de los anticolinesterásicos:
Una dosis adecuada de neostigmina, administrada en el momento adecuado (aparición de la segunda respuesta al TOF), produce su efecto máximo a los 7 minutos y tiene una duración de acción de sólo de 40 minutos 28 . Esto puede significar que en algunos pacientes ocurra una recurarización, especialmente cuando se usan BNM de larga duración, en que el efecto inhibidor de la colinesterasa puede durar menos que la redistribución, metabolismo y eliminación del bloqueador neuromuscular.
-
Gran incidencia de bloqueo residual:
Esta razón es probablemente la más importante y sólo por sí misma justifica plenamente la incorporación de nuevos agentes para revertir el bloqueo neuromuscular. La obstrucción de la vía aérea durante la recuperación de la anestesia es causada por los efectos residuales de los anestésicos generales o los analgésicos centrales, solos o en combinación con un cierto grado de bloqueo neuromuscular residual.
Basados en un estudio de Ali de 1971, realizado en menos de 2 docenas de pacientes, se determinó que el nivel de bloqueo óptimo que se correlaciona con una capacidad vital y una fuerza inspiratoria normales, signos compatibles con condiciones clínicas satisfactorias, era una relación T4/T1 > 0,70 (Figura 1) 29 . Este estándar no se cuestionó durante los siguientes 20 años.
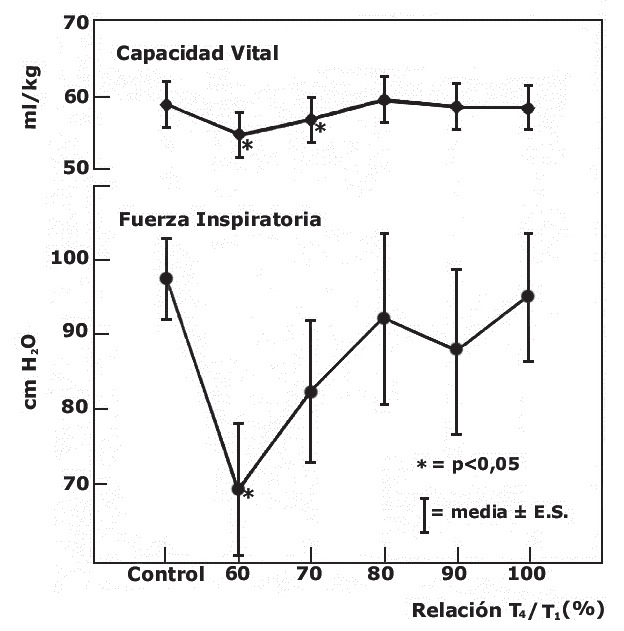
Figura 1 Correlación entre la relación T4/T1 con signos clínicos de recuperación. La capacidad vital (arriba) está significativamente disminuida (*) hasta con una relación T4/T1 del 70%. La fuerza inspiratoria (abajo) está significativamente disminuida hasta con una relación T4/T1 del 60%. Sólo una relación T4/T1 mayor de 70% es compatible con índices clínicos satisfactorios de recuperación.
En base a la evidencia actual, el nuevo estándar de recuperación es una relación T4/T1 = 0,9. Una serie de estudios han llevado a esta afirmación:
-
Hay evidencia que aún con bloqueos parciales mínimos (T4/T1 = 0,70), los BNM interfieren con el control hipóxico de la ventilación, reduciendo en un 30% la respuesta ventilatoria a la hipoxia. Parece ser que los BNM producen una depresión reversible de la actividad de los quimioreceptores de los cuerpos carotídeos 30 .
-
Relaciones T4/T1 < 0,90 se asocian a un deterioro funcional de los músculos de la faringe y la parte superior del esófago. El tono de reposo de la musculatura de la parte superior del esófago está significativamente disminuido y no se produce un buen acoplamiento en la coordinación requerida entre la relajación del esfínter esofágico superior y la contracción de la musculatura faríngea para el acto de la deglución, incluso con una relación T4/T1 = 0,8. De este modo, los sujetos con tan bajos niveles de bloqueo tienen dificultad para tragar y episodios de aspiración demostrados con medio de contraste, cuya incidencia aumenta con el aumento de nivel del bloqueo: 0,80 (8%), 0,70 (25%), 0,60 (33%) 31 .
-
Varios estudios en voluntarios despiertos demuestran que desde el punto de vista del paciente, una recuperación neuromuscular “satisfactoria”, ocurre sólo cuando el TOF es igual o mayor que 0,9 32 . Incluso los sujetos con una relación T4/T1 = 1 pueden tener diplopía y necesitan 45-90 min para que la sensación de visión alterada vuelva a la normalidad 33 .
A partir de las primeras publicaciones sobre bloqueo residual de Viby-Mogesen en 1979 34 , se creyó que se trataba de un problema relacionado con los bloqueadores neuromusculares de larga duración, pero después de la incorporación de los BNM de duración intermedia se publicó una serie de estudios que demostraban que aún existía una alta proporción de pacientes que tenían un bloqueo residual clínicamente significativo al llegar a la sala de recuperación, por lo que el asunto estaba lejos de estar resuelto.
Se ha reportado parálisis residual con todos los BNMND disponibles, incluso con mivacurio 35 , ya sea si se haya usado o no reversión con anticolinesterásicos, aunque indudablemente en grados diferentes. De este modo, el problema está tan relacionado con el tipo de agente utilizado, como con la falta de monitorización y la inadecuada reversión 36 .
La Tabla 1 resume los resultados de diversos estudios al utilizar distintos BNMND 37 – 50 . El bloqueo residual promedio es significativamente menor cuando se usan relajantes de duración intermedia (17,1%), que cuando se usan relajantes de larga duración (34,7%).
Tabla 1 Comparación de los resultados de diferentes publicaciones relacionadas con bloqueo neuromuscular residual en salas de recuperación de anestesia, entre relajantes de larga duración (d-tubocurarina, galamina, alcuronio y pancuronio), y relajantes de duración intermedia (atracurio, vecuronio y rocuronio): n = número de casos estudiados, % = porcentaje de pacientes con relación T4/T1 < 0,7 al TOF (excepto * = T4/T1 < 0,8 y ** = T4/T1 < 0,9)
| Autor |
Larga Duración |
Duración Intermedia |
||
|
n |
% |
n |
% |
|
| Viby-Mogensen (1979) |
72 |
42 |
||
| Lenmarken (1984) |
48 |
25 |
||
| Beemer (1986) |
100 |
21 |
||
| Anderson (1988) |
30 |
20 |
30 |
0 |
| Bevan (1988) |
47 |
36 |
103 |
6 |
| Howard-Hansen (1989) |
10 |
50 |
9 |
0 |
| Jensen (1990) |
159 |
39 |
329 |
2 |
| Brull (1991) |
29 |
48 |
24 |
8 |
| Berg (1997) |
226 |
26 |
450 |
24 |
| Baillard (2000) |
568 |
42 |
||
| Hayes (2001) |
148 |
52* |
||
| Kim (2002) |
477 |
22 |
||
| Debaene (2003) |
526 |
45** |
||
| Murphy (2004) |
35 |
40 |
34 |
2 |
| Baillard (2005) |
218 |
3** |
||
| Total |
756 |
34,7 |
2.916 |
17,1 |
En general, el impacto del bloqueo residual en el resultado final es difícil de evaluar y ha sido poco estudiado, sin embargo, una serie de trabajos sugieren fuertemente que esta prolongación del efecto de los bloqueadores neuromusculares puede alargar el período de recuperación, afectar adversamente la función respiratoria, empeorar los reflejos protectores de la vía aérea superior y ocasionar síntomas desagradables de debilidad muscular 51 . Resulta difícil relacionar el bloqueo residual con mortalidad postoperatoria por dificultades estadísticas y por la gran cantidad de variables implicadas.
Murphy en 2008, de un total de 7.459 sujetos estudiados, comparó 42 pacientes que evidenciaron un evento crítico en la sala de recuperación (hipoxia severa en un 52,4% y obstrucción de la vía aérea superior en un 35,7%), con un grupo control de características demográficas similares. La relación T4/T1 promedio fue de 0,62, con un 73,8% de los casos con una relación T4/T1 < 0,70, en tanto que en el grupo control fue de 0,98 (p < 0,001). Esto sugiere que una recuperación incompleta del bloqueo neuromuscular es un factor importante en el desarrollo de eventos adversos respiratorios en el postoperatorio inmediato 52 .
Un estudio escandinavo, diseñado para determinar el impacto del bloqueo residual sobre la incidencia de complicaciones pulmonares postoperatorias (neumonía y/o atelectasias), demostró que la incidencia de estos eventos en pacientes a los que se había administrado pancuronio era el triple en los pacientes que ingresan a la sala de recuperación con relaciones T4/T1 < 0,7 (16,9%), que los que ingresan con relaciones T4/T1 ≥ 0,7 (4,8%) 53 . La edad, la cirugía digestiva y la duración de la anestesia fueron también factores asociados independientes en ese estudio.
Se ha demostrado que la incidencia de hipoxemia en el postoperatorio está relacionada con el bloqueo residual y con la duración del BNMND utilizado: el 60% de los pacientes en que se usa pancuronio ingresan a la sala de recuperación con una relación T4/T1 < 0,7 hace episodios de hipoxemia, comparado con sólo el 10% de aquéllos en que se usa rocuronio 54 . Esta asociación entre bloqueo residual e hipoxemia postoperatoria también se ha demostrado en pacientes sometidos a cirugía ortopédica mayor 55 .
Teniendo en cuenta la relación entre bloqueo residual y morbilidad, la única forma de evitar este efecto es llegando al final de la operación con una recuperación espontánea o reversión farmacológica total: es decir, una relación T4/T1 > 0,9 medida en forma objetiva. En la actualidad todos los estudios que evalúan parálisis residual usan un T4/T1 ˂ 0,9 para definir recuperación incompleta.
La única forma de detectar niveles tan bajos de bloqueo neuromuscular es mediante el uso de monitores con sistema objetivo de medición, es decir, un monitor que mide y despliega en una pantalla el TOF a tiempo real. Un editorial de Anesthesiology hace 6 años afirma: “…la monitorización neuromuscular objetiva es una práctica basada en la evidencia y consecuentemente debe ser usada cada vez que se administra un BNM” 56 . En el mundo real, la verdad es que los anestesiólogos se han adaptado muy rápidamente a nuevas técnicas de monitorización (capnografía, oximetría, BIS), pero por causas desconocidas, siempre han limitado el uso de estimuladores de nervio periférico convencionales, y menos aún el uso de sistemas objetivos de medición. Un estudio reciente en el Reino Unido, encontró que el 62% de los anestesistas nunca usan ENP de ninguna clase, y menos de un 10% usan un monitor objetivo 57 . En países en que existe una escuela en relación a la monitorización del bloqueo neuromuscular como en Dinamarca 58 , el uso de monitores objetivos alcanza un 28% y en países en que no la hay como en México, probablemente más cercano a lo que se hace en nuestro país, es de sólo un 2% 59 .
El riesgo de bloqueo residual puede ser minimizado utilizando una metodología clínica que ha sido ampliamente aceptada por evidencia y brillantemente expuesta por Murphy en Minerva Anestesiológica 60 y en Anesthesia and Analgesia 61 ,62 :
-
Evitar el uso de BNMND de larga duración: puede ocurrir bloqueo residual con cualquier BNMND pero varios estudios demuestran que es 3-4 veces más frecuente con los de larga duración. De hecho, este tipo de agente es cada vez menos usado, a menos que se anticipe una ventilación mecánica en el postoperatorio. El resultado es que en muchos países el pipecuronio nunca se comercializó y el pancuronio (como ocurre actualmente en Chile), ha dejado de distribuirse.
-
Uso rutinario de monitorización de la función neuromuscular en el pabellón: la incidencia y magnitud del bloqueo residual pueden disminuir si se usa DBS al final de la operación. Sólo un 24% de los pacientes a los que se les ha efectuado DBS llegan con un TOF objetivo < 0,7 a la sala de recuperación, comparado con un 57% en los que no se ha efectuado 63 . Sin embargo, el DBS tiene una sensibilidad (probabilidad para que el DBS sea asimétrico en los pacientes que tienen un T4/T1 = 0,9) de sólo un 29%. Su valor predictivo negativo (posibilidad de que no haya bloqueo residual cuando el DBS es simétrico) es de un 29% y su valor predictivo positivo (posibilidad que el paciente tenga un T4/T1 < 0,9, cuando el DBS es asimétrico) es cercano al 100%; es decir 71% de falsos negativos, y casi 0% de falsos positivos.
-
Uso de aceleromiografía durante la cirugía y previo a la extubación: la medición objetiva del TOF puede atenuar la severidad del bloqueo residual, pues es más sensible que la monitorización estándar, pero no logra abolirlo completamente. Sin embargo, un meta-análisis efectuado por Naguib en 24 estudios, que incluían a 3.375 pacientes, concluyó que la incidencia de bloqueo residual es significativamente menor con los BNMND de duración intermedia que los de larga duración, pero no logró demostrar que el uso de monitorización neuromuscular intraoperatoria disminuyera su incidencia 64 .
-
Evitar la abolición total de la respuesta al TOF: si el TOF se mantiene sin respuesta durante la cirugía hay mayores posibilidades que a su término la recuperación espontánea no se haya iniciado lo suficiente para iniciar la reversión farmacológica. Pocas cirugías requieren una relajación total y se logra habitualmente una relajación adecuada para cirugía abdominal con 1-2 respuestas presentes al TOF.
-
Reversión rutinaria de los BNM: la reversión farmacológica con anticolinesterásicos no está exenta de riesgos y la reversión rutinaria no es garantía de éxito, pero a pesar de todo, es recomendable revertir los efectos de los BNND, a menos que se haya demostrado una relación T4/T1 > 0,9 con aceleromiografía. Se ha estudiado los efectos de la reversión del bloqueo sobre la morbimortalidad postoperatoria, demostrándose que la reversión del bloqueo al final de la cirugía, disminuye el riesgo de mortalidad y coma en las primeras 24 horas del postoperatorio 65 . Es lógico pensar que la reversión rutinaria es aún más recomendable si se usa una droga con menos efectos colaterales demostrados hasta el momento, como el sugammadex.
-
Reversión a partir de 2 o 3 respuestas al TOF: el tiempo requerido hasta la recuperación total depende del grado de recuperación espontánea cuando se administran anticolinesterásicos. Con el sugammadex puede lograrse recuperación a partir de un bloqueo profundo, pero las dosis son diferentes.
-
Antagonismo precoz: el antagonismo de los BNND debe iniciarse cuando no se necesita más relajación, no cuando haya concluido el cierre de la piel. Incluso cuando se ha administrado neostigmina con 4 estímulos al TOF y cierto grado de fatiga al final de la cirugía, hasta la tercera parte de los pacientes no alcanzan una relación T4/T1 = 0,9 hasta 20 minutos después 66 .
Indudablemente que con la introducción del sugammadex, una serie de estas recomendaciones pierden vigencia, pero siguen siendo buenas prácticas clínicas.
¿Qué son las ciclodextrinas?
Uno de los tópicos más atractivos del desarrollo del sugammadex fue el aspecto químico: el diseño de una molécula que actuara encapsulando al BNMND, partiendo de la hipótesis que esta secuestración del BNMND en el plasma, produciría su salida desde el sitio efector, dando como resultado la reversión del bloqueo.
Para demostrar esta hipótesis se seleccionó un grupo de oligosacáridos cíclicos derivados del almidón: las ciclodextrinas, que se encuentran en forma natural dondequiera que haya fuentes de almidón. Para poder encapsular a la molécula de bloqueador neuromuscular (en principio rocuronio), estas moléculas debían tener algunas características especiales: una cavidad interna lipofílica bien definida, un exterior hidrofílico, una alta solubilidad en agua y, una buena tolerancia biológica (se han usado como vehículos de una serie de productos usados en anestesia, como propofol, etomidato, sufentanil, piroxican, bupivacaína espinal y midazolam nasal) 67 – 73 .
Las ciclodextrinas forman parte de una familia de oligosacáridos cíclicos compuestas por unidades α-D-glucopiranósido, unidas por enlaces α 1→4 dispuestas en forma circular. Las más comunes se denominan α-, β- y γ-ciclodextrinas que contienen 6, 7 y 8 unidades de glucosa respectivamente, sin embargo, las cavidades lipofílicas de menor diámetro de las ciclodextrinas α y β (menos de 6,5 Å) (Figura 2: izquierda y centro), son menos afines con la voluminosa molécula de rocuronio que las γ-ciclodextrinas (7,5 – 8,3 Å) (Figura 2: derecha) 74 .
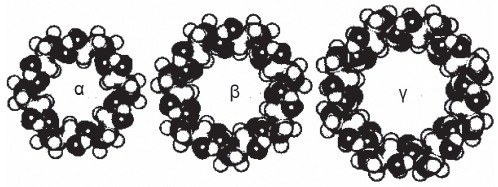
Figura 2 α-ciclodextrina, β-ciclodextrina (menos de 6,5 Å, izquierda y centro), y γ-ciclodextrinas (7,5 – 8,3 Å) (derecha).
Para llegar a la mejor afinidad anfitrión-huésped se adoptaron dos estrategias con la molécula inicial de γ-ciclodextrina 75 :
-
Aumentar la profundidad de la cavidad de la γ-ciclodextrina, con el fin de lograr una encapsulación completa de los 4 anillos de la molécula de esteroide.
-
Introducir grupos aniónicos funcionales (carboxilos) en el interior de la cavidad, de tal modo que estos grupos cargados negativamente, proporcionen interacción electrostática con los átomos de nitrógeno cargados positivamente de los aminoesteroides, y mantengan la alta solubilidad en agua de las γ-ciclodextrinas.
Así, se logró modificar la molécula añadiendo 8 cadenas laterales para agrandar la profundidad de la cavidad lipofílica de 2 a 3 átomos de carbono, aumentando 30 veces la potencia de reversión in vitro y más de 100 veces in vivo. Se llegó así a la molécula definitiva, primitivamente llamado Org 25969, y posteriormente sugammadex (refiriéndose a su de sugar y gammadex, la molécula estructural de γ-ciclodextrina), un compuesto altamente soluble, de mejor actividad, que logra una reversión del bloqueo más rápidamente que la neostigmina, y a partir de un bloqueo más profundo (Figura 3).
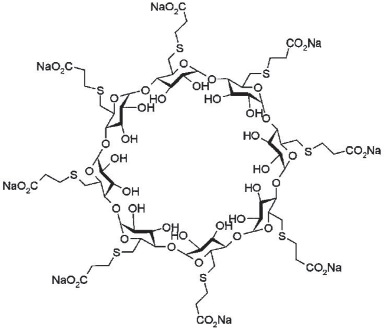
Figura 3 Molécula de Sugammadex: compuesta por 8 moléculas de azúcar dispuestas en anillo, C72 H112 O48 S8, peso molecular 1279 daltones, correspondiente al derivado Ciclooctakis-(1→4)-[6-S-(2-carboxietil)-6-thio-α-D-glucopiranósido].
El aumento de profundidad del anillo de la γ-ciclodextrina, le dio la forma tridimensional de cono hueco truncado, con una abertura más amplia llamada cara secundaria y una más estrecha llamada cara primaria, que conjuntamente forman una estructura geométrica llamada toroide (Figura 4). Los grupos hidroxilos cargados negativamente se alinean en ambas caras y son responsables de la gran solubilidad en agua de las ciclodextrinas. Los átomos de carbono, conjuntamente con los enlaces α 1→4 se distribuyen en el interior de la molécula y son responsables de crear una cavidad lipofílica (Figura 4).
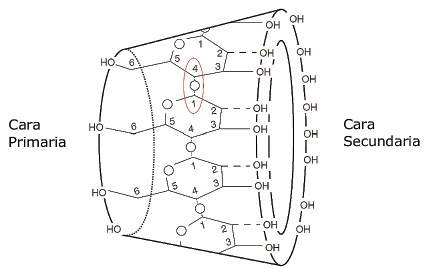
Figura 4 Disposición de grupos hidroxilo en la cara primaria y secundaria, y de las unidades α-D-glucopiranósido con los enlaces α 1→4 (señalados en color rojo) hacia el interior del toroide que conforma la molécula de sugammadex.
Al tener una cavidad lipofílica central, las ciclodextrinas son capaces de encapsular moléculas huéspedes lipofílicas de un tamaño adecuado, como los aminoesteroides, uno de los dos grupos químicos existentes de BNMND, y formar complejos 1:1 anfitrión-huésped. Este antagonismo químico de neutralización se denomina quelación, complejación o encapsulación (Figura 5). La estabilidad del complejo sugammadex-rocuronio es el resultado final de una interacción de fuerzas intermoleculares (de van der Waals), que incluyen además interacciones termodinámicas (enlaces de hidrógeno) e hidrofóbicas.
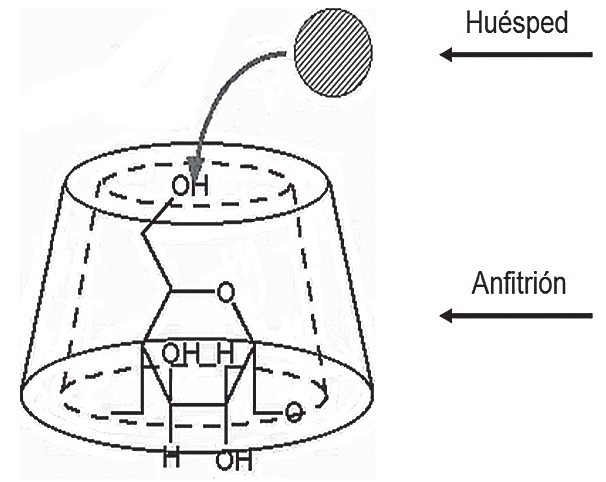
Figura 5 Formación del complejo anfitrión (sugammadex)-huésped (rocuronio). El orificio central de la molécula cilíndrica de γ-ciclodextrina, acoge al aminoesteoide por razones de tamaño de la cavidad lipofílica y por fuerzas electrostáticas generadas por los grupos carboxilo en los bordes del cilindro, que interactúan con el nitrógeno cuaternario del rocuronio.
El sugammadex forma complejos de unión muy firmes con el rocuronio, existentes en equilibrio con una constante de asociación muy alta (K a de alrededor de 25 megaM-1: constante matemática que describe la afinidad de unión de 2 moléculas en estado de equilibrio) y un grado de disociación muy bajo. De hecho, se trata de uno de los complejos anfitrión-huésped más estables reportados en la literatura 76 . Se estima que por cada 25 millones de complejo sugammadex-rocuronio que se forman, sólo uno se disocia.
Con una nueva tecnología de cristalografía de rayos X, es posible apreciar la molécula de sugammadex, encapsulando a una molécula de rocuronio, desde el plano lateral y el plano axial 6 (Figura 6).
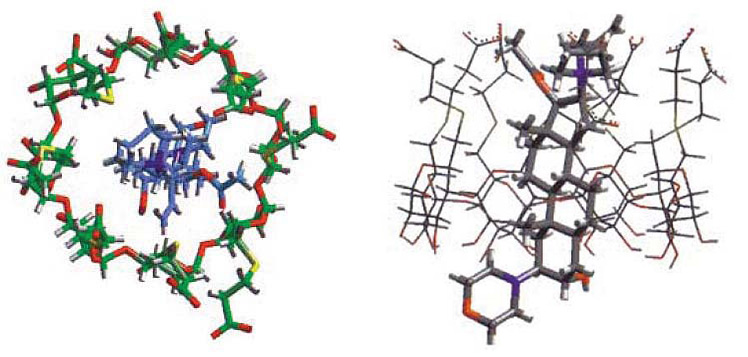
Figura 6 Estructura cristalográfica del sugammadex: plano lateral (izquierda), plano axial (derecha) 6 .
Mecanismo de Acción
El sugammadex actúa directa y selectivamente sobre el relajante muscular, por lo que es el primer SRBA (selective relaxant binding agent), disminuyendo la concentración plasmática de BNMND aminoesteroide libre. No actúa como los antagonistas conocidos hasta la fecha (anticolinesterásicos), que lo hacen indirectamente, aumentando la vida media de la acetilcolina en la unión neuromuscular. Lo más novedoso es que todo este proceso ocurre en el plasma y no en la unión neuromuscular como en el caso de los anticolinesterásicos.
El sugammadex ejerce su efecto formando complejos anfitrión-huésped a una relación 1:1 con la molécula de BNMND aminoesteroide, con una mayor afinidad por el rocuronio, una afinidad intermedia por el vecuronio y una menor afinidad por el pancuronio.
La administración endovenosa de sugammadex produce una rápida remoción de las moléculas libres de BNMND aminoesteroide en el plasma, creando una gradiente de concentración que favorece la salida de las moléculas de BNMND aminoesteroide que están en la unión neuromuscular hacia el plasma, donde son inmediatamente encapsuladas por moléculas de sugammadex libre. El sugammadex también entra a los tejidos y forma complejos con el rocuronio.
La rápida disminución de la concentración de BNMND libre en el plasma, lleva a valores inferiores el umbral necesario para conseguir una ocupación efectiva de receptores. El resultado es una rápida restauración de la función neuromuscular sin alterar de ninguna forma la homeostasis de la acetilcolina, evitándose de esta forma los efectos colaterales de los anticolinesterásicos derivados del aumento de acetilcolina en otras terminaciones nerviosas.
Aunque la concentración total de rocuronio (libre + unido a sugammadex) aumenta en el plasma 77 , el efecto final es una reversión rápida y eficiente del bloqueo neuromuscular de los BNMND del grupo aminoesteroide, más rápida para el rocuronio, un poco menos para el vecuronio y bastante menos para el pancuronio.
Conclusiones
Hay suficientes razones que hacen necesario nuevos agentes para revertir el bloqueo neuromuscular. Los altos índices de bloqueo residual, casi siempre inadvertidos, se han relacionado con patología pulmonar y eventos durante el postoperatorio, que de por sí justifican la inclusión de nuevos agentes, y especialmente el sugammadex, que hasta el momento ha demostrado un gran margen de seguridad. Sin embargo, además de un nuevo agente, en la medida que el costo/beneficio no justifique su uso rutinario, existe una serie de estrategias destinadas a prevenir el bloqueo residual. La más obvia parece ser el abandono definitivo de los BNMND de larga duración.
La monitorización rutinaria del BNM por sí sola no basta para prevenir el bloqueo residual, pero si a ello se agrega el uso racional de los modelos de estimulación y evitar el bloqueo profundo por sobredosis, la incidencia de esta complicación será mínima.
Mediante un mecanismo de selección prolijo y atractivo, se ha llegado a una ciclodextrina ideal para la reversión de los BNMND del grupo aminoesteroide: el sugammadex. Su mecanismo de acción es diferente y novedoso: la quelación de la molécula de rocuronio o vecuronio. Un mecanismo al que los anestesiólogos no estamos acostumbrados. Casi siempre se había intentado desarrollar compuestos tratando de mejorar la eficacia de los anticolinesterásicos (para aumentar indirectamente la concentración de acetilcolina); nunca hubiéramos pensado hace sólo 10 años atrás que la quelación sería una forma de antagonizar el bloqueo neuromuscular.
REFERENCIAS
- Taylor P. Anticholinesterase Agents. En Goodman and Gilman: The pharmacological basis of therapeutics. Hardman JG, Limbird LE (Ed). Novena Edición. McGraw-Hill Inc, Nueva York 1996; 161.
- Mirakur RK, McCarthy GJ. Basic pharmacology of reversal agents. En Anesthesiology Clinics of North America: Advances in the use of muscle relaxants. Partridge BL (Ed). W.B. Saunders Co. Filadelfia 1993, 11: 237.
- Soni N, Kam P. 4-aminopyridine, a review. Anaesth Int Care 1982; 10: 120-126.
- Henning RH, Nelemans A, Houwertjes M, Agoston S. Reversal by suramin of neuromuscular block produced by pancuronium in the anaesthetized rat. Br J Pharmacol 1993; 108: 717-720.
- Kaur M, Reed E, Sartor O, et al. Suramin’s development: what did we learn? Invest New Drugs 2002; 20: 209-219.
- Bom A, Bradley M, Cameron K, et al. A Novel Concept of Reversing Neuromuscular Block: Chemical Encapsulation of Rocuronium Bromide by a Cuclodextrin-Based Synthetic Host. Angew Chem Int 2002; 41: 266-269.
- Adam J, Nennett J, Bom A, et al. Ciclodextrin-Derived Host Molecules as Reversal Agents for de Neuromuscular Blocker Rocuronium Bromide: Synthesis and Structure-Activity Relationship.
- Bustamante R. Antagonistas de los Bloqueadores Neuromusculares. Rev Chil Anest 2004: 33: 175-198.
- Gottlieb JB, Sweet RB. The antagonism of curare: the cardiac effects of atropine and neostigmine. Can Anaesth Soc J 1963; 10: 114-121.
- Shields JA. Heart Block and prolonged Q-Tc interval following muscle relaxant reversal: a case report. AANA J 2008; 76: 41-45.
- Tramer M, Fushs-Buder T. Omitting antagonism of neuromuscular block: effect on postoperative nausea and vomiting and risk of residual paralysis. A systematic review. Br J Anaesth 1999; 82: 379-386.
- King MJ, Milazkiewics R, Carli F, Deacock AR. Influence of neostigmine on postoperative vomiting. Br J Anaesth 1988; 61: 403-406.
- Pratt CI. Bronchospasm after neostigmine. Anaesthesia 1988; 43: 248.
- Ramamurthy S, Shaker MH, Winnie AP. Glycopyrrolate as a substitute for atropine in neostigmine reversal of muscle relaxant drugs. Can J Anaesth 1972; 19: 399-411.
- Cozanitis DA, Dundee JW, Merrett JD, et al. Evaluation of glycopyrrolate and atropine as adjuncts to reversal of non-depolarizing neuromuscular blocking agents in a “true-to-life” situation. Br J Anaesth 1989; 52: 85-89.
- McCubbin TD, Brown JH, Dewar KMS, et al. Glycopyrrolate as a premedicant: Comparison with atropine. Br J Anaesth 1979; 51: 885-889.
- Klingenmaier CH, Bullard R, Thompson D, Watson R. Reversal of neuromuscular blockade with a mixture of neostigmine and glycopirrolate. Anesth Analg 1972; 51: 468-472.
- Payne JP, Hughes R, Azawi SAl. Neuromuscular blockade by neostigmine in anaesthetized man. Br J Anaesth 1980; 52:69.
- Caldwell JE. Reversal of residual neuromuscular block with neostigmine at one to four hours after a single intubating dose of vecuronium. Anesth Analg 1995; 80: 1168-1174.
- Sherby ShM, Eldefrawi AT, Albuquerque EX, Eldefrawi ME. Comparison of the actions of carbamate anticholinesterases on the nicotinic acetylcholine receptor. Mol Pharmacol 1985; 27: 343.
- Stoelting RK. Anticholinesterase Drugs and Cholinergic Agonist. En Pharmacology & Physiology in Anesthetic Practice. Stoelting RK (Ed). Tercera Edición. Lippincott-Raven, Filadelfia 1999; 224.
- Rupp SM, McChristian JW, Miller RD, et al. Neostigmine and edrophonium antagonism of varying intensity neuromuscular blockade induced by atracurium, pancuronium or vecuronium. Anesthesiology 1986; 64: 711-717.
- Kopman AF. Recovery times following edrophonium and neostigmine reversal of pancuronium, atracurium and vecuronium steady-state infusions. Anesthesiology 1986; 65: 572-578.
- Engbaek J, Ostergaard D, Skovgaard LT, Vivy-Mogensen J. Reversal of intense neuromuscular blockade following infusion of atracurium. Anesthesiology 1990; 72: 803-806.
- Bevan DR, Donati F, Kopman AF. Reversal of neuromuscular blockade. Anesthesiology 1992; 77: 785.
- Churchill-Davidson HC, Christie TH, Wise RP. Dual neuromuscular block in man. Anesthesiology 1960; 21: 144.
- Katz RL Wolff CC, Papper EM. The non-depolarizing neuromuscular blocking action of suxamethonium in man. Anesthesiology 1963; 24: 784.
- Miller RD, Van Nyhuis LS, Eger EI, et al. Comparative times to peak effect and duration of action of neostigmine and pyridostigmine. Anesthesiology 1974; 41: 27.
- Ali HH, Wilson RS, Savarese JJ, Kitz RJ. The effect of tubocurarina on indirectly elicited train-of-four muscle response and respiratory measurements in humans. Br J Anaesth 1975; 47: 570.
- Eriksson L. Reduced hypoxic chemosensitivity in partially paralyzed man. A new property of muscle relaxants. Acta Anaesthesiol Scand 1996; 40: 520-523.
- Sandman E, Witt H, Olsson R, et al. The incidence and mechanism of pharyngeal and upper esophageal dysfunction in partially paralyzed humans. Anesthesiology 2000; 92: 977-984.
- Kopman AF. Neuromuscular monitoring: Old issues, new controversies. J Critic Care 2009; 24: 11-20.
- El Mikatti N, Wilson A, Pollard BJ. Pulmonary function and head lift during spontaneous recovery from pipecuronium neuromuscular block. Br J Anaesth 1995; 74: 16-19.
- Viby-Mogensen J, Jorgensen BC, Ording H. Residual curarization in the recovery room. Anesthesiology 1979; 59: 539-541.
- Cammu G, De Witte J, De Veylder J, et al. Postoperative residual paralysys in outpatients versus inpatients. Anest Analg 2006; 102: 426-429.
- Viby-Mogensen J. Postoperative residual curarization and evidence-based anaesthesia. Br J Anaesth 2000; 84: 301-303.
- Lennmarken C, Löfström JB. Partial curarization in the post-operative period. Acta Anaesthesiol Scand 1984; 28: 260-262.
- Beemer GH, Rozental P. Postoperative neuromuscular function. Anaesth Intensive Care 1986; 14: 41-45.
- Anderson BN, Madsen JV, Schurizek BA, Juhl B. Residual curarization: A comparative study of atracurium and pancuronium. Acta Anaesthesiol Scand 1988; 32: 79-81.
- Bevan DR, Smith CE, Donati F. Postoperative neuromuscular blockade: A comparison between atracurium, vecuronium and pancuronium. Anesthesiology 1988; 69: 272-276.
- Howard-Hansen P, Rasmussen JA, Jensen BN. Residual curarization in the recovery room: Atracurium versus gallamine. Acta Anaesth Scand 1989; 33: 167-169.
- Jensen E, Engbaeck J, Anderson BN. The frequency of residual neuromuscular blockade following atracurium (A), vecuronium (V), and pancuronium (P): A multicenter randomized study. Anesthesiology 1990; 73: A914.
- Brull SJ, Ehrenwerth J, Cronnelly R, Silverman DG. Assesment of residual curarization using low-current stimulation. Can J Anaesth 1991; 38: 164-168.
- Berg H, Viby-Mogensen J, Roed J, et al. Residual neuromuscular block is a risk factor for postoperative pulmonary complications. Acta Anaesthesiol Scand 1997; 41: 1095-1103.
- Baillard C, Gehan G, Reboul-Marty, et al. Residual curarization in the recovery room after vecuronium. Br J Anaesth 2000; 84: 394-395.
- Hayes AH, Mirakhur RK, Breslin DS, et al. Postoperative residual block after intermediate-acting neuromuscular blocking drugs. Anaesthesia 2001; 56: 312-318.
- Kim KS, Lew SH, Cho HY, Cheong MA. Residual paralysis induced by either vecuronium or rocuronium after reversal with pyridostigmine. Anesth Analg 2002; 95: 1656-1660.
- Debaene B, Plaud B, Dilly MP, Donati F. Residual paralysis in the PACU after a single intubating dose of non-depolarizing muscle relaxant with an intermediate duration of action. Anesthesiology 2003; 98; 1042-1048.
- Murphy GS, Szokol JW, Franklin M, et al. Postanesthesia care unit recovery times and neuromuscular blocking drugs: a prospective study of orthopedic surgical patients randomized to receive pancuronium or rocuronium. Anesth Analg 2004; 98: 193-200.
- Baillard C, Clec’h C, Catineau J, et al. Postoperative residual neuromuscular block: a survey of management. Br J Anaesth 2005; 95: 622-626.
- Bevan DR. Recovery from neuromuscular block and its assessment. Anesth Analg 2000; 90: S7-S13.
- Murphy GS, Szokol JW, Marymont JH, et al. Intraoperative acceleromyographic monitoring reduces the risk of residual neuromuscular blockade and adverse respiratory events in the postanesthesia care unit. Anesthesiology 2008; 109: 389-398.
- Berg H, Viby-Mogensen J, Roed J, et al. Residual neuromuscular block is a risk factor for postoperative pulmonary complications. A prospective, randomized, and blinded study of postoperative pulmonary complications after atracurium, vecuronium, and pancurinium. Acta Anaesthesiol Scand 1997; 41: 1095-1103.
- Bissinger U, Schimeck F, Lenz G. postoperative residual paralysis and respiratory status: A comparative study of pancuronium and Vecuronium. Phisiol Res 2000; 49: 455-462.
- Murphy GS, Szokol JW, Franklin M, et al. Postanesthesia care unit recovery times and neuromuscular blocking drugs: a prospective study of orthopedic surgical patients randomized to receive pancuronium or rocuronium. Anesth Analg 2004; 98: 193-200.
- Eriksson LI. Evidence-based practice and neuromuscular monitoring: it’s time for routine quantitative assessment. Anesthesiology 2003; 98: 1037-1039.
- Grayling M, Sweeney BP. Recovery from neuromuscular: a survey of practice. Anaesthesia 2007; 62: 806-809.
- Sorgenfrei IF, Viby-Mogensen J, Swiatek FA. Does evidence lead to a change in clinical practice? Danish anaesthetits’ and nurse anaesthetits’ clinical practice anf knowledge of postoperative residual curarization. Ugeskr Laeger 2005; 167: 3878-3882.
- Neva Ocampo AA. Preferences of Mexican anesthesiologists for vecuronium, rocuronium and other neuromuscular blocking agents: a survey BMC. Anesthesiology 2002; 2: 2.
- Murphy GS: Residual neuromuscular blockade: incidence, assessment, and relevance in the postoperative period. Minerva Anestesiol 2006; 72: 97-109.
- Murphy GS, Brull SJ. Residual neuromuscular block: lessons unlearned. Part I: definitions, incidence, and adverse physiologic effects of residual neuromuscular block. Anesth Analg 2010: 111: 120-128.
- Brull SJ, Murphy GS. Residual neuromuscular block: lessons unlearned. Part II: methods to reduce the risk of residual weakness. Anesth Analg 2010; 111: 129-140.
- Fruergaard K, Viby-Mogensen J, Berg H, El-Mahdy AM. Tactile evaluation of the response to double burst stimulation decreases, but does not eliminate, the problem of postoperative residual paralysis. Acta Anaesthesiol Scand 1998; 42: 1168-1174.
- Naguib M, Kopman AF, Ensor JE. Neuromuscular monitoring and postoperative residual curarization: a meta-analysis. Br J Anaesth 2007; 98: 302-316.
- Arbous MS, Meursing AE, van Kleef JW, et al. Impact of anesthesia management characteristics on severe morbidity and mortality. Anesthesiology 2005; 102: 257-268.
- Murphy GS, Szokol JW, Marymont JH, et al. Residual paralysis at the time of tracheal extubation. Anesth Analg 2005; 100: 1840-1845.
- Davis ME, Brewster ME. Cyclodextrin-based pharmaceutics: past, present and future. Nat Rev Drug Discov 2004; 3: 1023-1035.
- Munro IC, Newberne PM, Young VR, Bar A. Safety assessment of -cyclodextrin. Regul Toxical Pharmacol 2004; 39: 3-13.
- Egan TD, Kern SE, Johnson KB, Pace NL. The pharmacokinetics and pharmacodynamics of propofol in a modified cyclodextrin formulation (Captisol) versus propofol in a lipid formulation (Diprivan): an electroencephalographic and hemodynamic study in a porcine model. Anesth Analg 2003; 97: 72-79.
- Baker MT, Naguib M. Propofol: the challenges of formulation. Anesthesiology 2005; 103: 860 -876.
- Gudmundsdottir H, Sigurjonsdottir JF, Masson M, et al. Intranasal administration of midazolam in a cyclodextrin based formulation: bioavailability and clinical evaluation in humans. Pharmazie 2001; 56: 963- 966.
- Estebe JP, Ecoffey C, Dollo G, et al. Bupivacaine pharmacokinetics and motor blockade following epidural administration of the bupivacaine-sulphobutylether 7-beta-cyclodextrin complex in sheep. Eur J Anaesthesiol 2002; 19: 308-310.
- Meert TF, Mesens J, Verheyen P, Noorduin H. Hydroxypropyl-beta-cyclodextrin can modulate the activity of spinally administered sufentanil. Eur J Anaesthesiol 1992; 9: 399-409.
- Szejtli J. Past, Present and future of cyclodextrin research. Pure Appl Chem 2004; 76: 1825-1845.
- Szente J, Szejtli J. High solubles ciclodextrin derivates: chemistry, properties and trends in developement. Adv Drug Deliv Rev 1999; 36: 17-28.
- Zhang MQ, Rees DC. A review of recent applications of cyclodextrins for drug discovery. Expert Opin Ther Pat 1999; 9: 1697-1717.
- Epemolu O, Bom A, Hope F, Mason R. Reversal of neuromuscular blockade and simultaneous increase in plasma rocuronium concentration after the intravenous infusion of the novel reversal agent Org 25969. Anesthesiology 2003: 99: 632-637.
