Ricardo Bustamante Bozzo 1
Recibido: 15-11-2020
Aceptado: 17-11-2020
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 1 pp. 27-55|https://doi.org/10.25237/revchilanestv50n01-04
PDF|ePub|RIS
Anaphilactic shock and anaphilaxis
Abstract
Anaphylaxis is a life-threatening clinical condition that results from the activation of mast cells/basophils, inflammatory pathways, or both. It can be specific (allergic), or non-specific (non-allergic). Most anaphylaxis are mediated by IgE, but there are also some mediated by IgM and complement activation. Incidence is about 1:10,000 anesthesia. Recent studies show that the drugs or substances mostly implicated in producing perioperative anaphylaxis are: neuromuscular blockers (60.6%), antibiotics (18.2%), patent blue dye (5.4%) and latex (5.2%). However, all drugs and substances used during anesthesia and surgery, perhaps with the sole exception of inhalation agents and crystalloids, have been reported as potentially causes of anaphylaxis. The clinical presentation is multisystemic, producing signs and symptoms mainly on skin, respiratory, cardiovascular, gastrointestinal and central nervous systems. In its advanced phase, it may evolve to anaphylactic shock, causing tissue hypoperfusion and leading to altered cell integrity and multiple organ failure, associated with high mortality. Diagnosis is based on clinical presentation (history and clinical manifestations), biological evidence (serum tryptase levels, serum histamine levels and search for specific IgE) and allergological evidence (skin tests, provocation test, mediator release tests and tests of activation of basophils). Treatment include 3 stages: general measures, first-line or primary treatment and second-line or secondary treatment. General measures consist of: Trendelenburg position, invasive monitoring (according to the severity of the clinical presentation), 100% oxygen administration, discontinuation of drugs and/or suspected agents and asking for help. The primary treatment is epinephrine in doses proportional to the clinical manifestations, airway support, 100% oxygen and aggressive resuscitation with intravenous fluids. Secondary treatment includesadministration of bronchialodilators, corticosteroids, and antihistamines.
Resumen
Una anafilaxia es una condición clínica potencialmente mortal que resulta de la activación específica (alérgica), o no específica (no alérgica) de mastocitos/ basófilos, vías inflamatorias o ambos. La mayoría de las anafilaxias son mediadas por IgE, pero también las hay por IgM y activación del complemento. Su incidencia es de 1:10.000 anestesias. En los últimos estudios, los fármacos o sustancias más implicadas en producir anafilaxia perioperatoria son los bloqueadores neuromusculares (60,6%), los antibióticos (18,2%), las tinturas azules (5,4%) y el látex (5,2%), sin embargo, todas las drogas y sustancias usadas durante la anestesia y la cirugía, tal vez con la única excepción de los agentes inhalatorios y los cristaloides, han sido reportadas como potencialmente causantes de anafilaxia. El cuadro clínico es multisistémico, originando signos y síntomas centrados en la piel y los sistemas respiratorio, cardiovascular, gastrointestinal y nervioso central. En su fase avanzada puede evolucionar a anafiláctico, causando hipoperfusión tisular y llevando a alteración en la integridad celular y falla de múltiples órganos, con alta mortalidad asociada. El diagnóstico se basa en evidencias clínicas (historia y manifestaciones clínicas), evidencias biológicas (niveles de triptasa sérica, de histamina sérica y búsqueda de IgE específicas) y evidencias alergológicas (pruebas cutáneas, test de provocación, pruebas de liberación de mediadores y pruebas de activación de basófilos. El tratamiento incluye 3 etapas: medidas generales, tratamiento de primera línea o primario y tratamiento de segunda línea o secundario. Las medidas generales consisten en poner al paciente en posición de Trendelemburg, iniciar monitorización invasiva según la intensidad del cuadro clínico, administración de oxígeno al 100%, discontinuación de drogas y/o agentes posiblemente incriminados y pedir ayuda. El tratamiento primario es la adrenalina, en dosis proporcionales a las manifestaciones clínicas, el soporte de la vía aérea manteniendo el oxígeno ql 100% y la reanimación agresiva con fluidos endovenosos. El tratamiento secundario incluye la administración de broncodilatadores, corticoesteroides y antihistamínicos.
-
Introducción
La nomenclatura de las reacciones alérgicas ha ido cambiando. El uso de una terminología de consenso facilita el uso de los algoritmos de diagnóstico y tratamiento, permite comparar los datos de diferentes investigaciones y reduce los mal entendidos[1]. Aunque las sociedades científicas relacionadas con alergia recomiendan uniformar la terminología, la variabilidad permanece; por ejemplo, las palabras hipersensibilidad, alergia y anafilaxia con frecuencia se usan indistintamente sin uniformidad en su significado, al igual que alergia, pseudoalergia y anafilactoidea.
Según el Comité de Revisión de Nomenclatura de la WAO (World Allergy Organization)[2] y la EAACI (Eurperan Academy of Allergology and Clinical Immunology)[3], todas las reacciones adversas inmediatas a drogas deben llamarse anafilaxias, con una subclasificación adicional en alergias o no alérgicas. A su vez, las anafilaxias alérgicas se subclasifican en mediadas por IgE y no mediadas por IgE. Se evita de esta forma la denominación reacción anafiláctica. Ambas son el resultado de la liberación de mediadores preformados y neoformados en mastocitos y basófilos. Por otra parte, una anafilaxia derivada de cualquier otra causa que no sea inmunológica debe denominarse anafilaxia no alérgica, evitando llamarlas reacción pseudoalérgica o anafilactoídea.
No hay una definición universalmente aceptada de anafilaxia, pero se acepta que se trata de “una reacción grave de inicio rápido y que puede causar la muerte”[4]. Se considera la patología médica de emergencia por excelencia: los síntomas se inician rápidamente y la muerte puede ocurrir en minutos.
Se define anafilaxia perioperatoria como aquella que se produce en pacientes que se someten a un procedimiento que requiere anestesia general, regional, sedación o monitoreo con anestesista, bajo la atención de un anestesista, entre el período de la primera administración de un medicamento (incluida la medicación previa), el posprocedimiento y el traslado a la sala de recuperación o de cuidado crítico.
En todo caso, el término anafilaxia, se refiere a una condición clínica potencialmente mortal que resulta de la activación específica (alérgica), o no específica (no alérgica) de mastocitos/basófilos, vías inflamatorias o ambos. Es una reacción de hipersensibilidad grave, generalizada o sistémica, secundaria a la administración de un fármaco o al contacto con una sustancia desencadenante. Se caracteriza por la rápida aparición de una serie de signos y síntomas, después de la exposición a este desencadenante.
La anafilaxia es la forma más grave de una reacción alérgica, porque puede llevar a una insuficiencia respiratoria aguda y colapso cardiovascular. En los casos graves, hay broncoespasmo intenso, edema laríngeo, cianosis, hipotensión y shock.
-
Fisiopatología
Las reacciones de hipersensibilidad pueden ser descritas por la clasificación de Gell y Coombs, que las sistematiza dependiendo de su escala temporal y etiología, en cuatro grupos, no necesariamente independientes. Entre el 60% y 70% de las anafilaxias alérgicas durante la anestesia son mediadas por IgE y corresponden a una reacción de hipersensibilidad inmediata de tipo I según dicha clasificación. El resto es mediado por IgG y complejos inmunes relacionados con el complemento[5].
-
Anafilaxias mediadas por IgE
Para estar en riesgo de reacciones de hipersensibilidad tipo I un individuo debe haber sido sensibilizado a un antígeno a través de una exposición previa. La primera exposición debe haber producido una inmunoglobulina E (IgE) específica para el antígeno y la capacidad de producir esa IgE mantenida en la memoria de las células plasmáticas. La hipersensibilidad ocurre cuando una exposición subsecuente al mismo antígeno induce la producción de IgE a gran escala, las que se unen a los receptores Fcs presentes en la superficie de los mastocitos y basófilos. La interacción de la IgE unida a mastocitos y basófilos con su antígeno induce degranulación y liberación de mediadores inflamatorios, que ocasionan alteración en la permeabilidad capilar (urticaria, edema), vasodilatación, broncoconstricción, hipotensión con taquicardia y otros signos y síntomas observados en la anafilaxia.
Los mastocitos y basófilos se originan y maduran en la médula ósea y juegan un rol determinante en los mecanismos fisiopatológicos de la alergia. Comparten muchas propiedades, pero también sensibles diferencias que confieren a los mastocitos un rol particular en el compromiso cardíaco de la anafilaxia. Los mastocitos se marginan posteriormente en el tejido conjuntivo, mientras que los basófilos circulan en la sangre pasando a los tejidos como parte de la respuesta inflamatoria. Ambos se caracterizan por tener gránulos citoplasmáticos que contienen histamina preformada.
La unión de un antígeno con dos anticuerpos en la membrana de un mastocito genera la activación inmunológica de ésta, induciendo la movilización de sus gránulos citoplasmáticos hacia la membrana celular y liberación de su contenido, compuesto por histamina (uno de los principales mediadores preformados liberados en una anafilaxia[6]), otros mediadores preformados y mediadores neoformados. Entre los mediadores preformados están los de la familia de las proteasas y los proteoglicanos: triptasa, quinasa, carboxipeptidasa y heparina. Entre los mediadores neoformados, se produce fundamentalmente la estimulación de la síntesis de metabolitos lipídicos: prostaglandinas y leucotrienos[7] (Figura 1). También se ha implicado en la configuración del cuadro clínico de la anafilaxia el factor activador de las plaquetas, la serotonina, la bradiquinina, la calcitonina y el óxido nítrico[8]. Los efectos de la histamina, asociados a los de los otros mediadores preformados y neoformados pueden llevar al shock anafiláctico, la manifestación clínica más grave de la anafilaxia.
-
Anafilaxias mediadas por IgG
Algunas sustancias como los dextranos, usadas actualmente muy poco en anestesia, y los anticuerpos monoclonales quiméricos o humanizados, producen una anafilaxia alérgica causada por anticuerpos IgG, que producen complejos inmunes con el antígeno (por ejemplo, macromoléculas de dextrano), activando de esta manera el sistema de complemento[9].
-
Activación del complemento
La cascada del complemento puede ser activada por tres vías: clásica, lectina y alternativa. La activación por la vía clásica puede ser de origen alérgico o no alérgico, como se ha demostrado en productos como los dextranos, la protamina o la heparina. La vía alternativa al ser activada a nivel de C3, conduce a la producción de anafilatoxinas C3a y C5a, responsables de anafilaxias no alérgicas. La vía alternativa, de origen no inmunológico, está relacionada con la génesis de ciertas anafilaxias no alérgicas como es el caso de los medios de contraste yodados.
-
Anafilaxia no alérgica
La anafilaxia no alérgica no es mediada inmunológicamente, sino que gatillada químicamente, como resultado de la activación de basófilos y mastocitos por un estímulo que es independiente de la IgE específica, producida por factores cuyo mecanismo exacto se desconoce[10]. Al no involucrar un mecanismo inmunológico, no es necesario un contacto previo con la sustancia. Deriva de la activación del complemento y/o de la cascada de bradiquinina y de la activación directa de los mastocitos y basófilos. Las manifestaciones clínicas de la anafilaxia no alérgica pueden ser indistinguibles de las que originan las anafilaxias alérgicas, pero tienden a causar sintomatología y signología menos severa, pues la cantidad de histamina liberada es menor y la liberación de otros mediadores es excepcional. La respuesta clínica no es homogénea, debido a la diversidad de respuesta de los mastocitos según los sitios anatómicos y los productos administrados[11].
Muchos fármacos usados durante la anestesia, de diversa estructura molecular, desencadenan la degranulación de mastocitos y la liberación de histamina en forma proporcional a la dosis, con un mecanismo no inmunológico.
Los medicamentos responsables de liberación inespecífica de histamina son generalmente compuestos básicos cargados positivamente, que inducen liberación de histamina por acción directa a nivel de la membrana de los mastocitos y basófilos[12]. Este fenómeno es facilitado por la presencia de antecedentes atópicos, por la velocidad de inyección y por la hiperosmolaridad del producto.
El ejemplo más típico en anestesia son los bloqueadores neuromusculares (BNM) del grupo de las bencilisoquinolinas, especialmente el atracurio y el mivacurio, pues el cisatracurio no produce liberación de histamina en las dosis usadas en clínica. Otros productos implicados son la protamina, los opiáceos (especialmente la morfina, petidina y codeína), ciertos antibióticos como la vancomicina[13] y algunos agentes de inducción como el tiopental[14] y propofol[15].
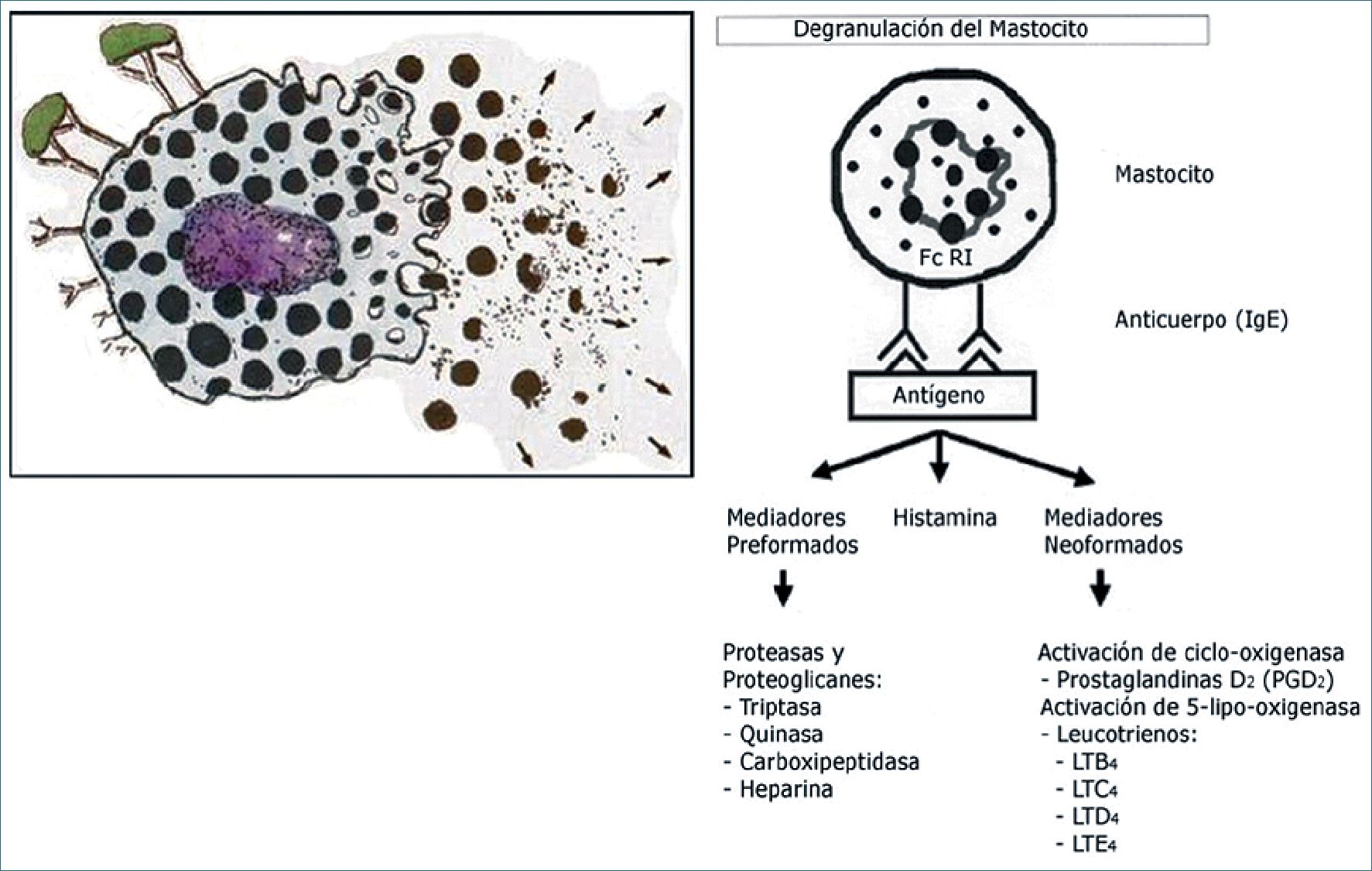
Figura 1. Resultado de la activación inmunológica de los mastocitos y basófilos: liberación de histamina, mediadores preformados y mediadores neoformados.
-
Incidencia
La prevalencia de anafilaxia en general se estima en 0,05% a 2% incluyendo todas las etiologías[16]. Estudios más actuales muestran un incremento en la población joven. En el perioperatorio la incidencia es mucho menor, pero se asocia a una mucho mayor mortalidad; se puede reducir aún más mediante una buena anamnesis sobre eventos adversos ocurridos en anestesias previas. Los pacientes atópicos, aquellos con asma o rinitis alérgica, o aquellos que tienen alergia a un medicamento que no es probable que se use durante el curso de la anestesia o el procedimiento, no se consideran en un riesgo significativamente mayor de una reacción de hipersensibilidad. No existe evidencia de que un estudio de laboratorio previo esté indicado para disminuir la incidencia.
La verdadera incidencia de anafilaxia perioperatoria, su morbilidad y su mortalidad asociadas están probablemente subvaloradas, debido a la incertidumbre sobre la exactitud de los reportes y a la dificultad de la identificación del mecanismo inmunológico de la reacción. El estudio mejor realizado para tratar de evitar el sesgo derivado del subreporte de casos, es el del Groupe d’Études des Réactions Anafiilactoídes Peranesthésiques (GERAP), mediante el método captura-recaptura, basado en la correlación de dos fuentes diferentes de datos (en este caso, la base de datos del GERAP y la base de datos del Sistema Francés de Farmacovigilancia), con el propósito de identificar el número de casos. Con este método se estimó una incidencia de anafilaxia mediada inmunológicamente (alérgica) de 1 en 10.060 anestesias (1 en 5.540 en mujeres y 1 en 15.490 en hombres) (Figura 2)[17]. Se ha propuesto explicar esta mayor incidencia de reacciones de hipersensibilidad inmediata observadas en mujeres por una posible sensibilización con compuestos de amonio cuaternario existentes en los cosméticos, pero esta hipótesis no ha sido demostrada. Por el contrario, el papel jugado por las hormonas sexuales en este riesgo aumentado, sí ha sido demostrado, al confirmarse la ausencia de este predominio de incidencia en la mujer antes de la pubertad. Además, la mayor incidencia de anafilaxia no inmune que también ocurre en las mujeres, sugiere que los estrógenos también podrían desempeñar un papel en el aumento de la síntesis y liberación de mediadores alérgicos[18].
En Chile, debido especialmente a la falta de posibilidades diagnósticas, no se cuenta con estadísticas, lo que es una lástima porque todos los estudios realizados revelan una epidemiología muy particular de cada lugar geográfico. Por ejemplo, en la mayor parte de los países de Europa, los BNM están más frecuen temente implicados, en cambio en Estados Unidos son los antibióticos y en Dinamarca la clorhexidina.
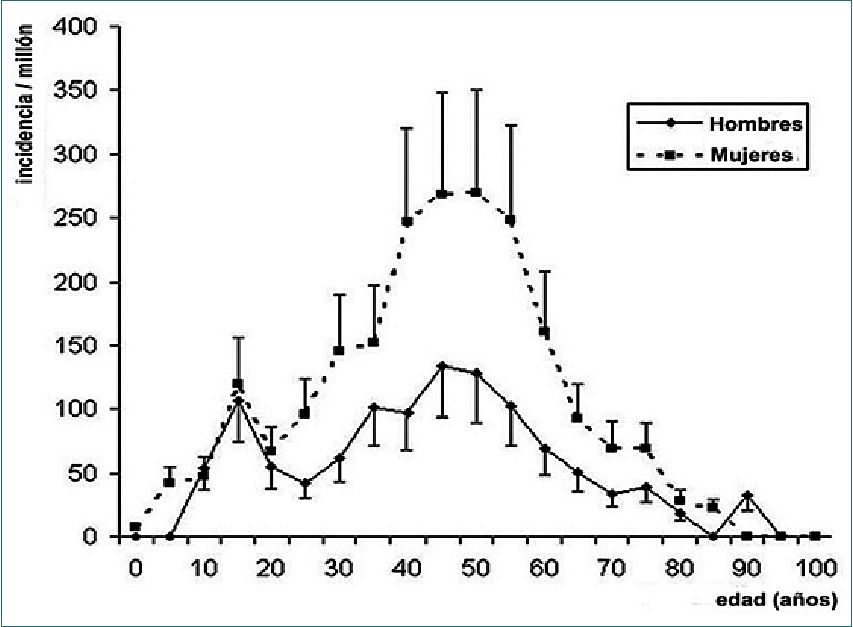
Figura 2. La incidencia de anafilaxia alérgica es menor en las edades extremas de la vida y mayor entre las mujeres de 40 a 60 años.
Un estudio reciente realizado en el Reino Unido, el 6th National Audit Project (Sexto Proyecto Nacional de Auditoría NAP6) del Royal College of Anesthetists, examinó la incidencia, los factores predisponentes, el manejo y el impacto de la anafilaxia perioperatoria potencialmente mortal. El estudio incluyó 356 hospitales públicos y 304 independientes. Abarcó todas las anestesias generales en pacientes adultos y pediátricos, sedaciones, anestesias generales o locales y analgesias de partos, en las que participó un anestesista. Coordinadores locales reportaron todos los casos de sospecha de anafilaxia perioperatoria potencialmente mortal, durante un año, hasta mayo de 2017. Se recibieron más de 500 reportes de anafilaxia severa, con 266 reportes susceptibles de ser analizados; se identificaron 199 agentes probablemente causales en 192 casos[19]. La incidencia general de anafilaxia alérgica perioperatoria severa fue de « 1:10.000 anestesias.
Los niños menores de 10 años son responsables de un poco menos de 5% del total de anafilaxia perioperatoria. Un estudio prospectivo multicéntrico llevado a cabo entre 1991-1992 en centros hospitalarios pediátricos franceses y belgas en 162.551 niños, demostró una incidencia de anafilaxia alérgica de 1 en 7.741 anestesias[20]. Los cuadros clínicos en los niños tienden a ser menos intensos y no se reportan paros cardíacos.
La incidencia de anafilaxia relacionada exclusivamente a los BNM se estima entre 1/5.200 a 1/6.500 anestesias en que se haya usado estos fármacos. La mortalidad perioperatoria es de 3% a 10% de los casos[21]. Un grupo adicional de 2% de pacientes queda con daño neurológico significativo[22]. Las mayores tasas de mortalidad se han reportado en Japón (4,76%)[23] y en Estados Unidos (4%)[24] y las menores en Australia (1,4%)[25].
Por tratarse de un cuadro de baja incidencia y alta mortalidad, es importante mantener actualizados los niveles de conocimiento de la enfermedad, asertividad diagnóstica y rápido tratamiento entre los anestesiólogos. En términos prácticos, un anestesiólogo individualmente al realizar 1.500 procedimientos anestésicos al año tiene la probabilidad de enfrentar un caso de anafilaxia grave en su práctica cada 5 a 10 años[26]. En comparación, la incidencia de hipotensión arterial grave (definida como una disminución de más del 50% de la presión arterial sistólica/media), se produce en aproximadamente el 5%-10% de los procedimientos anestésicos.
La adquisición y preservación de las habilidades clínicas para solucionar tales eventos raros es un desafío. La simulación es una de las técnicas que puede aplicarse para lograr una experiencia adecuada, entrenando a los anestesiólogos con intervalos regulares en un entorno seguro[27]. Un estudio realizado en Dinamarca que incluía 42 anestesistas con experiencia ayudados por un instructor, quienes fueron confrontados a un simulador de anafilaxia, demostró que ninguno de ellos pudo diagnosticar el cuadro en los 10 primeros minutos, y sólo el 25% logró hacerlo después de 15 minutos[28].
-
Sustancias responsables
En la vida diaria, los principales agentes causantes de anafilaxia son los alimentos, las picaduras de abejas y avispas, los fármacos y otros agentes. En relación con los alimentos, destacan a nivel mundial el maní y otros frutos secos, mariscos, pescados, leche, huevo y sésamo. En anestesiología, todas las drogas y sustancias usadas durante la anestesia y la cirugía, tal vez con la única excepción de los agentes inhalatorios y los cristaloides, han sido reportadas como potenciales causantes de anafilaxia alérgica. Incluso aquellas tan poco probables, como la atropina o la betametasona. El sugammadex, que por ser un azúcar se creyó tenía una incidencia baja, hoy exhibe abundantes reportes en la literatura, e incluso la Sociedad Japonesa de Anestesiólogos ha emitido una advertencia sobre el shock anafiláctico inducido por sugammadex en cinco ocasiones desde marzo de 2011, la tercera incluyendo 95 casos de anafilaxia relacionadas con sugammadex, aunque no mortales[29].
Por otra parte, también la mayoría de los agentes usados durante la anestesia se han reportado como responsables de anafilaxia no alérgica. Dependiendo de la acuciosidad diagnóstica, se ha determinado que entre el 8% y el 73% de los pacientes sometidos a anestesia general presentan algún grado de liberación inespecífica de histamina.
Desde los años 80, especialmente en Francia, Australia, Nueva Zelanda y el Reino Unido se ha desarrollado una intensa política de investigación alergológica sistemática en los pacientes con alergias perianestésicas. Los estudios más detallados han sido realizados por el GERAP: 10 estudios que han documentado la epidemiología de cerca de 5.000 reacciones anafilácticas con riesgo vital en Francia desde los años 80. Esto ha permitido seguir la evolución del riesgo por más de 30 años (Tabla 1).
Tabla 1. Incidencia relativa de anafilaxias alérgicas intraoperatorias de las diferentes sustancias implicadas según las 10 encuestas del GERAP. Las columnas representan cada uno de los estudios realizados desde 1989 hasta 2017
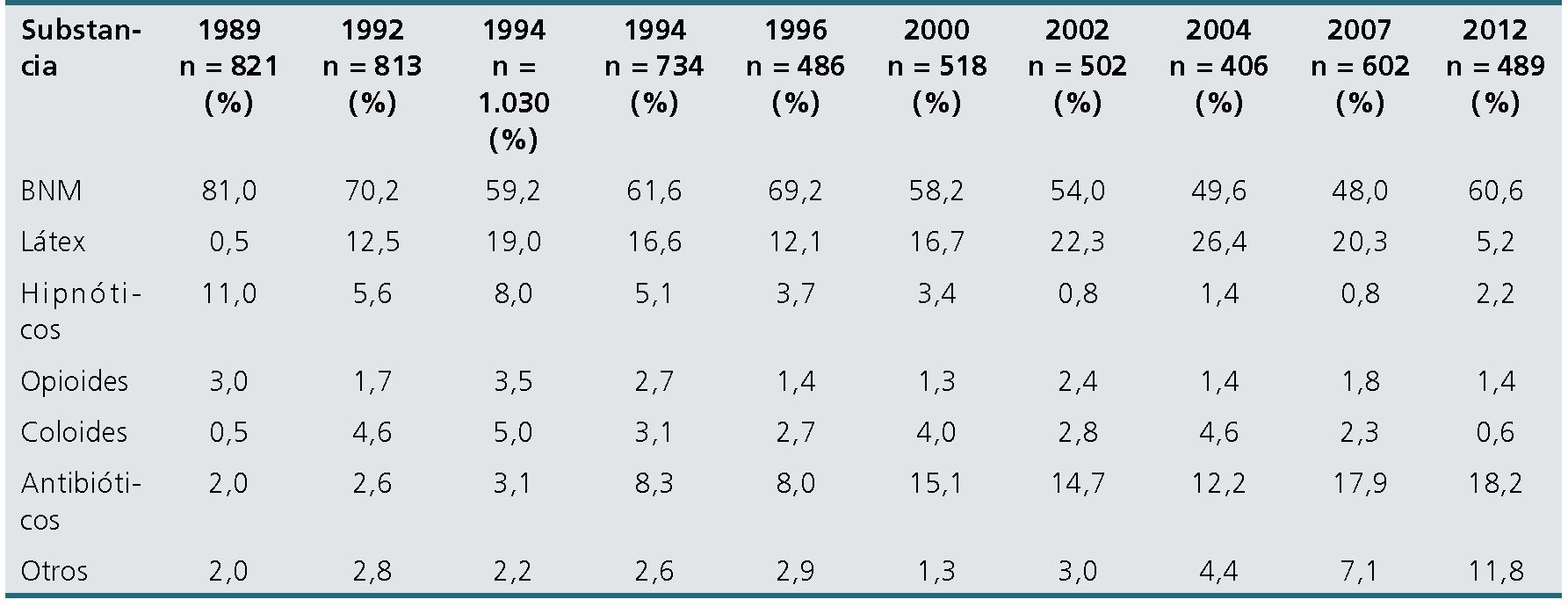
Con el transcurso de los años, la incidencia relativa de los fármacos más reportados como responsables de anafilaxia intraoperatoria ha ido cambiando en relación con la práctica anestesiológica, el mayor o menor uso de algunas drogas, la aparición u obsolescencia de otras y el reflejo de participación en el mercado; es por eso que debe ser permanentemente monitorizada. Sin embargo, los BNM siguen siendo la mayor causa de anafilaxia alérgica en Francia. El segundo y tercer lugar ha ido cambiando, pero siempre han estado presente los antibióticos, el látex y las tinturas azules (especialmente el azul patente).
Las diferencias entre el séptimo y décimo estudio son un ejemplo de este cambio epidemiológico. El séptimo reporte publicado en 2011 abarcó 2.516 casos estudiados entre los años 1997-2004, de los cuales 1.816 casos corresponden a reacciones anafilácticas mediadas inmunológicamente (72,18%) y 700 a reacciones anafilácticas donde no se comprobó mecanismo inmunológico involucrado (27,82%). La incidencia relativa de los agentes más implicados fue de 58% para los BNM, 19,6% para el látex y 12,8% para los antibióticos[30]. El décimo reporte publicado en 2017 abarcó 714 pacientes que presentaron anafilaxias entre enero de 2011 y diciembre de 2012, de los cuales 489 correspondieron a anafilaxias alérgica (68,5%) y en 225 en que no se demostró mecanismo inmunológico involucrado (31%)[31].
Ambos estudios coinciden con reportes anteriores en la proporción de anafilaxia alérgica y no alérgica, sin embargo, no en los agentes más implicados. En el último estudio los BNM siguen siendo los más implicados con una incidencia relativa de 60,6%, seguido ahora por los antibióticos (18,2%) y las tinturas azules (5,4%), en tanto el látex quedó relegado al cuarto lugar con 5,2%. La causa de este cambio probablemente es la mejor prevención y conocimiento del manejo de la alergia al látex (incluyendo que la gran mayoría de los insumos son ahora libres del producto). La incidencia relativa de anafilaxia alérgica a las tinturas azules subió de 0,6% a 5,4% de un período a otro, probablemente por el mayor uso de azul patente como marcador de ganglios centinelas en diferentes patologías oncológicas. Sin embargo, este estudio abarca solo un año y 300 casos, a diferencia de los otros que son bienales o han abarcado un número de hasta 5.000 anafilaxias, de modo que las conclusiones no pueden ser definitivas.
En el estudio NAP6 realizado en el Reino Unido, los agentes más implicados en los 199 confirmados fueron los antibióticos (94), BNM (65), clorhexidina (18) y azul patente (9). La reacción a succinilcolina se presentó clínicamente, principalmente, como broncoespasmo severo y tuvo el doble de probabilidad de relacionarse a anafilaxia que los otros BNM. La anafilaxia del atracurio se presentó fundamentalmente como hipotensión severa. Los BNM no despolarizantes tuvieron una incidencia similar entre ellos; no se reportaron casos de anafilaxia a anestésicos locales o al látex[32].
Las sustancias responsables de shock anafiláctico perioperatorios en niños son similares a las usadas en adultos, aunque el látex es el alergeno más común, particularmente en aquellos que han sido sometidos a cirugía con frecuencia (por ejemplo, pacientes con espina bífida o malformaciones urogenitales).
-
Bloqueadores neuromusculares
La incidencia relativa de los BNM en anafilaxia perioperatoria ha tendido a disminuir en los últimos años, probablemente por una indicación más selectiva en el uso de estos fármacos, pero, a pesar de todo, en todos los reportes del GERAP, la responsabilidad de los BNM en las anafilaxias alérgicas sigue siendo preponderante: entre el 54% (entre el 2000 y 2002) y el 81% (entre 1984 y 1989) de acuerdo con el período observado. Según el último reporte publicado en 2017, ya citado, los BNM son responsables del 60,6% de las anafilaxias alérgicas perioperatorias (Tabla 1).
En el último estudio francés, la incidencia relativa de anafilaxia alérgica a los diferentes BNM (60,6% del total) es de 68,2% para la succinilcolina, 13,9% para el atracurio, 10,6% para el rocuronio, 5,3% para el cisatracurio, 1,7% para el vecuronio y 0,3% para el mivacurio (Figura 3). Sin embargo, La responsabilidad de los BNM en la incidencia a la anafilaxia alérgica debe ser interpretada teniendo en cuenta la proporción de utilización de los diferentes BNM en clínica, o su participación en el mercado. En este sentido, la frecuencia de anafilaxia por uso se revela mayor para el rocuronio, con una incidencia de 13,8 reacciones por 100.00 ampollas vendidas, seguido de cerca por la succinilcolina con 13,3 reacciones por 100.000 ampollas (p = NS). El cisatracurio es el BNM que ocasiona con menos frecuencia de anafilaxia, con una incidencia de 0,4 reacciones por 100.000 ampollas vendidas (p < 0,0001 en comparación con rocuronio) (Tabla 2).
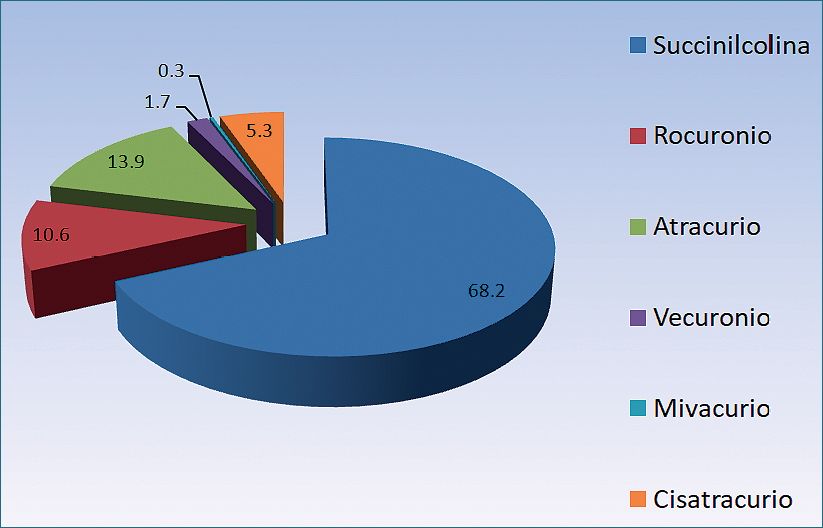
Figura 3. Incidencia relativa de anafilaxias alérgicas mediadas por IgE de los BNM entre 2011 y 2012 en Francia, según el estudio de Tacquard y cols., publicado en 2017.
El aumento de riesgo de anafilaxia al rocuronio fue reportado inicialmente en Francia, luego en Noruega y, posteriormente, ha sido confirmado en otros países, a pesar de que en un primer momento fue muy discutido. Por el contrario, el gran margen de seguridad del cisatracurio debe ser interpretado con precaución, hasta que se tengan estudios epidemiológicos más numerosos. El propio estudio francés reconoce la posibilidad de una subestimación del riesgo de alergia al cisatracurio.
La incidencia de reacciones cruzadas entre diferentes BNM es de alrededor de 50%-75%, sobre todo con los agentes del grupo aminoesteroide. Los BNM, tanto del grupo químico aminoesteroide como bencilisoquinolínico, tienen un epítope común: los iones amonio cuaternario y terciario. La gran ubicuidad de estos grupos en los diferentes BNM (varios tienen 2 o incluso 3 amonios cuaternarios), permite explicar en parte la alta incidencia de reacciones cruzadas. Además, la presencia de amonio cuaternario es frecuente en productos de uso diario, que podrían producir sensibilización sin contacto previo con el alérgeno: cosméticos, pastas de dientes, jarabes antitusígenos, etc. Es así que hasta 50% de las reacciones a los BNM ocurren sin exposición previa a la droga y la exposición por primera vez a un alérgeno (debido a la reactividad cruzada) es consistente con el diagnóstico de anafilaxia. Los BNM no despolarizantes también pueden presentar reacciones cruzadas a nivel de los receptores nicotínicos y muscarínicos responsables de las acciones a nivel de receptores colinérgicos de fuera de la unión neuromuscular, causando efectos periféricos autonómicos y ganglionares. Esto explica, por ejemplo, porqué el rapacuronio fue responsable de una alta incidencia de broncoespasmo secundaria a una mayor afinidad por los receptores muscaníricos M2 en comparación con los M3, lo que llevó a su retirada del mercado[33].
Al estudiar las reacciones cruzadas, sólo 4,3% de los pacientes es sensible a todos los BNM actualmente disponibles. Además, el 16% de los pacientes sensibles a la succinilcolina son también sensibles al rocuronio, lo que limita el uso de BNM en la inducción en secuencia rápida. Las reacciones cruzadas también son más frecuentes con rocuronio que con cisatracurio, lo que contribuye al perfil de seguridad del cisatracurio con relación al riesgo de anafilaxia comparado con el resto de los BNM. La descripción completa de las reacciones cruzadas se aprecia en la Tabla 3.
La incidencia de reacciones cruzadas es tan alta y la sensibilidad diagnóstica es tan baja, que cuando existen antecedentes de anafilaxia a un BNM, si es posible, hay que evitar el uso de cualquier BNM; si esto fuera inevitable, debe usarse el que haya salido negativo al estudio de pruebas cutáneas, aceptando que ello no garantiza que no ocurra anafilaxia. Aunque raros, se han reportado en la literatura algunos casos de reincidencia de anafilaxia después de administrar un BNM considerado seguro[34]. La reacción cruzada a todos los BNM es muy poco frecuente, pero parece ser más frecuente en el grupo aminoesteroide que en el bencilisoquinolínico[35].
Tabla 2. Incidencia de relativa de anafilaxias alérgicas mediadas por IgE de los BNm entre 2011 y 2012 en Francia, teniendo en cuenta su uso clónico (número de ampollas utilizadas), según el estudio de Tacquard y cols., publicado en 2017
| BNm | N° de | % de | Ventas entre | % de cuota del | N° de anafilaxias |
| Anafilaxias | Anafilaxias | 2011-2012 | mercado | por 100.000 | |
| (N° ampollas) | ampollas vendidas | ||||
| Rocuronio | 32 | 10,6 | 231.847 | 2,2 | 13,8 |
| Succinilcolina | 206 | 68,2 | 1.548.630 | 14,7 | 13,3 |
| Vecuronio | 5 | 1,7 | 156.270 | 1,5 | 3,2 |
| Atracurio | 42 | 13,9 | 3.789.677 | 36,1 | 1,1 |
| Mivacurio | 1 | 0,3 | 162.783 | 1,5 | 0,6 |
| Cisatracurio | 16 | 5,3 | 4.552.495 | 43,3 | 0,4 |
| Total | 302 | 100 | 10.511.412 | 100 | 2,9 |
Tabla 3. Relación entre las reacciones cruzadas de los diferentes BNm en Francia entre 2011 y 2012, según el estudio de Tacquard y cols, publicado en 2017
| * | Succinilcolina | Rocuronio | Cisatracurio | Atracurio |
| Succinilcolina | – | 16,0% | 10,2% | 11,2% |
| Rocuronio | 45,2% | – | 29,0% | 22,6% |
| Cisatracurio | 25,0% | 31,3% | – | 56,3% |
| Atracurio | 16,7% | 2,4% | 38,0%, | – |
| * BNM responsable de la reacción (en vertical) y BNM probado para reacción cruzada (en horizontal). | ||||
La incidencia de reacciones a los BNM no mediadas por IgE varía entre un quinto y un tercio de los casos reportados en la mayoría de las series, sin embargo, en un estudio basado en los reportes de efectos adversos del Reino Unido, las reacciones no alérgicas ocurren casi con la misma frecuencia que las alérgicas[36]. El mecanismo preciso de las reacciones no mediadas por IgE es difícil de establecer, pero se presume que son el resultado de una activación directa e inespecífica de mastocitos y basófilos, que produce una liberación de histamina, generalmente menos severa que las reacciones mediadas por IgE. Los BNM que liberan histamina son del grupo de las bencilisoquinolinas: atracurio y mivacurio (el cisatracurio no libera histamina en dosis clínicas). El atracurio tiene una incidencia de efectos secundarios graves por liberación de histamina de 1%[37].
La anafilaxia a los BNM tiene particularidades dignas de destacar: 1) hasta 50% de ellas ocurren después de la primera exposición, lo que es contradictorio con el mecanismo de hipersensibilidad inmediata de tipo I; 2) hay un fuerte predominio de las mujeres de 2:1 a 8:1; 3) hay una alta incidencia de reacciones cruzadas entre los distintos BNM, lo que no es igual, por ejemplo, en el caso de los antibióticos con anillo betalactámico.
-
Antibióticos
La incidencia relativa de anafilaxia relacionada con los antibióticos actualmente es de 18,2%, siendo la segunda causa de anafilaxia perioperatoria, especialmente después de la instalación rutinaria de la práctica de profilaxis antibiótica preoperatoria.
Las penicilinas y otros agentes con anillo betalactámico, como las cefalosporinas, producen reacciones adversas mediadas por mecanismos específicos, pero heterogéneos y frecuentemente desconocidos. El mecanismo más común en pacientes con una anafilaxia documentada a penicilina es una reacción mediada por IgE y corresponde a una reacción de hipersensibilidad inmediata de tipo I.
En el último estudio francés, del total de anafilaxias alérgicas por antibióticos el 53,8% corresponde a cefazolina, el 36,2% a penicilina (90% a ambas), el 7% a vancomicina y 3% a otros.
Existe el concepto generalizado de que la penicilina es la causa más frecuente de anafilaxia intraoperatoria, sin embargo, la gran mayoría de pacientes que dicen ser alérgicos NO LO SON. Aunque la anafilaxia a la penicilina es excepcional en el perioperatorio, continúa siendo responsable de alrededor del 75% de las muertes por anafilaxia en la población general en Estados Unidos fuera del pabellón[38]. Los pacientes con alergia a la penicilina tienen un riesgo 3 veces mayor de experimentar una anafilaxia a otra droga. En aquellos pacientes en que debe hacerse profilaxis, debe usarse antibioterapia alternativa: clindamicina, vancomicina o lincomicina. La reacción cruzada entre penicilina y cefalosporina se reportó en un comienzo entre 8% y 10%, pero estudios posteriores han demostrado una reacción cruzada de sólo 1%. La mayoría de los reportes son sólo eritemas cutáneos de origen no inmunológico y casos antiguos, en que las cefalosporinas estaban contaminadas con pequeñas trazas de penicilina[39].
La vancomicina se usa cada vez con mayor frecuencia para profilaxis, especialmente en pacientes con varios días de hospitalización. Aunque se ha reportado anafilaxias, la gran mayoría de las reacciones adversas observadas por vancomicina, están relacionadas con un fenómeno no inmune asociado a una rápida administración (“síndrome del hombre rojo”). Su manejo incluye el uso de antihistamínicos, la administración más lenta o el fraccionamiento de la dosis.
-
Colorantes azules
La identificación del ganglio centinela se ha convertido en los últimos años en parte de un protocolo de rutina en el tratamiento del cáncer de mama y melanoma, y se está estudiando en otros tipos de cáncer. Las dos tinturas más usadas para marcar los
ganglios en este procedimiento son el azul patente y el azul isosulfán, que comparten una estructura química común (triarilmetano). El azul de metileno tiene una estructura diferente, pero también se ha asociado con anafilaxia. Genéricamente se les conoce como colorantes azules. Estas sustancias pueden ser responsables de anafilaxia que, aunque suelen ser leves, también puede expresarse con manifestaciones clínicas severas y provocar efectos hemodinámicos graves que requieren fármacos vasoactivos e incluso presentarse como shock anafiláctico.
La incidencia estimada informada de anafilaxia alérgica mediada por IgE a colorantes azules varía entre 150 y 1.000 por 100.000 administraciones[40],[41],[42]. En el último reporte del GERAP se han instalado como la tercera causa de anafilaxia alérgica perioperatoria: 5,4%. La incidencia relativa es de un 89% para el azul patente y de 11% para el azul de metileno. El estudio NAP6 identificó 9 de 199 casos (3,4% de incidencia relativa) de anafilaxia alérgica al azul patente; basado en una estimación de 61.768 exposiciones en el Reino Unido, la incidencia sería de 14,6:10.000 administraciones (mayor que la succinilcolina).
Otro efecto observado con el uso de azul patente son los cambios de oximetría de pulso, pues interfiere con la lectura de la longitud de onda utilizada para medir la oxihemoglobina, ocasionando lecturas falsamente bajas, lo que puede producir un potencial retraso en el reconocimiento de la aparición del cuadro de anafilaxia[43].
Aunque las reacciones a las tinturas azules pueden deberse a diferentes mecanismos, como activación directa de mastocitos y basófilos, o mediadas por IgE, el grupo analizado en el último estudio francés presentó pruebas cutáneas positivas, lo que demuestra un mecanismo alérgico. Las manifestaciones clínicas de la anafilaxia a las tinturas azules pueden diferir a las de las reacciones de hipersensibilidad inmediata, siendo habitualmente tardías, ocurriendo 45 a 60 minutos después de la inyección.
-
Látex
Entre alrededor de 250 proteínas que posee la Hevea brasiliensis, unas 50 son potencialmente alergénicas. Algunas de ellas pueden tener epítopes comunes con ciertos vegetales y frutas tropicales, que pueden ser responsables de reacciones cruzadas hasta en el 50% de los casos.
El látex pasó a ser la cuarta causa de reacciones anafilácticas intraoperatorias, por una pequeña diferencia: 5,2%. Una incidencia que en encuestas anteriores pareció estar sobrestimada, ahora ha caído a niveles más reales. Entre los años 2000 a 2007 la incidencia relativa superaba los dos dígitos, pero ahora ha disminuido a niveles más creíbles, debido a la fabricación de la mayoría de los elementos usados en anestesia y cirugía, libre de látex y a la mayor precaución tenida en los grupos de riesgo.
La incidencia de reacciones al látex es muy dependiente de la población estudiada y del método de diagnóstico utilizado. En países en los que se han adoptado estrategias para reducir la exposición al látex, como en Noruega, se reporta desde hace años una incidencia relativa aún más baja, de sólo 3,6%[44].
Los factores de riesgo para la alergia al látex incluyen: 1) antecedentes de hipersensibilidad inmediata después de la exposición al látex; 2) atopia; 3) pacientes con espina bífida; 4) cirugías múltiples, especialmente en niños; 5) exposición ocupacional al látex y 6) alergia a frutas exóticas (palta, plátano, kiwi, etc.)[45].
La disminución de la incidencia de reacciones anafilácticas al látex se ha atribuido a la identificación de los pacientes con mayor riesgo de presentarlas y a una serie de medidas preventivas que se ha implementado en este sentido. Entre ellas: 1) Identificar pacientes de riesgo, especialmente con una historia cuidadosa; 2) manejar los pacientes con historia sugerente y confirmación de laboratorio (cuando es posible), evitando completamente el látex; 3) coordinar equipos: anestesiólogos, cirujanos, enfermeras de pabellón y técnicos paramédicos; 4) disponer y revisar permanentemente el equipamiento, para pabellón libre de látex; 5) programar al paciente de cirugía electiva a primera hora, pues hay una menor cantidad de partículas de látex en suspensión; 6) disponer letreros “ALERGIA AL LÁTEX” en la puerta del pabellón, así como en la cama del paciente durante el período postoperatorio; 7) utilizar algún sistema de identificación (brazalete o medalla), que indique su condición de alérgico al látex; 8) recordar que el uso profiláctico de bloqueadores H1, H2 y corticoesteroides no tiene evidencia suficiente y produce una falsa sensación de seguridad[46]; pueden ayudar a disminuir las reacciones mediadas por histamina no alérgica, pero no previenen de forma fiable las reacciones mediadas por IgE, de modo que evitar el alérgeno es la única forma verdadera de prevenir una anafilaxia alérgica.
Los pacientes alérgicos al látex, ya sea como resultado de una historia categórica o producto de un estudio alergoanestésico, pueden ser intervenidos quirúrgicamente en forma segura en ambiente libre de látex, tomando las medidas previamente enumeradas, que una vez implementadas han hecho disminuir significativamente su incidencia.
-
Otros productos
– Inductores: la incidencia relativa de todos los hipnóticos usados como inductores es de 2,2%. Entre ellos, el propofol y la ketamina comparten 45% de incidencia y el midazolam 10%. Las anafilaxias al etomidato y a la ketamina son extremadamente raras, así como a las otras benzodiacepinas, en que las anafilaxias reportadas han sido más bien al solvente que a la droga misma. Después de los BNM bencilisoquinolínicos, los agentes más implicados en liberación inespecífica de histamina durante la anestesia son los hipnóticos (tiopental y propofol). Primitivamente se relacionó la alergia a algunos alimentos con reacciones al propofol; aunque se han notificado algunos casos de alergia al propofol, ninguno de ellos tenía antecedentes de alergia al huevo, soya o maní[47]. El grupo isopropilo o el anillo de fenol se han sugerido como los determinantes alergénicos en lugar del vehículo lipídico.
– Opioides: la incidencia relativa de todos los opioides usados es de 1,4%. Entre ellos, la morfina y el sufentanil comparten el 42,8% y el remifentanil 14,4%. La morfina y la meperidina son aminas terciarias que producen liberación inespecífica de histamina dosis dependiente, aunque hay reportes de reacciones mediadas por IgE para estos opioides[48]. El fentanil es una fenilpiperidina que no produce liberación no inmunológica de histamina y tiene muy pocos reportes de anafilaxia alérgica. Hay reacciones cruzadas entre los opioides de la misma familia, pero no entre diferentes subclases: fenantrenos (morfina, codeína, tramadol), fenilpiperidinas (alfentanil, fentanilo, sufentanil, remifentanil, meperidina) y difenilheptanos (metadona, propoxifeno)[49]. La reactividad cruzada entre morfina y codeína es frecuente.
– Expansores plasmáticos: en el último estudio publicado, sólo las gelatinas tienen una incidencia del 0,6% del total de las anafilaxias alérgicas, sin embargo, en otros períodos ha habido reacciones a almidones y albúmina. Las gelatinas y los dextranos se asocian más comúnmente con anafilaxia que la albúmina y el hetastarch. No existe reactividad cruzada conocida entre los diferentes coloides. La liberación inespecífica de histamina también constituye el mecanismo esencial de reacciones que ocurren con las gelatinas con puente de urea (Haemaccel)[50].
– Anestésicos locales: contrariamente a lo que siempre se ha supuesto, el riesgo de anafilaxia a los anestésicos locales es extremadamente bajo, tanto del grupo amida como del grupo ésteres. A pesar del gran número de anestesias locales y regionales que se realizan, su incidencia relativa es de sólo 0,4%. Entre ellos, la incidencia es de 50% para la bupivacaína, 33% para la lidocaína y 16,7% para la mepivacaína. Algunas anafilaxias reportadas a los anestésicos locales, así como las reacciones cruzadas entre aquellos de diferente grupo químico, se debieron al uso de preservativos comunes, que con la excepción del metasulfito de sodio que se utiliza en las soluciones adrenalinizadas, han sido eliminados[51]. La mayoría de las reacciones adversas a los anestésicos locales están relacionadas con inyección intravascular inadvertida, absorción sistémica de adrenalina o reacción vagal, no con alergia. Se estima que menos del 1% de todas las reacciones adversas atribuidas a anestésicos locales tienen un mecanismo alérgico[52].
– Clorhexidina: se trata de un antiséptico ampliamente utilizado en la actualidad en el ambiente perioperatorio y, debido al gran aumento de su uso, comenzaron a aparecer reportes esporádicos de alergia, hasta llegar a estar en la actualidad en algunos centros entre la segunda a la cuarta causa más comúnmente diagnosticada de alergia perioperatoria a lo largo de todo el mundo. La falta de reconocimiento de la clorhexidina como alérgeno es una barrera para un adecuado diagnóstico. Los trabajadores de la salud frecuentemente expuestos a clorhexidina también pueden ser sensibilizados[53]. En el estudio NAP 6 hubo 18 casos de anafilaxia alérgica entre 199 estudiados, que representan el 9% de la incidencia relativa. De acuerdo con el uso de clorhexidina en el Reino Unido (2.298.566 exposiciones por al menos una vía), se estima la incidencia de anafilaxia alérgica a la clorhexidina en 0,78 por 100.000 exposiciones. Un solo caso fue fatal; la mayoría de los casos fueron en hombres (16/18); 10 pacientes fueron ASA 2 y 8 ASA 3. La cirugía urológica (6 casos), cardiaca (3 casos) y ortopédica (3 casos) representó la mayoría de los reportes. El anestesista sospechó de clorhexidina en solo cinco (28%) casos. Las manifestaciones clínicas de la anafilaxia a la clorhexidina, al ser administrada por vía cutánea, aparecieron en su mayoría en forma más lenta que otros agentes y fueron de menor intensidad. Aproximadamente, dos tercios de los casos se presentaron con hipotensión y ninguno presentó broncoespasmo. La exposición a la clorhexidina aumenta mediante la absorción a través de las superficies mucosas (uretra, vejiga) y la piel (incisión, epidural), especialmente si la clorhexidina no está seca antes del inicio del procedimiento[54].
– Otros: entre los productos misceláneos que se han demostrado causantes de reacción anafiláctica intraoperatoria están: paracetamol, aprotinina, protamina, diversos AINES, metilprednisolona, ranitidina, ondansentrón, sugammadex, ibuprofeno, protamina, heparina y povidona. Los pacientes con reacciones adversas a povidona yodada no tienen reacciones cruzadas con los medios de contraste yodados.
-
Cuadro clínico
La anafilaxia es un trastorno multisistémico que produce signos y síntomas clínicos centrados en la piel, los sistemas respiratorio, cardiovascular, gastrointestinal y nervioso central. La historia médica del paciente puede influenciar la naturaleza y severidad del cuadro clínico. Los pacientes asmáticos son más propensos al broncoespasmo, mientras que aquellos con enfermedades cardíacas preexistentes o que están en tratamiento con bloqueadores beta adrenérgicos, desarrollan con mayor frecuencia hipotensión severa y shock.
Se han propuesto varios sistemas de clasificación para evaluar la gravedad de los signos y síntomas de la anafilaxia. El más antiguo es propuesto por Ring y Messmer[55] y sigue siendo una buena escala para decidir el tratamiento:
– Grado I: Signos cutaneomucosos generalizados; eritema, urticaria con o sin edema angiogénico.
– Grado II: Daño multivisceral moderado, con signos cutaneomucosos, hipotensión y taquicardia moderada, hiperactividad bronquial (tos, disnea).
– Grado III: Daño multivisceral grave, con riesgo vital, que impone una terapia específica agresiva (taquicardia o bradicardia, arritmias, broncoespasmo, colapso cardiovascular con shock distributivo). Es el típico cuadro de shock anafiláctico. Los signos cutáneos pueden estar ausentes o aparecer sólo después de la recuperación de la presión arterial.
– Grado IV: Colapso cardiocirculatorio. Paro cardiorrespiratorio.
Esta escala ha sufrido múltiples modificaciones en Europa, incluyendo una muy similar propuesta por la SFAR (Société Franqaise d’Anesthésie et de Réanimation). El NAP6 utilizó un sistema de clasificación de gravedad de cinco grados, en que los casos fatales se separaron en un nuevo grado V, presumiblemente para resaltar este grupo y permitir un escrutinio más detallado de estos casos[56].
Las manifestaciones clínicas de una anafilaxia pueden ocurrir en cualquier momento durante la anestesia, pero lo más común es que sea dentro de los primeros minutos después de la inducción de la anestesia. El 77% sobrevienen en el momento de la inducción (relacionadas generalmente con los agentes endovenosos usados durante la preinducción e inducción), el 16% en el transcurso de la anestesia y el 6,5% al final del procedimiento[57] (relacionadas generalmente, aunque no siempre, con el látex, la clorhexidina y el azul patente). La reacciones pueden ocurrir con cierto retardo, dependiendo de varios factores: 1) agentes como los colorantes azules y coloides; 2) vía de administración (cutánea, mucosa, intraperitoneal o subcutánea) que retardan la absorción de agentes como el látex, la clorhexidina o materiales quirúrgicos (glues) y 3) algunos procedimientos, como los ginecológicos, debido a la liberación de partículas del látex al útero después de la inyección de oxitocina, o como traumatológicos, después de la liberación del torniquete de isquemia.
Los signos clínicos iniciales reportados más frecuentemente en los estudios del GERAP son la ausencia de pulso, signos cutáneos, dificultad en la ventilación, desaturación y baja inexplicable de la ETCO2. Puede ser más difícil el diagnóstico cuando está presente un solo signo: la mayoría de las veces shock o signos cutáneos (eritema, urticaria). En el 91% de los casos se trata de una anestesia general y sólo en el 9% de una anestesia regional. En el 3% de los casos la anestesia fue realizada en condiciones de urgencia[58].
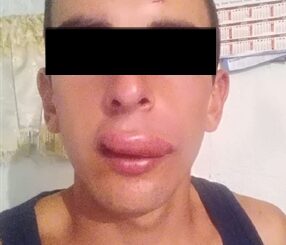
Los signos cutáneos ocurren en el 63% de las anafilaxias alérgicas y en el 93% de las no alérgicas. Las primeras manifestaciones ocurren en la cara, cuello y región anterior del tórax y luego se generalizan rápidamente[59]: desde eritemas y máculo-pápulas hasta edema de Quincke, que puede comprometer la laringe y ocasionar obstrucción de la vía aérea superior en el paciente no intubado o con anestesia regional. En todo caso, la ausencia de signos cutáneos no excluye el diagnóstico de anafilaxia.
Los signos respiratorios ocurren por infiltración edematosa de la mucosa y broncoconstricción, que se manifiesta clínicamente en el 40% de las anafilaxias alérgicas y en el 20% de las no alérgicas. El broncoespasmo es especialmente frecuente en los sujetos asmáticos o con hiperreactividad bronquial. Si ocurre antes de la inducción, se manifiesta con tos seca, disnea y sibilancias; si ocurre antes de la intubación, puede hacerse difícil o imposible la ventilación con mascarilla y si ocurre en el paciente intubado se traduce en un aumento de la presión de la vía aérea y en una inadaptación completa al respirador, que puede incluso dificultar la insuflación manual. Puede ser refractaria al tratamiento clásico, lo que conduce a hipoxemia y/o hipercapnia y, eventualmente, paro cardiaco anóxico. Los signos son confundidos con superficialidad anestésica o intubación esofágica, lo que retrasa el tratamiento de la anafilaxia. Puede ocurrir edema pulmonar como resultado de alteraciones de la permeabilidad capilar, o menos frecuentemente a una disfunción miocárdica.
Los signos cardiovasculares pueden culminar en el colapso, que le confiere el nombre al shock anafiláctico. Puede ser el primer y el único signo clínico observado[60]. Las diferentes manifestaciones clínicas (hipotensión, shock, arritmias y paro cardíaco), ocurren en el 79% de las anafilaxias alérgicas y en el 32% de las anafilaxias no alérgicas. Se describen trastornos de la excitabilidad y conducción (bradicardia, bloqueo AV, bloqueo de rama, extrasistolía y fibrilación ventricular), así como manifestaciones de isquemia o infarto del miocardio (modificaciones del segmento ST). Puede ocurrir paro cardíaco como producto de una manifestación cardiovascular, sin que exista broncoespasmo o signos cutáneos asociados.
Se producen, además, manifestaciones digestivas consistentes en hipersialorrea, náuseas, vómitos y dolores abdominales, producto de la contracción de la musculatura lisa del intestino y de la hipersecreción, y manifestaciones neurológicas consistentes en cefalea, compromiso de conciencia, convulsiones, incontinencia de esfínteres y síndrome piramidal bilateral, producto de anoxia cerebral. Una vez terminado el cuadro puede observarse un retardo del despertar o definitivamente un compromiso de consciencia por hipoxia o anoxia con secuelas graves.
En el estudio NAP6, ya mencionado, la forma clínica de presentación más común fue hipotensión (46%), broncoespasmo (18%), taquicardia (9,8%), desaturación de oxígeno (4,7%), bradicardia (3%), y disminución o ausencia de la curva de capnografía (2,3%). Todos los pacientes estuvieron hipotensos durante el episodio. El inicio fue rápido en el caso de los BNM y antibióticos, pero retardado 30 a 60 minutos con la clorhexidina y el azul patente. Hubo 10 muertes y 40 paros cardíacos, especialmente manifestados como actividad eléctrica sin pulso, a menudo con bradicardia. Los peores resultados de asociaron a la clasificación de ASA, obesidad y a los usuarios de betabloqueadores o inhibidores de la angiotensina convertasa.
-
Shock anafiláctico
La anafilaxia en su fase avanzada puede evolucionar al shock, lo que se entiende como un estado de desequilibrio entre el aporte y demanda de oxígeno a los tejidos y distintos parénquimas, causando hipoperfusión tisular, llevando a alteración en la integridad celular y falla de múltiples órganos, con alta mortalidad asociada. Es así que el shock anafiláctico representa la manifestación más grave de la anafilaxia y es el resultado de la liberación dependiente de IgE de mediadores químicos de los mastocitos y basófilos. Clínicamente se manifiesta con piel fría, pálida y sudorosa, venas subcutáneas colapsadas, hipotensión, taquicardia, oliguria o anuria, defecación involuntaria y pérdida de la conciencia. Puede debutar con un paro cardíaco.
Un estudio sobre muertes por anafilaxia demuestra que el shock circulatorio fue una característica clínica prominente en el 54% de los casos (67 de 125), de hecho, la causa única de muerte en la mitad de ellos; en la otra mitad, se combinó con obstrucción de la vía aérea superior y/o inferior[61].
En un modelo animal, Dewatcher demostró que el shock anafiláctico tiene un perfil distributivo caracterizado por un débito cardíaco preservado y una severa vasoconstricción de la musculatura esquelética, así como un gran metabolismo anaerobio secundario a la rápida disminución de la presión tisular de oxígeno[62].
Sin embargo, la fisiopatología del shock circulatorio en la anafilaxia es compleja, pués incluye además de elementos distributivos, también elementos de shock hipovolémico, cardiogénico e incluso obstructivo. El shock anafiláctico tiene, entonces, componentes variables de shock distributivo debido a la vasodilatación secundaria a la liberación de mediadores, de hipovolemia debido a la fuga de líquido capilar y de shock cardiogénico causado por una disminución de la contractibilidad miocárdica y a veces por una bradicardia que no responde al tratamiento. Aunque varios estudios en animales y observaciones en seres humanos apoyan el concepto de que algunos mediadores de la anafilaxia tienen un efecto directo sobre el miocardio, la contribución de este componente a la morbilidad y mortalidad no han sido bien definidos[63]. La vasoconstricción del territorio pulmonar puede incluso introducir un componente obstructivo al reducir el llenado del ventrículo izquierdo. Esta causalidad múltiple, reduce la posibilidad de compensación del organismo y, probablemente, explica el rápido inicio de una hipotensión severa y el compromiso de consciencia característico de la anafilaxia, que indetectable en el contexto perioperatorio con anestesia general[64].
La primera fase del shock anafiláctico corresponde a la de un shock hiperkinético con taquicardia, disminución de la resistencia vascular sistémica y vasodilatación arteriolar periférica, que produce una disminución del retorno venoso y del débito cardíaco. Esta fase es seguida por otra hipotensiva, con shock hipovolémico que se desarrolla secundariamente a la extravasación transcapilar de plasma. Los efectos de los metabolitos del ácido araquidónico, a través de su acción sobre la musculatura lisa de los vasos sanguíneos y las plaquetas, potencian los efectos circulatorios. El retraso del tratamiento o un manejo incorrecto pueden ocasionar anoxia tisular, que conduce a una falla orgánica múltiple que culmina en un shock irreversible.
Otros mediadores que son liberados por mecanismos no dependientes de IgE también pueden producir shock por diversos mecanismos; por ejemplo, la protamina induce vasoconstricción pulmonar aguda, con un mecanismo claramente obstructivo.
El término “anafilaxia cardíaca”, aunque no muy bien definido en la literatura, puede referirse a: 1) las manifestaciones cardíacas que aparecen conjuntamente o aisladas de los otros signos de anafilaxia; 2) alteración documentada transitoria o persistente del miocardio, función sistólica (varios casos de alergia a la protamina han revelado insuficiencia aguda del ventrículo derecho secundaria a un gran aumento de la resistencia vascular pulmonar atribuida al factor activador de plaquetas) y 3) complicaciones cardíacas graves (como infarto de miocardio, paro cardíaco refractario), después de la reanimación de una anafilaxia con adrenalina.
La anafilaxia puede ser particularmente grave en pacientes con enfermedades cardiovasculares subyacentes, aunque también se ha descrito la presencia de depresión profunda del miocardio en pacientes sanos. Los mediadores de la anafilaxia pueden desencadenar complicaciones cardíacas o más probablemente hacer evidentes enfermedades cardíacas subclínicas. Esto podría explicar por qué los pacientes con enfermedades cardíacas documentadas corren un mayor riesgo de muerte ante una anafilaxia[65]. Cualquiera sea el mecanismo, se ha reportado daño miocárdico con aumento de niveles de troponina[66]. Un espasmo coronario agudo o síndrome de Kounis, puede producirse por activación de los mastocitos cardíacos y ser atribuido erróneamente a una enfermedad coronaria preexistente[67].
-
Diagnóstico
El diagnóstico de anafilaxia se basa en la historia y manifestaciones clínicas. Se ha confeccionado una serie de esquemas diagnósticos con puntajes para cada signo o síntoma, pero en general son discutiblemente aplicables a la anafilaxia perioperatoria[68]. En estas circunstancias el diagnóstico clínico es más difícil, pues algunas de las manifestaciones clínicas pueden estar enmascaradas por el estado de consciencia de la anestesia (ansiedad, disnea dolor abdominal), por los campos quirúrgicos (manifestaciones cutáneas) o por el efecto de alguna de las drogas utilizadas en anestesia que pueden ocasionar hipotensión. Además, la anestesia per se altera los mecanismos compensatorios que un individuo despierto movilizaría durante una anafilaxia. Esta dificultad en el diagnóstico clínico explica en parte la mayor mortalidad de la anafilaxia perioperatoria en comparación con la de los pacientes ingresados en los servicios de urgencias con el mismo cuadro (aproximadamente 0,7/1 millón de personas)[69].
Los síntomas tienden a ser más graves en las reacciones anafilácticas alérgicas. Aunque pueden observarse reacciones anafilácticas alérgicas grado I y II, la mayoría de las reacciones anafilácticas alérgicas son grado II (23%) o III (60%), mientras que la mayoría de las reacciones anafilácticas no alérgicas son grado I (55%) o II (30%)[70]. Del mismo modo, los signos cutáneos son más frecuentes en las reacciones no alérgicas, mientras que el colapso cardiovascular y el broncoespasmo son más frecuentes en las reacciones alérgicas. Hay anafilaxias alérgicas grado I, pero no hay anafilaxias no alérgicas grado IV (Figura 4).
Así mismo, las anafilaxias provocadas por los BNM y antibióticos tienden a ser más graves que las provocadas por el látex (Figura 5). Sin embargo, el cuadro clínico de una anafilaxia alérgica y no alérgica es indistinguible. De este modo, el diagnóstico diferencial no puede hacerse en base a las evidencias clínicas, sino hay que recurrir a evidencias biológicas y alergológicas, con una batería de exámenes, algunos de los cuales deben ser realizados durante o inmediatamente después de la reacción, y otros secundariamente, 4 a 6 semanas después de su presentación. El estudio inmediato comprende la determinación de los niveles de triptasa e histamina sérica para confirmar una reacción anafiláctica y la búsqueda de IgE específicas, destinadas a identificar el agente. El estudio secundario incluye las pruebas cutáneas (prick-tests e intradermorreacciones) y la búsqueda de IgE específicas, ya sea si no se hizo en forma inmediata o si el resultado fue negativo.
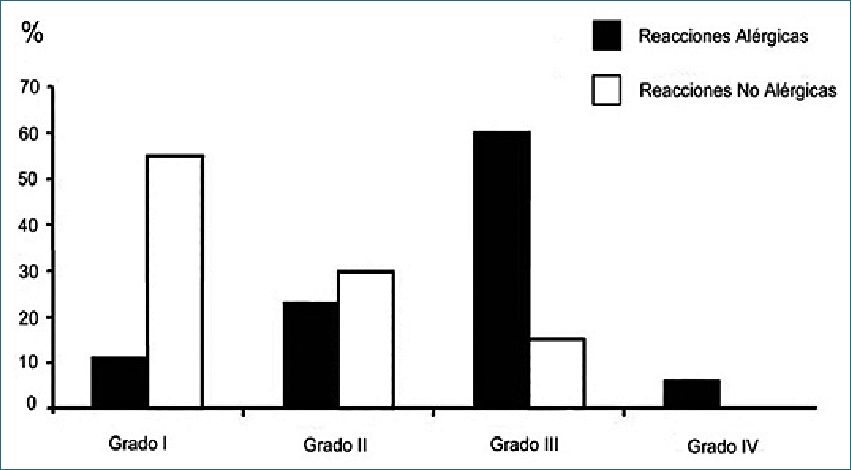
Figura 4. Las reacciones alérgicas tienden a ser más graves que las reacciones no alérgicas de acuerdo con la escala de gravedad de Ring Messmer.
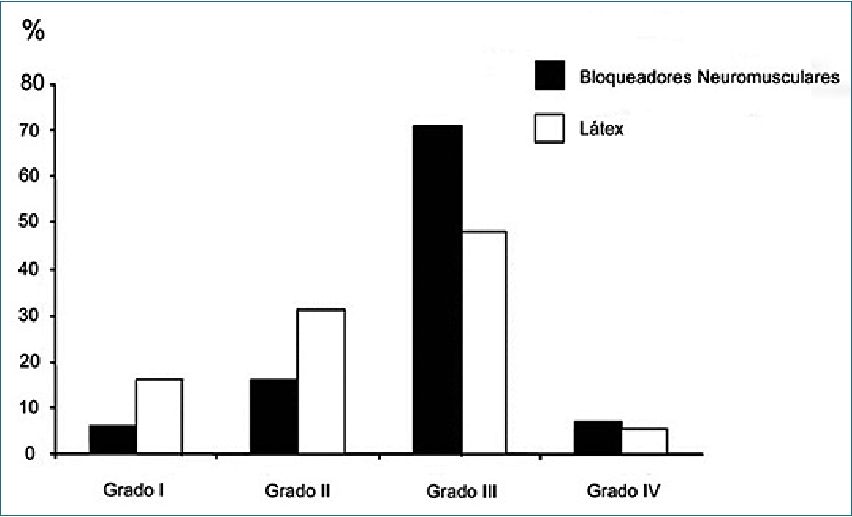
Figura 5. Las anafilaxias a los BNM tienden a ser más graves que las anafilaxias al látex de acuerdo con la escala de gravedad de Ring Messmer.
-
Evidencias biológicas
Las reacciones anafilácticas alérgicas involucran la activación de los basófilos y los mastocitos, mientras que las reacciones anafilácticas no alérgicas, activan solamente a los basófilos. La activación de los mastocitos durante una reacción de hipersensibilidad mediada por IgE, libera proteasas como la triptasa, histamina almacenada y mediadores vasoactivos de neoformación.
La anafilaxia alérgica IgE dependiente, puede ser detectada por la positividad de exámenes in vitro e in vivo y el aumento de los niveles de triptasa sérica durante la reacción. La reacción anafiláctica no alérgica ocurre por una liberación no inmunológica de mediadores o activación del complemento, es IgE independiente y, generalmente, no está asociada a un aumento de la triptasa.
-
1.Niveles de triptasa sérica
La triptasa es una proteasa liberada predominantemente por los mastocitos, que está compuesta de dos formas principales: alfa y beta-triptasa, que son homólogas en 90%. En los sujetos sanos se encuentra en forma de alfa-triptasa, mientras que la beta-triptasa refleja la activación de los mastocitos con liberación de mediadores. Aunque los basófilos también contienen triptasa, su concentración es 300 a 700 veces menor que en los mastocitos de la piel y los pulmones.
Las concentraciones de triptasa es máxima después de 30 minutos de las primeras manifestaciones clínicas y tienen una vida media de 90 minutos. El tiempo óptimo para el muestreo es de 15 a 60 minutos para los grados 1 y 2, y de 30 minutos a 2 horas para los grados 3 y 4. Los resultados siguen siendo positivos durante más de 6 horas en casos graves, e incluso post mortem. Debido a la amplia gama de valores basales normales entre un individuo y otro, es necesaria una muestra extraída después de la resolución completa de la reacción (1 a 3 días) para interpretar pequeños aumentos. Además, se pueden observar mayores concentraciones en la triptasa basal no relacionada con el incidente alérgico en pacientes con mastocitosis sistémica, síndrome de activación de mastocitos o enfermedades hematológicas.
La beta-triptasa, tiene valores normales inferiores a 12 μg·L-1. Los niveles de beta triptasa sérica están significativamente elevados (> 25 μg·L-1) en el 68% de las anafilaxias alérgicas (con una media de 45 pg-L y valores extremos entre 1 y 1.020 μg·L-1), mientras que están aumentadas en sólo el 4% de las anafilaxias no alérgicas (con una media de 6 μg·L-1 y valores extremos entre 1 y 106 μg·L-1 ). La duplicación de una triptasa basal, se considera también un aumento significativo. En el caso de una reacción mucocutánea (grado 1), las concentraciones a menudo son normales y tienden a ser ligeramente elevadas si la reacción sistémica es moderada.
La sensibilidad del examen es de 64%, la especificidad de 89,3%, el valor predictivo positivo es de 92,6% y el negativo de 54,4%. La determinación más ampliamente usada es la InmunoCAP®, que se realiza por radioinmunoensayo y mide la suma de las concentraciones de alfa y beta-triptasa. Los niveles normales de triptasa, no excluyen completamente una reacción inmunológica, pero su positividad aporta una práctica herramienta para distinguir entre una anafilaxia alérgica y no alérgica.
La determinación de otros marcadores de anafilaxia como el factor sérico activador de las plaquetas (PAF) y la PAF-acetilhidrolasa, no han sido validados aún para el diagnóstico de anafilaxia[71].
-
2.Niveles de histamina sérica
El alza de los niveles de histamina es muy fugaz, pues la vida media de eliminación es de sólo 15-20 minutos[72]. Su determinación se realiza por método radioinmunológico. Para reacciones aisladas mucocutáneas (grado 1), el tiempo ideal de toma de muestra debe ser menos de 15 minutos después de la reacción; para reacciones de grado 2 dentro de 30 minutos y para reacciones más severas dentro de 2 horas.
Un aumento de la concentración de histamina sin elevación concomitante de la triptasa puede deberse a una anafilaxia alérgica o no alérgica activada exclusivamente por basófilos; de este modo, no es capaz de determinar el tipo de anafilaxia, pero su precisión diagnóstica aumenta cuando se combinan la determinación de histamina y de triptasa.
La sensibilidad del examen es de 75%, la especificidad de 51%, el valor predictivo positivo es de 75% y el negativo de 51%. Actualmente, es muy poco utilizada por lo fugaz de su positividad y porque la lisis espontánea, o lisis provocada por basófilos dentro del tubo de muestreo, da como resultado lecturas falsas positivas.
-
3.IgE específicas
La búsqueda de IgE específicas en el suero se hace en relación con las drogas que tienen amonio cuaternario (BNM, pentotal, látex, antibióticos betalactámicos y clorhexidina)[73]. Tiene especial utilidad en estos agentes para demostrar una anafilaxia alérgica o cuando surge una dificultad en la interpretación de una prueba cutánea negativa, con un cuadro clínico de una reacción de hipersensibilidad inmediata.
Deben ser detectadas en un estudio inmediato, tomando una muestra en el momento de la reacción y en un estudio secundario que puede tomarse hasta 6 meses después de la reacción. Esto se debe a que hay algunas drogas como los BNM que hacen permanecer sensibilizados a los sujetos hasta 30 años después de una anafilaxia y, otras como los antibióticos, que sensibilizan sólo por un tiempo corto. Este ensayo no es un sustituto para las pruebas cutáneas.
Una serie de técnicas mediante radioinmunoensayo, radioinmunoabsorbencia y radioinmunoluminiscencia pueden detectar IgE específicas. Su especificidad es limitada, pues se ha encontrado IgE a iones de amonio cuaternario en 3%-10% de pacientes sin anafilaxia previa (controles sanos). Para rocuronio, con el método ImmunoCAP, se ha logrado una sensibilidad de más de 85% y una especificidad absoluta[74]. Las técnicas comercializadas para investigar y medir la IgE específica del látex son también extremadamente sensibles; los falsos positivos se pueden registrar y requieren una exploración adicional (es decir, mediciones de IgE de alérgenos recombinantes). Los ensayos de IgE específicos de antibióticos actualmente disponibles están limitados a la penicilina G y V, amoxicilina y ampicilina. No se investigan de forma rutinaria debido a su baja sensibilidad.
-
Evidencias alergológicas
Juntamente con la historia clínica, las pruebas cutáneas son el pilar diagnóstico de una reacción media
da por IgE: el test de escarificación (PST, de prick-skin test) y el test de intradermorreacción (IDT, de intradermoreaction test). En otros países, y en centros muy específicos en Chile se realizan también: el test de provocación, las pruebas de liberación de mediadores y las pruebas de activación de basófilos.
-
1.Pruebas cutáneas
Las pruebas cutáneas deben realizarse 4 a 6 semanas después de la reacción, por profesionales con experiencia en interpretar resultados con agentes usados en anestesia[75]. Deben incluir el conjunto de medicamentos administrados antes de la reacción y el látex[76]. La sensibilidad de las pruebas cutáneas a los BNM es de 94% a 97%[77]. La sensibilidad es mala para barbitúricos, opiáceos y benzodiacepinas y mejora para las gelatinas y penicilinas.
El resultado de una prueba cutánea debe ser claramente positivo o negativo (no dudoso). Si es necesario, debe repetirse la prueba a distancia del sitio elegido inicialmente. La sensibilidad de las pruebas cutáneas puede disminuir con el tiempo, dependiendo de los medicamentos probados. Es bastante estable con los bloqueadores neuromusculares, pero disminuye significativamente con los antibióticos.
Existen sólo pequeñas diferencias en los resultados entre el PST y el IDT; el PST tiene una pequeña tendencia a producir resultados falsos negativos, mientras que el IDT una pequeña tendencia a producir resultados falsos positivos, especialmente cuando las drogas que se ensayan producen una liberación de histamina directa.
El IDT es recomendable cuando se investiga reacciones cruzadas a BNM. Si se ha administrado un BNM, debe realizarse una prueba para el agente implicado y para cada uno de los otros BNM. La mayoría de las veces puede recomendarse otro BNM en base a pruebas cutáneas, pero para una mayor seguridad diagnóstica, es recomendable que la concentración del agente sea aumentada a los máximos permitidos, para disminuir la posibilidad de falsos negativos[78].
La sensibilidad al látex debe ser estudiada con PST usando dos extractos comerciales diferentes[79]. Los colorantes azules, deben ser estudiados con IDT usando una dilución 1:100[80].
-
2.Test de provocación
Consiste en administrar la droga posiblemente causante de la anafilaxia en dosis sucesivamente mayores cada cierto tiempo, en lo posible por la misma vía por la que se supone ocurrió la reacción (excepto neuroaxial), hasta alcanzar la dosis terapéutica o que el paciente tenga alguna manifestación de alergia. Los
test de provocación son el gold standard en la investigación de la alergia a drogas, pero no son muy usados en el diagnóstico, por el peligro de desencadenar anafilaxia. Deben ser hechos bajo estricta supervisión, sólo en centros especializados con monitorización y disponibilidad de recursos de resucitación.
Su mayor utilidad sería: 1) la investigación de alergia perioperatoria en que hay una alta sospecha clínica, pero en que pasa pruebas tradicionales (pruebas cutáneas, in vitro o ambas), conducen a resultados negativos equívocos; 2) para establecer el diagnóstico correcto cuando se sospechan resultados falsos positivos en los tests cutáneos y 3) cuando no existen otras alternativas posibles[81]. Además, se puede usar para diagnosticar o descartar reacciones cruzadas entre compuestos estructuralmente relacionados, como los BNM, pero con un riesgo/beneficio que contraindica su uso en tal situación.
Aunque en algunos países como España y Dinamarca se usa con gran frecuencia, debe tenerse presente el costo/beneficio para el paciente, realizarse en un recinto con posibilidades de reanimación y con un consentimiento informado. En el resto del mundo tiene indicaciones limitadas y está restringido a los anestésicos locales, los antibióticos con anillo betalactámico y el látex[82]. Aunque el examen no se realiza en Chile, en algunos países es el método de elección para el estudio de la sensibilidad a los anestésicos locales debido a que no se dispone de mediciones validadas de IgE específicas para estos fármacos.
-
3.Ensayos celulares
Los ensayos celulares disponibles actualmente son: el ensayo de liberación de histamina, la prueba de activación de basófilos (por citometría de flujo) y la prueba de liberación de leucotrienos (prueba de estimulación de antígenos celulares). No hay evidencia alguna de que estos ensayos sean claramente superiores a los otros dos, aunque los estudios iniciales muestran resultados prometedores para la prueba de activación de basófilos. Estos exámenes sirven para complementar las pruebas cutáneas, pero no son un sustituto; incluso son innecesarias si las pruebas cutáneas o las IgE específicas han sido positivas. Pueden tener indicación: 1) en caso de una reacción grado II o superior con pruebas cutáneas negativas a todas las sustancias sospechosas; 2) cuando los resultados de las pruebas cutáneas son difíciles de interpretar y 3) para el diagnóstico de anafilaxia alérgica a los AINES (con citometría de flujo y prueba de liberación de leucotrienos). En el caso de una reacción de hipersensibilidad inmediata a un BNM, los ensayos celulares pueden confirmar la responsabilidad del agente, incluso cuando las pruebas cutáneas son negativas.
Pruebas de liberación de mediadores
Las pruebas de liberación de mediadores (histamina y leucotrienos) cuantifican la cantidad de mediadores liberados durante la degranulación, especialmente de basófilos, secundaria al contacto con un antígeno. La sensibilidad de la prueba de liberación de histamina es de 71% y la especificidad de 100%[83]. La concordancia entre la prueba de liberación de histamina y la determinación de IgE por QAS-RIA es de 64%.
Este estudio puede efectuarse en una serie de productos utilizados en anestesia: BNM (rocuronio, succinilcolina, atracurio, mivacurio, pancuronio), inductores (propofol), anestésicos locales (lidocaína, bupivacaína, mepivacaína), AINES (ketoprofeno, naproxeno, diclofenaco, metamizol sódico), antibióticos (penicilina, cefalosporinas, ciprofloxacino, etc.), colorantes (azul patente, azul de metileno) y algunas sustancias (látex, clorhexidina, formaldehido, sulfitos). Sin embargo, su uso está validado sólo para el diagnóstico de anafilaxia a BNM y reacciones cruzadas entre ellos.
Prueba de activación de basófilos (por citometría de flujo)
La activación de los basófilos no sólo secreta mediadores cuantificables, sino que desencadena una sobrerregulación de marcadores de superficie, incluidos CD63, CD203c y CD300a, que se puede medir a través de un método in vitro por citometría de flujo, usando anticuerpos monoclonales específicos, conocido como prueba de activación de basófilos (BAT Basophil activation test). La sensibilidad del test de la prueba de activación de basófilos es de 65% y la especificidad de 100%.
Se ha comparado la reactividad cruzada entre BNM determinada por pruebas cutáneas (IDT) y activación de basófilos. De 61 pacientes que tuvieron anafilaxia a un BNM sólo 9 (15%) fueron positivos a ambas pruebas. Las pruebas no fueron concordantes para el pancuronio, cisatracurio y rocuronio, y lo fueron para el vecuronio y la succinilcolina. Nueve pacientes con IDT negativos, posteriormente, toleraron el cisatracurio, y se detectó un falso positivo para la activación de basófilos[84]. Esto demuestra que la utilidad del estudio en identificar el BNM seguro en anestesias subsecuentes necesita una mayor evaluación. Tal vez la negatividad de ambas pruebas aumente la certeza diagnóstica.
Está disponible en muy pocos centros. En los países escandinavos se realiza como parte del esquema de evaluación de una anafilaxia. Probablemente, una
vez que este tipo de análisis haya sido completamente validado, representará una herramienta de diagnóstico interesante en la anafilaxia a BNM y reacciones cruzadas entre ellos[85].
-
Estado actual de las posibilidades diagnósticas en Chile
– La triptasa sérica se determina en muchos hospitales públicos y clínicas privadas.
– En el sector privado, en Clínica Las Condes, Santa María y Alemana, se hace estudio in vivo con pruebas cutáneas para el diagnóstico causal y para determinar la reactividad cruzada de los BNM.
– En el sector público, en el Hospital Clínico de la Universidad de Chile, Clínica Quilín y en el Hospital Barros Luco se cuenta con Centros de Alergia que también lo realizan.
– El Laboratorio de Alergia e Inmunología María Cristina González (ex bioquímica de Clínica Servet) realiza muchas pruebas in vitro en Guardia Vieja 176: especialmente la prueba de liberación de sulfoleukotrieno (test de estimulación de alérgeno celular CAST) para tinturas azules, relajantes musculares y mezclas de ellos, antibióticos, látex y clorhexidina; IgE específicas para antígenos más comunes.
– Existen muy pocos inmunólogos especializados en alergoanestesia, pero a la hora de derivar a los pacientes a un estudio especializado, hay que anexar todos los datos obtenidos en el perioperatorio
– Desconocemos lo que pasa en el resto del país.
-
Tratamiento
El tratamiento de la anafilaxia está basado más en consensos que en evidencias. Cuando hay poca o ninguna evidencia, la experiencia clínica y algunas consideraciones fisiológicas teóricas pasan a tener especial importancia. Debido a que la anafilaxia tiene muy baja incidencia, un ensayo clínico aleatorizado y controlado en humanos sobre el mejor manejo del cuadro es impredecible y puede ser fatal.
Existe una serie de guías de manejo de la anafilaxia, especialmente alimentaria, pero también los últimos años se ha desarrollado una serie de recomendaciones en el contexto perioperatorio. Las guías más ampliamente usadas son las de la AHA (American Heart Association)[86] y la SFAR (Société Franqaise d’Anesthésie et de Réanimation)[87]. También constituyen una buena fuente de información las guías de la AAGBI (Association of Anaesthessic of Great Britain and Ireland)[88], del UK Resuscitation Council[89],
el Australian and New Zealand Anaesthetic Allergy Group[90], las Scandinavian Clinical Practice Guidelines[91] y la World Allergy Organization[92]. Todas ellas, son la base de la evidencia de este texto, adaptado en la medida de lo posible a la realidad nacional.
El tratamiento específico debe ser guiado por la severidad de la reacción (según la escala de Ring y Messmer o sus modificaciones), el historial del paciente, la disponibilidad de agentes o infraestructura (disponibilidad de circulación extracorpórea, ECMO, etc.) y la respuesta al tratamiento de emergencia (adrenalina). Es recomendable contar con un “Carro de Anafilaxia” en el recinto quirúrgico, preparado y disponible para iniciar rápidamente el tratamiento y cumplir con las normas desarrolladas en cada servicio o sociedad de anestesiólogos. Debe incluir una carta de manejo de anafilaxia independiente para adultos y niños, protocolos de infusión de adrenalina, noradrenalina, vasopresina y salbutamol, así como tubos de recolección para medir triptasa sérica.
El objetivo del tratamiento de la anafilaxia es: interrumpir el contacto con el alérgeno, modular los efectos de la liberación de mediadores e inhibir la producción y liberación de mediadores. Incluye 3 etapas: medidas generales, tratamiento de primera línea o primario y tratamiento de segunda línea o secundario. La reacción debe tratarse de inmediato, ya que esto influirá en el pronóstico del paciente, especialmente en el caso de la anafilaxia grado 3 y 4.
-
medidas generales
No son muy distintas de las medidas generales que se toman en otras urgencias que ocurren durante la anestesia, como la hipertermia maligna o la intoxicación por anestésicos locales. Se trata de medidas de sentido común, como avisar al cirujano, considerar en conjunto la posibilidad de abreviar o cancelar la cirugía, poner al paciente en posición de Trendelemburg para aumentar el retorno venoso, iniciar monitorización invasiva según la intensidad del cuadro clínico, administración de oxígeno al 100%, discontinuación de drogas y/o agentes posiblemente incriminados y pedir ayuda.
Un estudio retrospectivo australiano, analizando 223 casos, reportó que la cirugía se pudo proseguir en 104 pacientes (47%) y debió suspenderse en 119 (53%). Los autores muestran que una vez que se ha logrado la reanimación inicial y si se puede reiniciar la reanimación si fuera necesario, el hecho de continuar con la cirugía planificada en los grados I, II y III de anafilaxia alérgica, no se asocia con peores resultados[93]. Durante el estudio NAP6, sin embargo,
después de continuar con la cirugía en algunos casos (todos con cuadro clínico grado III), se decidió optar por la suspensión de la cirugía. En términos generales, parece una buena opción tomar la decisión dependiendo de la severidad de la reacción, las condiciones de salud previa de los pacientes, la edad (el 87% de los pacientes del estudio australiano era ASA I o II y menores de 47 años) y del momento de la cirugía en que ocurra. En acuerdo con el equipo quirúrgico, se puede: suspender, simplificar, acelerar o finalizar la intervención.
Aunque no existe evidencia definitiva que avale que la suspensión del posible agente deje de gatillar la reacción, es una práctica médica habitual. Interrumpir el efecto de mediadores liberados, nuevos o preformados, en respuesta a antígenos y prevenir una futura liberación de mediadores, también debe ser motivo de nuestra preocupación.
La absorción de alérgenos por vías distintas de la endovenosa es más lenta y retarda la aparición del cuadro clínico. En reacciones tardías en relación con la inducción anestésica, o a la administración de antibióticos, sospechar de látex, de clorhexidina y de azul patente como agentes causales.
Sin embargo, esto no debe hacernos olvidar que la piedra angular del tratamiento de la anafilaxia es la adrenalina[94].
-
Tratamiento primario
-
Adrenalina
La adrenalina es la droga de elección y la más eficaz en el tratamiento de la anafilaxia tanto alérgica como no alérgica. Retardar su administración influye negativamente el pronóstico de los cuadros más severos. Administrada en forma precoz es capaz de prevenir o revertir el broncoespasmo y el colapso cardiovascular y mejora la supervivencia[95].
Esto se debe a sus propiedades alfa y beta agonistas. La estimulación de los receptores alfa-1 adrenérgicos produce vasoconstricción de los vasos sanguíneos de capacitancia y resistencia, revirtiendo tanto la vasodilatación como el edema provocado por la anafilaxia. La estimulación de los receptores beta-1 adrenérgicos aumenta la contractilidad miocárdica y el débito cardíaco; la estimulación de los receptores beta-2 adrenérgicos produce broncodilatación, disminuye la resistencia venosa hepática (y como consecuencia aumenta el retorno venoso) y aumenta el AMP cíclico en mastocitos y basófilos, deteniendo la liberación y neoformación de mediadores inflamatorios[96]. A pesar
de esta evidencia, el estudio NAP6 demostró que la adrenalina no fue administrada cuando estuvo indicada en el 19% de los casos (en el 11% sencillamente no fue administrada y en el 8,4% fue administrada tardíamente). Esto significa que la quinta parte de los pacientes no recibieron un correcto tratamiento[97].
Tiene un inicio de acción rápido y una vida media corta con un estrecho margen terapéutico/tóxico. Sus efectos adversos leves son frecuentes y transitorios, pero pasan inadvertidos en el paciente anestesiado: inquietud, mareos, cefalea, palpitaciones, palidez y temblor. Los más graves son infrecuentes, salvo en caso de sobredosis, uso concomitante de otros fármacos o comorbilidad asociada: hipertensión y arritmias. Una línea arterial se recomienda en los grados más severos y una vía central cuando necesita ser administrada en infusión.
Debe considerarse la posibilidad de administrar la adrenalina por vía intramuscular en la parte lateral del muslo si no se ha establecido un acceso venoso o se ha perdido, o mientras se espera la preparación de una infusión. La dosis intramuscular es de 0,3 a 0,5 mg y puede repetirse después de 5-10 minutos, dependiendo de los efectos hemodinámicos[98]. Existen dispositivos autoinyectores dosificados (Epipen®) de 0,15 y 0,3 mg. De manera similar, la vía intratraqueal se puede usar en el paciente intubado, teniendo presente que solo un tercio de la dosis administrada por esta vía llega al torrente sanguíneo. Después de tres bolos de adrenalina vía IV o IM, se debe preparar una infusión y comenzar tan pronto como sea posible con la dosis recomendada según la gravedad del cuadro.
La adrenalina debe ser diluida a concentraciones máximas de 0,1 mg·ml-1. Al ser administrada por vía endovenosa debe ser cuidadosamente titulada y monitorizada con estrecha vigilancia de la respuesta cardiovascular, especialmente en pacientes cardiópatas. En anafilaxias grado I no debe administrarse, pero debe hacerse una observación cuidadosa de modo de iniciar la terapia si el cuadro empeora[99]. En anafilaxias grado II, en las guías inglesas se recomienda dosis iniciales de 50 μg por vía endovenosa que no reportaron casos de taquiarritmias posteriores al tratamiento. En las guías francesas, dependiendo de la severidad de la reacción, se recomienda una dosis en bolo de 10 a 20 μg (0,2 μg·kg-1 ) por vía endovenosa en las anafilaxias grado II; bolos de 100-200 μg ev (repetirlos cada 1-2 min hasta que la presión arterial media sea mayor a 60 mmHg) en reacciones grado III; si la respuesta es insuficiente, las dosis deben aumentarse rápidamente y si es necesario debe instalarse una infusión de 1-4 μg·min-1 (0,05 a 0,1 μg·k-1·min-1), para evitar los bolos repetidos; y en reacciones grado IV se recomiendan bolos de 1-3 mg ev (repetirlos cada 3 min y/o mantener una infusión de 4-10 μg·k-1·min-1 en caso necesario). Las guías australianas recomiendan 20 μg en las reacciones moderadas (grado II) y 100200 μg ev en las severas (grados III y superior). Las guías escandinavas recomiendan dosis iniciales de 10 a 50 pg ev, que pueden aumentarse a 100 μg ev en caso de hipotensión severa.
Como no todos los anestesiólogos están familiarizados con la dosificación endovenosa de adrenalina, estas diferencias pueden crear confusión en situaciones de emergencia. Sería bueno una estandarización de las cifras, pero mientras tanto, las recomendaciones clínicas de la Sociedad de Anestesiología de Chile, ha optado por sugerir las dosis francesas (Tabla 4)[100].
En los pacientes en quienes es necesario el uso de adrenalina en infusión continua, ésta debe mantenerse después de controlado el cuadro clínico, debido a su beneficioso efecto sobre mastocitos y basófilos, deteniendo la liberación y neoformación de mediadores inflamatorios. El nivel de evidencia de esta recomendación es bajo (opinión de expertos). La dosis debe adaptarse a las nuevas condiciones clínicas o eventuales contraindicaciones de cada paciente. La mantención de la infusión permite también el tratamiento inmediato de cuadros clínicos bifásicos o retardados (ver más adelante).
Como en el contexto perioperatorio la anafilaxia puede presentarse directamente como paro cardíaco (especialmente como actividad eléctrica sin pulso), es importante comenzar la reanimación cardiopulmonar inmediata de buena calidad, ciñéndose a las normas de la ACLS. Los casos de recuperación de anafilaxia perioperatoria sugieren que puede requerirse dosis más altas de adrenalina y vasopresores adicionales antes de recuperar un débito cardíaco y presión arterial satisfactorios. Por ejemplo, administrar adrenalina cada 1 o 2 minutos inicialmente si es necesario, con una rápida reposición de volumen y la precoz adición de vasopresores alternativos cuando es refractaria la terapia inicial.
-
Otros agentes es caso de refractariedad a la adrenalina
Aunque no hay unanimidad, en la literatura se acepta que la falta de respuesta a una dosis tan baja como 100 pg de adrenalina puede considerarse una refractariedad al tratamiento. El shock anafiláctico refractario, aunque no está definido, podría caracterizarse por signos clínicos persistentes después de más de 10 minutos de resucitación adecuadamente efectuada (expansión de volumen, más de 1 mg de adrenalina)[101]. Esto implicaría el uso potencial de alternativas a la adrenalina, gatillar la inminente necesidad de realizar una ecografía transtorácica e iniciar las alertas en los equipos de soporte extracorpóreo, cuando se dispone de éstos.
En pacientes con hipotensión refractaria, a pesar de una adecuada administración de adrenalina y reposición de volumen, puede considerarse el uso de varias otras drogas vasoconstrictoras como noradrenalina, fenilefrina, terlipresina (un análogo sintético de la vasopresina), metaraminol o metoxamina[102],[103],[104]. La que está habitualmente más disponible es la noradrenalina, que puede administrarse inmediatamente en forma de infusión a una dosis inicial de 0,1 μg·k-1·min-1. Sin embargo, ningún ensayo controlado aleatorio ha evaluado la epinefrina versus el uso de esos fármacos en el paro cardíaco por anafilaxia.
Hay varios reportes de tratamiento exitoso de anafilaxia severa refractaria a adrenalina en que se ha usado arginina vasopresina (hormona antidiurética) [105]. La razón precisa por la cual la vasopresina aumenta la presión arterial no está del todo clara, pero en estado de shock, puede restaurar el tono vascular por al menos cuatro mecanismos: 1) efecto vasoconstrictor producidos por la activación de los receptores noradrenérgicos arginina vasopresina V1, mediado por la activación de la proteína Gq de la fosfolipasa C; 2) la capacidad de cerrar los canales de K ATP-sensibles; 3) su capacidad de disminuir la concentración intracelular del segundo mensajero del ácido nítrico (guanosina 3’,5’-monofosfato cíclico), que le brinda la propiedad de modulación del óxido nítrico y 4) la potenciación de fármacos adrenérgicos y otros vasoconstrictores[106]. Debido a que una de las causas que contribuye al fracaso de las catecolaminas en el manejo del shock anafiláctico es la desensibilización de los receptores adrenérgicos, teóricamente estos mecanismos parecen una buena alternativa.
| Tabla 4. Dosis de adrenalina recomendadas por la Sociedad de Anestesiología de Chile | |
| Grado
I |
Tratamiento
No administrar adrenalina |
| II | 10 a 20 μg iv en bolo (0,2 μg·kg-1) |
| III | 100-200 μg iv en bolo cada 1-2 minutos
Aumentarse rápidamente es necesario Instalar una infusión de 1-4 μg·min-1 (0,05 a 0,1 μg·kg-1 ·min-1) |
| IV | 1-3 mg iv en bolo cada 3 minutos
Instalar una infusión de 4-10 μg·min-1 |
La vasopresina ha sido integrada a los algoritmos de resucitación del curso Apoyo Vital Avanzado Cardiovascular (ACLS, por su sigla en inglés), como un agente alternativo en el tratamiento del paro cardiaco, así como ha sido utilizada en tratamiento del shock séptico y la hipotensión resistente a estimulantes alfa adrenérgicos secundaria a bypass cardiopulmonar. En un contexto experimental, se ha demostrado que la adición de vasopresina a la epinefrina revierte la vasodilatación inducida por histamina de las arterias mamarias internas humanas[107]. De acuerdo con estos resultados se cree que la adrenalina sólo revierte parcialmente la vasodilatación inducida por los mediadores liberados en la anafilaxia, mientras que la vasopresina, el azul de metileno y los fármacos involucrados en la inhibición del óxido nítrico y la generación de prostaglandinas, conducen a una reversión completa de la relajación de la musculatura lisa vascular.
Durante el shock anafiláctico, la distribución en la acción vasoactiva de la vasopresina parece ser óptima: vasoconstricción de la piel, músculo esquelético, intestino y grasa, con efecto relativo menor de la vasculatura coronaria y renal, y vasodilatación cerebral[108]. La dosis utilizada habitualmente es de 2 U (0,03 mg·k-1), pudiendo llegar a 15 U (0,15 mg·k-1), con una media de 4 U (0,06 mg·k-1). La vasopresina tendría especial indicación en aquellos pacientes refractarios a la adrenalina, en los que la adrenalina se empezó a administrar tardíamente, en pacientes en los que el efecto adrenérgico de la adrenalina o noradrenalina (taquicardia significativa) pudiera resultar en una isquemia miocárdica cerebrovascular o en aquellos en tratamiento con betabloqueadores.
Los pacientes en tratamiento con betabloqueadores tienden a ser resistentes al tratamiento con adrenalina y desarrollar hipotensión refractaria y bradicardia. En estos casos la dosis de adrenalina debe aumentarse sin demora; si no es efectiva la primera dosis de 100 pg, debe seguirse con dosis de 1 mg a intervalos de 1-2 minutos. En caso de una respuesta refractaria persistente debe ser reemplazada por glucagón, por su efecto inótropo y cronótropo no mediado por los receptores beta adrenérgicos[109], cuando hay disponibilidad. La dosis de glucagón es de 1-2 mg IV y se repite cada 5 minutos o una infusión continua de 5-15 μg·min-1 o 0,3-1 mg·h-1. También tiene indicación en pacientes cardiópatas, especialmente coronarios, en que el uso de adrenalina puede asociarse a riesgos mayores.
El azul de metileno, usado históricamente con múltiples propósitos, se ha utilizado para aumentar la presión arterial, en combinación con la adrenalina[110], a modo de complemento en el shock séptico, el shock anafiláctico y el shock inducido por toxinas. El mecanismo de acción del azul de metileno en el aumento de la resistencia vascular sistémica es a través de la inhibición de la guanilil ciclasa y la actividad del óxido nítrico sintetasa. Además, el azul de metileno aumenta la resistencia vascular sistémica y revierte el shock en varios modelos animales[111],[112]. Desde hace tiempo se conoce esta interferencia del azul de metileno con la relajación de la musculatura lisa vascular, mediada por el óxido nítrico, pero se necesitan estudios clínicos para validar su verdadero rol en el tratamiento del shock anafiláctico. Sin embargo, hay numerosos reportes de casos de anafilaxia a distintos fármacos (protamina, aprotinina, penicilina, cefazolina, amlodipino y varios casos a medio de contraste yodado), en que la administración de un bolo de 100 mg de azul de metileno o 1,5 mg^kg seguido de una infusión de 120 mg por un período inespecificado de tiempo, revirtió el cuadro, a pesar de haberse administrado previamente adrenalina, noradrenalina o vasopresina y tratamiento secundario[113]. Desafortunadamente, hasta la fecha, la mayor parte de la literatura que sugiere los efectos beneficiosos de azul de metileno en el tratamiento de la anafilaxia se limita a unos pocos informes de casos.
Desde la comercialización del sugammadex, a partir de 2011 se reportaron una serie de casos en que como última alternativa se usaba sugammadex ante una anafilaxia severa cuyo agente causante se sospechaba era el rocuronio o el vecuronio[114]. Algunos reportes fueron espectaculares, describiéndose que después de varios minutos de RCP convencional, los pacientes recuperaban la presión arterial. El mecanismo por el cual actuaría el sugammadex sería que la quelación del rocuronio o vecuronio produciría la remoción de todas las moléculas de rocuronio o vecuronio circulante e interrumpiría el contacto con el alérgeno. Sin embargo, en una serie de publicaciones recientes se ha reportado que el sugammadex no modificó el curso de la reacción, por lo que se necesita más investigación para demostrar el perfil de seguridad de sugammadex en este aspecto. Un estudio en que se analizó retrospectivamente 13 anafilaxias perioperatorias supuestamente debidas a rocuronio, tratadas “exitosamante” con sugammadex, además del tratamiento primario, demostró resultados equívocos: de los 13 casos sólo en 8 se identificó como causante al rocuronio (3 fueron debidas a un antibiótico y 2 fueron anafilaxias no alérgicas); el estudio de los registros de cada caso mostró que hubo mejoría hemodinámica en sólo 6 casos (46%), 3 de ellos asociados con un agente desencadenante que no era rocuronio[115]. Estos resultados sugieren que el sugammadex no modifica el curso clínico de una anafilaxia a rocuronio y debe repensarse su inclusión en los algoritmos de tratamiento. El estudio NAP6 plantea que el sugammadex no tiene indicación en el tratamiento de una anafilaxia[116].
Por el contrario, en el caso de anafilaxia en que se sospeche de la protamina, el antagonismo directo (a través de interacciones químicas) con heparina, se ha demostrado que puede crear complejos con protamina y aliviar el cuadro. También en experiencia animal se ha demostrado que el azul de metileno previene y trata de manera segura las complicaciones hemodinámicas de la protamina, desde el punto de vista de la función endotelial[117].
El uso de atropina está restringido a los casos de bradicardia severa refractaria a la epinefrina y/o a la terapia con fluidos endovenosos, en los pacientes tratados con betabloqueadores b y en los que puede ocurrir un paro cardíaco en las fases tempranas de la anafilaxia.
-
Soporte de la vía aérea (oxígeno)
La administración de oxígeno en flujos altos por mascarilla de alto flujo (en caso de anestesia regional) o a oxígeno al 100% a través del tubo endotraqueal (en pacientes sometidos a anestesia general, con síntomas respiratorios o hipoxemia), aumenta la entrega de O2, compensando el aumento del consumo de O2. También se benefician de oxigenoterapia los pacientes con inestabilidad hemodinámica. En reacciones grado I puede ser la única medida necesaria.
En caso de pacientes no intubados que presenten anafilaxia durante el curso de una anestesia regional, se debe evaluar cuidadosamente le costo/beneficio de intubarlos, pues debe evitarse la administración de nuevas drogas liberadoras de histamina (succinilcolina, propofol), que podrían necesitarse para instrumentar la vía aérea de personas reactivas. Sin embargo, es ineludible el soporte de la vía aérea con intubación traqueal y ventilación mecánica en reacciones grado III y IV, así como en pacientes con edema progresivo de la vía aérea superior.
-
Reanimación agresiva con fluidos endovenosos
La administración de fluidos debe iniciarse en forma precoz, debido a la gran extravasación de plasma al espacio intersticial por el aumento de la permeabilidad vascular, especialmente en pacientes que se mantienen hipotensos a pesar de la administración de las dosis recomendadas de adrenalina. La pérdida de volumen puede afectar hasta el 70% del volumen sanguíneo. Pueden ser necesarios grandes volúmenes de solución salina isotónica (suero fisiológico o Ringer lactato) en los primeros 5 a 10 minutos después de la reacción. Se aconseja infundirlos utilizando 2 vías venosas de grueso calibre. En el caso de una anafilaxia con compromiso respiratorio importante o que responde precozmente al tratamiento, el manejo de fluidos debe ser menos agresivo.
El volumen aportado depende de la situación clínica; una hipotensión persistente requiere un enfrentamiento más agresivo con múltiples bolos de fluidos utilizando aceleradores de suero. Inicialmente se administran cristaloides (20 ml-kg-1), pero si hay una respuesta débil o nula a los cristaloides, se incluyen expansores plasmáticos o coloides (10 ml-kg1), especialmente cuando el volumen de cristaloides administrados excede los 30 ml-kg-1. Si ya se había infundido un coloide antes de que aparecieran signos de anafilaxia, ese tipo de coloides no se debe usar para la reanimación, ya que debe considerarse un alérgeno potencial.
El estudio NAP6, demostró que en 1 de cada 5 casos no se repuso volumen a la velocidad adecuada. Esto concuerda con un estudio francés previo sobre mortalidad perioperatoria por anafilaxia a BNM, lo que enfatiza la importancia de tener presente el llenado vascular para mantener la hemodinamia, juntamente con la administración de adrenalina[118].
-
Iniciar el estudio inmediato
Aunque no forma parte del tratamiento propiamente tal, una vez compensado el paciente debe comenzar la aproximación diagnóstica, mediante la toma de exámenes de laboratorio que servirán para demostrar si el cuadro clínico se trató de una afilaxia alérgica o no alérgica (triptasa) y del agente causante (IgE específica).
La muestra de triptasa requiere 5 ml de sangre en un tubo seco o con EDTA (ácido etilendiamino tetra-acético). El mismo frasco puede utilizarse para determinación de niveles de histamina, pero ya se ha mencionado sus limitaciones. En anafilaxias grado III y IV las muestras pueden ser extraídas hasta 6 horas después de ocurrido el evento.
La determinación de IgE requiere 7 ml de sangre en un tubo seco. Los tubos deben enviarse al laboratorio local dentro de 2 horas. Cuando esto no sea posible, los valores positivos se pueden medir en muestras refrigeradas a 4 °C hasta 12 horas. La muestra debe ser tomada en el momento de la reacción en el estudio primario, y hasta los 6 meses después en el secundario.
-
Tratamiento secundario
-
Broncodilatadores
En caso de broncoespasmo sin hipotensión arterial, se recomienda administrar un inhalador de dosis medida con 1-2 puffs de una agonista de los receptores adrenérgicos b2, como el salbutamol, o una nebulización de adrenalina. Si la respuesta es refractaria o en pacientes con síntomas severos, se recomienda un bolo iv de 100-200 μg de salbutamol y si es necesario una infusión continua de 5-25 μg·min-1. Síntomas de aún mayor severidad pueden necesitar una infusión continua de adrenalina, independientemente del estado hemodinámico del paciente. El sulfato de magnesio puede ser útil en casos de broncoespasmo refractario a otros tratamientos[119].
-
Corticoisteroides
Aunque no hay evidencia de su utilidad en anafilaxia aguda, su uso en otras reacciones alérgicas ha llevado a su incorporación en el manejo de este cuadro. Debido a su lento inicio de acción, son considerados parte del tratamiento secundario. Los corticosteroides pueden atenuar las manifestaciones tardías del shock anafiláctico.
No existe evidencia sobre las dosis óptimas a utilizar. En adultos se utilizan 200 mg de hidrocortisona iv en bolo (1-5 mg·kg-1) cada 6 horas, o 1 a 2 mg·kg-1 iv en bolo cada 6 horas.
Tampoco existe evidencia de que la premedicación con una dosis única de un corticosteroide sea eficaz para prevenir una reacción de hipersensibilidad inmediata alérgica. Los pacientes asmáticos que reciben tratamiento a largo plazo con corticosteroides muestran una incidencia disminuida de hiperreactividad bronquial durante la anestesia, por lo que tampoco se justifica su premedicación.
-
Antihistamínicos
Los bloqueadores H1 actúan lenta y principal mente aliviando los síntomas cutáneos, más que los problemas hemodinámicos y respiratorios, que son los que determinan que la anafilaxia se considere una emergencia vital, por lo que se consideran como parte del tratamiento de segunda línea para anafilaxia.
Aunque la premedicación no es efectiva en la prevención de reacciones de hipersensibilidad inmediata alérgica, es posible que los efectos de la unión de la histamina a sus receptores H1 se reduzcan mediante la administración previa de un antihistamínico H1. El uso de bloqueadores de los receptores H1 ha reducido la incidencia y la intensidad de las reacciones de hipersensibilidad inmediata no alérgica. Se recomienda el bloqueo H1 con 10 mg iv en bolo de clorfenamina.
La combinación de un antihistamínico H1 y H2 no es superior a un antihistamínico H1 solo para prevenir los efectos periféricos de la histamina, por lo que el uso de famotidina en forma concomitante actualmente no se justifica.
-
Posoperatorio
Los pacientes deben ser trasladados a una unidad de cuidados intensivos o de cuidados intermedios según los protocolos de cada institución, para observación, soporte hemodinámico y soporte respiratorio. No existe evidencia que sugiera la duración que debe tener esta estadía. Se sugiere que sea proporcional a la severidad de la reacción inicial, con un mínimo de 4 a 6 horas en reacciones que responden rápidamente a tratamiento. Aquellos pacientes que presentaron manifestaciones clínicas de hiperreactividad de la vía aérea deben permanecer más tiempo, pues la mayoría de las muertes ocurren en ese grupo.
La mayoría de las reacciones anafilácticas son únicas (unifásicas) y responden rápidamente y bien al tratamiento con adrenalina. Sin embargo, algunos pacientes desarrollan reacciones rolongadas con una respuesta incompleta, o empeoran al intentar interrumpir la infusión de adrenalina. Otros pacientes muestran recaída tras la aparente resolución de los síntomas y signos; este cuadro es conocido como anafilaxia bifásica y se produce en 1%-5% de los casos[120]. Los intervalos reportados entre el inicio de la reacción y el inicio de la segunda fase van en rango de 1 a 72 horas tras la recuperación completa.
No se han reconocido predictores clínicos capaces de identificar grupos de pacientes con mayor riesgo de presentar reacciones bifásicas, sin embargo, algunos estudios han sugerido una mayor predisposición en los pacientes que requieren mayores dosis de adrenalina para controlar los síntomas iniciales o aquello en que se ha demorado el inicio de su administración.
Referencias
1. Sabato V, Platt P, Garcez T, Cooke P. Suspected perioperative allergic reactions: nomenclature and terminology. Br J Anaesth 2019; 123: e13-e15. https://doi.org/10.1016/j.bja.2019.05.001
2. Johansson SGO, Blieber T, Dahl R et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol 203; 113: 832-6. https://doi.org/10.1016/j.jaci.2003.12.591
3. Johansson, SGO, Hourihan JO, Bousquet J et al. EAACI (the European Academy of Allergology and Cinical Immunology) nomenclature task force A revised nomenclature for allergy. An EAACI position statement from the EAACI nomenclature task force. Allergy 2001; 56: 813-24. https://doi.org/10.1034/j.1398-9995.2001.t01-1-00001.x
4. Gaeta TJ, Clark S, Pelletier AJ et al. National study of US emergency department visits for acute allergic reactions, 1993 to 2004. Ann Allergy Asthma Immunol 2007; 98: 360-5. https://doi.org/10.1016/S1081-1206(10)60883-6
5. Bustamante R, Luxoro C. Anafilaxia perioperatoria: cuadro clínico y diagnóstico. Rev Chil Anest 2010; 39: 36-52.
6. Guéant JL, Aimone-Gastin I, Namouf F et al. Diagnosis and pathogenesis of the anaphylactic and anaphilactoid reactions to anaesthetics. Clin Exp Allergy 1998;28 (S4):65-70.
7. Weiss ME. Drug allergy. Med Clin North Am 1992; 76: 857-82. https://doi.org/10.1016/S0025-7125(16)30329-7
8. Mertes PM, Dewachter P, Laxenaire|MC. Complications anaphylactiques et anaphylactoïdes de l’anesthésie génerale. Encycl Méd Chir, Anesthésie-Réanimation 2003; 36: 410-A-10, 15p. https://doi.org/10.1016/S0246-0289(03)00098-7
9. Hedin H, Richter W. Pathomechanisms of dextran-induced anaphylactoid/anaphylactic reactions in man. Int Arch Allergy Appl Immunol 1982; 68: 122-6. https://doi.org/10.1159/000233080
10. Simons. Anaphylaxis. Allergy Clin Immunol 2010; 125: S161-S168. https://doi.org/10.1016/j.jaci.2009.12.981
11. Marone G, Stellato C, Mastronardi P, Mazzarella B. Mechanism of activation of human mast cells and basophils by general anesthetic drugs. Ann Fr Anesth Réanim 1993; 12: 116-25. https://doi.org/10.1016/S0750-7658(05)81020-2
12. Findlay SR, Dvorak AM, Kagey-Sobotka A, Lichtenstein LM. Hyperosmolar triggering of histamine release from human basophils. J Clin Invest 1981; 67:1 604-13. https://doi.org/10.1172/JCI110195
13. Renz CL, Laroche D, Thurn JD et al. Tryptase levels are not increased during vancomycin-induced anaphylactoid reactions. Anesthesiology 1988; 89: 620-5. https://doi.org/10.1097/00000542-199809000-00010
14. Lorenz W, Doenicke A. Anaphylactoid reactions and histamine release by barbiturate induction agents: clinical relevance and pathomechanisms. Anesthesiology 1985; 63: 351-2. https://doi.org/10.1097/00000542-198510000-00001
15. Mc Hale SP, Konieczko K. Anaphylactoid reaction to propofol. Anaesthesia 1992;47:864-5. https://doi.org/10.1111/j.1365-2044.1992.tb03150.x
16. Lieberman P, Camargo CA Jr, Bohlke K al. Epidemiology of anaphylaxis: findings of the American College of Allergy, Asthma and Immunology Epidemiology of Anaphylaxis Working Group. Ann Allergy Asthma Immunol 2006; 97: 596-602. https://doi.org/10.1016/S1081-1206(10)61086-1
17. Mertes PM, Alla F, Tréchot P et al. Anaphylaxis during anesthesia in France: an 8-year national survey. J Allergy Clin Immunol. 2011; 128: 366-73. https://doi.org/10.1016/j.jaci.2011.03.003
18. Zaitsu M, Narita S, Lambert KC et al. Estradiol activates mast cells via a non-genomic estrogen receptor-alpha and calcium influx. Mol Immunol 2007; 44: 1977-85. https://doi.org/10.1016/j.molimm.2006.09.030
19. Cook TM, Harper NJN, Farmer L et al. Anaesthesia, surgery, and life-threatening allergic reactions: protocol and methods of the 6th National Audit Project (NAP6) of the Royal College of Anaesthetists. Br J Anaesth 2018; 121: 159-171. https://doi.org/10.1016/j.bja.2018.04.001
20. Murat I. Anaphylactic reactions during paediatric anaesthesia: Results of the survey of the French Society of Paediatric Anaesthetists (ADARPED) 1991-1992. Paediatr Anaesth 1993; 3: 339-43. https://doi.org/10.1111/j.1460-9592.1993.tb00101.x
21. Lienhart A, Auroy Y, Pesquignot F et al. Survey of anesthesia-related mortality in France. Anesthesiology 2006; 105: 1087-97. https://doi.org/10.1097/00000542-200612000-00008
22. Fisher MM, Baldo BA. The incidente and clinical features of anaphylactic reactions during anaesthesia in Australia. Ann Fr Anest Réanim 1993; 12: 97-104. https://doi.org/10.1016/S0750-7658(05)81016-0
23. Mitsuhata H, Matsumoto S, Hasegawa J. The epidemiology and clinical features of anaphylactic and anaphylactoid reactions in the perioperative period in Japan. Masui 1992; 41: 1664-9.
24. Light KP, Lovell AT, Butt H et al. Adverse effects of neuromuscular blocking agents based on yellow card reporting in the U.K.: are there differences between males and females? Pharmacoepidemiol Drug Saf 2006; 15: 151-60. https://doi.org/10.1002/pds.1196
25. Gibbs NM, Sadleir PH, Clarke RC et al. Survival from perioperative anaphylaxis in Western Australia 2000-2009. Br J Anaesth 2013; 111: 589-93. https://doi.org/10.1093/bja/aet117
26. Kemp HI, Cook TM, Thomas M, Harper NJN. UK anaethetists’ perspectives and experiences of severe perioperative anaphylaxis: NAP6 baseline survey. Br J Anaesth 2017; 119: 132-9. https://doi.org/10.1093/bja/aex124
27. Marshall SD, Sanderson P, McIntosh CA, Kolawole H. The effect of two cognitive aid designs on team functioning during intra-operative anaphylaxis emergencies: a multi-centre simulation study. Anaesthesia 2016; 71: 389-404. https://doi.org/10.1111/anae.13332
28. Jacobson J, Lindekaer AL, Ostergaard HT et al. Management of anaphylactic shock evaluated using a full-scale anaesthesia simulator. Acta Anaesthesiol Scand 2001; 45: 315-9. https://doi.org/10.1034/j.1399-6576.2001.045003315.x
29. Takazawa T, Mitsuhata H, Mertes PM. Sugammadex and rocuronium-induced anaphylaxis. J Anesth 2016; 30: 290-7. https://doi.org/10.1007/s00540-015-2105-x
30. Mertes PM, Alla F, Tréchot P et al. Anaphylaxis during anesthesia in France: An 8-year national survey. J Allergy Clin Immunol 2011; 128: 366-73. https://doi.org/10.1016/j.jaci.2011.03.003
31. Tacquard C, Collange O, Gomis P et al. Anaesthetic hypersensitivity reactions in France between 2011 and 2012: the 10th GERAP epidemiologic survey. Acta Anaesthesiol Scand 2017; 61: 290-9. https://doi.org/10.1111/aas.12855
32. Harper NJN, Cook TM, Garcez T, et al. Anaesthesia, surgery, and life-threatening allergic reactions: epidemiology and clinical features of perioperative anaphylaxis in the 6th National Audit Project (NAP6). Br J Anaesth 2018; 121: 159-71. https://doi.org/10.1016/j.bja.2018.04.014
33. Jooste E, Klafter F, Hirshman CA et al. A mechanism for rapacuronium-induced bronchospasm: M2 muscarinic receptor antagonism. Anesthesiology 2003; 98: 906-11. https://doi.org/10.1097/00000542-200304000-00017
34. Fisher MM, Merefield D, Baldo B. Failure to prevent an anaphylactic reaction to a second neuromuscular blocking drug during anaesthesia. Br J Anaesth 19991; 82: 770-3. https://doi.org/10.1093/bja/82.5.770
35. Mertes PM, Aimone-Gastin I, Guéant-Rodríguez RM et al. Hypersensitivity reactions to neuromuscular blocking agents. Curr Pharm Des 2008; 14: 2809-25. https://doi.org/10.2174/138161208786369704
36. Beaussier M, Raucoules-Aime M. Indications for curarization for intratracheal intubation. Scheduled surgery, patients without particular risk during the preanesthetic examination. Ann Fr Anesth Réanim 2000; 19 (Sup.2): S378-S386.
37. Woods AW, Allam S. Tracheal intubation without the use of neuromuscular blocking agents. Br J Anaesth 2005; 94: 150-8. https://doi.org/10.1093/bja/aei006
38. Neugut AI, Ghatak AT, Miller RL. Anaphylaxis in the United States: an investigation into its epidemiology. Arch Internal Med 2001; 161: 15-21. https://doi.org/10.1001/archinte.161.1.15
39. Solensky R. Hypersensitivity reactions to beta-lactam antibiotics Rev Clin Allergy Inmunol 2003; 24: 201-19. https://doi.org/10.1385/CRIAI:24:3:201
40. Barthelmes L, Goyal A, Newcombe RG et al. Adverse reactions to Patent Blue V dyedthe NEW START and ALMANAC experience. Eur J Surg Oncol 2010; 36: 399-403. https://doi.org/10.1016/j.ejso.2009.10.007
41. Brenet O, Lalourcey L, Queinnec M et al. Hypersensitivity reactions to Patent Blue V in breast cancer surgery: a prospective multicentre study. Acta Anaesthesiol Scand 2013; 57: 106-11. https://doi.org/10.1111/aas.12003
42. Hunting AS, Nopp A, Johansson SGO et al. Anaphylaxis to Patent Blue V. I. Clinical aspects. Allergy 2010; 65: 117-23. https://doi.org/10.1111/j.1398-9995.2009.02192.x
43. Takahashi Y, Hara K, Sata T. A case of prolonged reduction in arterial oxygen saturation measured by pulse oxymetry after administering Patent Blue in an elderly patient. Masui 2013; 62: 422-4.
44. Harboe T, Guttormsen AB, Irgens A, et al. Anaphylaxis during anesthesia in Norway: a 6-year single center follow-up study. Anesthesiology 2005: 102: 897-903. https://doi.org/10.1097/00000542-200505000-00006
45. Dewachter P, Kopac P, Laguna, Laguna JJ et al. Anaesthetic management of patients with pre-existing allergic conditions: a narrative review. Br J Anaesth. 2019; 123: e65-e81. https://doi.org/10.1016/j.bja.2019.01.020
46. Luxoro C, Bustamante R. Anafilaxia perioperatoria: Tratamiento y manejo alergoanestésico. Rev Chil Anest 2010; 39: 53-68.
47. Asserhoj LL, Mosbech H, Kroigaard M, Garvey LH. No evidence for contraindications to the use of propofol in adults allergic to egg, soy or peanut. Br J Anaesth 2016; 116: e77e82 https://doi.org/10.1093/bja/aev360
48. Fisher MM, Harle DG, Baldo BA. Anaphylactoid reactions to narcotic analgesics. Clin Rev Allergy 1991; 9: 309-18.
49. Ebo DG, Fisher MM, Hagendorens MM et al. Anaphylaxis during anaesthesia: diagnostic approach. Allergy 2007; 62: 471-87. https://doi.org/10.1111/j.1398-9995.2007.01347.x
50. Laxenaire MC, Charpentier C, Feldman L. Anaphylactoid reactions to colloid plasma substitutes: incidence, risk factors, mechanisms. A french multicenter prospective study. Ann Fr Anest Réanim 1994; 13: 301-10. https://doi.org/10.1016/S0750-7658(94)80038-3
51. Schwartz HJ, Sher TH. Bisulfite sensitivity manifesting as allergy to local dental anesthesia. J Allergy Clin Immunol 1985; 75: 525-7. https://doi.org/10.1016/S0091-6749(85)80027-0
52. Fisher MM, Bowey CJ. Alleged allergy to local anaesthetics. Anasth Intensive Care 1997; 25: 611-4. https://doi.org/10.1177/0310057X9702500602
53. Rose MA, Garcez T, Savic S, Garvey LH. Chlorhexidine allergy in the perioperative setting: a narrative review. Br J Anaesth. 2019; 123: e95-e103. https://doi.org/10.1016/j.bja.2019.01.033
54. Garvey LH, Kroigaard M, Poulsen LK et al. IgE-mediated allergy to chlorhexidine. J Allergy Clin Immunol 2007; 120: 409-15. https://doi.org/10.1016/j.jaci.2007.04.029
55. Ring J, Messmer K. Incidence and severity of anaphylactoid reactions to colloid volume substitutes. Lancet 1977; 1: 466-9. https://doi.org/10.1016/S0140-6736(77)91953-5
56. Grarvey LH, Hunter JM. Changing culprits in perioperative anaphylaxis. Br J Anaesth 2018; 121 114-117. https://doi.org/10.1016/j.bja.2018.05.008
57. Mertes PM, Laxenaire MC. Allergy and anaphylaxis in anaesthesia. Minerva Anestesiol 2004; 70: 28591.
58. Mertes PM, Laxenaire MC. Épidemiologie des reactions anaphylactiques et anaphylactoïdes peranesthésiques en France: Septième enquête multicentrique (Janvier 2001-Décembre 2002). Ann Fr Anesth Réanim 2004; 23: 1133-43. https://doi.org/10.1016/j.annfar.2004.10.013
59. Mertes PM, Laxenaire MC, Alla F. Anaphylactic and Anaphylactoid Reactions Occurring during Anesthesia in France. Anesthesiology 2003; 99: 536-45. https://doi.org/10.1097/00000542-200309000-00007
60. Laxenaire MC, Mertes P. Anaphylaxis during anaesthesia. Results of a 2 year survey in France. Br J Anaesth 2001; 87; 549-58. https://doi.org/10.1093/bja/87.4.549
61. Pumphrey RS. Lessons for management of anaphylaxis from a study of fatal reactions. Clin Exp Allergy 2000; 30: 1144-50. https://doi.org/10.1046/j.1365-2222.2000.00864.x
62. Dewatcher P, Jouan-Hureaux V, Franck P et al. Anaphylactic Shock: A Form of Distributive Shock without inhibition of Oxygen Consumption. Anesthesiology 2005; 103: 40-9. https://doi.org/10.1097/00000542-200507000-00010
63. Marone G, Bova M, Detoraki A et al. The human heart as a shock organ in anaphylaxis. Novartis Found Symp 2004; 257: 133-49. https://doi.org/10.1002/0470861193.ch11
64. Brown SGA. The Pathophysiology of Shock in Anaphylaxis. Immunol Allergy Clin N Am 2007; 27: 165-75. https://doi.org/10.1016/j.iac.2007.03.003
65. Reitter M, Petitpain N, Latarche C et al. Fatal anaphylaxis with neuromuscular blocking agents: a risk factor and management analysis. Allergy 2014; 69: 954-9. https://doi.org/10.1111/all.12426
66. Kounis NG, Mazarakis A, Bardousis C, Patsouras N. The heart and coronary arteries as primary target in severe allergic reactions: cardiac troponins and the Kounis hypersensitivity-associated acute coronary syndrome. Int J Cardiol 2015; 198: 83-4. https://doi.org/10.1016/j.ijcard.2015.06.142
67. Kounis NG, Mazarakis A, Tsigkas G et al. Kounis syndrome: a new twist on an old disease. Future Cardiol 2011; 7: 805-24. https://doi.org/10.2217/fca.11.63
68. Hopkins PM, Cooke PJ, Clarke RC et al. Consensus clinical scoring for suspected perioperative immediate hypersensitivity reactions. Br JAnaeth 2019; 123: e29-e37. https://doi.org/10.1016/j.bja.2019.02.029
69. Simons FER, Ebisawa M, Sanchez-Borges M et al. 2015 update of the evidence base: World Allergy Organization anaphylaxis guidelines. World Allerg Org J 2015; 8: 32. https://doi.org/10.1186/s40413-015-0080-1
70. Mertes PM, Laxenaire MC. Épidemiologie des reactions anaphylactiques et anaphylactoïdes peranesthésiques en France: Septième enquête multicentrique (Janvier 2001-Décembre 2002). Ann Fr Anesth Réanim 2004; 23: 1133-43. https://doi.org/10.1016/j.annfar.2004.10.013
71. Tomasiak-Łozowskaa MM, Klimeka M, Lis A et al. Markers of anaphylaxis a systematic review. Adv Med Sci 2018; 63: 265-77. https://doi.org/10.1016/j.advms.2017.12.003
72. Laroche D, Dubois F, Gérard J et al. Radioimmunoassay for plasma histamine: a study of false positive and false negative values. Br J Anaesth 1995; 74: 430-7. https://doi.org/10.1093/bja/74.4.430
73. Mertes PM, Laxenaire MC, Lienhart A et al. Reducing the risk of anafilaxis during anaesthesia: guidelines for clinical practices. J Invest Alergol Clin Inmunol 2005; 15: 1087-97.
74. Ebo DG, Venemalm L, Bridts CH et al. Immunoglobulin E antibodies to rocuronium: a new diagnostic tool. Anesthesiology 2007; 107: 253-9. https://doi.org/10.1097/01.anes.0000270735.40872.f2
75. Soetsens FM. Anaphylaxis during anaesthesia: diagnosis and treatment. Acta Anaesthesiol Belg 2004; 55: 229-37.
76. Kroigaard M, Garvey LH, Menne T et al. Allergic reactions in anesthesia: are suspected causes confirmed on subsequent testing? Br J Anaesth 2005; 95: 468-71. https://doi.org/10.1093/bja/aei198
77. Laxenaire MC, Moneret-Vautrin DA. Allergy and anaesthesia. Curr Opin Anaesthesiol 1992; 5: 436-41. https://doi.org/10.1097/00001503-199205030-00026
78. Fisher M, Baldo BA. Anaphylaxis during anaesthesia: current aspects of diagnosis and prevention. Eur J Anaesthesiol 1994; 11: 263-84.
79. Turjanmaa K, Palosuo T, Alenius H et al. Latex allergy diagnosis: in vivo and in vitro standarization of a natural rubber latex extract. Allergy 1997; 52: 41-50. https://doi.org/10.1111/j.1398-9995.1997.tb02544.x
80. Mertes PM, Malinovsky JM, Mouton-Faivre C et al. Anaphylaxis to dyes during the perioperative period: reports of 14 clinical cases. J Allergy Clin Immunol 2008; 122: 348-52. https://doi.org/10.1016/j.jaci.2008.04.040
81. Garvey LH, Ebo DG, Krøigaard M et al. The use of drug provocation testing in the investigation of suspected immediate perioperative allergic reactions: current status. Br J Anaesth 2019; 123: e126-e134. https://doi.org/10.1016/j.bja.2019.03.018
82. Allombert-Marechal G, Vervloet D, Arnaud A et al. Provocation tests to local anesthetics. Presse Med 1984; 13: 1903-4.
83. Mata E, Guéant JL, Moneret vautrin DA et al. Clinical evaluation of in vitro leukocyte histamine release in allergy to muscle relaxant drugs. Allergy 1992; 47: 471-6. https://doi.org/10.1111/j.1398-9995.1992.tb00667.x
84. Li J, Best OG, Rose MA et al. Assessing cross-reactivity to neuromuscular blocking agents by skin and basophil activation tests in patients with neuromuscular blocking agent anaphylaxis. Br J Anaesth. 2019; 123: e144-e150. https://doi.org/10.1016/j.bja.2019.03.001
85. Mertes PM, Lambert M, Guéant-Rodríguez RM et al. Perioperative Anaphilaxis. Immunol Allergy Clin N Am 2009; 29: 429-51. https://doi.org/10.1016/j.iac.2009.04.004
86. AHA Part 10.6: Anaphylaxis. Circulation 2005; 112: V-143-IV-145. https://doi.org/10.1161/CIRCULATIONAHA.105.166568
87. Mertes PM, Malinovsky JM, Jouffroy L et al. Reducing the risk of anaphylaxis during anesthesia: 2011 updated guidelines for clinical practice. J Investig Allergol Clin Immunol. 2011; 21: 442-53.
88. Harper NJN, Dixon T, Dugue, et al. Guidelines suspected anaphylactic reactions associated with anaesthesia. Anaesthesia 2009; 64: 199-211. https://doi.org/10.1111/j.1365-2044.2008.05733.x
89. Emergency treatment of anaphylactic reactions: guidelines for healthcare providers. UK: Resuscitation Council; 2016. Acceso el 14 de julio de 2019 en: https://www.resus.org.uk/anaphylaxis/emergency-treatment-of-anaphylactic-reactions/
90. Kolawole H, Marshall SD, Crilly H et al. Australian and New Zealand Anaesthetic Allergy Group/ Australian and New Zealand College of Anaesthetists Perioperative Anaphylaxis Management Guidelines. Anaesth Intensive Care 2017; 45: 151-8. https://doi.org/10.1177/0310057X1704500204
91. Kroigaard M, Garvey LH, Gillberg L et al. Scandinavian Clinical Practice Guidelines on the diagnosis, manage-ment and follow-up of anaphylaxis during anaesthesia. Acta Anaesthesiol Scand 2007; 51: 655-70. https://doi.org/10.1111/j.1399-6576.2007.01313.x
92. Simons FER, Ardusso LRF, Bilò MB et al. 2012 Update: World Allergy Organization Guidelines for the assessment and management of anaphylaxis. Curr Opin Allergy Clin Immunol 2012; 12: 389-99. https://doi.org/10.1097/ACI.0b013e328355b7e4
93. Sadleir PHM, Clarke RC, Bozic B t and Platt1 PR. Consequences of proceeding with surgery after resuscitation from intra-operative anaphylaxis. Anaesthesia 2018; 73:32-9. https://doi.org/10.1111/anae.14106
94. Malean-Tooke AP, Bethune CA, Fay AC, Spickett GP. Adrenaline in the treatment of anaphylaxis: what is the evidence? BMJ. 2003; 327: 1332-5. https://doi.org/10.1136/bmj.327.7427.1332
95. Anchor J, Settipane RA. Appropriate use of epinephrine in anaphylaxis. Am J Emerg Med 2004; 22: 488-90. https://doi.org/10.1016/j.ajem.2004.07.016
96. Simons FER. First-aid treatment of anaphylaxis to food: Focus on epinephrine. J Allergy Clin Immunol. 2004; 113: 837-44. https://doi.org/10.1016/S0091-6749(04)00926-1
97. Garvey LH, Mertes PM. Perioperative anaphylaxis -management and outcomes in NAP6. Br J Anaesth 2018; 121: 120-3. https://doi.org/10.1016/j.bja.2018.05.010
98. Muraro A, Roberts G, Worm M et al. EAACI Food Allergy and Anaphylaxis Guidelines Group. Anaphylaxis: Guidelines from the European Academy of Allergy and Clinical Immunology. Allergy 2014; 69: 1026-45. https://doi.org/10.1111/all.12437
99. Pumphrey R. Anaphylaxis: can we tell who is at risk of a fatal reaction? Curr Opin Allergy Clin Immunol 2004; 4: 285-90. https://doi.org/10.1097/01.all.0000136762.89313.0b
100. Recomendaciones Clínicas de la Sociedad de Anestesiología de Chile. La anafilaxia en anesthesia https://www.sachile.cl/view/pdf_pages/anafilaxia_en_anestesia.pdf
101. Garvey LH, Belhage B, Kroigaard M et al. Treatment with epinephrine (adrenaline) in suspected anaphylaxis during anesthesia in Denmark. Anesthesiology 2011; 115: 11-6. https://doi.org/10.1097/ALN.0b013e318218119d
102. Dhami S, Panesar SS, Roberts G et al. Management of anaphylaxis: a systematic review. Allergy 2014; 69: 168-75. https://doi.org/10.1111/all.12318
103. Heytman M, Rainbird A. Use of alpha-agonists for management of severe anaphylaxis occurring under anaesthesia: case studies and review. Anaesthesia. 2004; 59: 1210-5. https://doi.org/10.1111/j.1365-2044.2004.03968.x
104. Kemp AM, Kemp SF. Pharmacotherapy in refractory anaphylaxis: when intramuscular epinephrine fails. Curr Opin Allergy Clin Immunol. 2014; 14: 371-8. https://doi.org/10.1097/ACI.0000000000000080
105. Schummer C, Wirsing M, Schummer W. The Pivotal Role of Vasopressin in Refractory Anaphylactic Shock. International Anesthesia Research Society 2008; 107: 620-4. https://doi.org/10.1213/ane.0b013e3181770b42
106. Landry DW, Oliver JA. The pathogenesis of vasodilatory shock. N Engl J Med 2001;345:588-95. https://doi.org/10.1056/NEJMra002709
107. Tsuda A, Tanaka KA, Huraux C al. The in vitro reversal of histamine-induced vasodilation in the human internal mammary artery. Anesth Analg 2001; 93: 1453-9. https://doi.org/10.1097/00000539-200112000-00020
108. Oyama H, Suzuki Y, Satoh S et al. Role of nitric oxide in the cerebral vasodilatory responses to vasopressin and oxytocin in dogs. J Cereb Blood Flow Metab 1993; 13: 285-90. https://doi.org/10.1038/jcbfm.1993.35
109. Thomas M, Crawford I. Best evidence topic report. Glucagon infusion in refractory anaphylactic shock in patients on beta-blockers. Emerg Med J. 2005; 22: 272-3. https://doi.org/10.1136/emj.2005.023507
110. Zheng F, Barthel G, Collange O et al. Methylene blue and epinephrine: a synergetic association for anaphylactic shock treatment. Crit Care Med. 2013; 41: 195-204. https://doi.org/10.1097/CCM.0b013e318267667b
111. Viaro F, Dalio MB, Evora PRB. Catastrophic cardiovascular adverse reactions to protamine are nitric oxide/cyclic guanosine monophosphate dependent and endothelium mediated*: should methylene blue be the treatment of choice? Chest 2002; 122: 1061-6. https://doi.org/10.1378/chest.122.3.1061
112. Evora PRB, Simon MR. Role of nitric oxide production in anaphylaxis and its relevance for the treatment of anaphylactic hypotension with methylene blue. Ann Allerg Asthma Immunol 2007; 99: 306-13. https://doi.org/10.1016/S1081-1206(10)60545-5
113. Lo JCY, Darracq MA, MD, Clark RF. A review of methylene blue treatment for cardiovascular collapse. J Emerg Med 2014; 46: 670-9. https://doi.org/10.1016/j.jemermed.2013.08.102
114. McDonnell NJ, Pavy TJG, Green LK, Platt PR. Sugammadex in the management of rocuronium-induced anaphylaxis. Br J Anaesth 2011; 106: 199-201. https://doi.org/10.1093/bja/aeq366
115. Platt PR, Clarke RC, Johnson GH, Sadleir PHM. Efficacy of sugammadex in rocuroniuminduced or antibiotic-induced anaphylaxis. A case-control study. Anaesthesia 2015; 70: 1264-67. https://doi.org/10.1111/anae.13178
116. Garvey LH, Dewachter P, Hepne DL et. Al. Management of suspected immediate perioperative allergic reactions: an international overview and consensus recommendations. Br J Anaesth. 2019; 123: e50-e64. https://doi.org/10.1016/j.bja.2019.04.044
117. Albuquerque AA, Margarido EA, Menardi AC et al. Methylene Blue to Treat Protamine-induced Anaphylaxis Reactions. An Experimental Study in Pigs. Braz J Cardiovasc Surg 2016; 31: 226-231. https://doi.org/10.5935/1678-9741.20160054
118. Reitter M, Petitpain N, Latarche C,et al. Fatal anaphylaxis with neuromuscular blocking agents: a risk factor and management analysis. Allergy 2014; 69: 954-9. https://doi.org/10.1111/all.12426
119. Alter HJ, Koepsell TD, Hilty WM. Intravenous magnesium as an adjuvant in acute bronchospasm: a meta-analysis. Ann Emerg Med. 2000; 36: 191-7. https://doi.org/10.1067/mem.2000.109170
120. Brown AFT. Manejo actual de la anafilaxia. Emergencias 2009; 21: 213-223.

 ORCID
ORCID