Joel Marchant K. 1 ,*, Francisco Aracena C. 2 , Antonia Henríquez A. 4 , Juan P. Cabrera C. 3
Recibido: 12-12-2021
Aceptado: 04-02-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 3 pp. 293-302|https://doi.org/10.25237/revchilanestv5116031531
PDF|ePub|RIS
Abstract
The most feared complication in spinal surgeries is damage to the spinal cord due to inadvertent compression or interference in the blood supply with the consequent motor and/or sensory déficit. Intraoperative physiological surveillance reduces the risk of generating direct damage or due to hypoxia, helping in the early detection of complications. Publications in the Pubmed database are reviewed.
Resumen
La complicación más temida en las cirugías de columna es el daño de la médula espinal por una compresión inadvertida o interferencia en el aporte sanguíneo con el consiguiente déficit motor y/o sensitivo. La vigilancia fisiológica intra operatoria disminuye el riesgo de generar daño directo o por hipoxia, ayudando en la detección temprana de las complicaciones. Se revisan publicaciones en base de datos Pubmed.
-
Introducción
Previo a contar con la monitorización neurofisiológica, la práctica común para descartar la aparición de un nuevo déficit neurológico tras la intervención era el despertar intraoperatorio o “Wake-up test” de Stagnara, descrito en 1973, que mide la integridad funcional del sistema motor, sin valorar el sistema sensorial. Es común que el nivel de conciencia sea variable durante la prueba del despertar, lo cual puede evitarse con el uso de anestésicos de rápida metabolización, o agentes de fácil reversión, y requiere la cooperación por parte del paciente, por lo que no es posible de realizar siempre.
Por el contrario, la monitorización neurofisiológica con potenciales evocados somatosensoriales (PESS) y motores (PEM) en el paciente anestesiado, facilita la detección de lesión neurológica, siendo de gran utilidad en la toma de decisiones intraoperatorias para prevenir lesiones medulares y radiculares en cirugía de columna.
El papel del anestesiólogo es comprender, en general, los principios de la monitorización, y por lo tanto, decidir la técnica anestésica aplicable y adecuada a cada caso en particular, y como parte del equipo quirúrgico, brindar al paciente el mejor resultado posible.
-
Potenciales evocados
El sistema nervioso tiene la propiedad única de intercambio de información a través de la generación química de la actividad eléctrica. El monitoreo de esta actividad permite evaluar el estado funcional del sistema nervioso durante los estados de conciencia alterados (por ej. coma, anestesia), mientras que el monitoreo tradicional (por ej. la presión sanguínea y la oxigenación) mide solo parámetros que son de apoyo de la función. Aunque no sustituye al examen neurológico despierto, la mo- nitorización neurofisiológica intraoperatoria puede detectar un ambiente quirúrgico o fisiológico desfavorable que altera las funciones neuronales y así permite realizar maniobras que mejorarán la toma de decisiones y, por lo tanto, reducen la morbilidad operatoria. Son casi 50 años desde que se registraron por primera vez en humanos los potenciales evocados somato- sensoriales (PESS), y más de 20 años ya de su uso en la sala de operaciones. La eficacia del monitoreo de PESS se ha demostrado en muchos procedimientos quirúrgicos, se ha convertido en una herramienta valiosa para evaluar las consecuencias de las acciones quirúrgicas.
-
Bases fisiológicas de los potenciales evocados
Los potenciales evocados (PE) son procedimientos neurofisiológicos más sensibles que específicos, objetivos, fidedignos, reproducibles y sin riesgo para el paciente, empleados en cirugía de columna para evaluar la integridad de las vías sensoriales y motoras. Así como el electroencefalograma (EEG) registra la actividad eléctrica espontánea del cerebro (corteza cerebral), los potenciales evocados registran los potenciales eléctricos producidos luego de la estimulación de tractos neuronales específicos. Los PE más comúnmente utilizados son los producidos por la estimulación del sistema sensorial, potenciales evocados sensoriales (PES). La estimulación del tracto sensorial inicia una descarga eléctrica que viaja a la corteza cerebral y se puede ser medida en varios lugares a lo largo de los tractos neuronales implicados. La respuesta neuronal se registra como una serie de picos y valles. Los picos pueden ser positivos o negativos (con respecto al electrodo activo) y pueden ser trazados hacia abajo o arriba. Los picos y valles, se cree que surgen de generadores neuronales específicos (a menudo más de una estructura neu- ral) de forma similar a los picos en un electrocardiograma que siguen una respuesta iniciada por el marcapaso. La información registrada es, generalmente, la amplitud y el tiempo de la estimulación hasta el pico, llamada latencia (mseg) (Figura 1).
El objetivo del monitoreo es identificar rápidamente el compromiso neuronal inminente, para permitir la intervención de manera que se evita un daño permanente. Este objetivo requiere la identificación preoperatoria del tejido neural en riesgo de lesión vascular y mecánica durante la cirugía. Sobre la base de esta información, se eligen los potenciales evocados más apropiados para vigilar esta eventual injuria. Esta injuria se detecta mediante la disminución de la amplitud y el aumento de la latencia. Además, de este objetivo de monitoreo, los potenciales evocados se pueden utilizar para pruebas de diagnóstico du-
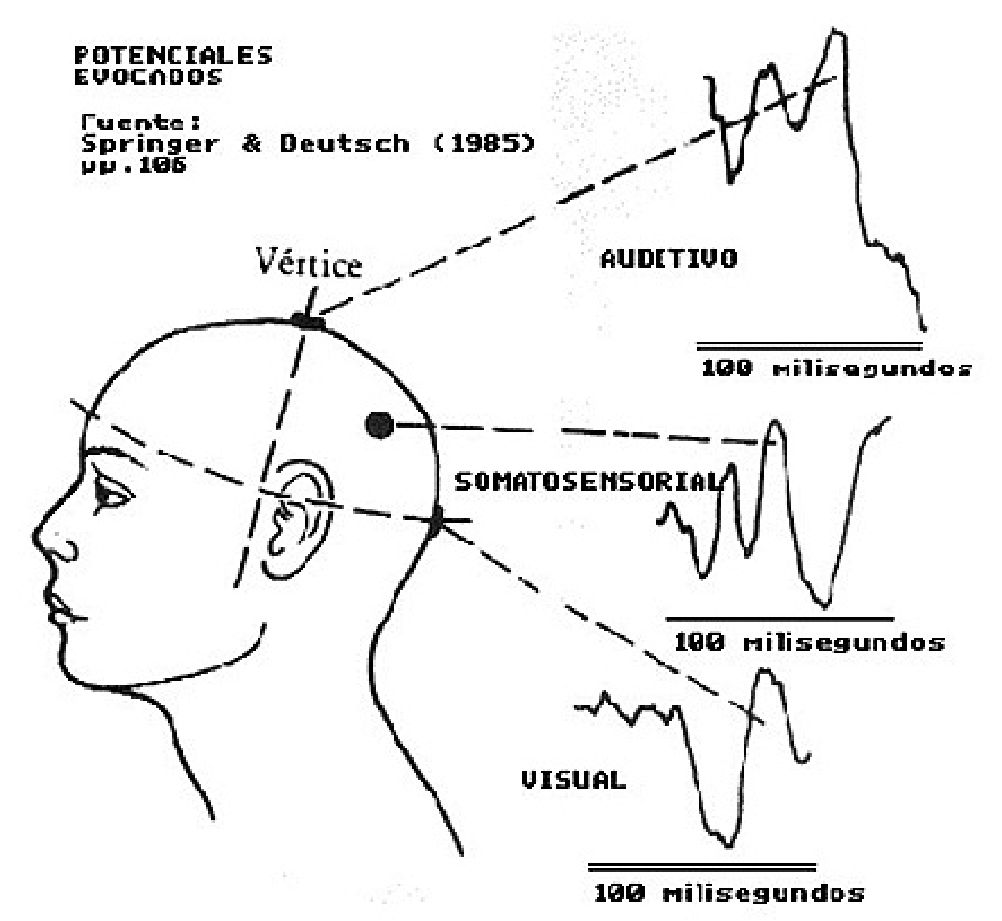
Figura 1.
rante la cirugía, permitiendo correctas tomas de decisiones (por ej. el borde del tumor y el tejido neuronal funcional), así como la identificación de complicaciones no quirúrgicas que pueden necesitar corrección, como, por ejemplo, la lesión del plexo braquial por el posicionamiento.
Al modificarse un potencial evocado debe evaluarse la hemodinamia, la anestesia y el entorno quirúrgico para determinar su contribución al cambio. La isquemia generalmente produce una pérdida de respuesta, en especial si los componentes sinápticos están involucrados. En general, la tolerancia a la isquemia se relaciona directamente con el flujo de sangre residual e inversamente a la demanda metabólica del tejido. Afortunadamente, la respuesta evocada es alterada a un nivel de flujo de sangre bien por encima del nivel que produce lesión irreversible. Por lo tanto, a menos que la lesión isquémica sea muy severa, habitualmente hay tiempo para la intervención antes que ocurran lesiones permanentes. Los estudios sugieren que una pérdida lenta de la amplitud de respuesta y aumento en la latencia pueden ser debido a isquemia difusa. Pérdidas rápidas (con un cambio mínimo de latencia) pueden ser debidos a lesión mecánica o isquemia localizada, especialmente en la sustancia gris. Como principio general, una reducción de la amplitud del 50% o un aumento de latencia de 10% de un potencial evocado se considera significativa, aunque pequeños cambios pueden indicar compromiso inminente. La experiencia de los equipos de monitorización es fundamental para una evaluación eficaz y para juzgar cuándo intervenir. El manejo anestésico a menudo desempeña un papel fundamental en la intervención (Figura 2).
-
Potenciales evocados somatosensoriales
Los potenciales evocados somatosensoriales (PESS) consisten en el estudio de las respuestas neurales originadas por la estimulación eléctrica de los nervios periféricos mixtos (motores y sensitivos). Los PESS se obtienen tanto en los miembros superiores como en los inferiores, aunque también se suele estimular algunas de las ramas del trigémino, así como estimulaciones por dermatomas; la estimulación del nervio mediano (C6-T1) en los miembros superiores y la del tibial posterior (L4-S2) en los inferiores son los más difundidos en la práctica diaria (Figura 3). Anatómicamente, la estimulación de nervios periféricos produce tanto la transmisión neural ortodrómica (que se propaga en la dirección normal) y antidrómica (que se propaga en la dirección inversa). La estimulación motora ortodrómica provoca una respuesta muscular, que es visto como un pie o la mano se contrae, y la estimulación sensorial ortodrómica produce el PESS. El registro de respuestas, por lo general, se lleva a cabo en varios sitios de registro para verificar que el sistema nervioso es estimulado y para identificar la localización de compromiso de los nervios si se pierde la respuesta.
La respuesta cortical se registra mejor sobre la corteza somatosensorial primaria apropiada para el nervio estimulado. Sin embargo, algunos componentes de la respuesta se distribuyen ampliamente sobre la corteza[1]. Las respuestas registradas posteriormente sobre la columna vertebral cervical probablemente representan respuestas de las vías en la médula espinal o del tronco cerebral.
-
Monitorización cortical usando los potenciales evocados somatosensoriales
La respuesta cortical se obtiene con electrodos situados sobre el cuero cabelludo. El PESS cortical se usa para detectar isquemia y para localizar áreas específicas del tejido cortical. Numerosos estudios han demostrado una relación entre el flujo sanguíneo cerebral regional y respuestas corticales evocadas[2]. Aunque las alteraciones neurológicas clínicas se vuelven anormales en un flujo sanguíneo cortical de aproximadamente 25 ml/100g/min, el PESS se mantiene normal hasta que el flujo de sangre cortical se reduce a aproximadamente 20 ml/100g/ min, pero se pierden en un flujo sanguíneo local de entre 15 y 18 ml/100g/min. Regiones subcorticales, tronco cerebral, la médula espinal y los nervios parecen ser menos sensibles a la hipoperfusión, explicando por qué el PESS persiste en la presión arterial por debajo del cual el EEG desaparece de forma rutinaria. Los cambios intraoperatorios del PESS se utilizan como una indicación para la colocación del shunt y para predecir la morbilidad posoperatoria. Se emplean durante los procedimientos vasculares intracraneales para determinar la idoneidad de las colaterales del flujo sanguíneo, la tolerancia a la oclusión de los vasos temporales, o la adecuada perfusión en la corteza cerebral. El uso más específico en la monitorización de la isquemia es durante cirugías de aneurismas vasculares intracraneales. Debido a que el PESS de la extremidad superior se genera en la corteza cerebral irrigada por la arteria cerebral media, este puede ser usado durante la cirugía para los aneurismas de la carótida interna y las arterias cerebrales medias. Del mismo modo, el PESS de la extremidad inferior se puede utilizar para evaluar la isquemia durante los procedimientos vasculares en la arteria cerebral anterior.
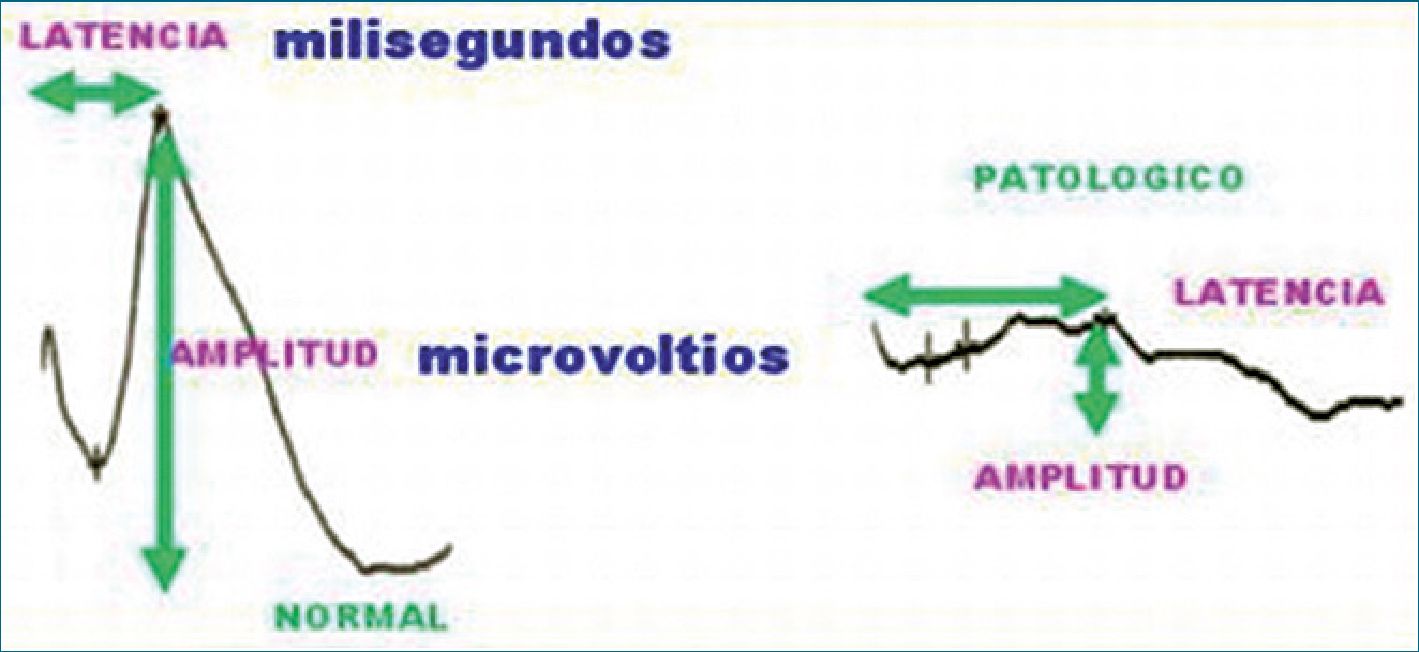
Figura 2.
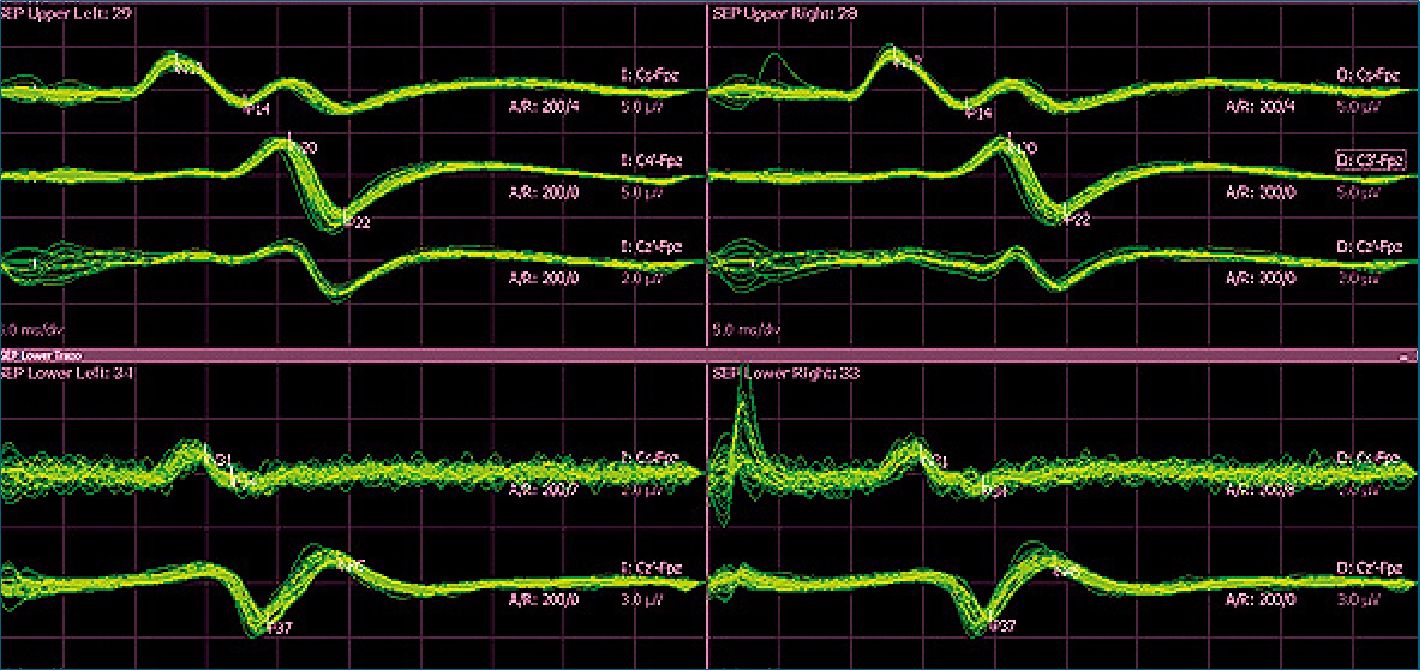
Figura 3.
La monitorización durante el clipaje temporal en la cirugía de aneurisma ha demostrado que una pérdida muy rápida de la respuesta PESS cortical (menos de 1 minuto después del clipaje) se asocia con el desarrollo de déficit neurológico permanente, sin embargo, una pérdida con una rápida recuperación después de la liberación del clip se asocia con la presencia de circulación colateral, con una incidencia marcadamente reducida de morbilidad neural. Symon y col., han sugerido que cuando el N20 del PESS del nervio mediano desaparece lentamente (durante 4 minutos), se pueden tolerar de manera segura 10 minutos adicionales de oclusión. Se ha visto una correlación entre el resultado y el monitoreo durante los aneurismas de la circulación anterior[3]. Los estudios sugieren que un cambio en la amplitud de PESS corticales es la indicación más sensible de isquemia.
Además de su uso intraoperatorio para determinar la tolerancia del tejido cortical al clipaje temporal de aneurismas o la identificación de una oclusión involuntaria de un vaso colateral por un clip, la monitorización se puede utilizar para identificar la isquemia por vasoespasmo o cuando una combinación de factores produce una isquemia inesperada (por ejemplo, la presión de retracción, la hipotensión, el clipaje temporal, y la hiperventilación). Otras aplicaciones son el monitoreo de la isquemia durante los procedimientos neurorradiológicos, como la oclusión de los vasos, y durante la disolución de coágulos de sangre por la estreptoquinasa. Los potenciales evocados se han denominado “indispensables” para la localización de la corteza sensorial-motriz en el paciente anestesiado. La localización se logra mediante el registro del componente cortical (N20) de los PESS del nervio mediano con el uso de cintas de registro bipolares colocados en la corteza.
-
Monitorización de los potenciales evocados somatosensoriales en la cirugía de columna
Las indicaciones quirúrgicas para monitorear la integridad de la médula espinal durante cirugía de la columna vertebral y de la médula espinal en las cuales esté a riesgo de lesión irreversible debido a descompresión de la médula espinal incluyen extirpación de los tumores de la médula espinal, trauma de columna vertebral quirúrgico, cirugía para malformaciones venosas de la médula espinal, corrección de escoliosis o deformidades de la columna vertebral, y en general instrumentación de columna a cualquier nivel. Cuando se utiliza el PESS durante la cirugía de médula espinal o esqueleto axial, se pueden identificar los insultos mecánicos o isquémicos cuando den lugar a una alteración o pérdida de transmisión a través del campo quirúrgico. Los riesgos de morbilidad neurológica en cirugía de columna sin monitorización son importantes; el riesgo de la disectomía cervical anterior es 0,46%, para la corrección de la escoliosis 0,25% a 3,2%, y para la cirugía de tumor de la médula espinal intramedular 23,8% a 65,4%; se estima que la monitorización reduciría la morbilidad en cirugía de la columna en 50% a 80%[4].
Daños a la médula espinal o un estrechamiento del canal espinal mediante un tornillo transpedicular pueden estar asociados con cambios en la latencia y amplitud de los PESS y a la vez, pérdida de la función motora. Debido a que las técnicas actuales de instrumentación de la columna vertebral presentan alta probabilidad de daño durante el curso de la operación, una técnica de monitorización casi continua como el PESS es ventajoso para precisar qué acto contribuyó a la disfunción neurológica. Además, el PESS se puede utilizar para identificar las alteraciones fisiológicas como hipotensión o problemas de posicionamiento, especialmente los relacionados con el plexo braquial. La prueba de despertar, anteriormente utilizada con frecuencia, está ahora reservada para la evaluación de la función motora cuando los potenciales evocados motores (PEMs) no son registrables o para confirmar la función motora cuando se deterioran las respuestas evocadas.
Los estudios en humanos sometidos a cirugía espinal indican que el PESS es predictivo del resultado neural[5]. Sin embargo, como con la prueba de despertar, la correlación de PESS y lesión neural no es exacto; se han producido casos de lesión motora sin previo aviso del PESS intraoperatorio. Una razón importante para la disociación del PESS de una lesión motora es el hecho de que el PESS es transmitido predominantemente por las columnas posteriores, en los que el suministro de sangre es de la arteria espinal posterior. Los tractos motores se encuentran en los cordones antero-laterales, y su suministro de sangre es a través de las arterias espinales anteriores. Por lo tanto, la capacidad del PESS para predecir la mayoría de los déficits motores resulta insuficiente. La utilidad del PESS en cirugía de la columna se muestra en un análisis realizado por la Sociedad de Investigación de la Sociedad Europea de Escoliosis y Deformidades Espinales en 1995. Se evaluaron los resultados del monitoreo durante la corrección de la deformidad de la columna de 51.263 operaciones (escoliosis, cifosis, fracturas, y la espondilolistesis) realizado por 173 cirujanos[6]. En estos casos, la incidencia global de injuria fue de 0,55% (1 de cada 182 casos), muy por debajo del promedio histórico del 0,7% al 4% que se espera para la instrumentación y sin monitorización. La incidencia de falsos negativos (es decir, en el que el paciente sufrió una lesión neurológica motora importante sin advertencia del PESS) fue muy baja (0,063%, o aproximadamente 1 caso en 1.500 procedimientos). El impacto económico de la monitorización fue estudiado por Nuwer y sus ayudantes[7], concluyó que el costo de la monitorización para prevenir un déficit neurológico persistente es US120.000 (dólares de 1995), que es poco en comparación con el costo de un cuidado médico de por vida. Otros autores han llevado a cabo los análisis de costes similares y llegaron a la conclusión de que el monitoreo si se aplica correctamente puede ser costo efectivo[8].
Numerosos estudios demuestran una mejora en los resultados después de la cirugía de columna con el monitoreo; la Sociedad de Investigación de la Escoliosis ha hecho una declaración que hace de la monitorización un estándar de cuidado durante los procedimientos de la médula espinal y del esqueleto axial. La declaración concluye que “la monitorización neurofisiológica puede ayudar en la detección temprana de las complicaciones y posiblemente prevenir la morbilidad posoperatoria en pacientes sometidos a operaciones en la columna vertebral”[9]. Este principio se ha hecho eco en la literatura británica por Loughman y sus ayudantes, que escribieron, “Hoy en día, es una práctica correcta llevar a cabo algún tipo de monitorización al realizar cualquier operación de la columna vertebral que se asocie con un alto riesgo de lesión neurológica. Por lo tanto, el monitoreo de PESS se ha convertido en algo común y casi un estándar de cuidado en la atención durante una amplia variedad de procedimientos que implican la columna vertebral.
-
Registro de potenciales evocados somatosensoriales de la columna vertebral
El registro de electrodos epidurales es un hecho común en Japón y Europa, y a pesar de su naturaleza invasiva, la técnica parece muy segura. Una de las técnicas de monitorización utiliza registros epidurales para controlar tanto las respuestas evocadas descendentes motoras de la estimulación cortical y las respuestas ascendentes del PESS. Aunque los tractos neuronales monitorizados con estas técnicas no se conocen, se han utilizado en un intento de registrar las respuestas que viajan a través de las vías motoras. Una técnica, inicialmente denominadas “potenciales evocados motores neurogénicos (PEMNs)”[10], ahora se cree que involucra la participación de ambos tractos sensoriales y motores, con las contribuciones relativas a la respuesta en función del tipo de anestesia y el tipo específico de estimulación empleada. Desafortunadamente, registrar una respuesta muscular no garantiza la estimulación pura del tracto muscular, ya que, la estimulación antidrómica del tracto sensitivo descendente puede activar la vía motora en la asta anterior por vías sensoriales a vías motoras reflejas. A pesar de la incertidumbre de las vías exacta supervisada, los PEMNs parecen útiles para el seguimiento, y el método se ha calificado como una manera segura y eficaz para llevar a cabo la monitorización en niños y adultos jóvenes con escoliosis idiopática o neuromuscular.
-
Potenciales evocados motores
El monitoreo de las vías motoras usando PEM está siendo cada vez más común, particularmente en la cirugía espinal, dada su mayor correlación con los resultados motores postoperatorios. En parte gracias al hecho de que PEM es inherentemente más sensible a los insultos vasculares isquémicos. Solo el monitoreo motor se desarrolló cuando se demostró que la estimulación transcraneal de la corteza motora por medios eléctricos o magnéticos produce una respuesta descendente que atraviesa el tracto corticoespinal y produce una respuesta muscular en forma de un potencial de acción muscular compuesto (PAMC)[11].
PEM permite diferenciar las vías motoras del monitoreo de otras vías, particularmente el PESS. PEM y PESS se ubican en una región topográfica y vascular diferente de la corteza cerebral, tronco encefálico y médula espinal. El monitoreo de PEM ha tomado importancia durante la cirugía de corrección de deformidad esquelética axial, tumores intramedulares e intracraneales y lesiones vasculares. También se ha usado para evaluación preventiva del resultado en accidente cerebrovascular y la función de la médula espinal durante la reparación de un aneurisma toracoabdominal[12].
El PEM ha sido particularmente importante en casos en que la cirugía puede dañar selectivamente las vías motoras del suministro de sangre por la arteria espinal anterior. A pesar de que se han intentado muchas técnicas de estimulación, solo se ha conseguido un monitoreo confiable de las vías motoras mediante la estimulación eléctrica de la corteza motora mediante el uso de electrodos ubicado tanto en el cuero cabelludo sobre la corteza motora (transcraneal) o directamente en la corteza motora. Para la cirugía espinal, las respuestas de PEM se registran generalmente en la extremidad inferior (tibia anterior, gastrocnemio lateral o medial, aductor hallucis) y extremidad superior (músculo abductor del pulgar).
El monitoreo de PEM se usa comúnmente durante los procedimientos de corrección esquelética axial y enfermedad del parénquima neuronal y cuando la perfusión cerebral o medular está en riesgo (aneurisma de arteria cerebral media, aneurisma toracoabdominal). El uso más común del monitoreo de PEM es en cirugía de corrección esquelética axial como parte de un protocolo de múltiples modalidades que también incluye monitoreo de PESS y EMG.
Muchos estudios han examinado el efecto del monitoreo de PEM en la cirugía correctiva medular. Todos reportaron que una pérdida permanente o transitoria de PEMs (Figuras 4 y 5) tiene una gran correlación con la disfunción motora de larga data[13].
El PEM es la modalidad mas fiable de vías motoras y es el indicador de daño inminente a la médula más efectivo que el PESS debido a la naturaleza más precaria de la irrigación sanguínea a la materia gris de la médula. Como tal, en una evaluación previa a la resección de tumor espinal intramedular, la lesión focal a la vasculatura espinal anterior o el tracto motor generalmente no se detecta (o se detecta varios minutos después de la lesión) solo con el monitoreo PESS. El monitoreo PEM y la estimulación de la médula espinal se ha usado con éxito para definir el “borde” del tumor espinal intramedular, de este modo se maximiza la resección y minimiza el deterioro motor.
El monitoreo PEM también ha tenido éxito durante la cirugía en que la vasculatura de la médula espinal está en riesgo. Esto incluye un tratamiento de intervención quirúrgica o radiológica para el aneurisma toracoabdominal y cirugía correctiva torácica anterior. En estos casos la interrupción de los perforadores radiculares desde la aorta (especialmente la arteria de Adamkiewicz) y la perfusión inadecuada a través del suministro pélvico al caudal de la médula espinal puede poner la médula espinal en riesgo de isquemia. El PEM permite una rápida detección de la isquemia ya que la materia gris, con su alto índice metabólico, es más sensible a la hipoperfusión.
El monitoreo PEM tiene sus riesgos; la Food and Drug Administration EE.UU (FDA) aprobó la tecnología PEM denotando algunas contradicciones al método. La preocupación más común fue la lesión térmica cortical (conocido como “kindling” o encender”), pero en los últimos 15 años, a pesar de que cientos de miles de pacientes se han sometido a monitoreo PEM, solo se han reportado dos casos de pacientes que con lesión térmica[11]. En 2002, un estudio publicó las complicaciones, éstas incluían: laceración de la lengua (n = 29), arritmia cardíaca (n = 5), quemadura del cuero cabelludo al costado de los electrodos de estimulación (n = 2), fractura mandibular (n = 1), y awareness (n = 1)[14]. Notablemente no se reportaron inicio de convulsiones, hematomas epidurales o infecciones por los electrodos epidurales o daños por movimientos (quirúrgico o luxación), enfermedad neuropsiquiátrica, dolores de cabeza o anomalías endocrinas. Las contradicciones relativas para el monitoreo PEM incluyen epilepsia, lesión de la corteza, defectos en el cráneo, alta presión intracraneal, aparatos intracraneales (electrodos, clip vascular, shunts), marcapasos cardiaco y otras bombas implantadas. Las complicaciones ya reconocidas y otras relativamente más comunes se limitan a dolores musculares y laceraciones de lengua[11].
Ciertamente, la incidencia y el número de complicaciones menores es sorprendentemente bajo. El movimiento asociado con el PEM requiere una coordinación cercana con el cirujano previo a la ejecución de un PEM, esta monitorización no es continua como el PESS o EMG.
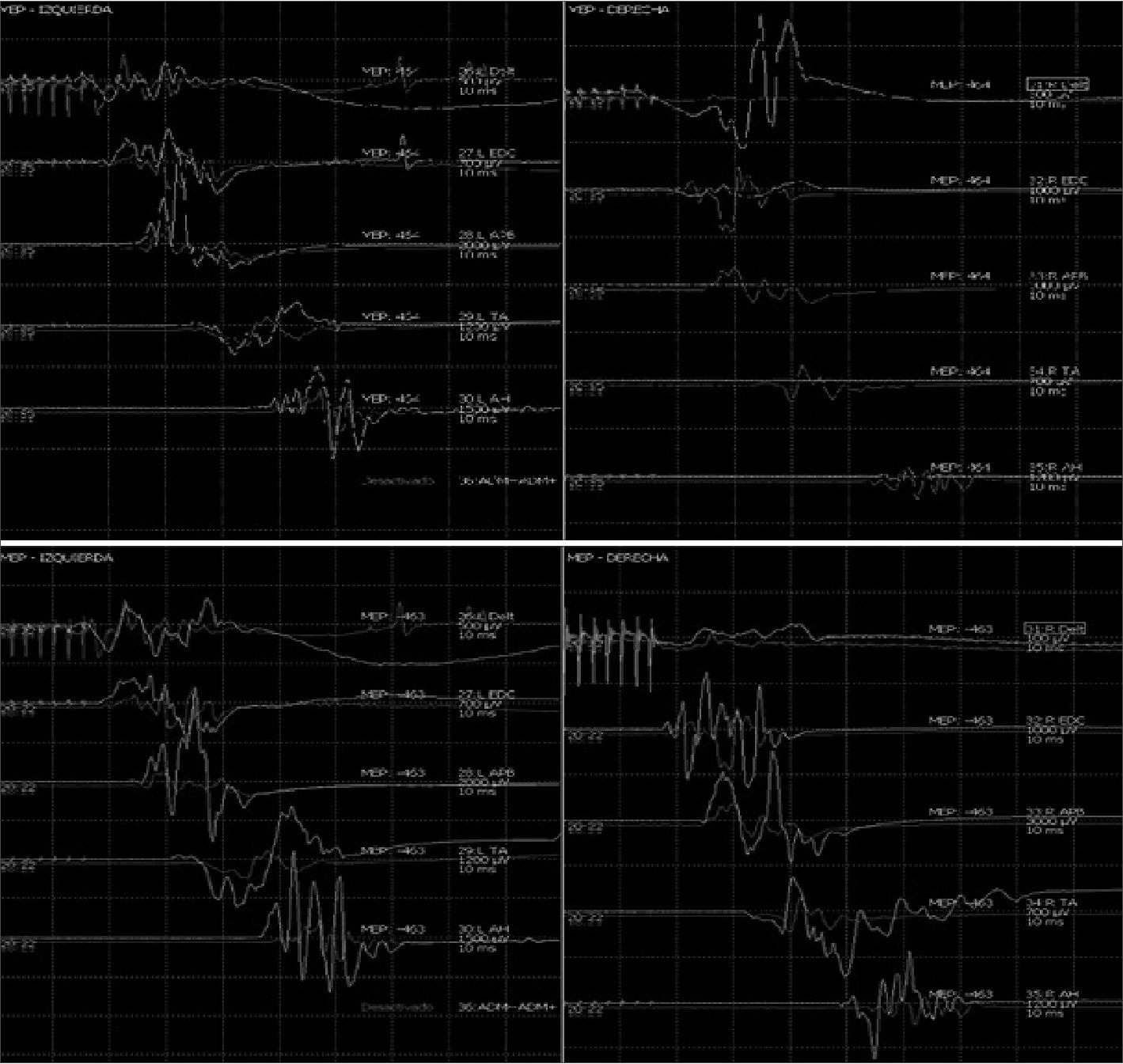
Figura 4 y 5. Caída significativa de amplitud potenciales motores lado derecho durante cirugía de columna cervical compleja, con recuperación tras detección precoz intraoperatoria, optimización de perfusión medular y corrección de maniobras quirúrgicas. Paciente despierta indemne neurológicamente.
-
Consideraciones anestésicas durante la monitorización de potenciales evocados
Cada técnica de monitoreo añade vigilancia intraoperatoria para las diferentes porciones del sistema nervioso. Para facilitar el monitoreo, el anestesista debe considerar varios efectos de la anestesia sobre las diferentes modalidades que se usan. Durante el monitoreo, muchos factores pueden alterar las respuestas además de la intervención quirúrgica. Tanto el manejo fisiológico como la elección de la anestesia afecta el funcionamiento neuronal y las respuestas del monitoreo. Una variedad de cambios fisiológicos puede alterar el funcionamiento neuronal y alterar la interpretación. Esto incluye condiciones que apuntan a la entrega inadecuada de oxígeno (hipotensión relativa, presión intracraneal aumentada, isquemia regional, anemia, hipoxia sistémica o de tejido), hipotermia, anomalías electrolíticas e hipoglicemia. A pesar de que la hipotermia no es perjudicial para el sistema neurológico, puede imitar cambios quirúrgicos, latencia incrementada y amplitud disminuida. La hipotensión es de particular interés, porque algunos planes anestésicos incluyen una inducción deliberada de hipotensión para reducir la pérdida de sangre. Se cree que el límite inferior de la autorregulación no siempre es el adecuado en tejidos sometidos a estrés quirúrgico[15]. Por lo tanto, el monitoreo permitiría una evaluación más óptima de la perfusión del tejido y el adecuado flujo sanguíneo. Otros factores tales como la patología, hiper- ventilación y la manipulación quirúrgica directa pueden alterar el límite inferior aceptable de presión sanguínea.
El manejo de la anestesia implica elegir una combinación de fármacos favorables y mantener una hemodinamia estable (evitar cambios de concentración o fármacos en bolo durante los períodos de monitoreo crítico). En general, el impacto de la anestesia se puede entender si se consideran los mecanismos de acción de los agentes anestésicos en el sistema nervioso central.
Los anestésicos inhalatorios producen un incremento en la latencia y una disminución en la amplitud de las respuestas sensoriales corticales hasta que no pueden ser detectadas fidedignamente (1-1,5 de CAM aproximada), sus efectos son dosis dependiente.
A diferencia del EEG los PESS son resistentes a la influencia de los anestésicos intravenosos, los cuales ejercen acción mínima sobre ellos. Pueden registrarse PESS incluso durante el coma profundo inducido por barbitúricos con un EEG isoeléctrico.
En las respuestas sensoriales, los efectos anestésicos de los inhalatorios son prominentes sobre las respuestas corticales, con latencia incrementada, amplitud disminuida y depresión marcada de amplitud con concentraciones por sobre 0,5 a 1 MAC[16]. El óxido nitroso también presenta un efecto depresor profundo sobre la amplitud de PESS, particularmente, cuando se utiliza en combinación con anestésico inhalado. Al igual que
con los agentes halogenados, los efectos en las respuestas de los nervios subcortical, epidural y periférico son mínimas. Los estudios sugieren que el efecto del óxido nitroso puede ser “sensible al contexto,” de forma similar a sus efectos en el EEG (el efecto real puede variar dependiendo de los otros anestésicos ya presentes). Tanto el óxido nitroso como el desflurano poseen la ventaja de la insolubilidad, la que facilita su eliminación cuando se usa una baja concentración y debe ser eliminado debido a la depresión anestésica excesiva del monitoreo.
Múltiples estudios han demostrado que con isoflurano con MAC 0,5, solo el 60% de los pacientes tienen PEMs, e isoflurano con 0,8% solo el 20% de los pacientes se les detectó PMEs[11]. El desflurano parece tener ventajas frente a otros anestésicos volátiles. Las comparaciones entre desflurano-N2O con MAC 0,5 y propofol- N2O muestran que estas concentraciones producen respuestas PEM comparables en cirugía de escoliosis[17].
Liu y colaboradores compararon los efectos de propofol e isoflurano a dosis de profundidad anestésica equivalente, encontrando que, aunque ambos disminuyeron la amplitud e incrementaron la latencia de los PESS, la amplitud se vio mayormente disminuida con isoflurano mientras que la latencia se incrementó importantemente con isoflurano siendo ambas diferencias estadísticamente significativas[18].
En un estudio similar Boisseau y cols., comparan al propofol con sevoflurano y con dosis equivalentes de profundidad anestésica a través de BIS. Demostraron que el sevoflurano afecta los registros de PESS de forma importante de acuerdo con la dosis. El propofol demostró nuevamente, mínima acción sobre los PESS[19].
Los efectos de desflurano sobre los PESS son sobresalientes sobre la amplitud de éstos, inclusive llegando a la supresión dosis relacionada[20].
La influencia importante que tiene el sevoflurano sobre los PESS es confirmada por Fletcher y cols., quienes lo comparan con isoflurano, en donde el primero disminuyó aún más la amplitud de los PESS comparado con isoflurano[21].
Los efectos de la hipotermia sobre los PESS son conocidos hace algún tiempo y se ha establecido que existe una correlación lineal entre la temperatura y los tiempos de latencia prolongándose estos con cada grado de disminución de la temperatura de la siguiente manera: 0,61, 1,15, 1,56 mseg para las ondas N10, P14 y N19 respectivamente[22]. Esto se ve confirmado posteriormente por Lang y cols., en pacientes sometidos a cirugía coronaria con bypass cardiopulmonar[23].
En cuanto al análisis de los PEM, en un principio Zenter y cols., documentaron que estos estaban influidos por halotano, enflurano e isoflurano en forma importante, dosis-dependiente similar en los tres a partir de 0,5 de CAM[24].
Más recientemente se ha establecido que si la concentración de los agentes inhalados se mantiene alrededor de 1,0 CAM los PEM se ven bien preservados usando desflurano o isoflurano[25].
Comparando los efectos de isoflurano con propofol, Pelosi y cols., encuentran que bajo propofol el registro correcto es del 97%, mientras que con el uso de isoflurano este descendió a 61%, por lo que proponen el uso de anestesia total endovenosa con propofol como la técnica de elección al usar PEM[26]. Esta opinión se ve compartida con McDonald y cols., quienes realizan la vigilancia transanestésica de cirugía de escoliosis con PEM y propofol en forma satisfactoria.
Según Wang y cols[27], el sevoflurano tiene efectos sobre la depresión de PESS dependiente de la dosis. Puede disminuir las amplitudes y prolongar las latencias. Considerando significativa diferencia individual, la viabilidad de sevoflurano en este tipo de cirugía puede determinarse midiendo la amplitud de la base bajo anestesia intravenosa total.
Hernández-Palazón y cols[28] compararon el efecto en la medición de PEM y PESS en dos grupos; en uno se usó sevo- flurano a CAM 0,5 y el otro propofol con concentración sitio efecto 2,5 pg/mL para mantener la anestesia, en ambos grupos recibieron remifentanilo en rango 0,25 a 0,35 pg/kg/min. Se controlaron PEM y PESS a la 1, 2, 3 y 4 hora de iniciada la anestesia, y como resultado las amplitudes de PEMs fueron significativamente mayores en el grupo de propofol que en el grupo de sevoflurano (P < 0,05), mientras que las latencias eran más cortas en el grupo de propofol que aquellos en el grupo de sevoflurano (P < 0,05). No se observaron diferencias en la latencia y la amplitud durante la monitorización de PESS entre las dos técnicas anestésicas.
El droperidol y la dexmedetomidina parecen tener mínimos efectos en las respuestas cuando se combina con opioides. La dexmedetomidina como agonista a2 con propiedades sedantes, se ha utilizado cada vez más frecuentemente como coadyuvante de los anestésicos generales para disminuir la dosis requerida de ellos en especial de los anestésicos inhalados y así evitar la interferencia de estos con el registro tanto de los PESS como de los PEM.
De acuerdo con la investigación realizada por Bala y cols., utilizando ambas modalidades de monitorización en 30 pacientes sometidos a cirugía de columna y empleando anestesia balanceada con desflurano y remifentanil, a la que adicionaron dexmedetomidina a razón de 0,3 pg/kg/h, no produjo cambio alguno en los registros tanto de PESS como de PEM. La concentración alveolar al final de la espiración de desflurano se mantuvo en 4%[29]. En contraste con este trabajo existe una publicación previa en donde se reporta la perdida de PEM transcraneales en dos pacientes jóvenes utilizando anestesia total endovenosa (propofol/sufentanyl) y dexmedetomidina. En el primer caso (13 años) la tasa de infusión de dexmedetomidina era de 0,5 pg/kg/h. Después de dos horas de anestesia los PEM desaparecieron gradualmente, por lo que se retiró la infusión de dexmedetomidina, resultando en la recuperación también gradual de los PEM al cabo de 30 minutos. En el segundo caso (19 años) se requirió de la administración de un bolo de 1 pg/kg de dexmedetomidina para tratar de profundizar el nivel anestésico, 10 minutos después de lo cual se encontró la desaparición de los PEM, lo que llevó también a suspender su infusión. Los registros de los potenciales motores se recuperaron dos horas después. Es importante hacer notar que en ambos casos los PESS que se estaban registrando al mismo tiempo que los PEM no tuvieron alteraciones[30].
Un aspecto más a considerar durante el uso de PEM, es que el paciente requiere de la integridad de la respuesta neu- romuscular, por lo que el uso de relajantes musculares de larga duración no está recomendado cuando se va a utilizar este tipo de monitoreo, prefiriendo aquellos relajantes musculares que terminen su acción rápidamente después de haber facilitado la intubación traqueal. Además, debe utilizarse bloqueo de mordida con gasas intraorales u otro dispositivo, a modo de proteger la lengua y el tubo endotraqueal de eventuales lesiones.
Los opioides causan solo una leve depresión de todas las respuestas, con pérdida de las respuestas de los peaks tardíos de evocados sensoriales (< 100 mseg) a dosis que produce sedación. Sus efectos sobre las respuestas sensoriales y motoras son mínimos. Del mismo modo, la analgesia opioide se usa comúnmente durante el registro de las respuestas sensorial cortical y PEMs, también la anestesia basada en opioide con fentanilo, remifentanilo o sufentanilo por lo general se usa para suplementar a los agentes inhalatorios de baja dosis o en anestesia intravenosa total. Los efectos de la ketamina en las respuestas subcorticales y periféricas son también mínimos; este agente mejora el efecto de la amplitud cortical PESS y de PEM. Esta característica ha hecho de la ketamina un agente deseable para monitorear las respuestas que son usualmente difícil de registrar durante la anestesia, especialmente en niños. El uso de la ketamina con propofol reduce el efecto depresor de este último, mientras proporciona un efecto mejorado en las respuestas.
El tiopental y el midazolam producen una depresión leve de las respuestas sensorial cortical, pero con PEMs producen una depresión duradera. Por consiguiente, estos agentes no se usan comúnmente en el monitoreo PEM. El etomidato también produce un incremento en la amplitud de los componentes cortical sensorial después de la inyección, sin cambios en las respuestas subcortical y sensorial periférica. Este incremento en la amplitud parece coincidir con el mioclono visto con el fármaco, sugiriendo una excitabilidad cortical aumentada. El etomidato se ha usado con el registro PESS, pero no en gran manera con el monitoreo de PEM.
El propofol es actualmente el sedante más usado del total de la anestesia intravenosa cuando PESSs y PEMs son monito- reados. El rápido metabolismo del propofol lo convierte en un excelente fármaco para la infusión, ya que su efecto sedante y, más aún, relacionado a las respuestas evocadas hace que se pueda ajustar rápidamente. Una infusión de propofol puede ser elegida para permitir el monitoreo cortical PESS y PEM, aunque la depresión de PEM puede ocurrir a altas dosis.
En general, los anestésicos intravenosos suprimen las respuestas PEM mucho menos que los agentes inhalatorios, por lo cual se prefiere anestesia intravenosa total cuando se debe monitorear los PEMs en pacientes con enfermedad neurológica. Por lo tanto, el propofol con o sin ketamina frecuentemente se combina con opioides[11].
Experiencia en monitorización de potenciales evocados en cirugía de columna en el Hospital Guillermo Grant Benavente de Concepción
En julio de 2012 se implementó la neuromonitorización con potenciales evocados en nuestro hospital y hasta la fecha ya se han realizado más de 1.600 cirugías con este tipo de monito- rización, de los que el mayor número corresponde a patología de columna adulto y pediátrica. Con el fin de realizar un análisis de los planes anestésicos empleados y su impacto en la monitorización de potenciales evocados en cirugía de columna se revisaron retrospectivamente los registros de una muestra de pacientes en el software NIM ECLIPSE (Medtronic). Para que los resultados fueran comparables se excluyeron las cirugías de escoliosis por sus diferentes características, en cuanto a manejo anestésico y hemodinámico.
Se revisaron retrospectivamente 139 registros de pacientes operados de patología de columna, en su mayoría correspondían a patología degenerativa, seguidos por patología traumática y tumoral, en el 84,1% de estos paciente se utilizó propofol + remifentanilo, sevoflurano + fentanilo en el 13,7%, propofol + fentanilo en el 1,5% (fueron 2 pacientes) y propofol + sevo- flurano en solo 1 paciente (0,7%).
De los 117 pacientes que se manejaron con propofol + remifentanilo, 19 presentaron disminución de la amplitud y prolongación de la latencia en los PEMs, 18 de ellos relacionado con el uso de relajante neuromuscular (atracurio o rocuronio), lo que afectó el registro basal de los PEMs, pero en todos estos casos pudo realizarse la monitorización una vez cedido el efecto del relajante. Un caso presentó alteración de los PEMs en su primer registro en que se relacionó con cambios hemodinámicos significativos (hipotensión), también se logra el registro una vez optimizada la hemodinamia.
En cuanto a los pacientes con sevoflurano + fentanilo (19 en total), en 18 se destacó alteraciones en el registro de los PEMs, 8 requirieron cambio a TIVA por solicitud del neurociru- jano que realizaba la monitorización por presentar un registro PEM plano, solo en un paciente pudo realizarse la monitorización desde el inicio el cual al momento del registro del PEM tenía una CAM de 0,8, de los 10 pacientes restantes no hay registro de PEMs posteriores. Dispusimos de poco registro de la CAM del sevoflurano, la mínima registrada fue 0,5 y la máxima 1,8. Los pacientes del grupo propofol + fentanilo no presentaron alteración de los PEMs.
El paciente en el cual se usó propofol + sevoflurano no presentó alteración en la monitorización de los PEMs, cabe destacar que su hemodinamia se mantuvo estable y al momento del registro presentaba una CAM de 0,5.
Referente al uso de relajante neuromuscular en la inducción anestésica se usaron en 49 pacientes (total 139), estos fueron atracurio, rocuronio, vecuronio y succinilcolina. Los pacientes que recibieron succinilcolina presentaron PEMs adecuados al momento del registro. La media de la dosis de rocuronio fue 38 mgs y de atracurio 28 mg. La dosis media en que no se vio afectado el registro de PEMs fue de 18 mg para rocuronio y 15 mg para atracurio. Solo un paciente recibió vecuronio en baja dosis y no se destacó alteración al registro de los PEMs. El uso de relajante neuromuscular tiene un impacto significativo sobre la obtención de línea basal de PE al inicio de la cirugía, así como también durante la estimulación de tornillos transpediculares, no discutido en el presente trabajo.
-
Conclusión
El monitoreo neurofisiológico con potenciales evocados se ha convertido en una importante herramienta en el manejo quirúrgico de patología de columna. En algunas cirugías, estos métodos han demostrado reducir la morbilidad neurológica y se han convertido en un estándar de cuidado. Han demostrado ser costo-beneficio y ya son parte del manejo rutinario. Para muchos cirujanos y anestesiólogos, estos métodos son una herramienta intraoperatoria indispensable. El anestesiólogo, como parte y miembro del equipo de cirugía, debe facilitar la realización de esta herramienta y ser una contribución al éxito del monitoreo eligiendo un plan anestésico adecuado y manejando la fisiología del paciente.
Referencias
1. Aminoff MJ, Eisen AA, Aminoff MJ, et al. AAEM minimonograph 19: somatosensory evoked potentials. Muscle Nerve. 1998 Mar;21(3):277–90. https://doi.org/10.1002/(SICI)1097-4598(199803)21:33.0.CO;2-7 PMID:9486856
2. Branston NM, Symon L, Crockard HA. Recovery of the cortical evoked response following temporary middle cerebral artery occlusion in baboons: relation to local blood flow and PO2. Stroke. 1976 Mar-Apr;7(2):151–7. https://doi.org/10.1161/01.STR.7.2.151 PMID:1265808
3. Schramm J, Zentner J, Pechstein U. Intraoperative SEP monitoring in aneurysm surgery. Neurol Res. 1994 Feb;16(1):20–2. https://doi.org/10.1080/01616412.1994.11740185 PMID:7913523
4. Costa P, Bruno A, Bonzanino M, Massaro F, Caruso L, Vincenzo I, et al. Somatosensory- and motor-evoked potential monitoring during spine and spinal cord surgery. Spinal Cord. 2007 Jan;45(1):86–91. https://doi.org/10.1038/sj.sc.3101934 PMID:16670686
5. Ben-David B. Spinal cord monitoring. Orthop Clin North Am. 1988 Apr;19(2):427–48. https://doi.org/10.1016/S0030-5898(20)30322-9 PMID:3282207
6. Nuwer MR, Dawson EG, Carlson LG, Kanim LE, Sherman JE. Somatosensory evoked potential spinal cord monitoring reduces neurologic deficits after scoliosis surgery: results of a large multicenter survey. Electroencephalogr Clin Neurophysiol. 1995 Jan;96(1):6–11. https://doi.org/10.1016/0013-4694(94)00235-D PMID:7530190
7. Nuwer MR. Spinal cord monitoring with somatosensory techniques. J Clin Neurophysiol. 1998 May;15(3):183–93. https://doi.org/10.1097/00004691-199805000-00002 PMID:9681556
8. Owen J. Cost efficacy of intraoperative monitoring. Semin Spine Surg. 1997;9:348.
9. Scoliosis Research Society. Somatosensory Evoked Potential Monitoring of Neurological Spinal Cord Function during Spinal Surgery, SRS Position Statement on Somatosensory Evoked Potential Monitoring of Neurological Spinal Cord Function, Park Ridge, IL, 1992, Scoliosis Research Society.
10. Owen JH, Bridwell KH, Grubb R, Jenny A, Allen B, Padberg AM, et al. The clinical application of neurogenic motor evoked potentials to monitor spinal cord function during surgery. Spine. 1991 Aug;16(8 Suppl):S385–90. https://doi.org/10.1097/00007632-199108001-00016 PMID:1785092
11. Macdonald DB. Intraoperative motor evoked potential monitoring: overview and update. J Clin Monit Comput. 2006 Oct;20(5):347–77. https://doi.org/10.1007/s10877-006-9033-0 PMID:16832580
12. Hendricks HT, Zwarts MJ, Plat EF, van Limbeek J. Systematic review for the early prediction of motor and functional outcome after stroke by using motor-evoked potentials. Arch Phys Med Rehabil. 2002 Sep;83(9):1303–8. https://doi.org/10.1053/apmr.2002.34284 PMID:12235613
13. Weinzierl MR, Reinacher P, Gilsbach JM, Rohde V. Combined motor and somatosensory evoked potentials for intraoperative monitoring: intra- and postoperative data in a series of 69 operations. Neurosurg Rev. 2007 Apr;30(2):109–16. https://doi.org/10.1007/s10143-006-0061-5 PMID:17221265
14. Legatt AD. Current practice of motor evoked potential monitoring: results of a survey. J Clin Neurophysiol. 2002 Oct;19(5):454–60. https://doi.org/10.1097/00004691-200210000-00008 PMID:12477990
15. Edmonds HL Jr. Multi-modality neurophysiologic monitoring for cardiac surgery. Heart Surg Forum. 2002;5(3):225–8. PMID:12538134
16. Sloan TB. Anesthetic effects on electrophysiologic recordings. J Clin Neurophysiol. 1998 May;15(3):217–26. https://doi.org/10.1097/00004691-199805000-00005 PMID:9681559
17. Lo YL, Dan YF, Tan YE, Nurjannah S, Tan SB, Tan CT, et al. Intraoperative motor-evoked potential monitoring in scoliosis surgery: comparison of desflurane/nitrous oxide with propofol total intravenous anesthetic regimens. J Neurosurg Anesthesiol. 2006 Jul;18(3):211–4. https://doi.org/10.1097/01.ana.0000211007.94269.50 PMID:16799350
18. Liu EH, Wong HK, Chia CP, Lim HJ, Chen ZY, Lee TL. Effects of isoflurane and propofol on cortical somatosensory evoked potentials during comparable depth of anaesthesia as guided by bispectral index. Br J Anaesth. 2005 Feb;94(2):193–7. https://doi.org/10.1093/bja/aei003 PMID:15516356
19. Boisseau N, Madany M, Staccini P, Armando G, Martin F, Grimaud D, et al. Comparison of the effects of sevoflurane and propofol on cortical somatosensory evoked potentials. Br J Anaesth. 2002 Jun;88(6):785–9. https://doi.org/10.1093/bja/88.6.785 PMID:12173194
20. Haghighi SS, Sirintrapun SJ, Johnson JC, Keller BP, Oro JJ. Suppression of spinal and cortical somatosensory evoked potentials by desflurane anesthesia. J Neurosurg Anesthesiol. 1996 Apr;8(2):148–53. https://doi.org/10.1097/00008506-199604000-00009 PMID:8829563
21. Fletcher JE, Hinn AR, Heard CM, Georges LS, Freid EB, Keifer A, et al. The effects of isoflurane and desflurane titrated to a bispectral index of 60 on the cortical somatosensory evoked potential during pediatric scoliosis surgery. Anesth Analg. 2005 Jun;100(6):1797–803. https://doi.org/10.1213/01.ANE.0000152193.90756.4E PMID:15920216
22. Markand ON, Warren C, Mallik GS, King RD, Brown JW, Mahomed Y. Effects of hypothermia on short latency somatosensory evoked potentials in humans. Electroencephalogr Clin Neurophysiol. 1990 Nov-Dec;77(6):416–24. https://doi.org/10.1016/0168-5597(90)90002-U PMID:1701704
23. Lang M, Welte M, Syben R, Hansen D. Effects of hypothermia on median nerve somatosensory evoked potentials during spontaneous circulation. J Neurosurg Anesthesiol. 2002 Apr;14(2):141–5. https://doi.org/10.1097/00008506-200204000-00009 PMID:11907395
24. Zentner J, Albrecht T, Heuser D. Influence of halothane, enflurane, and isoflurane on motor evoked potentials. Neurosurgery. 1992 Aug;31(2):298–305. https://doi.org/10.1227/00006123-199208000-00015 PMID:1513434
25. Bernard JM, Péréon Y, Fayet G, Guihéneuc P. Effects of isoflurane and desflurane on neurogenic motor- and somatosensory-evoked potential monitoring for scoliosis surgery. Anesthesiology. 1996 Nov;85(5):1013–9. https://doi.org/10.1097/00000542-199611000-00008 PMID:8916817
26. Pelosi L, Stevenson M, Hobbs GJ, Jardine A, Webb JK. Intraoperative motor evoked potentials to transcranial electrical stimulation during two anaesthetic regimens. Clin Neurophysiol. 2001 Jun;112(6):1076–87. https://doi.org/10.1016/S1388-2457(01)00529-6 PMID:11377268
27. Wang L, Meng X, Guo X, Zhao W, Wang Z. [Influence of different sevoflurane concentration on somatosensory evoked potentials monitoring in spinal cord surgery]. Zhonghua Yi Xue Za Zhi. 2015 Mar;95(10):753–6. PMID:26080847
28. Hernández-Palazón J, Izura V, Fuentes-García D, Piqueras-Pérez C, Doménech-Asensi P, Falcón-Araña L. Comparison of the Effects of Propofol and Sevoflurane Combined With Remifentanil on Transcranial Electric Motor-evoked and Somatosensory-evoked Potential Monitoring During Brainstem Surgery. J Neurosurg Anesthesiol. 2015 Oct;27(4):282–8. https://doi.org/10.1097/ANA.0000000000000157 PMID:25574800
29. Bala E, Sessler DI, Nair DR, McLain R, Dalton JE, Farag E. Motor and somatosensory evoked potentials are well maintained in patients given dexmedetomidine during spine surgery. Anesthesiology. 2008 Sep;109(3):417–25. https://doi.org/10.1097/ALN.0b013e318182a467 PMID:18719439
30. Mahmoud M, Sadhasivam S, Sestokas AK, Samuels P, McAuliffe J. Loss of transcranial electric motor evoked potentials during pediatric spine surgery with dexmedetomidine. Anesthesiology. 2007 Feb;106(2):393–6. https://doi.org/10.1097/00000542-200702000-00027 PMID:17264733

 ORCID
ORCID