Cristopher Araya G. 1 ,*, Fernando Aranda G. 2
Recibido: 09-12-2021
Aceptado: 12-02-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 5 pp. 543-551|https://doi.org/10.25237/revchilanestv5130061501
PDF|ePub|RIS
Deep anesthesia monitoring during cardiac bypass surgery
Abstract
The cardiovascular anesthesiologist must frequently assume the care of high-risk patients who will undergo complex and invasive surgeries. In order to ensure patient safety and facilítate decision making, great technological advances have been made to monitor them extensively, such as transesophageal echocardiography and sophisticated hemodynamic monitors. Although hypnotics used during general anesthesia act on the brain, the monitoring of this organ was not considered standard behavior for a long time. The classic electroencephalogram (EEG) appeared as a useful tool to evaluate the changes in neuronal electrical activity induced by general anesthesia and thus detect the different states of consciousness during general anesthesia, i.e., to evaluate the depth of anesthesia (DoA). However, its difficult intraoperative interpretation and the scarce evidence available in its favor were the main limitations for the use of this tool as a hypnosis monitor. Processed EEG (pEEG), derived from EEG decomposition, emerges as an easy-to-interpret alternative for anesthesiologists and useful for assessing anesthetic depth. In cardiac surgery, and especially in cardiopulmonary bypass (CPB), achieving safe and stable hypnosis is a great challenge, since there are critical periods that involve a series of changes in the physiology of the patients and in the administration of hypnotics. Given the above, the monitoring of anesthetic depth in this surgical scenario is currently supported by many authors, the main objectives being to reduce the incidence of awareness with intraoperative recall (AWR) due to hypnotic underdosing, to avoid hemodynamic and neurological adverse effects secondary to hypnotic overdosing, and to collaborate in the evaluation of cerebral perfusion during critical periods.
Resumen
El anestesiólogo cardiovascular, frecuentemente debe asumir el cuidado de pacientes de alto riesgo que serán sometidos a cirugías complejas e invasivas. Con el objetivo de garantizar la seguridad de los pacientes y facilitar la toma de decisiones, se han realizado grandes avances tecnológicos para monitorizarlos extensamente como, por ejemplo, la ecocardiografía transesofágica y sofisticados monitores hemodinámicos. Aunque los hipnóticos utilizados durante la anestesia general actúan en el cerebro, la monitorización de este órgano no fue considerada una conducta estandarizada por mucho tiempo. El electroencefalograma clásico (EEG) apareció como una herramienta útil para evaluar los cambios en la actividad eléctrica neuronal inducidos por la anestesia general y así detectar los diferentes estados de conciencia durante ésta, es decir, evaluar la profundidad anestésica (DoA). Sin embargo, su difícil interpretación intraoperatoria y la escasa evidencia disponible a su favor fueron las principales limitantes para el uso de esta herramienta como monitor de hipnosis. El EEG procesado (pEEG), derivado de la descomposición del EEG, surge como una alternativa fácil de interpretar para los anestesiólogos y útil para evaluar la profundidad anestésica. En cirugía cardíaca, y especialmente en bypass cardiopulmonar (CPB), lograr una hipnosis segura y estable corresponde un gran desafío, pues existen períodos críticos que suponen una serie de cambios en la fisiología de los pacientes y en la administración de los hipnóticos. Dado lo anterior, actualmente la monitorización de la profundidad anestésica en este escenario quirúrgico es respaldada por muchos autores, siendo los principales objetivos disminuir la incidencia de awareness con recuerdo intraoperatorio (AWR) debido a una sub-dosificación de hipnóticos, evitar los efectos adversos hemodinámicos y neurológicos secundarios a una sobre-dosificación de los mismos, y colaborar en la evaluación de la perfusión cerebral durante los períodos críticos.
-
Introducción
La cirugía cardíaca (CC) ha sido posible debido a la incorporación del bypass cardiopulmonar (CPB), una forma de soporte vital extracorpóreo, cuya asistencia hemodinámica y respiratoria facilita la intervención quirúrgica en el corazón y grandes vasos sanguíneos[1]. La primera CC exitosa en humanos con CPB fue desarrollada por John Gibbon en 1952, y consistió en el cierre de un defecto interatrial[2].
El manejo del paciente durante el CPB impone varios desafíos para el anestesiólogo cardiovascular, siendo uno de ellos lograr una adecuada profundidad anestésica (DoA). La exclusión de los pulmones de la circulación, y las alteraciones farmacocinéticas y farmacodinámicas que ocurren durante el CPB, dificultan la administración y dosificación óptima de los agentes anestésicos durante el período de asistencia[3]. Lo anterior puede resultar en una DoA inadecuada, la cual en múltiples estudios ha sido calificada como factor de riesgo para complicaciones perioperatorias[4].
La población que requiere de CC se caracteriza por ser añosa, frágil, con múltiples comorbilidades y clasificación ASA de alto grado, es decir, altamente susceptible de complicaciones relacionadas a una DoA excesiva, como inestabilidad hemodi- námica o delirium posoperatorio. Por lo tanto, la subdosificación de agentes anestésicos es una tendencia entre los anes- tesiólogos[5]. Sin embargo, una DoA superficial también se asocia a complicaciones como el despertar intraoperatorio, movimientos involuntarios, hipertensión intraoperatoria y sangrado perioperatorio[6]. Por lo tanto, resulta fundamental lograr un balance adecuado en la dosificación de agentes anestésicos para evitar estas complicaciones.
Con la intención de mejorar los outcomes de los pacientes sometidos a CC, presentamos a continuación una revisión de la bibliografía disponible respecto a las técnicas de anestesia general en CPB y a la motorización de la DoA durante este período
-
1. Técnicas de anestesia general en CPB
Los objetivos de la anestesia general en CC no son diferentes a los buscados en otro tipo de cirugías, es decir, lograr la inconciencia, hipnosis, amnesia, analgesia e inmovilidad del paciente mientras se mantiene la estabilidad hemodinámica. Como es sabido, la anestesia general balanceada logra cada uno de estos objetivos mediante el uso de múltiples fármacos, cuyas concentraciones plasmáticas varían durante el CPB debido a las alteraciones farmacocinéticas y farmacodinámicas que ocurren durante este período. Sin embargo, los cambios en la concentración plasmática de los hipnóticos corresponden a los mas clínicamente relevantes respecto a outcomes posoperatorios[7].
La CC corresponde a uno de los escenarios más utilizados en la literatura para comparar la anestesia inhalatoria con halogenados (AH) con la anestesia total intravenosa (TIVA), pues la dosificación de hipnóticos se ve alterada por la presencia del oxigenador en el circuito extracorpóreo y aumento en el volumen de distribución durante el CPB respectivamente. El hipnótico adecuado para asegurar una DoA óptima aún es motivo de debate, pero muchos anestesiólogos basan su elección en outcomes perioperatorios[8].
Los halogenados fueron utilizados por primera vez en CPB en 1974, y se han convertido en los hipnóticos más utilizados en CC[9]. Existe abundante evidencia a favor del efecto cardio- protector de los halogenados debido al preacondicionamiento farmacológico[10]. Un consenso internacional recientemente publicó que la AH es una de las pocas estrategias que podrían reducir la mortalidad asociada a CC[11]. No obstante, la administración de halogenados a través de los pulmones se encuentra imposibilitada por la exclusión de estos durante el CPB. Todo lo anterior, explica un mayor interés en los últimos años por el uso de TIVA[12].
Estudios de baja potencia han demostrado que TIVA en CPB tiene múltiples ventajas, como evitar la administración y captación de halogenados desde el oxigenador, efecto antiinflamatorio y neuroprotector[13]. Sin embargo, la potencial inhibición del efecto cardioprotector de los halogenados y la mayor inestabilidad hemodinámica y awareness con TIVA, limitan la utilización de esta técnica anestésica en CPB[14].
Si bien se necesitan grandes estudios para demostrar un real beneficio de una técnica sobre otra, el efecto cardioprotector de la AH hace que esta técnica sea preferida en CC con CPB. La AHA recomienda el uso de halogenados para mantención de anestesia general en pacientes que van a cirugía de revascularización miocárdica o cualquier paciente con riesgo de isquemia miocárdica[15].
-
2. Implementación segura de anestesia inhalatoria en CPB
La administración de halogenados en CPB debe ser a través del oxigenador del circuito extracorpóreo, lo cual supone una concentración sanguínea inexacta de estos debido a su transferencia a través de una membrana no biológica.
Actualmente, no existen dispositivos específicos para la administración segura de halogenados a través del oxigenador. Cuando se decide utilizar AH en CPB, es importante considerar que los puntos más susceptibles de complicaciones de esta técnica anestésica son el vaporizador, oxigenador y sistema de scavenging[7]. A continuación, se revisará brevemente las consideraciones más relevantes para una administración segura y eficiente (Figura 1).

Figura 1. Anatomía de Anestesia Inhalatoria en CPB. El vaporizador de halogenados fabricados para la máquina de anestesia son adaptados para su uso en CPB. El vaporizador (flecha negra) debe estar al alcance y vista del perfusionista, pero lejos del oxigenador (flecha roja) de polipropileno. Las conexiones de entrada y salida del vaporizador debe ser cuidadosamente posicionada, pues su acodadura puede resultar en graves complicaciones como hipoxia, hipercapnia y awareness. CPB: Cardiopulmonary bypass.
2.1. Oxigenador de membrana
El oxigenador reemplaza la función de los pulmones en la transferencia de halogenados hacia la sangre proveniente del reservorio venoso, siendo clave para la mantención de la anestesia general en CPB. Clásicamente existen dos tipos de oxigenadores, los de difusión y los de fibra hueca. Se recomienda que durante CPB se deben utilizar los oxigenadores de fibra hueca por sobre los de difusión, pues su membrana de polipropileno garantiza una transferencia eficiente de halogenados[16],[17].
2.2. Vaporizadores
Actualmente, los vaporizadores de dial son adaptados para ser conectados a la máquina de CPB; sin embargo, ningún fabricante ha autorizado explícitamente su uso de esta forma. El vaporizador debe estar a la vista y al alcance del perfusionista, tanto para ajustar las concentraciones de halogenados, como para pesquisar cuando el vaporizador este vacío. No obstante, este dispositivo debe estar alejado del oxigenador, pues existen reportes de daño en la carcasa de policarbonato de este relacionadas al derrame accidental de halogenados[18].
El vaporizador adaptado al CPB funciona bajo los mismos principios que cuando es utilizado en una máquina de anestesia. Las conexiones tanto del puerto de entrada como de salida al oxigenador deben ser verificadas, pues cualquier escape u obstrucción del flujo puede determinar graves complicaciones como hipoxia, hipercapnia e incluso awareness.
2.3. Sistema scavenging
La contaminación del pabellón con trazas de halogenados supone algunos riesgos como la exposición laboral del personal y depleción del ozono atmosférico, contribuyendo esto último al efecto invernadero. El instituto nacional de Estados Unidos para la seguridad y salud ocupacional (NIOSH) recomienda que el limite de exposición laboral a halogenados debe ser menor a 2 ppm, muy por debajo del umbral olfatorio del ser humano. Aunque aún es debatible los potenciales efectos adversos, es fundamental evitar la contaminación ambiental, tanto antes como durante el CPB, mediante la implementación de un adecuado sistema de scavenging[7].
A diferencia de la máquina de anestesia, no existe un sistema scavenging para la máquina de CPB. Algunas alternativas han sido publicadas, sin embargo, corresponden a adaptaciones locales como la conexión de la aspiración central al puerto de salida del oxigenador propuesto por Blokker-Veldhuis[19]. Dado al riesgo de embolia aérea por exceso de presión negativa al oxigenador que conlleva este sistema, actualmente se están estudiando algunos dispositivos como membranas adsorbentes.
-
3. Profundidad anestésica
El objetivo más determinante de la anestesia general desde un punto de vista farmacológico y de outcomes perioperatorios
es lograr una DoA optima (inconciencia y amnesia) mediante una dosificación adecuada de hipnóticos, mientras se mantiene la estabilidad hemodinámica del paciente[20].
Cuando se utiliza AH, la concentración al final de la espiración de halogenados (Et) es un medidor indirecto de la concentración sanguínea y cerebral de halogenados. Metaanálisis realizados en todo tipo de cirugías han concluido que un Et entre 0,7 a 1,2 CAM asegura una DoA adecuada, por lo que se ha recomendado mantener los halogenados en dicho ran- go[21]. En CPB, la concentración del halogenados a la salida del oxigenador (Eo) corresponde a un análogo de la Et, y es utilizado para estimar la concentración sanguínea y cerebral de halogenados[22].
Algunos estudios han demostrado correlación entre la Et de sevoflurano e isoflurano y la Eo de los mismos. Por otro lado, existen publicaciones que demuestran una correlación positiva entre la concentración sanguínea de halogenados y su Eo, lo cual implica que la primera puede ser estimada a partir de la segunda, de igual manera como se hace con la Et[3]. Esto es, potencialmente, relevante para los anestesiólogos cardiovasculares que utilizan AH en CPB.
Sin embargo, la administración de halogenados basada en estimaciones poblacionales, las variaciones en la transferencia de estos por las características farmacocinéticas que impone el oxigenador y los cambios farmacodinámicos que supone el CPB, determinan que pacientes reciban dosis inexactas de halo- genados durante la asistencia, siendo la Eo de estos un indicador poco fiable de una DoA adecuada.
-
4. Monitorización de la profundidad anestésica
La sensación de inseguridad que otorga la Eo de halogena- dos como indicador de DoA ha estimulado el uso estandarizado de una anestesia general profunda durante el CPB[20]. La mo- nitorización de la DoA podría evitar una dosificación inadecuada de hipnóticos, por lo que, se han introducido a la practica clínica monitores que otorgan información mas objetiva e individualizada respecto a la DoA[23].
4.1. Electroencefalograma no procesado (EEG)
El EEG es la representación gráfica de la actividad eléctrica en la corteza cerebral subyacente a electrodos instalados en la superficie craneal. La anestesia general produce cambios en la actividad eléctrica cerebral los cuales pueden ser reflejados en el EEG y posteriormente analizados a través de diferentes abordajes. La aproximación más básica es la caracterización de la frecuencia y amplitud de la actividad eléctrica cerebral global en el tiempo del EEG. Este abordaje denominado “dominio- tiempo” permite la formación de patrones EEG representativos de diferentes niveles de DoA, para así ajustar la dosis de hipnóticos de manera individualizada y disminuir las complicaciones de una DoA inadecuada[24]. Sin embargo, este abordaje es imposible en el intraoperatorio por un anestesiólogo no entrenado.
Dado lo anterior, a partir de los años 90 surge mayor interés en descomponer el EEG en sus diferentes frecuencias de onda (theta, delta, alfa, beta, gamma)[23] y su posterior incorporación a algoritmos matemáticos para una interpretación mas rápida y fácil de la información otorgada por este monitor. Este abordaje denominado “dominio-frecuencia” corresponde
al EEG procesado (pEEG), y es utilizado por varios monitores actuales que buscan objetivar fácilmente el nivel de DoA como revisaremos a continuación[6].
4.2. Índices numéricos
Estos monitores se basan en un algoritmo matemático que transforma y resume la actividad eléctrica cerebral en un índice numérico. Estos algoritmos tienen incorporado patrones EEG poblacionales conocidos de cada nivel de conciencia, y cada uno de ellos es representado en una escala de 0 a 100 (Figura 2A), donde el primero refleja una anestesia profunda mientras que el segundo una anestesia más superficial[25]. Si bien se ha reportado que estos índices numéricos no previenen la superficialidad anestésica pese a mostrar un valor sugerente de una hipnosis adecuada[26],[27], la simplicidad de este parámetro ha demostrado ser más aceptable en la práctica clínica que el uso del EEG en la medición de la DoA[21].
Existen varios índices numéricos en el comercio, y en CC ninguno ha demostrado ser superior a otro en la monitoriza- ción de DoA y outcomes posoperatorios. Sin embargo, el BIS es el índice más estudiado y utilizado en escenario quirúrgico[6]. Estudios iniciales determinaron que un BIS en un rango entre 40-60 aseguraba un nivel suficiente de inconciencia[28].
4.3. Espectrograma
Con el tiempo y publicación de varios estudios se delinearon las limitaciones de los índices numéricos en determinar fielmente el nivel de hipnosis[6]. Sin embargo, como veremos a continuación estos índices no corresponden a la única aplicación del pEEG durante la anestesia general.
La descomposición del EEG (Figura 2B) permite observar que cada frecuencia de onda que lo compone tiene una contribución a la actividad eléctrica cerebral global, lo cual se denomina poder de frecuencia. La representación gráfica en el tiempo de cada frecuencia con su respectivo poder corresponde al espectrograma o DSA (density spectral array). Este pEEG representa con colores el poder de cada frecuencia en el tiempo[6] (Figura 2C).
La hipnosis inducida por cada hipnótico es representada mediante un patrón especifico o “huella digital” en el DSA. Lo anteriormente descrito refleja la capacidad del DSA de identificar el mecanismo de acción y circuito cerebral sobre el cual actúa cada hipnótico, siendo así un monitor específico para identificar los diferentes estados de conciencia[29].
Aunque los índices han sido utilizados en los últimos 20 años, múltiples razones explican por qué estos monitores ya no son tan utilizados en la practica anestésica. Primero, los índices no aseguran la prevención del awareness durante la anestesia general. Segundo, estos índices asumen que un valor determinado refleja el mismo estado de conciencia para toda la población. Tercero, los índices no reflejan como los hipnóticos inducen la inconsciencia. Por ultimo, estos monitores sintetizan los valores en base a los extremos de frecuencia. El DSA al demostrar el mecanismo de acción de las drogas y sus efectos en los diferentes circuitos cerebrales permite otorgar un “dibujo” de la sensibilidad del cerebro a los hipnóticos y demostrar así pequeños cambios en el estado anestésico que pasarían inadvertidos con los índices. La tendencia actual en la literatura anestesiológica es promover el uso del DSA, el cual teóricamente ofrece la posibilidad de distinguir entre diferentes agentes anestésicos y los diferentes estados de conciencia[29].
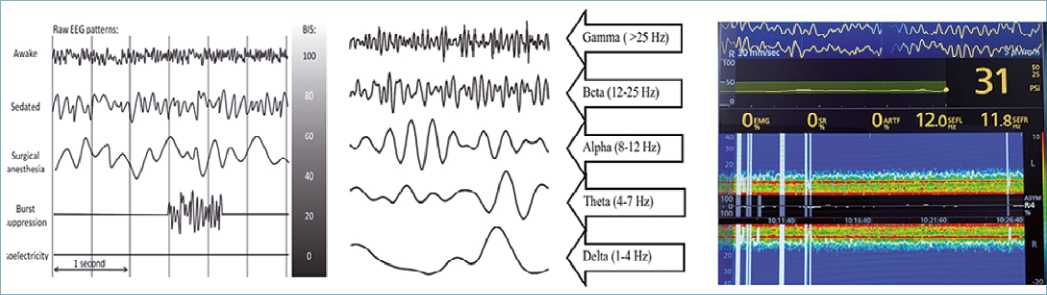
Figura 2. Evolución monitores de DoA. (A) Patrones EEG conocidos de los diferentes estados de conciencia. El pEEG mediante algoritmos matemáticos representa estos patrones en una escala de 0 a 100, sugerentes de una anestesia profunda y superficial respectivamente. El BIS es el índice numérico más utilizado en CC, cuyos valore sugerente de hipnosis adecuada es entre 40-60; (B) La descomposición del EEG en sus diferentes frecuencias de onda permite un análisis más detallado y fácil de la actividad eléctrica cerebral; (C) El DSA corresponde a la representación gráfica del poder, representado en escala color, de cada frecuencia de onda en el tiempo. Permite una lectura simplificada del EEG, además de ser una herramienta más sensible y específica para los diferentes estados de conciencia e hipnóticos. BIS: Biespectral index, DoA: Profundidad anestésica, EEG: electroencefalograma, pEEG: electroencefalograma procesado, DSA: density spectral array.
-
5. Implicancias clínicas en cirugía cardíaca
Los pacientes sometidos a CC son altamente susceptibles a los efectos secundarios de los hipnóticos, especialmente a nivel neurológico y hemodinámico. Por otro lado, como se ha mencionado en párrafos anteriores, la dosificación inexacta de ha- logenados es frecuente en CPB. Por lo tanto, es fundamental la monitorización de la DoA con el objetivo de racionalizar el uso de hipnóticos y así lograr la inconciencia sin mayores efectos colaterales.
Las principales aplicaciones clínicas del pEEG en CC son evitar las consecuencias de una anestesia demasiado superficial (sangrado perioperatorio por hipertensión arterial sistémica, movimiento intraoperatorio, awareness) y profunda (mayor uso de vasopresores por hipotensión arterial sistémica, deli- rium posoperatorio, mortalidad)[6],[27]. Además de los objetivos anteriormente mencionados, últimamente se ha utilizado la combinación del DSA y near infrarred spectroscopy (NIRS) cerebral para evaluar la desaturación cerebral, frecuentemente inadvertida durante los períodos de transición paciente-CPB.
-
5.1. Despertar intraoperatorio o awareness (AWR)
Si bien la concentración de halogenados en sangre arterial se correlaciona con la medida a la salida del oxigenador, muchos estudios no han logrado demostrar que cualquiera de estas se relacione con el BIS[30]. La explicación a este fenómeno radica en que el BIS es solo un indicador de actividad neuronal baja, y no permite diferenciar entre las causas responsables durante CPB como la hipnosis, hemodilución con el priming, bajo debito y la hipotermia. Por lo tanto, la tendencia actual ha sido la utilización de CAM altas para evitar el AWR accidental.
La incidencia de AWR en CC es de 1%-20%, mucho mayor a la reportada en la población quirúrgica general[31]. Los pacientes con deterioro de la función cardíaca e hipertensión pulmonar son susceptibles de compromiso hemodinámico con
la administración de hipnóticos y narcóticos, por lo que la subdosificación anestésica es frecuente en esta población. Además, la presión arterial y frecuencia de pulso presentan gran variabilidad en CC e incluso durante el período de asistencia dependen exclusivamente del CPB, por lo que, son signos clínicos poco fiables para la sospecha de AWR[27].
Algunos estudios han demostrado que la utilización de índices numéricos no es útil para guiar la administración de hipnóticos, y que el AWR podría ocurrir incluso ante valores sugerentes de una hipnosis adecuada[26],[27]. No obstante, basados en los resultados del ensayo B-Aware, podría ser razonable utilizar este monitor rutinariamente para evitar el AWR[32].
Si bien la mayoría de los estudios en CC han sido realizados con BIS, últimamente, el uso del DSA ha ganado mayor terreno. Se ha identificado que, aproximadamente, el 5% de los pacientes sometidos a CC presentan un patrón espectral similar al descrito durante el despertar anestésico, caracterizado por aumento en la frecuencia de ondas alfa y disminución en el poder theta[29],[33] (Figura 3A). La presencia de este patrón, sugerente de superficialidad anestésica, ocurre más frecuentemente en los períodos donde la concentración sanguínea de gases tiene mayor fluctuación, es decir, al inicio y separación del CPB. Por lo tanto, la evaluación del DSA, y dosificación de hipnóticos acorde, durante los periodos de transición paciente-CPB podría ser un método útil para evitar un despertar accidental.
-
5.2. Delirium posoperatorio (POD)
El POD ocurre en el 14%-51% de los pacientes sometidos a CC, y está asociado con una estadía prolongada en cuidados intensivos y con mayor morbimortalidad[34]. Las características EEG de esta complicación están descritas, pero su lectura intraoperatoria resulta impracticable. Aún cuando los monitores basados en pEEG fueron desarrollados para cuantificar la DoA, éstos podrían identificar a los pacientes con mayor riesgo de POD. Además del valor numérico, otros parámetros derivados de estos monitores como el burst supression rate (BSR), porcentaje de actividad cerebral suprimida (< 5 uV por mas de 0,5 segundos) durante los últimos 63 segundos, pueden ser
utilizados con estos fines. La presencia de BSR, sin importar el porcentaje, ha sido identificado como un factor de riesgo para POD, independiente del valor BIS. El BSR no solo representa una administración excesiva de hipnóticos, sino que también una sensibilidad extrema del cerebro a la acción de ellos[35]. Este último caso es observado en pacientes que experimentan BSR con valor BIS normal y puede explicar la mayor mortalidad asociada al POD.
Por otro lado, el DSA además de representar el BSR con franjas negras en el patrón espectral, permite graficar fácilmente las características EEG intraoperatorias de aquellos pacientes que tienen mayor riesgo POD. Este patrón espectral se caracteriza por una disminución en las frecuencias de ondas alfa y aumento en el poder de ondas theta[34] (Figura 3B).
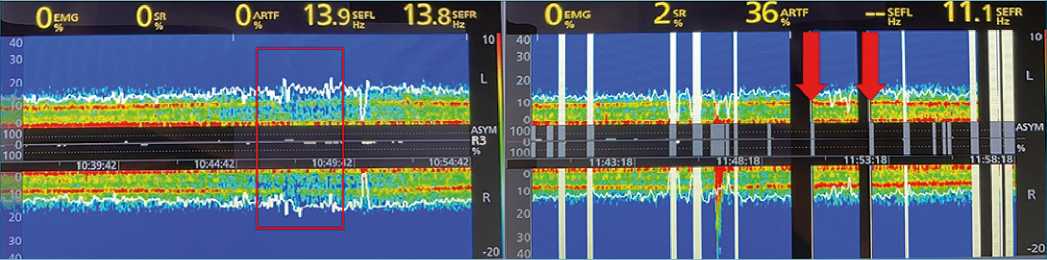
Figura 3. Profundidad Anestésica superficial y profunda. (A) El DSA facilita la identificación de patrones sugerentes de superficialidad anestésica, caracterizado por aumento en frecuencia de ondas alfa y disminución de poder theta. En el cuadro rojo se aprecia este patrón en un paciente sometido a cirugía de revascularización miocárdica en período de weaning del CPB. Esto ocurre por una variación en la concentración de hipnóticos en sitio efecto, frecuente en períodos de transición paciente-CPB; (B) El Burst Supression puede ser identificado fácilmente en el DSA mediante la visualización de franjas negras (flechas rojas), asociado a otros parámetros como el BSR. Esto no solo es sugerente de profundidad anestésica excesiva, sino que también a una mayor sensibilidad a los hipnóticos. BSR: Burst Supression rate, CPB: Cardiopulmonary bypass, DSA: density spectral array.
-
5.3. Hipotensión arterial sistémica y drogas vasoactivas (DVA)
Uno de los mayores efectos adversos asociados con la administración de agentes anestésicos es la hipotensión arterial intraoperatoria. En CC, una presión arterial media (PAM) inferior a 55 mmHg ha sido considerada como el mediador entre DoA y malos outcomes perioperatorios. El consecuente uso de DVA se asocia a mayor disfunción orgánica e isquemia miocárdica[36]. Se ha demostrado que el uso del pEEG disminuye las concentraciones plasmáticas de sevoflurano y, por lo tanto, la depresión hemodinámica que este agente pudiese causar[37]. Esta dosificación individualizada de hipnóticos permitiría conservar el tono vasomotor y respuesta simpática al estimulo quirúrgico, con la consecuente reducción en los requerimientos de DVA (dobutamina y noradrenalina)[36],[37]. Sin embargo, se debe considerar que, en la mayoría de los estudios, los pacientes en los grupos pEEG tenían mayor incidencia de hipertensión y necesidad de vasodilatadores, aunque sin impacto en outcomes.
-
5.4. Mortalidad
Estudios observacionales iniciales demostraron mayor tasa de complicaciones postoperatorias debido a una DoA profunda, aunque correspondieron a análisis post-hoc. Posteriormente, en el ensayo B-Aware quedo en evidencia que un BIS < 45 por más de 5 minutos se asociaba a mayor mortalidad, secundario a la toxicidad e inflamación sistémica causada por el exceso de hipnóticos[32]. El ensayo B-Unaware obtuvo una similar asociación solo en el subgrupo de CC, y ésta fue atribuida a una mayor sensibilidad de esta población a los hipnóticos20.
Clásicamente, la sensibilidad anestésica se define como una DoA excesiva (bajo BIS) con baja concentración de hipnóticos (baja CAM halogenados), y ha sido catalogada como un indicador de fragilidad y factor de riesgo independiente para mayor mortalidad. El mayor estudio observacional acerca de sensibilidad anestésica fue desarrollado en la Clínica de Cleveland, donde se evaluó la asociación entre mortalidad a 30 días y valores bajos de PAM (< 75 mmHg), BIS (< 45) y CAM (< 0,8)[38]. Este estudio permitió clasificar a los pacientes en tres grandes perfiles, cada uno asociado a una fragilidad y mortalidad creciente respectivamente; single low (BIS bajo con PAM y CAM normales), doble low (BIS y PAM bajos con CAM normal) y triple low (BIS, CAM y PAM bajos).
En resumen, la mortalidad también puede ser atribuida a una mayor sensibilidad anestésica a los hipnóticos, indicador de mayor fragilidad, y no solo al efecto per se de éstos.
-
5.5. Evaluación de la actividad cerebral
La isquemia cerebral es una complicación potencial de la CC que puede deteriorar la evolución de los pacientes. La oximetría cerebral no invasiva (NIRS), monitor utilizado como indicador indirecto del balance entre entrega y consumo de oxígeno cerebral, ha sido introducido en la práctica para pesquisar y corregir oportunamente las causas de hipoxia cerebral. En base a este monitor, y su asociación con NIRS somático, se han creado algoritmos que han permitido identificar y corregir la causa de la hipoxia cerebral en el contexto de CC[39].
El pEEG (PSI, BIS, DSA) además de permitir la monitorización de la profundidad anestésica, últimamente ha sido utilizado como una herramienta complementaria al NIRS cerebral y somático para evaluar los cambios en la saturación cerebral. En el algoritmo propuesto por Couture et al., los pacientes sometidos a CC pueden ser clasificados en 4 grandes grupos[40], lo cual facilita la identificación y corrección oportuna de las causas responsables del cambio en la oxigenación cerebral:
A) Disminución del NIRS y pEEG: En este escenario se debe sospechar de hipoxia cerebral debido a un flujo sanguíneo cerebral (FSC) insuficiente. Esto, generalmente, refleja una
reducción en la presión de perfusión cerebral (PPC), cuyas causas pueden ser sistémicas o regionales. El NIRS somático es de gran ayuda en este escenario, pues una reducción simultanea de éste traduce un mecanismo sistémico como causal de la caída en la PPC (anemia, hipoxia y bajo gasto cardíaco) mientras que un aumento de éste refleja un mecanismo regional (congestión venosa, compresión carotidea, canulación selectiva accidental carotidea, embolia).
B) Disminución del NIRS y aumento del pEEG: El mecanismo fisiopatológico responsable de este escenario es el aumento del consumo metabólico cerebral (CMRO2), cuyas causas mas frecuentes en CC y CPB son AWR, hipertermia durante el recalentamiento y crisis convulsivas inadvertidas.
C) Aumento del NIRS y pEEG: Descartada la presencia de artefactos, este escenario refleja un aumento del FSC. Esta hiperemia en CC puede ser vista posterior a la corrección de hipotensión arterial y durante CPB con manejo acido base pH-stat.
D) Aumento del NIRS y reducción del pEEG: Al contrario del escenario anterior, en este el mecanismo fisiopatológico es una reducción del CMRO2. En CC, esto puede observarse durante períodos de hipotermia sistémica en CPB, además de ser un indicador de DoA excesiva.
Por lo tanto, la combinación del pEEG y NIRS como monitores de la actividad y oxigenación cerebral respectivamente, corresponde a una alternativa útil para evaluar las causas en los cambios en la saturación cerebral (Figura 4).
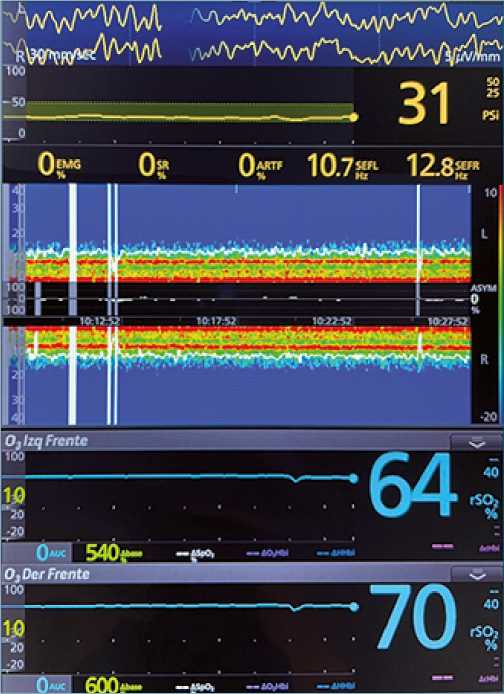
Figura 4. Evaluación de la saturación cerebral. La asociación de pEEG con el NIRS cerebral y somático es útil en la evaluación de las causas de episodios de desaturación cerebral. pEEG: electroencefalograma procesado, NIRS: near infrarred spectroscopy.
-
Conclusiones
Aunque la técnica de elección para la mantención de anestesia general durante el CPB aún es debatible, la AH es la más utilizada por su efecto cardioprotector. Sin embargo, el CPB impone dificultades en la administración de halogenados que determinan una dosificación inadecuada de ellos, siendo una de las consecuencias una DoA inadecuada y mayores complicaciones perioperatorias. Para la monitorización de la DoA, fundamental en CPB, el pEEG ha reemplazado al EEG, siendo el BIS uno de los mas estudiados y utilizados en este escenario. Sin embargo, el DSA ha ganado mayor popularidad al ser altamente sensible y especifico de cada estado de conciencia inducido por los diferentes hipnóticos. El pEEG ha demostrado individualizar y ajustar las dosis de halogenados para mantener la hipnosis mientras se evitan las complicaciones de una dosificación excesiva de estos como POD, mortalidad, hipotensión arterial, uso de DVA. Aunque los resultados son controversiales respecto a la eficacia del pEEG en evitar el AWR, se sugiere su uso rutinario para pesquisarlo oportunamente. Además, el uso de este monitor con el NIRS cerebral y somático ha sido útil en la identificación y corrección de las causas de hipoxia cerebral en CC. Aunque se requiere de mayores estudios, se debe considerar el uso estandarizado del DSA en CC, pues no solo permite evaluar fácilmente los diferentes estados de conciencia, sino que además, identificar a los pacientes con mayor riesgo de complicaciones posoperatorias tales como mortalidad y POD. Por lo tanto, el anestesiólogo cardiovascular debe preocuparse de la monitorización de la actividad eléctrica tanto del corazón como del cerebro.
Referencias
1. Sarkar M, Prabhu V. Basics of cardiopulmonary bypass. Indian J Anaesth. 2017 Sep;61(9):760–7. https://doi.org/10.4103/ija.IJA_379_17 PMID:28970635
2. Gravlee GP, Davis RF, Kurusz M, Utley JR, editors. Historical Development of Cardiopulmonary Bypass: Cardiopulmonary Bypass Principles and Practice. 2nd ed. Philadelphia: Lippincott Williams & Wilkins; 2000. p. 5.
3. Ng KT, Alston RP, Just G, McKenzie C. Assessing the depth of isoflurane anaesthesia during cardiopulmonary bypass. Perfusion. 2018 Mar;33(2):148–55. https://doi.org/10.1177/0267659117735883 PMID:28985693
4. Short TG, Leslie K, Campbell D, Chan MT, Corcoran T, O’Loughlin E, et al. A pilot study for a prospective, randomized, double-blind trial of the influence of anesthetic depth on long-term outcome. Anesth Analg. 2014 May;118(5):981–6. https://doi.org/10.1213/ANE.0000000000000209 PMID:24781568
5. Kaplan JA. Essentials of cardiac Anesthesia for noncardiac surgery. Amsterdam: Elsevier Health Sciences; 2018.
6. Montupil J, Defresne A, Bonhomme V. The Raw and Processed Electroencephalogram as a Monitoring and Diagnostic Tool. J Cardiothorac Vasc Anesth. 2019 Aug;33 Suppl 1:S3–10. https://doi.org/10.1053/j.jvca.2019.03.038 PMID:31279351
7. Neto C, Landoni G, Bezerra F, Cardoso T, Silva C, Stahlschmidt A. Anesthesia Management During Cardiopulmonary Bypass: volatile vs. Intravenous Drugs. Curr Anesthesiol Rep. 2017;7(3):331. https://doi.org/10.1007/s40140-017-0230-9.
8. Yeoh CJ, Hwang NC. Volatile Anesthesia Versus Total Intravenous Anesthesia During Cardiopulmonary Bypass: A Narrative Review on the Technical Challenges and Considerations. J Cardiothorac Vasc Anesth. 2020 Aug;34(8):2181–8. https://doi.org/10.1053/j.jvca.2020.03.013 PMID:32360007
9. Nordén I. The influence of anaesthetics on systemic vascular resistance during cardiopulmonary bypass. Scand J Thorac Cardiovasc Surg. 1974;8(2):81–7. https://doi.org/10.3109/14017437409130738 PMID:4416311
10. De Hert SG, Van der Linden PJ, Cromheecke S, Meeus R, Nelis A, Van Reeth V, et al. Cardioprotective properties of sevoflurane in patients undergoing coronary surgery with cardiopulmonary bypass are related to the modalities of its administration. Anesthesiology. 2004 Aug;101(2):299–310. https://doi.org/10.1097/00000542-200408000-00009 PMID:15277911
11. Landoni G, Pisano A, Lomivorotov V, Alvaro G, Hajjar L, Paternoster G, et al. Randomized Evidence for Reduction of Perioperative Mortality: An Updated Consensus Process. J Cardiothorac Vasc Anesth. 2017 Apr;31(2):719–30. https://doi.org/10.1053/j.jvca.2016.07.017 PMID:27693206
12. McMullan V, Alston RP, Tyrrell J. Volatile anaesthesia during cardiopulmonary bypass. Perfusion. 2015 Jan;30(1):6–16. https://doi.org/10.1177/0267659114531314 PMID:24732827
13. Güçlü ÇY, Ünver S, Aydınlı B, Kazancı D, Dilber E, Özgök A. The effect of sevoflurane vs. TIVA on cerebral oxygen saturation during cardiopulmonary bypass—randomized trial. Adv Clin Exp Med. 2014 Nov-Dec;23(6):919–24. https://doi.org/10.17219/acem/37339 PMID:25618118
14. Likhvantsev VV, Landoni G, Levikov DI, Grebenchikov OA, Skripkin YV, Cherpakov RA. Sevoflurane Versus Total Intravenous Anesthesia for Isolated Coronary Artery Bypass Surgery With Cardiopulmonary Bypass: A Randomized Trial. J Cardiothorac Vasc Anesth. 2016 Oct;30(5):1221–7. https://doi.org/10.1053/j.jvca.2016.02.030 PMID:27431595
15. Hillis LD, Smith PK, Anderson JL, Bittl JA, Bridges CR, Byrne JG, et al. 2011 ACCF/AHA Guideline for Coronary Artery Bypass Graft Surgery: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2011 Dec;124(23):2610–42. https://doi.org/10.1161/CIR.0b013e31823b5fee PMID:22064600
16. Wahba A, Milojevic M, Boer C, De Somer FM, Gudbjartsson T, van den Goor J, et al.; EACTS/EACTA/EBCP Committee Reviewers. 2019 EACTS/EACTA/EBCP guidelines on cardiopulmonary bypass in adult cardiac surgery. Eur J Cardiothorac Surg. 2020 Feb;57(2):210–51. https://doi.org/10.1093/ejcts/ezz267 PMID:31576396
17. Suma K, Tsuji T, Takeuchi Y, Inoue K, Shiroma K, Yoshikawa T, et al. Clinical performance of microporous polypropylene hollow-fiber oxygenator. Ann Thorac Surg. 1981 Dec;32(6):558–62. https://doi.org/10.1016/S0003-4975(10)61798-5 PMID:7316590
18. Nigro Neto C, Landoni G, Cassarà L, De Simone F, Zangrillo A, Tardelli MA. Use of volatile anesthetics during cardiopulmonary bypass: a systematic review of adverse events. J Cardiothorac Vasc Anesth. 2014 Feb;28(1):84–9. https://doi.org/10.1053/j.jvca.2013.05.030 PMID:24295716
19. Blokker-Veldhuis MJ, Rutten PM, De Hert SG. Occupational exposure to sevoflurane during cardiopulmonary bypass. Perfusion. 2011 Sep;26(5):383–9. https://doi.org/10.1177/0267659111409971 PMID:21593084
20. Leslie K, Short TG. Anesthetic depth and long-term survival: an update. Can J Anaesth. 2016 Feb;63(2):233–40. https://doi.org/10.1007/s12630-015-0490-0 PMID:26378002
21. Avidan MS, Jacobsohn E, Glick D, Burnside BA, Zhang L, Villafranca A, et al.; BAG-RECALL Research Group. Prevention of intraoperative awareness in a high-risk surgical population. N Engl J Med. 2011 Aug;365(7):591–600. https://doi.org/10.1056/NEJMoa1100403 PMID:21848460
22. Nigro Neto C, Landoni G, Cassarà L, De Simone F, Zangrillo A, Tardelli MA. Use of volatile anesthetics during cardiopulmonary bypass: a systematic review of adverse events. J Cardiothorac Vasc Anesth. 2014 Feb;28(1):84–9. https://doi.org/10.1053/j.jvca.2013.05.030 PMID:24295716
23. Fahy BG, Chau DF. The Technology of Processed Electroencephalogram Monitoring Devices for Assessment of Depth of Anesthesia. Anesth Analg. 2018 Jan;126(1):111–7. https://doi.org/10.1213/ANE.0000000000002331 PMID:28786839
24. Clark DL, Rosner BS. Neurophysiologic effects of general anesthetics. I. The electroencephalogram and sensory evoked responses in man. Anesthesiology. 1973 Jun;38(6):564–82. https://doi.org/10.1097/00000542-197306000-00011 PMID:4145825
25. Lewis C, Parulkar SD, Bebawy J, Sherwani S, Hogue CW. Cerebral Neuromonitoring During Cardiac Surgery: A Critical Appraisal With an Emphasis on Near-Infrared Spectroscopy. J Cardiothorac Vasc Anesth. 2018 Oct;32(5):2313–22. https://doi.org/10.1053/j.jvca.2018.03.032 PMID:30100271
26. Whitlock EL, Villafranca AJ, Lin N, Palanca BJ, Jacobsohn E, Finkel KJ, et al. Relationship between bispectral index values and volatile anesthetic concentrations during the maintenance phase of anesthesia in the B-Unaware trial. Anesthesiology. 2011 Dec;115(6):1209–18. https://doi.org/10.1097/ALN.0b013e3182395dcb PMID:22037642
27. Kertai MD, Whitlock EL, Avidan MS. Brain monitoring with electroencephalography and the electroencephalogram-derived bispectral index during cardiac surgery. Anesth Analg. 2012 Mar;114(3):533–46. https://doi.org/10.1213/ANE.0b013e31823ee030 PMID:22253267
28. Johansen JW, Sebel PS, Fisher DM. Development and clinical application of electroencephalographic bispectrum monitoring. Anesthesiology. 2000 Nov;93(5):1336–44. https://doi.org/10.1097/00000542-200011000-00029 PMID:11046224
29. Purdon PL, Sampson A, Pavone KJ, Brown EN. Clinical Electroencephalography for Anesthesiologists: Part I: Background and Basic Signatures. Anesthesiology. 2015 Oct;123(4):937–60. https://doi.org/10.1097/ALN.0000000000000841 PMID:26275092
30. Nitzschke R, Wilgusch J, Kersten JF, Goepfert MS. Relationship between Sevoflurane Plasma Concentration, Clinical Variables and Bispectral Index Values during Cardiopulmonary Bypass. PLoS One. 2015;10(8):e0134097. Published 2015 Aug 27. https://doi.org/10.1371/journal.pone.0134097.
31. Smith D, Goddard NG. Awareness in cardiothoracic anaesthetic practice e where now after NAP5? Anaesthesia 2015; 70: 130e4 https://doi.org/10.1111/anae.12952.
32. Myles PS, Leslie K, McNeil J, Forbes A, Chan MT. Bispectral index monitoring to prevent awareness during anaesthesia: the B-Aware randomised controlled trial. Lancet. 2004 May;363(9423):1757–63. https://doi.org/10.1016/S0140-6736(04)16300-9 PMID:15172773
33. Kaiser HA, Peus M, Luedi MM, Lersch F, Krejci V, Reineke D, et al. Frontal electroencephalogram reveals emergence-like brain activity occurring during transition periods in cardiac surgery. Br J Anaesth. 2020 Sep;125(3):291–7. https://doi.org/10.1016/j.bja.2020.05.064 PMID:32682555
34. Soehle M, Dittmann A, Ellerkmann RK, Baumgarten G, Putensen C, Guenther U. Intraoperative burst suppression is associated with postoperative delirium following cardiac surgery: a prospective, observational study. BMC Anesthesiol. 2015 Apr;15(1):61. https://doi.org/10.1186/s12871-015-0051-7 PMID:25928189
35. Whitlock EL, Torres BA, Lin N, Helsten DL, Nadelson MR, Mashour GA, et al. Postoperative delirium in a substudy of cardiothoracic surgical patients in the BAG-RECALL clinical trial. Anesth Analg. 2014 Apr;118(4):809–17. https://doi.org/10.1213/ANE.0000000000000028 PMID:24413548
36. Sponholz C, Schuwirth C, Koenig L, Hoyer H, Coldewey SM, Schelenz C, et al. Intraoperative reduction of vasopressors using processed electroencephalographic monitoring in patients undergoing elective cardiac surgery: a randomized clinical trial. J Clin Monit Comput. 2020 Feb;34(1):71–80. https://doi.org/10.1007/s10877-019-00284-1 PMID:30784008
37. Nitzschke R, Wilgusch J, Kersten JF, Trepte CJ, Haas SA, Reuter DA, et al. Bispectral index guided titration of sevoflurane in on-pump cardiac surgery reduces plasma sevoflurane concentration and vasopressor requirements: a prospective, controlled, sequential two-arm clinical study. Eur J Anaesthesiol. 2014 Sep;31(9):482–90. https://doi.org/10.1097/EJA.0000000000000106 PMID:24927118
38. Sessler DI, Sigl JC, Kelley SD, Chamoun NG, Manberg PJ, Saager L, et al. Hospital stay and mortality are increased in patients having a “triple low” of low blood pressure, low bispectral index, and low minimum alveolar concentration of volatile anesthesia. Anesthesiology. 2012 Jun;116(6):1195–203. https://doi.org/10.1097/ALN.0b013e31825683dc PMID:22546967
39. Denault A, Deschamps A, Murkin JM. A proposed algorithm for the intraoperative use of cerebral near-infrared spectroscopy. Semin Cardiothorac Vasc Anesth. 2007 Dec;11(4):274–81. https://doi.org/10.1177/1089253207311685 PMID:18270192
40. Couture EJ, Deschamps A, Denault AY. Patient management algorithm combining processed electroencephalographic monitoring with cerebral and somatic near-infrared spectroscopy: a case series. Can J Anaesth. 2019 May;66(5):532-539. English. https://doi.org/10.1007/s12630-019-01305-y..

 ORCID
ORCID