Héctor J. Lacassie1*, Martín Lacassie2, Emilia Lacassie3
Recibido: 24-07-2022
Aceptado: 26-07-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 6 pp. 623-635|https://doi.org/10.25237/revchilanestv5127091144
PDF|ePub|RIS
Neurologic complications and infections after neuraxial analgesia for labor
Abstract
Most peripartum neurological complications are due to compressive neuropathy secondary to obstetric causes and usually recover sponta- neously. The incidence of permanent neurological injury after neuraxial anesthesia is very rare. The suspicion and rapid evaluation of a possible complication favors a good outcome.
Resumen
La mayoría de las complicaciones neurológicas periparto se deben a una neuropatía compresiva secundaria a causas obstétricas que habitualmente se recuperan espontáneamente. La incidencia de lesión neurológica permanente después de la anestesia neuroaxial es muy infrecuente. La sospecha y rápida evaluación de una posible complicación favorece un buen desenlace.
-
Introducción
Si bien la analgesia y anestesia neuroaxial es generalmente segura, pueden ocurrir eventos adversos. En obstetricia, la situación es aún más segura, principalmente porque se trata de mujeres jóvenes, habitualmente sanas y sin alteraciones del neuroeje que favorezcan un accidente o evento adverso.
En 2003, hubo más de 4 millones de nacidos en EEUU. En aquellos hospitales con más de 1.500 nacimientos/año, cerca de 60% recibió algún tipo de analgesia neuroaxial. En el Reino Unido 2,4 millones de mujeres reciben analgesia epidural para el parto, lo que representa cerca del 35% del total. En Canadá, las cifras son de 45%, mientras que en Francia son 51%[1] y 51,5% en Chile en el año 2011[2]. Esto pone en perspectiva el enorme número de procedimientos neuroaxiales realizados en embarazadas en nuestro país y en el mundo.
Las complicaciones neurológicas más temidas frente a un procedimiento anestésico en el neuroeje son principalmente: procesos expansivos epidurales (hematomas o abscesos), infecciones neuroaxiales (abscesos epidurales o infección intratecal) y lesiones neurales directas. Este tipo de eventos son muy infrecuentes, por lo que su estimación de riesgo se realiza en base a estudios pequeños, reportes de casos, evidencia indirecta y sentido común[3]. Intencionalmente quedará afuera del análisis la cefalea pospunción meníngea y sus consecuencias[4], ya que requieren un artículo propio dada su alta frecuencia relativa.
En un reciente metaanálisis, Ruppen y cols., de la Universidad de Oxford, evaluaron más de 27 publicaciones que incluyeron sobre 1,3 millones de pacientes obstétricas. Los estudios seleccionados incluyeron reportes de casos, cohortes retrospectivas y algunos estudios prospectivos, desde 1966 a 2005[1]. Ahí pudieron determinar la incidencia de complicaciones graves de pacientes obstétricas que recibieron analgesia epidural para trabajo de parto (Tabla 1).
Tabla 1. Tasa de eventos para complicaciones
| Desenlace | Pacientes | Eventos | Riesgo individual (1 en:) | Número por millón |
| Hematoma epidural | 1.100.299 | 6 | 183.383 | 5 |
| Infección | 1.208.698 | 11 | 109.882 | 6 |
| Daño neurológico persistente | 770.938 | 3 | 256.979 | 4 |
| Daño neurológico transitorio | 987.218 | 254 | 3.887 | 257 |
Modificado de Ruppen y cols[1].
Desgraciadamente, las cifras crecen cuando se consideran todas las pacientes obstétricas, con o sin antecedentes de punción neuroaxial, donde la mayor parte de las complicaciones neurológicas son secundarias al embarazo propiamente tal o bien a las maniobras obstétricas del proceso del parto[3]. Esto hace manifiesta la necesidad de conocer en detalle las posibles complicaciones que pudieran afectar a las pacientes, de cómo debiese ser el abordaje para intentar solucionarlas y disponer de la mejor información para educar sobre el pronóstico de las lesiones. Es muy deseable que los anestesiólogos conozcamos en detalle las posibles fuentes de complicaciones, su prevención, evolución, tratamiento y pronóstico.
El objetivo de este artículo es revisar las características de las neuropatías obstétricas intrínsecas, las lesiones nerviosas relacionadas con la anestesia neuroaxial y la evaluación y manejo de las manifestaciones posparto que sugieren una lesión nerviosa.
-
Neuropatías obstétricas intrínsecas
Las neuropatías causadas por el embarazo y el parto son la causa más común de síntomas neurológicos en obstetricia y ocurren en hasta casi 1% de las mujeres después del parto[5].
Son aquellas atribuidas al embarazo, trabajo de parto y al parto en sí. A menudo son sensitivas o motoras, involucran múltiples raíces nerviosas lumbosacras y generalmente se resuelven en un período corto de tiempo (6 a 8 semanas).
Como factores de riesgo se han identificado la nuliparidad, trabajos de parto prolongados y el uso de fórceps[5]. En la población general se ha determinado que la posición de litotomía prolongada, especialmente por más de dos horas, es un importante factor de riesgo para neuropatías de extremidad inferior[6].
Los nervios que suelen lesionarse en el proceso del parto son: el plexo lumbosacro, el nervio femoral, el nervio obturador, el nervio fibular común, el nervio femorocutáneo lateral y el nervio ciático. Las lesiones habitualmente se deben a neuropraxia por la presentación fetal, parto con fórceps y posicio- namiento inadecuado de la paciente[7]. Conocer cada uno de estas posibles lesiones orientan al clínico y pudieran descartar una lesión de origen anestésico (Tabla 2).
-
Plexopatía lumbosacra intraparto y neuropatía fibular común1
El plexo lumbosacro, originado en la raíces L4-S4 puede dañarse por compresión del tronco lumbosacro (L4-5) contra el ala del sacro (Figura 1). Como factores de riesgo se han identificado: baja estatura, feto grande, trabajo de parto prolongado y uso de fórceps[8]. La presentación habitual es un pie caído e hi- poestesia de la cara lateral de la pierna y dorso del pie, síntomas del todo similares a la compresión del nervio ciático en el muslo o el nervio fibular común más a distal (Figuras 2a y 2b). Este último se puede comprimir al posicionar a la paciente para el parto, produciéndose una neuropraxia contra la cabeza fibular (Figura 3). Estudios de conducción neural permitirán dilucidar la altura de la lesión, sin embargo, la anamnesis y examen físico dirigido permiten un diagnóstico muy certero en la mayoría de los casos. Se puede ver un ejemplo de lesión nerviosa y su investigación etiológica en la Tabla 3.
-
Neuropatía femoral
El nervio femoral (L2-3-4) puede lesionarse durante el parto vaginal y la cesárea. La parálisis del nervio femoral se ha atribuido a una fuerte flexión de los muslos sobre el abdomen con abducción y rotación externa de las caderas que presumiblemente comprime el nervio femoral contra el canal inguinal[7]. Es la segunda neuropatía más frecuente del embarazo.
Los síntomas de la parálisis del nervio femoral dependerán del sitio exacto de la lesión, pero pueden incluir flexión limitada del muslo, pérdida de fuerza del cuádriceps, reflejo rotuliano ausente o reducido (el signo objetivo más confiable de neuropatía femoral[7] y pérdida de sensibilidad en la cara ántero medial del muslo[9] (Figuras 2b y 3). La función de los músculos aductores estará conservada, que son dependientes del nervio obturador, dependientes de las mismas raíces (L2-3-4) que el nervio femoral (Figura 4), lo que permitirá hacer el diagnóstico diferencial de si la lesión es del nervio o las raíces.
-
Neuropatía obturatriz
El nervio obturador (L2-4) es un nervio mixto, que junto al nervio femoral, constituyen la ramas terminales del plexo lumbar. Puede lesionarse con la cabeza fetal o con fórceps. Los casos posparto suelen ser unilaterales y combinados con neuropatía femoral, pero se han producido casos bilaterales. Como síntoma de compresión del nervio, la paciente puede quejarse de dolor agudo en la ingle y la cara interna del muslo. Más tarde, se encontrará debilidad en la aducción y rotación de la cadera, generalmente acompañada de una disminución de la percepción del tacto ligero y dolor punzante en la parte superior e interna del muslo (Figuras 2b y 4). Debiera conservarse la función del cuádriceps, que está inervado por el nervio femoral (L2-4), a menos que sea por una lesión radicular (L2-4), donde ambos nervios estarán comprometidos.
Tabla 2. Toma de decisión frente al diagnóstico de Pie caído posparto

-
Mononeuritis del nervio femorocutáneo lateral (meralgia parestésica de Berhardt-Roth)
Meralgia parestésica es un término usado para describir la mononeuritis del nervio femorocutáneo lateral (L2 y L3), que es un nervio sensitivo puro[10]. Es la neuropatía más frecuente del embarazo. Por lo general, es causado por un traumatismo o compresión del nervio, habitualmente en su paso bajo el ligamento inguinal. Se produce hipoestesia o disestesia en la cara ántero lateral del muslo (Figuras 2a y 4), sin compromiso motor. La meralgia parestésica suele comenzar alrededor de la semana 30 de gestación. Son factores de riesgo para su aparición la obesidad y el aumento en la presión intra abdominal en la segunda etapa del trabajo de parto[7]. De existir dolor, se puede infiltrar anestésico local en el área sensible a lo largo del ligamento inguinal. Normalmente, es auto limitado y se resuelve alrededor de los tres meses[7].
Así, frente al síntoma de muslo dormido, se puede tener una aproximación clínica bayesiana o probabilística de descarte, útil para la toma de decisiones y aproximación pronóstica (Figura 5).
Es importante destacar que muchas de estas lesiones ocurren en trabajos de partos prolongados y dificultosos o que requirieron instrumentalización. Coincidentemente, aquellos son factores de riesgo para recibir analgesia neuroaxial, por lo que es muy fácil concluir que la potencial lesión neurológica es secundaria al bloqueo anestésico, lo que habitualmente no es así. Sin embargo, la analgesia pudiera contribuir, ya que pudiera prolongar las etapas del trabajo de parto y la necesidad de uso de fórceps[11], sumado a que las pacientes con bloqueo sensitivo pueden no apreciar los síntomas de una lesión nerviosa inminente y no cambien la posición de su cuerpo de manera oportuna[5].

Figura 1. Plexo lumbosacro (L4-S4). Sus nervios terminales son el ciático y pudendo (S2-S3 y S4).
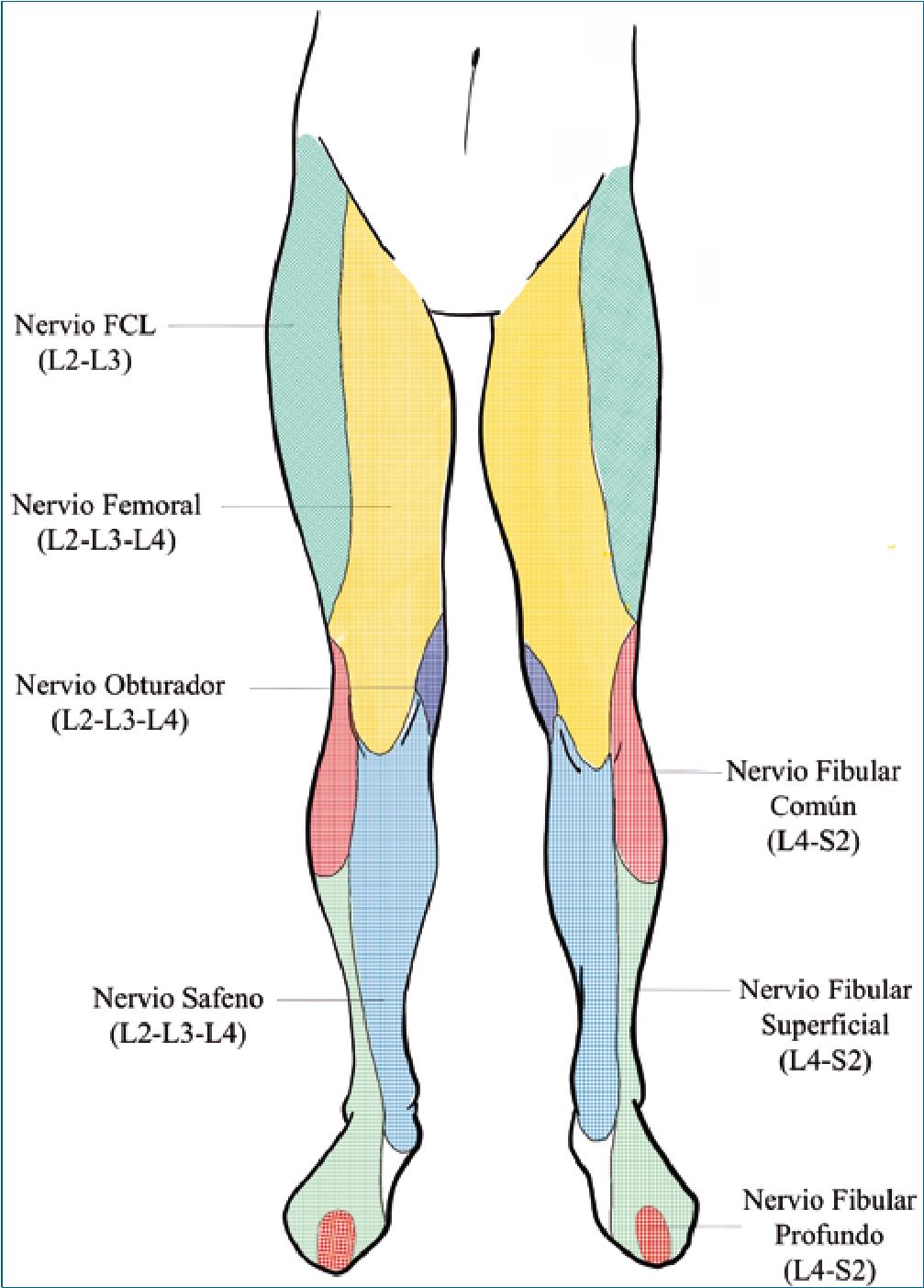
Figura 2a. Distribución sensitiva de los nervios en las extremidades inferiores. FCL: nervio femorocutáneo lateral.
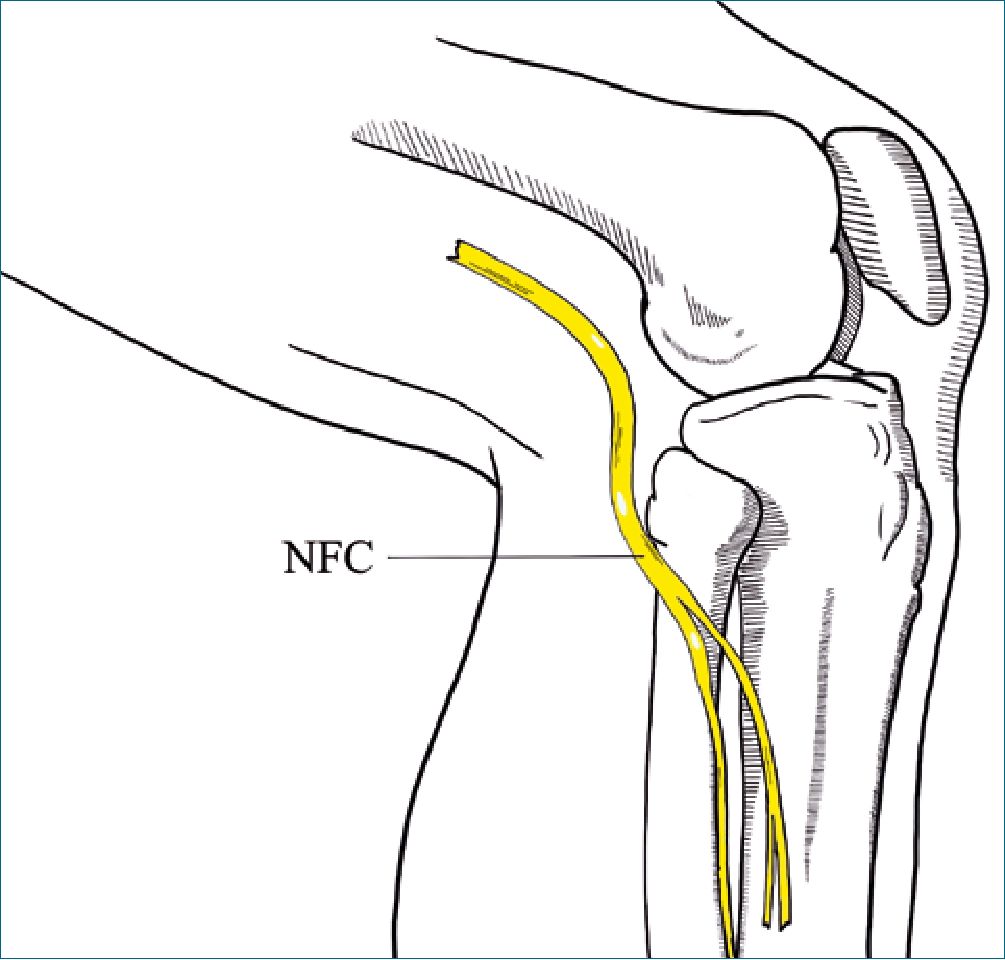
Figura 3. Nervio fibular común (NFC) en su paso por lateral de la cabeza fi- bular, que puede ser comprimido por una posición de litotomía inadecuada. Una lesión a ese nivel habitualmente generará un déficit sensitivo y motor.
Tabla 3. Lesiones nerviosas de origen obstétrico
| Nervio | Raíces nerviosas | Déficit sensitivo | Déficit motor |
| Nervio FCL | L2-L3 | Muslo ántero lateral | No |
| Nervio femoral | L2-L3-L4 | Muslo ántero medial | Flexión muslo, extensión rodilla, reflejo rotuliano |
| Nervio obturador | L2-L3-L4 | Muslo medial y rodilla | Aducción muslo |
| Plexo lumbosacro | L4-S4 | Pierna lateral y dorso del pie | Dorsiflexión y eversión del pie |
| Nervio fibular | L4-S2 | Pierna y pie antero lateral | Dorsiflexión y eversión del pie y ortejos |
| Nervio ciático | L4-S4 | Glúteos, muslos, pierna y pie por posterior | Flexión rodilla |
FCL: femorocutáneo lateral; Modificado de Wong y cols.[9].

Figura 2b. Distribución sensitiva de los nervios en las extremidades inferiores. FCL: nervio femorocutáneo lateral; CPM: nervio cutáneo posterior del muslo.
Adicionalmente, hay que considerar que las pacientes pueden tener preexistencias que condicionen una neuropatía posparto. En este contexto pudiera aparecer, por ejemplo, una hernia del núcleo pulposo de L5 subclínica, que se hace evidente en el posparto. También pueden manifestarse neuropatías hereditarias como aquella con susceptibilidad a la parálisis por presión (NHPP), la que está dada por una mutación en el cromosoma 17 del gen que codifica para la proteína de mieli- na periférica 22 (PMP22)[12]. Se caracteriza por una tendencia a desarrollar una mono neuropatía, comúnmente en lugares anatómicos donde el nervio es más superficial y vulnerable a la compresión externa, como por ejemplo, el nervio fibular común en su trayecto alrededor de la cabeza fibular (Figura 3).
Esto hace manifiesta la necesidad de una buena historia clínica, además de optimizar la técnica analgésica, utilizando las mínimas concentraciones de anestésicos locales, suficientes para abolir el dolor, pero preservando la propiocepción y capacidad motora de las extremidades inferiores.
-
Lesiones nerviosas relacionadas con la anestesia neuroaxial
La incidencia de lesiones nerviosas relacionadas con la anestesia neuroaxial en pacientes obstétricas afortunadamente es muy infrecuente. Ruppen y cols., en un metaanálisis que incluyó más de 1,3 millones de embarazadas, de aquellas pacientes que recibieron anestesia neuroaxial para su parto reportó 20 casos cuyo desenlace fue: hematoma epidural, infección epidural profunda o daño neurológico persistente. Mucho más frecuente fue la presencia de daño neurológico transitorio, con más de 250 casos[1].
La baja frecuencia de estos desenlaces es posible que se deba a que las pacientes obstétricas son habitualmente jóvenes y sanas. Los déficits neurológicos durante el parto pueden ocurrir espontáneamente por el proceso del parto o secundarios al acto anestésico. Cabe destacar que muchos de los reportes no tienen una causalidad clara entre el efecto adverso y la anestesia[13]. Algunos autores han encontrado lesiones neurológicas en pacientes sin antecedentes de punción neuroaxial, aunque sí, en 85% de los casos secundario al uso de fórceps[14]. Similar situación ha sido reportada para la aparición de hematomas y abscesos epidurales, donde no ha habido evidencia de instru- mentalización del neuroeje.
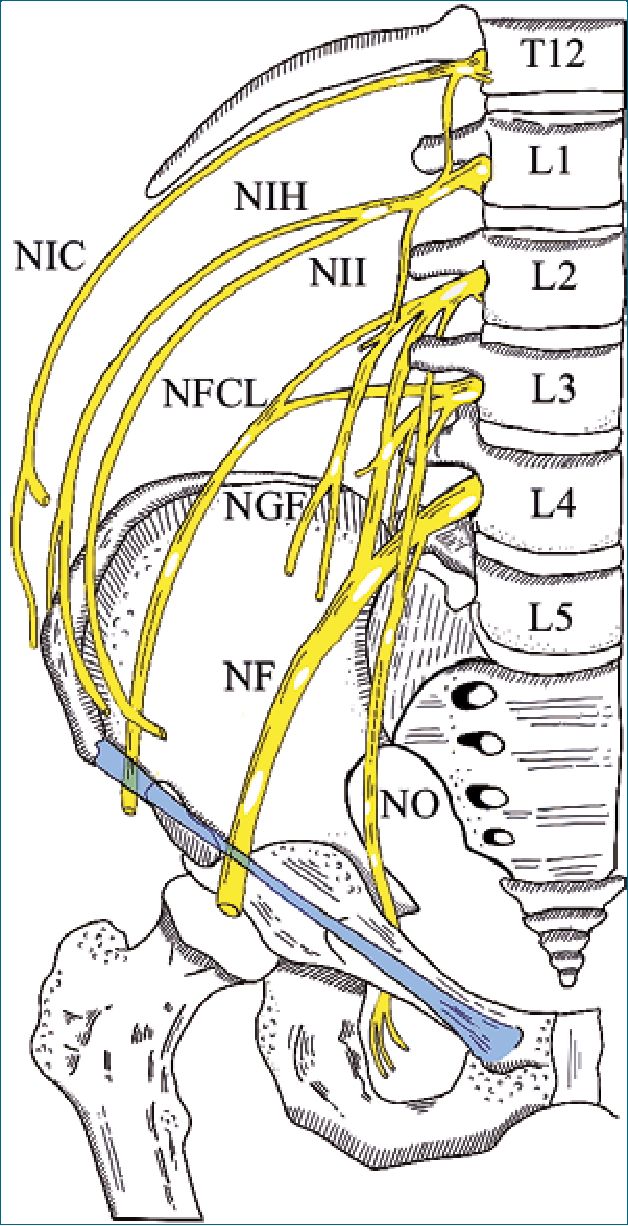
Figura 4. Plexo lumbar derecho. NIH: nervio iliohipogástrico (T12-L1); NIC: nervio intercostal (T12); NII: nervio ilioinguinal (L1); NFCL: nervio femorocutáneo lateral (L2-L3); NGF: nervio génitofemoral (L1-L2); NF: nervio femoral (L2-L3-L4); NO: nervio obturador (L2-L3-L4). Se omiten las raíces sacras.

Figura 5. Algoritmo de diagnóstico probabilístico frente al síntoma de “muslo dormido” en el posparto. Cajas con color indican el territorio potencialmente afectado. n. FCL: nervio femorocutáneo lateral.
-
Hematoma epidural
La tasa global de hematoma epidural en embarazadas que reciben analgesia epidural es de 1:183.000 o 5 por millón (IC95% 1-11)[1], que es algo menor al riesgo anual de morir al atorarse con comida (1:160.000)[13]. A su vez, los hematomas son cerca de 3 veces más frecuentes luego de una punción epidural que de una espinal en la población general[15]. En las embarazadas, los reportes de casos se han asociado a pacientes con coagulopatías secundarias a grandes sangrados, preeclampsia o al síndrome que incluye hemólisis, elevación de enzimas hepáticas y trombocitopenia (HELLP)[16]. Importantemente, 30%-50% de los hematomas han ocurrido al retirar el catéter epidural[15]. En la Pontificia Universidad Católica de Chile hubo un caso de hematoma epidural en los últimos 40 años, en un paciente que se le instaló un catéter intratecal para drenaje de líquido cefalorraquídeo en el contexto de una cirugía de endoprótesis aórtica. Desafortunadamente, el paciente tenía una disfunción plaquetaria no diagnosticada2. Esto da una tasa aproximada de 1 en 90.000 a 120.000 para la institución. No hay casos reportados en embarazadas, por lo que el límite superior del intervalo de confianza 95% (IC95%) para esta población es de aproximadamente 3-4 casos por millón.
El bajo riesgo de hematoma epidural en la embarazada comparado con el de mujeres añosas (1:3.600)[16] pudiera estar dado porque una columna joven tolera mejor la acumulación de volumen, habiéndose demostrado con imágenes el escape transforaminal de parches de sangre hacia el espacio paravertebral en cinco pacientes jóvenes[17], lo que da un margen de seguridad frente a procesos expansivos como un hematoma.
Además, en embarazadas recibiendo heparina no fraccionada en dosis habituales para una paciente no embarazada (10.000 UI s.c.), el comportamiento farmacocinético y farmaco- dinámico estará alterado, por lo que su peak plasmático y tiempo total de tromboplastina activado estarán disminuidos[18], proporcionándole una protección adicional frente a una potencial intervención neuroaxial.
Los primeros síntomas de un hematoma espinal son de déficit sensitivo y motor de las extremidades inferiores o manifestaciones secundarias a la compresión de las raicillas de la cola de caballo (disfunción vesical y rectal). El dolor es mucho menos frecuente. Síntomas bilaterales o aquellos no típicamente de neuropatías de causa obstétrica requieren investigación inmediata con neuroimágenes. De comprobarse, el tratamiento para la restitución neurológica completa es la laminectomía dentro de las primeras ocho horas del inicio de síntomas.
La aparición de un hematoma epidural generalmente se ve en relación a factores de riesgo agregados como pacientes con profilaxis o en tratamiento anticoagulante, trombocitopenia del embarazo, síndrome hipertensivo del embarazo, síndrome de HELLP o antecedentes de trastornos de la coagulación.
Frecuentemente, se aduce que la patología de columna y su instrumentalización para corrección sería un factor de riesgo para complicaciones de una punción epidural para trabajo de parto, incluyendo una falla en su efectividad analgésica, estimándose históricamente una tasa de éxito de las técnicas neuroaxiales de aproximadamente 50%. Recientemente, Bauchat y cols., estudiaron a 41 parturientas con antecedente de corrección quirúrgica de escoliosis, en las que se intentó dar analgesia neuroaxial. Si bien la punción fue más laboriosa que en pacientes sin instrumentalización neuroaxial, se logró una analgesia satisfactoria en el primer intento en 88% del grupo de instrumentación espinal, sin agregar morbilidad[19]. Esto da un matiz de optimismo frente a estas pacientes, pero a su vez, uno de alerta por el potencial riesgo del procedimiento.
Actualmente, las correcciones de curvaturas de columna se están haciendo cada vez más frecuentes y muchas de estas pacientes requerirán analgesia para un eventual trabajo de parto. Está por verse si las complicaciones derivadas de la analgesia neuroaxial pudieran aumentar en este subgrupo (Figura 6). Por el momento, no pareciera ser el caso[19].
Figura 6. Foto de corrección de escoliosis idiopática en paciente de 11 años.
La situación frente a la embarazada con trombocitopenia ha sido motivo de largo debate. En un análisis retrospectivo multicéntrico que incluyó 102 epidurales y 71 espinales en embarazadas con recuentos plaquetarios menores a 100.000/ mm3, Goodier y cols., no mostró casos de hematoma espinal o epidural[20]. El riesgo de hematoma epidural en la población no obstétrica aumenta cuando el recuento de plaquetas cae por debajo de aproximadamente 70.000/mm3 y en mayor grado cuando el recuento de plaquetas es inferior a 50.000/ mm3[21]. En obstetricia, la evidencia disponible indica que es probable que el riesgo de hematoma epidural o espinal asociado con un recuento de plaquetas mayor a 70.000/mm3 sea muy bajo en trombocitopenias secundarias a trombocitopenia gestacional, trombocitopenia inmunitaria y trastornos hipertensivos del embarazo, en ausencia de otros factores de riesgo[21]. Posiblemente, esto se deba a la hipercoagulabilidad propia del embarazo[22].
Dado que la incidencia de hematoma epidural en la embarazada es tan bajo, los estudios poblacionales en los que generalmente no hay casos reportados, el cálculo del límite superior del IC 95% para hematoma epidural arroja valores que permiten hacerse una idea del riesgo al que se someten las pacientes y contrastarlo contra el costo alternativo, que es administrar anestesia general en la paciente embarazada (Tabla 3). Goodier y cols., observó una tasa de complicaciones graves de 6,5% (1 aspiración, 3 casos de intubación traqueal prolongada y 1 de hemoptisis) en su cohorte de pacientes con trombocitopenia que no recibieron anestesia neuroaxial y que recibieron anestesia general en su lugar[20] (Tabla 4).
Así, ¿cuán bajo se puede llegar en el recuento plaquetario para ofrecer una anestesia neuroaxial razonablemente segura en la embarazada? Al día de hoy, el área de más controversia está entre recuentos plaquetarios de 70.000 y 50.000/mm3. Algunos expertos opinan que la mayoría de los anestesiólogos tendrán un nivel de preocupación diferente en una paciente con un recuento de plaquetas de 70.000/mm3 con preeclampsia grave y hematomas cutáneos extensos que en una paciente asintomática con el mismo recuento de plaquetas y púrpura trombocitopénica idiopática estable[24]. En muchas pacientes con recuentos de plaquetas entre 50.000 y 70.000/mm3 e incluso en algunas pacientes con recuentos inferiores a 50.000/ mm3, los beneficios de un procedimiento anestésico neuroaxial superarán los riesgos[22], optando por esta alternativa en vez de una técnica general.
| Tabla 4 Límite superior del intervalo de confianza 95% (IC 95%) para hematoma epidural de acuerdo a recuento placentario en embarazadas | ||
| Recuento | Límite superior | Tasa de |
| plaquetario (mm3) | del IC 95% para | complicaciones |
| hematoma | graves por | |
| epidural | anestesia general | |
| < 100.000 | 0,16% | |
| 99.000-70.000 | 0,19% | 6,5% |
| 69.000-50.000 | 2,6% | |
| < 50.000 | 9% | |
Modificado de Levy y cols. [23] y Goodier y cols. [20]
En resumen, la embarazada tendrá un cierto grado de protección contra la aparición de un hematoma neuroaxial por ser en general joven, sana, con tendencia a la hipercoagulabilidad, sin patología de columna y con un comportamiento farmacocinético y farmacodinámico alterado para anticoagulantes como la heparina de bajo peso molecular.
-
Infección epidural
Los abscesos epidurales secundarios a una punción anestésica neuroaxial son muy peligrosos, pudiendo resultar en compresión medular, arterial o venosa que determinen una isquemia medular y eventualmente una parálisis (Figura 7).
La tasa global de infección epidural en embarazadas que reciben analgesia epidural es de 1:145.000 o 7 por millón (IC95% 2-12)[1], que es algo menor al riesgo anual de morir al andar en bicicleta (1:130.000)[13].
La etiopatogenia tras una infección epidural, en el contexto de una punción epidural, es la de proliferación de gérmenes, más frecuentemente el Estafilococo aureus, en la forma de un absceso. Estos gérmenes habitualmente son parte de la flora cutánea y están implicados en la contaminación de implantes[25]. Generalmente, se originan por un mal manejo de la esterilidad del material quirúrgico, infección en el sitio de punción epidural por bacterias del microbioma de la piel o por introducción del agente infeccioso en la inyección epidural. El análisis de casos ha demostrado que el riesgo de infección epidural aumenta con el tiempo de cateterización[7]. Cabe mencionar que también se han aislado Estreptococos sp., los que pueden tener una diseminación hematógena (ej. desde la vagina)[7].

Figura 7. Corte transversal a nivel de T4, evidenciando una colección epidural que tiene efecto de masa desviando la médula espinal.
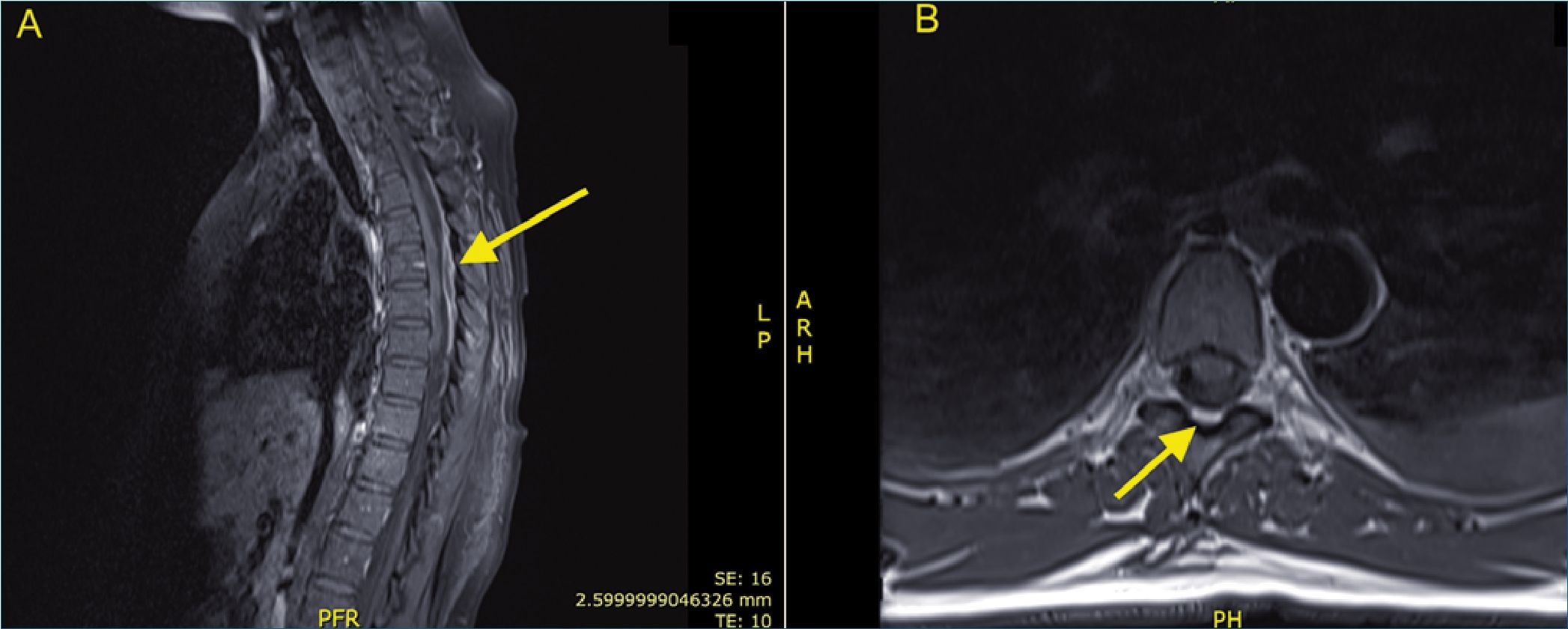
Figura 8. Resonancia nuclear magnética de absceso epidural T6-7 (flechas). A. Corte sagital en secuencia T1 con gadolinio; B. Corte transversal en secuencia T1.
En un estudio Sueco, retrospectivo, de complicaciones neu- rológicas graves luego de un procedimiento anestésico neuroa- xial, Moen y cols., detectaron 42 casos de etiología infecciosa. De ellos, un tercio fueron abscesos epidurales y dos tercios meningitis purulenta. De los 13 abscesos reportados, ocho eran mujeres, donde 12 fueron pospunción epidural y uno posbloqueo espinal. Solo uno ocurrió en una embarazada, donde se detectó como factor de riesgo complicaciones técnicas en la punción epidural. De los siete casos que tuvieron cultivos positivos, se aislaron Estafilococos sp.[16].
En nuestra institución tuvimos un caso de absceso epidural en una paciente joven no embarazada, a la que se le instaló un catéter epidural toráxico para manejo de dolor secundario a una cirugía de resección de primera costilla por síndrome de opérculo toráxico. La paciente evolucionó al 6° día de analgesia con dorsalgia, fiebre, cefalea y secreción purulenta por el sitio de inserción del catéter. En la resonancia nuclear magnética se evidenció una colección epidural T6-7 (Figura 8). Se realizó una laminectomía T6-7, dando salida a material purulento. El cultivo fue positivo para Estafilococo aureus multisensible. La paciente evolucionó hacia la mejoría de síntomas, sin secuelas neurológicas3.
Como se describe en el caso clínico, en los abscesos los síntomas incluyen fiebre y dolor de espalda y, según la descripción clásica, el déficit neurológico ocurre tardíamente con una mediana de cinco días después del cateterismo (rango de 2 días a 5 semanas)[16].
El tratamiento de un absceso epidural es con antibióticos empíricos de amplio espectro hasta contar con el antibiogra- ma, seguido en la mayoría de los casos de drenaje quirúrgico y eventual cirugía descompresiva. El pronóstico es habitualmente bueno si la resolución quirúrgica es antes de las 8 horas de inicio de síntomas.
-
Meningitis pospunción meníngea (MPPM)
La MPPM es una complicación grave, donde casi invariablemente ocurre luego de la perforación de la duramadre-aracnoi- des[16]. En consonancia con esta observación se ha determinado que la razón de probabilidades (odds ratio) de meningitis es de 39,7 (IC95% 13,6-115,5) luego de una punción accidental de duramadre-aracnoides en pacientes obstétricas[4]. En una revisión de 179 casos de MPPM entre los años 1952 y 2005, hubo 3 casos mortales en pacientes obstétricas[26]. En la Pontificia Universidad Católica ha existido un caso de MPPM secundario a una punción lumbar diagnóstica que fue muy laboriosa, donde el agente causal fue un Estafilococo aureus 4. La paciente se recuperó completamente. Esto resalta la gravedad del cuadro clínico y de la necesidad de tomar medidas para prevenirlo.
El principal agente causal es el Estreptococo viridans, que se aísla en más de 85% de los cultivos positivos. Secundariamente se identifica Estafilococo aureus y Pseudomona aeruginosa[26]. La mayoría de los casos de MPPM son causados por la contaminación por gotitas (por parte del personal médico) durante la punción meníngea. Otros casos pueden deberse a la contaminación de la aguja por piel esterilizada de manera incompleta. Aquellos casos que probablemente son de origen endógeno (hematógeno) representan una minoría de los casos informa- dos[26].
Los Estreptococos alfa hemolíticos son comensales de las vías respiratorias superiores y del tracto genitourinario, pero no pertenecen a la flora normal de la piel. Como patógenos de bajo grado, carecen de las características agresivas de los patógenos de la meningitis adquirida en la comunidad. Se ha rastreado un origen bacteriano de este cuadro hasta las vías respiratorias de la persona que realiza la punción lumbar[26]. Así, el anestesiólogo puede ser uno de los principales implicados, lo que hace mandatorio cuidar las medidas de asepsia al realizar un bloqueo neuroaxial. De acuerdo a las recomendaciones de la Asociación Americana de Anestesia Regional para punciones neuroaxiales, debiera utilizarse gorro, mascarilla y guantes estériles, a la vez de realizar previo a la punción una asepsia apropiada de la piel con clorhexidina[27] y observando minuciosamente la asepsia durante todo el procedimiento. Se recomienda no hablar durante la realización de la punción, ya que podría aumentar la aerolización de saliva que arrastre patógenos de la vía aérea superior. La protección de una máscara quirúrgica dura aproximadamente 15 minutos, por lo que puede ser prudente cambiarla entre casos[26].
Los primeros signos de meningitis bacteriana suelen aparecer dentro de las 24 h posteriores a la punción meníngea (rango de 8 h a 8 días). Los síntomas pueden ser modestos, pero invariablemente incluyen dolor de cabeza y fiebre. La rigidez de nuca, fotofobia y vómitos son signos de irritación meníngea que pueden acompañar a la cefalea intensa[15]. En la paciente obstétrica puede provocar errores diagnósticos al confundirse con un cuadro de cefalea pospunción meníngea, que es mucho más frecuente.
-
Daño neurológico persistente
Daño neurológico persistente se define como aquel daño que no se resuelve antes de seis meses[28] o un año[1], dependiendo de la publicación que se revise. La tasa global de daño neurológico persistente en embarazadas que reciben analgesia epidural es de 1:237.000 o 4 por millón (IC95% 0-8)[1], que es cercano al riesgo anual de morir en un accidente de avión comercial (1:250.000)[13].
Como se ha mencionado previamente, las alteraciones nerviosas propias del proceso del embarazo y parto todavía representan la gran mayoría de las lesiones neurológicas después de éste, con incidencias que van entre 0,6-92/10.000. Aunque son bastante angustiosas para la nueva madre, estas lesiones suelen ser transitorias (6-8 semanas)[9]. Es importante conocer las lesiones nerviosas obstétricas intrínsecas, de manera de diferenciarlas claramente de una complicación anestésica (vide supra).
A su vez, después de la anestesia neuroaxial se producen complicaciones del sistema nervioso central que pueden poner en peligro la vida o las extremidades, aunque son infrecuentes[9].
El Proyecto de Reclamos Cerrados de la Sociedad Americana de Anestesiólogos (Closed claims analysis, ASA) es una evaluación estructurada de resultados anestésicos adversos obtenidos de los archivos de reclamos concluidos de 35 compañías de seguros de responsabilidad profesional de los Estados Unidos de América. En el análisis de los casos exclusivamente obstétricos comprendidos entre 1990 y 2003, hubo 426 demandas que incluyeron a 58% de cesáreas y 42% de partos vaginales, donde 80% recibió anestesia regional. De las demandas, el daño neu- rológico fue el más frecuente con 89 casos (21%), junto con daño del recién nacido (21%). De los daños neurológicos, sólo 20% fue prolongado o inhabilitante. Todos excepto uno fue
secundario a anestesia regional y se asoció más comúnmente a parto vaginal. La lesión más frecuente fue una radiculopatía lumbar o sacra, que en 2/3 de los casos podría haber sido secundaria a la anestesia regional[29].
En la Pontificia Universidad Católica de Chile, han habido 2 casos de síndrome de cola de caballo en los últimos 40 años, de los cuales uno era un hombre mayor5 y la otra una paciente obstétrica6. En esta última, luego de una segunda anestesia subaracnoídea con bupivacaína isobárica 0,5% asociada a fen- tanyl 20 ug para la realización de una revisión quirúrgica de un hematoma perineal posparto, desarrolló una radiculopatía L5 bilateral. Luego se agregó dolor plantar bilateral, aunque nunca tuvo compromiso esfinteriano. Requirió fisioterapia, recuperándose por completo al cabo de dos años. El hombre tuvo una lesión de la cola de caballo posiblemente secundaria a aracnoiditis por anestésico local (bupivacaína hiperbárica 0,75%, 15 mg) y/o fentanyl (20 ug), con compromiso motor y sensitivo de las extremidades inferiores y esfínteres. Al cabo de cuatro años, aún presenta secuelas motoras, requiriendo de apoyo para deambular y de sondeo vesical intermitente. En este caso se atribuyó a un efecto idiosincrático de las drogas sobre el tejido neural.
-
Déficits neurológicos asociados a la anestesia
La incidencia es difícil de estimar, sin embargo, en pacientes obstétricas en el Reino Unido se ha estimado una incidencia de 3-12 por millón[28]. Obviamente, esto no incluye las consecuencias de la punción accidental o intencional de duramadre- aracnoides que son mucho más frecuentes.
La etiología de la lesión directamente atribuible a la aneste- sia/analgesia neuroaxial incluye traumatismo directo por agujas o catéteres, inyección de sustancias no deseadas (daño químico), síndrome neurológico transitorio y daño vascular.
-
Trauma directo
Un análisis retrospectivo encontró que 298 de 4.767 (6,3%) pacientes experimentaron parestesia durante la inserción de la aguja espinal. De los 298 casos, cuatro pacientes tuvieron parestesia persistente después de la operación. Otros dos pacientes con parestesia posoperatoria no tuvieron parestesia durante la inserción de la aguja. Los seis pacientes tuvieron una resolución de los síntomas a los 24 meses[30].
Su relación con la técnica anestésica es evidente. Los factores más relevantes para evitar trauma directo a la médula espinal son: 1) elección del sitio de punción bajo L3; 2) detenerse si se produce dolor o disestesia y; 3) inyectar solo si la disestesia desapareció[9]. Estas indicaciones incluyen implícitamente el evitar realizar un procedimiento neuroaxial en la paciente dormida, donde se pierde la capacidad de monitorización de una posible iatrogenia.
-
Daño químico
La lesiones químicas del neuroeje pueden provocar un síndrome de cauda equina o aracnoiditis. Los nervios espinales en el espacio epidural toleran bastante bien la inyección de sustancias potencialmente neurotóxicas, mientras que los nervios en el espacio subaracnoideo son mucho más susceptibles a la lesión tóxica[9]. Los nervios en el espacio epidural están cubiertos por el saco dural (i.e., duramadre y aracnoides), mientras que los nervios en el espacio espinal están cubiertos solo por piamadre, capa meníngea fenestrada, que permite el libre paso de sustancias al tejido neural[31]. Muchas sustancias son neurotóxicas, incluyendo preservantes y altas dosis o concentración de anestésicos.
-
Síndrome neurológico transitorio
Si bien este cuadro clínico escapa de la definición de daño permanente, se incluye por su frecuencia y relación con el acto anestésico.
Se caracteriza por debilidad motora, parestesias, hipoes- tesias o disestesias de intensidad variable que aparecen entre las 6 horas y 4 días posanestesia espinal, en glúteos o región lumbosacra, con irradiación a ambos muslos y pantorrillas en la cara dorso lateral, uni o bilateral, sin disfunción vesical ni rectal, que cede ocasionalmente con analgésicos antiinflamatorios y tiene una duración menor de dos semanas. Como factor de riesgo se ha implicado a la lidocaína y a situaciones que condicionen sobreestiramiento de fibras nerviosas, como la adopción de la posición en litotomía[32]. La etiología es desconocida y no es claro si existe un real daño neurológico. Afortunadamente, la incidencia en las pacientes obstétricas (0%-7%) es menor que en la población general (10%-30%)[9].
-
Daño vascular
La lesión isquémica de la médula espinal es muy infrecuente luego de una anestesia neuroaxial en pacientes obstétricas. El suministro de sangre a la médula espinal está dado por una arteria espinal anterior que es única y dos arterias espinales posteriores. La principal irrigación de la médula espinal lumbar anterior es la arteria de Adamkiewicz, que es unilateral y suele surgir de la porción torácica inferior o lumbar superior de la aorta entre T9 y L2[9]. El área irrigada por la arteria de Adamkiewicz es particularmente susceptible a la hipoperfusión. El síndrome de arteria espinal anterior generalmente se asocia con hipotensión arterial grave, arteriosclerosis o cirugías en las que hay interferencia con el flujo sanguíneo aórtico[7].
Las características clínicas son paraplejia o cuadriplejia, pérdida de la sensibilidad al dolor (analgesia) y la temperatura (ter- moalgesia) de las extremidades inferiores, incontinencia fecal y urinaria, pero con propiocepción, sentidos táctiles ligeros y de vibración intactos, ya que los cordones medulares posteriores están respetados[7].
En pacientes obstétricas se han reportado casos de síndrome de arteria espinal anterior en pacientes con malformación vascular medular, una paciente con diabetes y esclerodermia, tres casos de vasoespasmo secundario al uso de catéter epidural y algunos otros secundarios al uso de epinefrina en la mezcla anestésica[33].
Así, es razonable tomar medidas en pacientes con factores de riesgo como esclerodermia, lupus, arteritis de Takayasu, síndrome de Reynaud y arteriosclerosis. Si bien la anestesia neuroaxial no está contraindicada, se sugiere evitar el uso de epinefrina, mantener presiones de perfusión normales y preferir bupivacaína sobre lidocaína[33].
-
Pronóstico
En la serie de casos en el Reino Unido, las lesiones neuroló- gicas asociadas con isquemia de la médula espinal o hematoma del canal vertebral tuvieron un pronóstico notablemente pobre, mientras que todos los pacientes con meningitis y la mayoría de los pacientes que experimentaron lesión nerviosa y abscesos se recuperaron por completo[28].
Son signos de alarma y de inmediata atención por parte del anestesiólogo la aparición de: puntuación reducida de la escala de coma de Glasgow; cambios pupilares o ptosis palpebral; cualquier signo o síntoma neurológico en presencia de pirexia; paresia o hipoestesia unilateral o bilateral de las extremidades inferiores, que persiste más allá del efecto esperado para los anestésicos locales; dolor radicular unilateral o bilateral; dolor lumbar de inicio repentino; cefalea y/o rigidez de nuca; disfunción vesical o intestinal anestesia en silla de montar; y signos o síntomas neurológicos que evolucionan después de la resolución del bloqueo[34].
-
Estudios electrofisiológicos para el diagnóstico de neuropatías
Pueden ocurrir lesiones neurales por anestesia regional, cirugía, compresión por torniquete, manguitos de presión o mal posicionamiento en la mesa quirúrgica, entre otros. Sin embargo, en muchas ocasiones la etiología es multifactorial y no aparente, como por ejemplo en bajos grados de compresión asociados a una lesión subclínica, trastornos metabólicos o pacientes con mayor susceptibilidad al daño[35].
Los estudios electrofisiológicos permiten discriminar la naturaleza neurogénica de la lesión, su ubicación, antigüedad, gravedad y contribuir a la valoración pronóstica. Sin embargo, no permite el diagnóstico etiológico, el que sólo puede ser inferido clínicamente.
Los grados de lesión neural serán en orden de intensidad: neuropraxia (lesión local de la mielina, principalmente fibras más grandes. Hay continuidad axonal, sin degeneración Wa- lleriana), axonotmesis (alteración de la continuidad axonal con degeneración Walleriana, con epineuro intacto) y neurotmesis (sección neural completa).
Los estudios electrofisiológicos incluyen la electromiografía y los estudios de conducción nerviosa.
La electromiografía evalúa la actividad eléctrica del músculo en reposo y frente a la contracción voluntaria, por medio de un electrodo de superficie o un electrodo-aguja inserto en él. Los hallazgos sugerentes de denervación muscular incluyen: irritabilidad al estímulo (aparición a los pocos días) y actividad espontánea anormal en reposo (aparición luego de 1-4 semanas, dependiendo del largo del nervio remanente y de su degeneración Walleriana), donde se observa potenciales de fibrilación y ondas más intensas. Mientras más cercano a la médula esté el músculo interrogado, antes ocurrirán los cambios descritos, ya que el largo del nervio implicado tardará menos tiempo en perder su función. Lo opuesto ocurre con grupo musculares más lejanos. Esta actividad desaparece con la reinervación. La exploración de diferentes territorios musculares, proximales, distales y dependientes de diferentes raíces o nervios terminales permite una adecuada localización de una lesión focal (radiculopatía, plexopatía o mononeuropatía) o generalizada (miopatía o poli- neuropatía)[36].
Los estudios de conducción nerviosa permiten evaluar la ubicación, tipo y magnitud de la lesión. Además, el patrón eléctrico permitirá determinar el tiempo de lesión y pronóstico de recuperación. En esta técnica se realiza una estimulación eléctrica supramáxima por vía transcutánea que genera un potencial de acción sincrónico en el conjunto de axones de un nervio en particular. Dependiendo del sitio de registro, se pueden obtener conducciones sensitivas, motoras o mixtas[36]. Los principales parámetros por definir son latencia (tiempo que demora la aparición del potencial evocado desde la estimulación eléctrica del transductor) y amplitud (tamaño del campo eléctrico de la curva del potencial evocado). En términos generales las alteraciones de parámetros temporales (latencia y velocidad) se ven afectados por patologías desmielinizantes de los nervios, mientras que la amplitud se ve afectada por patología axonal[36].
Así, por ejemplo, en una paciente con el pie caído e invertido, signo típico de disfunción de los músculos eversores del pie (músculos fibulares), las posibles áreas de lesión serán a nivel de (de periférico a central): nervio fibular común (L4-S2), nervio ciático (L4-S4), plexo lumbo sacro (L4-S4), raíces L4-S5 o la médula espinal[37]. Tanto la clínica como los estudios elec- trofisiológicos permitirán discriminar perfectamente el sitio de lesión.
Frente a una sospecha de lesión neurológica, se recomienda hacer estudios electrofisiológicos no antes de 10-21 días, ya que la denervación puede tardar, dependiendo de la distancia de la lesión desde el neuroeje. Luego, como seguimiento se puede repetir entre 3 a 6 meses para evaluar reinervación precoz, seguido a los 6-12 meses para ver reinervación tardía. Cabe mencionar que los estudios electrofisiológicos no reemplazan a una buena anamnesis y examen neurológico, aunque pueden aportar frente a dudas clínicas o conflictos médicolegales.
-
Conclusiones
Estamos frente a cuadros clínicos muy infrecuentes aunque potencialmente muy graves. En muchos casos las complicaciones son inherentes al proceso del embarazo y parto, mientras que en otros, secundarias al quehacer anestesiológico, lo que motiva esta revisión y que estimula a mantener una constante alerta para la detección y tratamiento oportuno.
Igualmente, importante es bajar el umbral de tolerancia frente a un curso clínico inhabitual, que permita reaccionar con rapidez y eficacia antes de sufrir un trágico desenlace.
Presentado en parte en el Webinar de Anestesia Obstétrica de la SEDAR, Sociedad Española de Anestesia, Reanimación y Cuidado del Dolor, mayo de 2022.
Los autores no tienen conflictos de interés.
Referencias
1. Ruppen W, Derry S, McQuay H, Moore RA. Incidence of epidural hematoma, infection, and neurologic injury in obstetric patients with epidural analgesia/anesthesia. Anesthesiology. 2006 Aug;105(2):394–9. https://doi.org/10.1097/00000542-200608000-00023 PMID:16871074
2. Villagrán M, Pérez E, Merino W, Silva R, Venegas C, Becerra H. Perfil del manejo de la analgesia del trabajo de parto en el sector público de salud en Chile entre los años 2005 y 2011. Revista Chilena De Anestesia. 2012;41:231–2.
3. Reynolds F. Neurological infections after neuraxial anesthesia. Anesthesiol Clin. 2008 Mar;26(1):23–52. https://doi.org/10.1016/j.anclin.2007.11.006 PMID:18319178
4. Guglielminotti J, Landau R, Li G. Major Neurologic Complications Associated With Postdural Puncture Headache in Obstetrics: A Retrospective Cohort Study. Anesth Analg. 2019 Nov;129(5):1328–36. https://doi.org/10.1213/ANE.0000000000004336 PMID:31335402
5. Wong CA, Scavone BM, Dugan S, Smith JC, Prather H, Ganchiff JN, et al. Incidence of postpartum lumbosacral spine and lower extremity nerve injuries. Obstet Gynecol. 2003 Feb;101(2):279–88. https://doi.org/10.1097/00006250-200302000-00014 PMID:12576251
6. Warner MA, Warner DO, Harper CM, Schroeder DR, Maxson PM. Lower extremity neuropathies associated with lithotomy positions. Anesthesiology. 2000 Oct;93(4):938–42. https://doi.org/10.1097/00000542-200010000-00010 PMID:11020742
7. Loo CC, Dahlgren G, Irestedt L. Neurological complications in obstetric regional anaesthesia. Int J Obstet Anesth. 2000 Apr;9(2):99–124. https://doi.org/10.1054/ijoa.1999.0347 PMID:15321097
8. Birnbach DJ, Hernandez M, van Zundert AA. Neurologic complications of neuraxial analgesia for labor. Curr Opin Anaesthesiol. 2005 Oct;18(5):513–7. https://doi.org/10.1097/01.aco.0000182558.86938.a0 PMID:16534285
9. Wong CA. Nerve injuries after neuraxial anaesthesia and their medicolegal implications. Best Pract Res Clin Obstet Gynaecol. 2010 Jun;24(3):367–81. https://doi.org/10.1016/j.bpobgyn.2009.11.008 PMID:20053587
10. Mellado P, Sandoval P. Semiología en Neurología. In: Mellado P, Sandoval P, editors. Semiología en Neurología. 1st ed. Santiago, Chile: Editorial Mediterraneo Ltda; 2020. pp. 17–67.
11. Anim-Somuah M, Smyth RM, Cyna AM, Cuthbert A. Epidural versus non-epidural or no analgesia for pain management in labour. Cochrane Database Syst Rev. 2018 May;5(5):CD000331. https://doi.org/10.1002/14651858.CD000331.pub4 PMID:29781504
12. McKusick VA. NEUROPATHY, HEREDITARY, WITH LIABILITY TO PRESSURE PALSIES; HNPP. Online Mendelian Inheritance in Man, OMIM®, MIM Number: 162500. Fecha de publicación: 1986 Disponible en: https://omim.org/ [fecha de acceso: 21-2-22].
13. Laudan L. The book of risks : fascinating facts about the chances we take every day. New York: J. Wiley & Sons; 1994.
14. Murray RR. Maternal Obstetrical Paralysis. Am J Obstet Gynecol. 1964 Feb;88(3):399–403. https://doi.org/10.1016/0002-9378(64)90442-9 PMID:14123414
15. Moen V, Irestedt L. Neurological complications following central neuraxial blockades in obstetrics. Curr Opin Anaesthesiol. 2008 Jun;21(3):275–80. https://doi.org/10.1097/ACO.0b013e3282f8e22f PMID:18458541
16. Moen V, Dahlgren N, Irestedt L. Severe neurological complications after central neuraxial blockades in Sweden 1990-1999. Anesthesiology. 2004 Oct;101(4):950–9. https://doi.org/10.1097/00000542-200410000-00021 PMID:15448529
17. Beards SC, Jackson A, Griffiths AG, Horsman EL. Magnetic resonance imaging of extradural blood patches: appearances from 30 min to 18 h. Br J Anaesth. 1993 Aug;71(2):182–8. https://doi.org/10.1093/bja/71.2.182 PMID:8123389
18. Brancazio LR, Roperti KA, Stierer R, Laifer SA. Pharmacokinetics and pharmacodynamics of subcutaneous heparin during the early third trimester of pregnancy. Am J Obstet Gynecol. 1995 Oct;173(4):1240–5. https://doi.org/10.1016/0002-9378(95)91362-9 PMID:7485329
19. Bauchat JR, McCarthy RJ, Koski TR, Wong CA. Labor Analgesia Consumption and Time to Neuraxial Catheter Placement in Women with a History of Surgical Correction for Scoliosis: A Case-Matched Study. Anesth Analg. 2015 Oct;121(4):981–7. https://doi.org/10.1213/ANE.0000000000000690 PMID:25794113
20. Goodier CG, Lu JT, Hebbar L, Segal BS, Goetzl L. Neuraxial Anesthesia in Parturients with Thrombocytopenia: A Multisite Retrospective Cohort Study. Anesth Analg. 2015 Oct;121(4):988–91. https://doi.org/10.1213/ANE.0000000000000882 PMID:26378701
21. Bauer, ME, Arendt, K, Beilin, Y, Gernsheimer, T, Botero, JP, James, AH, y cols. The Society for Obstetric Anesthesia and Perinatology Interdisciplinary Consensus Statement on Neuraxial Procedures in Obstetric Patients With Thrombocytopenia. Anesthesia & Analgesia 2021.
22. Scavone BM, Wong CA. Neuraxial Anesthesia and the Ubiquitous Platelet Count Question-How Low Is Too Low? Anesth Analg. 2021 Jun;132(6):1527–30. https://doi.org/10.1213/ANE.0000000000005496 PMID:34032657
23. Levy N, Goren O, Cattan A, Weiniger CF, Matot I. Neuraxial block for delivery among women with low platelet counts: a retrospective analysis. Int J Obstet Anesth. 2018 Aug;35:4–9. https://doi.org/10.1016/j.ijoa.2018.01.006 PMID:29502991
24. Camann W. Obstetric Neuraxial Anesthesia Contraindicated? Really? Time to Rethink Old Dogma. Anesth Analg. 2015 Oct;121(4):846–8. https://doi.org/10.1213/ANE.0000000000000925 PMID:26378695
25. The Sanford guide to antimicrobial therapy., 5.1.2 Edition. Edited by David N. Gilbert, Henry F. Chambers, Michael S. Saag, Andrew T. Pavia, Boucher, HW. Sperryville, VA, Antimicrobial Therapy, Inc., 2022.
26. Baer ET, Warltier DC. Post-dural puncture bacterial meningitis. Anesthesiology. 2006 Aug;105(2):381–93. https://doi.org/10.1097/00000542-200608000-00022 PMID:16871073
27. Hebl JR. The importance and implications of aseptic techniques during regional anesthesia. Reg Anesth Pain Med. 2006 Jul-Aug;31(4):311–23. https://doi.org/10.1097/00115550-200607000-00006 PMID:16857551
28. Cook TM, Counsell D, Wildsmith JA; Royal College of Anaesthetists Third National Audit Project. Major complications of central neuraxial block: report on the Third National Audit Project of the Royal College of Anaesthetists. Br J Anaesth. 2009 Feb;102(2):179–90. https://doi.org/10.1093/bja/aen360 PMID:19139027
29. Davies, JM, Posner, KL, Lee, LA, Cheney, FW, Domino, KB. Liability associated with obstetric anesthesia: a closed claims analysis. 2009; 110: 131-39. https://doi.org/10.1097/01.aoa.0000362061.27989.1e.
30. Horlocker TT, McGregor DG, Matsushige DK, Schroeder DR, Besse JA; Perioperative Outcomes Group. A retrospective review of 4767 consecutive spinal anesthetics: central nervous system complications. Anesth Analg. 1997 Mar;84(3):578–84. PMID:9052305
31. Reina MA, López García A, de Andrés JA. [Anatomical description of a natural perforation present in the human lumbar pia mater]. Rev Esp Anestesiol Reanim. 1998 Jan;45(1):4–7. PMID:9558933
32. Lacassie HJ. Neurotoxicidad por Lidocaína 5%: descrédito o Realidad? Revista Chilena de Anestesia. 1998;27:112–4.
33. Preston R. Spinal cord disorders. In: Gambling DR, Douglas MJ, McKay RS, editors. Obstetric anesthesia and uncommon disorders. 2nd ed. Cambridge, New York: Cambridge University Press; 2008. pp. 191–214. https://doi.org/10.1017/CBO9780511544552.011.
34. Hennessy MM, Smith SE. Peripartum Neurological Injury. Tutorial 462. Peripartum Neurological Injury. Tutorial 462. Fecha de publicación: 2021 Disponible en: https://resources.wfsahq.org/anaesthesia-tutorial-of-the-week/ [fecha de acceso: 28-12-2021].
35. Aminoff MJ, Weiskopf RB. Electrophysiologic testing for the diagnosis of peripheral nerve injuries. Anesthesiology. 2004 May;100(5):1298–303. https://doi.org/10.1097/00000542-200405000-00034 PMID:15114229
36. Fadic R, Trujillo O. Estudio electrofisiológico en el neurointensivo. In: C, R, P, M, L, C, eds. Cuidados Intensivo Neurológicos 3a ed. Santiago: Mediterráneo.
37. Lacassie HJ, Mellado P, Cruz JP. Neural lesions in obstetrics: a diagnostic tree. JA Clin Rep. 2022 Jun;8(1):39. https://doi.org/10.1186/s40981-022-00529-0 PMID:35668331

 ORCID
ORCID