Pablo O. Sepúlveda V.1,*, Rodrigo Vera M.2
Recibido: 12-12-2022
Aceptado: 01-04-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 4 pp. 348-359|https://doi.org/10.25237/revchilanestv52n04-04
PDF|ePub|RIS
Linear thinking does not fit the new concepts in 21st century anesthesia, a narrative discussion
Abstract
Linear thinking, which explains phenomena in narrow temporalities and with a cause-effect relationship that generate a single possible outco- me, has predominated in the everyday life of humankind. Science has shown that linear phenomena are rare in nature and that most of them respond to the dynamics of complex non-linear systems. In anaesthesia, the conceptual development has also been simplified and modelled to achieve certain clinical goals, but in recent years a readjustment to new insights and data, obtained from neuroscience and pharmacology, has become peremptory. In this article we develop some central concepts that should be reconsidered in clinical activity and in the understanding of phenomena of the brain dynamics of anaesthetised patients and their recovery.
Resumen
El pensamiento lineal, que explica los fenómenos en temporalidades estrechas y con una relación causa-efecto que generan un solo resultado posible, ha predominado en la vida cotidiana de la humanidad. La ciencia ha mostrado que los fenómenos lineales son escasos en la naturaleza y que la mayoría responde a dinámica de sistemas complejos no lineales. En anestesia, el desarrollo conceptual también ha sido simplificado y mo- delizado para lograr ciertos objetivos clínicos, pero que en los últimos años se hace perentorio un reajuste a las nuevas visiones y datos, obtenidos en desde la neurociencia y la farmacología. En este artículo desarrollamos algunos conceptos centrales que deben reconsiderarse en la actividad clínica y en la comprensión de fenómenos de la dinámica cerebral del paciente anestesiado y su recuperación.
-
Sistemas lineales y caóticos
La ciencia clásica privilegiaba el orden y la estabilidad, aunque ya desde hace siglos en todos los niveles de observación, se reconocen el papel primordial de las fluctuaciones. Ilia Prigogine (1917-2003), en su libro: The End of Certain- ty, (el fin de las certidumbres)[1] dice que la introducción de la inestabilidad, o mejor las teorías del caos, conducen a la física cuántica a un quiebre del problema de la simetría del tiempo y soluciona la descripción cuántica de la influencia del observador, haciéndola más realista. El tiempo tendría evolución y se rompería con el determinismo de la física newtoniana e incluso la física cuántica. La comprensión de estos sistemas dinámicos inestables conduce a una nueva y ampliada comprensión de los conocimientos de la física. Pero la incerteza así instalada, lleva a afirmar un carácter probabilístico de los comportamientos físicos/biológicos, rompiendo así con certidumbres del pensamiento previo.
Esta nueva forma de entender la física ha sido un largo camino en ciencia, no superado aun por el individuo no involucrado en estas lides, porque el ser humano ha adaptado su pensamiento a respuestas lineales, para así tener la ilusión de la controlabilidad de nuestros actos individuales y sociales o del ambiente. Tenemos una alta confianza en ese tipo de gober- nanza dirigida y en la jerarquización de las decisiones.
Esta visión de lo lineal proviene de creer que los fenómenos son mayoritariamente proporcionales a la magnitud del estímulo, que son aditivos entre sus partes, se replican siempre igual y tienen siempre una clara relación causal en su efecto, permitiendo por ello su conocimiento completo.
Pero en realidad, ya desde hace más de un siglo se viene instalando la idea que los comportamientos No lineales son los más frecuentes en la naturaleza. Lo vemos en fenómenos climáticos, la mecánica celeste, los péndulos de 2 brazos, la dinámica de fluidos, y también en la forma en cómo funciona los sistemas biológicos, en especial los neurales de la corteza cerebral. Ejemplos en la vida cotidiana y en biología son múltiples, como las redes aéreas, las redes sociales, las redes neuronales.
Estos comportamientos pueden ser sistemas estáticos o dinámicos. Decimos que un sistema es estático, si al aplicarle un estímulo, el resultado es el mismo en todo momento y sólo depende del estímulo.
En contraposición, un sistema es dinámico, si el resultado que se obtiene luego de aplicarle un estímulo no depende sólo del estímulo, sino que, además, del estado actual en que se encuentre el sistema. Por cierto, dicho estado actual es fruto de los estímulos recibidos en tiempos anteriores. La condición inicial se define entonces, como el estado del sistema (x0) en el instante (tiempo 0 o t0). Esta condición inicial nos permite obtener una solución única para la evolución del sistema. La dificultad radica a veces en conocerla exactamente.
Adicionalmente, hacemos la distinción entre sistemas continuos y discretos. En los primeros, el tiempo y las variables del sistema están modeladas permanentemente para cada instante, por ejemplo, en el movimiento de un proyectil dentro del campo gravitacional. A su vez, los sistemas discretos, están definidos en intervalos fijos, como sería el registro horario de los signos vitales de un paciente.
Un sistema dinámico continuo se representa por una ecuación diferencial del tipo.
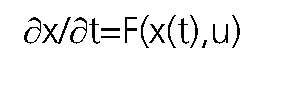
= con u como un conjunto de parámetros fijos en cada evolución del sistema.
en cambio los sistemas dinámicos discretos son representados por una ecuación de diferencias del tipo.
x(t + 1) = G(x(t),u).
ecuación diferencial del tipo
Un caso particular de sistema dinámico es el sistema lineal, en los cuales la función F arriba mencionada anterior es función lineal de x. Entendemos por función lineal, aquella en que
la variable dependiente (o resultado de la función) es la suma ponderada de las variables independientes (o entradas). El caso más simple de función lineal, de una variable dependiente y con una variable independiente x, es:
y = mx + b, con m y b constantes.
De esta manera, un sistema dinámico lineal, se puede expresar como x = Ax, donde A es una matriz de coeficientes constantes. Si bien, la descripción de sistemas lineales rara vez se expresa en la naturaleza de escala macroscópica, sin embargo, son una potente herramienta de modelación por sus capacidades de entregar soluciones analíticas y estructuras de análisis en el entorno de puntos o sitios de interés especial y dada unas condiciones iniciales conocidas.
Por el contrario, en los sistemas de mayor complejidad, como sistemas dinámicos no lineales, es excepcional poder encontrar soluciones analíticas. Es delicada la tarea que enfrenta quien plantea un modelo lineal de un fenómeno real, sin que dicha abstracción pierda lo esencial.
En estos sistemas más complejos se observan “Atractores”, que son conjuntos de valores hacia donde los sistemas dinámicos tienden a evolucionar. Hay una gran diversidad de tipo de atractores. Por simplicidad nos referiremos aquí sólo a los atractores clásicos y los atractores extraños.
En los atractores clásicos todas las trayectorias convergen a un estado estacionario, ya sea éste un Punto Fijo o bien con un denominado Ciclo Límite. Punto Fijo es aquel en que las variables del sistema presentan una variación nula (derivada igual 0) en ausencia de perturbaciones. En cambio, se entiende por Ciclo Límite las trayectorias cerradas a las cuales todas ellas convergen.
En los atractores extraños existe alta sensibilidad a las condiciones iniciales y describen patrones de trayectoria aparentemente aleatorios en el sistema. De esta manera, se obtienen comportamientos existe una alta incertidumbre, a pesar de que responden de todas formas a un sistema inequívocamente determinista.
Entonces cuando un modelo determinístico dinámico no lineal aparenta un comportamiento dinámico aleatorio hablamos de un sistema caótico.
Debemos decir entonces que, si bien un supuesto generalmente aceptado es que el determinismo implica predicción, un sistema complejo con múltiples variables e intrincadas relaciones entre ellas, sigue siendo determinista, pero nos obliga a conformarnos con una modelación estadística, en la cual renunciamos a conocer el comportamiento detallado en favor de estimar estados probables como predicciones futuras.
No es por tanto cierto que siempre que observamos un fenómeno complejo, en apariencia desordenado y con patrones irregulares, es consecuencia de una dinámica intrínseca compleja.
En efecto, un sistema caótico responde generalmente a una dinámica extraordinariamente simple, constituido incluso de una ecuación y una sola variable y por cierto, dicho sistema es en esencia determinista. Sin embargo, su estructura genera comportamientos altamente complejos, confirmando que de- terminismo no implica necesariamente predicción[2].
Entonces, en los sistemas caóticos las respuestas no son proporcionales al estímulo y pueden explicar comportamientos
inerciales al transitar del entorno de un atractor a otro. Además, son sistemas que dependen absolutamente y muy sensiblemente de sus condiciones iniciales, lo cual los hace impredecibles, porque en fenómenos reales nunca conocemos exactamente esa condición inicial. Un ejemplo en anestesia es el hecho de que cada paciente es diferente a otro y también a sí mismo ante una nueva anestesia.
Existen distintos tipos de movimientos caóticos: El caos permanente, cuando un sistema dinámico permanece en él para siempre, o el caos transitorio cuando este comportamiento caótico ocurre únicamente en un determinado período de tiempo y posteriormente el sistema pasa a comportarse de otro modo. En estos estados transitorios se distinguen los disipativos y los conservativos en función de si conservan o no la energía. Entre estos últimos destacan además los sistemas que oscilan en el borde del caos desde donde emerge el llamado criticalismo o los sistemas críticos. En general, los sistemas críticos se asocian a una escala tipo ley de potencia o fractal, a correlaciones de largo alcance en el espacio y el tiempo y a una rápida reconfiguración en respuesta a insumos o entrada de datos externos.
El ejemplo clásico de criticalismo es el efecto de la temperatura sobre material ferromagnético. Al estado magnetizado si le aplicamos temperatura pierde ese carácter de polaridad y entra en estado caótico. Pero hay un punto previo al caos entrópico donde se observan estados organizados fluctuantes. Estos son cuantificables en base a correlaciones de la fluctuación y coordinación, donde se observa que el punto de mayor correlación es el estado crítico.
Así los índices de correlación entre moléculas, o actividad neuronal, aumenta solo en el punto crítico debido a que la correlación a distancia es baja si es subcrítica por baja fluctuación o en el estado de caos por baja coordinación.
Estos estados críticos se han comparado a mesas con arena en punto de equilibrio antes de empezar las avalanchas (representativa del caos y medidos con técnicas como el exponente de Layapunov). En los sistemas críticos, la respuesta del sistema a los estímulos externos – llamado rango dinámico o correlación dinámica – se maximiza haciendo que las pequeñas perturbaciones del sistema en estado crítico conduzcan a retornos geométricos del estado estacionario[6], lo que lleva a la llamada correlación temporal de largo alcance (LRTC o de larga memoria). Esta LRTC se puede medir de múltiples maneras la más usada es la ley de potencia.
-
Sistemas caóticos, biología y cerebro
Los sistemas biológicos en especial, funcionan normalmente de forma caótica, y son organizaciones de múltiples elementos acoplados que forman redes interactivas y exhiben una dinámica oscilatoria que permite resistir el control determinís- tico de trayectorias futuras, es decir generan pseudoestabilida- des[3].
El cerebro es la estructura más compleja conocida. Registros de potencial en el EEG dan una clara idea de elementos de coherencia junto a pautas desordenadas, lo cual siguiere la existencia de fenómenos de dinámica no lineal, posiblemente caótica. Incluso, según Andreu et al[4], resultaría posible que también la propia actividad cognitiva esté expuesta a la dinámica caótica.
Definiciones como la del Programa de Exobiología de la NASA, vida es un sistema químico auto sostenido capaz de experimentar evolución darwiniana[5] o que está basada en el segundo principio de la termodinámica, donde los sistemas vivos son una organización especial y localizada de la materia, donde se produce un continuo incremento del orden sin intervención externa[6]. Esta definición se basa en que la vida sería una constante lucha contra la entropía donde los sistemas biológicos intentan ser conservativos de energía utilizando sus sistemas metabólicos. En este contexto, no es raro que la búsqueda de ciertas condiciones de estabilidad evolutivas haya hecho que la organización funcional del cerebro y los sistemas homeostáti- cos buscaran una fórmula que se estabilice de alguna manera la fluctuación entrópica por ser ineficiente para la vida. En el caso del cerebro, se requiere un tipo de pseudoestabilidad para dar sentido de temporalidad a la existencia de la mente y la consciencia y sus requerimientos materiales. Serían este tipo de organizaciones de sistemas al borde del caos o condición de criticalismo las que habrían permitidos este fenómeno.
Es en estos estados críticos se acercan al comportamiento de la actividad de las redes neurales, ya que sus propiedades incluyen la posibilidad de almacenamiento de información a través de estados oscilantes metaestables[8].
Además, la actividad caótica puede tener importancia en la generación de cambios adaptativos rápidos porque las señales que no varían no llevan nueva información, pero la evolución impredecible del caos representa entonces ganancia de información desde donde el cerebro genera nuevas respuestas posibles.
Esto es posible en un sistema muy estables, aunque no absoluto, o digamos estabilidad en movimiento. Esta estabilidad exige entonces una autoorganización en el estado caótico que provee información con posibilidades de variaciones.
Es interesante observar que la misma actividad del EEG como la actividad cognitiva tienen características similares: se- cuencialidad, continuidad, evolución con la edad de maduración, son autoorganizados y responden a estímulos internos y externos.
El estado crítico del cerebro tendría la mayor capacidad de procesamiento informático y tiende a la autoorganización para mantener estabilidad, pero requiere de redes con características particulares de gran interconexión. Para mantener estable y activo el sistema, este funciona en torno a atractores reverberantes que lo estabilizan rápido ante perturbaciones, dando el carácter autoorganizado en una oscilación multiestable. La dinámica del sistema entre atractores presenta comportamientos inerciales que dan estabilidad y continuidad temporal al producto informático, que en el caso del cerebro es la mentalización[9].
El tipo de organización requerida se observa en el conec- toma cerebral donde la homeostasis biológica sostendría mecanismos con sentido dinámicos oscilantes en estado de críticalis- mo[10].
Desde el punto de vista informático, Tononi, explica en su teoría información-integración de la consciencia[11], que propiedades informáticas en un sistema modular son: la diferenciación como la capacidad de distinguir infinitos estados experienciales, y la integración que unifica estas experiencias. La integración se mide con sincronías, coherencias, entropía etc. Desde este contexto emerge lo que consideramos información,
como una capacidad emergente de procesamiento que es denominada complejidad.
Por ejemplo: las letras generan diferenciación de caracteres, las palabras integran esto en palabras y de allí emerge información compleja que es el léxico. Pero esto es solo posible en los sistemas integrados como los descritos. Esta integración es dada especialmente por el grado de retroalimentación (o re- verberación/feedback), que tienen los sistemas auto organizados[12].
La otra característica mencionada de la criticidad es la denominada complejidad. Como se refiere Sleigh[13], se distinguen dos tipos de complejidad: de tipo I, que aumenta con el aumento de la información y aleatoriedad, independientemente de si esta información tiene algún significado. En anestesia tenemos como ejemplo, es el uso de drogas como la ketamina o un estado convulsivo, donde hay aumento de aleatoriedad sin necesariamente generar información. Por otro lado, tenemos la complejidad tipo II que es la que tiene tendencia a que las interacciones del sistema produzcan los llamados “fenómenos emergentes” e información a través de ellos. Describe la aparición de fenómenos cualitativamente nuevos, inesperados y quizá ni siquiera deducibles de las acciones de las partes[14]. Por ejemplo; “la Ola” del estadio de futbol, fenómeno emergente, que puede ser dimensionado matemáticamente por su correlación a distancia usando la coordinación y fluctuación.
En lo que respecta al cerebro, se ha ido confirmando que los fenómenos de emergencia más ricos se generan a partir de sistemas que no son ni extremadamente regulares ni extremadamente aleatorios, y necesitan oscilar en el punto de criticidad. Esta oscilación es conocida como multiestabilidad metaestable[15].
Anatomo-funcionalmente esto se ajusta al cambio conceptual de cómo se entiende el funcionamiento del cerebro actualmente. Antes se entendía al cerebro como un instrumento de alta jerarquía que ordena la función homeostática en rangos estrechos compatibles con la vida, reactivo a la información intero y exteroceptiva. Ahora se le asume como un sistema dinámico de alta dimensión, baja jerarquía, muy resiliente, predictivo y apto para adaptarse a la modulación externa, subjetivante y con mucha memoria para responder a la emergencia de la compleja vida social y la cultura. Las funciones particulares se realizan en redes ampliamente distribuidas que se configuran dinámicamente mediante la coordinación temporal (sincronización) en este inmenso conectoma[16].
Esta organización es necesaria para aumentar la velocidad de respuesta, funcionando en base a modelos predictivos en una dinámica “top down”, mucho más eficiente que “bottom up”, porque esta última debe procesar estímulos, generar imágenes, y conceptualizar desde cero cada vez para generar repuestas.
Para responder al funcionamiento critico No-lineal, el cerebro usa múltiples dimensiones para codificar (espacio, amplitud, fase), y opera en estrecho rango de autoorganización crítica[17] generando constantemente patrones altamente estructurados representados en información guardada. Aunque todavía no sabemos exactamente como guarda. Por ejemplo, la percepción es entendida como un proceso de reconstrucción donde las expectativas auto generadas son comparadas con las señales sensoriales. Todo esto requiere una organización en red con mucha reciprocidad y jerarquía flexible y resiliente.
Esto es también coherente con los hallazgos recientes en la inmensa red de reciprocidad (feedback) que exige el proceso completo de intercambio de información para permitir la emergencia de complejidad, que la podemos entender como mentalización consciente como máxima expresión, y emerger desde la información subliminal o subconsciente transformándose en conciencia sentiente[18].
Pero más aun, la actividad de feedback como actividad cortical intrínseca, no sería solo moduladora sino también conductora de mucha respuestas perceptivas y motoras[19],[20].
Como contraparte, está establecido que las redes modulares con ingentes rutas paralelas forman un sustrato pobre para la consciencia como es el caso del cerebelo[21].
Las características descritas confirman el carácter mayo- ritariamente predictivo en la toma de decisiones de nuestro cerebro. La teoría propone que el cerebro hace inferencias probabilísticas sobre el mundo, basadas en un modelo interno, calculando esencialmente una “mejor suposición” interpretativa de lo que está percibiendo (de acuerdo con las reglas de la estadística bayesiana, que cuantifica la probabilidad de un evento basándose en la información relevante recogida de experiencias anteriores[22]. Es por ello que Anil Seth denomina a la consciencia como una alucinación controlada[64].
Un ejemplo clínico de esto es un estudio reciente donde el cerebro tras una perturbación intenta sostener la estabilidad. Con RNM funcional y usando inducciones a velocidad moderada con propofol (30 mg/kg/h), donde se observa que, tras la perdida de conciencia clínica, se pierde tanto la conectividad cortico-cortical, como la conectividad cortico-subcortical, pero que tras unos minutos la conectividad cortical-subcortical tiende a reestablecerse para reorganizar su funcionalidad, habiendo perdido solo la capacidad informática de hacer de emerger conciencia[23].
Algo similar se ha visto en el espectrograma frontal del EEG con inducciones rápidas, donde inicialmente tras la perdida de consciencia aparece una actividad alfa (7-12 Hz) deprimida por varios minutos, pero luego que se recupera parcialmente (Figura 2)[24]. Es probable que, en cerebros frágiles, la capacidad de recuperar estados oscilantes estables sea mucho más difícil de conseguirse y esto sea causal de permanecer en estados lentos, incluso caer a atractores globales más lentos y/o eventualmente desencadenar ritmos anómalos como la burst supression.
Entonces aun tras una perturbación, en cerebros sanos, habría una tendencia a reestabilizar la dinámica neural, con fluctuación y transición de tipo metaestabilidad multiestable e histéresis[25].
La dinámica no lineal y los conceptos farmacológicos en anestesia
Es razonable entonces preguntarse si la modelación de la farmacología con una visión lineales del comportamiento cerebral debe adecuarse para reflejar los comportamientos de un sistema caótico sometido a perturbaciones profundas como es el caso de la anestesia y enfrentar la demanda clínica de la individualización de la dosificación.
Confusión de lo lineal o no lineal en farmacología
En anestesia, para poder describir las relaciones Concentración plasma-efecto (Cp-Ce) se requirió primero poder medir niveles de droga en sangre y desarrollar una descripción mate
mática de cómo se alcanzaban esos niveles[26] y posteriormente, se buscó la forma de relacionar esas Cp con un efecto clínico o del EEG, para modelar su comportamiento farmacodinámico.
Se presentaron muchas dificultades metodológicas para generar condiciones plasmáticas mínimamente estables y definir el correlato electroencefalográfico asociado a la inconsciencia. Estas dificultades llevaron a una simplificación conceptual de los modelos en representaciones de dinámica lineal.
-
La farmacocinética
El comportamiento de una droga en sangre tras un bolo o un cambio de velocidad de una perfusión se describe normalmente como una línea que asciende y/o decae. En realidad, eso no es así dado a que el sistema está en constante mezcla, siendo más acentuada ante bolos o perfusiones rápidas en especial los primeros minutos. Los modelos cinéticos generados por datos de perfusiones a alta velocidad presentan en esas fases iniciales gran error y gran dificultad de representar otras covariables específicas de las poblaciones necesarias para la titulación.
Se asumió por convención que, tras un bolo, hay un decaimiento exponencial, omitiendo describir que en perfusiones rápidas presentan alta inestabilidad de la mezcla (end front quinetics), por lo que es al menos ingenuo pensar además en
describir una supuesta estabilidad del efecto para luego intentar modelarlo. Además, todo el fenómeno de pérdida y recuperación de la consciencia fue descrito basado en algún tipo de índice procesado del EEG que caracteriza muy simplificadamen- te una depresión/activación compleja del cerebro. También se generalizó la idea de que la Ce de perdida de consciencia (LOC) era a la vez la misma de despertar[27]. Hoy se reconoce que los índices EEG procesados representan una simplificación extrema de la real dinámica cerebral hoy conocida[28],[29].
Comparando inducciones clásicas en bolo versus perfusiones ultra lentas se observa que las Ce calculadas a la pérdida de respuesta (LOC), los valores de los índices EEG (BIS o PSI Sedline), las condiciones neurológicas y los espectros de poder del EEG son totalmente diferentes[24],[30] (Tabla 1). En inducciones rápidas las Ce calculadas de propofol son mucho más altas al LOC, producen desacople cortico-cortical y apagan la conciencia, pero también el tronco cerebral y sus reflejos. Estos efectos de depresión troncal no son requeridos para titular el momento preciso de LOC, y explican gran parte del desajuste hemodinámico de la inducción rápida. En el EEG se observan condiciones muy diferentes entre ambas inducciones, con bandas alfa muy deprimidas en la inducción rápida (Figura 1). Existen otras confusiones de definición. Por ejemplo, cuando en farmacocinética (PK) se habla de cinética no lineal se refiere a la situación que ocurre al saturarse la capacidad de aclaramiento.
Tabla 1. Comparación de condiciones clínicas, Ce de Propofol predichas y condiciones del EEG al LOC, entre inducciones rápidas y lentas[24],[30]
| Ce al LOC | Reflejos de | Masa de droga | SEF 95 al LOC | PSI (Sedline) al | Estado de |
| (modelo | tronco | (mg/kg) | LOC | banda alfa al | |
| Schnider) | LOC | ||||
| Inducción lenta 3,2 (± 0,38) | Presente | 1,67 (87-57) | 18 (19-14) | 67 (87-57) | Intensa |
| Inducción en bolo 6,6 (± 0,93)* | Ausente | 1,91 | 15 (23-10) | 87 (93-75)* | Deprimida |
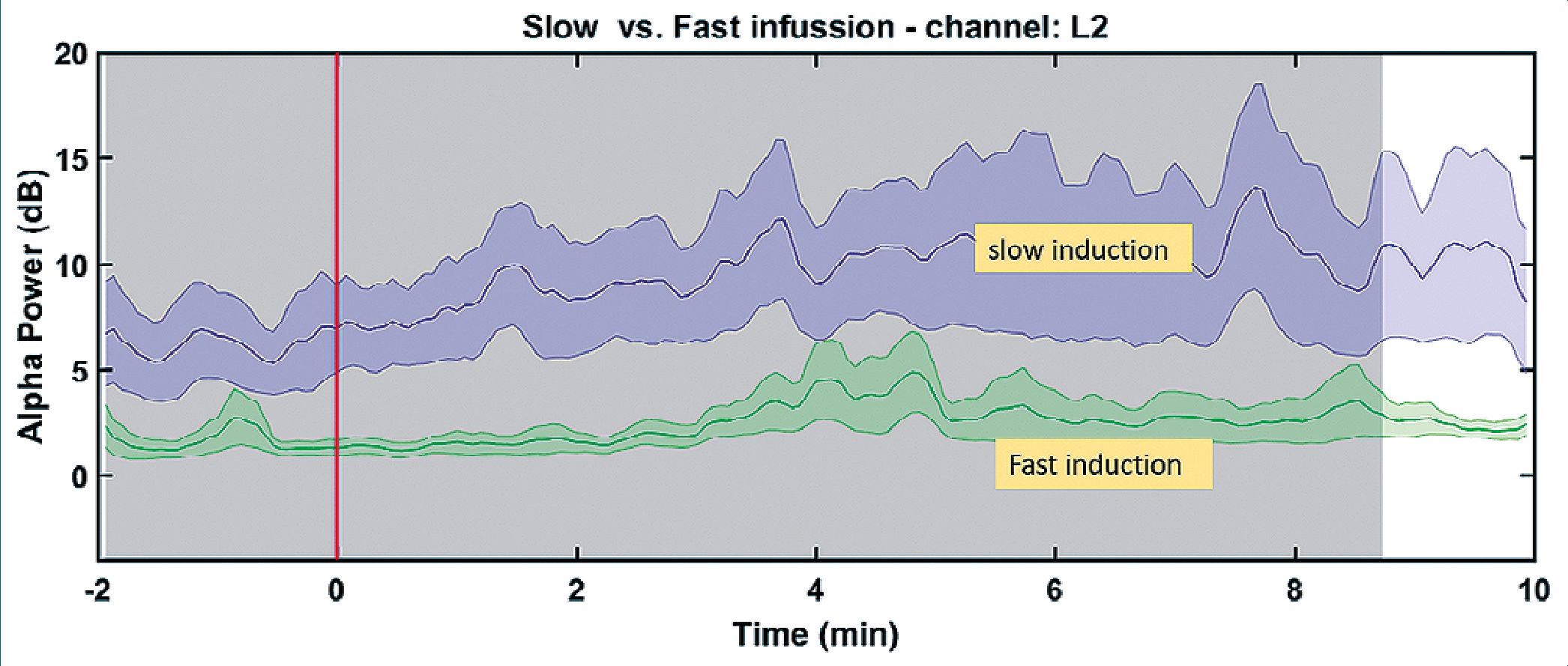
Figura 1. Poder de banda alfa en dos tipos de inducciones, bolo 1,9 mg/kg y otra lenta en 10 mg/kg/h hasta alcanzar el LOC[24]. Línea roja representa momento del LOC.
El término “aclaramiento constante” (por ser proporcionalmente constante al gradiente de concentración) se utiliza a menudo en el contexto de una denominada “cinética lineal”. Estas definiciones no tienen que ver con los fenómenos de comportamiento caóticos y generan confusión.
-
La farmacodinamia (FD)
Los fenómenos FD son los de mayor interés por representar el comportamiento del efecto. Los Non-Linear Mixed Effects Modeling (NONMEM) para farmacocinética y farmacodinámia tampoco reflejan la dinámica cerebral descrita, sino que describen lo No lineal en referencia a la variabilidadad de la manifestación del efecto en poblaciones, incluyendo covariables múltiples que la representen como edad, peso, masa magra etc[31].
Todos estos modelos entregan un valor central en la comprensión de la farmacodinámica: la variabilidad o sus coeficientes de variación, visto marginalmente entre paréntesis tras los valores tipo. Aunque lo más probable es que la variabilidad representada en los modelos sea incluso mayor que por dificultades metodológicas y simplificaciones en los diseños de estudio no ha sido desentrañada.
-
Los modelos E max
Al observar el clásico modelo Emax impresiona como un modelo estático. Asumen que cada Cp correspondería a una condición de equilibrio con un solo efecto. Estos modelos son atemporales y las relaciones de Cp con una teórica Ce, son usados para orientar la dosificación y las bandas terapéuticas[32].
El mismo concepto de “sitio de efecto” es una entelequia teórica y no es posible definir con exactitud los tiempos de equilibrio o que representa realmente en su correlato neural y funcional. La mayoría de estos modelos provienen de datos de estudios de condiciones de no equilibrio (bolos o infusiones rápidas, o condiciones de no equilibrio del circuito de gas: fase de mezcla de la droga) donde el retraso de la manifestación del efecto se lo adjudicó a una histéresis de origen farmacocinético[33].
En la práctica clínica es frecuente que el anestesiólogo utilice la referencia del modelo Emax para arbitrariamente definir una concentración de droga para el paciente, tanto en TCI o en la Fe de gas. Es frecuente utilizar el EC95 para asegurar tener al paciente inconsciente, sin hacer el ejercicio de individualizar el requerimiento.
El modelo Emax genera varios tipos de confusiones dado que puede representar varias definiciones simultáneas. Por ejemplo, puede representar la gradualidad de instalación del efecto en una población, o en un individuo, o el número de pacientes que se van reclutando a una respuesta binaria (ej consciencia-inconsciencia).
Es evidente que no es posible asumir que todas estas definiciones son adecuadas para usar como referencia para un paciente único y particular que enfrentamos diariamente.
Pero también se podría plantear otra interpretación/definición. Por ejemplo, que la EC50 corresponda al valor en que cada individuo respondiera el 50% de las veces a un estímulo repetido. Esto requeriría hacer varias mediciones en una misma concentración.
Un estudio de este tipo se realizó en ratas anestesiadas con isoflurano 0,6% por 2 h y pez cebra con propofol. Posteriormente, fueron estimularlas cada 3 minutos hasta 40 veces y se observó una gran variabilidad de respuestas individuales oscilando en forma estocática[34] donde si bien la probabilidad global de respuesta en la población fue estadísticamente homogénea del 50% durante el muestreo, el número de estados que resisten la transición en cada individuo es muy diferente, donde además la probabilidad de transición a la inconsciencia tiene una tendencia a ser similar al estado previo. Esta es una característica típica de los sistemas no lineales. Habría entonces una probabilidad de resistencia a la transición de cada individuo como nueva variable en la modelización.
Estos resultados hacen que la repuesta sea una condición probabilística menos absoluta que la representada en las curvas sigmoidales Emax clásicas, e implica que la pendiente de la curva de Hill tendería a ser más plana (valor Hill más bajo). Representa por lo tanto, mayor incerteza en la predicción al existir mayor variabilidad. Esto provoca además que los valores EC50 obtenidos en este modelo sean mucho más bajos que en los de estudios tradicionales. De hecho, en el estudio mencionado el EC50 obtenido fue 0,55% vs el histórico de 0,9%[34].
Otra observación que muestra el aumento de la incerteza es que las probabilidades de respuesta individuales a diferentes concentraciones se superponen. En dos poblaciones, una expuesta a 0,3% y otra a 0,6% de isofluorano, al estimar la densidad de probabilidad de las respuestas individuales y el solapamiento de las dos distribuciones, se observa que es prácticamente el azar: 57% (Figura 2).
Clínicamente todo esto implica que, en una amplia gama de probabilidades de respuesta, la predictibilidad de los modelos es escasa.
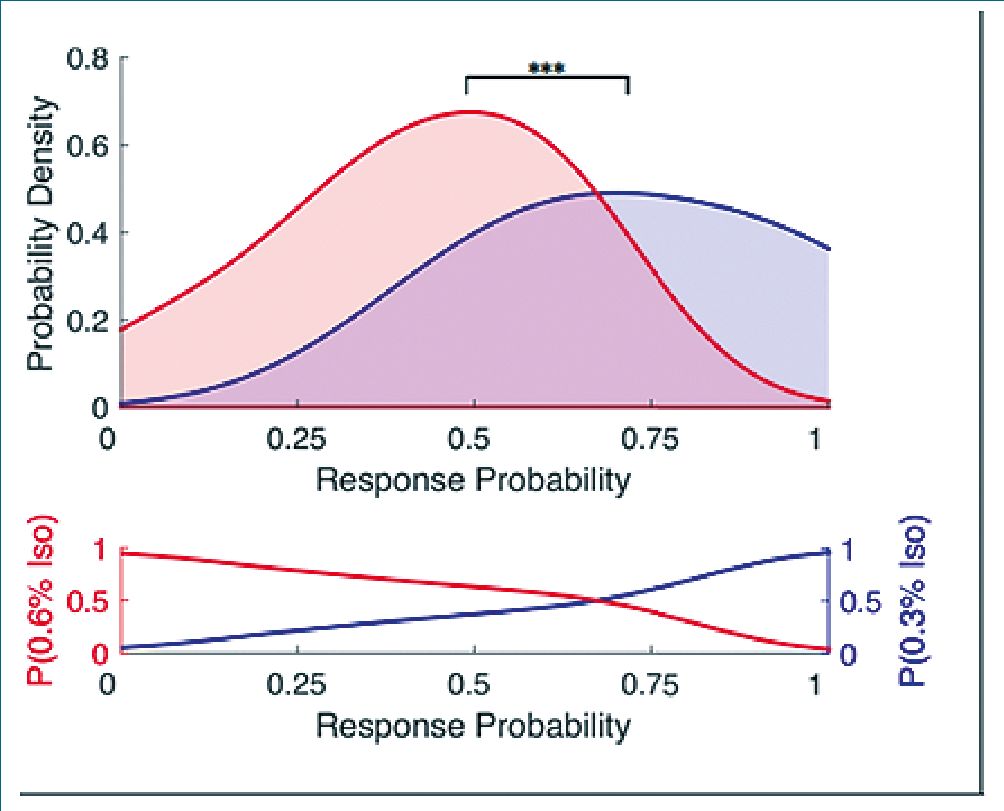
Figura 2. Se observa la densidad de probabilidad de respuesta individuales a 0,3% de isoflurano (azul) y 0,6% de isoflurano (rojo). A nivel de la población, las distribuciones de la capacidad de respuesta en las dos concentraciones son significativamente diferentes (p < 0,001), pero el solapamiento de las dos distribuciones fue del 57%. En un amplio rango de probabilidades de respuesta, las probabilidades de identificar correctamente la concentración del fármaco sobre la base de la capacidad de respuesta observada se acercan al azar[34].
-
Inercia y colapso de la histéresis
Ya se mencionó que una característica de los fenómenos de la dinámica no lineal son los comportamientos inerciales. El comportamiento inercial se le ha observado como parte del fenómeno del despertar del sueño fisiológico[35] y ya hace más de 10 años Friedman y Kelz mostraron[36], la denominada inercia neuronal en ratas y moscas anestesiadas, diferenciando las concentraciones de dormirse y despertarse y rompiendo la lógica farmacológica tradicional de que a una Cp correspondía solo un efecto. Descartaba que la histéresis representada entre el desfase de la Cp y la manifestación del efecto fuera solo un artilugio del retraso de la instalación del efecto (histéresis cinético-dinámica). La resolución matemática de este retraso, basado en el denominado colapso del loop histerético y usado para calcular una constante de transferencia al sitio de efecto (ke0), sería entonces una solución incompleta porque habría una inercia farmacodinámica intrínseca no colapsable[37] (Figura 3).
Esta inercia neuronal se ha ido corroborando posteriormente en estudios en humanos confirmándose la existencia como fenómeno farmacodinámico intrínseco[38],[39].
La existencia de la inercia tiene gran implicancia clínica, porque implica que las Cp al inducir la inconsciencia no necesariamente corresponderían a las requerida para el mantenimiento y menos aún para el despertar de los pacientes[40].
En los cerebros frágiles, esta inercia a estaría incluso aumentada y se ve representada por el retardo del despertar a concentraciones mucho menores que la perdida de consciencia en la inducción. Además, han aparecido otras características electroencefalográficas distintivas, como el hecho que la saturación de actividad de ondas lentas durante la inducción presenta un comportamiento tipo inercial entre la inducción y el despertar anestésico. Esto en humanos se asocia a fragilidad cognitiva[35],[39].
Esta inercia neuronal estudiada en las fases de despertar tendría además un comportamiento no predecible y reafirma la característica no lineal. Estos comportamientos, confirman que la lógica farmacológica del simple decaimiento lineal de las Cp no explica el fenómeno del despertar anestésico[41].
-
Complejidad y criticalidad
El otro fenómeno típico de comportamientos no lineales no reflejado en la modelación farmacodinamia es la llamada
complejidad. Boncompte, en pacientes sedados con propofol observa que ciertos pacientes tienen un comportamiento de mayor entropía denominado complejidad evaluada con la medición de complejidad Lempele-Ziv, que se define matemáticamente como el número de patrones no redundantes dentro de una señal de EEG. El comportamiento no lineal se confirma porque durante la infusión de propofol en un grupo de pacientes aumenta la complejidad representada con la descrita fase desinhibitoria previa a perder la consciencia, mientras en otro grupo disminuye al entrar en sedación[42].
Una población de pacientes se diferencia con distintas respuestas a similares concentraciones: uno con aparición de actividad excitatoria beta (13-28 Hz) y otro progresa directo a la inconsciencia con predominante actividad alfa (7-12 Hz). En este caso la complejidad es un instrumento evaluable y potencial marcador de la condición de inconsciencia en estos sistemas dinámicos no lineales como el cerebro.
-
Criticalidad
Como mencionamos arriba, una forma de organización de la materia con capacidad de generar fenómenos emergentes es la llamada criticalidad. Es un estado organizado al borde del caos, que permite aparición de fenómenos nuevos que aportan información y memoria. Los estados críticos son configuraciones transitorias únicas de los sistemas físicos que han sido el centro de atención de la física estadística durante más de un siglo.
En las neurociencias, la criticidad es atractiva porque la teoría y los modelos sugieren que las redes neuronales en estado crítico presentan propiedades óptimas de procesamiento y computación. Las propiedades incluyen la transmisión, almacenamiento de información, el rango dinámico, estados metaestables y la potencia de cálculo.
Estudios recientes[43],[47] que utilizan técnicas de análisis de criticalidad muestran como la consciencia se sostiene en estados críticos y esta dinámica se pierde en anestesia, estados convulsivos o aumenta en estados psicodélicos. Los estudios sugieren que el procesamiento de la información cortical se interrumpe durante los estados de inconsciencia debido a una transición de las oscilaciones eléctricas corticales de baja frecuencia fuera de este punto crítico.
Estos estados no son representados ni en los modelos PKPD ni en los índices procesados del EEG. Son cambios específicos de la condición cortical y suficientes para impedir la
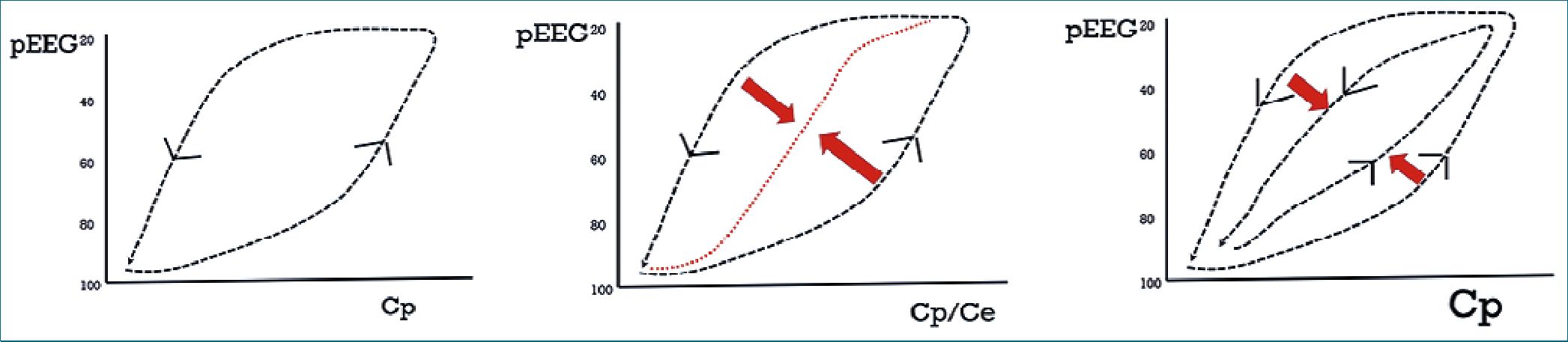
Figura 3. A) Loop de histéresis cinético-dinámico; B) Colapso tradicional del loop para construir relación atemporal Cp-Ce; C) loop parcialmente colapsado por presencia de inercia farmacodinámica intrínseca. pEEG índice electroencefalográfico procesado, Cp concentración plasmática, Ce concentración efecto.
emergencia de consciencia, por lo tanto, confirman que no se requiere deprimir más el córtex y confirma que la conceptualización de profundidad anestésica no se ajusta a las definiciones históricas. Sería además una llave para evitar fenómenos adversos producto de la sobredosis. Por ahora, se está en búsqueda de marcadores EEG de estas dinámicas para uso clínico que además sirvan para la modelización.
Podemos decir entonces que la potencia de las drogas no es suficiente para describir adecuadamente el efecto en un individuo específico. Y que cuantificaciones como la concentración efectiva no pueden dar cuenta del hecho de que la probabilidad de respuesta dependa no sólo de la concentración de la droga, sino también de la historia previa y de la dinámica oscilante estabilizadora que exige la existencia de inercia[44].
Un interesante estudio que intenta incluir la existencia de inercia neuronal en la modelación del efecto[37] usando dinámicas neurales, muestra que, usando el procesamiento de Markov para las transiciones del estado de vigilia modificado para anestesia y la ecuación de Hill estándar con 10 escalones (3 de vigilia y 7 de anestesia), más la incorporación de ruido al sistema (equivalente nociceptivo), se pudo modular la concentración de anestésico como parámetro de control y, así, estudiar numerosas características de la inercia neural en términos de las transiciones.
Los autores demostraron además que, si bien las transiciones de estado del anestésico dan lugar a la inercia, esta puede disminuirse aumentando el ruido en el sistema, confirmado que la inercia es independiente de la farmacocinética. Implicaría que tanto el equilibrio del fármaco y la dinámica neuronal desempeñan un papel fundamental en manifestación de la histéresis/ inercia.
Estos modelos confirman que la curva de dosis-respuesta se desplaza hacia la izquierda para el despertar en relación con la inducción y ratifican la importancia respecto al rol de la inercia en las transiciones de estado anestésico. Las transiciones complejas entre la conciencia e inconsciencia se describen con un modelo biestable modificado.
El estudio del comportamiento eléctrico del despertar también ha mostrado una gran variabilidad y sugiere la existencia de trayectorias de emergencia cualitativamente muy diferentes a la simple curva Emax[45]. Recientes hallazgos muestran que el cerebro reacciona en clusters según las concentraciones de droga, de manera que pasar de un cluster a otro depende de la calidad de la red cerebral. En los cerebros “débiles” o dañados en su conectividad, la recuperación de la función habitual puede ser entonces mucho más lenta si se llega a clusters “profundos” o de gran electrodepresión. Esto es común cuando la anestesia no se titula lenta e individualmente, sino utilizando concentraciones referenciales de datos poblacionales que además son poco representativas en poblaciones geriátricas.
Estos factores son claves para entender que la trayectoria del EEG del despertar impacta en el riesgo asociado a delirium y (post opetative cogitive disease)[46].
-
Mantenimiento de la anestesia y dinámica no lineal cerebral
Observaciones recientes, concluyen que con conocer solo las Cp de un momento (LOC) no es suficiente para definir la respuesta en el tiempo. Ya desde los años 90 se ha visto que, tras
la pérdida de la consciencia, el cerebro continúa activo, en una dinámica oscilatoria controlada, que soportaría el estado de criticalidad. Entendiendo si, que existe una reducción de la complejidad al perderse la consciencia por una desestructuración de redes de alto orden (las consideradas para generar consciencia explicita), muchas redes de menor orden continúan activas[47]. El EEG puede mostrar entonces cada cierto tiempo cambios en los espectrogramas y ratificar que la profundidad de la anestesia no es unidimensional como se asume en los monitores de EEG procesados por un solo número de 0 a 100. Esto es especialmente notorio por las diferentes representaciones que presentan distintos anestésicos por si solos o combinados.
Este tipo de comportamientos críticos no lineales se ha visto tanto en la inducción[47] como en el despertar anestésico[48],[49]. Incluso en voluntarios sometidos a anestesia sin cirugía se ha observado una oscilación significativa durante el mantenimiento que refleja estos comportamientos[62].
Durante el mantenimiento anestésico, esta dinámica es de menor probabilidad de transición entre distintos estados cerebrales, pero se han observado cambios en estados anestésicos aun sin estímulos nóxicos que serían predictores de mejor funcionalidad de la recuperación posopertoria[41]. Hudson mostró que en ratas anestesiadas se observa cómo oscilan los espectrogramas en distintas zonas del cerebro en dos diferentes concentraciones de isofluorano, sugiriendo que, a niveles consistentes con la anestesia quirúrgica, la actividad cerebral alterna entre múltiples atractores, pasando a menudo del orden de 10 minutos de un patrón de actividad antes de cambiar a otro. La probabilidad de estos saltos entre atractores sería con o sin estímulo y con o sin cambio en la concentración anestésica[49].
-
Consideraciones clínicas y monitoreo del EEG
Dada la mayor incerteza que generan los datos que demuestran el comportamiento de tipo no lineal incluso con dinámica tipo caótica, toma mucha relevancia la necesidad del uso de monitoreo en línea de señales que se ajusten cada vez más la toma de decisiones a esta dinámica cerebral y lejana de la conceptualización de la llamada “profundidad anestésica”. Esta nueva visión convierte a la titulación anestésica en un acto de ajuste permanente durante el mantenimiento basado en la observación de los monitores del EEG, que reflejen el correlato neural del EEG para lograr solo desacoplar los mecanismos necesarios para inhibir solamente la emergencia de consciencia y no necesariamente de otras actividades corticales. En especial las asociadas a loops con los sistemas homeostáticos que desestabilizan mecanismos reguladores, como es el ejemplo la aparición de burst supression en el cortex cingulado poste- rior[50],[51],[52].
Los marcadores más aceptados hoy menos para las drogas gabaergicas como propofol o sevofluorano, son la aparición de la sincronía talamocortical en alfa con una base en ritmos lentos (deltspinlde) en el espectrograma de bandas frontal. Estos marcadores no han estado exentos de discusión. Por ejemplo, existen estudios que plantean que, a pesar de la existencia de una banda alfa, habría pacientes que responden al test del antebrazo aislado[53].
Y otros al analizar el poder alfa muestran que este sería débil y asociado con gran poder delta al momento de la pérdida de la conciencia. Esto también sucedería con la conectividad
fronto-parietal. Estos estudios han sido muy criticados por no ser anestesias continuas, usar bolos que producen una pérdida de conciencia bottom up depresora profunda del tálamo y del brainstem o simplemente no haber estandarización de las anestesias para poder ser comparadas.
Por otro lado, Sepúlveda y cols[54],[55] muestran que el poder alfa es muy intenso con una reducción relativa del poder delta al realizar una inducción progresiva versus una inducción con bolos. La banda alfa se solidifica aún más al agregar remifentanil.
Estas aproximaciones diferentes reflejan mecanismos diferentes de perdida de consciencia y es una muestra de la utilidad del monitoreo para mostrar comportamiento no lineal ante la exposición a drogas gabaergicas.
La depresión de la banda de frecuencias alfa, se la ha asociado además a cerebros frágiles y en especial a sobredosificación. Aunque recientemente se ha mostrado que, si bien el poder total del EEG disminuye, la banda alfa normalizada por edad ocuparía el mismo poder en el espectro, sugiriendo que la debilidad alfa encontrada en ancianos y la mayor frecuencia de supresión radican esencialmente en una mala titulación (dosis y velocidad inadecuada)[63]. La disminución de un alfa basal tras la inducción lenta titulada al LOC, sería además un indicador del cambio dinámico de este cerebro oscilante que habría cambiado a un atractor más lento durante la anestesia. En cerebros frágiles es imprescindible identificar la condición de poder alfa basal para proyectar y orientar el mantenimiento. Esto solo es
posible con monitoreo del EEG y evitando cambios bruscos producto de bolo (Figura 4).
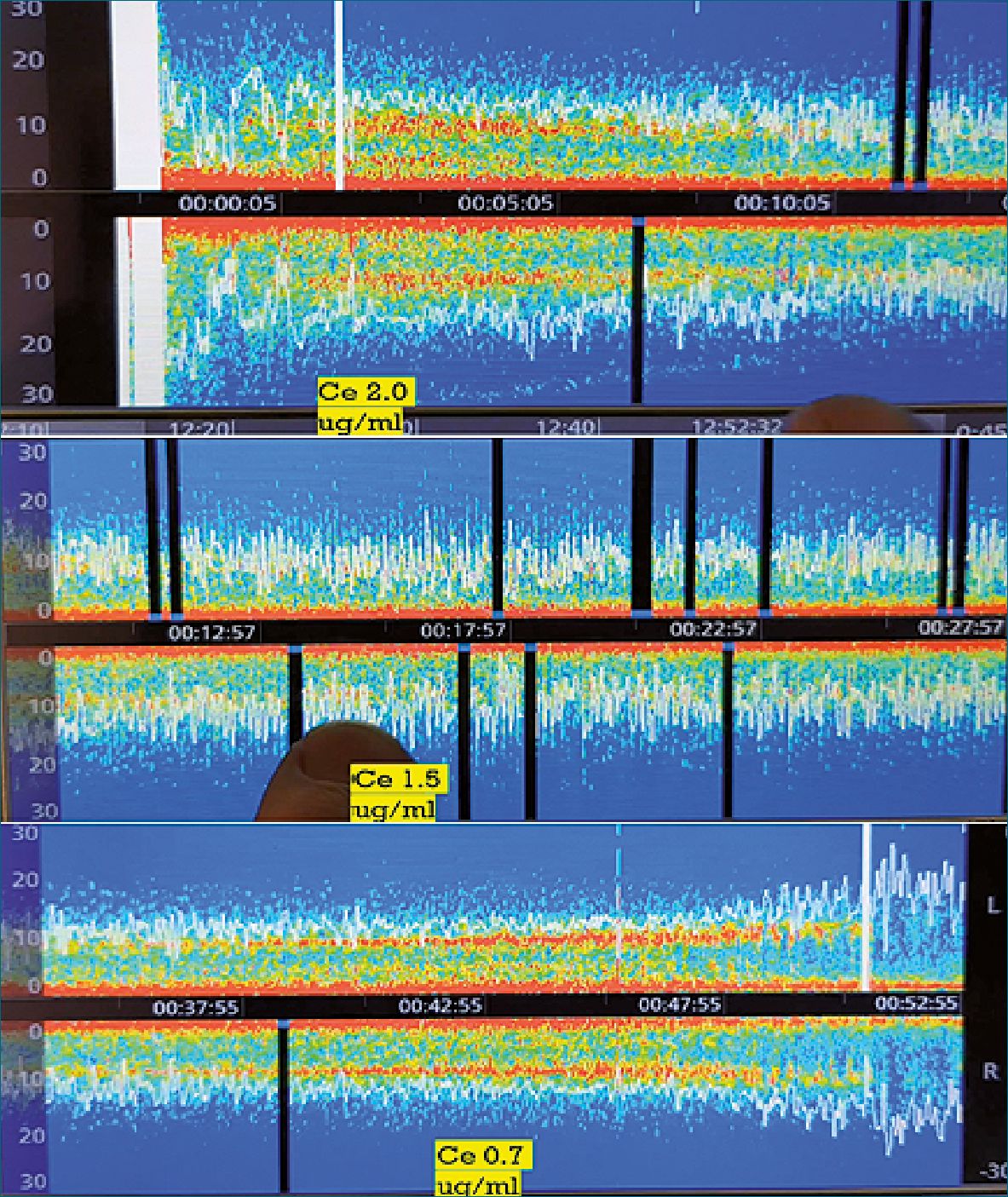
Figura 4. En clínica el fenómeno oscilatorio y no lineal, se ve en este paciente frágil, que tras la perdida de la conciencia muestra un debilitamiento de la banda alfa y compresión del SEF, con aparición progresiva de períodos de burst supression. Esto obliga a ir disminuyendo la concentración de propofol hasta lograr recuperar la banda alfa y desaparecer la supresión en 1,1 ug/ml. Al final se observa el despertar en Ce de 0,7 ug/ml.
La aparición de ritmos anormales como burst supression son principalmente señales de inadecuada dosificación producto del déficit de datos farmacológico sólidos en edades extremas, como se deduce del estudio de Purdon que muestra el dramático aumento de la BS con la edad[56].
Para lograr encontrar un alfa basal al LOC, solo sería posible entonces con inducciones progresivas y sin bolos. El uso de bolos de propofol y luego un inhalado no permite identificar finamente una condición basal del poder alfa tras LOC.
Se debe considerar además que los modelos TCI sitio- efecto están conocidamente sobrepredichos en relación con las concentraciones medidas[57],[58] y por tanto incluso tras inducir muy lento, al alcanzar LOC es posible reducir la Ce calculada alrededor de 10% a 15%.
Los pacientes cognitivamente frágiles, tras LOC, muestran una banda alfa débil, con una menor compresión del SEF95 (dada la mayor dispersión por la debilidad del poder alfa) pero con mayor frecuencia de aparición de períodos de burst supression si no se es estricto en la progresión de la titulación. La inducción no titulada obliga a ajustar a la baja la concentración de propofol (o el gabaergico administrado) hasta intentar recuperar una banda alfa y hacer desaparecer la supresión sin conocer la real condición basal del paciente. En estos pacientes los tiempos de despertar son más largos que en pacientes no frágiles, reflejándose la sobredosis y también mayor inercia neuronal[59],[60].
Recientemente, un estudio con más de 600 casos se asoció que la trayectoria del EEG desde estados profundo (bajo SEF, predominancia delta) a un estado de vigilia abrupto, presenta más riesgos asociados de delirium. El paso por estados intermedios con aparición de bandas alfa sería en este caso un factor protector[61]. Esto muestra que también el despertar anestésico es un acto clínico activo, con progresividad, intentando no forzar la sobrecarga informática al despertar y buscando un paso por actividad alfa, mientras se produce la recuperación del bloqueo colinérgico.
Hoy sabemos que, desde la oscilación intrínseca y los atractores generados por diferentes concentraciones de drogas y estímulos, emergen multiestados que se evidencian en diferentes firmas electroencefalográficas observables en procesamientos más complejos del EEG. Esto está forzando a redefinir la noción de profundidad anestésica como un fenómeno de dimensión única, y abandonando el concepto de depresión lineal desde la consciencia hasta el coma. El córtex tiene una actividad informática inmensa más allá de la emergencia o desaparición de la conciencia fenomenológica que no es necesario deprimir y la mayoría de las herramientas analíticas usadas en clínica los últimos 20 años, como los índices procesados del EEG (BIS, PSI, Ioc-View, Narcotrend, CSM), capturan firmas estacionarias, lineales y de baja dimensión de la complejidad dinámica cortical que no son útiles para observar el comportamiento cerebral complejo. Además, asocian en el concepto de profundidad al grado de depresión cortical como fenómeno íntegro del requerimiento anestésico, generando confusión con el componente del manejo de componente antinociceptivo que se debe enfrentar de forma específica con drogas y monitoreo ad hoc.
Sin desconocer el gran aporte de la modelización PKPD, nos enfrentamos ahora a nuevas opciones que representen los fenómenos biológicos de biestabilidad neural, complejidad e inercia. La entelequia que representan los modelos “sitio efecto” construida en modelos atemporales desde la curva Emax no es suficiente para representar la variabilidad del funcionamiento en metaestabilidad y tal vez nunca pueda hacerlo en plenitud, requiriendo avanzar en la integración de modelos y señales en nuevos instrumentos tecnológicos.
Por ahora la actitud de pensar en lógicas no lineales el fenómeno anestésico impulsará a desarrollar cambios desde la actitud clínica y la individualización de la terapia. Desde el punto de vista clínico, la propuesta para enfrentar la incerteza, implica asumir que la dinámica cerebral sería diferente a la lógica farmacológica clásica de linealidad de respuesta (Ce ^ un efecto) y la variabilidad farmacológica no se explica ni desde la cinética, ni desde diferente susceptibilidad, sino además desde un estado oscilatorio intrínseco.
En ese caso ¿no será razonable intentar enfrentar estos escenarios simplemente disminuyendo la velocidad que le imprimimos al cambio (el uso de bolos en drogas sensibles), para así enfrentar en forma algo más predecible las dinámicas no lineales?
Conflictos de intereses: Los autores no tienen conflicto de interés con fármacos o tecnologías mencionadas.
Referencias
1. Prigogine I. The End of Certainty. Book Editions Odile Jacob; 1996.
2. Solé RV, Manrubia S. Orden y caos en sistemas complejos. Fundamentos. Volumen 93 de Politext Series, Politext: Área de Física, Universidad Politécnica de Cataluña (Barcelona). Edicions de la UPC, S.L., 2001; ISBN 8483014300, 9788483014301
3. Janson NB. Contemporary Physics 2012, Marsh, 52-2. Non-linear dynamics of biological systems. https://doi.org/10.1080/00107514.2011.644441.
4. Andreu C, Echave J, Buela-Casal G. Actividad eléctrica según la teoría del caos. Psicothema, 1998. Vol. 10, nº 2, pp. 319-331 ISSN 0214 – 9915
5. Ruiz-Mirazo K, Peretó J, Moreno A. Defining life or bringing biology to life. Orig Life Evol Biosph. 2010 Apr;40(2):203–13. https://doi.org/10.1007/s11084-010-9201-6 PMID:20182798
6. https://es.wikipedia.org/wiki/Vida#cite_note-20 ; consultado el 8/11/2015.5.
7. Hesse J, Grpss T. Self-organized criticality as a fundamental property of neural systems Front. Syst. Neurosci., 23 September 2014 | https://doi.org/10.3389/fnsys.2014.00166.
8. Zimmern V. Why Brain Criticality Is Clinically Relevant: A Scoping Review. Front Neural Circuits. 2020 Aug;14:54. https://doi.org/10.3389/fncir.2020.00054 PMID:32982698
9. Kelso JA. Multistability and metastability: understanding dynamic coordination in the brain. Philos Trans R Soc Lond B Biol Sci. 2012 Apr;367(1591):906–18. https://doi.org/10.1098/rstb.2011.0351 PMID:22371613
10. Ma Z, Turrigiano GG, Wessel R, Hengen KB. Cortical Circuit Dynamics Are Homeostatically Tuned to Criticality In Vivo. Neuron. 2019 Nov;104(4):655–664.e4. https://doi.org/10.1016/j.neuron.2019.08.031 PMID:31601510
11. Tononi G. Integrated information theory of consciousness: an updated accountArchives Italiennes de Biologie, 150: 290-326, 2012
12. Oizumi M, Albantakis L, Tononi G. From the Phenomenology to the Mechanisms of Consciousness: Integrated Information Theory 3.0. Comput Biol 10(5): e1003588. https://doi.org/10.1371/journal.pcbi.1003588.
13. Sleigh J, Hight D. Is complexity complicated? [Editorial]. Br J Anaesth. 2021 Aug;127(2):173–4. https://doi.org/10.1016/j.bja.2021.05.014 PMID:34147246
14. Sarasso S, Boly M, Napolitani M, et al. Consciousness and complexity during unresponsiveness induced by propofol, xenon, and ketamine. Curr Biol 2015; 25: 3099e105 https://doi.org/10.1016/j.cub.2015.10.014.
15. Kitzbichler MG, Smith ML, Christensen SR, Bullmore E. Broadband criticality of human brain network synchronization. PLOS Comput Biol. 2009 Mar;5(3):e1000314. https://doi.org/10.1371/journal.pcbi.1000314 PMID:19300473
16. Singer W. The Neuronal Correlate of Consciousness: Unity in Time rather than Space? Neurosciences and the Human Person: New Perspectives on Human Activities Pontifical Academy of Sciences, Scripta Varia 121, Vatican City 2013 www.casinapioiv.va/content/dam/accademia/pdf/sv121/sv121-singer.pdf
17. Shew, et al. “The Human Brain Is On The Edge Of Chaos.”. Public Library of Science. ScienceDaily, 23 March 2009. www.sciencedaily.com/releases/2009/03/090319224532.htm
18. Mashour GA, Hudetz AG. Bottom-Up and Top-Down Mechanisms of General Anesthetics Modulate Different Dimensions of Consciousness. Front Neural Circuits. 2017 Jun;11:44. https://doi.org/10.3389/fncir.2017.00044 PMID:28676745
19. Ro T, Breitmeyer B, Burton P, Singhal NS, Lane D. Feedback contributions to visual awareness in human occipital cortex. Curr Biol. 2003 Jun;13(12):1038–41. https://doi.org/10.1016/S0960-9822(03)00337-3 PMID:12814549
20. Meyer K. Primary sensory cortices, top-down projections and conscious experience. Prog Neurobiol. 2011 Sep;94(4):408–17. https://doi.org/10.1016/j.pneurobio.2011.05.010 PMID:21683755
21. Abdullah Abdulrhman Al Abdulgader. Human Consciousness: The Role of Cerebral and Cerebellar Cortex, Vagal Afferents, and Beyond. Book, December 10th, 2020, https://doi.org/10.5772/intechopen.95040.
22. Colombo M, Sérié P. Bayes in the Brain—On Bayesian Modelling in Neuroscience. Br J Philos Sci. 2012;63(3):697–723. https://doi.org/10.1093/bjps/axr043.
23. Pujol J. Blanco-Hinojo1 L, Gallart L, Moltó L, Martínez-Vilavella G, Vilà E, Pacreu S, Adalid I, Deus J, Pérez-Sola V, Fernández-Candil J. Largest scale dissociation of brain activity at propofol induced loss of consciousness. SleepJ; 2021. pp. 1–12. https://doi.org/10.1093/sleep/zsaa152.
24. Sepúlveda P, Cortinez LI, Irani M, Egaña JI, Contreras V, Sánchez Corzo A, et al. Differential frontal alpha oscillations and mechanisms underlying loss of consciousness: a comparison between slow and fast propofol infusion rates. Anaesthesia. 2020 Feb;75(2):196–201. https://doi.org/10.1111/anae.14885 PMID:31788791
25. Kitzbichler MG, Smith ML, Christensen SR, Bullmore E. Broadband criticality of human brain network synchronization. PLOS Comput Biol. 2009 Mar;5(3):e1000314. https://doi.org/10.1371/journal.pcbi.1000314 PMID:19300473
26. Brodie B, Mark L, Papper EM, Lief P, Bernstein E, Rovenstine EA. The fate of thiopental in man and a method for its estimation in biological material. Surv Anesthesiol. 1965;9(4):391. https://doi.org/10.1097/00132586-196508000-00056.
27. Iwakiri H, Nishihara N, Nagata O, Matsukawa T, Ozaki M, Sessler DI. Individual effect-site concentrations of propofol are similar at loss of consciousness and at awakening. Anesth Analg. 2005 Jan;100(1):107–10. https://doi.org/10.1213/01.ANE.0000139358.15909.EA PMID:15616062
28. Whitlock E, Villafranca A, Lin N, Palanca B, Jacobsohn E, Finkel K, Zhang L, Burnside A, Kaiser H, Evers A, Avidan M. Relationship between Bispectral Index Values and Volatile Anesthetic Concentrations during the Maintenance Phase of Anesthesia in the B-Unaware Trial Anesthesiology 2011; 115:1209 –18 https://doi.org/10.1097/ALN.0b013e3182395dcb.
29. Bonhomme V, Staquet C, Montupil J, Defresne A, Kirsch M, Martial C, et al. General Anesthesia: A Probe to Explore Consciousness. Front Syst Neurosci. 2019 Aug;13:36. https://doi.org/10.3389/fnsys.2019.00036 PMID:31474839
30. Sepúlveda P, Acosta I, Hoppe A, Lobo FA, Carrasco E. Influence of rate of administration on the mechanism behind propofol induced loss of consciousness. Rev Esp Anestesiol Reanim (Engl Ed). 2021 May;68(5):245–51. https://doi.org/10.1016/j.redare.2020.05.025 PMID:33478749
31. Ophelia Yin, Raymond Miller, in Atkinson’s Principles of Clinical Pharmacology. (Fourth Edition), 2022
32. Sheiner LB, Stanski DR, Vozeh S, Miller RD, Ham J. Simultaneous modeling of pharmacokinetics and pharmacodynamics: application to d-tubocurarine. Clin Pharmacol Ther 1979; 25: 358e71 https://doi.org/10.1002/cpt1979253358.
33. Sepúlveda V PO, Demaría MC. Critical view of the effect site modelling of propofol. Rev Esp Anestesiol Reanim (Engl Ed). 2019 Oct;66(8):425–33. https://doi.org/10.1016/j.redare.2019.03.012 PMID:31477336
34. McKinstry-Wu AR, Wasilczuk AZ, Harrison BA, Bedell VM, Sridharan MJ, Breig JJ, et al. McKinstry-Wu1 A, Wasilczuk A, Harrison B, Bedell V, Sridharan M, Breig J, Pack M, Kelz M, Proekt A. Analysis of stochastic fluctuations in responsiveness is a critical step toward personalized anesthesia. eLife. 2019;8:e50143. https://doi.org/10.7554/eLife.50143.
35. Luppi AI, Spindler LR, Menon DK, Stamatakis EA. The Inert Brain: Explaining Neural Inertia as Post-anaesthetic Sleep Inertia. Front Neurosci. 2021 Mar;15:643871. https://doi.org/10.3389/fnins.2021.643871 PMID:33737863
36. Friedman EB, Sun Y, Moore JT, Hung HT, Meng QC, Perera P, et al. A conserved behavioral state barrier impedes transitions between anesthetic-induced unconsciousness and wakefulness: evidence for neural inertia. PLoS One. 2010 Jul;5(7):e11903. https://doi.org/10.1371/journal.pone.0011903 PMID:20689589
37. Proekt A, Kelz . Explaining anaesthetic hysteresis with effect-site equilibration British Journal of Anaesthesia, 126 (1): 265e278 (2021) https://doi.org/10.1016/j.bja.2020.09.022.
38. Sepúlveda PO 5th, Carrasco E, Tapia LF, Ramos M, Cruz F, Conget P, et al. Evidence of hysteresis in propofol pharmacodynamics. Anaesthesia. 2018 Jan;73(1):40–8. https://doi.org/10.1111/anae.14009 PMID:28872658
39. Warnaby C, Sleigh JW, Hight D, Jbabdi S, Tracey I, Phil D. Med.Sci. Investigation of Slow-wave Activity Saturation during Surgical Anesthesia Reveals a Signature of Neural Inertia in Humans Anesthesiology 2017; 127:645-57
40. Sepúlveda PO, Tapia LF, Monsalves S. Neural inertia and differences between loss of and recovery from consciousness during total intravenous anaesthesia: a narrative review. Anaesthesia. 2019 Jun;74(6):801–9. https://doi.org/10.1111/anae.14609 PMID:30835820
41. Proekt A, Hudson AE. A stochastic basis for neural inertia in emergence from general anaesthesia. British Journal of Anaesthesia, 121 (1): 86e94 (2018) https://doi.org/10.1016/j.bja.2018.02.035.)
42. Boncompte G, Medel V, Cortínez LI, Ossandón T. Brain activity complexity has a nonlinear relation to the level of propofol sedation. Br J Anaesth. 2021 Aug;127(2):254–63. https://doi.org/10.1016/j.bja.2021.04.023 PMID:34099242
43. Toker D, Pappas I, Lendner JD, Frohlich J, Mateos DM, Muthukumaraswamy S, et al. Consciousness is supported by near-critical slow cortical electrodynamics. Proc Natl Acad Sci USA. 2022 Feb;119(7):e2024455119. https://doi.org/10.1073/pnas.2024455119 PMID:35145021
44. Hudson AE. Metastability of Neuronal Dynamics during General Anesthesia: Time for a Change in Our Assumptions? Front Neural Circuits. 2017 Aug;11:58. https://doi.org/10.3389/fncir.2017.00058 PMID:28890688
45. Chander D, García PS, MacColl JN, Illing S, Sleigh JW. Electroencephalographic variation during end maintenance and emergence from surgical anesthesia. PLoS One. 2014 Sep;9(9):e106291. https://doi.org/10.1371/journal.pone.0106291 PMID:25264892
46. Hesse S Kreuzer M, Hight D, Gaskell A, Devari P, Singh D, Taylor NB, Whalin MK, Lee S, Sleigh JW, García PS. Association of electroencephalogram trajectories during emergence from anaesthesia with delirium in the postanaesthesia care unit: an early sign of postoperative complications. British Journal of Anaesthesia, 122 (5): 622e634 (2019) https://doi.org/10.1016/j.bja.2018.09.016.
47. Alonso LM, Proekt A, Schwartz TH, Pryor KO, Cecchi GA, Magnasco M. Dynamical criticality during induction of anesthesia in human ECoG recordings. Front. Neural Circuits, 25 March 2014 | https://doi.org/10.3389/fncir.2014.00020.
48. Walling PT, Hicks KN. Nonlinear Changes in Brain Dynamics during Emergence from Sevoflurane Anesthesia Preliminary Exploration Using New Software Anesthesiology 2006; 105:927–35.
49. Hudson AE, Calderon DP, Pfaff DW, Proekt A. Recovery of consciousness is mediated by a network of discrete metastable activity states. Proc Natl Acad Sci USA. 2014 Jun;111(25):9283–8. https://doi.org/10.1073/pnas.1408296111 PMID:24927558
50. Craig AD. How do you Feel? An interoceptive moment with your neurobiological self. Princeton (New Jersey): Princeton University Press; 2015. https://doi.org/10.1515/9781400852727.
51. Sleigh J, Warnaby C, Tracey I. General anaesthesia as fragmentation of selfhood: insights from electroencephalography and neuroimaging. British Journal of Anaesthesia, 121 (1): 233e240 (2018) https://doi.org/10.1016/j.bja.2017.12.038.
52. Vlisides PE, Li D, Zierau M, Lapointe AP, Ip Ki, McKinney AM, Mashour GA. Cortical Connectivity during General Anesthesia in Surgical Patients Anesthesiology 2019; 130:885-97
53. Gaskell AL, Hight DF, Winders J, Tran G, Defresne A, Bonhomme V, et al. Frontal alpha-delta EEG does not preclude volitional response during anaesthesia: prospective cohort study of the isolated forearm technique. Br J Anaesth. 2017 Oct;119(4):664–73. https://doi.org/10.1093/bja/aex170 PMID:29121278
54. Sepulveda P, et al. Diferential frontal alpha oscillations and mechanisms underlying loss of consciousness: A comparison between slow and fast propofol infusion rates. Anaesthesia. 2019; https://doi.org/10.1111/anae.14885 PMID:31788791
55. Obert DP, Sepúlveda P, Kratzer S, Schneider G, Kreuzer M. The influence of induction speed on the frontal (processed) EEG. Sci Rep. 2020 Nov;10(1):19444. https://doi.org/10.1038/s41598-020-76323-8 PMID:33173114
56. Purdon P, Pavone K, Akeju O, Smith A, Sampson A, Lee J, Zhou D, Solt K, Brown E. The Ageing Brain: Age-dependent changes in the electroencephalogram during propofol and sevoflurane general anaesthesia. Br J Anaesth 2015;115 Suppl 1(Suppl 1):i46-i57. https://doi.org/10.1093/bja/aev213..
57. Glen JB, Servin F. Evaluation of the predictive performance of four pharmacokinetic models for propofol. Br J Anaesth. 2009 May;102(5):626–32. https://doi.org/10.1093/bja/aep043 PMID:19297371
58. Sepúlveda PO, Mora X. [Reevaluation of the time course of the effect of propofol described with the Schnider pharmacokinetic model]. Rev Esp Anestesiol Reanim. 2012 Dec;59(10):542–8. PMID:23040653
59. Gutiérrez RG, Egaña JI, Maldonado FA, Sáez IA, Reyes FI, Soulat H, et al. Association Between Lower Preoperative Cognition With Intraoperative Electroencephalographic Features Consistent With Deep States of Anesthesia in Older Patients: An Observational Cohort Study. Anesth Analg. 2021 Jul;133(1):205–14. https://doi.org/10.1213/ANE.0000000000005262 PMID:33177327
60. Shanker A, Abel JH, Schamberg G, Brown EN. Etiology of Burst Suppression EEG Patterns. Front Psychol. 2021 Jun;12:673529. https://doi.org/10.3389/fpsyg.2021.673529 PMID:34177731
61. Hesse S, Kreuzer M, Hight D, Kreuzer M, Hight D, Gaskell A, Devari P, Singh D, Taylor NB, Whalin MK, Lee S Sleight JW, Garcia PS. Association of electroencephalogram trajectories during emergence from anaesthesia with delirium in the post anaesthesia care unit: an early sign of postoperative complications. British Journal of Anaesthesia, 2019;122 (5): 622e634 doi. org/https://doi.org/10.1016/j.bja.2018.09.016.
62. Li D, Vlisides PE, Kelz MB, Avidan MS, Mashour GA; ReCCognition Study Group. Dynamic Cortical Connectivity during General Anesthesia in Healthy Volunteers. Anesthesiology. 2019 Jun;130(6):870–84. https://doi.org/10.1097/ALN.0000000000002656 PMID:30946055
63. Obert P, Cardenas L, Zurita F, Schneider g, Kreuzer M, Sepúlveda P. The effect of the partient’s age on the spectral encephalographic characteristics during an ultra-slow propofol induction. Abstract IARS 2023
64. Being You: A New Science of Consciousness Hardcover – 2021 by Anil Seth

 ORCID
ORCID