Nicolás Villablanca N.1,*, Nicolás Valls1, Roberto González1,2
Recibido: 20-09-2023
Aceptado: 21-09-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 8 pp. 734-741|https://doi.org/10.25237/revchilanestv52n8-07
PDF|ePub|RIS
Anesthetic implications of neuroendocrine tumors and carcinoid syndrome
Abstract
Neuroendocrine tumors (NETs) are a diverse group of neoplasms often linked to paraneoplastic syndromes such as carcinoid syndrome (CS) and carcinoid crisis (CC). Despite available treatments like somatostatin analogs, CC remains a critical and potentially fatal event, the management and etiology of which are still subjects of debate. The lack of a standardized definition for CC leads to discrepancies in the literature concerning both its reported incidence rates (3-50%) and the effectiveness of prophylactic treatment with octreotide. Sudden fluctuations in blood pressure are often the primary indicator of CC, and current clinical guidelines lack a consensus on treatment. To address these challenges in NET patients, the Anesthesiology team at the National Cancer Institute has developed a perioperative protocol. Created in collaboration with multidisciplinary specialists, this protocol aims to standardize pre-surgical evaluation to predict the risk of CC and the potential benefits of pharmacological prophylaxis. This approach aspires to improve symptomatic management and prepares the surgical team for contingencies, thereby contributing to more precise and safer care.
Resumen
Los tumores neuroendocrinos (TNE) son una variedad heterogénea de neoplasias asociadas con síndromes paraneoplásicos como el síndrome carcinoide (SC) y la crisis carcinoide (CC). A pesar de terapias existentes como los análogos de somatostatina, la CC sigue siendo un evento agudo y potencialmente mortal, y su manejo y etiología continúan siendo temas de debate. La falta de una definición estandarizada de CC genera discrepancias en su incidencia reportada (3%-50%) y en la eficacia del tratamiento profiláctico con octreotide. Las fluctuaciones en la presión arterial son a menudo el principal indicador de CC, y las pautas clínicas actuales no ofrecen un consenso sobre el tratamiento. El equipo de Anestesiología del Instituto Nacional del Cáncer ha desarrollado un protocolo perioperatorio para abordar estos desafíos en pacientes con TNE. Creado en colaboración con especialistas multidisciplinarios, el protocolo tiene como objetivo estandarizar la evaluación prequirúrgica para predecir el riesgo de CC y los posibles beneficios de la profilaxis farmacológica. Este enfoque busca un mejor manejo sintomático y prepara al equipo quirúrgico para contingencias, contribuyendo a una atención más precisa y segura.
-
Introducción
Los tumores neuroendocrinos (TNE) representan un grupo diverso y heterogéneo de neoplasias malignas que emergen de las células neuroendocrinas. Una de sus propiedades distintivas es la secreción de sustancias biológicamente activas que, en determinadas circunstancias, pueden originar manifestaciones clínicas específicas[1],[2]. Aunque descritos por primera vez en 1888 como neoplasias localizadas en el íleon[3], fue en 1907 cuando Oberndorfer les confirió la nomenclatura de ‘Karzinoide Tumoren’ para subrayar su comportamiento menos agresivo en comparación con los adenocarcinomas[4]. Por consiguiente, los TNE también son conocidos como tumores carcinoides. Desde la década de 1950, existen registros de manifestaciones clínicas vinculadas a estas neoplasias, posteriormente catalogadas como Síndrome Carcinoide (SC).
Las células neuroendocrinas sirven como intermediarios entre los sistemas nervioso y endocrino. Estas células tienen la capacidad dual de recibir impulsos neuronales y, en respuesta, liberar hormonas. Distribuidas de forma difusa en todo el cuerpo, el eje hipotálamo-hipófisis actúa como el núcleo central de coordinación neuroendocrina. Además de su presencia en este eje, estas células se localizan a lo largo del tracto gastrointestinal, en células pulmonares y en las células neuroendocrinas suprarrenales, entre otros tejidos. Histológicamente, se distinguen por un citoplasma anofílico y núcleos redondos, con una cromatina que presenta un patrón ‘sal y pimienta’. En estudios inmunohistoquímicos, estas células expresan marcadores cito- plasmáticos de diferenciación neuroendocrina, como la sinap- tofisina y la cromogranina[2].
Los TNE pueden surgir en cualquier región que contenga células neuroendocrinas, siendo el tracto gastrointestinal, específicamente el intestino delgado y el páncreas, los sitios más frecuentes de aparición. El pulmón también representa un lugar común para la ubicación de TNE. A esta región que comprende el intestino delgado, páncreas y pulmón, se le designa como ‘intestino anterior’ y su ubicación tiene relevancia con relación a la funcionalidad específica de los TNE. No obstante, los TNE no se limitan a estas localizaciones y pueden aparecer en una variedad de tejidos, incluido el colon, recto, tiroides, médula suprarrenal, ovarios, cérvix y piel, donde se les conoce como tumor de Merkel.
-
Epidemiología
La incidencia de los TNE ha registrado un aumento significativo en las últimas décadas, elevándose de manera exponencial en comparación con otros tipos de cáncer[5]. Este incremento es particularmente notable en el pulmón y el tracto gastrointestinal, específicamente en el intestino delgado y el recto[6]. Tal ha sido la magnitud del aumento, que los TNE se han posicio- nado como la segunda causa más prevalente de cánceres gastrointestinales, siendo superados solo por el cáncer colorrectal. Este fenómeno ha impulsado a los sistemas de salud a destinar recursos específicos para el diagnóstico y tratamiento de esta enfermedad. Algunos factores que explicarían este crecimiento incluyen el incremento en el uso de procedimientos endoscó- picos digestivos y bronquiales, así como la implementación de técnicas diagnósticas avanzadas, como la tomografía por emisión de positrones con Galio 68 (PET DOTATATE).
Pese a la capacidad secretora de sustancias biológicamente activas por parte de los TNE, que en teoría determinaría una sin- tomatología específica, muchos casos se mantienen asintomáticos hasta fases avanzadas de la enfermedad. Este factor conduce a diagnósticos tardíos, que con frecuencia se confunden con patologías funcionales intestinales, retrasando el diagnóstico hasta en 5 a 8 años7. En este período, la mayoría de los casos evoluciona hacia etapas avanzadas con metástasis a distancia. Sin embargo, los TNE tienden a tener un pronóstico favorable, con tasas de sobrevida a 5 años del 71%, especialmente en los casos localizados en el intestino delgado[8].
En el contexto chileno, el año 2019 representó un hito con la publicación del primer registro de pacientes con TNE en el país[9]. De los casos registrados, el 64% pertenecía a tumores del sistema gastroenteropancreático (TNE-GEP), con 46% de afectación en el intestino delgado. Al momento del diagnóstico, el 64% presentaba metástasis. Además, el 92% de los pacientes se clasificaron dentro de las categorías 0-1 de la escala de performance ECOG10, lo que indica una buena tolerancia a la enfermedad. Es relevante subrayar que el 74% de los casos requirió una intervención quirúrgica, y dentro de estas, el 50% se realizó con intención curativa[8].
| Tabla 1. Síndromes asociados a tumores neuroendocrinos | |
| Tumor | Ubicación Péptidos |
| Carcinoide atípicoCarcinoide | Intestino, pulmón 5- HTP, histaminaIntestino delgado pulmón, páncreas 5- HTP, taquicinina prostaglandinas |
| Insulinoma | Células B páncreas Insulina, proinsulina |
| Gastrinoma | Triangulo del gastrinoma Gastrina |
| Glucagonoma | Células a páncreas Glucagón |
-
Clasificación
Históricamente, la clasificación de los TNE ha sido compleja y multifactorial, tomando en cuenta variables como el sitio del tumor primario, su origen embriológico, grado histológico y funcionalidad. No obstante, diversas organizaciones internacionales han hecho esfuerzos por estandarizar estos criterios de clasificación para optimizar tanto el diagnóstico como el tratamiento terapéutico de la enfermedad (Tabla 1).
La Sociedad Europea de Tumores Neuroendocrinos (ENETS) introdujo en 2014 una de las clasificaciones más reconocidas para los tumores gastroenteropancreáticos bien diferenciados. Esta estratificación se basa en el grado histológico y divide los tumores en bajo (grado 1), intermedio (grado 2) y alto grado (grado 3)[9]. En una línea similar pero más reciente, la Organización Mundial de la Salud (OMS) propuso en 2017 una categorización específica para los tumores pancreáticos neu- roendocrinos, distinguiendo entre tumores bien diferenciados y pobremente diferenciados, también conocidos como Neoplasia Mixta Neuroendocrina – No Neuroendocrina (MiNEN)[11]. En contraposición, la American Joint Committee on Cancer (AJCC) implementa el sistema de estadificación TNM, que evalúa variables como el tamaño del Tumor (T), la extensión a Nódu- los linfáticos cercanos (N) y la presencia de Metástasis (M)[12]. Este método permite una evaluación exhaustiva del estado del cáncer y facilita tanto la estratificación del riesgo como la personalización del tratamiento. Es relevante subrayar que estas clasificaciones ofrecen perspectivas complementarias en el manejo clínico de los TNE. Mientras la clasificación de la ENETS y la OMS están más enfocadas en la biología tumoral, el enfoque de la AJCC es importante para determinar el estadio clínico del cáncer. Esta diversidad en metodologías es fundamental para orientar la toma de decisiones terapéuticas, permitiendo la selección del tratamiento más apropiado en función del estadio y las características biológicas del tumor.
Para los anestesiólogos, uno de los aspectos cruciales en el manejo de TNE es la diferenciación entre los tumores funcionantes y no funcionantes. Esta distinción no es meramente taxonómica, sino que tiene implicaciones clínicas profundas. Los tumores funcionantes se caracterizan por la manifestación de síntomas clínicos derivados de la hipersecreción hormonal, y su diagnóstico se confirma a través de pruebas de laboratorio que evidencian niveles elevados de sustancias relacionadas con dicha hipersecreción. Este conocimiento es de suma importancia para el anestesiólogo, ya que la presencia de un tumor funcionante podría complicar el manejo anestésico y requerir una estrategia de tratamiento más elaborada y cautelosa. En este contexto, la clasificación basada en la funcionalidad del tumor se convierte en un elemento crucial para un cuidado perioperatorio óptimo.
-
Cuadro clínico
La sintomatología del TNE funcionante va a depender de la sustancia que secrete el tumor, existiendo más de 40 productos descritos que pueden ser secretados por las células neuroendocrinas. Así, el insulinoma, que secreta insulina en exceso, se va a manifestar con hipoglicemias frecuentes, el gastrinoma, por su lado, al secretar mayor gastrina, se va a manifestar con diarreas y enfermedad ulcerosa pépticas. Por su parte, los tumores de intestino anterior, intestino delgado, pulmón y algunos pancreáticos, se van a manifestar como síndromes carcinoides, asociado a la hipersecreción de serotonina y otras sustancias[13].
-
Síndrome carcinoide
Se define al SC como el conjunto de síntomas producidos por la secreción de sustancias activas por parte de tumores neuroendocrinos, principalmente los ubicados en el intestino anterior (intestino delgado, páncreas, bronquios, colon) y que alcanzan circulación sistémica.
Los síntomas más comunes son dolor abdominal (28% a 79%), diarrea de características secretoras (10% a 32%) o “flushing” (4% a 25%). También podrían presentarse como obstrucción intestinal y/o enfermedad cardíaca carcinoide, ambas derivadas de la acción de la serotonina sobre el mesenterio y endocardio[14]. Cuando estos síntomas se asocian a desorientación, ansiedad, temblor, lagrimeo, salivación, hipotensión, asma y edema se le denomina TNE atípico y es propio de ubicaciones broncopulmonares[14].
La mayoría de las sustancias activas secretadas por los TNE son metabolizadas eficientemente a nivel hepático, lo que suele prevenir su entrada en la circulación sistémica y, en consecuencia, la manifestación de sintomatología. Sin embargo, en situaciones de metástasis hepáticas o pulmonares, estas sustancias eluden la biotransformación hepática y se liberan directamente en la circulación sistémica, desencadenando así la sintomatología clásica del SC. Añadiendo una capa de complejidad, hay escenarios, como durante la manipulación quirúrgica o la realización de biopsias, en los que se puede producir una liberación excesiva de hormonas. Este fenómeno puede sobrepasar la capacidad metabólica del hígado, conduciendo a un rápido surgimiento de manifestaciones clínicas de SC. Este mecanismo ilustra la delicada interacción entre la fisiopatología del TNE y las prácticas clínicas, subrayando la necesidad de precaución en el entorno perioperatorio.
-
Fisiopatología del SC
La hormona que más se ha relacionado con la sintomatología del SC es la serotonina. Sin embargo, también se ha descrito la participación de histamina, bradiquinina, sustancia P, prostaglandinas y taquicininas. La principal alteración ocurre a nivel de metabolismo del triptófano. En individuos sanos, solo 1% del del triptófano de la dieta se metaboliza por la vía serotoninérgica. Sin embargo, en pacientes con tumores neuroendocrinos, sobre todo en los ubicados a nivel del intestino anterior, esta vía esta exacerbada y puede alcanzar hasta 70% del metabolismo del triptófano. Esto deriva en una mayor producción de serotonina por parte de las células neuroendocrinas tumorales. Por otro lado, en tumores de ubicación pulmonar, hay una disminución de la acción de la L-amino acido aromático descarboxilasa, enzima fundamental en la vía de la biotransformación a serotonina, por lo tanto, el metabolismo del triptófano se deriva hacia la vía histaminérgica, aumentando la producción y secreción de histamina, que va a explicar los síntomas del TNE atípico[15] (Figura 1).
La serotonina, al eludir la barrera hepática y penetrar en la circulación sistémica, es la principal responsable de los síntomas emblemáticos del SC. Esta hormona intensifica la motilidad intestinal, incrementa la secreción gastrointestinal y obstaculiza la absorción en los enterocitos. La consecuencia es una diarrea voluminosa, secretora y acuosa, que puede ser acompañada por desequilibrios hidroelectrolíticos y déficits nutricionales. Adicionalmente, la serotonina estimula el proceso de fibrogénesis, que puede manifestarse como fibrosis mesentérica y, en ciertos casos, evolucionar hacia una obstrucción intestinal.
En el plano cardiovascular, la serotonina favorece la formación de fibrosis y enfermedad valvular, en particular en el corazón derecho, un fenómeno denominado «corazón carcinoide». Este sesgo hacia la afectación de la válvula tricúspide se debe a la metabolización de la serotonina por enzimas localizadas en la arteria pulmonar, lo que impide su circulación hacia el corazón izquierdo. Aunque este síndrome puede manifestarse como insuficiencia cardíaca derecha, es más habitual que se mantenga asintomático, pese al daño valvular subyacente. Es notable que el empleo temprano de análogos de somatostatina ha disminuido la incidencia de corazón carcinoide de 50% a 20%, y en la gran mayoría de estos casos, los síntomas clínicos son ausentes[14].
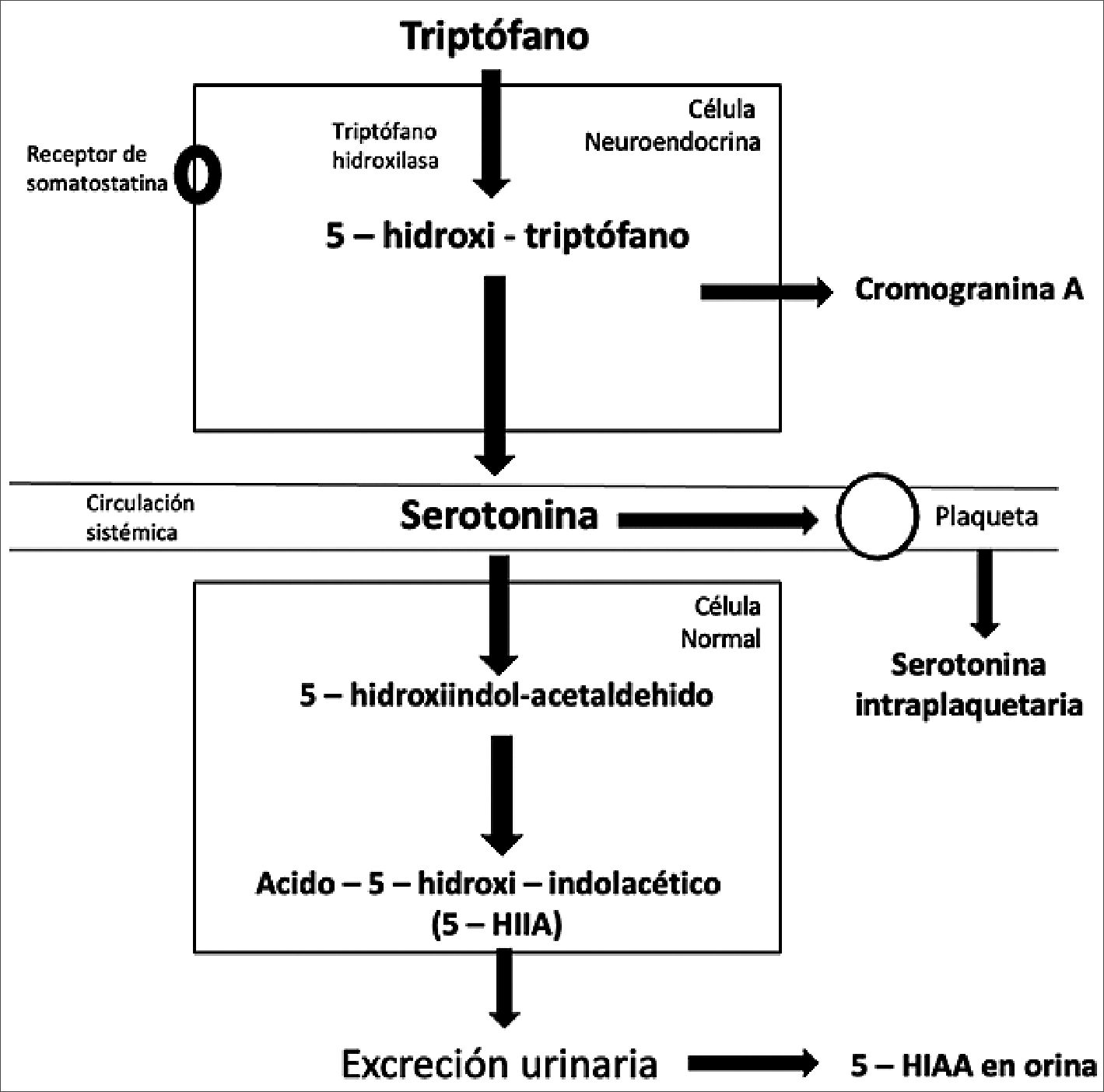
Figura 1. Metabolismo del triptófano en la célula neuroendocrina y biomarcadores de TNE. Adaptado de Carrillo et al.[16], con autorización del autor.
Por otra parte, la liberación de histamina por parte de los TNE puede expresarse en forma de broncoespasmos y vasodilatación sistémica, dando lugar al rubor facial y la hipotensión observados en estos pacientes. La bradicinina, derivada de la acción de la proteasa calicreína, también tiene implicaciones en el SC. Cuando el sistema de biotransformación hepática alcanza su límite, la bradicinina produce efectos amplificados y prolongados, induciendo una relajación intensa de la musculatura lisa. Esto se manifiesta como hipotensión severa y «flushing», mediados por un aumento en la producción de óxido nítrico, un mecanismo que también podría estar vinculado al broncoespasmo.
Ya que el principal péptido relacionado con las manifestaciones clínica del SC es la serotonina, se han utilizados análogos de somatostatina (aSST) como medida para el control de los síntomas y para el control del crecimiento tumoral[15]. Esto se debe a la capacidad de los aSST para bloquear la acción de la enzima triptófano hidroxilasa en las células neuroendocrinas, lo que no permite degradar el triptófano y, de esta manera, no producir serotonina. El aSSt más conocido es el octreotide, un octapeptido sintético que actúa en los receptores de somatostatina de las células neuroendocrinas, inhibiendo la liberación
de hormonas y, además, reduciendo el flujo sanguíneo esplácnico y hepático, lo que disminuiría aún más la captación y difusión de la serotonina a nivel sistémico. El 80% de los TNE bien diferenciados expresan recetores de somatostatina en su superficie celular, lo cual avala su uso en esta población especifica.
-
Crisis carcinoide
No hay consenso en la comunidad médica respecto a la definición más precisa para la crisis carcinoide (CC): “un evento infrecuente pero potencialmente fatal caracterizado por un inicio abrupto de inestabilidad hemodinámica”. Esta condición puede manifestarse con características del síndrome carcinoide, aunque no necesariamente se presenten en todos los casos[15]. Dada la falta de una definición estandarizada, la incidencia de la CC varía significativamente entre diferentes estudios, lo cual es atribuible en gran medida a las definiciones divergentes empleadas por distintos grupos de investigación. El mecanismo etiológico subyacente aún no se comprende completamente. Es relevante señalar que la CC puede manifestarse tanto en procedimientos invasivos (como cirugía, biopsia o manipulaciones) como en intervenciones no invasivas (anestesia, infusión de radiotrazadores). Esta falta de consenso en la definición ha llevado a que la incidencia reportada fluctúe dramáticamente, desde 3% hasta 50%, dependiendo casi exclusivamente de los criterios diagnósticos empleados por cada equipo de investigación. Kinney et al.[17], define la crisis carcinoide como una hipotensión severa, definido por presión arterial sistólicas de menos de 80 mmHg de más de 10 minutos de duración, o una frecuencia cardíaca de más de 120 latidos por minuto, asociado a características del síndrome carcinoide como lo son la urticaria, el rubor, broncoespasmo o acidosis, encontrando una incidencia de 6,7%. Massimino et al.[18], mantienen las características de inestabilidad hemodinámica por más de 10 minutos, sin asociarle características del SC, por lo que la incidencia sube a 24% de los casos. Por otro lado, cuando la definición incluye solo el concepto de inestabilidad hemodinámica, no estableciendo un tiempo mínimo de duración, ni las características del SC, la incidencia sube a 30% a 50% de los casos[19],[20].
En resumen, es imperativo destacar que la variación de la presión arterial emerge como el parámetro más frecuentemente citado y considerado crítico para la identificación de una crisis carcinoide. Añadiendo complejidad a este fenómeno, los desencadenantes para la crisis carcinoide son multifactoriales y no limitados a una localización tumoral específica. En efecto, estos episodios críticos suelen manifestarse en tumores situados tanto en el intestino anterior como en el intestino medio[15].
La falta en la comprensión de la fisiopatología de la CC ha impedido elegir una estrategia de profilaxis y tratamientos adecuadas. Existen varias teorías al respecto, la más difundida y aceptada es que estas crisis corresponderían a una forma grave del SC, y que los mecanismos relacionados serían una liberación masiva de sustancias humorales por parte de las células de este tumor, que van a generar una hipotensión sistémica generalizada, explicando las variaciones de la presión arterial. Es posible que se produzca una intensa vasoconstricción de la arteria pulmonar, llevando a una disminución drástica del gasto cardíaco y una subsiguiente caída de la presión arterial. Además, en ciertas circunstancias, podría ocurrir una vasoconstricción coronaria, induciendo una isquemia miocárdica que se manifestará como insuficiencia cardíaca acompañada de hipotensión[21].
Para intentar explicar la fisiopatología de las CC, Condron et al.[21], desarrolló un trabajo prospectivo, donde seleccionaron pacientes con TNE del intestino delgado, con metástasis hepáticas, y que iban a ser sometidos a cirugía abdominal electiva. En este estudio 70% de los pacientes tenían sintomatología atribuible al SC y todos estaban en tratamiento con octreotide preoperatorio para control de su sintomatología. A todos los casos se les midió parámetros ecocardiográficos mediante un ecógrafo transesofágico, parámetros hemodinámicos por medio de un catéter de arteria pulmonar, y además se les realizó un perfil hormonal de las sustancias más comúnmente relacionadas con el síndrome carcinoide (bradiquinina, histamina, serotonina, calicreína). Definieron crisis intraoperatoria como una inestabilidad hemodinámica no atribuible a otros factores (como compresión de la cava o sangrado) y que debía ser consensuada entre el anestesiólogo y el cirujano. La incidencia encontrada de CC fue de 35%. A todos ellos se les midieron los parámetros en 3 momentos: previo a la incisión, durante la crisis, y en el momento del cierre quirúrgico. Los parámetros ecocardiográficos se mantuvieron siempre constantes, sin diferencias en ninguno de los 3 momentos. Respecto a los parámetros hemodinámicos se logró detectar una caída de la presión arterial media, presión de arteria pulmonar y de la resistencia vascular sistémica entre el momento de la crisis con respecto al estado previo a la incisión. Sin embargo, estos valores se recuperaban al momento del cierre. Lo más llamativo fue la ausencia del peak de hormonas en medio de la crisis, como se tenía pensado, solo se observa una serotoninemia más elevada al momento previo a la CC. Este grupo concluyo que, si bien las crisis son muy frecuentes en pacientes con tumores neu- roendocrinos asociados a síntomas y metástasis hepáticas, el comportamiento de la CC es similar a un shock distributivo, sin relación alguna con un aumento de la liberación hormonal, por lo que el octeotride no tendría ningún un rol en la prevención y manejo de las crisis. Como única estrategia, se recomienda un reconocimiento precoz de esta crisis y un rápido manejo de ella con los fluidos y fármacos que se estimen necesarias. A pesar de estos hallazgos, la European Neurondocrine Tumor Society (ENETS)[22], la North American Neuroendocrine Tumor Society (NANETS)[23] y la UK and Ireland Neuroendocrine Tumor Society (UKINETS)[24] siguen recomendando la profilaxis y terapia del manejo de la CC con octeotride.
En un reciente metaanálisis que examinó 943 cirugías en 864 pacientes[25], se constató que las CC son notablemente frecuentes en pacientes con TNE de origen gastroenteropancreático (GEP), con una incidencia del 20%. Este estudio también subraya que la presencia de metástasis hepáticas aumenta de manera significativa el riesgo de desarrollar una CC. Contrariamente, ni la presencia del SC, ni el fenómeno del «corazón carcinoide,» ni el uso de análogos de somatostatina, influyeron en el riesgo de desarrollo de CC. Estos datos ponen en tela de juicio la eficacia del octreotide como una intervención profiláctica universal para pacientes que van a ser sometidos a cirugía en el contexto de un TNE. Reforzando esta perspectiva, un estudio desarrollado en 2022 que involucró a 195 pacientes sometidos a cirugía de TNE sin previa preparación con octreotide, encontró tasas similares de CC entre los pacientes que recibieron octreotide y los que no. Este hallazgo sugiere que la omisión del octreotide no incrementa ni la incidencia ni la duración de las CC en comparación con estudios donde se utilizó como medida profiláctica habitual[26] (Tabla 2).
| Tabla 2. Esquemas de profilaxis de crisis carcinoide con distintos esquemas de octeotride, bolo o infusión endovenosa |
| 100 mcg de octeotride endovenoso en el momento de la inducción |
| Octeotride 12,5 mcg/h endovenoso, 8 -12 h preoperatoria, hasta 12 – 24 h posoperatorias (250 mi SF 0,9% + 300 mcg Octeotride , iniciar a 10 ml/h) |
| Octeotride 25 mcg/h endovenoso, 24 h preoperatorias, hasta 24-48 h posoperatorias (250 mi SF 0,9% + 600 mcg Octeotride, iniciar a 10 ml/h) |
| Octeotride 50 mcg/h endovenoso, 24 h preoperatorias, hasta 72 h posoperatorias. (250 mi SF 0,9% + 1.200 mcg Octeotride, iniciar a 10 ml/h) |
| En caso de aparecer signos de síndrome carcinoide: bolo de 100 mcg o aumentar velocidad de infusión |
| Adaptado de UKINETS[24]. |
Con estos antecedentes podemos concluir que la CC es una
manifestación aguda, grave y potencialmente mortal de los TNE. La mayoría de la información disponible deriva de pequeños estudios retrospectivos o reporte de casos. Por otro lado, la clínica y las definiciones no son estandarizadas. El mecanismo fisiopatológico está en cuestionamiento, sin embargo, podemos asegurar que la CC es una entidad distinta al SC. A pesar de esta información, las guías europeas, americanas e inglesas siguen recomendando el octreotide para la prevención y manejo de la CC, aunque sin definir el esquema estándar, la duración ni la especificación de la dosis.
El uso de vasopresores en el tratamiento de las CC ha sido objeto de debate durante años, en gran parte debido a la investigación realizadas por Masson en 1966[27]. En dicho estudio, se observó que la administración de epinefrina a pacientes en medio de una CC resultaba en un deterioro de la hemodinamia, manifestada por una disminución de la presión arterial sistólica y de la resistencia vascular sistémica. Este empeoramiento se asoció con un aumento en los niveles de bradiquininas. La hipótesis planteada fue que la estimulación adrenérgica beta inducida por los simpaticomiméticos desencadenaba una liberación adicional de péptidos desde el tumor, complicando aún más el cuadro clínico. Sin embargo, en 2019, Limbach et al.[28], realizaron un estudio retrospectivo donde se intentó relacionar el uso de simpaticomiméticos y el desarrollo de CC, no encontrando correlación alguna entre ambos, concluyendo que los agonistas beta se pueden usar de manera segura para el manejo de la CC. Ante esta información, planteamos que la CC corresponde a un shock de características distributivas, y que el uso de vasoconstrictores y de beta adrenérgicos es parte del manejo global de la hipotensión, junto con el uso de la vasopresina y de los fluidos. Queda mucho por aprender sobre el tratamiento de la crisis carcinoide, sin embargo, debemos estar preparados para reconocerla y tratarla de manera agresiva. Los estudios futuros deben orientarse en entender la fisiopatología de esta emergencia endocrina[26].
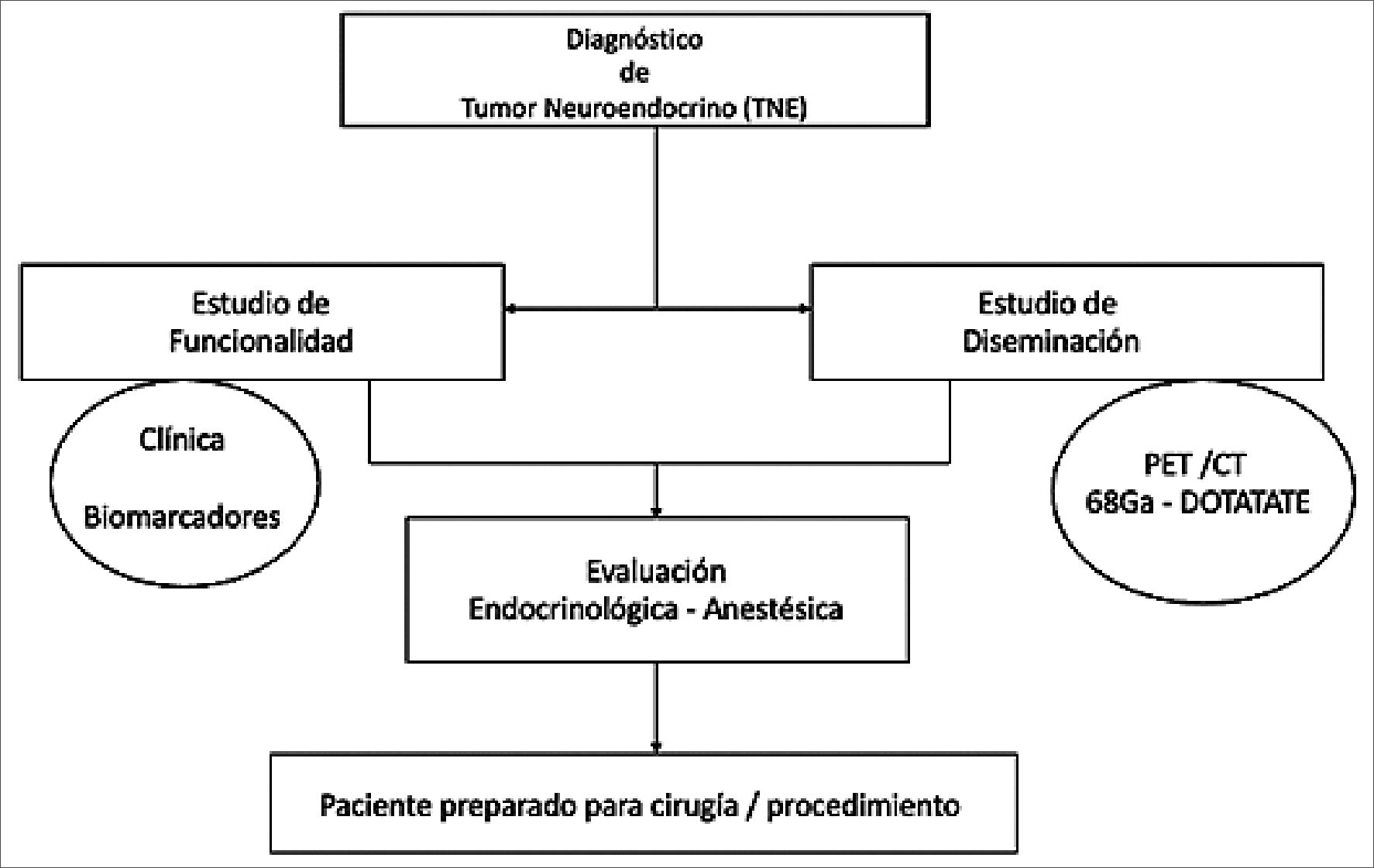
Figura 2. Algoritmo de estudio preoperatorio en el Instituto Nacional del Cáncer, para pacientes portadores de tumor neuroendocrino que va a cirugía o procedimientos bajo cuidado anestésico.
-
Propuesta de protocolo de estudio preoperatorio de tumores neuroendocrinos
Desde el año 2019, el equipo de Anestesiología del Instituto Nacional del Cáncer ha desarrollado un protocolo de estudio preoperatorio de pacientes portadores de tumores neuroendocrinos que van a cirugía, el que busca estandarizar exámenes y evaluaciones a realizar. Fue desarrollado entre cirujanos digestivos, anestesiólogos, miembros de la unidad prequirúrgica y endocrinólogos, a fin de recabar los mayores antecedentes clínicos y de laboratorio, y de esa manera intentar predecir el riesgo de crisis carcinoide y el beneficio de la profilaxis farmacológica, es decir, que llegue en las mejores condiciones clínicas a su cirugía y preparar al equipo para aquello. Como puntos específicos, intenta evaluar la presencia de síndrome carcinoide clínico, determinar la funcionalidad del tumor y la presencia de metástasis linfáticas y a distancias, datos que nos permitirán controlar parte de la sintomatología con análogos de somatostatina, si es que la presenta, y nos orientara al eventual riesgo de desarrollar una crisis carcinoide intraoperatoria (Figura 2).
El protocolo se activa al recibir pacientes con diagnóstico de TNE que serán sometidos a intervenciones quirúrgicas. Este proceso es coordinado por la Unidad Pre-Quirúrgica, subordinada a la Unidad de Anestesia. En esta etapa, se efectúan evaluaciones de diseminación para identificar posibles metástasis y se evalúa la funcionalidad para determinar la presencia del síndrome carcinoide. Actualmente, a todos los pacientes con TNE se les solicita un estudio de diseminación, que puede consistir en una tomografía computarizada, resonancia magnética para localizar lesiones hepáticas específicas, o un estudio funcional mediante PET/CT con Galio-68-DOTATATE). Este último método permite detectar células neuroendocrinas bien diferenciadas que expresen receptores de somatostatina en su superficie, tanto en el sitio tumoral original como en localizaciones secundarias. Para tumores neuroendocrinos mal diferenciados o en estados más avanzados, el PET con 68Ga-DOTATATE pierde sensibilidad. En tales circunstancias, el estudio de elección para detectar metástasis es el PET/CT con 18-flúor-deoxi-glucosa, apto para marcar células tumorales que no expresen receptores de somatostatina. Esta fase del estudio peroperatorio es crucial para identificar metástasis hepáticas y distantes, factores que se han establecido como riesgos asociados al desarrollo de CC.
Para evaluar la funcionalidad de un TNE, la primera etapa implica una evaluación clínica preoperatoria focalizada en la detección de sintomatología del SC. A esta evaluación se añade el análisis de biomarcadores específicos relacionados con la hiper- secreción tumoral, tales como Cromogranina A (CgA) y ácido 5-hidroxi-indol-acético (5-HIAA).
En términos de sintomatología asociada a la hipersecreción tumoral de serotonina y otros péptidos, los síntomas más comunes incluyen dolor abdominal, generalmente acompañado de diarrea voluminosa y acuosa. Este cuadro podría complicarse con síndromes carenciales y/o trastornos hidroelectrolíticos. Otro síntoma frecuente es el «flushing», o enrojecimiento paro- xístico de la cara, cuello y tórax anterior, que ocurre sin un factor desencadenante identificable y remite espontáneamente. Además, el efecto de masa tumoral podría manifestarse como obstrucción intestinal, hemorragia digestiva debido a sangrado submucoso o síntomas respiratorios como tos crónica o infecciones recurrentes, particularmente si el tumor se localiza en el pulmón.
Con respecto a los biomarcadores, el 5-HIAA se considera más relevante que la CgA para evaluar la funcionalidad del TNE. La CgA es una proteína comúnmente presente en los gránulos de las células neuroendocrinas y, aunque es útil para el diagnóstico de tumores no funcionantes, tiene una sensibilidad moderada y escasa especificidad. Por tanto, se emplea principalmente para diagnóstico y seguimiento, pero no como un marcador fiable de funcionalidad tumoral. En cambio, el 5-HIAA, un subproducto de la degradación de la serotonina intraplaquetaria, es altamente específico para tumores carcinoides. A pesar de su sensibilidad variable (35% a 75%), este biomarcador se correlaciona adecuadamente con la presencia de SC y debería solicitarse en caso de sospecha de este síndrome, especialmente en TNEs del intestino anterior. En el Registro Chileno de TNE, se logró establecer una asociación entre niveles elevados de 5-HIAA y la presencia de síndrome carcinoide. Esta correlación no se observó con niveles elevados de Cg A, que no permitieron discernir diferencias en cuanto a la funcionalidad del tumor[8].
Con los resultados de estas evaluaciones (clínica, funcionalidad y presencia de metástasis), el caso se analiza en colaboración con el departamento de endocrinología para determinar la necesidad de preparación o profilaxis de crisis carcinoide mediante el uso de octreótide. No hay consenso al respecto; diferentes grupos o sociedades médicas que han elaborado directrices para el manejo del síndrome carcinoide y las crisis carcinoides sugieren enfoques variados. Estos van desde la abstención de administrar medicamentos, hasta bolos únicos durante la inducción anestésica, o regímenes endovenosos continuos iniciados días antes de la cirugía y mantenidos durante el período posoperatorio. Dada la falta de recomendaciones unívocas, la valoración de cada paciente debe realizarse de forma individualizada y discutirse en un entorno multidisciplinario.
Aunque este protocolo busca ayudar a identificar factores de riesgo para el desarrollo de una crisis carcinoide, es fundamental considerar a todo paciente con diagnóstico de TNE que se someterá a cirugía o cualquier otro procedimiento invasivo, como un paciente en riesgo de desarrollar una crisis carcinoide intraoperatoria. Por lo tanto, es esencial tener una definición clara y consensuada de lo que constituye una crisis hemodinámica entre el equipo quirúrgico y anestésico. Se debe iniciar de manera temprana el uso de medicamentos para restablecer la estabilidad hemodinámica e intentar minimizar la duración de la crisis, un factor que se considera significativo para el resultado posoperatorio. Para este propósito, se dispone de todo el arsenal terapéutico habitual para el manejo de crisis, incluidos los simpaticomiméticos y el octreótide.
Financiamiento: No.
Conflictos de interés: No.
-
Conclusión
La instauración de un protocolo de estudio preoperatorio reviste una importancia capital, ya que permite estandarizar evaluaciones y requerimientos que faciliten abordar con máxima seguridad una cirugía oncológica de alta complejidad. Contar con un marco protocolizado, fundamentado en la mejor evidencia científica disponible, no es un lujo sino una necesidad imperante. Futuros estudios deben persistir en la indagación de las causas y mecanismos que precipitan una crisis carcinoide, con el objetivo de esclarecer los intrincados procesos fisiopatológicos involucrados. Al hacerlo, podremos idear estrategias terapéuticas precisas que no solo mitiguen la severidad de la emergencia, sino que también tengan el potencial de prevenir su desarrollo. Este es un horizonte investigativo de suma relevancia, cuyo impacto en la atención clínica y los resultados quirúrgicos podría ser transformador.
-
Referencias
1. Brenner DR, Poirier A, Woods RR, Ellison LF, Billette JM, Demers AA, et al.; Canadian Cancer Statistics Advisory Committee. Projected estimates of cancer in Canada in 2022. CMAJ. 2022 May;194(17):E601–7. https://doi.org/10.1503/cmaj.212097 PMID:35500919
2. Canadian Cancer Society. The Neuroendocrine system [Internet]. 2023;Available from: https://cancer.ca/en/cancer-information/cancer-types/neuroendocrine-tumours/what-are-neuroendocrine-tumours/the-neuroendocrine-system
3. Lubrasch O. Ueber den primaren Krebs des Ileum, nebst Bemerkungen uber das gleichzeitie Vorkommen von Krebs und Tuberkolose. Virchows Arch. 1888;111(2):280–317. https://doi.org/10.1007/BF01966242.
4. Oberndorfer S. Karzinoide Tumoren des Dünndarms. Frankf Z Pathol. 1907;1:425–32.
5. Fraenkel M, Kim MK, Faggiano A, Valk GD. Epidemiology of gastroenteropancreatic neuroendocrine tumours. Best Pract Res Clin Gastroenterol. 2012 Dec;26(6):691–703. https://doi.org/10.1016/j.bpg.2013.01.006 PMID:23582913
6. Yao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008 Jun;26(18):3063–72. https://doi.org/10.1200/JCO.2007.15.4377 PMID:18565894
7. Vinik AI, Silva MP, Woltering EA, Go VL, Warner R, Caplin M. Biochemical testing for neuroendocrine tumors. Pancreas. 2009 Nov;38(8):876–89. https://doi.org/10.1097/MPA.0b013e3181bc0e77 PMID:19855234
8. Pinto MP, Muñoz Medel M, Carrillo D, Retamal IN, Bravo ML, Valenzuela Y, et al. Chilean Registry for Neuroendocrine Tumors: A Latin American Perspective. Horm Cancer. 2019 Feb;10(1):3–10. https://doi.org/10.1007/s12672-018-0354-5 PMID:30465145
9. García-Carbonero R, Vilardell F, Jiménez-Fonseca P, González-Campora R, González E, Cuatrecasas M, et al.; Spanish Society of Pathology; Spanish Society of Medical Oncology. Guidelines for biomarker testing in gastroenteropancreatic neuroendocrine neoplasms: a national consensus of the Spanish Society of Pathology and the Spanish Society of Medical Oncology. Clin Transl Oncol. 2014 Mar;16(3):243–56. https://doi.org/10.1007/s12094-013-1062-9 PMID:23749327
10. Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol. 1982 Dec;5(6):649–55. https://doi.org/10.1097/00000421-198212000-00014 PMID:7165009
11. Lloyd RV. ORKGRJ. WHO Classification of Tumours of Endocrine Organs. 4th ed. Lyon, France: IARC; 2017.
12. Klöppel G, Rindi G, Perren A, Komminoth P, Klimstra DS. The ENETS and AJCC/UICC TNM classifications of the neuroendocrine tumors of the gastrointestinal tract and the pancreas: a statement. Virchows Arch. 2010 Jun;456(6):595–7. https://doi.org/10.1007/s00428-010-0924-6 PMID:20422210
13. Raphael MJ, Chan DL, Law C, Singh S. Principles of diagnosis and management of neuroendocrine tumours. CMAJ. 2017 Mar;189(10):E398–404. https://doi.org/10.1503/cmaj.160771 PMID:28385820
14. LEY No 20.850 – MINISTERIO DE SALUD 2019. Tratamiento con sunitinib o everolimus para personas con enfermedad progresiva de tumores neuroendocrinos pancreáticos. Para el Otorgamiento de las Prestaciones que cuentan con el Sistema de Protección Financiera para Diagnósticos y Tratamientos de Alto.
15. Bardasi C, Benatti S, Luppi G, Garajovà I, Piacentini F, Dominici M, et al. Carcinoid Crisis: A Misunderstood and Unrecognized Oncological Emergency. Cancers (Basel). 2022 Jan;14(3):662. https://doi.org/10.3390/cancers14030662 PMID:35158931
16. Carrillo D, Muñoz-Medel M, Retamal I, Pinto M, Bravo ML, Nervi B, et al. Tumores Neuroendocrinos: un desafío transversal. Rev Med Chil. 2021 Jun;149(6):888–98. https://doi.org/10.4067/s0034-98872021000600888 PMID:34751348
17. Kinney MA, Warner ME, Nagorney DM, Rubin J, Schroeder DR, Maxson PM, et al. Perianaesthetic risks and outcomes of abdominal surgery for metastatic carcinoid tumours. Br J Anaesth. 2001 Sep;87(3):447–52. https://doi.org/10.1093/bja/87.3.447 PMID:11517130
18. Massimino K, Harrskog O, Pommier S, Pommier R. Octreotide LAR and bolus octreotide are insufficient for preventing intraoperative complications in carcinoid patients. J Surg Oncol. 2013 Jun;107(8):842–6. https://doi.org/10.1002/jso.23323 PMID:23592524
19. Condron ME, Pommier SJ, Pommier RF. Continuous infusion of octreotide combined with perioperative octreotide bolus does not prevent intraoperative carcinoid crisis. Surgery. 2016 Jan;159(1):358–65. https://doi.org/10.1016/j.surg.2015.05.036 PMID:26603846
20. Fouché M, Bouffard Y, Le Goff MC, Prothet J, Malavieille F, Sagnard P, et al. Intraoperative carcinoid syndrome during small-bowel neuroendocrine tumour surgery. Endocr Connect. 2018 Dec;7(12):1245–50. https://doi.org/10.1530/EC-18-0324 PMID:30352418
21. Condron ME, Jameson NE, Limbach KE, Bingham AE, Sera VA, Anderson RB, et al. A prospective study of the pathophysiology of carcinoid crisis. Surgery. 2019 Jan;165(1):158–65. https://doi.org/10.1016/j.surg.2018.04.093 PMID:30415870
22. Kaltsas G, Caplin M, Davies P, Ferone D, Garcia-Carbonero R, Grozinsky-Glasberg S, et al.; Antibes Consensus Conference participants. ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: Pre- and Perioperative Therapy in Patients with Neuroendocrine Tumors. Neuroendocrinology. 2017;105(3):245–54. https://doi.org/10.1159/000461583 PMID:28253514
23. Kunz PL, Reidy-Lagunes D, Anthony LB, Bertino EM, Brendtro K, Chan JA, et al.; North American Neuroendocrine Tumor Society. Consensus guidelines for the management and treatment of neuroendocrine tumors. Pancreas. 2013 May;42(4):557–77. https://doi.org/10.1097/MPA.0b013e31828e34a4 PMID:23591432
24. Peri-operative management of patients with neuroendocrine tumours. [Internet]. 2023. Available from: https://www.ukinets.org/net-clinics-clinical-practice/
25. Xu A, Suz P, Reljic T, Are AC, Kumar A, Powers B, et al. Perioperative Carcinoid Crisis: A Systematic Review and Meta-Analysis. Cancers (Basel). 2022 Jun;14(12):2966. https://doi.org/10.3390/cancers14122966 PMID:35740631
26. Wonn SM, Pommier RF. Carcinoid Syndrome and Carcinoid Crisis. Endocrine Emergencies. Elsevier; 2022. pp. 201–12. https://doi.org/10.1016/B978-0-323-76097-3.00017-X.
27. Mason DT, Melmon KL. New understanding of the mechanism of the carcinoid flush. Ann Intern Med. 1966 Dec;65(6):1334–9. https://doi.org/10.7326/0003-4819-65-6-1334 PMID:5333235
28. Limbach KE, Condron ME, Bingham AE, Pommier SJ, Pommier RF. Β-Adrenergic agonist administration is not associated with secondary carcinoid crisis in patients with carcinoid tumor. Am J Surg. 2019 May;217(5):932–6. https://doi.org/10.1016/j.amjsurg.2018.12.070 PMID:30635207

 ORCID
ORCID