Angela Parra Palma1,2, Claudio Nicolás Valencia Parada1,2,*
Recibido: 28-08-2023
Aceptado: 02-09-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 8 pp. 742-748|https://doi.org/10.25237/revchilanestv52n8-08
PDF|ePub|RIS
Challenges in the perioperative analgesic management of cancer patients using opioids
Abstract
Opioid-users cancer patients are a challenge in the perioperative setting given the high prevalence of chronic pain along with multiple underlying pathologies. In addition, the anesthesiologist and the healthcare team should consider factors specific to these patients and how to prevent these patients from suffering uncontrolled pain, relying on the anaesthetist to plan a multimodal analgesia strategy with an emphasis on regional anesthesia, in addition to the adjustment and conversion of opioid doses. Mentioning pain mechanisms in cancer, understanding how to address pain, planning opioid management and other strategies for proper control of perioperative pain. A review of the literature was carried out in the databases of MEDLINE/Pubmed, Google Scholar and Science Direct. It included articles in English and Spanish, published between 2000 and 2023. To an adequate management of opioid-users cancer patients is required to know how to deal with chronic pain, its mechanisms, as well as to know managing opioids and its adverse effects.
Resumen
Los pacientes oncológicos usuarios de opioides son un desafío en el ámbito perioperatorio, dado la gran prevalencia de dolor crónico asociado a múltiples patologías de base. Además, el anestesiólogo y el equipo de salud, deben tener en cuenta factores propios de estos pacientes y cómo evitar que estos sufran de dolor descontrolado, apoyándose en el anestesiólogo para planificar una estrategia de analgesia multimodal con énfasis en la anestesia regional, además del ajuste y conversión de dosis de opioides Mencionar los mecanismos de dolor en cáncer, comprender cómo evaluar el dolor, planificar el manejo de opioides y otras estrategias para el control adecuado del dolor perioperatorio. Se realizó una revisión de la literatura en las bases de datos de MEDLINE/Pubmed, Google Scholar y Science Direct. Se incluyeron artículos en inglés y español, publicados entre 2000 y 2023. Para lograr un adecuado manejo del paciente oncológico usuario de opioides se requiere conocer cómo enfrentar el dolor crónico, sus mecanismos, además de conocer a cabalidad el manejo de opioides y sus efectos adversos.
-
Introducción
La presencia de dolor en pacientes con cáncer varía ampliamente dependiendo de numerosos factores, tales como la población estudiada, el tipo específico de cáncer, el estado de su tratamiento, entre otros.
La gran mayoría de los cánceres producen algún tipo de dolor, excepto algunos cánceres hematológicos. Se estima que la prevalencia global de dolor por cáncer es 44,5%, siendo moderado o severo en 30,6% de los casos[1]. Los opioides son el pilar en el manejo del dolor oncológico, a diferencia de otros tipos de dolor crónico[2].
La mayoría de los pacientes tendrán dolor controlado o tolerable con el uso de opioides, sin embargo, se estima que existe entre 10% a 20% de los pacientes con pobre respuesta a tratamiento, o en los cuales los efectos adversos son particularmente problemáticos, y que requerirán manejo intervencional del dolor[3]. Es en este subgrupo donde el anestesiólogo juega un rol fundamental en apoyar el trabajo de los equipos de cuidados paliativos. Este tema será abordado en una siguiente revisión.
En el contexto perioperatorio nos podremos ver enfrentados a este tipo de pacientes cuando son sometidos a alguna intervención quirúrgica, ya sea relacionada con el cáncer (las que suelen ser bastante invasivas), así como cirugías mayores o menores no relacionadas, lo que puede exacerbar su dolor basal. Lamentablemente, existen pocos estudios que orienten de forma práctica al anestesiólogo sobre el manejo de éstos pacientes. El dolor no controlado puede causar un sufrimiento innecesario, puede tener impacto en la calidad de vida e interferir con las actividades de la vida diaria, incluso afectando funciones básicas como el desplazamiento y el sueño. El dolor no controlado puede además disminuir la habilidad de hacer frente a la enfermedad e interrumpir el curso del tratamiento[4]. Por esta razón, es importante realizar una correcta evaluación y estrategia para el manejo analgésico de estos pacientes.
El objetivo de la siguiente revisión es orientar sobre las principales consideraciones en la evaluación y manejo del dolor perioperatorio de pacientes oncológicos usuarios de opioides, con la finalidad de ofrecer una analgesia efectiva a este grupo de pacientes.
-
Métodos
Se realizó una revisión de la literatura en las bases de datos de MEDLINE/Pubmed, Google Scholar y Science direct, se utilizaron los términos MESH “Chronic pain”, “Cancer pain”, “opioids”, “postoperative pain”. Se incluyeron artículos en inglés y español, publicados entre 2000 y 2023.
-
Evaluación clínica del dolor en el paciente con cáncer
Una evaluación integral y la compresión del dolor son esenciales para comenzar nuestro abordaje. Se debe considerar si el dolor está relacionado con el cáncer subyacente, la intervención y/o las complicaciones del tratamiento[4].
La aproximación inicial es similar a cualquier otro tipo de dolor crónico, realizando una evaluación integral del dolor, tratando de caracterizar la intensidad del dolor con las distintas escalas existentes (EVA, numérica, verbal), localización, tipo de dolor (opresivo, sordo, sensación punzante, como “agujas/ alfileres», corriente eléctrica, etc), irradiación, perfil temporal, agravantes, atenuantes, dolor incidental, etc.[5]. Además, se debe evaluar la presencia de otros síntomas asociados, tales como parestesias, hipoestesias, paresias, entre otros. Existen herramientas disponibles para ayudarnos a caracterizar el dolor por cáncer, evaluar su severidad e impacto en la calidad de vida, tales como The Brief Pain Inventory (BPI), The Edmond Classification, entre otros[6],[7],[8].
Es importante además reconocer síntomas de la esfera psicosocial, tales como ansiedad, estrés, síntomas depresivos o psicóticos, que también influyen en la expresión del dolor[9]. Considerar que a diferencia del dolor agudo, el dolor crónico puede no manifestarse con signos adrenérgicos, y la expresión facial del paciente puede parecer neutra a pesar de estar sufriendo dolor muy severo. Finalmente, debemos tratar de definir si el dolor es neuropatico, nociceptivo y/o nociplástico, además diferenciar si se trata de dolor visceral y/o somático. Esto nos guiará a grandes rangos para proponer diversas alternativas de tratamiento.
En cuanto al dolor visceral, cabe recordar que la mayoría de las vías aferentes viajan a través del sistema nervioso autónomo, específicamente las fibras C de dolor que viajan a la médula espinal a través de fibras simpáticas y nervios esplácnicos, las cuales presentan gran entrecruzamiento neuronal, y entran a la médula espinal a niveles distantes del punto de origen de dolor. Esto genera además el fenómeno de dolor referido, lo que aumenta la dificultad para localizar y describir el dolor visceral. Normalmente, el dolor visceral se describe como difuso, sordo e intermitente, además de estar asociado a un fuerte componente emocional[10].
El paciente con cáncer frecuentemente experimenta dolor neuropático, originado por lesión o disfunción del sistema nervioso central o periférico, el que se debe a compresión o infiltración tumoral, isquemia, alteraciones metabólicas, postquimioterapia o posquirúrgico[11],[12]. Normalmente, es descrito como dolor quemante, eléctrico o “como agujas y alfileres”, y habitualmente se asocia a parestesias, hipoestesias y/o alodinia. Existen escalas para caracterizar e identificar el dolor neuropá- tico, tales como el DN4[13], PainDETECT[14], LANSS[15], entre otros.
Además, se debe considerar que el paciente con cáncer probablemente presenta otros dolores frecuentes en la población general, tales como lumbago, cervicalgia, artrosis, intestino irritable, entre otros[16] (Figura 1).
-
Manejo de opioides perioperatorio en usuarios crónicos de opioides
Los pacientes oncológicos con dolor crónico utilizan con mayor frecuencia opioides vía oral. Después de la cirugía, ocasionalmente se requerirá que los pacientes modifiquen el opioide o que cambien la vía de administración. Para planificar las dosis de opioides perioperatorios, lo primero que debemos hacer es objetivar su consumo basal, y para ello debemos calcular los equivalentes de morfina diarios vía oral (EDM) que el paciente utiliza en su domicilio. Para esto se debe multiplicar la dosis diaria de cada opioide por su factor de conversión (Tabla 1). Se debe tener en consideración que éstas corresponden a dosis equianalgésicas estimadas, dada la variabilidad genética y fármacocinética de los pacientes.
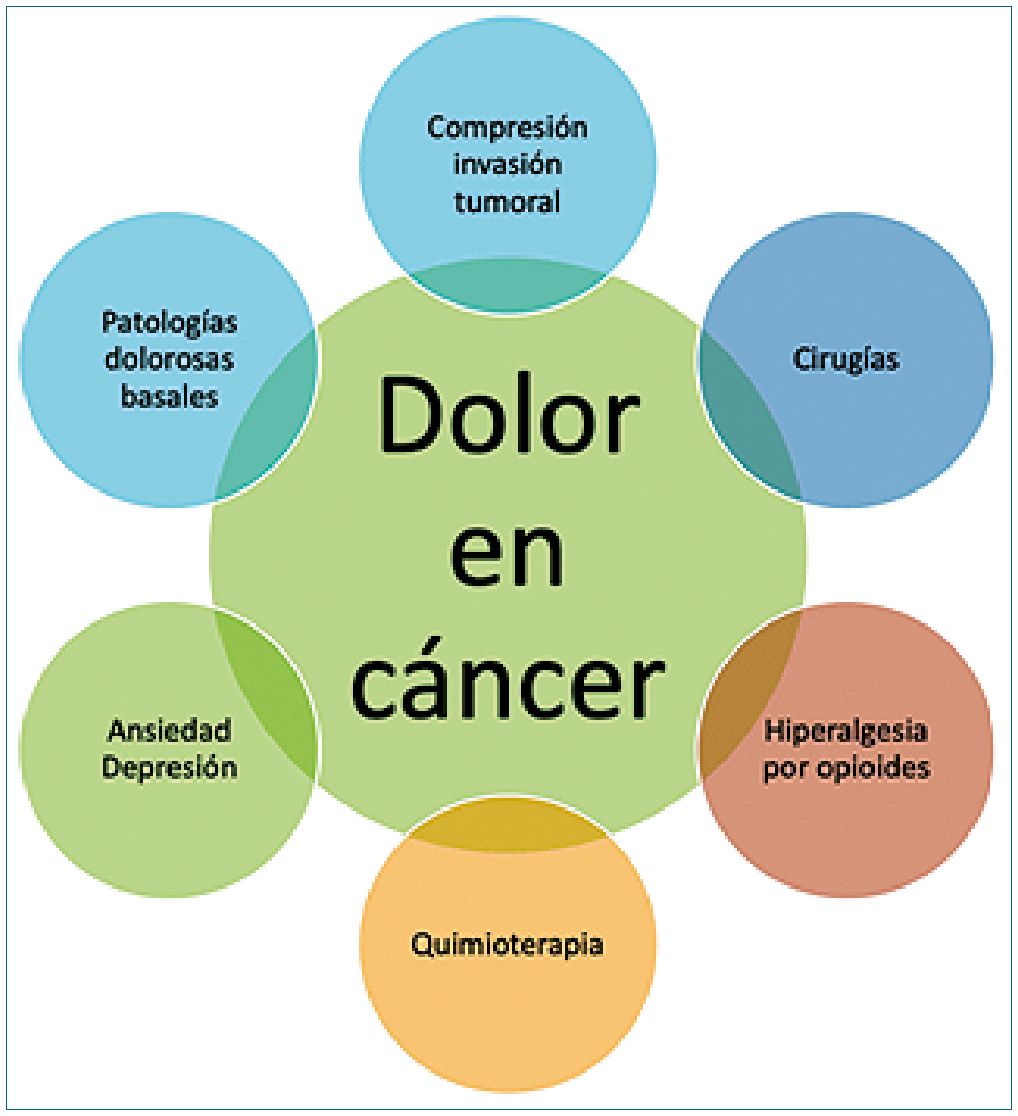
Figura 1. Dolor en paciente con cáncer.
Tabla 1. Conversión a Equivalentes diarios de Morfina oral (EDM)[27],[28]
| Opioide en uso | Para convertir a Equivalente de Morfina oral, multiplicar por: | Para convertir desde Morfina oral, multiplicar por: |
| (mg/día) | ||
| Buprenorfina (ug/h) | 5 ug/h = 9-14 mg EDM/d
10 ug/h = 18-28 mg EDM/d 15 ug/h = 27-41 mg EDM/d 20 ug/h = 36-55 mg EDM/d |
|
| Codeína | 0,15 | 6,67 |
| Hidromorfina | 5 | 0,2 |
| Metadona 1-20 mg/d | 4 | 0,25 |
| Metadona 21-40 mg/d | 8 | 0,13 |
| Metadona 41-60 mg/d | 10 | 0,1 |
| Metadona > 60 mg/d | 12 | 0,08 |
| Morfina | 1 | 1 |
| Oxicodona | 1,5 | 0,67 |
| Tapentadol | 0,4 | 2,5 |
| Tramadol | 0,1-0,2 | 6 |
| Fentanyl transdérmico | 25 ug/h = 60-134 mg morfina | |
| ug/h | 37 ug/h = 135-179 mg
50 ug/h = 180 – 224 mg 62 ug/h = 225 – 269 mg 75 ug/h = 270 – 314 mg 87 ug/h = 315 – 359 mg 100 ug/h = 360 – 404 mg |
Debido a que muchas veces los pacientes quedan sin disponibilidad de la vía oral (vo), se debe calcular además las dosis equivalentes a vía parenteral. Para esto, al pasar de vía oral a subcutánea o endovenosa se debe bajar la dosis a 30%-40%[17] (dado que ahora evitaremos el primer paso hepático). Luego, si además cambiamos de molécula (ej: de morfina a metadona) se debe considerar que existe tolerancia cruzada incompleta entre distintos opioides, además de variaciones farmacocinéticas, y por lo tanto, se debe bajar la dosis en 25%-50% adicional, con el fin de evitar una sobredosis accidental[18].
Se recomienda no mezclar distintas moléculas opioides en el perioperatorio dada la dificultad de titular, de identificar al culpable en caso de reacciones adversas y de cambiar las vías de administración. Sin embargo, se podría mezclar opioides en casos especiales. Por ejemplo, cuando tenemos a un paciente con parche transdérmico de buprenorfina de larga data y queremos aportar dosis de rescate de opioide de acción corta.
-
Preoperatorio
La primera recomendación es educar al paciente y su familia respecto el plan analgésico diseñado para su caso. Un buen plan de analgesia debe ser siempre multimodal, utilizar coadyuvantes y planificar un aumento de los requerimientos analgésicos basales[19].
Luego debemos caracterizar los opioides en uso: tipo, dosis, vías de administración, duración del tratamiento, pauta de rescate, efectos secundarios, y con esto calcular los equivalentes de morfina diarios (EDM) que usa el paciente en su domicilio (Tabla 2).
Lo siguiente es instruir sobre la administración de su tratamiento habitual la misma mañana de la intervención quirúrgica, antes de la inducción de la anestesia (ya sea general, espinal o regional). Se le debe explicar al paciente cómo ingerir su opioide por vía oral con un poco de agua (morfina, oxicodona, metadona, tramadol, etc), así como mantener instalados los parches transdérmicos (fentanilo, buprenorfina), durante todo el proceso quirúrgico[20]. En caso que sean necesario retirarlos (dado que se encuentran en la zona quirúrgica), se deben calcular los EDM y reemplazar. Con respecto a los sistemas implantados de infusión continua de opioides epidurales o intratecales, se recomienda mantener durante el período perioperatorio[21]. La única excepción aplica a los pacientes recibiendo infusiones intratecales del relajante muscular baclofeno, el que se aconseja descontinuar en el perioperatorio inmediato, dado sus efectos tanto centrales como periféricos sobre el bloqueo neuromuscular e incremento de la incidencia de hipotensión y sedación excesiva[22].
En pacientes en que por alguna razón se indicó suspender su tratamiento opioide habitual, o ya sea por olvido, pueden ser tratados con los EDM administrados de forma preoperatoria, oral o parenteral, tanto en el momento de la inducción anestésica como durante el intraoperatorio[22].
Tabla 2. Opiodes no parenterales disponibles en Chile*
| Presentación | Forma farmacéutica | Concentración | Nombre comercial | |
| Morfina | Comprimidos | Comprimidos de liberación prolongada | 10 mg, 20 mg, 30 mg, 60 mg | |
| Gotas | Solución oral | 10 mg/ml, 20 mg/ml | Oramorph | |
| Oxicodona | Comprimidos | Comprimidos | 5 mg, 10 mg | Oxycontin |
| Comprimidos recubiertos de liberación prolongada | 10 mg, 20 mg, 40 mg | |||
| Combinado con Naloxona | Comprimidos recubiertos de liberación prolongada | 10 mg/5 mg, 20 mg/10 mg, 40 mg/20 mg | Targinact | |
| Fentanil | Transdérmico | Parches transdérmicos | 25 mcg/h, 50 mcg/h, 75 mcg/h | Durogesic, fentadur |
| Oral | Comprimidos | 100 mcg, 200 mcg, 400 mcg | Fentora | |
| Metadona | Comprimidos | Comprimidos | 5 mg, 10 mg | Metapad |
| Buprenorfina | Transdérmico | Parches transdérmicos | 5 mcg/h, 10 mcg/h, 35 mcg/h | Norspan, Transtec, Brugesic, Preqifin |
| Codeína | Jarabe | Solución Codeína fosfato | 60 mg/ml | Codeipar |
| Tramadol | Gotas | Solución oral | 100 mg/ml (30 gotas = 1 ml) | Tramal, tramadol |
| Comprimidos | Cápsulas | 50 mg | Tramal | |
| Comprimidos de liberación prolongada | 50 mg, 100 mg, 150 mg, 200 mg | Tramal long | ||
| Comprimidos Tramadol/Paracetamol | 37,5 mg tramadol/325 mg paracetamol | Cronus, Doloten | ||
| Comprimidos Tramadol/Diclofenaco | 25 mg tramadol/ 25 mg diclofenaco | Adorlan | ||
| Tapentadol | Comprimidos | Comprimidos | 50 mg | Palexis IR |
| Comprimidos de liberación prolongada (retard) | 50 mg, 100 mg, 150 mg | Palexis PR |
*Adaptado Diplomado de Dolor Crónico PUC, 2022, Clase Dr. David Soto.
-
Intraoperatorio
Como primera opción debemos analizar si el tipo de cirugía propuesta se podría cubrir con analgesia regional, tanto neuroaxial como periférica, dado que esta alternativa nos permitiría ahorrar significativamente en el consumo de opioides. Además, en los últimos años ha crecido el interés sobre cómo la anestesia regional y el ahorro de opioides podría alterar los outcomes oncológicos, aumentando la sobrevida libre de enfermedad, lo que incluso ha dado pie a la incipiente subespecialidad de Onco-anestesia[23].
Al momento de la inducción y la mantención de la anestesia, se debe considerar que el paciente usuario de opioides crónicos podría requerir una dosis de éstos entre 50% a 300% mayor en comparación a un paciente virgen a opioides[24].
-
Posoperatorio
El cálculo de EDM es útil para conocer los requerimientos basales de opioides y mantener un aporte más o menos equivalente durante el perioperatorio, con el fin de evitar síndrome de deprivación (Tabla 3) y dolor. Por lo tanto, sobre los requerimientos basales se agregan los requerimientos adicionales para complementar la analgesia posoperatoria. La mejor forma y más segura de titular opioides en estos pacientes es con dispositivos de analgesia controlada por el pacientes (PCA), ya que la administración no depende de la disponibilidad de un tercero que pueda administrar dosis de opioides de rescate, además evita sobredosificación gracias al lock-out programado. Además, los dispositivos PCA muestran exactamente la dosis de opioides utilizados en cierto período de tiempo, lo que nos permite re-calcular y planificar dosis de rescate que el paciente podría requerir una vez suspendida la infusión y al momento del alta. En caso de que no contemos con dispositivos PCA en nuestro centro, se recomienda indicar dosis de analgesia de rescate equivalentes a 10%-15% de EDM, los cuales se pueden indicar cada 4 h SOS para la mayoría de los opioides. Preferir opioides de liberación inmediata para evitar sobredosificación y mejorar la capacidad de titulación.
Se debe tener en consideración que cualquier procedimiento quirúrgico o anestésico que elimine el estímulo doloroso puede llevar a un efecto depresor respiratorio mediado por opioides sin oposición, resultando en somnolencia o en depresión respiratoria[25]. Por lo que, en caso que se prevea una cirugía o técnica anestésica que pudiera estar asociada a alivio sustancial del dolor de base, las dosis de opiodes administrados en el posoperatorio se debieran reducir entre 25%-50% de los valores preoperatorios, y siempre se debe asociar una monitori- zación de signos vitales estricta de éstos pacientes[22].
Una vez al alta, se debe agendar precozmente una consulta de seguimiento en policlínicos de dolor.
| Tabla 3. Síntomas de deprivación de opioides |
| Mialgias |
| Dolor neuropático |
| Sudoración |
| Diarrea |
| Insomnio |
| Nauseas/vómitos |
| Espasmos abdominales |
| Espasmos musculares |
| Fiebre |
| Irritabilidad |
-
Ejemplo práctico
Se planifica paciente con cáncer cervicouterino avanzado para una ostomia descompresiva, dado que el cáncer invade y obstruye recto. Paciente usuaria de morfina (Oramorph) 10 mg/ml gotas, tomando 10 mg cada 6 h vía oral. En este caso los EDM son 40 mg. Luego, la indicación posoperatoria debe considerar el uso basal más dosis de rescate, además de pasar a vía parenteral. Entonces la dosis basal endovenosa sería 30%- 40% del basal: 12-16 mg morfina endovenosa o subcutánea al día. La indicación para cubrir requerimientos basales sería: morfina 3-4 mg subcutáneos o endovenosos cada 6 h. Además, de dosis de rescate PCA o bolos administrados por enfermera de 2-3 mg subcutáneo (SC) o endovenoso (EV) cada 4 h SOS. La dosis de morfina son cada 4 h dado su tiempo de acción, sin embargo, se pueden dar bolos pequeños antes de este tiempo en caso de dolor no controlado. Cuando se indica un rango de dosis, este no debe tener un rango igual o mayor de 50%, es decir en la indicación se debe escribir: morfina 2-3 mg sc/ev SOS cada 4 h y no morfina 2-4 mg sc/ev SOS cada 4 h, dado el riesgo de confusión y sobredosis.
Otra situación frecuente es cuando el paciente usa parches de administración transdérmica de fentanilo. En este caso es más dificil hacer conversión dado que existe un rango de equivalencia con morfina y no un número único. Imaginemos a la misma paciente del ejemplo anterior, pero que en vez de morfina usa un parche de fentanilo de 25 mcg/h. En este caso correspondería a 60 – 134 EDM oral (Tabla 1). Al dividir la dosis total quedaría una dosis basal de 10-22 mg morfina vo cada 4 h o 3-5 mg morfina aproximadamente ev o sc cada 4 h. Sobre esta dosis basal se puede indicar una PCA o bolos administrados por enfermera. En estos casos también es útil considerar una infusión endovenosa continua de morfina para cubrir requerimientos basales, o usar la función de infusión más bolo de la PCA. Sólo en pacientes usuarios crónicos de opioides consideramos infusiones continuas de opioides para analgesia posoperatoria.
-
Uso de co-adyuvantes y otros
Los adyuvantes son de gran utilidad para disminuir la dosis total de opioides y disminuir los efectos adversos como sedación, depresión respiratoria, ileo, náuseas, vómitos, entre otros. Por lo tanto, considere siempre el uso de coadyuvantes, tales como paracetamol, AINEs, gabapentinoides (sobre todo en dolor neuropático), antidepresivos inhibidores de la recaptación duales, agonista a-2 adrenérgicos (dexmedetomidina, clonidi- na) y ketamina en casos seleccionados[25].
Al momento de indicar opioides es fundamental no olvidar prescribir además medicamentos y medidas no farmacológicas para manejar los efectos adversos frecuentes. Siempre dejar indicación de laxantes, antieméticos y antipruriginosos de rescate. Las dosis van a depender del contexto de cada paciente.
-
Conclusiones
Cada vez es más frecuente el número de pacientes con cáncer y consumo crónico de opioides que son sometidos a una intervención quirúrgica, lo que se asocia a aumento del dolor posoperatorio y de los requerimientos analgésicos.
Este grupo de pacientes son frecuentemente subtratados en el contexto perioperatorio, ya sea por desconocimiento del uso de opioides en forma crónica, miedo a la sobredosis, o no disponibilidad temporal de la vía oral de administración de su tratamiento de base. Disminuciones significativas en las dosis de opioides basales pueden llevar a un síndrome de deprivación e hiperalgesia en el período perioperatorio, lo que se vería empeorado por el dolor causado por la cirugía en sí.
Para enfrentar esta situación se sugiere que el anestesiólogo sea capaz de identificar a éstos pacientes previo a la cirugía, crear un plan de manejo óptimo y seguro de opioides durante el perioperatorio, utilizar de preferencia técnicas de anestesia regional y uso de coadyuvantes, y formular un plan colaborativo con el paciente y equipo tratante sobre cómo retornar a las dosis preoperatorias previo al alta.
Conflictos de intereses: Ninguno que declarar.
Apoyo financiero y patrocinio: Ninguno.
-
Referencias
1. Snijders RA, Brom L, Theunissen M, van den Beuken-van Everdingen MH. Update on prevalence of pain in patients with cancer 2022: A systematic literature review and meta-analysis. Cancers (Basel). 2023 Jan;15(3):591. https://doi.org/10.3390/cancers15030591 PMID:36765547
2. Reid CM, Gooberman-Hill R, Hanks GW. Opioid analgesics for cancer pain: symptom control for the living or comfort for the dying? A qualitative study to investigate the factors influencing the decision to accept morphine for pain caused by cancer. Ann Oncol. 2008 Jan;19(1):44–8. https://doi.org/10.1093/annonc/mdm462 PMID:18073222
3. Scott-Warren J, Bhaskar A. Cancer pain management: Part II: Interventional techniques. Contin Educ Anaesth Crit Care Pain. 2015;15(2):68–72. https://doi.org/10.1093/bjaceaccp/mku012.
4. Yoong J, Poon P. Principles of cancer pain management: an overview and focus on pharmacological and interventional strategies. Aust J Gen Pract. 2018 Nov;47(11):758–62. https://doi.org/10.31128/AJGP-07-18-4629 PMID:31207672
5. Kychenthal Loyola C, Vega Pérez E, Elgueta Le-Beuffe F. Consideraciones en Pacientes con Dolor Crónico Sometidos a Cirugía. Rev Cir. 2020;72(6): https://doi.org/10.35687/s2452-45492020006978.
6. Cleeland CS, Ryan KM. Pain assessment: global use of the Brief Pain Inventory. Ann Acad Med Singap. 1994 Mar;23(2):129–38. PMID:8080219
7. Kalyadina SA, Ionova TI, Ivanova MO, Uspenskaya OS, Kishtovich AV, Mendoza TR, et al. Russian Brief Pain Inventory: validation and application in cancer pain. J Pain Symptom Manage. 2008 Jan;35(1):95–102. https://doi.org/10.1016/j.jpainsymman.2007.02.042 PMID:17980999
8. Nekolaichuk CL, Fainsinger RL, Aass N, Hjermstad MJ, Knudsen AK, Klepstad P, et al.; European Palliative Care Research Collaborative (EPCRC). The Edmonton Classification System for Cancer Pain: comparison of pain classification features and pain intensity across diverse palliative care settings in eight countries. J Palliat Med. 2013 May;16(5):516–23. https://doi.org/10.1089/jpm.2012.0390 PMID:23614710
9. Meints SM, Edwards RR. Evaluating psychosocial contributions to chronic pain outcomes. Prog Neuropsychopharmacol Biol Psychiatry. 2018 Dec;87 Pt B:168–82. https://doi.org/10.1016/j.pnpbp.2018.01.017 PMID:29408484
10. Sikandar S, Dickenson AH. Visceral pain: the ins and outs, the ups and downs. Curr Opin Support Palliat Care. 2012 Mar;6(1):17–26. https://doi.org/10.1097/SPC.0b013e32834f6ec9 PMID:22246042
11. Bennett MI, Kaasa S, Barke A, Korwisi B, Rief W, Treede RD; IASP Taskforce for the Classification of Chronic Pain. The IASP classification of chronic pain for ICD-11: chronic cancer-related pain. Pain. 2019 Jan;160(1):38–44. https://doi.org/10.1097/j.pain.0000000000001363 PMID:30586069
12. Edwards HL, Mulvey MR, Bennett MI. Cancer-related neuropathic pain. Cancers (Basel). 2019 Mar;11(3):373. https://doi.org/10.3390/cancers11030373 PMID:30884837
13. Bouhassira D, Attal N, Alchaar H, Boureau F, Brochet B, Bruxelle J, et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain. 2005 Mar;114(1-2):29–36. https://doi.org/10.1016/j.pain.2004.12.010 PMID:15733628
14. Freynhagen R, Baron R, Gockel U, Tölle TR. painDETECT: a new screening questionnaire to identify neuropathic components in patients with back pain. Curr Med Res Opin. 2006 Oct;22(10):1911–20. https://doi.org/10.1185/030079906X132488 PMID:17022849
15. Bennett M. The LANSS Pain Scale: the Leeds assessment of neuropathic symptoms and signs. Pain. 2001 May;92(1-2):147–57. https://doi.org/10.1016/S0304-3959(00)00482-6 PMID:11323136
16. McCormick T, Frampton C. Assessment of acute and chronic pain. Anaesth Intensive Care Med. 2019;20(8):405–9. https://doi.org/10.1016/j.mpaic.2019.05.010.
17. Smith HS, McCleane G. OPIOIDS ISSUES. Current Therapy in Pain. Elsevier; 2009. pp. 408–21. https://doi.org/10.1016/B978-1-4160-4836-7.00055-9.
18. De Rosa A. Equianalgesia, opioid switch and opioid association in different clinical settings: a narrative review. Eur Rev. 2022;•••: https://doi.org/10.26355/eurrev_202203_28349.
19. Brill S, Ginosar Y, Davidson EM. Perioperative management of chronic pain patients with opioid dependency. Curr Opin Anaesthesiol. 2006 Jun;19(3):325–31. https://doi.org/10.1097/01.aco.0000192813.38236.99 PMID:16735818
20. Mehta V, Langford RM. Acute pain management for opioid dependent patients. Anaesthesia. 2006 Mar;61(3):269–76. https://doi.org/10.1111/j.1365-2044.2005.04503.x PMID:16480353
21. Mugabure Bujedo B, González Santos S, Tranque Bizueta I, Araujo López A, Torán García L. Manejo del dolor perioperatorio de los pacientes en tratamiento crónico con opioides. Rev. Soc. Esp. Dolor. 2009;16(5):288–97. https://doi.org/10.1016/S1134-8046(09)72038-5.
22. Rozen D, Grass GW. Perioperative and intraoperative pain and anesthetic care of the chronic pain and cancer pain patient receiving chronic opioid therapy. Pain Pract. 2005 Mar;5(1):18–32. https://doi.org/10.1111/j.1533-2500.2005.05104.x PMID:17156114
23. Thomas M. Advances in oncoanaesthesia and cancer pain. Cancer Treat Res Commun. 2021;29:100491. https://doi.org/10.1016/j.ctarc.2021.100491 PMID:34837798
24. Rapp SE, Ready BL, Nessly ML. Acute pain management in patients with prior opioid consumption: a case-controlled retrospective review. Pain. 1995 May;61(2):195–201. https://doi.org/10.1016/0304-3959(94)00168-E PMID:7659429
25. Hanks GW, Twycross RG, Lloyd JW. Unexpected complication of successful nerve block. Morphine induced respiratory depression precipitated by removal of severe pain. Anaesthesia. 1981 Jan;36(1):37–9. https://doi.org/10.1111/j.1365-2044.1981.tb08596.x PMID:6894066
26. Carroll IR, Angst MS, Clark JD. Management of perioperative pain in patients chronically consuming opioids. Reg Anesth Pain Med. 2004;29(6):576–91. https://doi.org/10.1097/00115550-200411000-00011 PMID:15635517
27. Busse JW, Craigie S, Juurlink DN, Buckley DN, Wang L, Couban RJ, et al. Guideline for opioid therapy and chronic noncancer pain. CMAJ. 2017 May;189(18):E659–66. https://doi.org/10.1503/cmaj.170363 PMID:28483845
28. Von Korff M, Saunders K, Thomas Ray G, Boudreau D, Campbell C, Merrill J, et al. De facto long-term opioid therapy for noncancer pain. Clin J Pain. 2008;24(6):521–7. https://doi.org/10.1097/AJP.0b013e318169d03b PMID:18574361

 ORCID
ORCID


 Creative Commons Attribution
Creative Commons Attribution