Karen Müller V.*, y Milko Zott M.**
Reve Chil Anest Vol. 42 Número 1 pp. 48-54|doi:
PDF|ePub|RIS
INTRODUCCIÓN
La isquemia miocárdica sigue siendo la principal causa de morbimortalidad postoperatoria, con una incidencia entre un 2 a 6% en cirugía no cardiaca 1 y, considerando que son más de 230 millones de cirugías mayores que se realizan anualmente en todo el mundo 2 , los costos asociados son enormes. La evidencia para el manejo de estas complicaciones ha crecido durante las últimas décadas, priorizando la identificación de los pacientes de mayor riesgo y de las estrategias para optimizar su manejo. Los pacientes con factores de riesgo como cardiopatía coronaria conocida, edad, hipertensión arterial, diabetes o tabaquismo crónico sometidos a cirugías de riesgo intermedio o alto tienen mayor posibilidad de sufrir un infarto al miocardio durante el intra y el postoperatorio que una persona sin ellos. La mortalidad a 30 días asociada a cirugías no cardiacas de moderado a alto riesgo es entre 2 a 5% respectivamente 3 y probablemente aumente a medida que envejece la población y pacientes con mayores factores de riesgo cardiovascular se sometan a cirugía.
Tradicionalmente el infarto agudo de miocardio (IAM) ha sido definido según los criterios de la Organización Mundial de la Salud (OMS) que incluyen ECG y enzimas miocárdicas. El IAM postoperatorio puede ser particularmente de difícil diagnóstico dado que es habitualmente silente por la sedación, analgesia y el dolor quirúrgico del paciente. Las enzimas cardiacas pueden estar elevadas por la cirugía misma o patologías de base. Incluso son frecuentes cambios inespecíficos del segmento ST y onda T en el postoperatorio. En el intraoperatorio las limitantes son la ausencia de monitorización continua de 12 derivadas electrocardiográficas, la sensibilidad operador dependiente de la ecografía transesofágica y, por supuesto, la sedación o inconciencia del paciente. Esto lleva frecuentemente al diagnóstico tardío con a una alta mortalidad de IAM postoperatorio (30-70% en el corto plazo) 3 , 4 .
Todavía existen discrepancias en la monitorización óptima para detectar IAM perioperatorio en pacientes de alto riesgo que se somenten a cirugía no cardiaca. En la era pre ecografía se utilizaba la presión capilar pulmonar como índice de falla aguda del ventrículo izquierdo. Hoy en día se acepta que todo paciente de alto riesgo cardiovascular debe tener monitorización electrocardiográfica con la mayor cantidad de derivadas posibles y ecografía transesofágica según disponibilidad. Numerosos estudios han tratado de explorar la relación entre la hemodinamia y la isquemia perioperatoria. La taquicardia es el predictor más fuerte de sufrimiento miocárdico, sin embargo, durante cirugías de revascularización miocárdica la mayor parte de los infartos intraoperatorios no se han correlacionado con cambios hemodinámicos 5 . Si bien se ha descrito que la mayoría de las isquemias intraoperatorias no se acompañan de hipotensión, en un estudio reciente se propone a la hipotensión intraoperatoria como factor predictor independiente de infarto miocárdico 6 .
Así, los elementos que aparecen más confiables para el diagnóstico de isquemia perioperatoria son: el control seriado de troponinas y el ecocardiograma transesofágico intraoperatorio (ETE). Para el primero se debe tener la sospecha y para el segundo se debe estar entrenado. El objetivo de este artículo es ordenar y revisar las alternativas y herramientas que tenemos para enfrentar este problema.
DEFINICIÓN Y FISIOPATOLOGÍA
Durante la última década se ha hecho un esfuerzo por actualizar la definición de infarto del miocardio. En el año 2000 se publicó la primera guía de opinión de expertos conformado por la Sociedad Europea de Cardiología, la American Heart Association (AHA) y la Fundación del Colegio Americano de Cardiología (ACC), que define infarto del miocardio como cualquier necrosis miocárdica en el escenario de isquemia miocárdica. Siete años más tarde salió la segunda revisión que hace énfasis en las diferentes condiciones que pueden llevar a un infarto (ruptura de placa vs cualquier condición que lleve a desbalance entre el aporte y los requerimientos de oxígeno). Este año salió la tercera guía que integra en el diagnóstico de IAM el uso de enzimas cardiacas ultrasensibles capaces de detectar pequeñas cantidades de necrosis miocárdica. En la Tabla 1 se muestran los criterios actuales de diagnóstico de IAM según esta guía 7 .
Tabla 1 Criterios actuales de diagnóstico de IAM
| Elevación y/o caída de biomarcadores cardíacos con al menos un valor sobre el p99 del valor límite y al menos uno de los siguientes factores:
• Síntomas de isquemia • Cambio reciente del segmento ST o nuevo BCRI • Onda Q patológicas en ECG • Imagen sugerente de isquemia miocárdica reciente o alteración segmentaria de movilidad • Identificación de un trombo coronario por angiografía o autopsia |
| Muerte cardiaca con síntomas sugerentes de isquemia miocárdica y cambios ECG o nuevo BCRI, en la medida que esto ocurriera antes que los biomarcadores se elevaran o fueran obtenidos |
|
IAM asociado a intervención coronaria percutánea o IAM asociado a cirugía de revascularización miocárdica que se define como elevación de troponina ultrasensible (cTn) > 5 veces el valor de percentil 99 y > 10 veces sobre el percentil 99 respectivamente, en pacientes con valores basales normales más uno de los siguientes elementos: (i) nuevos cambios electrocardiográficos, (ii) oclusión coronaria documentada por angiografía (iii) imagen sugerente de pérdida de viabilidad miocárdica o nueva alteración segmentaria de la motilidad de pared |
El IAM es el resultado de un desbalance entre el aporte de oxígeno y su demanda en los miocitos cardiacos. A continuación se señala la clasificación universal de IAM según su mecanismo responsable 8 :
-
IAM espontáneo o Tipo 1: Ruptura espontánea, fisura o erosión de placa ateromatosa inestable, generando una trombosis aguda, isquemia e infarto del tejido cercano.
-
IAM secundario a desbalance isquémico o Tipo 2: Desbalance entre la demanda y aporte de oxígeno en el tejido miocárdico secundario a cambios hemodinámicos, siendo la taquicardia e hipotensión sus mayores responsables. Frecuencias cardiacas mayores a 80 latidos por minuto (lpm) en pacientes portadores de una cardiopatía coronaria que previamente presentaban frecuencias de 50-60 lpm pueden terminar en isquemia e infarto. Si se asocia hipotensión, aumento de las hormonas de estrés, vasoconstricción, anemia, hipoxemia e hipercapnia la situación empeora 3 .
-
IAM asociado a muerte súbita o Tipo 3.
-
IAM asociado a procedimiento de revascularización (endovasculares) o Tipo 4 y cirugía abierta o Tipo 5, ya sea por la injuria secundaria a la instrumentalización del corazón o por trombosis del stent.
El proceso de contracción miocárdica que implica acortamiento de la fibra durante el sístole y su relajación durante el diástole son procesos dependiente de energía que requieren de oxígeno. La isquemia lleva rápidamente a una alteración de la función ventricular que se manifiesta inicialmente en una disfunción diastólica seguida de una disfunción sistólica que se observa como una alteración segmentaria en el movimiento de la pared 9 . Los cambios electrocardiográficos y hemodinámicos son más tardíos (Figura 1).
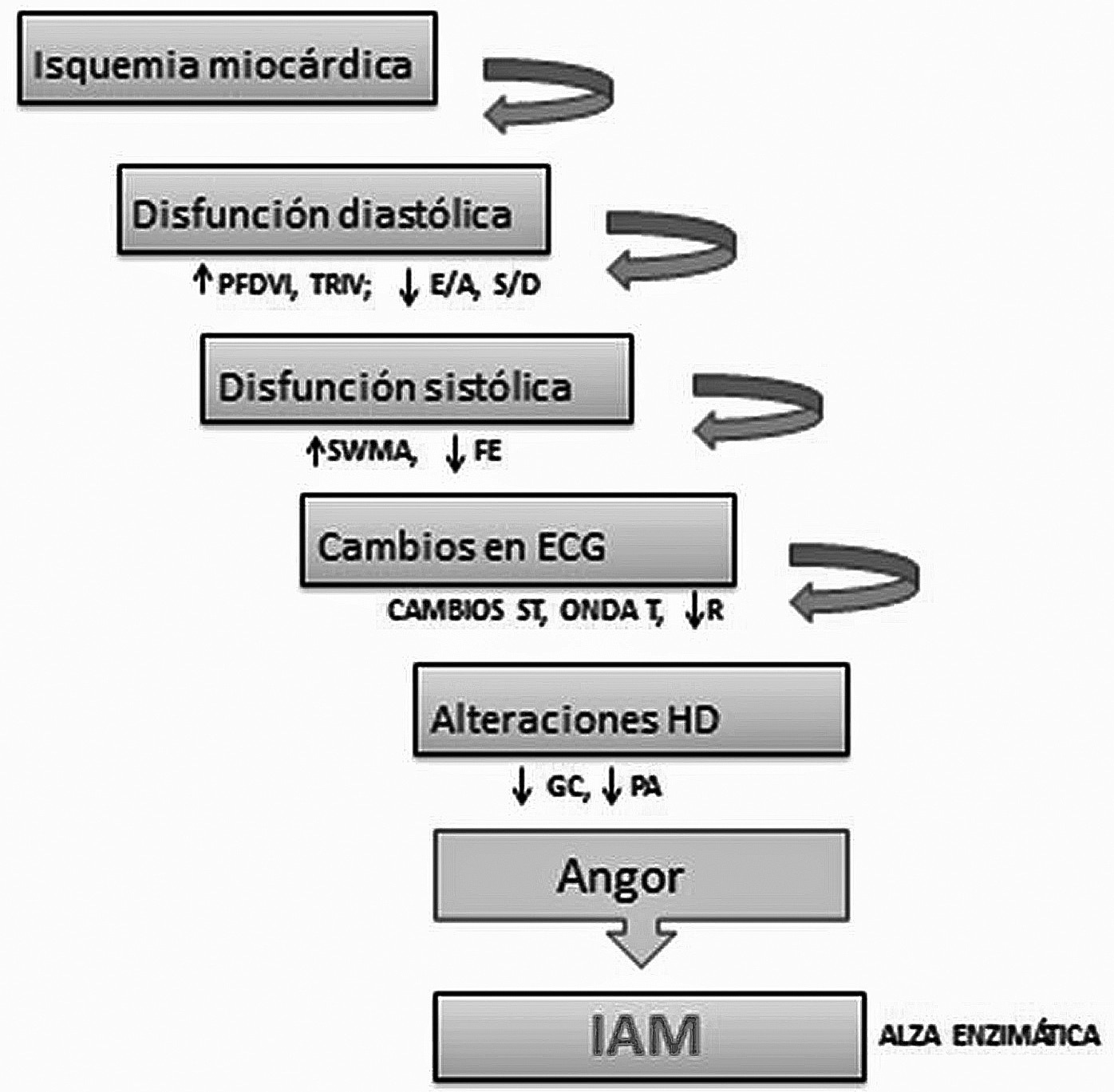
Figura 1 Cascada de la isquemia miocárdica. PFDVI: presión de fin de diástole del ventrículo izquierdo. TRIV: tiempo de relajación isovolumétrica. E/A: relación entre el llenado precoz (E) y contracción auricular (A). S/D relación ondas vena pulmonar. SWMA: alteración de la motilidad segmentaria de la pared. FE: fracción de eyección. R: onda R del QRS. GC: gasto cardiaco. PA: presión arterial (Ecocardiografía básica intraoperatoria, Universidad de Valparaíso – editorial 2012).
EVALUACIÓN PREOPERATORIA
El primer paso es intentar prevenir que ocurra un IAM perioperatorio. Pacientes con cardiopatía coronaria conocida o con síntomas sugerente de dicha patología deben tener una evaluación cardiológica preoperatoria. En pacientes asintomáticos la historia clínica y el examen físico tienen un rol fundamental, especialmente en aquellos mayores de 50 años o con factores de riesgo cardiovascular. La evaluación debe ser exhaustiva y debe considerar el tipo de cirugía, con el objetivo de decidir en base a los riesgos y beneficios la eventual suspensión de un procedimiento electivo. En la última guía internacional de evaluación preoperatoria publicada en el 2007 por la AHA, se esquematiza el algoritmo a seguir en la toma de decisiones frente a pacientes de mayor riesgo 20 .
ENZIMAS CARDIACAS
Tanto la troponina como la fracción de crea-tinfosfoquinasa miocárdica (CK-MB) son mundialmente utilizadas como biomarcadores para la injuria miocárdica. El principal problema es el tiempo que demoran en alterarse considerando que la necrosis completa de células del miocardio toma entre 2 a 4 horas. Esto depende de varios factores: la presencia de circulación colateral en la zona de isquemia, si la oclusión coronaria es persistente o intermitente, la sensibilidad del miocito a la isquemia, si hubo precondicionamiento o no y de las demandas individuales de oxígeno y nutrientes. El proceso completo hasta la cicatrización miocárdica puede demorar 5-6 semanas y la cTn puede estar elevada hasta el décimo día post IAM. La CK se eleva a las 4-8 h y vuelve a normalidad a las 48-72 h 10 .
Es importante destacar que la elevación de enzimas comienza entre las 24-48 h post cirugía, momento de mayor estrés post operatorio. Le Manach y colaboradores identificaron 2 grupos de temporalidad en la elevación de biomarcadores; un grupo con peak precoz de troponinas (menor de 24 h) y un grupo tardío (mayor de 24 h), lo que lo correlacionaron con los distintos patrones fisiopatológicos de isquemia (oclusión coronaria aguda e isquemia miocárdica prolongada respectivamente) 11 .
La troponina es un componente del aparato contráctil de las células miocárdicas y se expresa casi exclusivamente en el corazón. Si bien su elevación refleja necrosis de los miocitos, no indica el mecanismo de injuria. La troponina es una proteína localizada junto a la tropomiosina en el filamento de actina. Está formada por 3 cadenas polipéptidas o 3 subunidades: la troponina T, que se une a la tropomiosina, la troponina I, que inhibe la actividad del ATP una vez unida a actina y la troponina C, que contiene sitios de unión al calcio. La mayoría de la troponina se encuentra en forma de este complejo pero entre 2-8% está en forma de subunidades separadas en el plasma 12 .
En el esfuerzo para mejorar los métodos de detección de este biomarcador apareció la troponina ultrasensible (cTn), que es el examen de elección para el diagnóstico de IAM. La cTn tiene gran especificidad y puede detectar zonas de necrosis miocárdica microscópicas.
Se considera un alza de cTn cuando el valor excede el percentil 99 de la referencia en población sana, valor que es definido por los fabricantes. Se ha intentado determinar un valor de corte de troponina como umbral de infarto miocárdico. Howwell y colaboradores observaron la correlación entre clínica de IAM y elevación enzimática en 65 pacientes sometidos a cirugía vascular mayor electiva durante los primeros 4 días postoperatorios y propusieron un valor de corte para cTn de 0,68 µg·L-1 y para CK-MB de 40 µg·L-1 13 , valor similar al encontrado por Metzler y colegas, que describieron un valor predictivo positivo de 87,5% y un valor predictivo negativo de 98% para el diagnóstico de IAM con cTn mayor a 0,6 µg·L-1 14 .
La CK es una enzima presente en la miofibrilla y otros tejidos (como cerebro y tracto gastrointestinal) que cataliza la producción de fosfocreatina, proceso en el cual se provee a la mitocondria de una molécula de ATP, constituyendo una reserva energética para la célula. Se puede elevar ante cualquier injuria de músculo esquelético. La isoenzima CK-MB tiene la ventaja de no estar presente en concentraciones significativas en el tejido extracardiaco. Así, un relación CK-MB/CK ≥ 2,5 sugiere daño miocárdico, aunque se debe tener presente que ésta se puede elevar en miocarditis, post cardioversión eléctrica o cirugía cardiaca 10 .
Existen múltiples condiciones que pueden llevar a muerte de los miocitos no asociado a isquemia aguda. Pequeñas cantidades de biomarcadores de necrosis pueden ser detectados en la insuficiencia cardiaca, falla renal, miocarditis, arritmias, TEP y procedimientos percutáneos o cirugía de revascularización miocárdica no complicada. Esto de denomina injuria miocárdica, que se diferencia del IAM por la falta de evidencia clínica de isquemia miocárdica y por la ausencia de alza o caída aguda de troponinas. Este último punto es de especial importancia, dado que la curva enzimática es patognomónica de un evento agudo. Considerando esto, se recomienda tomar enzimas cardiacas preoperatorias en pacientes de alto riesgo para tener un basal con que compararlo posteriormente. Frente a la sospecha de síndrome coronario agudo se debe tomar una nueva muestra y repetir el examen a las 3-6 h 7 .
Las troponinas son también marcadores de pronóstico. El grupo VISION (The Vascular Events in Noncardiac Surgery Patients Cohort Evaluation Study Investigators) realizó un estudio prospectivo con el objetivo de determinar la relación entre el nivel de cTn al tercer día postoperatorio y la mortalidad a los 30 días. Se incluyeron más de 15.000 pacientes operados de cirugía no cardiaca. La valores de cTn de < 0,01, 0,02, 0,03-0,29 y ≥ 0,30 ng/ml tuvieron una mortalidad a los 30 días de 1%, 4%, 9,3% y 16,9% respectivamente 15 .
A pesar que revisiones antiguas han sugerido que la CK-MB no tiene valor pronostico 16 , Domanski y colaboradores publicaron una revisión sistemática que muestra que la mortalidad aumenta proporcionalmente al aumento de la relación CK-MB/CK en pacientes sometidos a bypass coronario. A los 30 días los pacientes que tenían CK-MB entre 20 y 40% del valor de la CK presentaron una mortalidad de 7,06%, sugiriendo la CK-MB como un fuerte predictor de mortalidad dentro de los primeros 30 días postoperatorios. Resultados similares tuvieron con la troponina 17 .
ELECTROCARDIOGRAMA (ECG)
El ECG es parte fundamental del diagnóstico de trabajo frente a sospecha de IAM, por lo que todo anestesiólogo debe estar instruido en su interpretación. Es simple, barato y no invasivo. Los cambios dinámicos durante episodios de isquemia aguda hacen que sea necesario adquirir múltiples trazados electrocardiográficos (cada 15-30 minutos), especialmente si el primero no es concluyente. Idealmente utilizar trazado continuo de 12 derivadas, que tiene una sensibilidad cercana a 85% 3 . Los cambios observados durante el IAM agudo en ausencia de hipertrofia ventricular izquierda y de BCRI son 7 :
-
Elevación ST.
-
Nuevo supradesnivel en el punto J de dos derivadas continuas ≥ 0,1 mV, a excepción de V2-V3 donde deben ser ≥ 0,2 mV en hombres mayores de 40 años, ≥ 0,25 mV en hombres menores de 40 años y ≥ 0,15 mV en mujeres.
-
-
Depresión ST y cambios en la onda T.
-
Nuevo infradesnivel horizontal o down sloping ≥ 0,05 mV en dos derivadas continuas y/o inversión de onda T ≥ 0,1 mV en dos derivadas continuas con onda R prominente o relación R/S >1.
-
Durante el intraoperatorio existe la limitación de la cantidad de derivadas usadas y la escasa detección visual de cambios de nivel del ST. En la década del 80 se estudió vastamente la sensibilidad de las derivadas durante el test de esfuerzo, mostrando que las derivaciones precordiales (V3 a V6) eran mucho más sensibles que las derivadas bipolares frontales (DI, DII, DIII) y unipolares clásicas (aVR, aVL, aVF) para la detección de isquemia. London y colaboradores observaron 105 pacientes coronarios sometidos a cirugía no cardiaca con monitorización continua electrocardiográfica de 12 derivadas durante el intraoperatorio, y confirmaron que la sensibilidad de DII era de 33%, V4 de 61%, V5 de 75% y DII + V5 de 80%. Si se agrega una tercera derivada (V4) aumenta la sensibilidad a 96%, lo que es poco aplicable con los monitores habituales que no permiten seleccionar 2 derivadas simultáneas. En la práctica habitual se utilizan las derivadas bipolares modificables que se asemejan muy bien a V5 18 .
Dado que la detección visual de cambios en el ST durante el intraoperatorio es operador dependiente, se crearon monitores con sistemas computarizados, aumentando la sensibilidad y especificidad para el diagnóstico de cambios en el ST a un 74% y 73% respectivamente 19 .
Como ya se mencionó anteriormente, son frecuentes los cambios electrocardiográficos postoperatorios con o sin isquemia miocárdica. El valor en su interpretación depende de la probabilidad de tener un evento cardiaco según sus factores de riesgo y de los síntomas asociados. Numerosos estudios han demostrado que cambios en el segmento ST frecuentes o continuos (por más de dos horas) o de duración prolongada (episodios de al menos 30 minutos) durante el perioperatorio, predicen eventos cardiovasculares mayores, considerándose un factor independiente de pronóstico en pacientes de alto riesgo 20 .
ECOCARDIOGRAFÍA TRANSESOFÁGICA INTRAOPERATORIA (ETE)
Actualmente la ETE es la mejor herramienta que disponemos para diagnosticar un IAM intraoperatorio. En 1985 Smith y colaboradores observaron que la ETE intraoperatoria supera ampliamente al ECG en sensibilidad y especificidad para la detección de IAM en pacientes de alto riesgo sometidos a cirugía de aneurisma abdominal 21 . El fundamento radica en la patología y manifestación de la isquemia miocárdica donde prima la aparición precoz de movimientos paradojales de la pared ventricular ante la oclusión arterial, descrito en la década de los 30 por Tennant y Wiggers; demuestran que luego de la oclusión coronaria aguda aparece un movimiento paradójico de la zona isquémica a sólo segundos de haber ocurrido este proceso, antes o incluso en ausencia de cambios electrocardiográficos 22 . Así, estos movimientos paradojales de la pared ventricular detectados al ETE se han transformado en el gold standard para el diagnóstico de IAM intraoperatorio.
Lee A. Fleisher el año 2000 19 se muestra partidario del ETE intraoperatorio sin antes mencionar algunas dudas y reparos al respecto como la presencia de falsos positivos: ¿Cuántos de estos movimientos anómalos se deben realmente a una isquemia de pared? Las alteraciones hemodinámicas pueden llevar a trastornos en el movimiento de la pared por disminución en el retorno venoso sin que sea por isquemia o pueden haber pacientes con alteraciones en la contracción prexistentes; también están los casos de un aumento agudo en la post carga como lo es en el pinzamiento aórtico en la cirugía de aorta abdominal, donde también se pueden detectar alteraciones en la contractilidad. Incluso hay un trabajo de Eisemberg donde la detección de eventos isquémicos en la cirugía no fue muy superior con ecocardiograma al compararlo con ECG de 12 derivadas 23 . Una limitante del ETE es que sólo se puede utilizar durante la anestesia general, impidiendo el uso de anestesia regional y haciendo imposible su uso en la inducción anestésica, momento crucial para la monitorización y manejo hemodinámico. Otro tema a considerar es el costo del equipo y la necesidad de ser utilizado por un operador adiestrado. Esto hace pensar que si bien es comparativamente mejor examen que el ECG, hoy en día aún es subutilizado por las dificultades que presenta su uso.
Actualmente, para lograr una detección temprana de isquemia miocárdica no sólo se buscan alteraciones agudas en la motilidad segmentaria ventricular izquierda, sino también otros hallazgos sugerentes como: disfunción diastólica aguda, insuficiencia mitral por ruptura del musculo papilar, miocardio con paredes delgadas y ventrículo dilatado. La Sociedad Americana de Ecocardiografía y Anestesia Cardiovascular (SCA/ASE), con el fin de estandarizar y disminuir la subjetividad de este examen, recomienda un modelo de 17 segmentos del ventrículo izquierdo (VI). El VI se divide en tres niveles (basal, medial y apical), donde los niveles basal y medial presentan 6 segmentos (anterior, lateral, inferior, posterior, septal y anteroseptal) y el apical 4 segmentos (anterior, inferior, lateral y septal). Por último el apex es el 17 (Figura 2).

Figura 2 Vistas transgástricas en eje largo y corto. Se esquematizan los segmentos y porciones del ventrículo izquierdo. Eje largo: Ecocardiografía básica intraoperatoria, 2012 Editorial Universidad de Valparaíso. Eje corto: Ecocardiografía transesofágica intraoperatoria. Aproximación práctica y sistemática. 2006 MRA Ediciones, S.L. Barcelona.
El doppler tisular se ha sumado como nueva herramienta del ETE intraoperatorio, evaluando flujos de bajas velocidades a nivel intramiocárdico. Se sugiere que realizando doppler tisular de forma repetida se detectaría isquemia regional con mayor sensibilidad que con la técnica visual actual (disminución de onda S’ y E’ y una E’/A’ < 1) 24 .
La ETE intraoperatoria se ha transformado en un monitor más dentro del quirófano, prestando gran ayuda especialmente en cirugías de pacientes de alto riesgo. No cabe duda que es el monitor más precoz en la detección de isquemia miocárdica, lo que no implica que los otros exámenes no se deban utilizar complementariamente. Con la aparición de nuevos equipos de mayor resolución, menor costo y tamaño, probablemente en un futuro cercano sean de uso rutinario en pacientes seleccionados.
CONCLUSIÓN
Con la evolución de la tecnología no se debe dejar de lado una buena historia clínica para orientar una aproximación hacia nuestros pacientes. La sospecha y diagnóstico de una patología isquémica en el intraoperatorio no es fácil, especialmente si tenemos una historia clínica poco clara. Idealmente es tener disponible un ecocardiógrafo transesofágico a mano con un operador competente. Frente a un paciente con factores de riesgo que se someterá a una cirugía de complejidad mayor, la toma de muestras de troponinas en el preoperatorio para luego hacer un seguimiento en caso de sospecha, pareciera ser un método efectivo de diagnóstico y pronóstico.
No es recomendable descansar sólo en la monitorización hemodinámica y ECG como fuente de diagnóstico, pues son tardíos y poco específicos además de tener una baja sensibilidad. Pareciera que el presente y futuro le pertenece a la ETE intraoperatoria. Teniendo claro sus limitaciones, en la actualidad es el mejor instrumento de apoyo para enfrentar estos pacientes.
REFERENCIAS
- Devereaux PJ, et al.Perioperative cardiac events in patients undergoing noncardiac surgery: a review of the magnitude of the problem. CMAJ 2005; 173(6): 627-634.
- Thomas G. Weiser, et al. An estimation of global volume of surgery: a modalig strategy based on available data. Lancet 2008; 372: 139-144.
- Giora Landenberg, MD, DSc, et al . Perioperative myocardial infarction. Circulation 2009; 119: 2936-2944.
- Jesse E. Adams, et al. Diagnosis of perioperative myocardial infarction with measurement of cardiac troponin I. N. England J Med 1994; 330: 670-674.
- Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine, 9th Edition. Capítulo 85.
- Richard F. Alcock, et al . Perioperative myocardial necrosis in patients at high cardiovascular risk undergoing elective non-cardiac surgery. Heart 2012; 98: 792-798.
- Kristian Thygesen, et al. Third universal definition of myocardial infarction. European Heart Journal/AHA 2012.
- Kristian Thygesen, et al. Second universal definition of myocardial infarction. European Heart Journal/AHA 2007.
- Cabrera MC. Libro “Ecocardiografía básica intraoperatoria” Universidad de Valparaíso-editorial 2010. Capítulo VIII Dr. Mauricio González: Ecocardiografía transesofágica e isquemia miocárdica intraoperatoria.
- Harrison’s Principles of Internal Medicine, 16th Edition. Capítulo 228
- Lee Manach, et al. Early and delayed myocardial infarction after abdominal aortic surgery. Anesthesiology 2005; 102(5): 885-891.
- Juliet A, et al . Cardiac troponins: their use and relevance in anaesthesia and critical care medicine. Critical Care & Pain 2008; 8(2): 62-67.
- Kaluza L, et al . Relationship between perioperative troponin elevation and other indicators of myocardial injury in vascular surgery patients. Br J Anaesth 2006; 96: 303-309.
- Metzler H, et al . Perioperative myocardial cell injury: the role of troponins. Br J Anaesth 1997; 78(4): 386-390.
- Metzler H, et al . Association between postoperative troponin levels and 30-day mortality among patients undergoing noncardiac surgery. JAMA 2012; 307(21): 2295-2304.
- Devereux PJ, et al . Surveillance and prevention of major perioperative ischemic cardiac events in patients undergoing noncardiac surgery: a review. CMAJ 2005; 173(7): 779-788.
- Domanski MJ, et al . Association of myocardial enzyme elevation and survival following coronary artery bypass graft surgery. JAMA 2011; 305(6): 585-591.
- London MJ, et al . Intraoperative Myocardial Ischemia: Localization by continuos 12 lead electrocardiography. Anesthesiology 1988; 69: 232-241.
- Lee A, Fleisher MD, et al . Real time intraoperative monitoring of myocardial ischemia in non cardiac surgery. Anesthesiology 2000; 92: 1183-1188.
- Lee A, Fleisher MD, et al . Guidelines on Perioperative Cardiovascular and Care for Non cardiac Surgery. ACCF/AHA 2007.
- Smith JS, et al . Intraoperative detection of myocardial ischemia in high risk patients: electrocardiography vs two dimentional transesophageal echocardiography. Circulation 1985; 72: 1015-1021 doi: 10.1161/01.CIR.72.5.1015.
- Tennant R, et al . The effect of coronary occlusion on myocardial contraction. Am J Physiology 1935; 112: 351.
- Eisemberg JF, et al . Monitoring for myocardial ischemia during non cardiac surgery. A technology assessment of transesophageal echicardiography and 12 lead electrocardiography. JAMA 1992.
- Skubas, et al . Intraoperative doppler tissue imaging is a valuable addition to cardiac anesthesiologists’ armamentarium: a core review. Skubas revision publicada el año 2008 Anesthesia Analgesia.