Claudia Jimena Cárdenas Rey3,*, Angélica Fernández1, Ximena Rodríguez Cardona1, Catalina Moreno-Quijano2, Carlos Hernán Rodríguez Martínez3
Recibido: 08-12-2022
Aceptado: 11-08-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 8 pp. 711-715|https://doi.org/10.25237/revchilanestv52n8-03
PDF|ePub|RIS
Treatment of difficult cancer pain
Abstract
Cancer pain is a complex entity that is not only about physical pain but also refers to total pain, which affects the quality of life of patients and caregivers. The management of cancer pain has advanced due to the great needs of each of the patients with advanced cancer diseases, not only multiple pharmacological options are available, but also interventional management and non-pharmacological measures play an important role in the management of this pathology. The objective of this review is to describe the different analgesic strategies reported in the literature for patients with difficult-to-manage cancer pain.
Resumen
El dolor oncológico es una entidad compleja que no solo se trata del dolor físico sino que hace referencia a un dolor total, que afecta la calidad de la vida de los pacientes y de los cuidadores. El manejo de dolor oncológico ha ido avanzado debido a las grandes necesidades de cada uno de los pacientes con enfermedades oncológicas avanzadas, no solo se tiene disponible múltiples medicamentos sino también el manejo intervencionista y medidas no farmacológicas juegan un importante papel en el manejo de esta patología. El objetivo de esta revisión, es describir las diferentes estrategias analgésicas reportadas en la literatura de los pacientes con dolor oncológico de difícil manejo.
-
Introducción
El dolor es un síntoma muy prevalente y alarmante que representa un importante problema de salud en los pacientes oncológicos. La incidencia de dolor oscila entre el 24% y el 60% y se acerca al 58% y el 69% en quienes re
ciben tratamiento activo y quienes se encuentran en la etapa avanzada de la enfermedad, respectivamente. Además, el dolor puede persistir en el 30% de los pacientes después de la terapia curativa[1].
El dolor oncológico se presenta como un síndrome mul- tifacético y retador para el profesional en salud, que implica dos componentes: un componente físico dado por el efecto del tumor y el efecto de tratamiento onco específico, y un componente no físico representado por la capacidad para afrontarlo, el nivel de angustia y el sufrimiento. Por lo que pensar en un manejo individualizado y multidisciplinar es la decisión más racional. Sin embargo, en la práctica clínica, con el uso crónico del opioide en el paciente oncológico, se debe contar con diferentes estrategias farmacológicas para lograr una mejor respuesta y evitar otras complicaciones asociadas como tolerancia, hiperalgesia inducida por opioides, adicción o mal uso de las terapias farmacológicas.
Esta revisión de la literatura evaluará las estrategias farmacológicas en el contexto del paciente oncológico con intención terapéutica paliativa en la que por diferentes componentes mencionados previamente no se cuenta con control del dolor. Así mismo, revisar las diferentes estrategias multimodales para el tratamiento del dolor oncológico de difícil manejo.
-
Tipos de escenarios DODM
En la práctica clínica de los cuidados paliativos oncológicos, estamos en constante evolución en el control de los síntomas físicos principalmente en la atención de las instituciones de alta complejidad de salud. Dentro de la revisión de la literatura, en el paciente oncológico se describen diferentes escenarios en la generación de DODM:
1. Progresión de la enfermedad neoplásica locorregional o metastásica: La cronificación en el dolor asociado a cáncer suele estar acompañando con la progresión de la enfermedad (por compromiso secundario, por compresión o infiltración neural), así como, se pueden presentar complicaciones del tumor agudas o relacionadas con el manejo onco-es- pecífico[2]. Entendiendo la variedad de circunstancias que pueden perpetuar el dolor cuando nos encontramos en el escenario de una enfermedad oncológica en progresión, adicional al manejo interdisciplinar del control del dolor y de acuerdo a la funcionalidad y escalas pronósticas del paciente; el tratamiento dirigido por parte del oncólogo es el principal abordaje que ha demostrado mejoría del control sintomático[2],[3].
Pueden ocurrir diferentes escenarios como el dolor visceral crónico que puede ser irruptivo hasta en 75%. Otro escenario es la obstrucción ureteral que se representa como dolor tipo cólico, a menudo superpuesto a un dolor sordo, y puede estar referido a la región inguinal o a los genitales. Cuando es intenso, el dolor tipo cólico puede estar asociado con náuseas y vómitos. La derivación urinaria o la colocación de stents pueden proporcionar alivio sintomático.
2. Situación clínica asociada a los tratamientos oncológicos: La mucositis oral es una de las complicaciones dolorosas agudas más comúnmente asociadas a tratamiento dirigido (qui- mio/radioterapia), que se presenta dentro de las primeras dos semanas, usualmente postinicio de tratamiento y llega a afectar la mucosa de todo el tracto gastrointestinal (mucositis oral, enteritis, rectitis). Siendo el dolor el síntoma por el que deciden consultar dado que puede ser de intensidad severa y es acompañado de pérdida del apetito, náuseas, vómito y diarrea que lleva a compromiso nutricional[3]. Otra síntoma frecuente es el dolor perineal (rectal, genital o difuso) que es común en los tumores del recto o colon (como en el reporte de caso clínico), cáncer genitourinario (más frecuente en mujeres) y está en relación directa con el compromiso tumoral o compromiso locorregional. El dolor generalmente es severo, difuso y se exacerba al sentarse o pararse, con o sin un componente de tenesmo o espasmos vesicales intensos e intermitentes[4].
Presentaciones leves a severas las cuales requiere de un manejo multimodal para el control sintomático y muchas veces se debe evaluar el riesgo beneficio de la continuidad del tratamiento oncológico. Dentro de los diferentes escenarios, el paciente puede cursar con complicaciones secundarias al tratamiento oncológico, dadas por supresión inmunológica llevándolo a presentar complicaciones asociadas.
3. Tolerancia e hiperalgesia opioide: El DODM puede llevar a presentar tolerancia e hiperalgesia, escenarios que generan un reto adicional en el tratamiento. El uso de opioides se asocia frecuentemente con la aparición de efectos adversos o problemas clínicos como la tolerancia definida como el requerimiento de dosis mayores de fármacos opioides para lograr el mismo efecto. Los mecanismos de tolerancia a los opioides incluyen adaptaciones inducidas por fármacos o un desbalance en los mediadores primarios alterando así, los circuitos de respuesta de dolor. El aumento de la dosis en la terapia con opioides a largo plazo puede causar hiperalgesia inducida por opioides, lo que resulta en una exacerbación de la sensación de dolor en lugar de un alivio del dolor[5]. Los mecanismos mediante los cuales se puede explicar la tolerancia es debido a cambios a nivel de los receptores que pueden ser; en los receptores endógenos, segundos mensajeros y otros sistemas de neurotransmisión. Dentro de los cambios, a nivel de los receptores, se encuentra la desensibilización por fosforilación, la internalización del receptor y la degradación. Así mismo, pueden ocurrir cambios en la señalización intracelular como: aumento en la adenilato ciclasa, un incremento en la activación de los canales de calcio, pérdida de la activación de los canales de potasio. También se ha propuesto que la administración crónica de opioides da como resultado la activación de los sistemas descendentes facilitadores del dolor.
Anna DuPen et col (2007)[6], describen esta desensibilización cuando las enzimas reguladoras intracelulares, como las quinasas, las arrestinas y la adenilciclasa, son activadas por los opioides de tal manera que desacoplan el receptor opioide de la proteína G o producen un cambio en el acoplamiento del receptor a una proteína G, disminuyendo posteriormente la actividad analgésica. La hiperalgesia inducida por opioides (HIO) se define como el aumento de la sensibilidad a los estímulos dolorosos como resultado del uso de opioides que se puede manifestar mediante hiperalgesia o alodinia, los mecanismos son multifactoriales, Célerier et al (2016), describen la HIO cuando la actividad antinociceptiva es contrarrestado por una respuesta endógena, incluyendo la activación de la adenilato ciclasa, la activación del receptor de glutamato N-metil-D-aspartato (NMDA) y la liberación de péptidos pro nociceptivos generando un aumento del dolor cuando se administran dosis repetidas de opioides, provocando la sensibilización de las neuronas espinales; este mecanismo pronociceptivo se ha implicado en el desarrollo de dolor neuropático[7].
Otros estudios han documentado que la hiperalgesia resulta del aumento de los neurotransmisores excitatorios activando las vías espinales provocando una sensibilización central, dando como resultado la amplificación de la señales de dolor que se transmiten a la médula espinal. Cuando la enfermedad está en progresión es una de las principales causas generadoras de este fenómeno. El aumento de dosis de opioides sin obtener una analgesia explica el desbalance en los mediadores primarios, alterando así los circuitos de respuesta de dolor. Ante este aumento de dosis de opioides, el paciente puede presentar HIO, en quien a pesar de un manejo multimodal, puede inclusive llegar a un dolor refractario oncológico. Estos escenarios que se han descrito, requieren de un manejo integral farmacológico y no farmacológico.
-
Tratamiento farmacológico DODM
Opioides: siguen siendo los únicos analgésicos con beneficio comprobado en el dolor oncológico de difícil manejo, se pueden alcanzar rápidamente concentraciones séricas altas mediante la administración parenteral, se ha demostrado que el 77% de los casos se controlan con opioide sin diferencias entre las vías subcutánea e intravenosa. Según la evidencia disponible, la Asociación Europea de Cuidados Paliativos (EAPC) recomienda el uso de infusiones parenterales de opioides en los casos en que los opioides orales o transdérmicos no logran proporcionar una analgesia eficaz en caso de dolor oncológico de difícil manejo[8],[9] Bruera et al (2019)[10], proponen que el uso de opioides para el tratamiento del dolor oncológico es necesario para la mayoría de los pacientes, sin embargo, su uso se ha convertido en un desafío frente a la epidemia de opioides y la evidencia emergente de que los pacientes con cáncer también están en riesgo de uso no médico de opioides.
Dos opioides: los pacientes con dolor refractario a un único opioide podrían beneficiarse de la adición de un segundo opioide, especialmente cuando se utilizan fármacos con diferentes características (solubilidad en lípidos, rutas de metabolismo, agonismo/antagonismo del receptor o afinidad por el tipo de receptor opioide), sin embargo, los estudios en la literatura son contradictorios ya que hay mejoría pero no se recomienda el uso simultáneo de dos opioides potentes para el dolor oncológico por los efectos secundarios[11].
Rotación de opioides: Fallon et al (2018), propone que los mecanismos para la rotación de opioides incluyen tolerancia cruzada, variación en la actividad intrínseca del receptor opioide, variación entre pacientes en la farmacocinética/dinámica y desensibilización de los receptores opioides, evidenciando en la revisión de la literatura que el cambio de opioides es altamente efectivo para lograr mejor control de dolor oncológico de difícil manejo y reducir los efectos adversos. La metadona se usa con frecuencia en el escenario de rotación de opioides, sin embargo, se debe siempre tener en cuenta la equivalencia de la dosis, la mejor forma de titular y el potencial de toxicidad, también dentro de este escenario está la buprenorfina transdérmica, en la literatura se ha reportado que en comparación con la administración de morfina de liberación sostenida, fue más eficaz para controlar el dolor a largo plazo, mejorar la calidad en pacientes con cáncer y con dolor de difícil manejo[12].
Coadyuvantes: Afsharimani et al (2015)[11], describen el uso de analgésicos no opioides y analgésicos adyuvantes con indicación dentro del manejo multimodal para control de dolor oncológico de difícil manejo, los AINES pueden tener un efecto ahorrador de opioides y podrían mejorar la analgesia. Sin embargo, se debe tener en cuenta sus efectos secundarios y evaluar el perfil de seguridad del paciente. También están los anticonvulsivantes y antidepresivos que pueden ser una opción en el tratamiento del dolor según las características del mismo.
Antagonistas de los receptores de N-metil-D-aspartato (NMDA): Se cree que la activación del receptor NMDA produce hiperexcitabilidad neuronal y el desarrollo de tolerancia a los opioides, por lo que Loveday, et al (2015)[13], refieren que uno de estos antagonistas, como la ketamina, se ha utilizado para el tratamiento del dolor refractario o difícil, normalmente en combinación con opiáceos, la dosis, vía y frecuencia de administración dependerá de cada caso.
Lidocaína: es un anestésico local utilizado como analgésico en el dolor neuropático o para el control del dolor de difícil manejo oncológico. Dentro de la revisión de la literatura, Lee et al (2019)[14], y Cochrane concluyeron que para el dolor neuropá- tico, la lidocaína parenteral y sus análogos orales evidenciaban seguridad y eficacia, sin embargo, no se pudo establecer una conclusión definitiva sobre el uso de estos fármacos para el tratamiento del dolor por cáncer.
Corticosteroides: teniendo en cuenta el potencial de toxicidad grave con el uso a largo plazo, se debe iniciar a bajas dosis y ciclos cortos, y realizar un análisis de riesgo-beneficio antes de iniciarlos. Pueden ser opción para manejo adyuvante en esquemas oncoespecíficos y en radioterapia para disminuir efectos secundarios[15].
-
Tratamiento intervencionista
Los procedimientos tipo bloqueo con anestésicos locales y corticoides, y los neurolíticos como agentes químicos o térmicos son herramientas útiles en el enfoque del manejo multimodal del dolor oncológico incluso de manera precoz. Se puede abordar desde el nervio periférico, plexos, ganglio de la raíz dorsal o incluso raíces mixtas, pares craneanos, eje simpático, catéteres epidurales o intratecales con o sin bombas programables y técnicas avanzadas de estimulación de cordones posteriores o estimulación profunda cerebral. En los pacientes con cáncer avanzado y dolor de difícil manejo, se recomienda ser más agresivo con técnicas neurolíticas o implantes de neuroestimulación o infusiones intratecales dependiendo del tipo de paciente y su expectativa de vida[16],[17],[18].
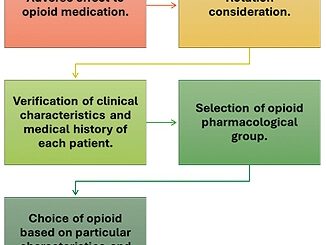
En la Figura 1, se evidencian cuáles son las características clínicas del DODM así como los escenarios y las posibilidades de tratamiento descritas previamente. Es importante mencionar que el DODM, es un entidad compleja que el manejo multimodal debe ser individualizado a cada uno de los pacientes y sus necesidades. En este gráfico se resume la evidencia actual para el tratamiento del dolor oncológico de difícil manejo.
-
Conclusión
El DODM se considera un síndrome clínico en los pacientes con cáncer, que independiente de su causal, genera factores emocionales y de adaptación para el paciente y su entorno. Es un reto pese a las múltiples modalidades terapéuticas conocidas.
Figura 1. Algoritmo para manejo farmacológico en dolor oncológico de difícil manejo. Fuente propia.
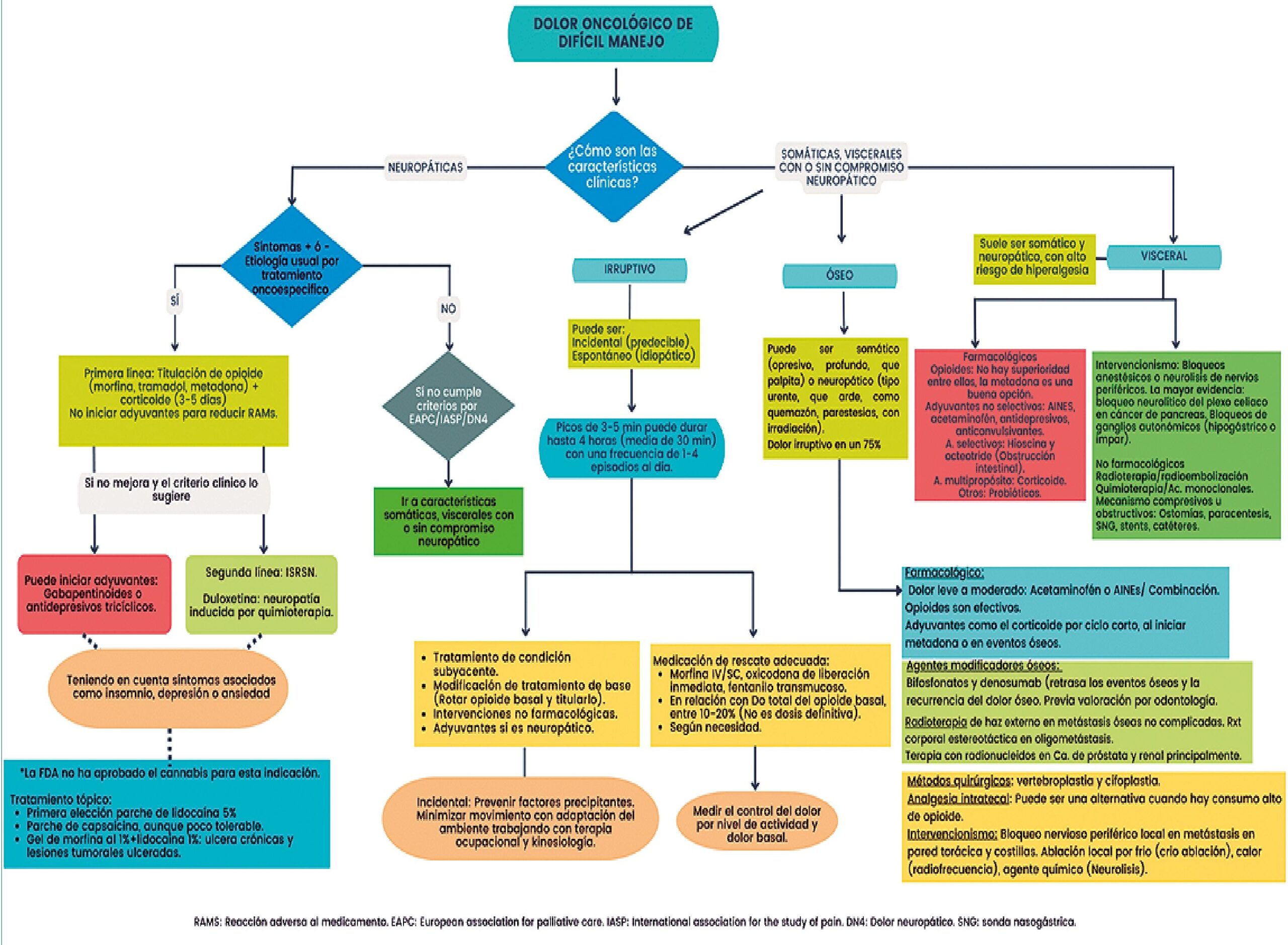
El tratamiento del DODM va desde las dosis del medicamento, el tipo de opioide a iniciar, así como las terapias adyuvantes que será individualizado según las características propias del paciente (características antropológicas, compromiso sistémico multiorgánico) así como; las preferencias del grupo tratante, partiendo de un balance entre la evidencia y la práctica clínica. En el caso de existir un desbalance entre el control analgésico y efectos secundarios a la medicación, se deberá reevaluar la estrategia terapéutica proponiendo en este punto la rotación de opioides, adición de otra medicación adyuvante y bajo la guía de especialistas en dolor, definir la utilidad del uso de infusiones (tipo lidocaína y/o ketamina), así como, en caso de refractarie- dad el inicio de sedación paliativa.
Un abordaje precoz y oportuno, es de gran importancia para realizar intervenciones de acuerdo a la evolución del dolor y los factores psicológicos y sociales, que favorezcan un acompañamiento continuo.
Financiamiento: Se trabajó con recursos propios de los autores.
Conflicto de interés: Los autores declaran que no tienen conflicto de interés.
-
Referencias
1. van den Beuken-van Everdingen MH, Hochstenbach LM, Joosten EA, Tjan-Heijnen VC, Janssen DJ. Update on Prevalence of Pain in Patients With Cancer: Systematic Review and Meta-Analysis. J Pain Symptom Manage. 2016 Jun;51(6):1070–1090.e9. https://doi.org/10.1016/j.jpainsymman.2015.12.340 PMID:27112310
2. Carrillo-Torres O, Medina-Hernández PJ. Entendiendo el concepto de dolor refractario a opioides. Rev Mex Anest; 2017.
3. Brant JM, Keller L, McLeod K, Yeh C, Eaton LH. Chronic and Refractory Pain: A Systematic Review of Pharmacologic Management in Oncology . Clin J Oncol Nurs. 2017 Jun;21(3 Suppl):31–53. https://doi.org/10.1188/17.CJON.S3.31-53 PMID:28524906
4. Brix Finnerup N, Hein Sindrup S, Staehelin Jensen T. 2013 Management of painful neuropathies. https://doi.org/10.1016/B978-0-444-52902-2.00017-5.. PMID: 23931787.
5. Mercadante S, Arcuri E, Santoni A. (2019) Opioid-Induced Tolerance and Hyperalgesia. https://doi.org/10.1007/s40263-019-00660-0.. PMID: 31578704.
6. DuPen A, Shen D, Ersek M. Mechanisms of opioid-induced tolerance and hyperalgesia. Pain Manag Nurs. 2007 Sep;8(3):113–21. https://doi.org/10.1016/j.pmn.2007.02.004 PMID:17723928
7. Hayhurst CJ, Durieux ME. Differential Opioid Tolerance and Opioid-induced Hyperalgesia: A Clinical Reality. Anesthesiology. 2016 Feb;124(2):483–8. https://doi.org/10.1097/ALN.0000000000000963 PMID:26594912
8. Dale O, Moksnes K, Kaasa S. European Palliative Care Research Collaborative pain guidelines: opioid switching to improve analgesia or reduce side effects. A systematic review. Palliat Med. 2011 Jul;25(5):494–503. https://doi.org/10.1177/0269216310384902 PMID:21708856
9. Kela I, Kakarala CL, Hassan M, Belavadi R, Gudigopuram SV, Raguthu CC, et al. Chronic Pain: A Complex Condition With a Multi-Tangential Approach. Cureus. 2021 Nov;13(11):e19850. https://doi.org/10.7759/cureus.19850 PMID:34963858
10. Dalal S, Bruera E. 2019 Pain Management for Patients With Advanced Cancer in the Opioid Epidemic Era. Am Soc Clin Oncol https://doi.org/10.1200/EDBK_100020.. Epub 2019 May 17. PMID: 31099619.
11. Afsharimani B, Kindl K, Good P, Hardy J. Pharmacological options for the management of refractory cancer pain-what is the evidence? Support Care Cancer. 2015 May;23(5):1473–81. https://doi.org/10.1007/s00520-015-2678-9 PMID:25749509
12. Cherny NI, Radbruch L; Board of the European Association for Palliative Care. European Association for Palliative Care (EAPC) recommended framework for the use of sedation in palliative care. Palliat Med. 2009 Oct;23(7):581–93. https://doi.org/10.1177/0269216309107024 PMID:19858355
13. Loveday BA, Sindt J. Ketamine protocol for palliative care in cancer patients with refractory pain. J Adv Pract Oncol. 2015;6(6):555–61. PMID:27648345
14. Ahmedzai SH, Bautista MJ, Bouzid K, Gibson R, Gumara Y, Hassan AA, et al.; CAncer Pain management in Resource-limited settings (CAPER) Working Group. Optimizing cancer pain management in resource-limited settings. Support Care Cancer. 2019 Jun;27(6):2113–24. https://doi.org/10.1007/s00520-018-4471-z PMID:30242544
15. Cimerman J., Peirano G., Rey V., Tedeschi V. .Manual de dolor oncológico de difícil manejo. 2020. Asociación argentina de medicina y cuidados paliativos.
16. Raffa RB, Pergolizzi JV Jr. Intracerebroventricular opioids for intractable pain. Br J Clin Pharmacol. 2012 Jul;74(1):34–41. https://doi.org/10.1111/j.1365-2125.2012.04201.x PMID:22295988
17. Ramírez LJ, Santacruz JG, Arteaga C. Analgesia epidural en dolor crónico oncológico refractario. Acta Med Colomb. 2019;36(1):36–7. https://doi.org/10.36104/amc.2011.1515.
18. Birthi P, Sloan P. Interventional treatment of refractory cancer pain. Cancer J. 2013;19(5):390–6. https://doi.org/10.1097/PPO.0b013e3182a631a2 PMID:24051611

 ORCID
ORCID