Luciano González J. y Roberto Moreno E.*
Reve Chil Anest Vol. 42 Número 1 pp. 55-66|doi:
PDF|ePub|RIS
INTRODUCCIÓN
Las mayores expectativas de vida de los pacientes con valvulopatías es el reflejo de mejoras en el diagnóstico (especialmente después de la incorporación de la ecocardiografía), del progreso de las técnicas quirúrgicas y del desarrollo de guías clínicas de evaluación y manejo del paciente valvulópata, aumentando con esto las posibilidades de que este tipo de pacientes accedan a una cirugía que solucione su valvulopatía o enfrenten una cirugía no cardíaca en mejores condiciones.
Cualquier alteración valvular, en sus etapas iniciales es bien tolerada, debido a múltiples mecanismos compensatorios, que en el largo plazo van a generar sobrecargas de presión o volumen, evolucionando de no mediar corrección, a insuficiencia cardíaca.
El manejo durante el perioperatorio, requiere un entendimiento de las alteraciones hemodinámicas y procesos compensatorios de cada una de las valvulopatías, siendo las más frecuentes las de las válvulas mitral y aórtica. La selección de la técnica y drogas anestésicas se debe basar en conseguir metas hemodinámicas específicas, por lo que, se debe conocer sus repercusiones sobre las distintas variables hemodinámicas.
En este artículo se considerarán la estenosis aórtica y mitral, realizando un análisis fisiopatológico y posteriormente mencionando algunas consideraciones de carácter clínico para el manejo de pacientes con alguna de estas estenosis valvulares en caso de enfrentar una cirugía no cardíaca.
ESTENOSIS AÓRTICA (EA)
La EA es la lesión valvular más frecuente en los países desarrollados. Su creciente incidencia se debe al proceso de envejecimiento de la población y a los cambios degenerativos que conllevan un proceso de calcificación del aparato valvular. Si bien se pensaba que éste era un proceso exclusivamente ligado al envejecimiento de la población, hoy existe evidencia que sugiere que el fenómeno de calcificación valvular es secundario a un proceso inflamatorio. Por otro lado, también existe evidencia que demuestra que la EA comparte los mismos factores de riesgo que la enfermedad arterioesclerótica.
La EA es más frecuente en hombres y como se mencionó anteriormente la principal causa no es reumática, sino degenerativa. La válvula aórtica bicúspide constituye una variedad anatómica que se relaciona frecuentemente con EA, cuyo proceso degenerativo es similar al de una válvula normal.
Las lesiones reumáticas suelen presentar fusión de las comisuras y posterior calcificación, limitando la adecuada movilidad de las valvas lo que produce estenosis e insuficiencia valvular. Además, en las lesiones de este origen, el compromiso concomitante de la valvular mitral es frecuente.
Está dado por la clásica triada de angina, síncope o insuficiencia cardiaca congestiva. La aparición de cualquiera de estos síntomas o condiciones marca un mal pronóstico, dado que una vez presente alguno de ellos, la expectativa de vida, de no mediar intervención, es de 2 a 5 años como máximo. Existe evidencia que pacientes con EA moderada (área valvular aórtica de 0,7 – 1,2 cm²) también presentan un riesgo aumentado de presentar complicaciones, lo que se incrementa si aparece alguno de los síntomas antes descritos. Los episodios de angina son el síntoma más frecuente y se presenta en 2/3 de los pacientes con EA crítica. Además, la mitad de los pacientes sintomáticos tienen asociada enfermedad coronaria, por lo que, se requiere un estudio coronario complementario en aquellos pacientes con indicación de recambio valvular.
En la EA se somete al ventrículo izquierdo de manera crónica y progresiva a un aumento de la postcarga, secundario a la disminución del área valvular desde valores normales de 2,5 – 3,6 cm² hasta valores menores a 1 cm². El criterio de obstrucción crítica está dado por un gradiente sistólico transvalvular peak mayor a 50 mmHg, con gasto cardiaco conservado y un área valvular aórtica (AVA) inferior a 0,4 cm². Dado el mal pronóstico de la EA severa (AVA < 0,7 cm²), en pacientes sintomáticos, la cirugía de recambio valvular tiene indicación inmediata. La progresión de la lesión en términos de disminución del área es en promedio 0,1 cm²/año y en términos de gradiente peak de 10 mmHg/año.
La relación entre el gradiente transvalvular y el área valvular aórtica se puede deducir de la fórmula de Gorlin (posteriormente simplificada en la fórmula de Hakki), donde se hace evidente que la reducción del orificio valvular aórtico, suponiendo una mantención del gasto cardiaco requiere de un gran aumento de la presión transvalvular:
GRADIENTE TRANSVALVULAR = DÉBITO CARDIACO / ÁREA VALVULAR
De esta manera, una gradiente transvalvular de 60 mmHg requiere de la generación de una presión de 180 mmHg a nivel ventricular izquierdo para mantener una presión de 120 mmHg a nivel de la aorta. Evidentemente, la generación de los niveles descritos de presión intraventricular requiere de función ventricular normal, de manera que la correlación de un área valvular pequeña con gradientes transvalvulares bajos es un signo de mala función ventricular, independiente de la fracción de eyección medida en dicho paciente. Lo anteriormente señalado es concordante con la observación de que los pacientes con mala función ventricular, bajo gradiente transvalvular, bajo volumen sistólico y bajo gasto cardiaco presentan alta mortalidad quirúrgica y mal pronóstico.
El aumento crónico de las presiones a las que está sometido el ventrículo izquierdo produce hipertrofia ventricular izquierda concéntrica como mecanismo compensatorio (Figura 1), que se explica mediante la fórmula de Laplace: Tensión de la pared ventricular = (P x R)/ 2 h, en donde P corresponde a la presión intraventricular, R el radio interno del ventrículo izquierdo y h el grosor de la pared ventricular.
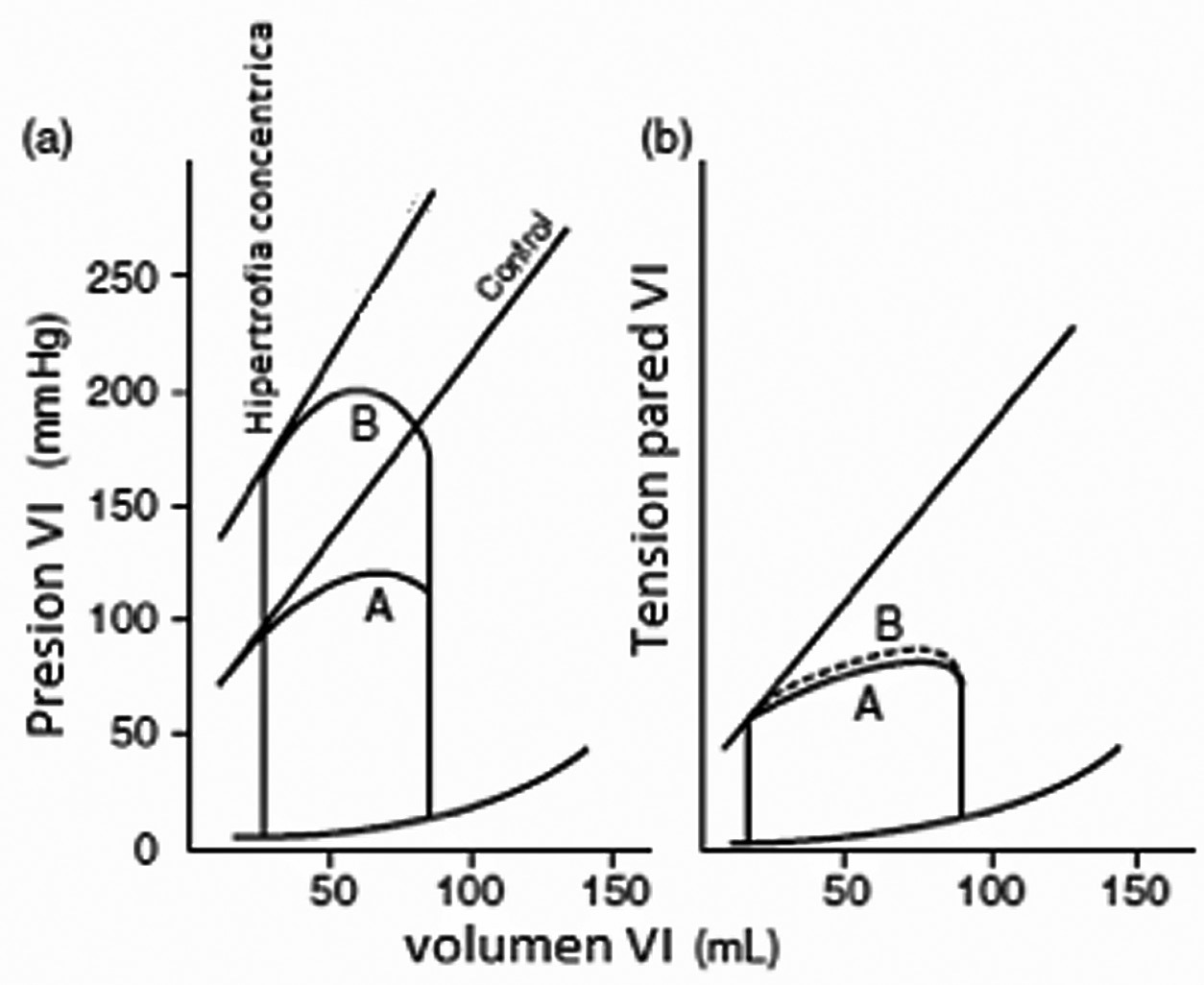
Figura 1 Gráfica (a): Curva presión-volumen ventricular izquierda normal (A), comparada con curva presión-volumen en hipertrofia VI (B): los volúmenes de fin de diástole se mantienen constantes, pero la presión sistólica del VI aumenta importantemente. Gráfica (b): Volumen del VI versus tensión de la pared ventricular: la curva A es normal mientras la curva B muestra el efecto compensatorio de la hipertrofia VI.
-
Implicancia hemodinámica de la hipertrofia ventricular izquierda
La hipertrofia concéntrica del ventrículo izquierdo por multiplicación de sus sarcómeros, produce alteración del diástole secundario a la menor compliance ventricular, desbalance entre aporte y demanda de oxigeno miocárdico y alteración de la contractilidad miocárdica.
La hipertrofia ventricular izquierda tiene algunas implicancias hemodinámicas: disminuye la compliance y, secundariamente, el llene ventricular precoz (pasivo), aumentando la contribución de la contracción auricular en dicho llene (activo) desde un 20% a un 30-40% de la precarga del ventrículo izquierdo. Por consiguiente, la contracción auricular adquiere gran importancia en la mantención del volumen sistólico y gasto cardiaco. En condiciones normales el aporte de la contracción auricular ocurre sin un incremento significativo de las presiones intraauriculares, pero esta situación cambia en pacientes con EA, produciéndose un aumento de dichas presiones independiente del ritmo cardiaco en que se encuentre el paciente. Mediante este mecanismo, en una primera fase se logra aumentar el llene ventricular izquierdo, mantener el volumen sistólico y el gasto cardiaco, pero aumentos ulteriores de las presiones de la aurícula izquierda por encima de 25 mmHg ya no se traducen en sucesivos aumento del llenado ventricular izquierdo, traduciéndose en cambio en aumento de las presiones retrógradas y congestión pulmonar.
-
Riesgo de isquemia miocárdica en pacientes con EA
Como se dijo, la mitad de los pacientes con EA sintomática están asociados a enfermedad coronaria. El riesgo de isquemia miocárdica en el contexto de la EA se produce por factores que producen desbalance entre aporte y demanda de oxígeno:
Entre los factores que aumentan la demanda oxígeno están:
-
El aumento de la masa miocárdica.
-
El aumento de las presiones de trabajo del ventrículo izquierdo: tienen mayor impacto que el aumento de los volúmenes.
-
El aumento de la duración de la fase eyectiva.
Entre los factores que disminuyen el aporte de oxígeno están:
-
El aumento de la presión de fin de diástole del ventrículo izquierdo (PFDVI) por menor compliance ventricular izquierda secundario a hipertrofia.
-
Una menor presión diastólica aórtica.
-
Una menor perfusión coronaria en diástole por aumento de la fase eyectiva del ventrículo izquierdo.
-
La compresión subendocárdica de los vasos coronarios por hipertrofia del ventrículo izquierdo.
-
La ausencia de irrigación coronaria en sístole por el gran aumento de la presión en el ventrículo izquierdo.
-
Efecto de la frecuencia cardiaca
La modificación de la frecuencia cardíaca tiene implicancias clínicas. El aumento de la frecuencia cardiaca tiene como consecuencia una disminución del tiempo diastólico con disminución de la perfusión subendocárdica y riesgo de isquemia. Por contraparte, la bradicardia pudiera aumentar el gradiente transvalvular aórtico, si es que el ventrículo izquierdo intenta mantener el débito a expensas de un aumento del volumen eyectivo, como lo expone la fórmula que determina el gasto cardiaco: GC = FC x VS, donde GC = gasto cardiaco, FC = frecuencia cardiaca y VS = volumen sistólico.
-
Hipertensión pulmonar y falla ventricular derecha
El proceso evolutivo de la enfermedad conduce a hipertensión pulmonar y falla ventricular derecha. La presencia de una EA severa con disminución de la fracción de eyección bajo el 50% del volumen sistólico, implica que nuevos mecanismos compensatorios intenten sostener el gasto cardiaco, involucrando un aumento de las presiones de aurícula izquierda y de arteria pulmonar. Este aumento de la presión de arteria pulmonar produce paulatinamente fibrosis de dicha arteria, de manera que la no resolución de la estenosis deriva en hipertensión pulmonar crónica que finalmente puede hacer claudicar al ventrículo derecho.
-
Indicaciones de recambio valvular aórtico3
Las indicaciones absolutas de recambio valvular aórtico se resumen en la siguiente lista:
-
EA severa sintomática (angina, síncope o insuficiencia cardiaca congestiva).
-
EA severa en pacientes que serán sometidos a revascularización miocárdica.
-
EA severa en pacientes que serán sometidos a cirugía de reparación o recambio de otra válvula o a cirugía de aorta torácica.
Existe además un grupo de condiciones en que dicha indicación es relativa:
-
EA moderada en pacientes que serán sometidos a revascularización, cirugía de la aorta o de otra válvula.
-
EA severa asintomática con fracción de eyección menor a 50%, inestabilidad hemodinámica en el ejercicio o episodios de taquicardia ventricular.
-
Cirugía no cardiaca en el paciente con EA 3
Según las normas del American College of Cardiology/American Heart Association (ACC/AHA) la EA severa es una condición cardiaca activa, por lo que, estos pacientes tienen indicación de cirugía de recambio valvular previo a cualquier otro tipo de cirugía, a menos que se trate de una urgencia o emergencia. Los pacientes con EA leve o moderada que requieran cirugía electiva deben ser evaluados de acuerdo a las normas antes señaladas, resumidas en la Tabla 1.
Tabla 1 Conducta de evaluación postulada por la ACC/AHA, según severidad de la estenosis valvular y cirugía NO cardíaca
|
¿Tiene al menos 1 de los siguientes criterios de severidad? |
¿La cirugía NO cardíaca es una emergencia o urgencia? |
Cirugía que se debe resolver 1º |
| Disnea III/IV
Disnea progresiva Síncope con ejercicio Insuficiencia cardiaca AVM < 1 cm2 |
||
|
SI |
SI |
NO Cardiaca |
|
SI |
NO |
Cardiaca |
|
NO |
SI |
NO Cardiaca |
|
NO |
NO |
NO Cardiaca |
Si la condición de urgencia obliga a someter al paciente a una cirugía no cardiaca, previo a la resolución de su patología valvular, es necesario poner atención en una serie de variables cuyo manejo puede influir en los resultados de morbimortalidad final.
-
Objetivos hemodinámicos perioperatorios de un paciente portador de EA 1 -3
De la fisiopatología de la EA se deriva una serie de objetivos hemodinámicos definidas para esta valvulopatía:
-
Mantener el ritmo sinusal, recordando que este aporta hasta un 40% del llene ventricular.
-
Frecuencia cardiaca entre 70 y 90 latidos por minuto.
-
Mantener precarga normal alta durante la cirugía.
-
Mantener la postcarga para garantizar la perfusión coronaria.
-
Mantener la contractilidad ventricular.
En ausencia de insuficiencia cardiaca, una adecuada premedicación evita los efectos deletéreos que produce la ansiedad, como la taquicardia, que aumenta el consumo de oxígeno y el gradiente transvalvular. Por otra parte, una sedación excesiva puede provocar vasodilatación con disminución de la precarga y la postcarga, lo que pudiera desestabilizar un estado hemodinámico apenas compensado.
No existe una técnica anestésica superior a otra, por lo que, la elección de los fármacos (endovenosos o inhalatorios), se debe basar en la consecución de los objetivos hemodinámicos para la valvulopatía.
Se debe evitar aquellos anestésicos con propiedades cardiodepresoras. Por ello, el etomidato y algunos opioides como el fentanilo o sufentanil son adecuados. Sin embargo, se debe recordar que, si bien estas drogas no tienen efectos inótropos negativos directos, si pueden producir hipotensión por la disminución del tono simpático.
El propofol puede causar severa hipotensión y debe usarse con precaución. Los agentes halogenados como el isofluorano, sevoflurano y desfluorano presentan un leve efecto cardiodepresor y un efecto vasodilatador variable, por lo que en pacientes portadores de EA y en especial en pacientes con mala función ventricular, se deben usar con precaución. Este efecto hipotensor permite, conjuntamente con el uso de opioides, disminuir la hipertensión que provoca el estímulo quirúrgico, haciendo menos necesario el uso de nitroglicerina o nitroprusiato de sodio. Sin embargo, se debe recordar que en este tipo de valvulopatía existe débito fijo, por la incapacidad del ventrículo de elevar dicho parámetro en respuesta a la vasodilatación, por lo tanto, lejos la principal complicación hemodinámica que puede presentarse es la vasodilatación descontrolada, ya que ésta comprometerá la perfusión orgánica y en particular la perfusión miocárdica.
En consecuencia, es mucho más frecuente el uso de vasoconstrictores que el uso de vasodilatadores, como recurso para mantener la hemodinamia estable. Se debe considerar además que ésta es la única condición cardiaca en que el uso de vasoconstrictores no produce un aumento del stress de la pared ventricular ni un aumento del consumo de oxígeno, puesto que la postcarga se encuentra determinada por la válvula estrecha y no por la resistencia vascular sistémica.
En el caso de requerirse vasodilatadores y tratarse de un paciente con cardiopatía coronaria concomitante, la nitroglicerina posee la ventaja de ser un vasodilatador coronario que actúa especialmente sobre los terrenos isquémicos y subendocárdicos, por lo cual es la droga de elección.
Las benzodiacepinas son utilizadas en cirugía cardiaca y su uso permite evitar el recuerdo intraoperatorio, pero se deben usar con cautela ya que combinadas con opioides pueden provocar gran vasodilatación periférica e hipotensión. De la misma manera los opioides combinados con protóxido de nitrígeno (N2O) son cardiodepresores en pacientes coronarios y también elevan la resistencia vascular pulmonar por lo que, si existe aumento elevación previa de este parámetro, deben ser utilizados con el debido cuidado.
Dado los efectos derivados de la reducción de la precarga, postcarga y frecuencia cardiaca, con la consiguiente hipotensión, muchos autores consideran contraindicadas las técnicas neuroaxiales. Sin embargo, los pacientes con compromiso leve o moderado de la válvula aórtica, pueden tolerar estas técnicas sin incidentes si se realiza un bloqueo progresivo con dosis incrementales de anestésicos locales 6 ,7 .
Por otro lado, si bien estas técnicas de anestesia regional se consideran contraindicadas en pacientes portadores de EA severa, la verdadera contraindicación no es a la técnica anestésica propiamente tal sino sus efectos hemodinámicos, por lo que, en caso de que la anestesia general reporte excesivos riesgos para algún paciente, es posible realizar una anestesia neuroaxial teniendo la precaución de manejar la precarga, postcarga y frecuencia cardiaca en rangos adecuados, en base al uso continuo de drogas vasoactivas.
En el año 2008 Nishimura et al 4 , en una actualización sobre las recomendaciones del manejo de la endocarditis infecciosa y su profilaxis preoperatoria, concluyen que en el caso de la EA no está indicada la profilaxis antibióticas para ningún tipo de cirugía.
El paciente portador de una EA debe ser monitorizado con electrocardioscopia de 5 derivaciones, de manera de obtener al menos dos trazados continuos de diferente derivada, lo cual permitirá maximizar la detección de isquemia. Dentro de éstas, debe estar incluida la derivada V5 como monopolar o su equivalente bipolar (CS5, CM5 o CB5), dada su sensibilidad para detectar isquemia del ventrículo izquierdo.
Se debe tener en cuenta que los cambios isquémicos a la electrocardioscopia son en ocasiones difíciles de identificar ya que la hipertrofia ventricular izquierda per se produce alteraciones del segmento ST y T que pueden enmascarar un cambio intraoperatorio. Por tal motivo, un registro previo a la cirugía es de utilidad para su comparación.
La derivación D2 dado su excelente visualización de la onda P, también puede ser en extremo útil debido a la gran dependencia al ritmo sinusal que presenta la hemodinamia de estos pacientes, como se señaló previamente.
Dentro de la monitorización hemodinámica es controversial la medición de presión venosa central (PVC), ya que ésta es errática en estimar las condiciones de llenado ventricular izquierdo en corazones con compliance disminuida y puede subestimar de manera significativa la PFDVI.
El catéter de arteria pulmonar a través de la medición de presión de capilar pulmonar (PCP), al igual que el catéter venoso central, puede subestimar la PFDVI y el volumen de fin de diástole del ventrículo izquierdo (VFDVI), no dando cuenta de su nivel de precarga real. Sin embargo, el uso de dicho catéter permite la realización de otras mediciones hemodinámicas cuyo manejo estricto puede contribuir a obtener un mejor resultado final. Dentro de estas mediciones se encuentran variables hemodinámicas como gasto cardiaco, resistencia vascular sistémica, resistencia vascular pulmonar y variables respiratorias como saturación venosa de oxigeno mixto (Svo2), y variables derivadas de transporte y consumo de oxígeno.
La monitorización de la presión arterial en forma invasiva, no sólo otorgará una medición continua de este parámetro, sino también la interpretación de la curva de registro, cuyas variables por si solas no permiten obtener conclusiones fehacientes, pero que sumadas a otros datos, permiten una visión global del estado hemodinámico del paciente.
Debido a las limitaciones antes expuestas en los métodos de monitoreo invasivo mencionados, la ecocardiografía transesofágica asoma como un recurso de monitoreo y diagnóstico de extrema utilidad en este tipo de pacientes, permitiendo evaluar:
-
Volemia.
-
Motilidad global (valoración de la contractilidad general y determinación de fracción de eyección).
-
Motilidad segmentaria (detección de isquemia miocárdica).
-
Volumen sistólico y diastólico.
-
Gasto cardiaco.
-
Presión de arteria pulmonar.
Además, permite la evaluación directa del funcionamiento de la válvula enferma, acceder al cálculo de su área, ponderar el gradiente transvalvular y confirmar o descartar la coexistencia de insuficiencia con sus implicancias en el manejo hemodinámico.
Dependiendo de la cirugía a la que será sometido el paciente, se debe considerar además el uso de una sonda urinaria para medir diuresis y realizar un adecuado balance de aportes y pérdidas, dado lo vulnerables que son este tipo de pacientes tanto a las condiciones de hiper como de hipovolemia.
-
Postoperatorio
El posoperatorio de la cirugía de recambio valvular aórtico se debe realizar en una unidad de cuidados intensivos cardioquirúrgicos. El postoperatorio de cirugía no cardiaca en pacientes portadores de EA, dependerá de las condiciones particulares del paciente, tipo de cirugía y resultado del procedimiento realizado. Los pacientes con mayor compromiso valvular deben ser manejados en una unidad de pacientes críticos. Los objetivos hemodinámicos que se señalaron para el intraoperatorio deben mantenerse vigentes en el postoperatorio a lo que se debe agregar el manejo adecuado del dolor.
ESTENOSIS MITRAL (EM)
-
Introducción
La EM con significancia clínica generalmente es secundaria a enfermedad reumática. El período inicial donde el área valvular mitral (AVM) es normal (4 a 6 cm2) puede llegar a durar varias décadas y es caracterizado por la usencia de síntomas; puede aparecer los primeros síntomas cuando el AVM se encuentra entre 1,5 y 2 cm2 y se suma un aumento de la frecuencia cardíaca ante el ejercicio, fiebre o embarazo, o se desarrolla una fibrilación auricular; cuando el AVM es menor de 1,5 cm2 aparecen los síntomas en reposo o con ejercicio leve.
-
Cuadro clínico
La disnea es el síntoma cardinal, lo que refleja un aumento de las presiones de la aurícula izquierda y de congestión pulmonar secundaria; posteriormente aparecen las palpitaciones, que generalmente se deben a presencia de fibrilación auricular (Tabla 2).
Tabla 2 Presiones de las cavidades izquierdas y gasto cardíaco en estenosis mitral; los pacientes con EM severa no pueden hacer ejercicio
|
Grado de Estenosis |
Área Valvular (cm2) |
Presión de Aurícula Izquierda |
Presión de Arteria Pulmonar |
Gasto Cardíaco |
|||
|
Reposo |
Ejercicio |
Reposo |
Ejercicio |
Reposo |
Ejercicio |
||
| Normal |
4 – 6 |
N |
N |
N |
N |
N |
N |
| Leve |
1,5 – 2,5 |
N |
|
N |
|
N |
|
| Moderada |
1,1 – 1,5 |
|
|
|
|
N |
|
| Severa |
0,6 – 1,0 |
|
No puede |
- |
No puede |
- |
No puede |
En este artículo se tratará temas relacionados con los cuidados perioperatorios de los pacientes que, teniendo una estenosis mitral, deben ser sometidos a una cirugía no cardíaca ya sea electiva o de urgencia o emergencia.
La EM reumática resulta en un engrosamiento de los velos valvulares y la fusión de las comisuras; posteriormente hay calcificación de los velos, de las cuerdas tendíneas y de los músculos papilares. Estos cambios se combinan para determinar una reducción del AVM y así limitar el flujo diastólico desde la aurícula izquierda (AI) hacia el ventrículo izquierdo (VI). Como resultando de esta “obstrucción fija” del flujo de entrada al VI, suben las presiones de la AI, limitando el drenaje venoso pulmonar y generando un aumento de las presiones de la arteria pulmonar. Si esta hipertensión del territorio vascular pulmonar tiene un comportamiento crónico, desencadenará incrementos de la presión y del volumen de fin de diástole del ventrículo derecho (VD) y en algunos pacientes aparecerán signos de falla cardíaca derecha como ascitis y edema periférico. El crecimiento de la AI es casi un hallazgo universal en los pacientes con EM avanzada y es el principal factor de riesgo para el desarrollo de fibrilación auricular (FA).
Los pacientes con EM toleran muy mal los aumentos de la frecuencia cardíaca, ya que a la estenosis valvular (limitación del flujo de entrada al VI), se suma la disminución del período diastólico (llene ventricular); por esto, para mantener el llene ventricular en estas condiciones, el corazón debe aumentar la velocidad de flujo. Esta apreciación nuevamente se comprueba a través de la fórmula de Gorlin previamente descrita.
La taquicardia precipita la aparición de disnea. Incluso en los pacientes con FA, el aumento de la frecuencia ventricular es más deletéreo que la pérdida del ritmo sinusal (contracción efectiva de la AI). De este modo, la meta del tratamiento de los pacientes con EM y FA, es el control de la frecuencia ventricular, lo que se logra fundamentalmente con el uso de betabloqueadores, antagonistas del calcio no dihidropiridinicos y digitálicos o la combinación de estas drogas, para mantener frecuencias ventriculares cercanas a 80 lpm en reposo y cercanas a 100 lpm durante el ejercicio suave. La amiodarona debe ser reservada para algunos pacientes con control refractario de la frecuencia debido a sus severos efectos adversos extra cardíacos (disfunción tiroidea, bradicardia y fibrosis pulmonar) 9 .
LA EM determina una reducción de la reserva de precarga del VI, como se puede ver en la curva presión/volumen (Figura 2). La reducción del volumen sistólico es acompañada de una disminución del volumen y presión de fin de diástole del VI (VFDVI / PFDVI).
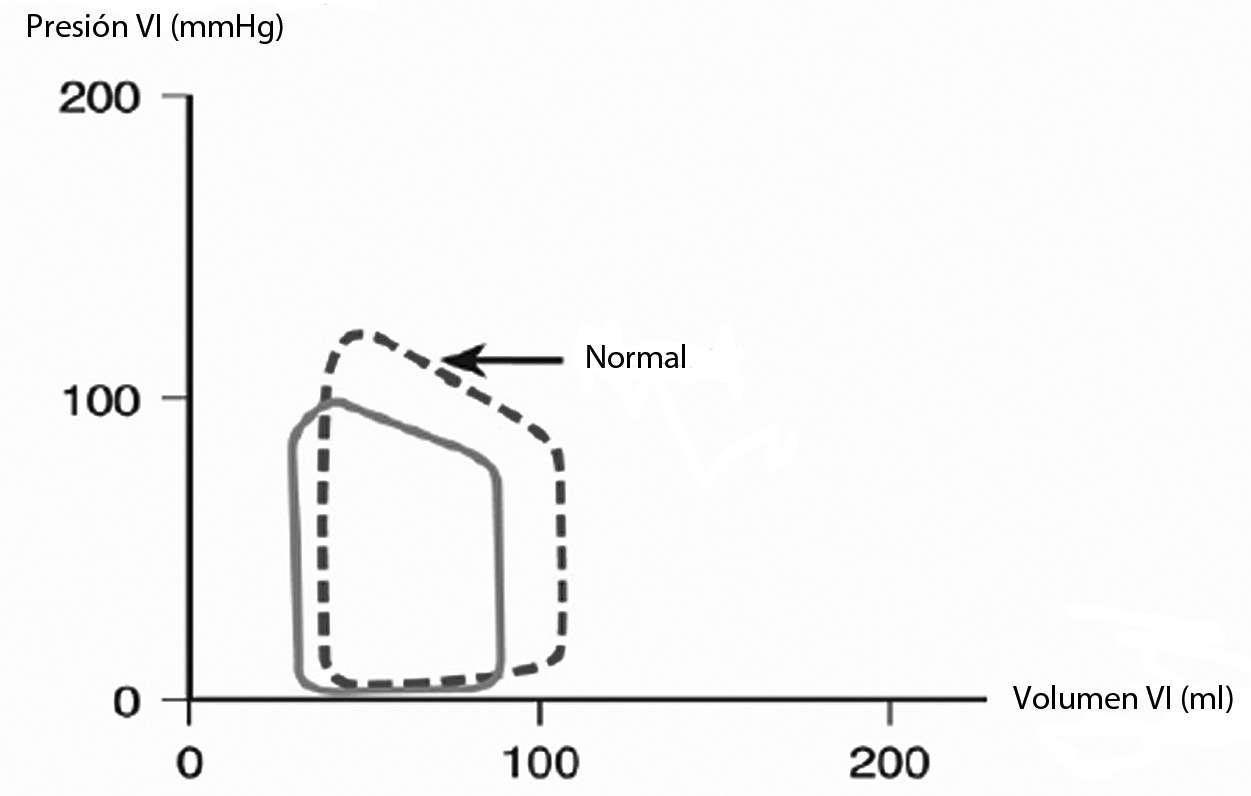
Figura 2 Curva Presión / Volumen de VI en estenosis mitral.
-
Estudio y preparación preoperatoria
Dentro del estudio preoperatorio, la ecocardiografía es el examen de elección para hacer el diagnóstico. El uso del doppler, permite de manera no invasiva y con exactitud, medir la gradiente de presión transvalvular y la clasificación según el AVM 9 . La ecocardiografía también es de extrema utilidad en la ponderación de otras variables importantes como la función sistólica de ambos ventrículos y la estimación de la presión de arteria pulmonar 2 –3 .
-
¿Cuándo se debe resolver quirúrgicamente la Estenosis Mitral?
Cuando los síntomas son severos, fundamentalmente una capacidad funcional clase III y IV según la clasificación de la New York Heart Association 10 , ya que el pronóstico empeora con tratamiento médico exclusivo 2 .
En los casos de EM moderada (AVM entre 1 – 1,5 cm2) con hipertensión pulmonar (HP) significativa (presión sistólica de arteria pulmonar mayor a 50 mmHg), la intervención quirúrgica debe ser considerada al igual que en todos los casos en que el AVM es menor a 1,0 cm2.
En los casos en que no exista gran calcificación o engrosamiento de los velos ni del aparto subvalvular y en que no exista insuficiencia mitral asociada, es posible considerar una valvuloplastía percutánea con balón 5 .
-
¿Qué hacer si se postula una cirugía no cardíaca en un paciente con EM?
Las variables que deben tenerse presente son la severidad de la EM, su repercusión en la capacidad funcional y si la cirugía no cardíaca que se pretende hacer es electiva o una urgencia/emergencia.
Las guías norteamericanas de evaluación cardiovascular preoperatoria para cirugía no cardíaca, catalogan la estenosis mitral sintomática (disnea progresiva en reposo o con ejercicio suave, síncope con el ejercicio o insuficiencia cardíaca), como una condición cardíaca activa (CCA), lo que implica que en caso de ser necesaria una cirugía no cardíaca que no revista urgencia o emergencia, debe resolverse la patología valvular de forma primaria5 (Figura 3).
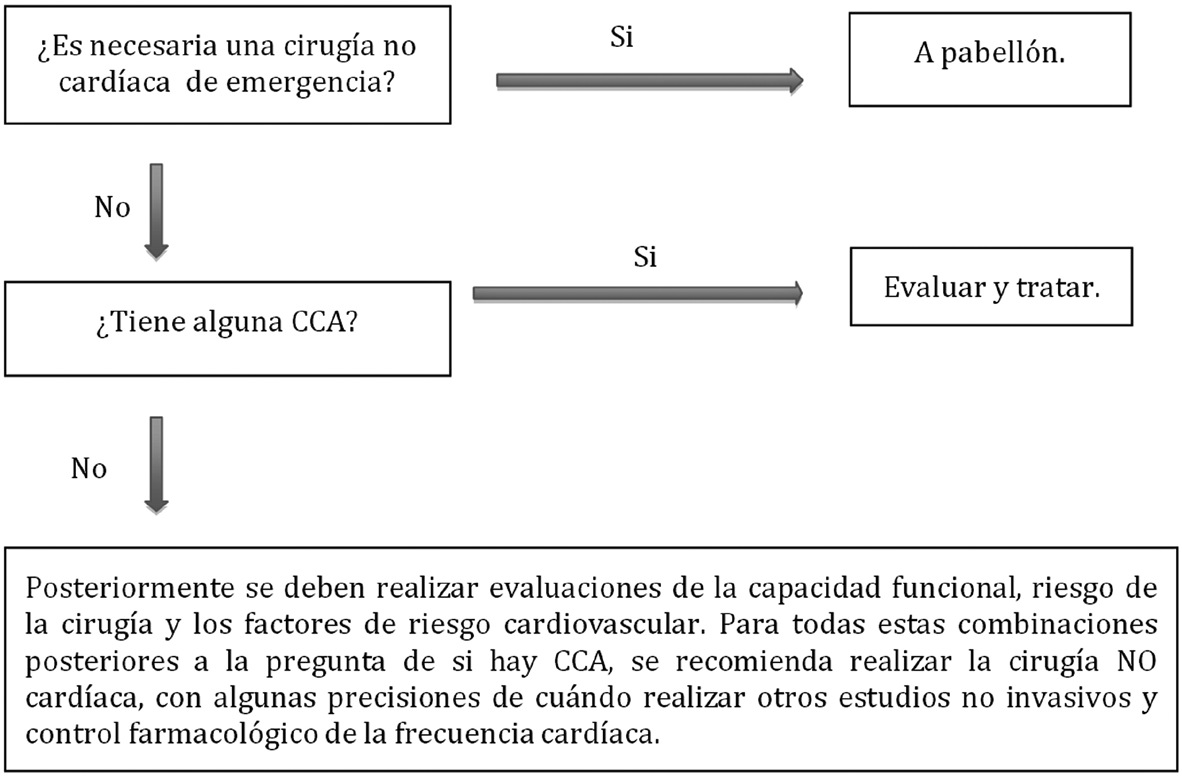
Figura 3 Evaluación para cirugía no cardíaca para condiciones cardíacas activas (CCA).
En la Tabla 1 se resumen las probables combinaciones entre las variables que se deben tomar en cuanta durante la evaluación preoperatoria y el tipo de cirugía no cardíaca y se sugiere una conducta basada en las guías anteriormente citadas 5 . En general las patologías no cardíacas serán resueltas de manera primaria en aquellos pacientes sin síntomas severos y con un AVM mayor a 1 cm2 y en todos los pacientes que requieran una intervención quirúrgica de urgencia o emergencia, independientes de sus síntomas o AVM.
-
Consideraciones anestésicas
La resolución de la cirugía no cardíaca en un paciente con EM implica desafíos anestésicos interesantes como el estudio y optimización preoperatoria, la técnica anestésica, la monitorización y los cuidados postoperatorios inmediatos.
En la evaluación y optimización preoperatoria (Tabla 3) es fundamental valorar la repercusión sistémica de la EM e identificar desencadenantes de taquicardia y de HP 17 para realizar su corrección en forma precoz.
Tabla 3 Evaluación y optimización preoperatoria
| Evaluación Preoperatoria | Optimización Preoperatoria |
| Signos vitales (FC) | Corregir desencadenantes de taquicardia: |
| Capacidad funcional previa | – Anemia |
| ECG (ritmo cardíaco) | – Dolor y ansiedad |
| Tipo de cirugía no cardiaca | – Fiebre |
| Ecocardiograma
(AVM, FSVI/FSVD, PSAP) |
– Deshidratación |
| Corregir desencadenantes de HP: | |
| Laboratorio: | – Anemia |
| – Hematocrito | – Hipoxia |
| – Coagulación | – Hipercapnia |
| – Función renal y ELP | – Acidosis |
| – Gasometría arterial | – Dolor y Ansiedad |
| FC: Frecuencia cardiaca; ECG: Electrocardiograma; AVM: Área valvular mitral; FSVI: Función sistólica ventrículo izquierdo; FSVD: función sistólica ventrículo derecho; PSAP: Presión sistólica arteria pulmonar; ELP: electrolitos plasmáticos; HP: Hipertensión Pulmonar. | |
La monitorización previa a la administración de la anestesia debe contar con aquellos elementos habituales para todo tipo de anestesia (electrocardioscopia, oximetría de pulso, capnografía), considerando en este caso la conveniencia de realizar monitoreo de presión arterial invasivo y al menos de presión venosa central (PVC), recodando que en este tipo de valvulopatía existen los mismo reparos de este último parámetro hemodinámico, que los descritos para la estenosis aórtica.
En este caso surge el mismo reparo de utilizar o no un catéter de arteria pulmonar, atendiendo a las mismas utilidades descritas para el monitoreo de pacientes portadores de estenosis aórtica.
Del mismo modo, el monitoreo y diagnóstico ecocardiográfico intraoperatorio por vía transtorácica o transesofágica, permitirá obtener datos de suma relevancia como función ventricular, gradiente transvalvular, estado de volemia, coexistencia o no de insuficiencia valvular, débito cardiaco, presión de arteria pulmonar sistólica.
La medición rutinaria de temperatura central y diuresis, dependerá de la ponderación por parte del anestesista de la condición del paciente y de la cirugía programada.
Durante el perioperatorio de un paciente portador de EM, deben cumplirse ciertos objetivos hemodinámicos claras para el manejo de estos pacientes (Tabla 4). Estos objetivos se pueden resumir en tres pilares fundamentales, que son 3 :
-
Prevenir la taquicardia y corregirla inmediatamente cuando se presente.
-
Mantener normal o levemente aumentada la precarga ventricular.
-
Evitar factores que agraven la hipertensión pulmonar .
Tabla 4 Metas hemodinámicas en pacientes con EM para una cirugía no cardíaca 2 ,3
| Metas Hemodinámicas |
| – Frecuencia cardiaca baja |
| – Contractilidad normal |
| – Postcarga normal |
| – Precarga normal o levemente aumentada |
Dentro de las medidas para prevenir un aumento de la frecuencia cardiaca, debe considerarse el control de la ansiedad preoperatoria, que se puede obtener con narcóticos o benzodiacepinas en dosis bajas. Sin embargo, una sedación excesiva puede ser contraproducente por el potencial riesgo de hipoventilación, con la consiguiente hipercapnia e hipoxia, que empeorará la HP que generalmente acompaña a la EM. Cuando se opta por una ansiolisis farmacológica preoperatoria, se debe considerar una apropiada monitorización y suplementación de oxígeno.
Los medicamentos que el paciente recibía en forma crónica para controlar la frecuencia cardíaca deben mantenerse (digitálicos, beta bloqueadores, antagonistas de los receptores de calcio no dihidropiridínicos o amiodarona)2-3. Dosis adicionales de estos medicamentos pueden ser requeridas en el intraoperatorio, particularmente para mantener la frecuencia ventricular controlada en el caso de los pacientes con FA 2 , 3 . Si la frecuencia ventricular, en caso de una FA, se eleva a niveles que generen hipotensión arterial, debe manejarse con cardioversión eléctrica bifásica externa con 120-200 J 14 .
La anestesia basada en opioides es una buena alternativa para evitar episodios de taquicardia intraoperatoria 3 .
Se deben tratar de evitar relajantes neuromusculares que puedan desencadenar aumentos de la frecuencia cardíaca como la succinilcolina, el atracurio y el parcuronio, y preferir los que no la modifican como el vecuronio o los que la modifican sólo levemente como el rocuronio.
La mantención de la precarga es otra meta importante en el manejo de este tipo de pacientes que tienen una obstrucción fija del llene ventricular izquierdo. Se debe realizar un apropiado reemplazo de las pérdidas sanguíneas y por exposición quirúrgica de los tejidos, con el fin de evitar estados de hipovolemia. También se debe evitar la venodilatación inducida por los anestésicos usados (inhalatorios, intravenosos y/o técnicas neuroaxiales). Así, es recomendable el ajuste de dosis de drogas intravenosas por peso ideal cuando corresponda, teniendo especial cuidado con la mezcla “inductor-opioides-benzodiacepinas-halogenados” en pacientes hemodinámicamente inestables, de edad avanzada, deshidratados, con función sistólica ventricular deteriorada o con una mala capacidad funcional preoperatoria.
Debido al riesgo de vasodilatación brusca con caída del gasto cardíaco que ocurre con la anestesia neuroaxial con dosis única, es que se prefieren las técnicas neuroaxiales continuas (peridural, combinada espinal/peridural o espinal), con las cuales se puede titular la instauración del bloqueo simpático y por lo tanto de la vasodilatación. Estas técnicas aparecen como una alternativa atractiva, luego de múltiples reportes de su uso seguro en pacientes con EM con HP severa para trabajo de parto y operación cesárea 11 –13 .
La monitorización de la precarga se puede hacer con cálculos extraídos de la curva de presión arterial, mediante la variación de presión de pulso o la variación de la presión sistólica 15 , teniendo en consideración que para que la medición sea confiable, el paciente debe estar en ventilación mecánica invasiva con volúmenes corrientes de al menos 8 ml·kg-1 de peso ideal, sin esfuerzo inspiratorio, sin requerimientos de PEEP mayores a 10 cmH2O y no debe encontrase en FA 15 .
El uso de catéter de arteria pulmonar puede ser de gran utilidad para conocer variables como el gasto cardíaco, la PSAP y la resistencia vascular sistémica, pero pobre en poder identificar hipovolemia y la respuesta a cargas de volumen, debido, probablemente, a que la compliance ventricular no es lineal 16 y la presión de capilar pulmonar se ve sobreestimada en presencia de HP 3 .
El uso de ecocardiografía transesofágica intraoperatoria es una poderosa herramienta que permite evaluar la precarga a través de la medición del volumen de fin de diástole de ambos ventrículos, además del estado de la contractilidad global y segmentaria, entre otras variables 3 ; lamentablemente es una tecnología costosa y de baja disponibilidad, tanto del equipamiento como de los profesionales capacitados en su uso.
Los estados de hipervolemia también pueden ser deletéreos para los pacientes con EM, ya que puede precipitar o agravar la congestión pulmonar 3 .
Muchos de los pacientes con EM presentan HP. La técnica anestésica elegida debe evitar cualquier incremento de la resistencia vascular pulmonar que pudiese determinar un deterioro de la función ventricular derecha (Tabla 5) 17 . Es recomendable un meticuloso control de los parámetros ventilatorios con gases arteriales seriados, evitando la hipercapnia, hipoxia yacidosis, entre los múltiples desencadenantes de HP que existen en el perioperatorio.
Tabla 5 Desencadenantes y mecanismo de aumento de la resistencia vascular pulmonar 17
| Desencadenante | Mecanismo |
| Hipovolemia |
Disminución del radio de los vasos pulmonares, de la resistencia al flujo sanguíneo |
| Hipercapnia / Acidosis |
Los hidrogeniones tienen un efecto vasoconstrictor pulmonar (precapilar) directo |
| Hipoxia (PaO2 < a 60 mmHg) |
La hipoxia alveolar desencadena vasoconstricción pulmonar hipóxica (VCPH) |
| Sobredistención alveolar |
Compresión de los vasos pulmonares, de la resistencia al flujo sanguíneo |
| Colapso pulmonar |
Genera hipoxia alveolar (ver en el texto explicación de hipoxia) |
| Vasoconstrictores pulmonares |
Disminución del radio de la vasculatura pulmonar, de la resistencia al flujo sanguíneo |
| Vasodilatadores Sistémicos |
Disminución de la precarga, radio de los vasos pulmonares, resistencia al flujo sanguíneo |
| Anestesia superficial |
Actividad simpática exagerada con vasoconstricción pulmonar |
| Analgesia inadecuada |
Actividad simpática exagerada con vasoconstricción pulmonar |
| Ansiedad |
Actividad simpática exagerada con vasoconstricción pulmonar |
| Hipotermia |
Actividad simpática exagerada con vasoconstricción pulmonar |
En el año 2008 Nishimura et al 4 , en una actualización sobre las recomendaciones del manejo de la endocarditis infecciosa y su profilaxis preoperatoria, concluyen que en el caso de la EM no está indicada ninguna antibioprofilaxis para ningún tipo de cirugía.
Se debe planificar el postoperatorio en unidad de cuidados intensivos, ya que es en este período donde ocurre la máxima mortalidad 11 – 13 , 17 .
-
Algunas consideraciones de las embarazadas con EM
La EM es la enfermedad cardíaca significativa más prevalente de la embarazada, con una mortalidad materna de 15-20%, cuando la EM es grave 11 . En el contexto de una EM, los cambios fisiológicos del embarazo (Tabla 6) resultan deletéreos por su mayor repercusión hemodinámica.
Tabla 6 Cambios fisiológicos durante el embarazo 11 –13
| Gasto cardíaco 40-50% | Volemia 45% |
| Volumen sistólico 30% | Resistencia vascular sistémica 20% |
| Frecuencia cardíaca 20% | Consumo oxígeno 30-40% |
Las consideraciones en la asistencia de la embarazada durante el parto o cesárea, se resumen en no desencadenar estados hemodinámicos nocivos para la madre con EM y para el feto (Tabla 7):
Tabla 7 Situaciones a evitar durante el trabajo de parto y cesárea 11 –13
| Aumento de la frecuencia cardíaca | Inotropismo negativo | Disminución del retorno venoso |
| Intubación/extubación | Halogenados | Compresión aorto-cava |
| Dolor | Asociar opioides/benzodiacepinas | Uso de fórceps para evitar valsalva |
| Evitar las siguientes drogas:
– Epinefrina – Efedrina – Ketamina – Óxido nitroso |
Elegir técnica neuroaxial continua | |
| del retorno venoso por ventilación mecánica (presión positiva) |
De acuerdo a la Tabla 7, la técnica anestésica de elección en una embarazada portadora de EM severa, inclusive si presenta HP severa, es la neuroaxial continua (peridural, combinada espinal/peridural y espinal continua), con dosis reducidas de anestésico local asociados a opioides 11 , que proveen una instalación lenta y titulada, dando tiempo a la corrección de complicaciones hemodinámicas, secundarias a la vasodilatación por bloqueo simpático 11 – 13 , mediante co-carga con cristaloides o coloides (persiste controversia) y dosis bajas o infusión continua de fenilefrina 13 . No se debe seguir estrictamente las recomendaciones sobre fármacos anticoagulantes y antitrombóticos en relación a anestesia regional 18 , ya que las pacientes con EM y FA se encuentran anticoaguladas y podrían estar bajo los efectos de dichas drogas al momento de iniciar el trabajo de parto. Toda técnica neuroaxial se debe suplementar con oxígenoterapia 13 .
Cuando se decide una anestesia general, por condición materna o contraindicación de anestesia regional, se debe considerar una inducción en secuencia rápida con etomidato, remifentanil y succinilcolina, y usar beta bloqueo previo a la intubación y extubación traqueal, de preferencia esmolol, por su corta latencia y tiempo de acción, pudiendo existir un breve efecto residual en el recién nacido, por lo cual el neonatólogo debe ser avisado del uso de beta bloqueadores en la madre 13 . Se recomienda hacer la mantención de la anestesia general con mezcla de oxígeno/aire, remifentanil, vecuronio, halogenados en dosis bajas (fracción espirada de 0,7).
Después del parto, la oxitocina nunca se debe pasar en un bolo, ya que de manera brusca disminuye la resistencia vascular sistémica y aumenta la resistencia vascular pulmonar, por lo que, se debe iniciar una infusión de oxitocina a 40-80 miliU/min hasta conseguir la contracción uterina 19 . Drogas de uso clínico para las hemorragias post parto, como la metilergometrina (methergin) 19 y el 15-metilprostaglandina F2α (carboprost) 20 , provocan hipertensión arterial, taquicardia severa y aumentan la resistencia vascular pulmonar.
Referencias
- James A Di Nardo. Anesthesia for Cardiac Surgery. Third edition; Anesthesia for Valvular Heart Disease. 129-166.
- Joel A Kaplan. Essentials of Cardiac Anesthesia. First Edition; Valvular Heart Disease: Replacement and Repair. David J. Cook, Philippe R. Housmans, Kent H. Rehfeldt: 417-454.
- Joel A Kaplan. Cardiac Anesthesia The Echo Era. Sixth edition; Valvular Heart Disease: Replacement and Repair. David J. Cook, Philippe R. Housmans, Kent H. Rehfeldt: 589-633.
- Nishimura RA, Carabello BA, Faxon DP, et al. Guideline update on valvular heart disease: focused update on infective endocarditis: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines endorsed by the Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2008 Aug 19; 52(8): 676-685.
- Fleisher LA, Beckman JA, Brown KA, et al. Guidelines ACC/AHA on perioperative cardiovascular evaluation and care for noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines on Perioperative Cardiovascular Evaluation for Noncardiac Surgery). J Am Coll Cardiol 2007; 50: e159-241.
- http://www.scartd.org/arxius/cardiopata0708.pdf. Manejo anestésico del paciente Cardiópata Candidato a Cirugía no Cardiaca. Fernández Núñez JA. Hospital de la Santa Creu i Sant Pau de Barcelona.
- Rojas-Pérez E. Anestesia para la embarazada con estenosis e insuficiencia aórtica. Revista Mexicana de Anestesiología 2007; 30: S276-281.
- Camm AJ, Kirchhof P, Lip GYH, Schotten U, Savelieva I, Ernst S, et al. Guidelines for the management of atrial fibrillation: The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). European Heart Rhythm Association, European association for Cardio-Thoracic Surgery. European Heart J 2010; 31: 2369-2429.
- Popovic AD, Stewart M, Stewart M. Echocardiographic evaluation of valvular stenosis: The gold standard for the next millenium?. Echocardiography 2001; 18: 59.
- The Criteria Committee of the New York Heart Association. Nomenclature and Criteria for Diagnosis of Diseases of the Heart and Great Vessels. 9th ed. Boston, Mass: Little, Brown & Co; 1994; 5: 253-256.
- Kocum, et al. Epidural Anesthesia for Cesarean Section in a Patient With Severe Mitral Stenosis and Pulmonary Hypertension. Letters To The Editor. J of Cardioth and Vasc Anesth, Vol 24, Nº 6 (December), 2010: 1022-1028.
- Pan P, D´Angelo R. Anesthesic and Analgesic Management of Mitral Stenosis During Pregnancy. Reg Anesth and Pain Med, Vol 29, Nº 6 (November-December), 2004: 610-615.
- Kuczkowski KM, Van Zundert A. Anesthesia for Pregnant Women With Valvular Heart Disease: The State of the Art. J Anesth 2007; 21: 252-257.
- Field JM, Hazinski MF, Sayre MR, et al. Part 1: Executive Summary: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation, 2010 Nov 2; 122 (18 Suppl 3): S640-656.
- Michard F. Changes in arterial pressure during mechanical ventilation. Anesthesiology 2005; 103 :419-428.
- Kumar A, Anel R, Bunnell E, et al: Pulmonary artery occlusion pressure and central venous pressure fail to predict ventricular filling volume, cardiac performance, or the response to volume infusion in normal subjects. Crit Care Med 2004; Mar; 32(3): 691-699.
- Fermandois M, López R, León P, Lema G. Hipertensión pulmonar y el paciente quirúrgico: Estrategias de manejo actual. Rev Med Chile 2010; 138: 496-503.
- Horlocker TT, et al. Regional Anesthesia in the Patient Receiving Antithrombotic or Thrombolytic Therapy. American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Third Edition). Reg Anesth Pain Med, 2010; 35: 64-101.Rowlingson JCWedel DJ
- Secher NJ, Arnsbo P, Wallin L. Haemodinamic effects of oxytocin and methyl ergometrin on the systemic and pulmonary circulation of pregnant anaesthetized women. Acta Obstet Gynecol Scand 1978; 57: 97-103.
- Secher NJ, Thayssen P, Arnsbo P, et al. Effects of prostaglandin E2 and F2alpha on the systemic and pulmonary circulation in pregnant anaesthetized women. Acta Obstet Gynecol Scand 1982; 61: 213-218.