Claudia Carvajal F.*
Reve Chil Anest Vol. 42 Número 1 pp. 97-112|doi:
PDF|ePub|RIS
INTRODUCCIÓN
El diagnóstico y manejo de las cardiopatías congénitas (CC) ha tenido una evolución muy favorable en los últimos 30 años. En las décadas del 50 y 60, cuando se inició la cirugía cardíaca abierta, se operaban solo los casos de menor complejidad, de tal forma que la mayoría de pacientes con CC de moderada o alta complejidad morían en la infancia. Gracias a los avances tecnológicos y la ganancia de conocimiento y experiencia, hoy en día 85 a 90% de los pacientes que nacen con CC y que son tratados, alcanzarán la edad adulta. Esto ha llevado a un cambio en el perfil de la población con CC. Si bien la incidencia de las CC se ha mantenido constante en el tiempo (aproximadamente 1% de nacidos vivos), la prevalencia de adultos con CC (tratada o no) ha aumentado con los años. Actualmente se estima que debe haber 4 adultos con CC por cada 1.000 adultos vivos 1 , 2 . Aunque la mayoría de los pacientes hayan sido diagnosticados y manejados oportunamente, al menos un 50% requerirá reintervenciones y necesitará seguimiento estricto. Este es el caso de los pacientes que han sido sometidos a procedimientos paliativos, que los llevan a condiciones no fisiológicas (por ejemplo, pacientes con ventrículo único). 25% de los pacientes adultos con CC no han tenido intervenciones quirúrgicas, bien sea por falta de diagnóstico o por que la alta complejidad de sus lesiones los dejó fuera del alcance quirúrgico en su momento.
Es claro que existe una nueva población de pacientes adultos con alguna forma de CC, que continuará creciendo, ya que Chile tiene más de un 90% de cobertura de diagnóstico y manejo de CC 3 . Esto ha generado a nivel mundial la necesidad de crear grupos multidisciplinarios especializados en el manejo de estos pacientes, que tradicionalmente fueron vistos por pediatras, en hospitales pediátricos, pero que deben hacer su transición hacia la vida adulta 4 , 5 . Los pacientes adultos con CC, pueden requerir cirugía no cardíaca o intervenciones obstétricas, por lo que los anestesiólogos deberíamos tener los conocimientos necesarios para enfrentar su manejo en forma adecuada.
Una de las mayores dificultades en el abordaje de las CC es la gran variedad de lesiones. Existen múltiples clasificaciones que intentan facilitar el estudio de estas patologías. Una de las más tradicionales divide las CC en cianóticas y no cianóticas. En esta revisión nos centraremos en las CC cianóticas en pacientes adultos. Haremos énfasis en las consecuencias que produce la cianosis crónica en múltiples órganos, lo que la convierte en una enfermedad sistémica y haremos algunas recomendaciones sobre la forma de enfrentar estas patologías durante cirugía no cardíaca.
CIANOSIS Y SUS CONSECUENCIAS
Cianosis es la coloración azulada de las mucosas y la piel debido a la presencia de una cantidad aumentada de hemoglobina (Hb) desaturada en los tejidos. Puede ser central o periférica. La cianosis central se produce por mezcla de sangre desoxigenada con sangre oxigenada (por comunicaciones de derecha a izquierda intra o extracardiacas o mezcla en una cámara común) o por sangre que no se oxigena en los alvéolos es decir shunt intrapulmonar. La periférica ocurre por aumento de la extracción de oxígeno en la piel cuando hay un flujo cutáneo reducido (vasoconstricción periférica por frío o fenómenos vasogénicos).
La cianosis central implica hipoxemia que, cuando es crónica, produce mecanismos adaptativos en diversos órganos. A continuación revisaremos los cambios que se producen por la hipoxia crónica:
-
1- Alteraciones hematológicas
-
– Eritrocitosis
La hipoxemia crónica estimula la producción de eritropoyetina (EPO) a nivel renal, lo que produce un aumento de la masa globular roja, fenómeno conocido como eritrocitosis. Este término no es equivalente al de policitemia.
Policitemia: termino griego que significa aumento de células en la sangre. Puede ser primaria o secundaria. En las policitemias primarias hay un defecto innato en progenitores hematopoyéticos que permite la sobreproducción celular a nivel medular. La forma más común de policitemia primaria es la Policitemia Rubra Vera, en la que hay proliferación de las tres líneas celulares (células rojas, blancas y plaquetas) 6 . Las policitemias secundarias se producen por el estímulo de factores circulantes sobre la médula ósea, como sería el caso de la EPO en los casos de hipoxia crónica o algunos tumores.
La eritrocitosis secundaria es un mecanismo adaptativo para mejorar el aporte de oxígeno a los tejidos, pero produce alteraciones en la reología normal. El aumento de la masa de glóbulos rojos (GR) produce aumento de la viscosidad sanguínea que puede reducir el flujo sanguíneo y la perfusión tisular 7 , 8 . La morfología de los GR también altera la viscosidad sanguínea. Estudios in vivo han mostrado que a nivel microvascular, una vez que los vasos alcanzan un diámetro menor que el de un GR (4 a 6 micras), la viscosidad se hace muy dependiente de la deformabilidad del GR 9 . Los glóbulos rojos con una cantidad adecuada de hierro (Fe++) son bicóncavos y más flexibles que los que tienen deficiencia de este ion, los cuales son microesferocíticos, rígidos y con tendencia a la agregación 10 , 11 . Es decir que para un nivel de hematocrito (Hcto) igual, la viscosidad sanguínea será mayor si los eritrocitos tienen deficiencia de Fe++. Este concepto ha ganado importancia en los últimos años ya que es frecuente que los pacientes cianóticos crónicos tengan deficiencia de Fe++, sobre todo si son sometidos a flebotomías, que es una práctica utilizada para disminuir los síntomas de hiperviscosidad. Es más, el accidente cerebro-vascular (ACV), complicación que se presenta en aproximadamente 14% de los pacientes cianóticos crónicos 12 , parece tener más correlación con la deficiencia de Fe++ que con los niveles de Hcto 13 .
-
– Aumento de la viscosidad sanguínea (hiperviscosidad)
La disminución del aporte de oxígeno tisular por el aumento de la viscosidad sanguínea produce síntomas como cefalea, trastornos visuales, pérdida de la concentración, parestesias, fatiga muscular y, lo más temido, eventos trombóticos como ACV o embolia pulmonar. Actualmente la flebotomía solo está indicada cuando hay síntomas moderados o severos de hiperviscosidad una vez que se ha descartado o manejado la deshidratación y la deficiencia de Fe++. Rara vez se producen síntomas con Hctos menores de 65% y las flebotomías profilácticas no están indicadas 7 .
-
2- Alteraciones de la coagulación
Está bien documentado que los pacientes cianóticos tienen mayor riesgo de sangrado cuando se someten a procedimientos quirúrgicos 14 – 16 . Es frecuente encontrar pruebas de coagulación anormales en estos pacientes. El tiempo de protrombina (TP), el tiempo parcial de tromboplastina (TPT) y el recuento plaquetario están frecuentemente alterados en pacientes con Hctos mayores de 60% 17 . Una mayor proporción de niños cianóticos tienen aumentados los niveles de dímero-D, evidenciando activación de la coagulación 18 . Algunas de las explicaciones a estos hallazgos son:
-
– Alteraciones plaquetarias
El recuento plaquetario está inversamente relacionado con el Hcto, así que es común que los pacientes con eritrocitosis secundaria a hipoxia, tengan al menos trombocitopenia leve (100.000 a 150.000 plaquetas) 8 . Los primeros trabajos sobre el tema encontraron que la agregación 19 y la vida media plaquetaria se alteran en relación con el grado de eritrocitosis 20 , 21 . En un estudio más reciente Lill y cols., encontraron disminución de la producción plaquetaria en 25% de 105 pacientes cianóticos 22 . En estos pacientes el recuento plaquetario estaba inversamente relacionado con la magnitud del shunt de derecha a izquierda. Esto se explicaría porque los megacariocitos son transformados en plaquetas durante su paso por el lecho pulmonar, de tal forma que si se pierde este paso, se pierde parte importante de la maduración plaquetaria.
-
– Coagulación intravascular diseminada (CID)
El aumento de la viscosidad a nivel microvascular hace que haya estasis vascular, que permite la interacción de las plaquetas con el endotelio, con la consecuente activación plaquetaria, generación de trombina y formación de fibrina. De esta forma se consumen plaquetas y factores de coagulación. Esto explicaría los mayores niveles de dímero-D encontrado en estos pacientes 18 .
-
– Disminución de la producción de factores de coagulación
Los factores sintetizados en el hígado pueden producirse en forma anormal si los pacientes tienen una función hepática disminuida por la hipoxia y la hipoperfusión crónica. Además, los factores vitamina K dependientes (II, VII, IX y X) requieren de una adecuada absorción a nivel intestinal, que puede estar afectada por la cianosis.
-
– Error en la forma de procesar las pruebas de coagulación
La eritrocitosis disminuye la cantidad de plasma en una muestra de sangre total. Las pruebas de coagulación se realizan en plasma y se colectan en tubos con anticoagulante. Si no se corrige la cantidad de anticoagulante, el plasma quedará con un exceso de éste que alterará el resultado. Normalmente la relación es de 1 parte de anticoagulante por 9 de sangre. El volumen de sangre que se debe adicionar a un tubo con 0,25 ml de citrato de sodio al 3,8% se puede calcular con la siguiente formula 14 :
Volumen en ml = 2,25 x (100 – Hcto normal / 100 – Hcto del paciente).
-
– Otras alteraciones de la coagulación:
Los pacientes con cardiopatías congénitas pueden presentar formas adquiridas de enfermedad de von Willebrand (EVW), secundarias a una mayor destrucción de los multímeros de factor de VW, producida por los flujos turbulentos que se generan en la anatomía cardiaca anormal 23 , 24 . También se ha documentado aumento de la fibrinolisis primaria, que sería la razón por la cual los antifibrinolíticos han demostrado utilidad en la disminución del sangrado durante cirugía cardíaca en este tipo de pacientes.
-
3- Alteraciones vasculares
A nivel microvascular los pacientes cianóticos crónicos parecen tener disfunción endotelial, que se manifiesta como menor capacidad de aumentar el flujo sanguíneo ante mayor demanda (por ejemplo, ejercicio) y generación de acidosis 25 . Esto se explicaría porque si bien en forma aguda, la hipoxia aumenta la vasodilatación por mecanismos mediados por óxido nítrico (NO), en forma crónica se producen mecanismos adaptativos como remodelación vascular con aumento del diámetro de los vasos para normalizar el shear stress 26 . Otra importante consideración es que la Hb tanto libre como intracelular es un scavenging de NO, así que la eritrocitosis podría bloquear la vasodilatación dependiente de NO 27 . Otra manifestación de la disfunción endotelial, es que la vía de la trombomodulina/proteína C y proteína S está subregulada en cianóticos crónicos por aumento del shear stress, induciendo un estado protrombótico y procoagulante 28 , 29 . Estas alteraciones endoteliales tienen importancia porque modifican el aporte de oxígeno a los tejidos disminuyendo el rendimiento cardiovascular y están implicadas en causas frecuentes de morbimortalidad como ACV y trombo-embolismo pulmonar 25 .
A nivel de vasos de mayor diámetro, la hipoxia estimula factores angiogénicos como factor de crecimiento endotelial vascular y factores de crecimiento de fibroblastos, que producen malformaciones vasculares en estos pacientes 30 , 31 . Es frecuente observar vasos dilatados, tortuosos o aneurismáticos en pacientes cianóticos a nivel pulmonar, coronario y retinal (Figura 1). Las coronarias extramurales de estos pacientes presentan pérdida del músculo liso medial, lamina elástica interna rota y displasia fibromuscular. En la microcirculación las arteriolas coronarias están dilatadas en exceso, lo que resulta en un flujo coronario basal aumentado, lo cual sumado a que estos pacientes parecen estar protegidos del desarrollo de aterosclerosis (por hipocolesterolemia, trombocitopenia, sobrerregulación del NO e hiperbilirrubinemia), explica que sea muy infrecuente la enfermedad coronaria y el infarto al miocárdio 32 .
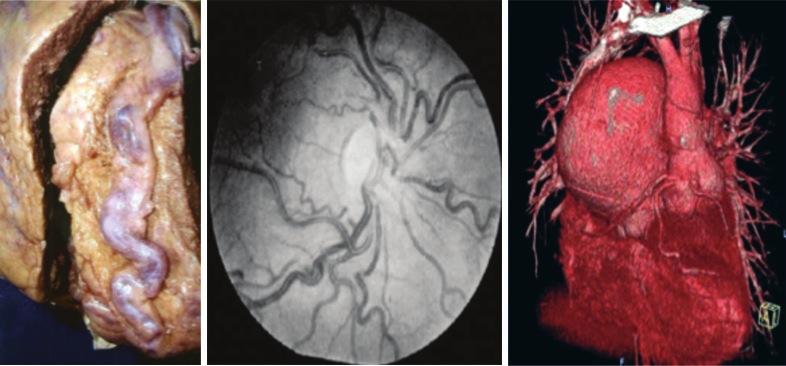
Figura 1 Imágenes que muestran algunas de las alteraciones vasculares propias de los pacientes cianóticos crónicos. La primera imagen corresponde a una arteria coronaria descendente anterior muy dilatada y tortuosa. La segunda imagen muestra el fondo de ojo donde se observa dilatación de arterias y venas retinales y en la tercera imagen se observa un aneurisma de la arteria pulmonar (Cardiol Young 2010; 20: 242-253).
Existe mayor riesgo de trombosis venosa ya que la viscosidad es mayor en lado venoso por menor shear rate. La trombosis del seno venoso cerebral es una causa mayor de ACV. En este grupo de paciente la trombosis y ruptura vascular son causas importantes de morbimortalidad s 33 .
-
4- Alteraciones renales
Es frecuente que los pacientes cianóticos crónicos presenten alteraciones estructurales y funcionales a nivel renal. Sus glomérulos son hipercelulares y congestivos. J. Perloff 34 , describió dos tipos de alteraciones glomerulares en pacientes con cianosis por CC. La primera es de tipo vascular, producida por el alto shear stress generado en el glomérulo por la eritrocitosis y la ultrafiltración. Este estímulo aumenta la liberación de NO que produce dilatación del lecho glomerular. La segunda ocurre en respuesta al factor de crecimiento derivado de las plaquetas (FCDP) y al factor de crecimiento ß (FCß) que se encuentran en los gránulos de los megacariocitos que llegan a la circulación sistémica gracias al shunt de derecha-izquierda que impide su paso por el lecho pulmonar. Estos factores de crecimiento son los responsables del aumento de células mesangiales y mayor celularidad yuxtaglomerular. Las principales manifestaciones de disfunción renal de los pacientes cianóticos son la disminución de la excreción de ácido úrico y aumento de la pérdida de proteínas (proteinuria) 35 .
-
5- Otras modificaciones
-
– Hiperuricemia y gota
Es frecuente que los pacientes cianóticos tengan aumentados los niveles de ácido úrico (AU), pero es raro que presenten artritis gotosa. El aumento del AU plasmático parece ser secundario principalmente a la disminución de la excreción a nivel renal y puede ser una manifestación de alteración hemodinámica renal (la hipoperfusión renal aumenta la reabsorción de agua y uratos a nivel del túbulo proximal) 35 . Por otra parte, la sobreproducción de AU también puede estar involucrada en su aumento plasmático. El AU es el producto final del metabolismo de las purinas, de tal forma que los tejidos hipóxicos o isquémicos pueden tener mayor degradación de ATP hacía AU 36 . Un estudio reciente encontró que los niveles de AU se correlacionan con la severidad de las alteraciones hemodinámicas en pacientes con síndrome de Eisenmenger y pueden ser un predictor de mayor lesión orgánica y mal pronóstico 37 .
-
– Colelitiasis
La bilirrubina es el producto final del metabolismo de los grupos hem. De este modo, los pacientes con eritrocitosis tienen una mayor concentración de bilirrubina no conjugada en la bilis, que puede generar cálculos de bilirrubinato cálcico5. Estos pacientes pueden presentarse con colecistitis aguda que puede producir bacteremia y endocarditis infecciosa.
-
– Osteoartropatía hipertrófica (OAH)
La OAH se caracteriza por proliferación celular y formación de nuevo tejido óseo y periostitis principalmente en metacarpos, metatarsos, falanges y huesos largos de extremidades. Esto es lo que da origen a los dedos en palillo de tambor (clubbing en inglés). La etiología parece estar relacionada con la presencia en la circulación sistémica de mediadores que normalmente son removidos por la circulación pulmonar y que llegan a ésta gracias al shunt de derecha a izquierda. Estudios histológicos evidencian la presencia de megacariocitos y cúmulos de plaquetas que probablemente liberan factores de crecimiento como FCDP y FCß que son los responsables del crecimiento celular 38 . La Figura 2 muestra las manos y los pies de una paciente de 30 años con un ductus arterioso persistente (DAP). En este caso los pies tienen dedos en palillo de tambor mucho más marcados que las manos. Esto ocurre porque la mezcla sanguínea ocurre a nivel del arco aórtico distal y así las extremidades inferiores reciben mucha más sangre desoxigenada que las extremidades superiores.
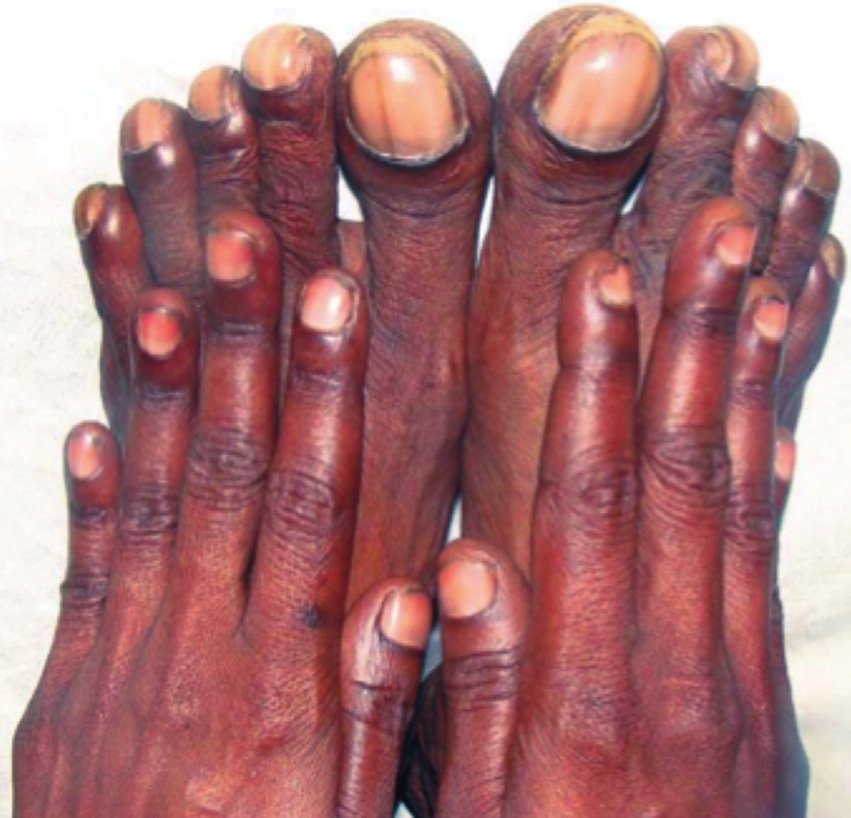
Figura 2 Manos y pies de un paciente de 30 años con ductus arterioso persistente y cianosis crónica por shunt de derecha a izquierda. En este caso los pies tienen dedos en palillo de tambor más marcados porque por la ubicación del shunt han recibido mayor cantidad de sangre desoxigenada (NEJM 2011; 364: 7).
CARDIOPATÍAS CONGÉNITAS CIANÓTICAS EN EL ADULTO
Dada la amplitud de los diagnósticos de CC, las clasificaremos según la causa fisiopatológica que lleva a la producción de cianosis y haremos énfasis en las lesiones que con más frecuencia pueden presentarse en la edad adulta.
La cianosis por CC puede presentarse por 4 causas fisiopatológicas, aunque algunas de ellas se mezclan en un solo diagnóstico:
-
Cianosis por disminución del flujo sanguíneo pulmonar: tetralogía de Fallot (TF), atresia pulmonar (AP) (Figura 3).
-
Cianosis por mezcla de sangre venosa y arterial en una cámara común: tronco arterioso (TA), hipoplasia de ventrículo izquierdo o ventrículo derecho, drenaje venoso pulmonar anómalo total (DVPAT) (Figura 4).
-
Cianosis por circulación en paralelo: D-transposición de grandes arterias (D-TGA), con o sin comunicación interventricular (CIV) (Figura 5).
-
Síndrome de Eisenmenger (SEM) (Figura 6).
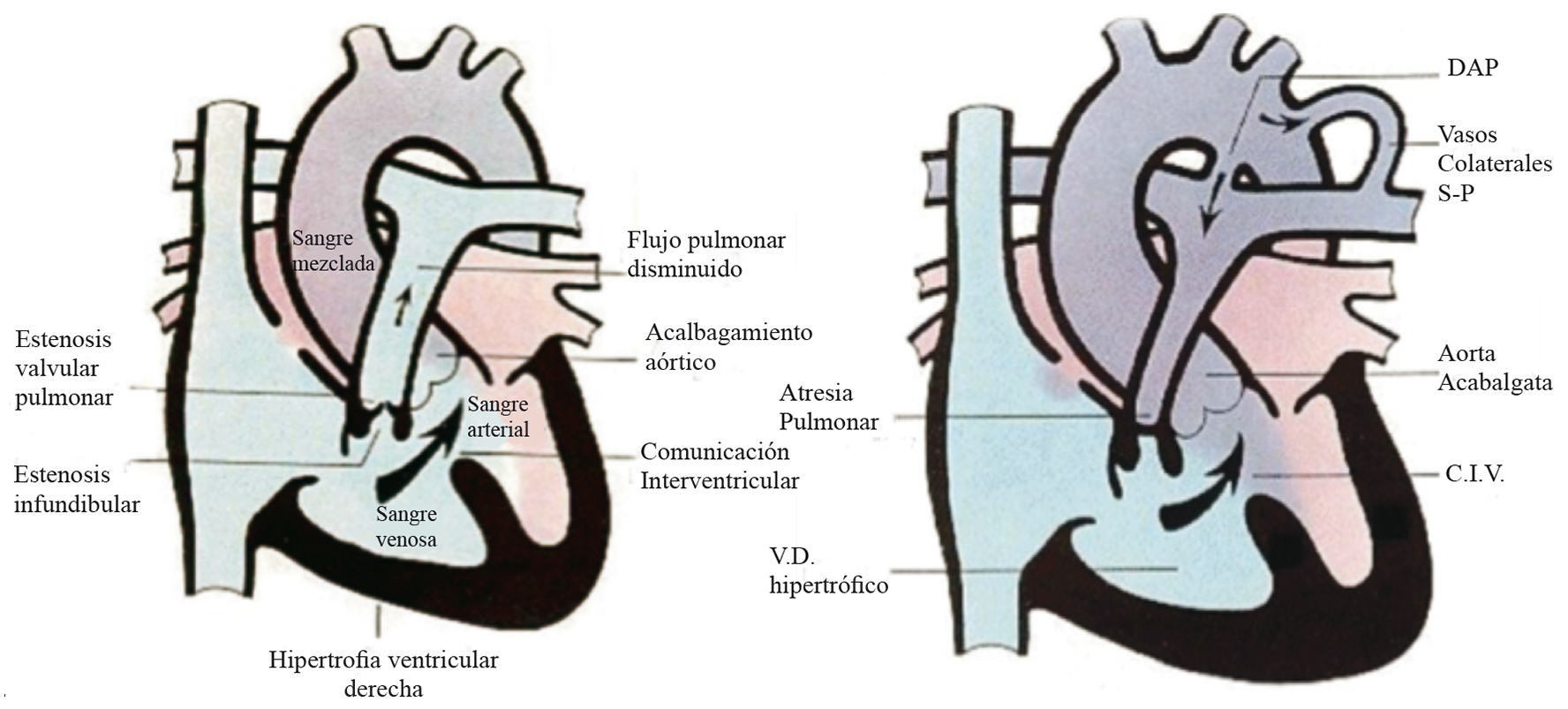
Figura 3 Cianosis por disminución del flujo sanguíneo pulmonar (Tetralogía de Fallot. En la figura de la derecha se muestra la imagen de una Tetralogía de Fallot (TF) clásica, en la que el flujo sanguíneo pulmonar está disminuido por la obstrucción a la salida del ventrículo derecho (V.D.), y la comunicación interventricular (C.I.V.) tiene flujo de derecha a izquierda que produce cianosis. La figura de la izquierda muestra una TF con obstrucción total de la salida del V.D por atresia pulmonar. En este caso el flujo pulmonar está disminuido y es dependiente de un ductus arterioso persistente (DAP) o de vasos colaterales de arterias sistémicas hacia arterias pulmonares (S-P) (Imágenes modificadas de Images paediatri Cardiol 1999; 1 (1): 18-21).
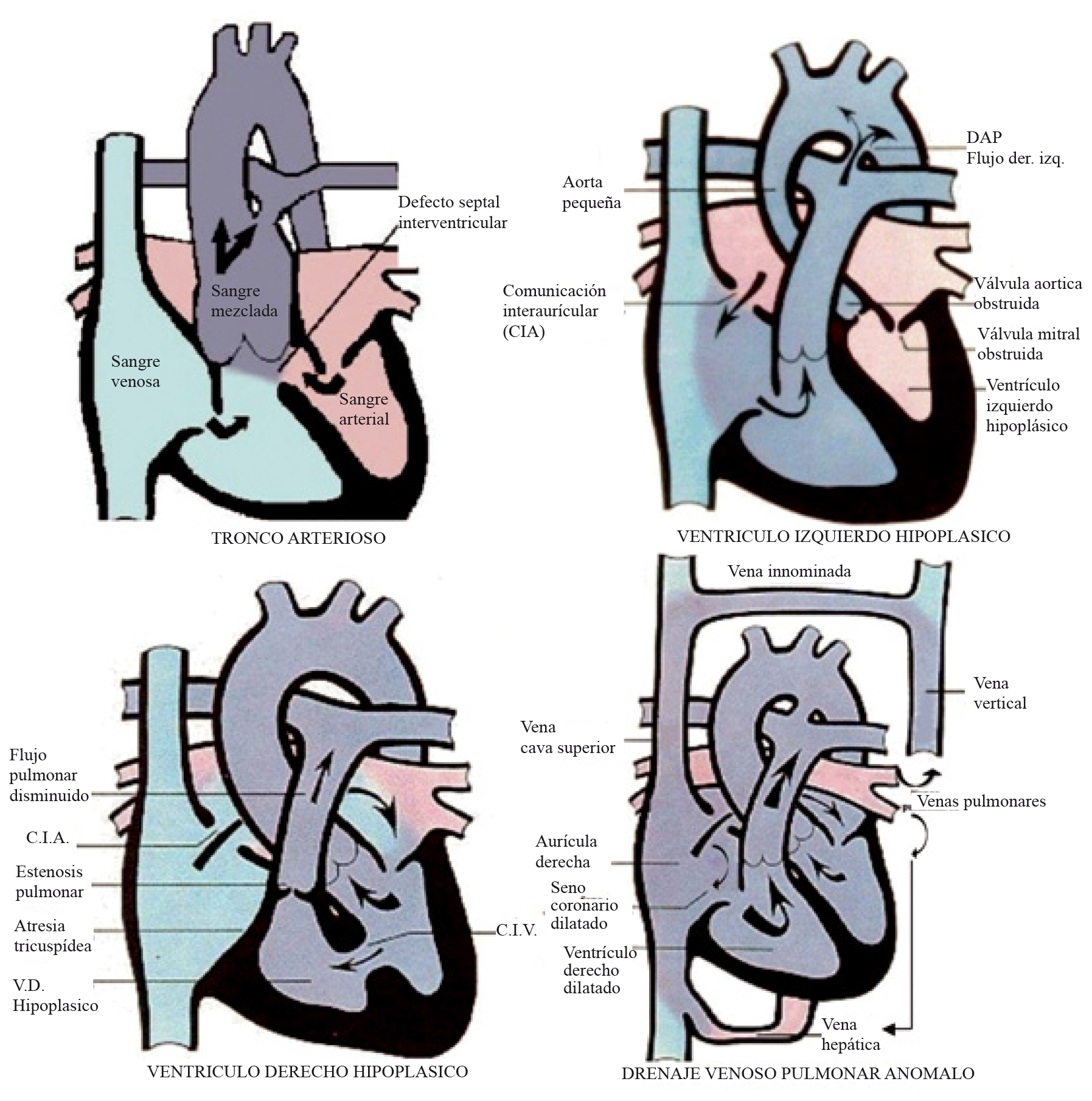
Figura 4 Cianosis por mezcla de sangre arterial y venosa en una cámara común. Tronco Arterioso: Hay una mezcla completa de la sangre arterial y venosa en un vaso común que da origen a la aorta y a la arteria pulmonar. Hay hiperflujo e hipertensión pulmonar severa. Ventrículo izquierdo hipoplásico: Hay obstrucción severa de la válvula mitral y aórtica que impide la formación adecuada del ventrículo izquierdo. La sangre se mezcla a nivel auricular y se eyecta por la arteria pulmonar. La perfusión sistémica es dependiente del ductus (flujo de derecha a izquierda). Hay hiperflujo pulmonar. Ventrículo derecho hipoplásico: Hay atresia tricuspídea que impide la adecuada formación del ventrículo derecho. La sangre se mezcla a nivel auricular y se eyecta por la aorta y la pulmonar (en algunos casos hay atresia pulmonar, haciéndose la circulación pulmonar ductus dependiente). Drenaje venoso pulmonar anómalo: El drenaje venoso pulmonar llega a venas sistémicas y no a la aurícula izquierda. Puede ser supracardíaco (si el drenaje va al territorio de la cava superior), infracardíaco (si el drenaje va al territorio de la cava inferior) o cardíaco (si el drenaje es al seno coronario). Hay congestión severa de cavidades derechas e hipertensión pulmonar venosa y arterial severa. Es una urgencia neonatal (Modificadas de Images paediatri Cardiol 1999; 1: 18-21).
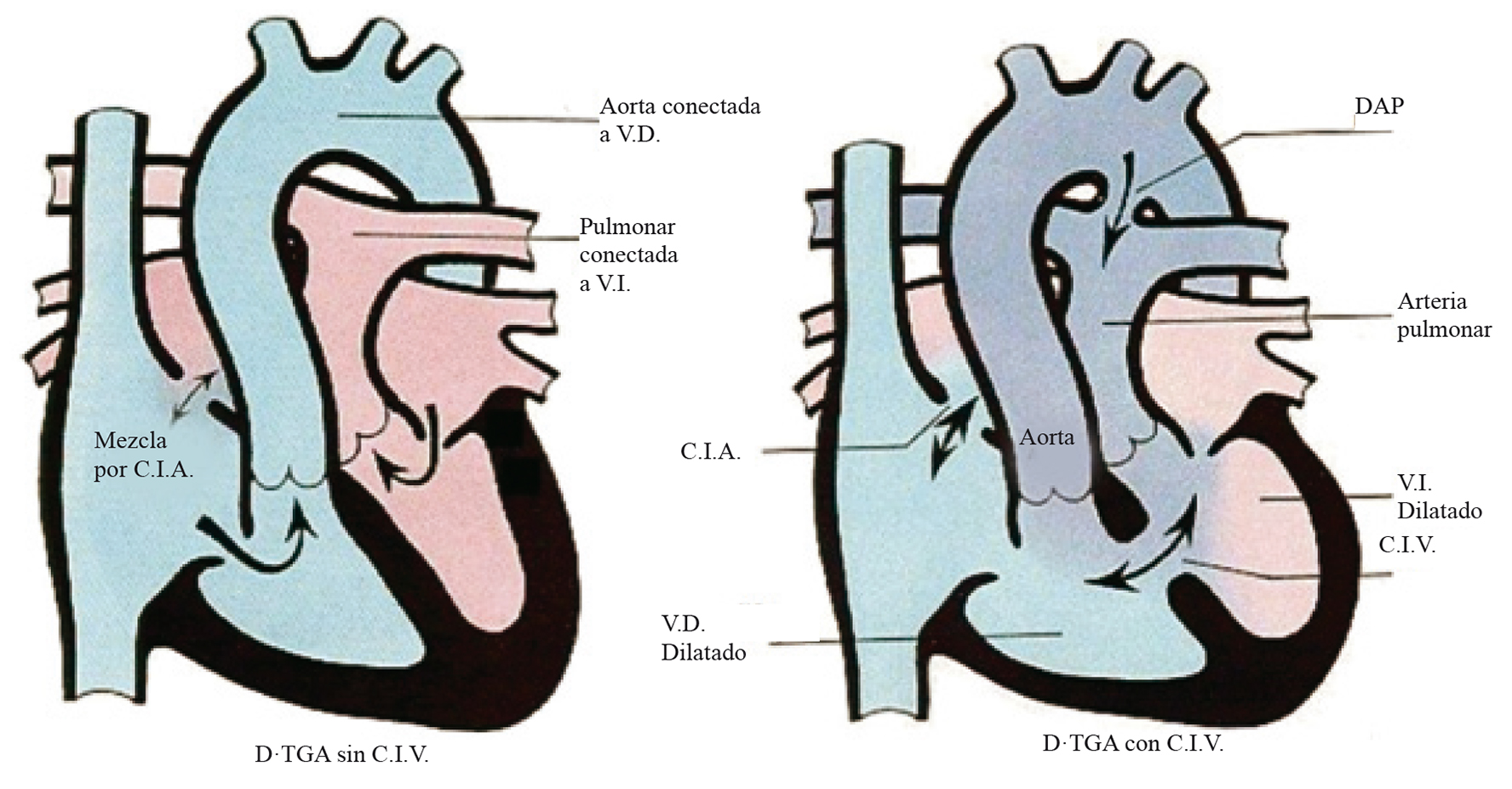
Figura 5 Cianosis por circulación en paralelo; transposición de grandes arterias. En la transposición de las grandes arterias (D-TGA), existe discordancia en la conexión ventrículo-arterial, de tal forma que el ventrículo derecho está conectado a la arteria pulmonar, generándose un circuito venoso y el ventrículo izquierdo está conectado a la arteria pulmonar, generándose un circuito arterial. La circulación venosa y la circulación arterial corren en paralelo y necesitan mezclarse a nivel intracardiaco (Modificadas de Images paediatri Cardiol 1999; 1: 18-21).
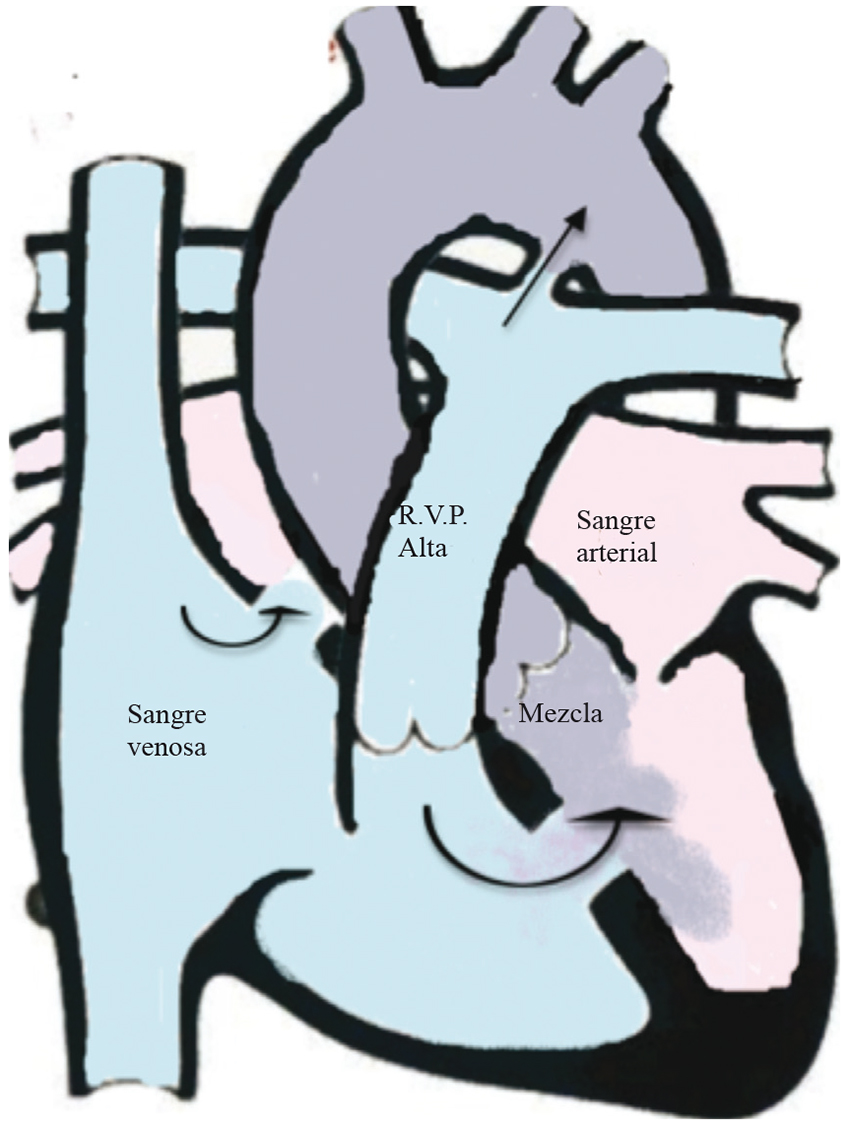
Figura 6 Cianosis por síndrome de Eisenmenger. En este caso la cianosis se producen por que existe shunt de derecha a izquierda por defectos septales o ductus persistentes que no fueron resueltos a tiempo y produjeron aumento severo de la resistencia vascular pulmonar e inversión del shunt (Modificadas de Images paediatri Cardiol 1999; 1: 18-21).
En esta revisión haremos énfasis en los pacientes del grupo 1 y 4 que son las patologías que se pueden presentar en la edad adulta. Las otras patologías requieren corrección en edad temprana (muchas de ellas en el período neonatal) o no sobrevivirán. Los pacientes con hipoplasia ventricular deben ser llevados a una fisiología de corazón uni-ventricular, que tampoco tocaremos en este artículo ya que merece una revisión más profunda.
-
1- Enfermedades con cianosis por disminución del flujo sanguíneo pulmonar
-
– Tetralogía de Fallot (TF)
Es la forma más común de enfermedad cianótica después del año de edad y corresponde al 10% de todas las cardiopatías congénitas 39 . La Figura 3 muestra las características de la lesión, en la que existe una desviación anterior del septum conal que lleva a: 1. Una comunicación interventricular (CIV) mal alineada y no restrictiva; 2. Cabalgamiento de la aorta sobre el septum; 3. Obstrucción a la salida del ventrículo derecho (VD), por estenosis valvular y obstrucción infundibular muscular y 4. Hipertrofia VD secundaria. El flujo y la presión arterial pulmonar están disminuidos y se puede acompañar de algún grado de hipoplasia de las ramas pulmonares. En realidad la TF es un espectro que puede ir desde la mínima obstrucción a la salida del VD, comportándose como CIV no restrictiva (Fallot rosado), hasta el paciente con atresia pulmonar (AP) y perfusión pulmonar dependiente de colaterales aorto-pulmonares.
Los síntomas están determinados por el grado de obstrucción a la salida del VD, que usualmente tiene un componente anatómico fijo y un componente dinámico por contracción del músculo infundibular. A mayor obstrucción menos sangre pasa por el lecho pulmonar y más sangre no oxigenada se desvía por la CIV hacía la aorta, empeorando la cianosis. Cuando existe AP (obstrucción completa a la salida del VD), el ventrículo se comporta como un ventrículo único donde se mezcla la sangre oxigenada y desoxigenada y la perfusión pulmonar dependerá del flujo que pase por vías alternativas como un ductus arterioso persistente (DAP), colaterales sistémico-pulmonares o shunt paliativos.
El tratamiento quirúrgico definitivo se hace cerrando la CIV y ampliando la salida del VD con resección infundibular, valvulotomía pulmonar y colocación de un parche infundibular y algunas veces transanular. Cuando es necesario se coloca un conducto valvulado entre el VD y las arterias pulmonares. Actualmente la reparación se hace lo más temprano posible, incluso en período neonatal si la anatomía lo permite, con excelentes resultados (mortalidad perioperatoria aproximada 1% y sobrevida a 35 años aproximada 85%) 40, 41 . Los pacientes que no pueden ser corregidos precozmente se manejan con shunt paliativos que mejoran la oxigenación y permiten el crecimiento de las ramas pulmonares, hasta que se pueda realizar la reparación definitiva (Figura 7).
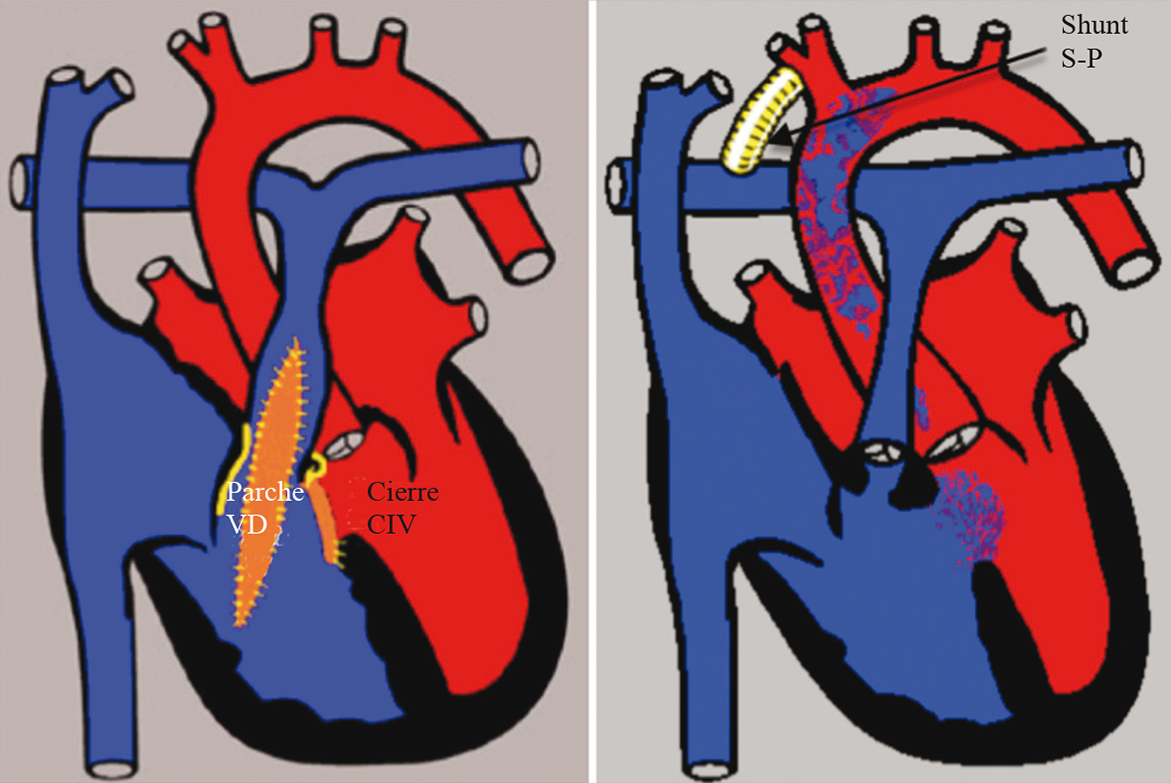
Figura 7 Manejo quirúrgico de la tetralogía de Fallot. La imagen de la derecha muestra la corrección definitiva de una tetralogía de Fallot que consiste en cerrar la comunicación interventricular (CIV) y ampliar la salida del ventrículo derecho (VD) con un parche infundibular y transanular. La figura de la izquierda muestra un shunt de Blalock-Taussing (entre la arteria subclavia derecha y rama pulmonar derecha), que es un procedimiento paliativo para aumentar el flujo sanguíneo pulmonar. Shunt S-P: Shunt sistémico pulmonar.
Los paciente no operados tienen una sobrevida a 10 años de 30% y a 40 años de menos del 3% 40 . A la edad adulta llegan principalmente pacientes con flujo pulmonar mantenido por colaterales sistémico-pulmonares o shunts paliativos.
El manejo anestésico de estos pacientes debe estar dirigido a aumentar el flujo sanguíneo pulmonar. En pacientes con TF clásica se debe evitar la obstrucción dinámica, por contracción del músculo infundibular, evitando aumentos del tono simpático (dolor, drogas adrenérgicas) o utilizando beta-bloqueadores y se debe favorecer el shunt de izquierda a derecha por la CIV aumentando la resistencia vascular sistémica (RVS) con drogas que no aumenten el tono simpático (fenilefrina es la droga de elección). En los pacientes que tienen AP y su flujo pulmonar es dependiente de colaterales o shunt paliativos, la perfusión pulmonar es dependiente de la presión arterial sistémica, que se debe mantener alta con una adecuada volemia y con vasoconstrictores. La saturación arterial de O2 (SaO2), es un monitor muy útil para evaluar la eficiencia de los shunts que mantienen el flujo pulmonar. Sí se aumenta la presión arterial sistémica y aumenta la SaO2 confirmamos que hay flujo por el shunt y podemos determinar qué presión se requiere para que este se mantenga 39 .
-
– Síndrome de Eisenmenger
En 1897 el médico vienés Víctor Eisenmenger describió el caso de un hombre de 32 años que presentaba cianosis y disnea desde la infancia y que luego de un rápido deterioro de su capacidad funcional y signos de falla cardíaca derecha falleció súbitamente después de una hemoptisis masiva. La autopsia reveló una CIV no restrictiva, un ventrículo derecho hipertrófico y ateromatosis de las arterias pulmonares 42 . El primero en hacer una descripción fisiopatológica de la entidad fue Paul Wood, quién en 1958 asoció la entidad a la presencia de hipertensión pulmonar (HP) producida por un shunt de izquierda a derecha intra o extracardíaco, que con el tiempo se revierte produciendo cianosis 43 .
El síndrome de Eisenmenger (SEM) se define hoy en día como la presencia de cualquier defecto cardíaco congénito, no importa la localización, que permite aumento del flujo sanguíneo pulmonar y transmisión de presión aumentada a la circulación pulmonar y que con el tiempo causa un shunt balanceado o predominantemente de derecha a izquierda secundario a una resistencia pulmonar vascular (RVP) fija o marcadamente elevada 42 . Hemodinámicamente se define como un aumento de las RVP a 12 unidades Wood o una relación RVP:RVS igual o mayor a 1.
El aumento de flujo sanguíneo pulmonar y de presión pulmonar lleva a una remodelación de los vasos pulmonares que al parecer involucra vasoconstricción, inflamación, trombosis, proliferación celular y fibrosis 44 . En estos mecanismos están implicados mediadores vasoactivos tales como endotelina-1, tromboxano, prostaciclinas y Óxido Nítrico (NO) 44 . Las 3 principales vías implicadas en el desarrollo de HP y a donde se dirige la terapia médica se ilustran en la Figura 8.
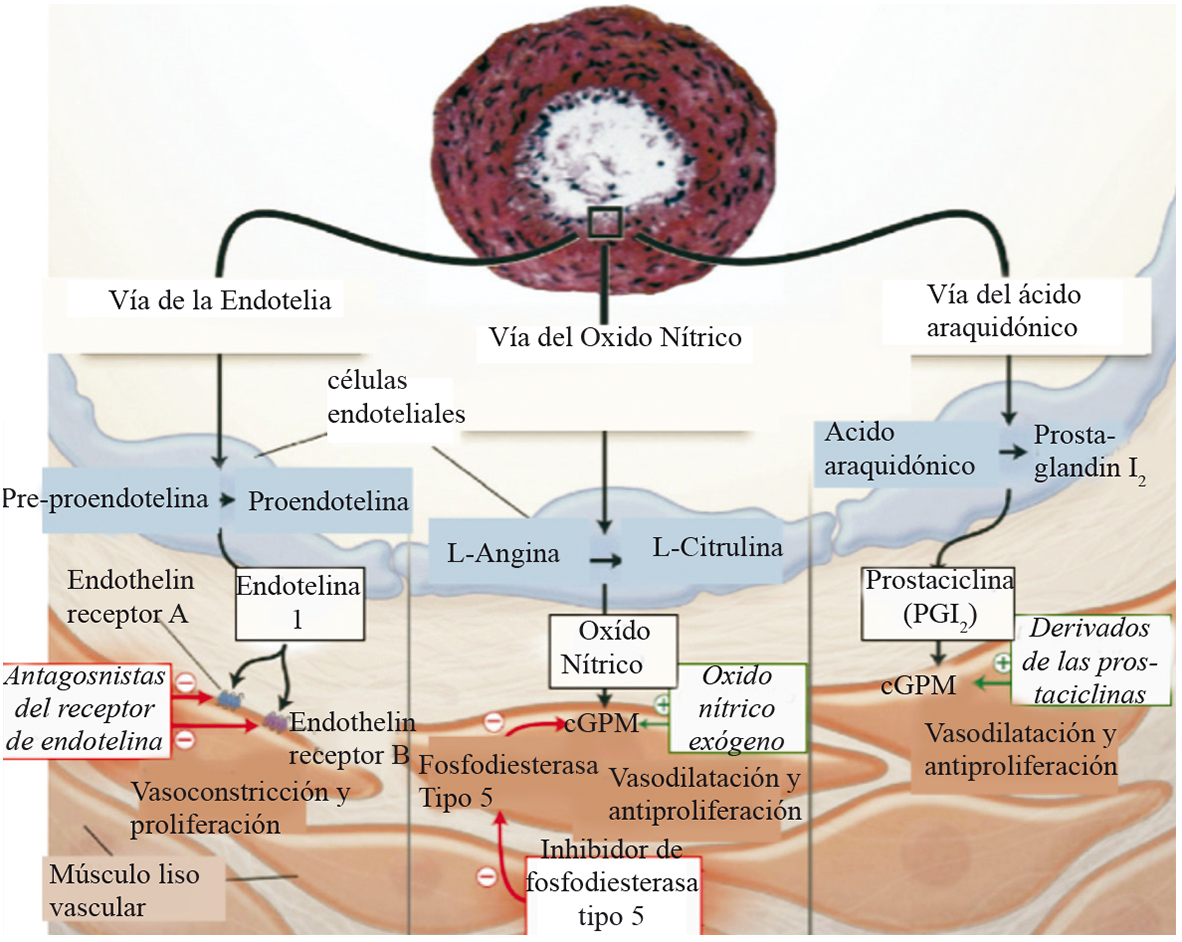
Figura 8 Fisiopatología de la hipertensión pulmonar. Vías Fisiopatológicas que llevan a Hipertensión pulmonar: La gráfica esquematiza una pequeña arteria pulmonar (< 500 micras), con marcada hipertrofia de la pared media y proliferación de la íntima. Las células endoteliales presentan producción disminuida de prostaciclina y óxido nítrico con producción incrementada de endotelina 1, promoviéndose así la vasoconstricción y la proliferación del músculo liso. Hacia la manipulación de estos mediadores está dirigida la terapia actual para el manejo de la hipertensión pulmonar (Modificado de JACC 2009; 53: 735).
Que se produzca SEM dependerá de que el defecto sea suficientemente grande para que las presiones se igualen entre ambos ventrículos o entre grandes vasos y de la presencia de factores asociados como el síndrome de Down, en el que la HP se tiende a desarrollar más rápidamente probablemente por la mayor asociación de obstrucción respiratoria y algún grado adicional de disfunción endotelial 45 , 46 . Se puede establecer aún en los 2 primeros años de vida si el shunt es aorto-pulmonar o interventricular. No se produce si los pacientes tienen asociada estenosis pulmonar. Los defectos particularmente susceptibles son CIV, canal AV, ductus, ventana aorto-pulmonar, D-TGA con CIV o tronco arterioso. Los defectos auriculares pueden producir HP pero usualmente hasta la segunda o tercera década de la vida.
La prevalencia actual del SEM ha venido disminuyendo gracias al diagnóstico oportuno y al manejo precoz de las cardiopatías congénitas. En una publicación de 1971 se reportaba que alrededor del 8% de todos los pacientes con cardiopatías y 11% de aquéllos con shunt de izquierda a derecha desarrollarían SEM 47 . El CONCOR 48 (Congenital Cor Vitia), un registro holandés de pacientes adultos con enfermedad cardíaca congénita, reporta una incidencia de 1,1% de SEM en un total de 5.970 adultos registrados. El defecto más frecuentemente asociado es CIV (42%). Las CIAs se asocian en su mayoría con HP pero muy pocas presentan SEM (10%). En este registro el paciente de mayor edad con SEM tenía 69 años (CIA).
La historia natural de la enfermedad es de un largo período libre de síntomas. Los pacientes se ajustan a una menor capacidad de ejercicio desde niños. Pueden estar bien hasta la adolescencia o la adultez temprana. La mayoría se hacen sintomáticos en la tercera década y gradualmente desarrollan cianosis, intolerancia al ejercicio, disnea, síncope, accidente cerebro-vascular o abscesos cerebrales, falla cardíaca derecha, complicaciones derivadas de la hiperviscosidad, hemorragia pulmonar (hemoptisis), endocarditis y arritmias 49 . La mayoría de los pacientes fallecen por muerte súbita, falla cardíaca congestiva, hemoptisis, abscesos cerebrales, eventos tromboembólicos, complicaciones durante el embarazo o cirugía no cardiaca. Aunque los primeros reportes situaban la muerte de estos pacientes entre los 30 y 35 años, estudios más recientes reportan 50% de sobrevida a los 55 años en cardiopatías simples y 50% de sobrevida a los 40 años en cardiopatías complejas 50 . Los predictores de mortalidad o pobres resultados son la baja capacidad funcional, los signos de falla cardíaca derecha y las arritmias y datos de laboratorio asociados con falla cardíaca o arritmias como bajos niveles de albúmina, hipokalemia y mayor duración del QRS y el intervalo QTc 50 .
El tratamiento de estos pacientes ha sido principalmente sintomático 44 , 51 , con posibilidad de trasplante corazón-pulmón en algunos pacientes. Es usual que reciban medicamentos para el manejo de la falla cardíaca (digital, diuréticos, antiarrítmicos), ninguno de los cuales ha demostrado modificaciones en la sobrevida. El uso de anticoagulación es controversial pues si bien la prevalencia de trombosis y enfermedad embólica es alta, también tienen un alto riesgo de sangrado. Algunos de estos pacientes pueden presentar mejoría de sus síntomas con O2.
Ha habido avances recientes en el tratamiento médico dirigido hacía la manipulación de algunos mediadores implicados en la remodelación vascular pulmonar que se produce en diferentes formas de HP. El Bosentan es un antagonista del receptor de endotelina, que ha mostrado buenos resultados en pacientes con HP idiopática y que ha sido utilizado en pacientes con SEM con resultados aún no evaluables a largo plazo 52 , 53 . Por otra parte, la fisiología de los pacientes con SEM es diferente a la de los pacientes con HP idiopática, ya que si el defecto no se corrige, la disminución de RVP aumenta el flujo pulmonar y así aumenta la presión y el shear stress, lo cual puede intensificar los cambios vasculares. Actualmente hay algunos reportes de manejo combinado de cierre parcial del shunt después de respuesta positiva a la terapia vasodilatadora, pero sus resultados son aún inciertos 54 .
Los pacientes con SEM tienen alto riesgo de complicaciones y mortalidad cuando se someten a cirugía no cardíaca 55 , 56 . El estado hemodinámico limítrofe en el que se encuentran hace que tengan poca capacidad de adaptación a los cambios producidos por el aumento del tono simpático, la vasodilatación o la pérdida de volumen propia de un procedimiento quirúrgico. Los aumentos súbitos de la presión arterial pulmonar pueden hacer colapsar a un ventrículo derecho ya enfermo y con tendencia a presentar arritmias. Los aumentos de la RVS pueden producir colapso del ventrículo izquierdo que también está sobrecargado y sometido a hipoxia crónica. La disminución de las RVS empeora la cianosis al facilitar el shunt de derecha a izquierda. A esto se suma el riesgo aumentado de sangrado y complicaciones tromboembólicas.
El embarazo es de muy alto riesgo en estas pacientes, tanto así que se recomienda contraindicarlo 4 , 5 . Con los cambios hemodinámicos propios del embarazo y el parto (aumento del volumen sanguíneo y el gasto cardíaco y caída de las RVS) es usual que empeore la cianosis y la falla cardíaca. En una revisión sistemática de la literatura publicada recientemente se encontró que la mortalidad materna en pacientes con SEM en la década de 1997 a 2007 fue de 28% comparada con 36% en el período entre 1978 a 2006. Aunque ha habido una leve mejoría en los resultados, el riesgo sigue siendo prohibitivo. La mayoría de muertes ocurren en el postparto (media: 6 días, rango de 0 a 24 días), por falla cardíaca derecha, tromboembolismo, arritmias o crisis de HP 57 .
CONSIDERACIONES ANESTÉSICAS
En general todas las CC cianóticas son complejas y tienen alto riesgo de morbilidad y mortalidad cuando los pacientes que las presentan se someten a procedimientos quirúrgicos no cardíacos. Se recomienda que estos pacientes sean intervenidos en centros de referencia que cuenten con grupos entrenados que puedan manejar las posibles complicaciones 4 , 5 .
-
1- Evaluación preoperatoria
El éxito en el manejo de estos pacientes parte por entender la anatomía y fisiopatología de su lesión. Es muy importante revisar los exámenes, imágenes y protocolos operatorios que nos permitan entender cuál es la causa de la cianosis del paciente, cuáles son las fuentes de flujo pulmonar y en qué estado hemodinámico se encuentra.
La ecocardiografía es la primera línea de diagnóstico. Brinda información de la anatomía cardíaca básica. Permite evaluar la función ventricular, la presencia de shunt y algunos datos hemodinámicos como presión de arteria pulmonar y gradientes. Actualmente la Resonancia Nuclear Magnética (RNM) ha ganado importancia porque permite hacer reconstrucciones anatómicas tridimensionales. Es superior a la ecocardiografía para cuantificar los volúmenes y la función del ventrículo derecho y para evaluar las arterias pulmonares, los conductos VD-AP o las colaterales sistémico-pulmonares 59 .
Hoy en día el cateterismo cardíaco se reserva para resolución de preguntas anatómicas o fisiológicas muy específicas o para realizar intervenciones. Sin embargo en lesiones con shunt e HP el cateterismo es parte fundamental del proceso diagnóstico. Es el gold standard para calcular la RVP y si la HP es severa, y permite hacer test de vasoreactividad pulmonar. Tradicionalmente se ha usado O2 para estos test pero en lesiones con shunt el NO puede ser preferible 59 . El diagnóstico de SEM se hace si los pacientes tienen RVP altas y no reactivas.
Como ya expusimos, la cianosis crónica es una enfermedad sistémica que afecta múltiples órganos. Estos pacientes tienen alto riesgo de sangrado y trombosis peri-operatoria, por lo cual deben tener una adecuada evaluación de su sistema de coagulación. Es muy importante evaluar la deficiencia de Fe++, ya que este es un factor asociado con el aumento de la viscosidad sanguínea y con trombosis a nivel microvascular. La deshidratación empeora el aumento de la viscosidad sanguínea, por lo que sería apropiado evitar el ayuno prolongado o administrar líquidos endovenosos preoperatorios. Hay que recordar que estos pacientes tienen riesgo de embolia paradójica por lo que se debe ser cuidadoso en evitar las burbujas en las líneas venosas.
Endocarditis infecciosa: Las lesiones cardíacas cianóticas no reparadas, se encuentran entre las de mayor riesgo de complicarse con endocarditis infecciosa (EI), (aproximadamente 8,2 casos/1.000 pacientes/año) por lo cual tienen indicación de profilaxis antibiótica (PAB) ante algunos procedimientos asociados con bacteremia (Tablas 1, 2 y 3). Las últimas guías de la sociedad europea y americana de cardiología 60 , 61 , hacen especial énfasis en que la profilaxis de EI debe basarse más que en la administración de antibióticos (que no ha demostrado realmente disminuir su incidencia) en recomendaciones como una buena higiene oral con una revisión regular dental y en evitar uso de tatuajes o piercings. Esto porque las bacteremias transitorias ocurren frecuentemente en el contexto de muchas actividades diarias como lavarse los dientes o masticar y no sólo durante procedimientos dentales o quirúrgicos. Es muy importante ser rigurosos con las medidas de asepsia durante instalación y manipulación de catéteres venosos centrales o cualquier procedimiento invasivo.
Tabla 1 Condiciones cardíacas con mayor riesgo de endocarditis infecciosa que requieren profilaxis antibiótica 4 ,5
|
Recomendación de profilaxis antibiótica para prevenir EI |
Clasea |
Nivelb |
|
1. Pacientes con válvulas protésicas o reparaciones valvulares que hayan usado material protésico |
IIa
|
C |
|
2. Pacientes con EI previa |
||
|
3. Pacientes con cardiopatía congénita: – Enfermedad congénita cianótica no corregida o con defectos residuales o con shunt paliativos o conductos. – Enfermedad congénita reparada con material protésico o dispositivos colocados por vía quirúrgica o técnicas percutáneas, en los primeros 6 meses post-procedimiento. – Cuando persiste un defecto residual en el sitio de implantación de un material protésico o dispositivo, que impida su endotelización. |
||
|
4. Receptores de trasplante cardíaco que desarrollan valvulopatía* No se recomienda profilaxis antibiótica en otras formas de enfermedad valvular o enfermedad cardíaca congénita |
III |
C |
|
aTipo de recomendación; bNivel de evidencia; *Recomendación de las guías americanas, no de las guías europeas; EI: endocarditis infecciosa. |
||
Tabla 2 Recomendaciones de profilaxis antibiótica para endocarditis infecciosa de acuerdo al tipo de procedimiento 4 ,5
|
Recomendación de profilaxis antibiótica para prevenir EI |
Clasea |
Nivelb |
| Procedimientos dentales:
– Se recomienda profilaxis sólo en aquellos procedimientos que requieran manipulación de los dientes en la región gingival o periapical o perforación de la mucosa oral |
IIa |
C |
|
Procedimientos del tracto respiratorio: – Se recomienda para procedimientos que involucren incisión o biopsia de la mucosa respiratoria, ej. Adeno-amigdalectomía* – No se recomienda para otros procedimientos como broncoscopia, laringoscopia, intubación naso o endotraqueal – Cuando hay infección establecida, asegurarse que el régimen de antibióticos que se está usando cubra al estreptococo viridans |
IIa III |
C C |
| Procedimientos del tracto Gastrointestinal o Genitourinario:
– No se recomienda profilaxis antibiótica para procedimientos como endoscopia digestiva alta, colonoscopia, cistoscopia o ecocardiografía transesofágica. – Cuando hay infección establecida, asegurarse que el régimen de antibióticos que se está usando cubra al enterococo. |
III |
C |
| Procedimientos en la piel o tejidos blandos:
– No se recomienda profilaxis antibiótica en estos procedimientos. – Cuando hay infección establecida, asegurarse que el régimen de antibióticos que se está usando cubra al estafilococo y al estreptococo ß-hemolítico |
III |
C |
| aTipo de recomendación; bNivel de evidencia; *Recomendación de las guías americanas, no de las guías europeas. EI: endocarditis infecciosa. | ||
Tabla 3 Antibióticos recomendados para profilaxis de endocarditis bacteriana 4 ,5
|
Situación |
Agente |
Dosis |
|
1. Procedimientos dentales y del tracto respiratorio. Contra estreptococo viridans. |
Vía oral: Amoxicilina Vía I.V.: Ampicilina (otras opciones: cefazolina o ceftriaxona) Alérgico a Penicilinas: clindamicina (Otras opciones: azitromicina) |
Adultos 2 g Niños: 50 mg/Kg Adultos 2 g Niños: 50 mg/Kg Adultos: 600 mg Niños: 20 mg/Kg |
|
2. Procedimientos del tracto digestivo o genitourinario. Contra enterococo |
Vía oral: Amoxicilina Vía I.V.: Ampicilina (otras opciones Penicilina o Vancomicina) Alérgico a Penicilinas: Vancomicina |
Adultos 2 g Niños: 50 mg/Kg Adultos 2 g Niños: 50 mg/Kg Adultos: 1 g Niños: 10 mg/Kg |
|
3. Procedimientos en la piel o tejidos blandos. Contra estafilococo y estreptococo ß hemolítico |
Vía oral: Cefalexina (otras opciones: cloxa o dicloxacilina) Vía I.V.: Cefazolina (otras opciones: Cloxacilina) Alérgico a Penicilinas: Vancomicina (otra opción: clindamicina) |
Adultos 2 g Niños: 50 mg/Kg Adultos 1g Niños: 50 mg/Kg Adultos: 1 g Niños: 10 mg/Kg |
-
2- Manejo intraoperatorio
Una vez que hemos revisado los datos del paciente, deberíamos estar en la capacidad de planear los objetivos del manejo hemodinámico de cada uno de ellos y de este modo decidir la monitorización y la técnica anestésica. Se puede clasificar los pacientes cianóticos crónicos en dos grandes grupos con fisiología diferente: los que tienen bajo flujo pulmonar (Fallot, flujo pulmonar dependiente de shunt quirúrgicos o colaterales sistémico- pulmonares) y los pacientes con SEM. La Tabla 4 muestra las acciones que se pueden realizar durante el manejo anestésico según el tipo de lesión 62 – 64 .
Tabla 4 Objetivos hemodinámicos y manejo anestésico según la causa de la cianosis
|
Tipo de lesión |
Objetivo hemodinámico |
Manejo anestésico |
|
Bajo Flujo pulmonar – TF clásica |
Aumentar Flujo pulmonar – Disminuir o evitar la obstrucción dinámica en el tracto de salida del VD – Disminuir el shunt de derecha a izquierda por la CIV |
– Evitar estímulos adrenérgicos (dolor, drogas, etc.) – Beta-bloqueadores – Manejo de la hipovolemia – Mantener RVS altas (vasoconstrictores tipo fenilefrina) |
|
– Shunt o colaterales SP |
– Mantener presión arterial sistémica alta para asegurar presión de entrada en vasos que perfunden el pulmón |
– Evitar hipovolemia – Mantener RVS altas (vasoconstrictores tipo fenilefrina |
|
Síndrome de Eisenmenger |
Evitar aumentos de la RVP – Disminuir estímulos simpáticos. – Evitar hipercarbia, acidosis, hipotermia o empeoramiento de la hipoxemia. – Evitar aumentos de la presión intratorácica |
– Manejo del dolor, profundidad anestésica. – Manejo ventilatorio con FiO2 alta, alta frecuencia respiratoria y menores presiones intratorácicas medias. – Uso de vasodilatadores pulmonares: NO, milrinona |
|
Mantener o mejorar la función ventricular |
– Evitar depresión miocárdica. – Inótropos: Dobutamina, Milrinona |
|
|
Evitar las caídas de la RVS, que empeoran la cianosis |
– Manejo de la volemia – Dosis bajas de Noradrenalina para contrarrestar la vasodilatación – Optimización del hematocrito |
-
– Monitorización
La elección de la monitorización dependerá del procedimiento quirúrgico y el estado del paciente. Probablemente el mejor monitor en pacientes con bajo flujo pulmonar es el oxímetro de pulso, que se correlaciona bien con los cambios en el flujo sanguíneo pulmonar. Una línea arterial facilita la toma de exámenes frecuentes y permite una monitorización continua de la hemodinamia. Si el paciente tiene un shunt de arteria subclavia a una rama pulmonar es importante que la línea arterial se instale del lado contrario o la presión medida estará subestimada por el flujo que roba el shunt.
Hay que recordar que la capnografía subestima la verdadera PaCO2 en pacientes que tienen bajo flujo pulmonar o shunt de derecha a izquierda, porque se disminuye el paso de la sangre venosa por los alveolos ventilados (aumento del espacio muerto pulmonar).
El uso de un catéter venoso central puede ser muy importante en los pacientes de mayor riesgo, no tanto por la monitorización como por la posibilidad que de administrar drogas vasoactivas, que muy probablemente serán necesarias. El uso de catéter de arteria pulmonar es imposible en muchos casos y en otros se debe sopesar con sus riesgos potenciales (riesgos tromboembólicos y ruptura de arteria pulmonar). Actualmente se le está dando más valor a la ecografía transesofágica intraoperatoria que brinda monitoria hemodinámica, evalúa el estado de volemia y la función ventricular. Pero en pacientes con CC, tiene la desventaja que requiere mayor experiencia que en pacientes con corazones normales.
-
– Técnica anestésica
Sí se tienen objetivos claros y un plan para lograrlos, probablemente la técnica anestésica no debería alterar los resultados. Tanto las técnicas generales como las técnicas regionales tienen ventajas y desventajas. La anestesia general permite hacer un mejor control de los parámetros respiratorios y evita el bloqueo simpático con vasodilatación e hipotensión sistémica que puede ocurrir con las técnicas regionales, pero por otro lado puede producir mayor estimulo simpático y aumentos de la presión intratorácica que se traducirán en mayores RVP. La ventilación de los pacientes con HP debe balancearse entre la hiperventilación y la preservación de una baja presión intratorácica. Hay que manipular la frecuencia respiratoria, el volumen corriente y el modo ventilatorio (presión o volumen) para obtener la mejor paCO2 con la menor presión media intratorácica, recordando que la duración de la inspiración aumenta más la presión media que el valor pico de la presión inspiratoria 64 . La anestesia regional que evite caídas bruscas de la presión arterial es una buena opción y es especialmente utilizada en obstetricia. Existen múltiples reportes del uso seguro de anestesia regional en pacientes con SEM 65 – 67 y algunos de ellos muestran que la mortalidad de estas pacientes es menor con la utilización de anestesia regional 57 , 68 .
El manejo postoperatorio debe hacerse en unidades de cuidado intensivo ya que la mayoría de las muertes en pacientes con SEM ocurre en los primeros días postoperatorios o postparto.
CONCLUSIONES
La cianosis crónica es una enfermedad sistémica que afecta múltiples órganos y es un factor de riesgo de complicaciones perioperatorias. Los pacientes adultos con cardiopatías congénitas cianóticas deben considerarse de muy alto riesgo cuando se someten a procedimientos quirúrgicos u obstétricos e idealmente debieran ser manejados en centros de referencia que cuenten con personal capacitado en su manejo. La prioridad del manejo anestésico es entender la anatomía y fisiopatología de cada lesión y trazarse objetivos de manejo.
REFERENCIAS
- Hoffman JIE, Kaplan S, Liberthson RR. Prevalence of congenital heart disease. Am Heart J 2004; 147: 425-439.
- Marelli AJ, Mackie AS, Ionescu-Ittu R, et al. Congenital heart disease in the general population, changing prevalence and age distribution. Circulation 2007; 115: 163-172.
- Sandoval N, Kreutzer C, Jatene M, et al. Pediatric cardiovascular surgery in Routh america: current status and regional differences. World Journal for pediatric and congenital heart surgery 2010; 1: 321.
- Warnes CA, Williams RG, Bashore TM, et al. ACC/AHA 2008 Guidelines for the Management of Adults With Congenital Heart Disease. J Am Coll Cardiol 2008; 52: 1890-1947.
- Baumgartner H, Bonhoeffer P, De Groot N, et al. ESC Guidelines for the Management of grown-up congenital heart disease (new version 2010). The Task Force on the Management of Grown-up Congenital Heart Disease of the European Society of Cardiology (ESC). Eur Heart Jour 2010; 31: 2915-2957.
- Gordeuk VR, Stockton DW, Prchal JT. Congenital polycythemias/ erythrocytoses. Haematologica 2005; 90: 109-116.
- Oechslin E. Hematological Management of the cyanotic adult with congenital heart disease. Int J Card 2004; 97: 109-115.
- Warrell DA, Cox TM, Firth JD, Benz EJ. Cyanotic Heart Disease: A Multisystem Disorder. Oxford Textbook of Medicine, 4th edition. London: Oxford University Press; 2003.
- Pries AR, Secomb TW. Microvascular blood viscosity in vivo and the endothelial surface layer. Am J Physiol Heart Circ Physiol 2005; 289: H2657-H2664.
- Linderkamp O, Klose HJ, Betke K, et al. Increased blood viscosity in patients with cyanoticcongenital heart disease and iron deficiency. J Pediatr 1979; 95: 567-569.
- Schmid-Schonbein H, Wells R, Goldstone J. Influence of deformability of human red cells upon blood viscosity. Circ Res 1969; 25: 131-143.
- Engelfriet P, Boersma E, Oechslin E, et al. The spectrum of adult congenital heart disease in Europe: morbidity and mortality in a 5 year follow-up period. The Euro Heart Survey on adult congenital heart disease. Eur Heart J 2005; 26: 2325-2333.
- Ammash N, Warnes CA. Cerebrovascular events in adult patients with cyanotic congenital heart disease. J Am Coll Cardiol 1996; 28: 768-772.
- Tempe DK, Virmani S. Coagulation abnormalities in patients with cyanotic congenital heart disease. J Cardioth Vasc Anest 2002; 16: 752-765.
- Dore A, Glancy DL, Stone S, et al. Cardiac surgery for grown-up congenital heart patients: Survey of 307 consecutive operations from 1991 to 1994. Am J Cardiol 1997; 80: 906-913.
- Chauhan S, Kumar BA, Rao BH, et al. Efficacy of aprotinin, epsilon-aminocaproic acid, or combination in cyanotic heart disease. Ann Thorac Surg 2000; 70: 1308-1312.
- Colon-Otero G, Gilchrist GS, Holcomb GR, et al. Preoperative evaluation of hemostasis in patients with congenital heart disease. Mayo Clin Proc 1987; 62: 379-385.
- Goel M, Shome DK, Singh ZN, et al. Haemostatic changes in children with cyanotic and acyanotic congenital heart disease. Ind Heart J 2000; 52: 559-563.
- Ekert H, Dowling SV. Platelet release abnormality and reduced prothrombin levels in children with cyanotic congenital heart disease. Aust Paediatr J 1977; 13: 17-21.
- Goldschmidt B, Sarkadi B, Gardos G, et al. Platelet production and survival in cyanotic congenital heart disease. Scand J Haematol 1974; 13: 110-115.
- Peters AM, Rozkovec A, Bell RN, et al. Platelet kinetics in congenital heart disease. Cardiovasc Res 1982; 16: 391-397.
- Lill M C, Perloff J, Child JS. Pathogenensis of trombocitopenia in cyanotic congenital heart disease. Am J Cardiol 2006; 98: 254-258.
- Gill JC, Wilson AD, Endres-Brooks J, et al. Loss of the largest von Willebrand factor multimers from the plasma of patients with congenital cardiac defects. Blood 1986; 67: 758-761.
- Territo MC, Perloff JK, Rosove MH, et al. Acquired von Willebrand factor abnormalities in adults with congenital heart disease. Clin Appl Thrombosis/Hemostasis 1998; 4: 257-261.
- Cordina RL, Celemajer DS. Chronic cyanosis and vascular function: implications for patients with cyanotic congenital heart disease. Card Young 2010; 20: 242-253.
- Ogunshola OO, Djonov V, Staudt R, et al. Chronic excessive erythrocytosis induces endothelial activation and damage in mouse brain. Am J Physiol Regul Integr Comp Physiol 2006; 290: R678-R684.
- Rimar S, Gillis CN. Selective pulmonary vasodilation by inhaled nitric oxide is due to hemoglobin inactivation. Circulation 1993; 88: 2884-2887.
- Malek AM, Jackman R, Rosenberg RD, et al. Endothelial expression of thrombomodulin is reversibly regulated by fluid shear stress. Circ Res 1994; 74: 852-860.
- Horigome H, Murakami T, Isobe T, et al. Soluble P-selectin and thrombomodulin-protein C-Protein S pathway in cyanotic congenital heart disease with secondary erythrocytosis. Thromb Res 2003; 112: 223-227.
- Starnes SL, Duncan BW, Kneebone JM, et al. Vascular endothelial growth factor and basic fibroblast growth factor in children with cyanotic congenital heart disease. J Thorac Cardiovasc Surg 2000; 119: 534-539.
- Niwa K, Perloff JK, Bhuta SM, et al. Structural abnormalities of great arterial walls in congenital heart disease: light and electron microscopic analyses. Circulation 2001; 103: 393-400.
- Perloff JK. The coronary circulation in cyanotic congenital heart disease. Int J Cardiol 2004; 97 (Suppl 1): 79-86.
- Phornphutkul C, Rosenthal A, Nadas AS, et al. Cerebrovascular accidents in infants and children with cyanotic congenital heart disease. Am J Cardiol 1973; 32: 329-334.
- Perloff JK, Latta H, Barsotti P. Pathogenesis of the glomerular abnormality in cyanotic congenital heart disease. Am J Cardiol 2000; 86: 1198-1204.
- Ross EA, Perloff JK, Danovitch GM, et al. Renal function and urate metabolism in late survivors with cyanotic congenital heart disease. Circulation 1986; 73: 396-400.
- Anker SD, Leyva F, Poole-Wilson PA, et al. Relation between serum uric acid and lower limb blood flow in patients with chronic heart failure. Heart 1997; 78: 39-43.
- Oya H, Nagaya N, Satoh T, et al. Haemodynamic correlates and prognostic significance of serum uric acid in adult patients with Eisenmenger syndrome. Heart 2000; 84: 53-58.
- Dickinson CJ. The aetiology of clubbing and hypertrophic osteoarthropathy. Eur J Clin Invest 1993; 23: 330-338.
- Andropoulos DB, Stayer SA, Russel IA. Anesthesia for congenital heart disease. 2005, Blackwell Publishing.
- Nollert G, Fischlein T, Bouterweerk S, et al. Long-term survival in patients with repair of tetralogy of Fallot: 36-year follow-up of 490 survivors of the first year after surgical repair. J Am Coll Cardiol 1997; 30: 1374-1383.
- Pigula FA, Khalil PN, Mayer JE, et al. Repair of tetralogy of Fallot in neonates and young infants. Circulation 1999; 100 (suppl 2): 157-161.
- Kaemmerer H, Mebus S, Schulze-Neick I, et al. The Adult Patient with Eisenmenger Syndrome: A Medical Update After Dana Point Part I: Epidemiology, Clinical Aspects and Diagnostic Options. Curr Cardiol Rev 2010; 6: 343-355.
- Wood P. The Eisenmenger syndrome or pulmonary hypertension with reversed central shunt. Br Med J 1958; 20: 701-709.
- Beghetti M, Galiè N. Eisenmenger Syndrome. A Clinical Perspective in a New Therapeutic Era of Pulmonary Arterial Hypertension. J Am Coll Cardiol 2009; 53: 733-740.
- Shapiro NL, Huang RY, Sangwan S, et al. Tracheal stenosis and congenital heart disease in patients with Down syndrome: diagnostic approach and surgical options. Int J Pediatr Otorhinolaryngol 2000; 54: 137-142.
- Cappelli-Bigazzi M, Santoro G, Battaglia C, et al. Endothelial cell function in patients with Down’s syndrome. Am J Cardiol 2004; 94: 392-395.
- Young D, Mark H. Fate of the patient with the Eisenmenger syndrome. Am J Cardiol 1971; 28: 658-669.
- Duffelsa MGJ, Engelfrieta PM, Bergerb RMF. Pulmonary arterial hypertension in congenital heart disease: An epidemiologic perspective from a Dutch registry. International Journal of Cardiology 2007; 120: 198-204.
- D’Alto M, Mahadevan V. Pulmonary arterial hypertension associated with congenital heart disease. Eur Respir Rev 2012; 21: 328-337.
- Diller GP, Dimopoulos K, Broberg C. Presentation, survival prospects, and predictors of death in Eisenmenger syndrome: a combined retrospective and case-control study. Eur Heart J 2006; 27: 1737-1742.
- Oechslin E, Mebus S, Schulze-Neick I. The Adult Patient with Eisenmenger Syndrome: A Medical Update After Dana Point Part III: Specific Management and surgical aspects. Curr Cardiol Rev 2010; 6: 363-372.
- Vis JC, Duffels M, Mulder P, et al. Prolonged beneficial effect of bosentan treatment and 4-year survival rates in adult patients with pulmonary arterial hypertension associated with congenital heart disease. Int J Cardiol 2011; 2011 Jun 30. [Epub ahead of print].
- Monfredi O, Griffiths L, Clarke B, et al. Efficacy and Safety of Bosentan for Pulmonary Arterial Hypertension in Adults With Congenital Heart Disease. Am J Cardiol 2011; 108: 1483-1488.
- Dimopoulos K, Peset A, Gatzoulis M. Evaluating operability in adults with congenital heart disease and the role of pretreatment with targeted pulmonary arterial hypertension therapy. Int J Cardio 2008; 129: 163-171.
- Perloff J, Sopher M. Noncardiac surgery. In: Perloff J, Child J, Aboulhosn J, Congenital Heart Disease in Adults. 3rd ed: Saunders / Elsevier; 2009; pp. 380-389.
- Ammash NM, Connolly HM, Abel MD, et al. Noncardiac surgery in Eisenmenger syndrome. J Am Coll Cardiol 1999; 33: 222-227.
- Bédard E, Dimopoulos K, Gatzoulis MA. Has there been any progress made on pregnancy outcomes among women with pulmonary arterial hypertension?. Eur Heart J 2009; 30: 256-265.
- Kilner PJ, Geva T, Kaemmerer H, et al. Recommendations for cardiovascular magnetic resonance in adults with congenital heart disease from the respective working groups of the European Society of Cardiology. Eur Heart J 2010; 31: 794-805.
- Galie N, Hoeper MM, Humbert M, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J 2009; 34: 1219-1263.
- Habib G, Hoen B, Tornoso P, et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009). The Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Eur Heart J 2009; 30: 2369-2413.
- Wilson W, Taubert K, Gewitz M, et al. Prevention of Infective Endocarditis Guidelines From the American Heart Association. A Guideline From the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation 2007; 116: 1736-1754.
- Seal R. Adult congenital heart disease. Pediatric Anesth 2011; 21: 615-622.
- Cannesson M, Earing M, Collange V, et al. Anesthesia for Noncardiac Surgery in Adults with Congenital Heart Disease. Anesthesiology 2009; 111: 432-440.
- Chassot PG, Bettex DA. Anesthesia and Adult Congenital Heart Disease. J Cardioth Vasc Anesth 2006; 20: 414-437.
- Gurumurthy T, Hegde R, Mohandas BS. Anaesthesia for a patient with Eisenmenger’s syndrome undergoing caesarean section. Indian J Anaesth 2012; 563: 291-294.
- Ghai B, Mohan V, Khetarpal M, et al. Epidural anesthesia for cesarean section in a patient with Eisenmenger’s syndrome. Int J Obstet Anesth 2002; 11: 44-47.
- Parneix M, Fanou L, Morau E, et al. Low-dose combined spinal-epidural anaesthesia for caesarean section in a patient with Eisenmenger’s syndrome. Int J Obstet Anesth 2009; 18: 81-84.
- Martin JT, Tautz TJ, Antognini JF. Safety of regional anesthesia in Eisenmenger’s syndrome. Reg Anesth Pain Med 2002; 27: 509.