David Barra Ortiz1,* Maximiliano Zamora Helo2
Recibido: 10-03-2024
Aceptado: 02-04-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 5 pp. 495-500|https://doi.org/10.25237/revchilanestv53n5-09
PDF|ePub|RIS
Vasoplegia in cardiac surgery What’s new?
Abstract
Vasoplegic syndrome is a common complication in cardiac surgery, its incidence according to definition can occur between 5% – 50% of patients. It is defined as a state of hypoperfusion secondary to a drop in systemic vascular resistance. Risk factors include chronic kidney disease, emergency cardiac surgery, and prolonged cardiopulmonary bypass times. Its pathophysiology is multifactorial, highlighting the release of inflammatory mediators with vasodilatory properties, expression of nitric oxide synthetase, desensitization of adrenergic receptors and decrease in circulating vasopressin. Management includes constant evaluation, fluid administration, and first-line vasopressors that include norepinephrine and vasopressin. Rescue therapies include methylene blue, angiotensin II, hydroxocobalamin, and cytokine hemoadsorption therapies.
Resumen
El síndrome vasopléjico es una complicación común en cirugía cardíaca, su incidencia, según la definición que se utilice, es de 5% a 50% de los pacientes sometidos a este tipo de cirugía. Se define como un estado de hipoperfusión secundario a una caída en la resistencia vascular sistémica. Dentro de los factores de riesgo se incluye la enfermedad renal crónica, cirugía cardíaca de emergencia y tiempos de cardiopulmonar prolongados. Su fisiopatología es multifactorial, destacando la liberación de mediadores inflamatorios con propiedades vasodilatadores, expresión de óxido nítrico sintetasa, desensibilización de receptores adrenérgicos, y disminución de vasopresina circulante. El manejo incluye evaluación constante, administración de fluidos y vasopresores como norepinefrina y vasopresina de primera línea. Dentro de las terapias vasopresoras de rescate se incluye y se hace una revisión de azul de metileno, angiotensina II, hidroxocobalamina y las terapias de hemoadsorción de citoquinas.
-
Introducción
Vasoplejia es un síndrome caracterizado por hipoperfusión tisular asociado a una disminución en la resistencia vascular sistémica (RVS) en presencia de un gasto cardíaco normal o alto. Los criterios diagnósticos publicados en la literatura son variables, pero una RVS < 800 dinas/s/cm5, presión arterial media (PAM) < 65 mmHg y un índice cardíaco > 2,2 L/ min/m2 son consistentes con vasoplejia[1],[2]. A menudo se sospecha por una necesidad persistente de fármacos vasopresores en dosis ‘’altas’’, sin estar definido este límite, para mantener una presión arterial adecuada.
La incidencia de síndrome vasopléjico en cirugía cardíaca varía según distintas publicaciones, pero se puede observar entre el 5%-25% de los pacientes que no presentan factores de riesgo[3]y entre 30%-50% en los grupos que si los presentan[4].
Los factores de riesgo para vasoplejia post cirugía cardíaca los podemos agrupar en preoperatorios, intraoperatorios y postoperatorio, estos se resumen en la Tabla 1. Un factor de riesgo a destacar es la enfermedad renal crónica, que tiene un Odds ratio (OR) de 1,47; 95% CI 1,17-1,86, esto parece estar asociado a los altos niveles de citoquinas proinflamatorias y la disfunción endotelial que presenta este grupo de pacientes[5]. Dentro de los factores intraoperatorios se encuentra la cirugía combinada OR 2,12; 95% CI 1,82-2,47, tiempos prolongados de circulación extracorpórea y clampeo aórtico.
-
Fisiopatología
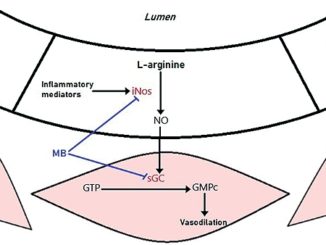
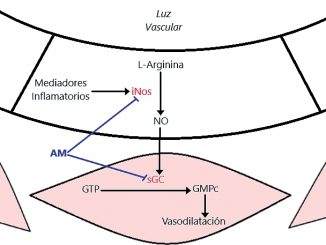
Para poder comprender el síndrome vasopléjico debemos comprender la fisiología de la contracción de la célula de músculo liso presente en los vasos sanguíneos. La fosforilación de la cadena ligera de miosina (CLM) es la piedra angular de la contracción del músculo liso. Los agentes vasoconstrictores como norepinefrina (NE), angiotensina 2 (AT-II) y vasopresina activan los receptores acoplados a proteína G (RPG) de la superficie celular para inducir un aumento en la concentración intracelular de calcio (Ca++) en las células del músculo liso vascular. A su vez, el Ca++ se une a la calmodulina, formando un complejo que activa la CLM quinasa para promover la fosforilación de esta, con la posterior interacción actina-miosina y contracción del músculo liso[6]. Por el contrario, los vasodilatadores como el óxido nítrico (NO) y los péptidos natriuréticos desencadenan un aumento dependiente de la guanilil ciclasa del monofosfato de guanosina cíclico (GMPc), que activa la miosina fosfatasa para desfosforilar el CLM, previniendo así la contracción del músculo liso[7].
La fisiopatología del síndrome vasopléjico es compleja del punto de vista molecular, pero la resumiremos en sus distintos mecanismos que la generan durante la cirugía cardíaca y el uso del bypass cardiopulmonar (BCP).
1. En primer lugar, existe una desensibilización del receptor adrenérgico debido al aumento de las citoquinas IL-1, IL-6 y TNF alfa por dos mecanismos. Uno debido a una disminución en la expresión celular de los receptores y el segundo es debido a la liberación excesiva de catecolaminas durante el BCP[8].
2. Existe un incremento en la producción de NO debido a la sobreexpresión de la isoforma óxido nítrico sintetasa inducible (iNOS). El mecanismo principal por el cual el NO ejerce sus propiedades vasodilatadoras es la activación de la guanilil ciclasa en la célula muscular lisa de la vasculatura promoviendo la formación de GMPc permitiendo la desfosforilación de la CLM[9].
3. Además, se sabe que la hipotensión persistente resulta en una progresiva disminución de vasopresina. En pacientes que desarrollan vasoplejia, Colson y cols., mostró que estos pacientes presentan una significativa caída en los niveles plasmáticos de esta hormona a las 8 h posteriores al BCP, comparado con los pacientes que no desarrollan vasoplejia[10]. Esta disminución anula los efectos vasopresores que dependen del receptor vascular V1, promoviendo así, un estado de vasodilatación.
4. Por último, se genera una disfunción del sistema renina angiotensina. La AT-II se genera por la acción de la enzima convertidora de angiotensina , presente en el endotelio pulmonar, sobre la angiotensina 1 (AT-I). La AT-II se une al receptor de AT-I generando un aumento del calcio iónico intracelular y en consecuencia vasoconstricción. Durante el BCP existe una exclusión de la vasculatura pulmonar y la formación de AT-II está disminuida y se promueve la conversión de AT-I en angiotensinógeno 1-7 que presenta propiedades vasodilatadoras[11].
Tabla 1. Factores de riesgo para el desarrollo de vasoplejia en cirugía cardíaca
| Preoperatorios | Intraoperatorios | Postoperatorios |
| Enfermedad renal crónica | Cirugía emergencia | Transfusión glóbulos rojos |
| Diabetes Mellitus | Cirugía combinada | |
| Fracción de eyección reducida | Tiempo prolongado de bypass cardiopulmonar
Tiempo prolongado de clampeo aórtico |
-
Resultados
Hoy estamos viviendo la era de la medicina perioperatoria y dándole importancia acerca de los resultados que obtienen nuestro pacientes. Existen estudios que han evaluado cuales son los resultados de los pacientes que sufren vasoplejia post cirugía cardíaca. Estos pacientes requieren más apoyo vasopre- sor, tienen más complicaciones hemorrágicas, más disfunción hepática, renal y respiratoria, lo que conlleva mayor tiempo de ventilación mecánica versus pacientes que no cursan con vasoplejia. Estas complicaciones impactan en la sobrevida de los pacientes, con tasas de mortalidad reportadas entre 5,6%-15% versus 3,4%-6% que se reporta en población general sometida a cirugía cardíaca[5],[12]-[13].
-
Tratamiento
Una presión arterial media (PAM) de 65-70 mmHg es considerada hoy la meta hemodinámica en distintos tipos de shock. Además, deberíamos realizar monitorización de los parámetros de perfusión tisular de forma constante[14]. Antiguamente, el inicio de la terapia vasopresora se sugería posterior a la administración de fluídos, actualmente se recomienda iniciar en forma conjunta vasopresores y fluídos, esta recomendación se extrapola de la vasoplejia inducida por sepsis ya que se ha asociado con disminución de la mortalidad[15]. Las drogas vasoconstrictoras que se pueden utilizar se resumen en la Tabla 2.
-
Norepinefrina
La norepinefrina se una al receptar alfa 1 y beta 1 para incrementar el Ca++ y promover la contracción de la célula muscular lisa vascular. Aunque no existe evidencia de que su uso mejore la mortalidad en pacientes con síndrome vasopléjico post BCP, se recomienda como primera opción en múltiples publicaciones. Además, no existe una recomendación universal
Tabla 2. Resumen vasoconstrictores utilizados en tratamiento de vasoplejia en cirugía cardíaca
| Agente
Noradrenalina Vasopresina Azul Metileno |
Mecanismo de Acción
Acción alfa-2 Acción V1 Inhibición óxido nítrico sintetasa Inhibición de Guanilil ciclasa |
Dosis
0,01 – 1 mcg/kg/min IV 0,03 – 0,06 Ui/min IV 1-2 mg/kg IV |
| Hidroxocobalamina | Inhibición óxido nítrico sintetasa
Inhibición de óxido nítrico |
5 g IV |
| Angiotensina II | Acción AT-1 | 10-40 ng/kg/min IV |
| Hidrocortisona | Reducción citoquinas proinflamatorias
Aumentos síntesis de adrenoreceptores |
50 mg cada 6 h IV |
acerca de la dosis límite para iniciar un segundo vasopresor, esta varia desde 0,1-0,7 mcg/kg/min[16],[17].
-
Vasopresina
La vasopresina se une al receptor V1 promoviendo la vasoconstricción, como se mencionó anteriormente, la disminución de la vasopresina circulante en paciente sometidos al bypass cardiopulmonar genera un nicho racional para su uso. Además, presenta la ventaja de aumentar la resistencia vascular sistémica sin aumentar la resistencia vascular pulmonar, por lo tanto, mejora la presión de perfusión del ventrículo derecho sin aumentar su postcarga[18].
La evidencia de su uso se sustenta en el estudio VANCS[19]un ensayo clínico randomizado de 300 pacientes que presentaron síndrome vasopléjico post cirugía cardíaca, en quienes se comparó el uso de vasopresina en dosis de 0,01 – 0,06 U/min versus norepinefrina en dosis 10 – 60 mcg/min para mantener PAM > 65 mmHg. Este trabajo mostró que los pacientes en quienes se administró vasopresina tuvieron disminución del outcome primario, el cual era mortalidad a 30 días, y complicaciones severas (32% vs 49%, p = 0,0014). Además, presentaron menos fibrilación auricular sin presentar aumento en el riesgo de isquemia miocárdica, intestinal o digital.
-
Azul de metileno
El azul de metileno es un colorante que se utiliza como tratamiento de la metahemoglobinemia. Su mecanismo de acción para tratar la vasoplejia es múltiple, incluyendo inhibición de oxido nítrico sintetasa (NOS), inhibición de la enzima guanilil ciclasa y por eliminación directa del óxido nítrico[20].
Existen varios estudios acerca del uso de azul de metileno y vasoplejia en cirugía cardíaca, pero sus resultados son dispares. Levin y cols., randomizó 54 pacientes con diagnóstico de síndrome vasopléjico post cirugía cardiaca a recibir 1,5 mg/kg vs placebo. Esta grupo reportó una disminución en la mortalidad en los pacientes en quienes se utilizó al azul de metileno (0% vs 21%, p < 0,001)[21].
Otro estudio retrospectivo de 88 pacientes a quienes se les administró azul de metileno para vasoplejia post cirugía cardíaca mostró un aumento en 8 mmHg en la presión arterial media y su peak de acción fue a las 2 h. Además, el año 2022 Kofler y cols., publicaron una cohorte de 10 años con el uso precoz de azul de metileno, dentro de 15 minutos de diagnosticada la vasoplejia, que incluía a 221 pacientes, ellos concluyeron que luego de la administración precoz de azul de metileno los pacientes tenían presión arterial media más alta y menos uso de vasopresores, pero sin diferencia en mortalidad a los 90 días[22].
En contraste con los estudios anteriores, Weiner y cols., en un estudio retrospectivo que incluía 226 pacientes con el diagnóstico de vasoplejia, el uso de azul de metileno fue un factor independiente de complicaciones posoperatorias (p = 0,001) y recomiendan no ocuparlo como primera línea en vasoplejia[23].
Sus contraindicaciones son principalmente déficit de glu- cosa-6-fosfato deshidrogenasa, debido a que podría generar anemia hemolítica y el uso concomitante de medicamentos antidepresivos debido a que puede desencadenar síndrome sero- toninérgico.
Basados en la evidencia actual, los grupos expertos internacionales se han manifestado en contra del uso de azul de metileno para otro motivo que no sea el rescate de vasoplejia post cirugía cardíaca[24].
-
Angiotensina II
La posible disfunción del sistema renina angiotensina y la consecuente disminución en los niveles plasmáticos de angio- tensina II, como posible factor que genere vasoplejia en cirugía cardíaca, apoya la administración de angiotensina II como tratamiento de esta condición. El estudio clínico randomizado ATHOS -III comparó en 344 pacientes con shock vasodilator la adición de angiotensina II a la terapia estándar vs placebo. Este trabajo demostró que la angiotensina II fue efectiva en aumentar la presión arterial media en pacientes que no respondían a terapia convencional sin diferencias en efectos adversos[25]. Posterior a esto se realizó un análisis post hoc de este estudio en que se incluyó a 16 pacientes con vasoplejia post cirugía cardíaca el que nos confirma que el aumento en la presión arterial media fue alcanzado por el 89% de los pacientes a los que se adicionó AT-II vs 0% en el grupo placebo[26].
Se han publicado numerosos reportes y series de casos en cirugía cardíaca sobre el tratamiento de vasoplejia incluyendo pacientes durante trasplante cardíaco, endocarditis, asistencia ventricular izquierda y trasplante pulmonar[27],[28]. A pesar de
lo anterior, no existe evidencia de alta calidad que apoye el uso de angiotensina II como tratamiento de vasoplejia post cirugía cardíaca aunque varios grupos la han incorporado dentro de sus algoritmos de manejo como terapia de rescate.
-
Hidroxocobalamina
Hidroxocobalamina (vitamina B12, Cyanokit®) es una droga exclusivamente aprobada por la Food and Drug Administration (FDA) para el tratamiento de la intoxicación por cianuro. Su principal efecto secundario es la extrema hipertensión vista entre el 18%-28% de los pacientes en los que se usa. Su mecanismo de acción seria dual, inhibiendo al óxido nítrico y a la NOS[29].
Su uso en vasoplejia es reciente y se limita a series de casos y estudios retrospectivos. Estos trabajos han utilizado principalmente la dosis recomendada para la intoxicación por cianuro, 5 g IV administrados durante 15 min como infusión y ha mostrado aumento en presión arterial y reducción de las dosis de vasopresores[30].
Uno de las trabajos precursores sobre este tema y de mayor tamaño es el estudio de Shah y cols.[31], el que, en una serie de 33 pacientes con vasoplejia en cirugía cardíaca, demostró respuesta vasopresora al usar un bolo de hidroxocobalamina, en 24 pacientes. Sin embargo, esta respuesta no fue mantenida en el tiempo e incluso en algunos existió efecto rebote al suspender la infusión. Por los resultados anteriores, se estudió su infusión prolongada, durante 6 h, en una serie de 12 casos de vasoplejia post BCP y se evidenció una disminución de los vasopresores en todos los pacientes[32].
Una revisión sistemática de hidroxocobalamina vs azul de metileno para el tratamiento de vasoplejia post cirugía cardíaca solo mostró una PAM más alta en el grupo hidroxocobala- mina, sin diferencias en dosis de vasopresores ni en mortalidad[33].
A pesar de lo anterior, varios grupos han incluído a la hidro- xocobalamina dentro de sus algoritmos de manejo de vasoplejia post cirugía cardíaca. Pero aún quedan dudas acerca de a quién, cómo, cuánto y cuándo deberíamos administrar este fármaco para el tratamiento de vasoplejia en cirugía cardíaca[34]y es necesario la realización de estudios de mayor calidad metodológica para resolver estas dudas.
-
Corticoesteroides
Los corticoesteroides han sido utilizados para el tratamiento de la vasoplejía post cirugía cardíaca basado en dos mecanismos fisiopatológicos, el primero es que estos permiten una reducción en la expresión de citoquinas inflamatorias y segundo aumentan la síntesis y sensibilidad de los adrenoreceptores.
En cirugía cardíaca existen dos estudios que evaluaron los efectos de altas dosis de corticoesteroides en mortalidad y morbilidad y no mostraron grandes efectos en estos resulta- dos[35],[36]. Un metaanálisis del uso de corticoides en cirugía cardíaca mostró que su uso podría estar asociado con disminución de marcadores de inflamación, riesgo de fibrilación auricular, falla renal, estadía en UCI y estadía hospitalaria pero no se estudió su uso específicamente en vasoplejia post BCP.
A pesar de su nula evidencia actual en vasoplejia post cirugía cardíaca, varios centros los incluyen dentro de sus algo ritmos de tratamiento del síndrome vasopléjico, extrapolando evidencia desde estudios en pacientes con shock séptico[38].
-
Hemoadsorción de citoquinas
La hemoadsorción de citoquinas es una técnica de purificación sanguínea usando filtros diseñados para la extracción de mediadores inflamatorios de la circulación sanguínea[39]. La evidencia proviene de reportes y series de casos en pacientes con shock séptico con resultados prometedores.
El año 2022, se publicó el estudio REMOVE, un ensayo clínico randomizado multicéntrico que incluyó 288 pacientes con endocarditis infecciosa, que comparó el uso de remoción de citoquinas vs la terapia estándar. Este ensayo no pudo demostrar una reducción en la disfunción orgánica posoperatoria. Solo mostró una disminución de citoquinas IL-1 e IL- 18 al final del BCP, sin diferencia en ningún outcome clínico medido[40].
Además, el mismo año se publicó un metaanálisis y revisión sistemática del uso de terapia de hemoadsorción en pacientes críticamente enfermos, dentro del cual incluye 10 estudios en cirugía cardíaca, que mostró, con baja calidad de evidencia, que el uso de terapia de hemoadsorción en estos pacientes podría aumentar la mortalidad y que los efectos adversos son frecuentes y no han sido sistemáticamente estudiados[41].
Sin embargo, el mismo año 2022, se publica un metaanáli- sis y revisión sistemática acerca del uso de filtros de citoquinas durante el BCP que incluyó 15 estudios en cirugía cardíaca y dentro de sus conclusiones destaca una disminución en la mortalidad a 30 días (OR 0,40, 95% CI 0,20-0,83; p = 0,01) en pacientes sometidos a cirugías de emergencia (que incluye a pacientes con endocarditis infecciosa)[42].
Con estos datos podemos decir que la eficacia y seguridad del uso de filtros para remover citoquinas aún no está establecida y no se puede recomendar el uso en pacientes con vasoplejía en cirugía cardíaca.
-
Conclusión
El síndrome vasopléjico es una complicaciones frecuente post cirugía cardíaca y trae consigo un gran impacto en morbilidad y mortalidad de quienes presentan esta complicación. Su definición varia ampliamente en la literatura pero varios criterios son homogéneos e incluyen una RVS disminuida asociada a un índice cardíaco normal o elevado. Dentro de los factores de riesgo se encuentran enfermedad renal crónica, cirugía de emergencia y tiempo de clampeo aórtico prolongado. Su tratamiento se basa inicialmente en adecuada reposición de fluidos y en aumentar la resistencia vascular sistémica. Dentro de los pilares iniciales se encuentra la administración de norepinefrina y vasopresina solos o en combinación. Dentro de los tratamientos de rescate con poco nivel de evidencia se encuentra el azul de metileno, el uso de angiotensina II e hidroxocobalamina. Siendo necesarios estudios de mayor calidad metodológica para incluirlos como tratamiento de primera línea.
-
Referencias
1. Busse LW, Barker N, Petersen C. Vasoplegic syndrome following cardiothoracic surgery-review of pathophysiology and update of treatment options. Crit Care. 2020 Feb;24(1):36. https://doi.org/10.1186/s13054-020-2743-8 PMID:32019600
2. Cremer J, Martin M, Redl H, Bahrami S, Abraham C, Graeter T, et al. Systemic inflammatory response syndrome after cardiac operations. Ann Thorac Surg. 1996 Jun;61(6):1714–20. https://doi.org/10.1016/0003-4975(96)00055-0 PMID:8651772
3. Fischer GW, Levin MA. Vasoplegia during cardiac surgery: current concepts and management. Semin Thorac Cardiovasc Surg. 2010;22(2):140–4. https://doi.org/10.1053/j.semtcvs.2010.09.007 PMID:21092891
4. Weis F, Kilger E, Beiras-Fernandez A, Nassau K, Reuter D, Goetz A, et al. Association between vasopressor dependence and early outcome in patients after cardiac surgery. Anaesthesia. 2006 Oct;61(10):938–42. https://doi.org/10.1111/j.1365-2044.2006.04779.x PMID:16978306
5. Dayan V, Cal R, Giangrossi F. Risk factors for vasoplegia after cardiac surgery: a meta-analysis. Interact Cardiovasc Thorac Surg. 2019 Jun;28(6):838–44. https://doi.org/10.1093/icvts/ivy352 PMID:30649312
6. Touyz RM, Alves-Lopes R, Rios FJ, Camargo LL, Anagnostopoulou A, Arner A, et al. Vascular smooth muscle contraction in hypertension. Cardiovasc Res. 2018 Mar;114(4):529–39. https://doi.org/10.1093/cvr/cvy023 PMID:29394331
7. Landry DW, Oliver JA. The pathogenesis of vasodilatory shock. N Engl J Med. 2001 Aug;345(8):588–95. https://doi.org/10.1056/NEJMra002709 PMID:11529214
8. Busse LW, Barker N, Petersen C. Vasoplegic syndrome following cardiothoracic surgery-review of pathophysiology and update of treatment options. Crit Care. 2020 Feb;24(1):36. https://doi.org/10.1186/s13054-020-2743-8 PMID:32019600
9. Pacher P, Beckman JS, Liaudet L. Nitric oxide and peroxynitrite in health and disease. Physiol Rev. 2007 Jan;87(1):315–424. https://doi.org/10.1152/physrev.00029.2006 PMID:17237348
10. Colson PH, Bernard C, Struck J, Morgenthaler NG, Albat B, Guillon G. Post cardiac surgery vasoplegia is associated with high preoperative copeptin plasma concentration. Crit Care. 2011;15(5):R255. https://doi.org/10.1186/cc10516 PMID:22026977
11. Chow JH, Wittwer ED, Wieruszewski PM, Khanna AK. Evaluating the evidence for angiotensin II for the treatment of vasoplegia in critically ill cardiothoracic surgery patients. J Thorac Cardiovasc Surg. 2022 Apr;163(4):1407–14. https://doi.org/10.1016/j.jtcvs.2021.02.097 PMID:33875258
12. Hajjar LA, Vincent JL, Barbosa Gomes Galas FR, Rhodes A, Landoni G, Osawa EA, et al. Vasopressin versus Norepinephrine in Patients with Vasoplegic Shock after Cardiac Surgery: The VANCS Randomized Controlled Trial. Anesthesiology. 2017 Jan;126(1):85–93. https://doi.org/10.1097/ALN.0000000000001434 PMID:27841822
13. Hansen LS, Hjortdal VE, Andreasen JJ, Mortensen PE, Jakobsen CJ. 30-day mortality after coronary artery bypass grafting and valve surgery has greatly improved over the last decade, but the 1-year mortality remains constant. Ann Card Anaesth. 2015;18(2):138–42. https://doi.org/10.4103/0971-9784.154462 PMID:25849679
14. De Backer D, Cecconi M, Lipman J, Machado F, Myatra SN, Ostermann M, et al. Challenges in the management of septic shock: a narrative review. Intensive Care Med. 2019 Apr;45(4):420–33. https://doi.org/10.1007/s00134-019-05544-x PMID:30741328
15. Li Y, Li H, Zhang D. Timing of norepinephrine initiation in patients with septic shock: a systematic review and meta-analysis. Crit Care. 2020 Aug;24(1):488. https://doi.org/10.1186/s13054-020-03204-x PMID:32762765
16. Guarracino F, Habicher M, Treskatsch S, Sander M, Szekely A, Paternoster G, et al. Vasopressor Therapy in Cardiac Surgery-An Experts’ Consensus Statement. J Cardiothorac Vasc Anesth. 2021 Apr;35(4):1018–29. https://doi.org/10.1053/j.jvca.2020.11.032 PMID:33334651
17. Ltaief Z, Ben-Hamouda N, Rancati V, Gunga Z, Marcucci C, Kirsch M, et al. Vasoplegic Syndrome after Cardiopulmonary Bypass in Cardiovascular Surgery: Pathophysiology and Management in Critical Care. J Clin Med. 2022 Oct;11(21):6407. https://doi.org/10.3390/jcm11216407 PMID:36362635
18. Yimin H, Xiaoyu L, Yuping H, Weiyan L, Ning L. The effect of vasopressin on the hemodynamics in CABG patients. J Cardiothorac Surg. 2013 Mar;8(1):49. https://doi.org/10.1186/1749-8090-8-49 PMID:23497457
19. Hajjar LA, Vincent JL, Barbosa Gomes Galas FR, Rhodes A, Landoni G, Osawa EA, et al. Vasopressin versus Norepinephrine in Patients with Vasoplegic Shock after Cardiac Surgery: The VANCS Randomized Controlled Trial. Anesthesiology. 2017 Jan;126(1):85–93. https://doi.org/10.1097/ALN.0000000000001434 PMID:27841822
20. Mazzeffi M, Hammer B, Chen E, Caridi-Scheible M, Ramsay J, Paciullo C. Methylene blue for postcardiopulmonary bypass vasoplegic syndrome: A cohort study. Ann Card Anaesth. 2017;20(2):178–81. https://doi.org/10.4103/aca.ACA_237_16 PMID:28393777
21. Levin RL, Degrange MA, Bruno GF, Del Mazo CD, Taborda DJ, Griotti JJ, et al. Methylene blue reduces mortality and morbidity in vasoplegic patients after cardiac surgery. Ann Thorac Surg. 2004 Feb;77(2):496–9. https://doi.org/10.1016/S0003-4975(03)01510-8 PMID:14759425
22. Kofler O, Simbeck M, Tomasi R, Hinske LC, Klotz LV, Uhle F, et al. Early Use of Methylene Blue in Vasoplegic Syndrome: A 10-Year Propensity Score-Matched Cohort Study. J Clin Med. 2022 Feb;11(4):1121. https://doi.org/10.3390/jcm11041121 PMID:35207394
23. Weiner MM, Lin HM, Danforth D, Rao S, Hosseinian L, Fischer GW. Methylene blue is associated with poor outcomes in vasoplegic shock. J Cardiothorac Vasc Anesth. 2013 Dec;27(6):1233–8. https://doi.org/10.1053/j.jvca.2013.02.026 PMID:23972738
24. Vasopressor Therapy in Cardiac Surgery—An Experts’ Consensus Statement Guarracino, Fabio et al. J Cardiothorac Vasc Anesth. •••;35(4):1018–29. https://doi.org/10.1053/j.jvca.2020.11.032.
25. Khanna A, English SW, Wang XS, Ham K, Tumlin J, Szerlip H, et al.; ATHOS-3 Investigators. Angiotensin II for the Treatment of Vasodilatory Shock. N Engl J Med. 2017 Aug;377(5):419–30. https://doi.org/10.1056/NEJMoa1704154 PMID:28528561
26. Klijian A, Khanna AK, Reddy VS, Friedman B, Ortoleva J, Evans AS, et al. Treatment With Angiotensin II Is Associated With Rapid Blood Pressure Response and Vasopressor Sparing in Patients With Vasoplegia After Cardiac Surgery: A Post-Hoc Analysis of Angiotensin II for the Treatment of High-Output Shock (ATHOS-3) Study. J Cardiothorac Vasc Anesth. 2021 Jan;35(1):51–8. https://doi.org/10.1053/j.jvca.2020.08.001 PMID:32868152
27. Angiotensin II for Critically Ill Patients With Shock After Heart Transplant Cutler, Nathan S. et al. J Cardiothorac Vasc Anesth. •••;35(9):2756–62. https://doi.org/10.1053/j.jvca.2020.07.087.
28. Synthetic Human Angiotensin II for Postcardiopulmonary Bypass Vasoplegic Shock Wieruszewski, Patrick M. et al. J Cardiothorac Vasc Anesth. •••;33(11):3080–4. https://doi.org/10.1053/j.jvca.2019.03.004.
29. Cai Y, Mack A, Ladlie BL, Martin AK. The use of intravenous hydroxocobalamin as a rescue in methylene blue-resistant vasoplegic syndrome in cardiac surgery. Ann Card Anaesth. 2017;20(4):462–4. https://doi.org/10.4103/aca.ACA_88_17 PMID:28994688
30. Shapeton AD, Mahmood F, Ortoleva JP. Hydroxocobalamin for the Treatment of Vasoplegia: A Review of Current Literature and Considerations for Use. J Cardiothorac Vasc Anesth. 2019 Apr;33(4):894–901. https://doi.org/10.1053/j.jvca.2018.08.017 PMID:30217583
31. Shah PR, Reynolds PS, Pal N, Tang D, McCarthy H, Spiess BD. Hydroxocobalamin for the treatment of cardiac surgery-associated vasoplegia: a case series. Can J Anaesth. 2018 May;65(5):560–8. https://doi.org/10.1007/s12630-017-1029-3 PMID:29209927
32. Seelhammer TG, Plack D, Nei S, Wittwer E, Nelson J, Nabzdyk CG. Extended duration infusion of high-dose hydroxocobalamin for vasoplegic syndrome following cardiac surgery. Heart Lung. 2021;50(2):173–6. https://doi.org/10.1016/j.hrtlng.2020.11.003 PMID:33242823
33. Brokmeier HM, Seelhammer TG, Nei SD, Gerberi DJ, Mara KC, Wittwer ED, et al. Hydroxocobalamin for Vasodilatory Hypotension in Shock: A Systematic Review With Meta-Analysis for Comparison to Methylene Blue. J Cardiothorac Vasc Anesth. 2023 Sep;37(9):1757–72. https://doi.org/10.1053/j.jvca.2023.04.006 PMID:37147207
34. Kumar N, Rahman GR, Falkson S, Lu SY, Dalia A. Hydroxocobalamin in Refractory Vasodilatory Shock: More Questions than Answers. J Cardiothorac Vasc Anesth. 2023 Sep;37(9):1773–5. https://doi.org/10.1053/j.jvca.2023.05.001 PMID:37225547
35. Dieleman JM, Nierich AP, Rosseel PM, van der Maaten JM, Hofland J, Diephuis JC, et al.; Dexamethasone for Cardiac Surgery (DECS) Study Group. Intraoperative high-dose dexamethasone for cardiac surgery: a randomized controlled trial. JAMA. 2012 Nov;308(17):1761–7. https://doi.org/10.1001/jama.2012.14144 PMID:23117776
36. Whitlock RP, Young E, Noora J, Farrokhyar F, Blackall M, Teoh KH. Pulse low dose steroids attenuate post-cardiopulmonary bypass SIRS; SIRS I. J Surg Res. 2006 May;132(2):188–94. https://doi.org/10.1016/j.jss.2006.02.013 PMID:16566943
37. Chai T, Zhuang X, Tian M, Yang X, Qiu Z, Xu S, et al. Meta-Analysis: Shouldn’t Prophylactic Corticosteroids be Administered During Cardiac Surgery with Cardiopulmonary Bypass? Front Surg. 2022 Jun;9:832205. https://doi.org/10.3389/fsurg.2022.832205 PMID:35722531
38. Sprung CL, Annane D, Keh D, Moreno R, Singer M, Freivogel K, et al.; CORTICUS Study Group. Hydrocortisone therapy for patients with septic shock. N Engl J Med. 2008 Jan;358(2):111–24. https://doi.org/10.1056/NEJMoa071366 PMID:18184957
39. Ricci Z, Romagnoli S, Reis T, Bellomo R, Ronco C. Hemoperfusion in the intensive care unit. Intensive Care Med. 2022 Oct;48(10):1397–408. https://doi.org/10.1007/s00134-022-06810-1 PMID:35984473
40. Diab M, Lehmann T, Bothe W, Akhyari P, Platzer S, Wendt D, et al.; REMOVE Trial Investigators*. Cytokine Hemoadsorption During Cardiac Surgery Versus Standard Surgical Care for Infective Endocarditis (REMOVE): Results From a Multicenter Randomized Controlled Trial. Circulation. 2022 Mar;145(13):959–68. https://doi.org/10.1161/CIRCULATIONAHA.121.056940 PMID:35213213
41. Heymann M, Schorer R, Putzu A. Mortality and adverse events of hemoadsorption with CytoSorb® in critically ill patients: A systematic review and meta-analysis of randomized controlled trials. Acta Anaesthesiol Scand. 2022 Oct;66(9):1037–50. https://doi.org/10.1111/aas.14115 PMID:35788557
42. Use of Cytokine Filters During Cardiopulmonary Bypass: Systematic Review and Meta-Analysis Naruka, Vinci et al. Heart, Lung and Circulation, Volume 31, Issue 11, 1493 – 1503.

 ORCID
ORCID