Alejandro Luengo T.* y Claudia Carvajal F.**
Reve Chil Anest Vol. 42 Número 2 pp. 167-179|doi:
PDF|ePub|RIS
Introducción
La anestesia general produce alteraciones de la fisiología pulmonar que pueden traducirse en complicaciones perioperatorias en un 2 a 20% de los pacientes 1 , 2 , dependiendo de sus condiciones basales y del tipo de cirugía realizada.
La formación de atelectasias es la complicación pulmonar más frecuente en el período perioperatorio. En estudios realizados con imágenes se ha confirmado que entre 5 y 10 min después de la inducción anestésica, hasta un 90% de los pacientes presentan atelectasias en las zonas pulmonares más dependientes 3 , 4 . Las atelectasias pueden persistir durante varios días del período postoperatorio, asociándose con hipoxemia y mecanismos de inflamación pulmonar que favorecen la infección y otras complicaciones postoperatorias 5 – 7 .
Se ha visto que el uso de estrategias ventilatorias que promueven el reclutamiento alveolar, así como menores fracciones de oxígeno, pueden ser útiles para revertir o para evitar la formación de atelectasias 8 , 9 . Además, la aplicación de los conceptos de ventilación protectora, que ha demostrado su eficacia en los pacientes críticos con distress respiratorio, podría beneficiar a los pacientes de mayor riesgo durante el período perioperatorio 10 , 11 .
Dada la alta relevancia de esta complicación respiratoria, nuestros objetivos para esta revisión son: repasar los factores asociados con la anestesia general que influyen en la formación de las atelectasias y revisar las estrategias, ventilatorias y no ventilatorias, que pueden ser útiles para disminuir su incidencia.
-
Mecanismos de formación de atelectasias en el período perioperatorio
Las atelectasias corresponden a la falta de aireación o colapso del parénquima pulmonar. Los tres principales factores que mantienen la apertura alveolar son 8 :
-
La presión transpulmonar, que es la presión ejercida hacia afuera del alvéolo durante todo el ciclo respiratorio y que depende de la presión en la vía aérea o presión intra-alveolar menos la presión pleural. Ya que la presión pleural se hace más positiva por efecto de la gravedad, las zonas más dependientes tendrán menor presión transpulmonar y por tanto mayor tendencia al colapso (Figura 1).
-
El soporte mecánico producido por las fibras colágenas y elásticas, que constituyen un esqueleto que se opone a las fuerzas que favorecen el colapso alveolar al final de la espiración.
-
El surfactante alveolar, que preserva la arquitectura alveolar al disminuir la tensión superficial que se produce por el contacto entre el gas y el tejido alveolar.
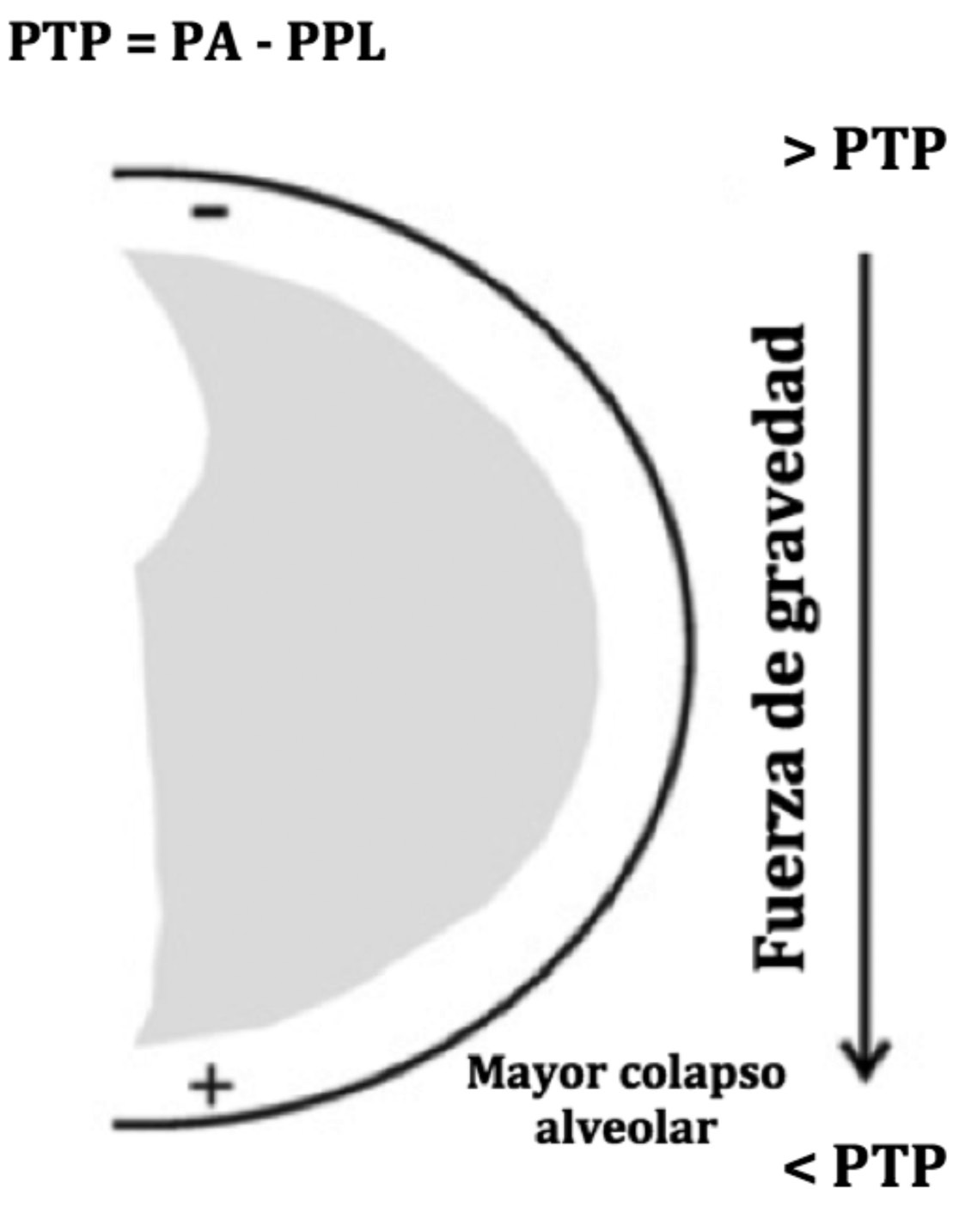
Figura 1 Corte axial del hemitórax derecho. En esta figura se muestra que la presión transpulmonar (PTP) corresponde a la diferencia entre la presión de la vía aérea (PA) y la presión pleural (PPL). En ventilación mecánica, la PA es positiva y homogéneamente distribuida entre los pulmones mientras la PPL muestra una gradiente vertical de presión siguiendo el vector de gravedad. Esto resulta en una PTP menor en las zonas más dependientes (Modificado de Tusman G et al, Best Pract & Res Clin Anesth 2010; 24:183-197 8 ).
El paciente quirúrgico se somete a múltiples alteraciones de su fisiología pulmonar. La posición supina sumada a la inducción de la anestesia general, lleva a una disminución de la capacidad residual funcional (CRF) de 1 a 1,5 L (Figura 2). La CRF es el volumen que queda en los pulmones al final de una espiración normal, cuando los músculos respiratorios están en reposo y está determinada por el balance entre las fuerzas opuestas de retroceso elástico del pulmón y la pared torácica. La capacidad de cierre pulmonar (CC) es el volumen de gas por debajo del cual la vía aérea se empieza a colapsar y corresponde al Volumen de cierre (VC) más el Volumen Residual (VR), es decir CC = VC + VR. Normalmente la CRF excede a la CC, manteniéndose así la permeabilidad de la vía aérea 12 , 13 . Aunque la CRF aumenta con la edad, la CC aumenta más rápido, de tal forma que cierto grado de colapso ocurrirá en posición de pie luego de los 65 años y alrededor de los 50 años si se está en posición supina. La anestesia general produce una disminución adicional de la CRF que empeora el colapso de la vía aérea 14 .
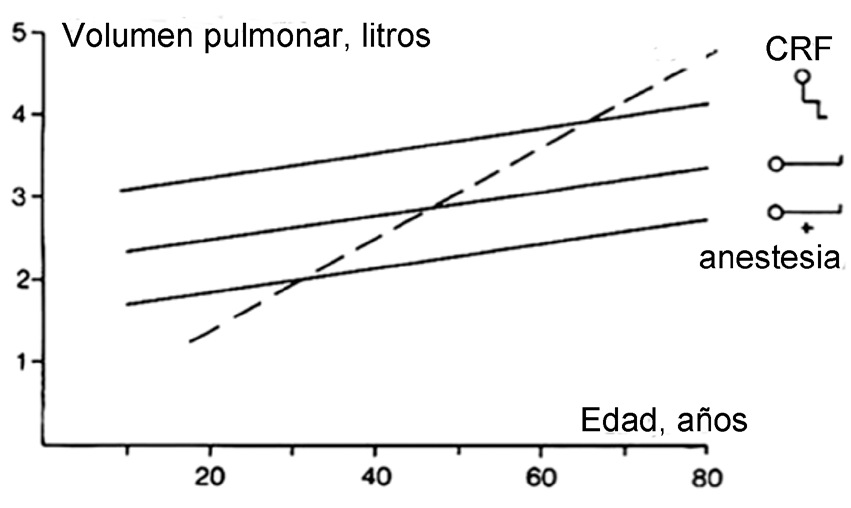
Figura 2 Esta figura resume los cambios que ocurren en la capacidad residual funcional (CRF) con la edad, con los cambios de posición y la inducción de anestesia general. Hay una disminución de 0,7 a 0,8 L de la CRF por el paso de la posición de pie al decúbito y una caída adicional de 0,4 a 0,5 L por efecto de la anestesia. Aunque la CRF aumenta con la edad la capacidad de cierre (CC) aumenta más rápido, de tal forma que cierto grado de colapso de la vía aérea ocurrirá en posición de pie luego de los 65 años y alrededor de los 50 años si se está en posición supina. Con la disminución adicional de la CRF durante la anestesia muchos pacientes sufrirán algún grado de colapso de su vía aérea (Modificado de Hedenstierna G et al, Best Pract & Clin Anaesth 2010; 24:157-169 14 ).
Las tres principales causas fisiopatológicas que explican la formación de atelectasias durante la anestesia son las siguientes 15 :
-
– Atelectasias por compresión:
Las atelectasias por compresión ocurren cuando la presión transpulmonar disminuye tanto que el alvéolo se colapsa. Al parecer el factor esencial que explica el desarrollo de este tipo de atelectasias durante la anestesia general es la pérdida del tono muscular del diafragma. En trabajos realizados con cineradiografía, se ha demostrado que en posición supina pero con respiración espontánea, aunque hay un desplazamiento cefálico del diafragma por efecto de la presión intra-abdominal, la región dorsal que es la que normalmente es más efectiva para contraerse (porque tiene mayor masa muscular y menor radio de curvatura), es capaz de generar suficiente tensión para oponerse al contenido abdominal. Con la parálisis muscular, hay un mayor desplazamiento de la porción dorsal del diafragma, que aumenta la presión pleural de estas zonas. Además, la presión positiva produce mayor desplazamiento del diafragma ventral que genera menor resistencia al movimiento 16 ,17 . Estas diferencias regionales en el desplazamiento diafragmático, sumadas a la menor presión transpulmonar basal en las zonas dependientes y a la disminución de la CRF por el decúbito, hacen que el colapso predomine en las áreas dependientes que son además las responsables del mayor intercambio gaseoso. Por lo tanto, en un paciente en decúbito, las áreas de mayor atelectasias serán las zonas más caudales y dorsales.
Otros factores involucrados en el mecanismo de compresión son: el efecto de la ventilación con presión positiva que disminuye el retorno venoso al tórax y aumenta el volumen sanguíneo abdominal y, por tanto, el peso de los órganos abdominales que comprimen el diafragma 18 , el mayor peso de la pared del tórax y el abdomen en los pacientes obesos 19 y el peso aumentado del parénquima pulmonar en los pacientes con algún grado de edema pulmonar o distress respiratorio 20 .
-
– Atelectasias por absorción del gas alveolar:
Se pueden producir por dos mecanismos: el primero ocurre porque si hay cierre de la vía aérea (por los fenómenos ya descritos) y la unidad alveolar continúa siendo perfundida, el gas atrapado pasará a la sangre hasta equilibrarse con la presión capilar de oxígeno (O2). La velocidad de la absorción de este gas se incrementará mientras mayor sea la fracción inspirada de O2 (FiO2) 21 . El segundo mecanismo se produce por la absorción de O2 que ocurre en las zonas pulmonares con una relación ventilación/perfusión (V/Q) baja. Como en estas zonas la ventilación es menor que la perfusión, el flujo neto de gas hacia la sangre excede el flujo inspirado de gas y hace que el volumen alveolar disminuya. El colapso ocurrirá rápidamente si se usa una FiO2 alta 22 . Esto se produce, porque el nitrógeno no difunde a la sangre, por lo que mientras mayor sea la proporción de éste en la mezcla inspirada, menor será la pérdida de volumen del alvéolo. Esto ha sido comprobado con el uso de FiO2 menores de 1. Por ejemplo, al comparar una pre-oxigenación con una FiO2 de 1 en relación a una al 0,6, se aprecia que el tejido pulmonar atelectasiado se reduce de un 15% a un 2% y se eliminan las atelectasias con una FiO2 de un 0,3 (Figura 3) 23 .
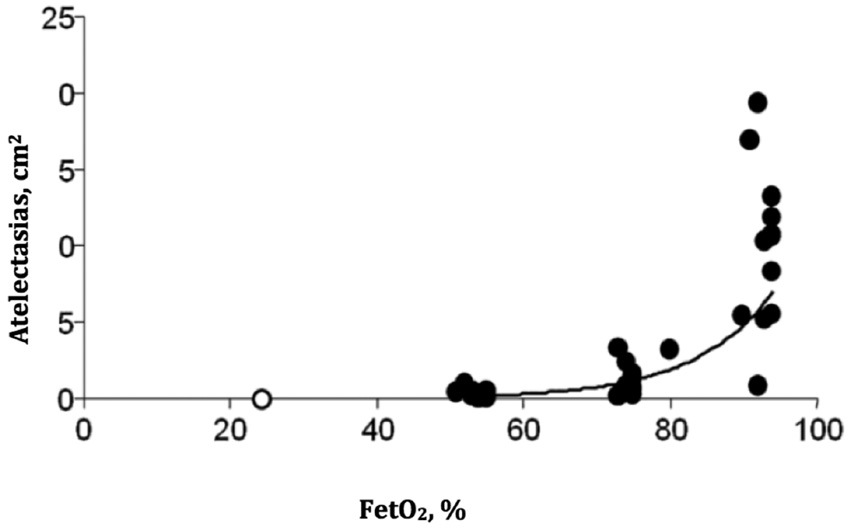
Figura 3 Porcentaje de atelectasias que se producen entre los primeros 5-15 min de anestesia. Cada punto oscuro representa un paciente. La extensión de las atelectasias es mayor a mayor concentración de oxígeno durante la pre-oxigenación. El círculo abierto muestra la mediana de 10 pacientes en quienes la anestesia fue inducida con una fracción inspirada de O2 de 30% (Modificado de Hedenstierna G et al., Act Anaesth Scand 2012; 56: 675-685 53 ).
-
– Atelectasias por alteración del surfactante pulmonar:
Una vez que se han formado atelectasias, disminuye la formación del surfactante pulmonar, lo que favorece la tendencia al colapso pulmonar. Inclusive, si el tejido afectado es reabierto, es más inestable 24 . Además, el estrés producido por la fricción de las membranas alveolares colapsadas lleva a un proceso de inflamación pulmonar que favorece el daño epitelial y el edema pulmonar 25 . Sin embargo, dada la larga vida media del surfactante pulmonar y de su proceso de síntesis, se cree que este mecanismo no tiene gran importancia en la formación de atelectasias durante la anestesia, a diferencia de los pacientes que requieren ventilación mecánica prolongada.
-
Factores clínicos relacionados con el desarrollo de atelectasias
La formación de atelectasias se da en un 90% de los pacientes durante la inducción de la anestesia general. Sin embargo, en la mayoría no tienen repercusión clínica. Existen factores, ya sea del paciente o de la cirugía, que aumentan la probabilidad de formación de atelectasias y/o hacen que su repercusión clínica sea mayor. Estos factores son:
-
Factores relacionados con el paciente:
-
Obesidad: Los pacientes obesos tienen mayor riesgo de presentar atelectasias en el intra y postoperatorio, las cuales se resuelven en forma más lenta que en el paciente no obeso 26 . El mayor peso del tórax y el abdomen hace que estos pacientes tengan una menor distensibilidad pulmonar, una mayor presión intra-abdominal y una menor CRF, factores todos que aumentan el riesgo de atelectasias 27 . Lo mismo sucede en otros pacientes que presentan aumento de la presión intra-abdominal, como embarazadas o pacientes con ascitis.
-
Edad: Las atelectasias durante la anestesia general pueden ocurrir en cualquier edad. No se ha encontrado que el aumento de la edad en forma aislada aumente la incidencia de atelectasias 28 ,29 . Este hallazgo es llamativo teniendo en cuenta que la CC aumenta con la edad, lo que debería favorecer el colapso pulmonar sobre todo en el decúbito. Hedenstierna y cols., en una publicación reciente, proponen como hipótesis que el aumento del cierre de la vía aérea, así como altera la relación V/Q, enlentece también el remplazo de nitrógeno por O2 al 100% durante la pre-oxigenación, disminuyendo las atelectasias por absorción y de esta forma “protegiendo” a algunas áreas del colapso 14 . Los niños, especialmente los menores de 3 años, tienen una CRF menor que la de un adulto, con un volumen de cierre aumentado, lo que favorece el desarrollo de atelectasias, aún con la utilización de FiO2 bajas. Esto se explica por un desbalance entre las fuerzas de retroceso elástico del pulmón y de la caja torácica (que en los niños es más complaciente). Por la alta deformabilidad de la caja torácica, en los niños, la contracción del diafragma puede producir movimientos paradojales costales que favorecen el colapso pulmonar 30 . El volumen de cierre de la vía aérea disminuye desde el nacimiento hasta los 20 años, después de esta edad, predominantemente por disminución del tejido elástico, este volumen aumentará con la edad. Esto hace que un niño de 5 años tenga la misma posibilidad de cierre que un adulto de 50 años 31 , 32 .
-
Alteraciones pulmonares previas: Los pacientes con limitación crónica del flujo aéreo se caracterizan por presentar hiperinsuflación de sus pulmones, lo que disminuye el colapso pulmonar por compresión. Sin embargo, el atrapamiento aéreo y las mayores alteraciones de la relación V/Q, favorece las atelectasias por absorción 33 .
-
Factores relacionados con la cirugía:
-
Efecto de la posición quirúrgica: Como ya explicamos, la posición supina sumada a la anestesia disminuye la CRF (Figura 2). La posición de Trendelenburg empeora la compresión que ejercen los órganos abdominales contra el tórax, reduciendo aún más la CRF y aumentado la tendencia al colapso34. En el decúbito lateral el pulmón dependiente tendrá mayor predisposición al colapso, mientras que el pulmón no dependiente aumentará su CRF 34 . La posición prona aumenta levemente la CRF y al parecer produce una distribución más uniforme de la ventilación 35 . Sin embargo, el paciente anestesiado y operado en posición prona, tendrá el mismo riesgo de generar atelectasias si se somete a una presión intra-abdominal aumentada 36 .
-
Tipo de cirugía: Las cirugías con mayores alteraciones fisiológicas pulmonares son las cirugías torácicas y abdominales altas. La cirugía torácica pulmonar conlleva manipulación directa del pulmón asociada a la comunicación directa de éste con el exterior (neumotórax abierto) lo que trae consigo el colapso pulmonar. La ventilación mono-pulmonar que facilita el abordaje quirúrgico, merece todo un capítulo en el manejo anestésico, que se escapa de los objetivos de nuestra revisión.
-
Cirugía cardíaca con circulación extracorpórea (CEC): Merece una especial atención pues las complicaciones respiratorias pueden alcanzar una incidencia hasta del 30% 37 . Múltiples factores explican la lesión pulmonar en este tipo de cirugía: respuesta inflamatoria que aumenta la permeabilidad alvéolo capilar, edema pulmonar cardiogénico, lesión pulmonar asociada con transfusión, etc 38 ; sin embargo, las atelectasias han demostrado ser la principal causa de disfunción respiratoria postoperatoria luego de cirugía cardiaca 39 , 40 .
-
Cirugía abdominal abierta: Por todos los factores ya descritos, en este grupo de pacientes hay un alto riesgo de formación de atelectasias intraoperatorias. En el postoperatorio, habrá disminución de la capacidad vital (CV), que está asociado con dolor y con disfunción de músculos respiratorios. La disminución de la capacidad vital, disminuye la capacidad de toser y movilizar secreciones que, sumados a la disminución de la CRF, favorecen la formación de atelectasias y la sobreinfección 41 . De aquí la importancia del manejo del dolor y los beneficios que ha mostrado el uso de analgesia peridural en este tipo de cirugías 42 . La cirugía abdominal laparoscópica, aumenta la presión intra-abdominal favoreciendo la formación de atelectasias en el intraoperatorio. Sin embargo, ya que la lesión de los músculos de la pared abdominal es menor, favorece la recuperación de la función respiratoria 43 , 44 .
-
Consecuencias clínicas de la formación de atelectasias
Las atelectasias perioperatorias pueden pasar desapercibidas en la mayoría de los pacientes y resolverse en las primeras 24 h postoperatorias, sin consecuencias. En algunos pacientes de mayor riesgo, estas se manifestarán clínicamente como:
-
Hipoxemia perioperatoria: Las causas de hipoxemia perioperatoria son múltiples. Las atelectasias la producen, ya que alteran la relación V/Q, produciendo zonas perfundidas, pero no ventiladas, es decir, shunt intrapulmonar. Prevenir las atelectasias intraoperatorias puede dar a los pacientes una mayor reserva para tolerar otras causas de hipoxemia durante el período postoperatorio.
-
Disminución de la distensibilidad pulmonar: La reducción del volumen pulmonar hace que el ciclo respiratorio empiece en un volumen más bajo en la curva presión-volumen, lo que producirá una respiración menos eficiente, con mayor gasto energético para conseguir un volumen corriente determinado 15 ,45 .
-
Aumento de la resistencia vascular pulmonar: Se produce por la vasoconstricción de los capilares pulmonares en las zonas de atelectasias, que es un mecanismo que intenta redistribuir el flujo hacia zonas con mejor ventilación (vasoconstricción pulmonar hipóxica) 46 .
-
Daño pulmonar: El colapso pulmonar y la ventilación mecánica necesaria para la reapertura alveolar pueden producir lesión pulmonar aún en pulmones sanos 47 . Los mecanismos que explican esta lesión son: la sobredistensión de áreas no colapsadas, mecanismo conocido como volutrauma, y la activación de fenómenos inflamatorios e inmunes a nivel alveolar o biotrauma 48 ,49 .
-
Infección postoperatoria: Los cambios asociados con la formación de atelectasias favorecen la presentación de neumonía en el postoperatorio 50 . Se ha demostrado empíricamente que la disminución en la incidencia de atelectasias disminuye el riesgo de neumonía y translocación bacteriana a la sangre 51 .
-
Estrategias de prevención y tratamiento de las atelectasias
Las atelectasias comienzan a producirse desde la inducción, por lo tanto toda intervención que pueda implementarse ya desde este momento será beneficiosa. Algunas estrategias preventivas son:
-
Estrategias no ventilatorias:
-
Uso de anestesia regional: Si la cirugía lo permite, en pacientes de alto riesgo, utilizar una técnica regional evita la pérdida del tono muscular del diafragma, y disminuye la formación de atelectasias.
-
Uso de FiO2 adecuada: Está claro que el uso de FiO2 de 1 durante la inducción anestésica produce atelectasias por absorción 23 ,52,53 , potenciado por la disminución de la CRF. Edmark y cols. 54 , compararon la pre-oxigenación e inducción anestésica con FiO2 de 1, 0,8 y 0,6 midiendo las atelectasias y el tiempo de tolerancia a la apnea (tiempo en el que la apnea produjo una saturación arterial de O2 < de 90%). Encontraron que pre-oxigenar con FiO2 de 0,8, reducía en forma significativa las atelectasias, pero disminuía el tiempo de tolerancia a la apnea de 6,8 min (con FiO2 de 1), a 5 min. Utilizar FiO2 de 0,6 no aportaba beneficios, ya que la reducción de las atelectasias era marginal, pero disminuía la tolerancia a la apnea a sólo 3,5 min (Figura 4). Esto no significa que haya suficiente evidencia para cambiar el estándar de manejo, que sigue siendo utilizar O2 a 100% durante la inducción y la extubación para brindar mayor seguridad al paciente, pero se podría considerar utilizar FiO2 de 0,8 en casos bien seleccionados y disminuir la FiO2 una vez que se ha asegurado la vía aérea. Varios trabajos han demostrado que si se utilizan técnicas de reclutamiento alveolar (PEEP o CPAP) desde la inducción anestésica se previene la formación de atelectasias a pesar de utilizar FiO2 de 1 9 ,55 . No se ha definido aún cuál sería la mejor FiO2 en el período intraoperatorio. Hedenstierna y Rothen, autores responsables de un número importante de trabajos sobre el tema, recomiendan FiO2 de 0,3 a 0,4 durante la anestesia para prevenir la reaparición de atelectasias luego de hacer maniobras de reclutamiento 15 ,56 . Otros autores no han encontrado diferencias significativas en la incidencia de atelectasias cuando han comparado FiO2 de 0,3 con FiO2 de 0,8 en el intraoperatorio 57 ,58 . Algunos grupos han propuesto el uso de altas concentraciones de O2 en el período intra y postoperatorio, como estrategia para disminuir la infección de la herida quirúrgica. Una revisión de la literatura reciente sobre este tema encontró 7 estudios aleatorios y 3 metaanálisis publicados desde el año 2000, con resultados no concluyentes: 4 estudios no mostraron beneficio (incluyendo uno terminado tempranamente por aumento de riesgo) y 3 mostraron beneficio 59 .
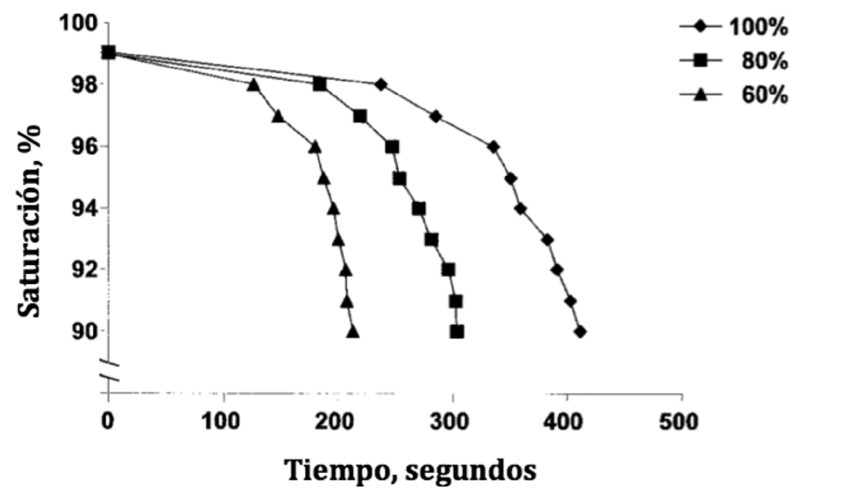
Figura 4 Esta curva muestra la caída de la saturación de oxígeno durante la apnea en pacientes que fueron preoxigenados con concentraciones de O2 de 100%, 80% y 60% durante la inducción anestésica. Los tiempos promedios en llegar a una saturación de 90% fueron 411 ± 84, 303 ±59 y 213 ± 69 segundos usando O2 al 100%, 80% y 60% respectivamente (Modificado de Edmark L et al, Anesthesiology 2003; 98: 28-33 54 ).
-
Estrategias ventilatorias
Así como el colapso pulmonar es un fenómeno presión dependiente, el reclutamiento alveolar también lo es. Cada unidad pulmonar tiene una presión de cierre, que es la presión transpulmonar por debajo de la cual empezará el colapso alveolar y una presión de apertura, que es la presión transpulmonar necesaria para que se reabra la unidad alveolar. La presión de cierre alveolar se alcanza principalmente al final de la espiración, porque en esta fase del ciclo respiratorio la presión transpulmonar alcanza su menor valor y la presión de apertura se alcanza al final de la inspiración que es cuando la presión transpulmonar es más alta. Un alvéolo necesita más presión para abrirse si está colapsado que la presión que necesita para mantenerse abierto. Esto se explica por la ley de Laplace: P = 2T/r, donde P en este caso es la presión transpulmonar, T es la tensión superficial y r el radio del alvéolo. Así, la presión transpulmonar necesaria para abrir un alvéolo es inversamente proporcional al radio de éste. Se puede concluir que el reclutamiento pulmonar es un fenómeno inspiratorio, que se alcanza con presión de meseta, mientras que el colapso pulmonar es un fenómeno espiratorio, que se evita con presión al final de la espiración (PEEP) 60 . En estos conceptos se basan las maniobras ventilatorias usadas para prevenir y manejar las atelectasias intraoperatorias.
Las estrategias ventilatorias para prevenir el colapso pulmonar pueden iniciarse desde la inducción anestésica, especialmente en poblaciones de riesgo. Se ha utilizado presión positiva continua en la vía aérea (CPAP) durante la inducción anestésica para aminorar la disminución de la CRF y mantener la presión transpulmonar por encima de la presión de cierre. En un estudio realizado en pacientes con peso normal, el uso de 6 cm de H2O de CPAP durante la inducción anestésica redujo la formación de atelectasias medidas por tomografía axial computarizada (TAC) 9 . El trabajo fue repetido en pacientes obesos mórbidos, con 10 cm de H2O de CPAP, demostrando una disminución de las áreas de atelectasias de 10,4% del tejido pulmonar en el grupo control a 1,7% en el grupo de CPAP 55 (Figura 5). A pesar de sus potenciales beneficios, estas maniobras no son fácilmente aplicables o pueden estar contraindicadas en pacientes con riesgo de regurgitación, además de que su efecto se pierde rápidamente durante la laringoscopia.
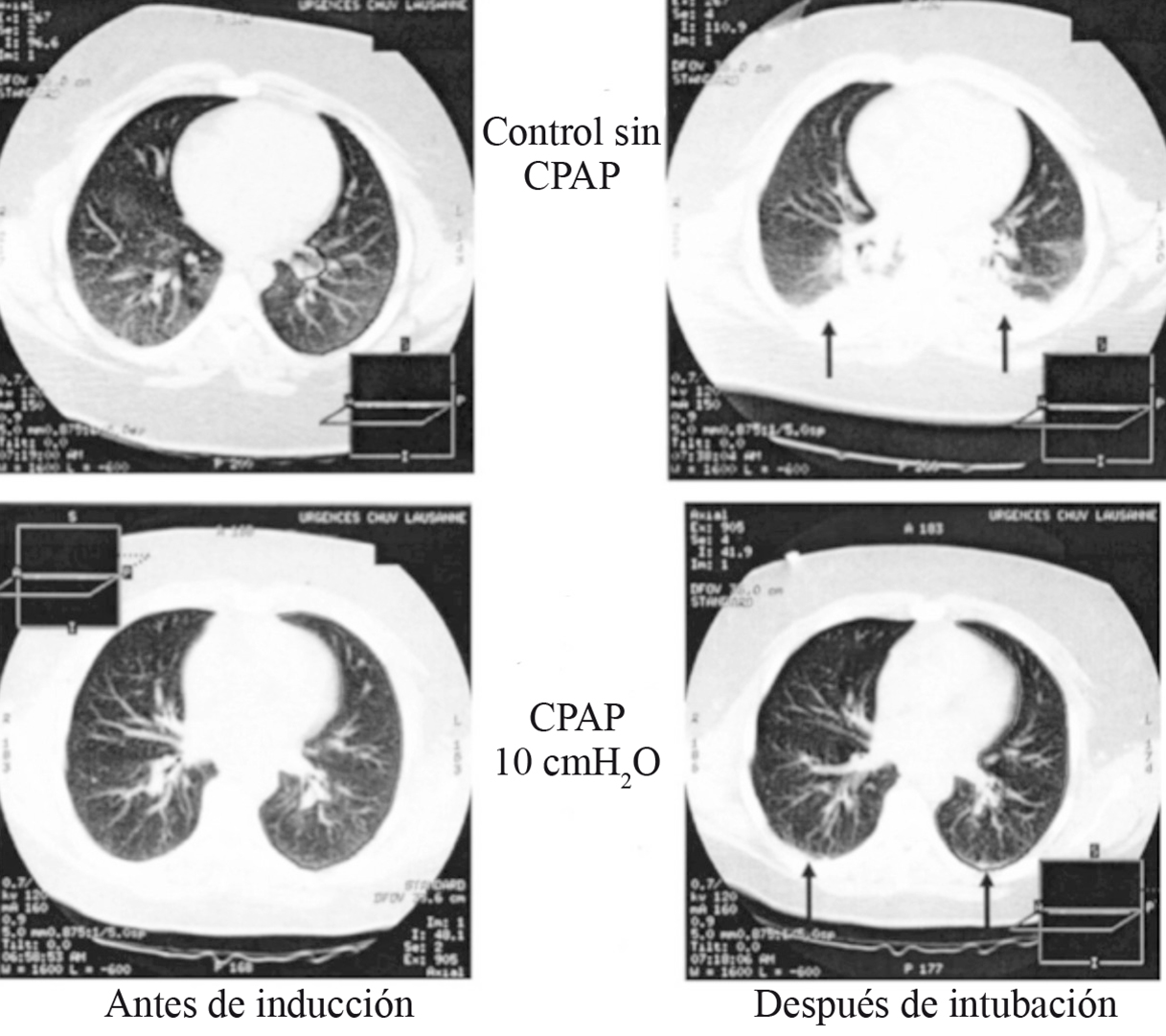
Figura 5 Imágenes de tomografías computarizadas torácicas de 2 pacientes obesos mórbidos manejados con y sin CPAP durante la inducción anestésica. Se observa que en el paciente manejado con CPAP existe menor porcentaje de atelectasias que en el control. . Las imágenes fueron obtenidas 1 cm sobre el nivel del diafragma derecho. Las flechas muestran las zonas de atelectasias (Modificado de Coussa M et al, Anesth Analg 2004; 98: 1492-1495 55 ).
Durante el mantenimiento anestésico, el uso de PEEP ha demostrado que aumenta la CRF, mejorando la oxigenación y disminuyendo las atelectasias postoperatorias 61 . Sin embargo, dado que cada unidad alveolar tendrá su propia presión de apertura y de cierre, el nivel de PEEP usualmente utilizado en anestesia (4 a 10 mmHg), puede ser insuficiente para abrir la vía aérea ya colapsada y puede incluso sobredistender zonas normalmente ventiladas, produciendo alteraciones V/Q que favorecen el espacio muerto. Es por esta razón que en algunos pacientes el uso aislado de PEEP sin aplicar previamente maniobras de reclutamiento alveolar puede ser insuficiente para manejar las atelectasias. En un estudio presentado por Reinius y cols. 62 , 30 pacientes obesos mórbidos (IMC 45), sometidos a bypass gástrico, se randomizaron en 3 grupos de tratamiento: PEEP de 10 cm de H2O, maniobra de reclutamiento (MR) con 55 cm de H2O por 10 segundos sin PEEP posterior y MR + PEEP. Se realizó TAC de tórax despierto, 5 minutos después de la inducción y 5 y 20 minutos después de la cirugía. Las MR + PEEP redujeron el porcentaje de atelectasias, manteniéndose su efecto en el tiempo. Las MR solas fueron efectivas en disminuir las atelectasias, pero su efecto fue transitorio. El uso de PEEP aislado no redujo el porcentaje de atelectasias (Figura 6).
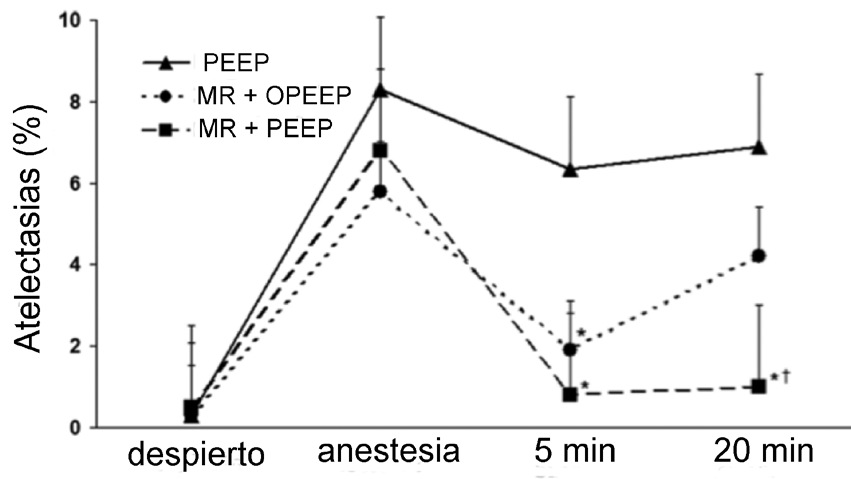
Figura 6 Se muestra en la gráfica el porcentaje de atelectasias en diferentes momentos, en pacientes obesos mórbidos manejados con 3 estrategias diferentes de ventilación. La aplicación de PEEP (10 cm de H2O) aislado (n = 10) no tiene efecto en el porcentaje de atelectasias. La aplicación de MR (Presión inspiratoria de 55 mmHg por 10 segundos) sin PEEP posterior (n = 10), reduce las atelectasias pero su efecto no es sostenido en el tiempo. Sólo la aplicación de MR más PEEP (n = 10) reduce las atelectasias en forma sostenida. PEEP = presión positiva de fin de espiración. MR = maniobras de reclutamiento. 0PEEP = cero presión positiva de fin de espiración (Modificado de Reinius H et al, Anesthesiology 2009; 111: 979-987 62 ).
-
Maniobras de reclutamiento (MR)
Son estrategias que buscan expandir las áreas de pulmón colapsado por medio del aumento de la presión transpulmonar. Bendixen y cols., en 1963 fueron los primeros en describir cómo al aplicar una presión de 40 cm de H2O en la vía aérea por 15 segundos, se podía mejorar la oxigenación y la distensibilidad pulmonar 63 . Iniciando la década del 90, Lachmann, estudiando pacientes críticos, estableció que el pulmón puede ser expandido usando una alta presión en la vía aérea y después mantenerse abierto si se aplica una PEEP suficiente para evitar un nuevo colapso 64 . Estos conceptos han sido extrapolados y aplicados durante el período intraoperatorio y gracias a la disponibilidad de mejores ventiladores, estas maniobras son ahora más reproducibles y controladas 8 .
Las MR, deben cumplir con dos objetivos: abrir áreas colapsadas y mantenerlas abiertas en el tiempo 65 . Como ya habíamos explicado, el reclutamiento alveolar, se obtiene al alcanzar la presión de apertura al final de la inspiración. Se ha demostrado que, en pulmones sanos colapsados la apertura pulmonar comienza a producirse en las áreas más ventrales a una presión de meseta de 30 cm de H2O y no está completa sino hasta que alcanza una presión de 40 cm de H20 en las regiones más dorsales 66 ,67 . Una vez abiertos los alvéolos, se requiere de presiones menores para mantenerlos abiertos. Se previene el “re-colapso” si se mantiene la presión transpulmonar por encima de la presión de cierre, lo cual se obtiene al aplicar PEEP. La PEEP óptima sería aquella que mantiene abiertos los alvéolos sin sobredistender las áreas ventiladas.
Se han descrito dos tipos de MR:
-
– Maniobras de capacidad vital o CPAP
Es la clásica MR que consiste en la aplicación de una presión continua de 40 cm de H2O por un tiempo de 10 a 30 segundos, retornando luego a la ventilación basal. Esta estrategia aisladamente no es recomendada, porque induce cambios bruscos y severos en la presión intratorácica, lo que puede producir inestabilidad en la hemodinamia del paciente y, además, si no es combinada con el uso de PEEP adecuada posterior a la reapertura pulmonar tendrá, un efecto transitorio, sobre todo si se usan FiO2 altas 68 .
-
– Maniobras de ciclado
La más conocida es la estrategia de reclutamiento alveolar (ERA), descrita por Tusman en 1999 69 . En esta estrategia de ventilación, la presión de la vía aérea se va aumentando en forma progresiva hasta alcanzar la presión de apertura y luego se va disminuyendo, también progresivamente, hasta conocer la presión de cierre. Tiene varias ventajas en relación al uso de CPAP. La primera es que, dado que los aumentos se hacen paso a paso cada 2 o 3 ciclos respiratorios, es posible evaluar la hemodinamia del paciente y parar para hacer los ajustes en caso de ser necesario. Además el estrés que sufre el tejido pulmonar, por el aumento de presión es menor, ya que en cada paso hay más tejido abierto en el que se distribuye esta mayor presión. La segunda ventaja es que la titulación del PEEP permite conocer la presión de cierre de cada paciente, de tal forma que el manejo posterior a la MR se hará con una PEEP superior a esta presión lo que permitirá prevenir nuevamente el colapso 70 ,71 . La determinación de esta PEEP óptima o también llamada PEEP de pulmón abierto (OL-PEPP) requiere que, al disminuir progresivamente la PEEP, se monitoricen parámetros respiratorios que nos permitan saber cuándo se produce el colapso alveolar. Durante el intraoperatorio podemos utilizar parámetros de la mecánica pulmonar como la compliance (o distensibilidad) dinámica y la resistencia de la vía aérea, o parámetros de oxigenación como la PaO2/FiO2, o parámetros de ventilación como el CO2 de final de espiración (EtCO2), o de aumento del espacio muerto como el aumento del gradiente PaCO2-ETCO2 (Figura 7) 60 . La necesidad de repetir una maniobra de reclutamiento por deterioro de alguna de estas mediciones sería un signo de que la PEEP aplicada es insuficiente.
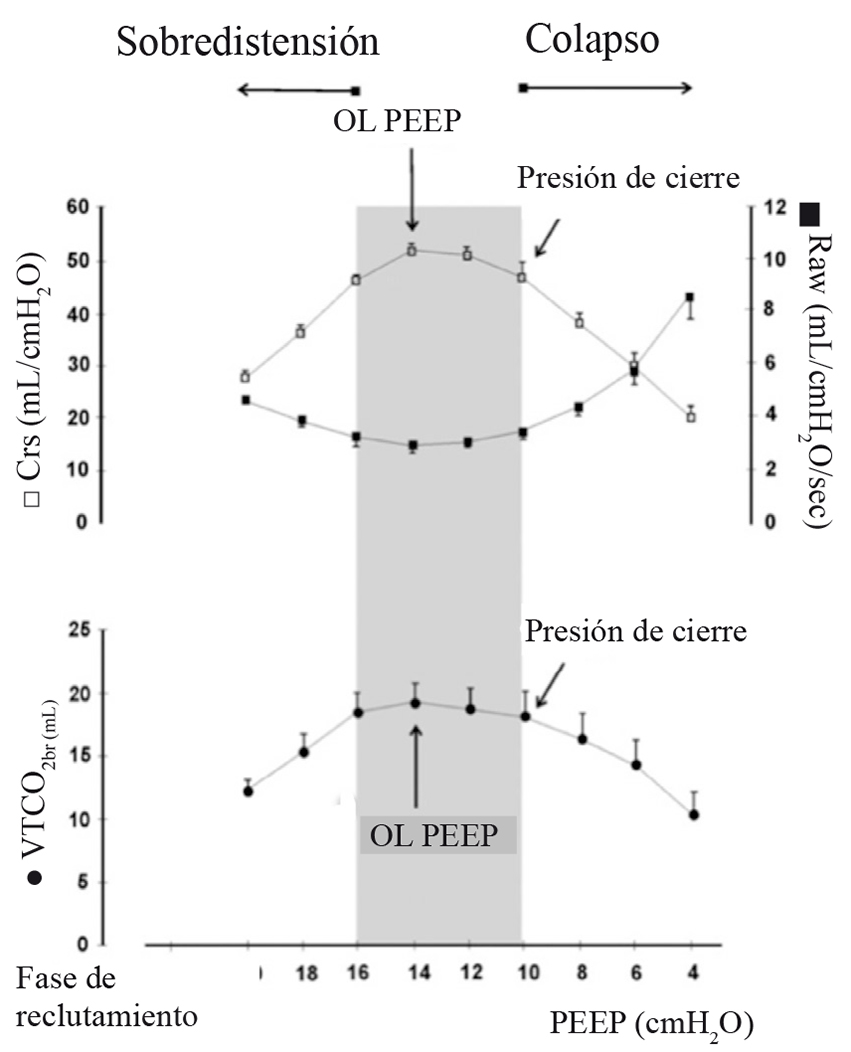
Figura 7 Determinación de la OL-PEEP (del inglés PEEP de pulmón abierto) durante la fase de titulación de PEEP. Cada nivel de PEEP se mantuvo por 2 min o 30 respiraciones. La compliance respiratoria dinámica (Crs), resistencia de la vía aérea (Raw) y la eliminación de CO2 por cada respiración (VTCO2,br) fue registrada no invasivamente con sensores adecuados ubicados en la vía aérea. La OL-PEEP y la presión de cierre de los pulmones se marcan con las flechas. El área gris muestra el rango seguro de PEEP, en este paciente en particular, que no causa sobredistensión ni colapso (Modificado de Tusman G et al, Curr Anaesth Crit Care 2010; 21: 244-249 60 ).
La Figura 8 muestra las fases en que se realiza la ERA. Se describe su realización con ventilación en modo de presión control, partiendo con una presión que obtenga un volumen corriente entre 6 y 8 ml·Kg-1, con frecuencia respiratoria entre 10 y 15/min, con una relación I:E de 1:1 y FiO2 de 1. En la fase de pre-acondicionamiento hemodinámico, la PEEP se aumenta 5 cm de H2O por 5 respiraciones hasta alcanzar una PEEP de 20 y una presión de meseta de 40 cm de H2O. En esta fase se evalúa la hemodinamia con cada cambio. Si la presión arterial, la frecuencia cardiaca o el gasto cardiaco se deterioran en más de 15 a 20% del valor basal, la PEEP se devuelve a un valor seguro hasta que mejoren las condiciones del paciente, usualmente con infusión de volumen, ya que lo que hace el aumento de la presión intratorácica es disminuir el retorno venoso al tórax. En la fase de reclutamiento, una vez alcanzada la presión de apertura (presión de meseta de 40 cm de H2O en la mayoría de los pacientes, aunque puede ser mayor en obesos mórbidos o en pacientes con alteraciones severas de la distensibilidad pulmonar), se realizan 10 respiraciones con las que se abre el tejido pulmonar que aún este colapsado. La última fase es la fase de titulación de la PEEP que tiene como objetivo identificar la presión de cierre de cada paciente. En ella se disminuye la PEEP 2 cm de H2O por vez y se monitorizan los parámetros respiratorios disponibles (en cuidado intensivo se pueden utilizar imágenes como TAC de tórax), siendo la presión de cierre la PEEP con la que se evidencia colapso pulmonar. Una vez que se conoce la presión de cierre se puede realizar una nueva fase de reclutamiento y luego reiniciar la ventilación basal con una estrategia de volumen corriente < de 8 ml·Kg-1 y con una PEEP levemente superior a la presión de cierre. Como es posible que en el intraoperatorio no contemos con suficientes herramientas para titular la PEEP, podemos utilizar niveles extrapolados de trabajos realizados en diferentes poblaciones, en los que la PEEP óptima se ubica entre 5 y 15 cm de H2O, dependiendo de los factores de riesgo de cada grupo. La Tabla 1 resume estos trabajos 8 .
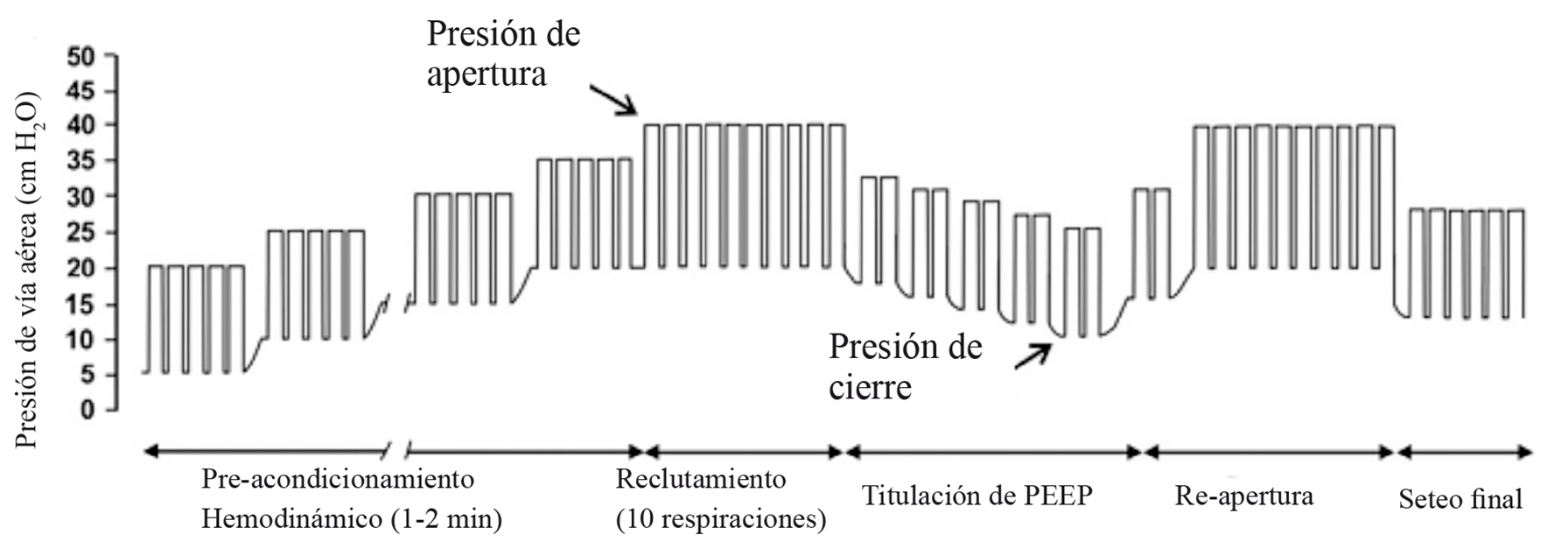
Figura 8 Representación esquemática de una estrategia de reclutamiento alveolar: Cada respiración está representada por un rectángulo. En modo presión control, la presión es ajustada a un volumen corriente de 8 ml•Kg-1 y entonces la PEEP es aumentada paso a paso en 5 cm de H2O. A un nivel de PEEP entre 10 y 15 cm de H2O, se mantiene hasta que el estado hemodinámico es evaluado y mejorado si es necesario. Esta es la fase de pre-acondicionamiento hemodinámico. La presión de apertura se alcanza cuando la presión meseta alcanza los 40 cm de H2O, esta presión se mantiene por 10 ciclos respiratorios. En la fase de titulación del PEEP se hacen disminuciones progresivas de esta presión hasta definir la PEEP en la que se evidencia nuevo colapso pulmonar (presión de cierre). Una segunda maniobra de reclutamiento es aplicada antes de programar la ventilación con una PEEP 2 cm de H2O mayor que la presión de cierre, para mantener los pulmones abiertos hasta el final de la cirugía (Modificado de Tusman et al, Br J Anaesth 1999; 82: 8-1369).
Tabla 1 Resumen de evidencia sobre maniobras de reclutamiento alveolar
|
Autor |
N |
Tipo de MR |
P meseta (cm H2O) |
PEEP (cm H2O) |
Principal conclusión |
| Rothen 77 , 1993 |
16 |
CPAP |
10 a 40 |
– |
CPAP de 40 cm de H2O revierte las atelectasias, evaluado por TAC. |
| Tussman 69 , 1999 |
30 |
Ciclado |
40 |
5 |
MR aumenta la PaO2 y la distensibilidad. |
| Rothen 78 , 1999 |
12 |
CPAP |
40 |
– |
7-8 segundos de CPAP revierten las atelectasias por TAC. |
| Neumann 79 , 1999 |
13 |
CPAP |
40 |
10 |
MR y la PEEP mantienen el pulmón abierto a pesar de FiO2 1. |
| Tussman 80 , 2000 |
24 |
Ciclado |
35, 40, 45 |
5 |
40 cm de H2O muestran la mejor PaO2 y distensibilidad pulmonar. |
| Tussman 81 , 2002 |
30 |
Ciclado |
40 |
5, 10 |
10 PEEP mejor que 5 PEEP después de una MR en pacientes obesos. |
| Tussman 82 , 2002 |
10 |
Ciclado |
40 |
5 |
MR aumenta la oxigenación en ventilación monopulmonar. |
| Benoit 75 , 2002 |
30 |
CPAP |
40 |
– |
FiO2 0,4 y CPAP, disminuye las atelectasias postoperatorias. |
| Tussman 83 , 2003 |
24 |
Ciclado |
40 |
5 |
MR resuelven las atelectasias en niños a pesar de usar FiO2 de 1. |
| Claxon 84 , 2003 |
78 |
Ciclado |
40 |
5 |
MR aumenta la PaO2 en pacientes cardiacos. |
| Pang 85 , 2003 |
24 |
Ciclado |
40 |
5 |
MR incrementan la PaO2 durante laparoscopia. |
| R. Miranda 86 , 2004 |
24 |
Ciclado |
45 |
17 |
MR aumentan la PaO2 en cirugía cardiaca. |
| Tussman 87 , 2004 |
12 |
Ciclado |
40 |
8 |
MR mejoran la PaO2 y el espacio muerto en ventilación monopulmonar. |
| Tussman 88 , 2004 |
16 |
Ciclado |
40 |
5 |
MR aumentan la PaO2 y disminuyen el espacio muerto. |
| Dyhr 68 , 2004 |
30 |
CPAP |
45 |
12 |
12 PEEP después de MR aumentan la PaO2 y el volumen pulmonar. |
| Whalen 89 , 2006 |
20 |
Ciclado |
40 |
12 |
MR mejoran la oxigenación en pacientes con obesidad mórbida |
| Malbouisson 90 , 2008 |
10 |
CPAP |
40 |
10 |
MR revierte la hipoxemia en shock cardiogénico. |
| Almarakbi 91 , 2009 |
60 |
CPAP |
40 |
10 |
MR repetidas mejoran PaO2 en pacientes con obesidad mórbida. |
| Bohm 92 , 2009 |
11 |
Ciclado |
50 |
5, 10, 15 |
15 PEEP después de una MR mejoran función pulmonar en pacientes con obesidad mórbida. |
|
MR: Maniobra de reclutamiento, n: número de pacientes, P meseta: presión de vía aérea usada para alcanzar el efecto de reclutamiento, PEEP: presión positiva de fin de expiración usada para mantener el reclutamiento (Modificado de Tusman G et al, Best Pract & Res Clin Anesth 2010; 24: 183-1978). |
|||||
Ya que el 90% de los pacientes sometidos a anestesia general desarrollan algún grado de colapso pulmonar, las maniobras de reclutamiento pueden ser aplicadas en casi todos los pacientes anestesiados. Serán especialmente beneficiosas en los pacientes de mayor riesgo de colapso alveolar por sus condicionales basales y el tipo de cirugía realizada. Existen situaciones que contraindican la aplicación de estas maniobras como: ventilación con máscara laríngea, pacientes con broncoespasmo, fístula broncopleural, presión intracraneana alta o hemodinamia inestable. Además, el nivel anestésico debe ser profundo para que las maniobras se realicen adecuadamente. Se recomienda realizarlas después de la inducción anestésica y cada vez que haya desconexión del circuito anestésico o succión traqueal. Si bien hay numerosos estudios que han demostrado la utilidad de las maniobras de reclutamiento intraoperatorias en el intercambio gaseoso y la mecánica pulmonar, no existen estudios que hayan demostrado que el uso de estas estrategias de ventilación tengan impacto en la morbilidad o mortalidad postoperatoria.
La terminación del procedimiento quirúrgico y extubación es otro momento de alto riesgo de colapso pulmonar. Usualmente ésta se hace con FiO2 de 1 y con suspensión de la presión positiva, por lo que el reclutamiento que se haya obtenido durante la cirugía se puede perder rápidamente. Se ha demostrado que aplicar CPAP mientras el paciente respira espontáneamente mejora la CRF y disminuye las atelectasias postoperatorias 72 . El uso de presión positiva no invasiva (BiPAP, por bi-level positive airway pressure) o CPAP, en el postoperatorio inmediato de pacientes obesos mórbidos, ha demostrado que reduce la disfunción pulmonar postoperatoria y la necesidad de reintubación 73 ,74 . Igual que en la inducción anestésica, disminuir la FiO2 una vez que se ha asegurado la permeabilidad de la vía aérea luego de la extubación podría reducir las atelectasias postoperatorias y mejorar la relación V/Q 75 ,76 . Incluso algunos autores como Tusman y cols., recomiendan combinar CPAP con disminución de la FiO2 (0,6 a 0,8) durante la extubación anestésica para disminuir el colapso pulmonar y mejorar la función respiratoria en el período postoperatorio temprano 8 .
Aunque no es el tema de esta revisión, el manejo intraoperatorio debe complementarse con una estrategia postoperatoria que incluya: 1. Analgesia post-operatoria que favorezca el aumento del volumen pulmonar, la capacidad vital y la actividad diafragmática; 2. Movilización temprana y 3. Rehabilitación pulmonar.
Conclusiones
-
El colapso parcial del parénquima pulmonar o atelectasia es la complicación pulmonar más frecuente en pacientes sometidos a cirugía con anestesia general. Se produce por tres mecanismos: compresión pulmonar, absorción del gas alveolar y disminución del surfactante pulmonar. Se presenta principalmente en zonas pulmonares dependientes y produce alteraciones en la mecánica pulmonar, la oxigenación y la ventilación que pueden llevar a otras complicaciones perioperatorias.
-
Los pacientes con mayor riesgo de presentar atelectasias intraoperatorias son los pacientes con enfermedad pulmonar previa, los que son sometidos a cirugía abdominal alta, torácica y cirugía cardiaca, los pacientes operados en posición de Trendelemburg y los pacientes obesos.
-
La disminución de la FiO2 durante la anestesia general disminuye las atelectasias por absorción. Durante la inducción anestésica la recomendación sigue siendo utilizar FiO2 de 1 para aumentar el tiempo de tolerancia a la apnea y dar mayor seguridad al paciente en caso de una vía aérea difícil no anticipada. Una vez asegurada la vía aérea, se recomienda reducir la FiO2. No existe consenso sobre que FiO2 utilizar durante el mantenimiento anestésico, algunos autores recomiendan no utilizar más allá de FiO2 de 0,3 a 0,4 y otros autores no encuentran ventajas en utilizar menos de 0,8. Lo recomendable es evaluar caso a caso y utilizar la menor FiO2 que se considere segura para cada paciente. Durante la extubación, al igual que en la inducción anestésica, la recomendación continúa siendo la utilización de FiO2 de 1, hasta asegurar la permeabilidad de la vía aérea y un buen patrón respiratorio.
-
El reclutamiento alveolar es un fenómeno inspiratorio que se logra con una adecuada presión de meseta. El colapso alveolar es un fenómeno espiratorio que se evita con PEEP. En este principio se basa la aplicación de las maniobras de reclutamiento intraoperatorias. Las maniobras de ciclado han demostrado ser efectivas para expandir y prevenir un nuevo colapso pulmonar, mejorando con esto la mecánica ventilatoria y la oxigenación, con un aceptable margen de seguridad. Sin embargo, aún se requiere de mayor evidencia para demostrar que el uso de estas maniobras tiene un efecto real en la morbimortalidad de los pacientes.
referencias
- Kroenke K, Lawrence VA, Theroux JF, et al. Postoperative complications after thoracic and major abdominal surgery in patients with and without obstructive lung disease. Chest 1993; 104: 1445-1451.
- Fisher BW, Majumdar SR, McAlister FA. Predicting pulmonary complications after nonthoracic surgery: A systematic review of blinded studies. Am J Med 2002; 112: 219-225.
- Lundquist H, Hedenstierna G, Strandberg A, et al. CT assessment of dependent lung densities in man during general anaesthesia. Act Radiol 1995; 36: 626-632.
- Brismar B, Hedenstierna G, Lundquist H. Pulmonary densities during anesthesia with muscular relaxation: A proposal of atelectasis. Anesthesiology 1985; 62: 422-428.
- Greif R, Akca O, Horn EP, et al. Supplemental perioperative oxygen to reduce the incidence of surgical-wound infection. Outcomes research group. N Engl J Med 2000; 342: 161-167.
- Greif R, Laciny S, Rapf B, et al. Supplemental oxygen reduces the incidence of postoperative nausea and vomiting. Anesthesiology 1999; 91: 1246-1252.
- Reeder MK, Muir AD, Foëx P, et al. Postoperative myocardial ischaemia: temporal association with nocturnal hypoxemia. Br J Anaesth 1991; 67: 626-631.
- Tusman G, Böhm S. Prevention and reversal of lung collapse during the intra-operative period. Best Pract & Res Clin Anesth 2010; 24: 183-197.
- Rusca M, Proietti S, Schnyder P, et al. Prevention of atelectasis formation during induction of general anesthesia. Anesth Analg 2003; 97: 1835-1839
- Haas CF. Lung protective mechanical ventilation in acute respiratory distress syndrome. Respir Care Clin N Am 2003; 9(3): 363-396.
- Böhm Sh, Tham OC, Von Sanderslebe A, et al. Alveolar recruitment strategy and high positive end-expiratory pressure levels do not affect hemodynamics in morbidly obese intravascular volume-loaded patients. Anesth Analg 2009; 109: 160-163.
- Levitzky MG. Chapter 2. Mechanics of Breathing. In: Levitzky MG, ed. Pulmonary Physiology. 7th ed. New York: McGraw -Hill; 2007. http://www.accessmedicine.com
- West J. Relación Ventilación-Perfusión: Cómo el equilibrio de los gases y la sangre determina el intercambio gaseoso. De: West J, Fisiología Respiratoria. Sexta edición, Buenos Aires: Editorial Médica Panamericana; 2002, págs 138-139.
- Hedenstierna G, Edmark L. Mechanisms of atelectasis in the perioperative period. Best Pract & Res Clin Anesth 2010; 24: 157-169.
- Duggan M, Kavanagh BP. Pulmonary atelectasis. Anesthesiology 2005; 102: 838-854.
- Froese AB, Bryan AC. Effects of anesthesia and paralysis on diaphragmatic mechanics in man. Anesthesiology 1974; 41: 242-255.
- Tokics L, Hedenstierna G, Strandberg A, et al. Lung collapse and gas exchange during general anesthesia: Effects of spontaneous breathing, muscle paralysis, and positive end-expiratory pressure. Anesthesiology 1987; 66: 157-167.
- Hedenstierna G, Strandberg A, Brismar B, et al. Functional residual capacity, thoraco-abdominal dimensions and central blood volume during general anesthesia with muscle paralysis and mechanical ventilation. Anesthesiology 1985; 62: 247-254.
- Strandberg A, Tokics L, Brismar B, et al. Constitutional factors promoting development of atelectasis during anaesthesia. Act Anaesthe Scand 1987; 31: 21-24.
- Gattinoni L, Caironi P, Cressoni M, et al. Lung recruitment in patients with the acute respiratory distress syndrome. N Engl J Med 2006; 354: 1775-1786.
- Joyce CJ, Baker AB, Kennedy RR: Gas uptake from an unventilated area of lung: Computer model of absorption atelectasis. J Appl Physiol 1993; 74: 1107-1116.
- Wagner PD, Laravuso RB, Uhl RR, et al. Continuous distributions of ventilation-perfusion ratios in normal subjects breathing air and 100 per cent O2. J Clin Invest 1974; 54: 54-68.
- Rothen HU, Sporre B, Engberg G, et al. Prevention of atelectasis during general anaesthesia. Lancet 1995; 345: 1387-1391.
- Oyarzún MJ, Iturriaga R, Donoso P, et al. Factors affecting distribution of alveolar surfactant during resting ventilation. Am J Physiol 1991; 261: L210-217.
- Uhlig U, Haitsma JJ, Goldmann T, et al. Ventilation induced activation of the mitogen-activated protein kinase pathway. Eur Respir J 2002; 20: 946-956.
- Eichenberger A, Proietti S, Wicky S, et al. Morbid obesity and postoperative pulmonary atelectasis: An underestimated problem. Anesth Analg 2002; 95: 1788-1792.
- Pelosi P, Croci M, Ravagnan I, et al. The effects of body mass on lung volumes, respiratory mechanics, and gas exchange during general anesthesia. Anesth Analg 1998; 87: 654-660.
- Gunnarsson L, Tokics L, Gustavsson H, et al. Infl̄uence of age on atelectasis formation and gas exchange impairment during general anaesthesia. Br J Anaesth 1991; 66: 423-432.
- Rothen HU, Sporre B, Engberg G, et al. Airway closure, atelectasis and gas exchange during general anaesthesia. Brit J Anaesth 1998; 81: 681-686.
- Beardsmore CS, Stocks J, Helms P. Elastic properties of the respiratory system in infants. Eur Respir J (Suppl 1) 1989; 4: 135-139.
- Serafini G, Cornara G, Cavalloro F, et al. Pulmonary atelectasis during paediatric anaesthesia: CT scan evaluation and effect of positive end expiratory pressure (PEEP). Paediatr Anaesth 1999; 9: 225-228.
- Mansell A, Bryan C, Levison H. Airway closure in children. J Appl Physiol 1972; 33: 711-714.
- Gunnarsson L, Tokics L, Lundquist H, et al. Chronic obstructive pulmonary disease and anaesthesia: Formation of atelectasis and gas exchange impairment. Eur Respir J. 1991; 4: 1106-1116.
- Lumb AB, Nunn JF. Respiratory function and rib cage contribution to ventilation in body positions commonly used during anesthesia. Anesth Analg 1991; 73: 422-426.
- Gattinoni L, Tognoni G, Pesenti A, et al. Effect of prone positioning on the survival of patients with acute respiratory failure. N Engl J Med 2001; 345: 568-573.
- Rehder K, Knopp TJ, Sessler AD. Regional intrapulmonary gas distribution in awake and anesthetized-paralyzed prone man. J Appl Physiol 1978; 45: 528-535.
- Groeneveld AJ, Jansen EK, Veheij J. Mechanisms of pulmonary disfunction after on-pump and off-pump cardiac surgery: a prospective cohort study. J Cardioth Surg 2007; 2: 11-16.
- Clark SC. Lung injury after cardiopulmonary bypass. Perfusion 2006; 21: 225-228
- Claxton BA, Morgan P, McKeague H, et al. Alveolar recruitment strategy improves arterial oxygenation after cardiopulmonary bypass. Anaesthesia. 2003; 58: 111-116.
- Verheij J, Van Lingen A, Raijmakers HM, et al. Pulmonary abnormalities after cardiac surgery are better explained by atelectasis than by increased permeability oedema. Act Anaesth Scand 2005; 49: 1302-1310.
- Brooks-Brunn JA. Predictors of postoperative pulmonary complications following abdominal surgery. Chest 1997; 111: 564.571.
- Pöpping DM, Elia N, Marret E, Remy C, et al. Protective effect of epidural analgesia on pulmonary complications after abdominal and thoracic surgery. Arch Surg 2008; 143: 990-999.
- Frazee RC, Roberts JW, Okeson GC, et al. Open versus laparoscopic cholecystectomy: a comparison of post operative pulmonary function. Ann Surg 1991; 213(6): 651-654.
- Kum CK, Eypasch E, Aljaziri A, et al. Randomised comparison of pulmonary function after the French and American techniques of laparoscopic cholecystectomy. Br J Surg 1996; 83(7): 938-941.
- Duggan M, Kavanagh BP. Atelectasis in the perioperative patient. Curr Opin Anaesthesiol. 2007; 20: 37-42.
- Marshall BE. Importance of hypoxic pulmonary vasoconstriction with atelectasis. Adv Shock Res 1982; 8: 1-12.
- Wolthuis EK, Vlaar AP, Choi G, et al. Mechanical ventilation using non-injurious ventilation settings causes lung injury in the absence of pre-existing lung njury in healthy mice. Crit Care 2009; 13: R1.
- Steinberg JM, Schiller HJ, Halter JM, et al. Alveolar instability causes early ventilator induced lung injury independent of neutrophils. Am J respir Crit Care Med 2004; 169: 57-63.
- Schilling T, Kozian A, Huth C, et al. The pulmonary immune effects of mechanical ventilation in patients undergoing thoracic surgery. Anesth Analg 2005; 101: 957-965.
- Warner DO. Preventing postoperative pulmonary complications: The role of the anesthesiologist. Anesthesiology 2000; 92: 1467-1472.
- Van Kaam AH, Lachmann RA, Herting E, et al. Reducing atelectasis attenuates bacterial growth and translocation in experimental pneumonia. Am J Respir Crit Care Med 2004; 169: 1046-1053.
- Reber A, Engberg G, Wegenius G, et al. Lung aeration. The effect of pre-oxygenation and hyperoxygenation during total intravenous anaesthesia. Anaesthesia. 1996; 51: 733-737.
- Hedenstierna G. Oxygen and anesthesia: what lung do we deliver to the post-operative ward?, Act Anaesth Scand 2012; 56: 675-685.
- Edmark L, Kostova-Aherdan K, Enlund M, et al. Optimal oxygen concentration during induction of general anesthesia. Anesthesiology 2003; 98: 28-33.
- Coussa M, Proietti S, Schnyder P, et al. Prevention of atelectasis formation during the induction of general anesthesia in morbidly obese patients. Anesth Analg 2004; 98: 1492-1495.
- Rothen HU, Sporre B, Engberg G, et al. Influence of gas composition on recurrence of atelectasis after a reexpansion maneuver during general anesthesia. Anesthesiology 1995; 82: 832-842.
- Akca O, Podolsky A, Eisenhuber E, et al. Comparable postoperative pulmonary atelectasis in patients given 30% or 80% oxygen during and 2hours after colon resection. Anesthesiology 1999; 91: 991-998.
- Staehr AK, Meyhoff CS, Henneberg SW, et al. Influence of perioperative oxygen fraction on pulmonary function after abdominal surgery: a randomized controlled trial. BMC Reserch Notes 2012; 5: 383-386.
- Fakhry SM, Montgomery SC. Peri-operative oxygen and the risk of surgical infection. Surg Infect 2012; 13: 228-233.
- Tusman G, Belda JF. Treatment of anesthesia-induced lung collapse with lung recruitment maneuvers. Curr Anaesth Crit Care 2010; 21: 244-249.
- Imberger G, McIlroy D, Pace NL, et al. Positive end-expiratory pressure (PEEP) during anaesthesia for the prevention of mortality and postoperative pulmonary complications. Cochrane Database Syst Rev 2010, 9: 10.1002/14651858. CD007922.
- Reinius H, Jonsson L, Gustafsson S, et al. PEEP and recruitment maneuver in morbidly obese patients during general anesthesia and muscle: a computed tomography study. Anesthesiology 2009; 111(5): 979-987.
- Bendixen HH, Hedley-Whyte J, Chir B et al. Impaired oxygenation in surgical patients during general anesthesia with controlled ventilation. N Engl J Med 1963; 269: 991-996.
- Lachmann B. Open up the lung and keep the lungs open. Intensive Care Med 1992; 18: 319-321.
- Halter JM, Steinberg JM, Schiller HJ, et al. Positive end-expiratory pressure after a recruitment maneuver prevents both alveolar collapse and recruitment/derecruitment. Am J Resp Crit Care Med 2003; 167: 1620-1626.
- Hedenstierna G, Rothen HU. Atelectasis formation during anesthesia: Causes and measures to prevent it. J Clin Monit Comput 2000; 16: 329-335.
- Magnusson L, Tenling A, Lemoine R, et al. The safety of one, or repeated, vital capacity maneuvers during general anesthesia. Anesth Analg 2000; 91: 702-707.
- Dyhr T, Nygard E, Laursen N, et al. Both lung recruitment maneuver and PEEP are needed to increase oxygenation and lung volume after cardiac surgery. Act Anaesth Scand 2004; 48: 187-197.
- Tusman G, Böhm SH, Vazquez da Anda G, et al. “Alveolar recruitment strategy” improves arterial oxygenation during general anaesthesia. Br J Anaesth 1999; 82: 8-13.
- Maisch S, Reissmann H, Fuellekrug B, et al. Compliance and dead space fraction indicate an optimal level of positive end expiratory pressure after recruitment in anesthetized patients. Anesth Analg 2008; 106: 175-181.
- Suárez Sipmann F, Böhm SH, Tusman G, et al. Use of dynamic compliance for open lung positive end-expiratory pressure titration in an experimental study. Crit Care Med 2007; 35: 214-221.
- Lindner KH, Lotz P, Ahnefeld FW. Continuous positive airway pressure effect on functional residual capacity, vital capacity and its subdivisions. Chest 1987; 92: 66-70.
- Joris JL, Sottiaux TM, Chiche JD, et al. Effect of bi-level positive airway pressure (BiPAP) nasal ventilation on the post- operative restrictive syndrome in obese patients undergoing gastroplasty. Chest 1997; 111: 665-670.
- Squadrone V, Coha M, Cerutti E, et al. Continuous positive airway pressure for treatment of postoperative hypoxemia. A randomized controlled trial. JAMA 2005; 293: 589-595.
- Benoit Z, Wicky S, Fisher JF, et al. The effect of increased FiO2 before tracheal extubation on postoperative atelectasis. Anesthesia and Analgesia 2002; 95: 1777-1781.
- Loackinger A, Kleinsasser A, Keller C, et al. Administration of oxygen before tracheal extubation worsens gas exchange after general anesthesia in a pig model. Anesthesia and Analgesia 2002; 95: 1772-1776.
- Rothen HU, Sporre B, Wegenius G, et al. Re-expansion of atelectasis during general anaesthesia: a computed tomography study. Br J Anaesth 1993; 71: 788-795.
- Rothen HU, Neumann P, Berglund JE, et al. Dynamics of re-expansion of atelectasis during general anaesthesia. Br J Anaesth 1999; 82: 551-556.
- Neumann P, Rothen HU, Berglund JE, et al. Positive end-expiratory pressure prevents atelectasis during general anaesthesia even in presence of a high inspired oxygen concentration. Act Anaesth Scand 1999; 43: 295-301.
- Tusman G, Böhm SH, Melkun F, et al. Evaluacion de diferentes niveles depresión pico en la via aérea sobre una estrategia de reclutamiento alveolar. Rev Arg Anest 2000; 58: 67-73.
- Tusman G, Böhm SH, Melkun F, et al. Efectos de la maniobra de reclutamiento alveolar y la PEEP sobre la oxigenacion arterial en pacientes obesos anestesiados. Rev Españ Anest y Reanim 2002; 49: 177-183.
- Tusman G, Böhm SH, Melkun F, et al. Alveolar recruitment strategy increases arterial oxygen at on during one-lung ventilation. Ann Thorac Surg 2002; 73: 1204-1209.
- Tusman G, Böhm SH, Tempra A, et al. Effects of recruitment maneuver on atelectasis in anesthetized children. Anesthesiology 2003; 98: 14-22.
- Claxon BA, Morgan P, McKeague H, et al. Alveolar recruitment strategy improves arterial oxygenation after cardiopulmonary bypass. Anaesthesia 2003; 58: 111-116.
- Pang CK, Yap J, Chen PP. The effect of an alveolar recruitment strategy on oxygenation during laparoscopic cholecystectomy. Anaesth Int Care 2003; 31: 176-180.
- Reis Miranda D, Gommers D, Struijs A, et al. The openlung concept: effects on righ ventricular afterload after cardiac surgery. British Journal of Anaesthesia 2004; 93: 327-332.
- Tusman G, Böhm SH, Suárez-Sipmann F, et al. Lung recruitment improves the efficiency of ventilation and gas exchange during one-lung ventilation anesthesia. Anesth Analg 2004; 98: 1604-1609.
- Tusman G, Böhm SH, Suárez Sipmann F, et al. Alveolar recruitment improves ventilator efficiency of the lungs during anaesthesia. Can J Anaesth 2004; 51: 723-727.
- Whalen FX, Gajic O, ThompsonGB, et al. The effects of the alveolar recruitment maneuver and positive end-expiratory pressure on arterial oxygenation during laparoscopic bariatric surgery. Anesth Analg 2006; 102: 298-305.
- Malbouisson LMS, Brito M, Carmona MJC, et al. Hemodynamic impacts of alveolar recruitment maneuver in patients evolving with cardiogenic shock in the immediate postoperative period of myocardial revascularization. Rev Brasil Anest 2008; 58: 112-123.
- Almarakbi WA, Fawzi HM & Alhashemi JA. Effects of four intraoperative ventilator strategies on respiratory compliance and gas exchange during laparoscopic gastric banding in obese patients. Brit J Anaesth 2009; 102: 862-868.
- Böhm SH, Maisch S, von Sandersleben A, et al. Effects of lung recruitment on phase III slope of volumetric capnography in morbidly obese patients. Anesth Analg 2009; 109: 151-159.