Ana Fernández-Martínez MD.1*, Jesús Gutiérrez Delgado MD.1, Marta Aguado Sevilla MD.1, María Alcañiz Muro MD.1
Recibido: 13-08-2024
Aceptado: 12-12-2024
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 6 pp. 960-963|https://doi.org/10.25237/revchilanestv54n6-26
PDF|ePub|RIS
Anesthetic considerations in Da Vinci robotic surgery for medial arcuate ligament syndrome, case report (February 2024)
Abstract
Median arcuate ligament syndrome, or celiac trunk syndrome, is a rare vascular compression syndrome in which the ligament compresses the celiac artery and ganglion, causing epigastric pain, nausea and vomiting, and weight loss. The diagnosis is one of exclusion and requires an imaging study, such as magnetic resonance angiography (MRA) or computed tomography angiography (CTA), with arteriography being the gold standard. Treatment is surgical, and minimally invasive techniques, such as robotic surgery, are increasingly advocated. Laparoscopic robotic surgery and the manipulation of major vascular structures require special considerations in the anesthetic management of these patients.
Resumen
El síndrome del ligamento arcuato medio o síndrome del tronco celíaco es un síndrome compresivo vascular poco frecuente en el que dicho ligamento comprime la arteria y el ganglio celíaco, produciendo epigastralgia, náuseas y vómitos y pérdida de peso. Su diagnóstico es de exclusión y requiere de una prueba de imagen, como una angioresonancia o angioTAC, siendo la arteriografía el gold estándar. Su tratamiento es quirúrgico y cada vez se aboga más por técnicas mínimamente invasivas, como la cirugía robótica. La cirugía robótica laparoscópica y la manipulación de estructuras vasculares importantes requieren de algunas consideraciones especiales en el manejo anestésico de estos pacientes.
-
Introducción
El síndrome del ligamento arcuato medio o síndrome de compresión del tronco celíaco se trata de un síndrome compresivo vascular poco frecuente que afecta a 2 de cada 100.000 personas, siendo más frecuente en mujeres de entre 30 y 50 años[1]. En este síndrome la parte proximal de la arteria celíaca y del ganglio celíaco son comprimidos por el ligamento arcuato medio, una banda tendinosa que une los pilares diafragmáticos derecho e izquierdo. Habitualmente, el ligamento rodea el hiato aórtico y adopta una posición cefálica con respecto al origen de la arteria celíaca, sin embargo, entre 10% y 24% de la población presenta una posición más caudal del mismo, comprimiendo la arteria celíaca y las estructuras nerviosas adyacentes. La clínica más frecuente es la epigastralgia posprandial, ya que el aumento de la demanda de flujo sanguíneo posprandial a través de la arteria celíaca estenosada por el ligamento produce isquemia intestinal[2]. También son frecuentes las náuseas, los vómitos y la pérdida de peso[1].
Su diagnóstico es de exclusión y precisa de una prueba de imagen que demuestre la compresión de la arteria celíaca (resonancia magnética, angiografía por resonancia magnética, angiografía por tomografía computerizada o ecografía Doppler). La angiografía mesentérica lateral es considerada la prueba gold standard[1].
El tratamiento es quirúrgico y requiere de la liberación del ligamento para disminuir la compresión sobre el tronco celíaco. La manipulación de estructuras vasculares importantes puede producir cambios hemodinámicos rápidos además de graves complicaciones, lo que supone un reto para el anestesiólogo.
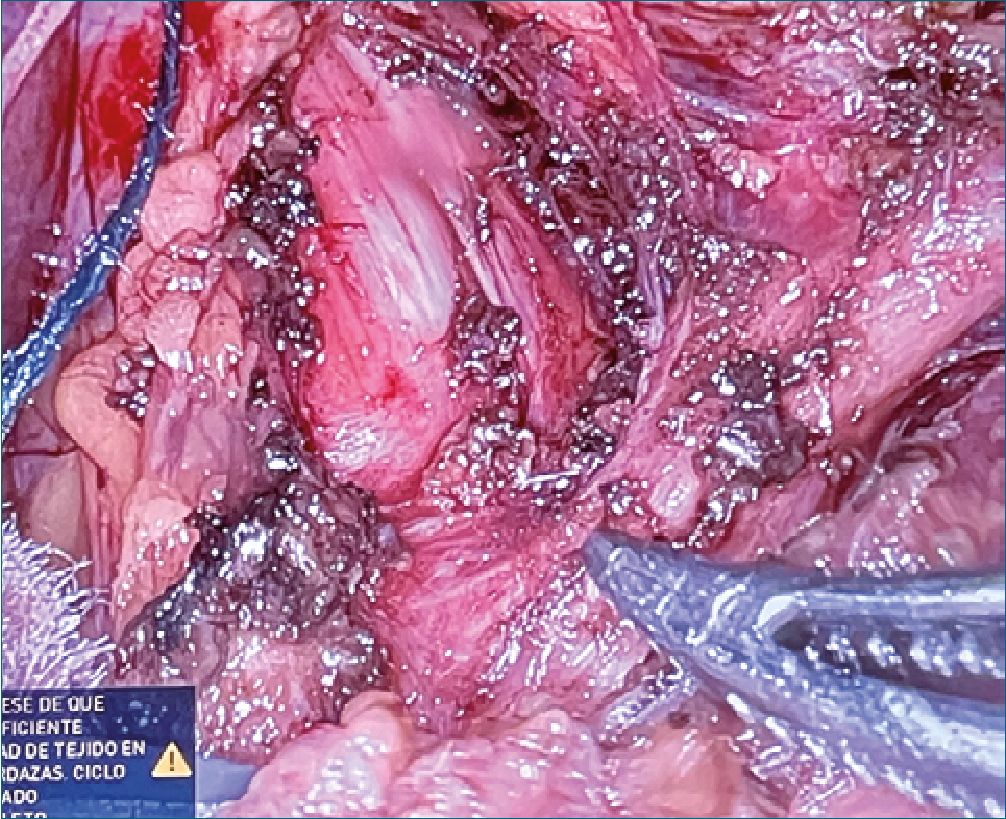
Figura 1. Fotografía obtenida durante la liberación robótica del ligamento. En ella se puede ver la compresión ejercida sobre la arteria celíaca y sus estructuras adyacentes.
-
Caso clínico
La paciente es una mujer de 48 años, American Society of Anesthesiologist (ASA) II. Había sido intervenida con anterioridad de un mioma uterino, colecistectomía, resección de teratoma ovárico y cesárea.
Refería como clínica epigastralgia posprandial y dolor abdominal severo irradiado a hipocondrio izquierdo de 5 meses de evolución. Además, presentó una pérdida de peso de 10 kg tras limitar la ingesta por el dolor posprandial.
Tras ser valorada por digestivo y realizarse varias pruebas diagnósticas, se realizó una angioresonancia magnética que evidenció una estenosis focal en la salida del tronco celíaco por el ligamento arcuato, además de una leve dilatación postestenótica del tronco celíaco proximal a la bifurcación de la arteria hepática y esplénica.
El resultado de la angioresonancia y la exclusión de otros posibles diagnósticos permitieron diagnosticar a la paciente de síndrome del ligamento arcuato medio y se programó para su liberación mediante cirugía robótica Da Vinci.
El día de la intervención y previo a la cirugía la paciente fue premedicada con 7,5 mg de midazolam oral y cefazolina 2 g intravenosa como antibioterapia profiláctica. A su llegada a quirófano se monitorizó con electrocardiograma de dos derivaciones, pulsioximetría, tensión arterial no invasiva, monitorización biespectral BIS de 4 canales, temperatura y monitorización de la relajación neuromuscular mediante TOF.
La inducción se realizó por medio de un acceso venoso periférico 18G con 100 pg de fentanilo, 60 mg de lidocaína, 120 mg de propofol y 50 mg de rocuronio. Se intubó con tubo endotraqueal del 7,5 bajo laringoscopia directa con pala MAC 3 al primer intento y sin incidencias (Cormack-Lehane I). Tras la inducción se administraron 6 mg de dexametasona como profilaxis antiemética y se procedió a canalizar otro acceso venoso periférico 18G y una arteria radial izquierda para monitorización invasiva de la tensión arterial. Se administraron paracetamol 1 g y dexketoprofeno 50 mg como analgesia antes de realizar las incisiones.
El mantenimiento de la hipnosis se realizó con perfusión de propofol mediante “target controlled infusion” entre 2 y 2,5 pg ml-1. Se administraron bolos de rocuronio de 30 mg cada 45 minutos para el mantenimiento de la relajación neuromuscular y se empleó una perfusión de remifentanilo entre 0,1 y 0,2 pg kg-1 min-2 como analgesia intraoperatoria.
La ventilación mecánica se realizó controlada por volumen, manteniendo unas presiones pico y plateau por debajo de los 24 y 22 cmH2O respectivamente y un EtCO2 inferior a 40.
Se realizó una ecografía intraoperatoria antes de la liberación robótica del ligamento que mostró un flujo a gran velocidad en la arteria celíaca, sugestivo de compresión. Posteriormente, se realizó la liberación del ligamento, que condicionaba una estenosis de la arteria celíaca inmediatamente proximal a la salida de la arteria gástrica izquierda, como puede apreciarse en la Figura 1. Tras ello, se repitió la ecografía intraoperatoria, que evidenció una reducción considerable de la velocidad del flujo y una mejoría significativa de la estenosis.
La paciente se mantuvo estable hemodinámicamente durante toda la intervención, con PAI entre 110/60 mmHg y 120/80 mmHg y en ritmo sinusal en torno a 80 lpm. Se le administraron 500 cc de Ringer Lactato a 5 ml kg-1 como fluidoterapia durante el intraoperatorio.
Se administró 1,25 mg de droperidol y 100 pg de fentanilo previo a la educción y extubación de la paciente, además, los puertos quirúrgicos fueron infiltrados con 10 cc de levobupivacaína 0,25%. Se revirtió el bloqueo neuromuscular con 200 mg de sugammadex, y tras obtener un TOF 90% se procedió a la extubación sin incidencias.
La paciente fue trasladada a la unidad de reanimación postanestésica con una RASS -1, estable hemodinámicamente y con oxigenoterapia mediante mascarilla tipo Venturi con FiO2 50%. Durante su estancia requirió de 3 mg de cloruro mórfico intravenoso como rescate por dolor irruptivo. Tras 2 h, la paciente se encontraba eupneica, con buena saturación de oxígeno respirando aire ambiente, con constantes vitales en rango y con el dolor controlado, por lo que fue dada de alta a la planta de cirugía general con un test de Aldrete de 10.
En planta la paciente inició tolerancia oral con agua a las 7 h de la cirugía sin presentar náuseas ni vómitos. En los dos días siguientes a la cirugía se progresó a dieta semiblanda y blanda respectivamente, con buena tolerancia. Se mantuvo afebril y con buen control del dolor con paracetamol 1 g y metamizol 2 g intravenoso cada 8 h, no precisando de más rescates. Fue dada de alta al domicilio a las 72 h de la cirugía. La paciente evolucionó satisfactoriamente, encontrándose asintomática en el momento actual.
-
Discusión
En 2007 Jaik y colaboradores, emplearon por primera vez con éxito la cirugía robótica para el tratamiento del síndrome del ligamento arcuato medio[3], ya que permite realizar maniobras más complejas, proporciona mayor control de movimiento y visualización tridimensional. Se trata de una opción segura y eficaz, aunque precisa de más estudios[4]. Por contra, supone mayor tiempo quirúrgico, requiere de formación específica y es más cara[2].
Existen algunas consideraciones anestésicas a tener en cuenta en la cirugía robótica laparoscópica. La ventilación mecánica debe ser protectora a 6-8 ml kg-1 y la PEEP debe individualizarse mediante maniobras de reclutamiento pulmonar tras la intubación y tras la realización del neumoperitoneo. En los pacientes difíciles de ventilar u oxigenar adecuadamente puede ser mejor la ventilación controlada por presión[5].
Además, requiere de una adecuada relajación y monitorización neuromuscular para facilitar la cirugía y evitar complicaciones por movimientos del paciente cuando los brazos del robot están acoplados[5]. El bloqueo neuromuscular profundo puede mejorar las condiciones quirúrgicas y permitir el uso de una presión intraabdominal más baja[6].
Dado que no se preveía una cirugía muy larga, se optó por mantener la relajación neuromuscular con rocuronio en bolos, pero en cirugías más largas podría emplearse una perfusión.
La hipnosis se mantuvo con una TIVA de propofol para disminuir las náuseas y los vómitos en el posoperatorio, sin embargo, cabe mencionar que la reducción de los reflejos espinales con el propofol es menor que con el sevoflurane, por lo que se adicionó una perfusión de remifentanilo como analgesia intraoperatoria, ya que minimiza su aparición y ayuda a mantener la estabilidad hemodinámica al disminuir los picos intraoperatorios de presión arterial. El sulfato de magnesio también puede ser útil para controlar la tensión arterial, pero la paciente mantuvo sistólicas en torno a 120 mmHg durante todo el procedimiento, por lo que no fue administrado[6].
La manipulación quirúrgica del tronco celíaco puede producir labilidad hemodinámica[7], por lo que se recomienda emplear fármacos vasodilatadores o vasopresores de vida media corta para poder adaptarse a los cambios hemodinámicos bruscos. Además, el riesgo de hemorragia requiere de la realización de pruebas cruzadas y de la disponibilidad de hemoderivados en el banco de sangre.
La fluidoterapia excesiva, el neumoperitoneo y la posición de Trendelemburg incrementan el riesgo de edema de vía aérea y extubación fallida. El edema periorbitario puede servir de predictor de edema laríngeo, así como la medición mediante ecografía del diámetro de la vaina del nervio óptico. La prueba de fuga puede realizarse antes de extubar para valorar el riesgo de edema de glotis[5]. Nuestra paciente presentaba un riesgo bajo de edematización de las vías respiratorias, ya que no se colocó en Trendelemburg y la cirugía duró solo 2 h, por lo que únicamente se valoró la existencia de edema periorbitario.
El dolor posoperatorio fue fácilmente controlable con paracetamol y metamizol intravenoso, necesitando únicamente un rescate de cloruro mórfico de 3 mg. Este hecho contrasta con la experiencia de otros anestesiólogos que presentaron problemas para controlar el dolor en el posoperatorio inmediato, necesitando dosis muy altas de cloruro mórfico[7].
En definitiva, el anestesiólogo debe tener presentes las particularidades de la cirugía robótica y estar alerta ante posibles fluctuaciones hemodinámicas derivadas de la manipulación de estructuras vasculares importantes, o de la aparición de una hemorragia grave.
Contribución de los autores
Ana Fernández: presente durante la cirugía. Recogida de datos. Solicitar consentimiento informado firmado a la paciente. Búsqueda bibliográfica. Redacción del artículo.
María Alcañiz: búsqueda bibliográfica. Redacción del artículo.
Marta Aguado: búsqueda bibliográfica. Redacción del artículo. Corrección del paper.
J esús Gutiérrez: presente durante la cirugía. Recogida de datos. Búsqueda bibliográfica.
Conflicto de intereses
Ninguno.
Fuentes de financiación
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
-
Referencias
1. Chaum M, Shouhed D, Kim S, Walts AE, Marchevsky AM. Clinico-pathologic findings in patients with median arcuate ligament syndrome (celiac artery compression syndrome). Ann Diagn Pathol. 2021 Jun;52(151732):151732. https://doi.org/10.1016/j.anndiagpath.2021.151732 PMID:33798927
2. Kim EN, Lamb K, Relles D, Moudgill N, DiMuzio PJ, Eisenberg JA. Median arcuate ligament syndrome—review of this rare disease. JAMA Surg. 2016 May;151(5):471–7. https://doi.org/10.1001/jamasurg.2016.0002 PMID:26934394
3. Jaik NP, Stawicki SP, Weger NS, Lukaszczyk JJ. Celiac artery compression syndrome: successful utilization of robotic-assisted laparoscopic approach. J Gastrointestin Liver Dis. 2007 Mar;16(1):93–6. PMID:17410294
4. Fernstrum C, Pryor M, Wright GP, Wolf AM. Robotic surgery for median arcuate ligament syndrome. JSLS. 2020;24(2):e2020.00014. https://doi.org/10.4293/JSLS.2020.00014.
5. Suryawanshi CM, Shah B, Khanna S, Ghodki P, Bhati K, Ashok KV. Anaesthetic management of robot-assisted laparoscopic surgery. Indian J Anaesth. 2023 Jan;67(1):117–22. https://doi.org/10.4103/ija.ija_966_22 PMID:36970478
6. Hottenrott S, Schlesinger T, Helmer P, Meybohm P, Alkatout I, Kranke P. Do small incisions need only minimal anesthesia?—anesthetic management in laparoscopic and robotic surgery. J Clin Med. 2020 Dec;9(12):4058. https://doi.org/10.3390/jcm9124058 PMID:33334057
7. Álvarez-Fuente E, Fadrique Fuentes A, Poves-Álvarez R, Gómez-Pesquera E, Hernández Lozano A. Manejo anestésico del síndrome del ligamento arcuato medio. Rev Esp Anestesiol Reanim (Engl Ed). 2018 Dec;65(10):597–600. https://doi.org/10.1016/j.redare.2018.11.004 PMID:30049572

 ORCID
ORCID