Darío Ríos1, Rodrigo Brisso1, Pedro Lobos PhD.3, Lorena Caipo4, José Ignacio Egaña2,3, Rodrigo Gutiérrez2,3, Antonello Penna2,3
Recibido: 23-05-2025
Aceptado: 18-08-2025
©2026 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 55 Núm. 1 pp. -|https://doi.org/10.25237/revchilanestv55n1-10
PDF|ePub|RIS
Preoperative neurocognitive testing and its correlation with brain damage biomarkers
Abstract
Perioperative neurocognitive disorders are frequent in older adults undergoing general anesthesia, negatively affecting clinical outcomes. The Montreal Cognitive Assessment (MoCA) detects mild cognitive impairment but has diagnostic limitations. Serum biomarkers such as UCH-L1 (ubiquitin C-terminal hydrolase L1), TAU (tau protein), NFL (neurofilament light polypeptide) and GFAP (glial fibrillary acidic protein) could complement this assessment. To determine the correlation between MoCA score and serum levels of biomarkers of brain damage in older adults undergoing elective surgery with general anesthesia at the Hospital Clínico de la Universidad de Chile (HCUCH). Prospective observational study performed in 20 patients > 60 years. Those with neurological and psychiatric pathologies were excluded. The MoCA test was applied, and preoperative blood samples were obtained for analysis by SIMOA® (NEUROLOGY 4-PLEX A). MoCA scores were correlated with serum biomarker levels using Spearman coefficients. Fifteen patients were analyzed. The median MoCA was 23 points. Only two patients had elevated TAU and/or NFL levels. No significant correlations were found between MoCA scores and levels of any biomarker (p < 0.3; p > 0.3). There was no evidence of a significant correlation between the MoCA questionnaire score, and the biomarkers analyzed. This suggests that MoCA scores obtained immediately prior to surgery do not adequately assess the patients’ cognitive status. The upcoming surgical event may influence the low performance observed in cognitive tests.
Resumen
Los trastornos neurocognitivos perioperatorios frecuentan en adultos mayores sometidos a anestesia general, afectando negativamente los desenlaces clínicos. La Evaluación Cognitiva de Montreal (MoCA) detecta el deterioro cognitivo leve, pero presenta limitaciones diagnósticas. Existen biomarcadores séricos como UCH-L1 (ubiquitina carboxil hidrolasa terminal L1), TAU (proteína TAU), NFL (cadena ligera de neurofilamento) y GFAP (proteína ácida fibrilar glial) que podrían complementar esta evaluación. Determinar la correlación entre el puntaje de MoCA y los niveles séricos de biomarcadores de daño cerebral en adultos mayores sometidos a cirugía electiva con anestesia general en el Hospital Clínico de la Universidad de Chile (HCUCH). Estudio observacional prospectivo realizado en 20 pacientes > 60 años. Se excluyeron aquellos con patologías neurológicas y psiquiátricas. Se aplicó la prueba MoCA y se obtuvieron muestras de sangre preoperatorias para análisis mediante SIMOA® (NEUROLOGY 4-PLEX A). Se correlacionaron los puntajes MoCA con los niveles séricos de biomar- cadores utilizando coeficientes de Spearman. Se analizaron 15 pacientes. La mediana del MoCA fue 23 puntos. Solo dos pacientes presentaron niveles elevados de TAU y/o NFL. No se encontraron correlaciones significativas entre los puntajes MoCA y los niveles de ningún biomarcador (p < 0,3; p > 0,3). No se evidenció que exista una correlación significativa entre el puntaje del cuestionario MoCA y los biomarcadores analizados. Esto indica que los valores de MoCA inmediatamente previo a la cirugía no evalúan de manera adecuada el estado cognitivo de los pacientes. El evento quirúrgico próximo por realizarse posiblemente influye en la obtención de bajos rendimientos en las pruebas cognitivas.
-
Introducción
Los trastornos neurocognitivos perioperatorios abarcan un conjunto diverso de afecciones como el deterioro cognitivo menor, el deterioro cognitivo mayor y el delirium, entre otros. Estas alteraciones son frecuentes en pacientes sometidos a anestesia general, con una incidencia de deterioro cognitivo que oscila entre el 10% y el 40% antes, durante o después de la cirugía. Su presencia se asocia con un mayor riesgo de mortalidad y complicaciones posoperatorias[1],[2]. Por ello, resulta fundamental la detección temprana de trastornos preexistentes, ya que estos influyen negativamente en los desenlaces quirúrgicos.
Para la evaluación preoperatoria, existen diversas herramientas neuropsicológicas, entre las cuales destaca la Evaluación Cognitiva de Montreal (MoCA), la cual ha demostrado una mayor sensibilidad que el Mini-Mental State Examination (MMSE) en la detección de deterioro cognitivo moderado[1]. Sin embargo, la heterogeneidad de las manifestaciones clínicas de los trastornos neurocognitivos plantea desafíos para su diagnóstico preciso mediante estas pruebas. Ante esta limitación, se ha comenzado a explorar el uso de biomarcadores de daño cerebral como herramientas complementarias para mejorar la evaluación, clasificación y manejo de estos trastornos.
En este contexto, un estudio retrospectivo analizó la utilidad de biomarcadores indicativos de daño axonal en la evaluación del delirium, incluyendo UCH-L1 (ubiquitina carboxil hidrolasa terminal), TAU (proteína TAU), NFL (cadena ligera de neurofilamento) y GFAP (proteína ácida fibrilar glial). Los resultados sugieren que la proteína TAU y NFL presentan mayor utilidad diagnóstica[3]. Además, los biomarcadores han sido estudiados en el manejo de pacientes con delirium y lesión cerebral traumática; no obstante, la evidencia actual no respalda su imple- mentación rutinaria en la práctica clínica[4],[5].
Dado que los biomarcadores podrían complementar las evaluaciones neuropsicológicas tradicionales, surge la necesidad de investigar su relación con herramientas clínicas ampliamente utilizadas en el perioperatorio. En este sentido, el presente estudio tiene como objetivo determinar la correlación entre los puntajes obtenidos en la prueba MoCA inmediatamente previo a la cirugía y los niveles de biomarcadores específicos de daño cerebral. Este análisis permitirá evaluar si la combinación de estas herramientas puede mejorar la detección de disfunción cognitiva en el contexto perioperatorio.
-
Materiales y Métodos
Tras la aprobación del comité de ética del HCUCH (acta aprobación número 81 de 2022), se realizó un estudio observa- cional de una cohorte prospectiva de 20 pacientes de 60 años o más que estaban planificados para una cirugía electiva con anestesia general. Se excluyeron a los pacientes con diagnóstico de patologías neurológicas, enfermedades agudas activas o crónicas descompensadas, enfermedades psiquiátricas severas o alergia al propofol.
A cada participante, tras la firma del consentimiento informado, se les realizó una prueba de MoCA para evaluar su función cognitiva previo a la cirugía. Además, previo al suministro de cualquier fármaco intravenoso, se obtuvo una muestra sanguínea de 5 mL, y se le instaló un sensor BIS bilateral o SedLine para registrar la actividad electroencefalográfica para guiar la dosificación anestésica. El procedimiento anestésico se realizó según el criterio del anestesiólogo tratante.
La muestra de sangre venosa periférica fue procesada y almacenada a -80°C. Posteriormente, se realizó el análisis de las muestras mediante el equipo HD-X SIMOA®, el cual es totalmente automatizado y digital para la realización de inmunoen- sayos, basado en la tecnología SIMOA® y que proporcionan una señal y/o medición ultrasensible hasta 1.000 veces mayor que los inmunoensayos convencionales (en el rango femtomolar). La sangre fue analizada con el kit NEUROLOGY 4-PLEX A (NFL, TAU, GFAP, UCH-L1) y el equipo entregó los resultados para cada muestra que fueron correlacionados con respecto al valor del puntaje de MoCA.
El tamaño de la muestra calculado fue de 20 pacientes para detectar un coeficiente de correlación entre los niveles de marcadores del kit NEUROLOGY 4-PLEX A y los valores de MoCA de 0,6, con un error alfa de 0,5 y un poder del 80% con dos colas (G*Power 3.1.9.4). Los análisis se realizaron utilizando el software graphpad Prisma.
-
Resultados
Se estudiaron 20 pacientes; sin embargo, a 3 sujetos no se les pudo realizar el MoCA previo a la cirugía y a otros dos no se les hizo un análisis de la muestra de sangre. Los 15 pacientes restantes tuvieron una edad promedio de 68,2 ± 6,3 años y 9 pacientes fueron de sexo femenino (Tabla 1). A 11 pacientes se les realizó una colecistectomía por video laparoscopia, mientras a otros cuatro se les realizó un bypass gástrico, una reconstitución de tránsito, una resección de un tumor pleural y una resección segmentaria de un tumor pulmonar.
Los biomarcadores del kit NEUROLOGY 4-PLEX A y los puntajes de MoCA se detallan en la Tabla 2. Se destaca que la mediana del valor MoCA fue de 23 (min-max, 12-29) puntos, los cuales indican que es una población con un bajo rendimiento cognitivo[6]. Por otro lado, los valores de los biomarcadores al compararlos con respecto a su normalidad: UCH-L1 50-200 pg/ mL[7]; TAU 1,5-8,5 pg/mL[8]; NFL 3,4-16,7 pg/mL[9]; y GFAP 50-200 pg/mL[10], indican que sólo un paciente tuvo valores anormales para la proteína TAU con un valor de 32,5 pg/mL y para la proteína NFL 104,6; mientras para un segundo paciente NFL tuvo un valor sobre lo normal de 17,2 pg/mL. Los valores de los marcadores para los otros 13 pacientes estuvieron en el rango de la normalidad.
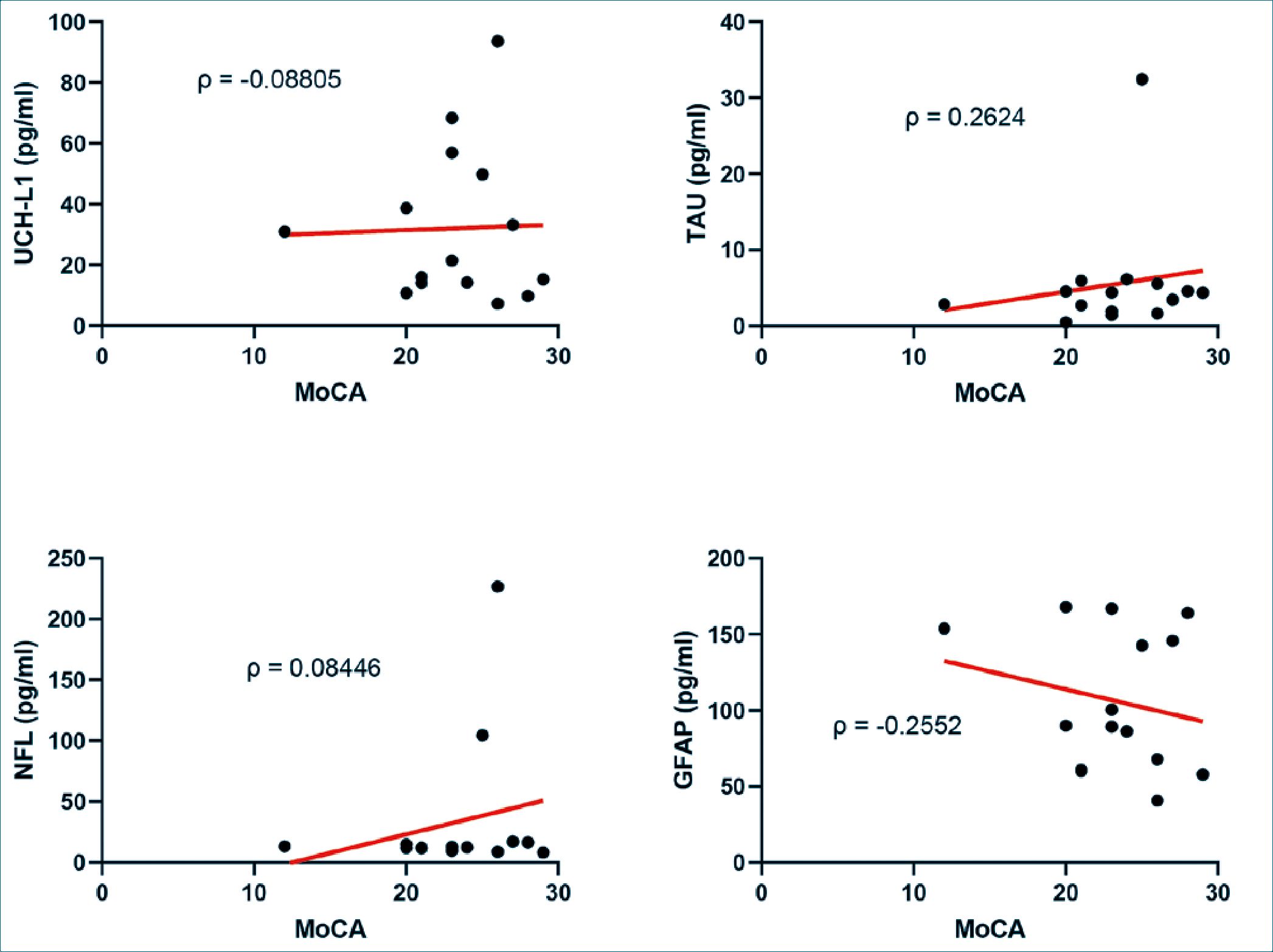
Al correlacionar los puntajes de MoCA y los puntajes de cada uno de los biomarcadores se obtuvo con UCH-L1 p = -0,08805 (p = 0,8); TAU p = 0,2624 (p = 0,3); NFL p = 0,08446 (p = 0.8); y GFAP p = -0,2552 (p = 0,4) (Figura 1).
Tabla 1. Descripción general de la muestra
| Característica | n = 15 |
| Edad, promedio (DE), años | 68,2 (6,3) |
| Sexo femenino, n (%) | 9 (60) |
| Tipos de cirugías | |
| Colecistectomia por video laparoscopia, n (%) | 11 (73,3) |
| Reconstitución de tránsito, n (%) | 1 (6,7) |
| Cirugía de bypass gástrico, n (%) | 1 (6,7) |
| Resección tumor pleural, n (%) | 1 (6,7) |
| Resección tumor pulmonar, n (%) | 1 (6,7) |
| ASA-PS, n (%) 1-2 3-4 | 10 (66,7)
5 (33,3) |
ASA-PS: American Society of Anesthesiologist Physical Status.
Tabla 2. Valores de la prueba cognitiva MoCA y biomarcadores cerebrales
| Característica | n = 15 |
| MoCA, mediana (min-max) | 23 (12-29) |
| UCHL-1, promedio (DE), pg/mL | 32,2 (25,2) |
| TAU, promedio (DE), pg/mL | 5,5 (7,6) |
| NFL, promedio (DE), pg/mL | 32,9 (58,7) |
| GFAP, promedio (DE), pg/mL | 106,3 (45,7) |
MoCA: Montreal Cognitive Assesment; UCHL-1: ubiquitina carboxil hidrolasa terminal L1; TAU: proteína TAU; NFL: cadena ligera de neurofilamento; GFAP: proteína ácida fibrilar glial.
-
Discusión
Los resultados del presente estudio ofrecen una perspectiva preliminar sobre la relación entre biomarcadores de daño neuronal y el desempeño cognitivo preoperatorio en adultos mayores, evaluado mediante el cuestionario MoCA. Aunque el tamaño de la muestra es limitado, los hallazgos permiten identificar ciertos patrones iniciales que, de confirmarse en investigaciones de mayor escala, podrían tener implicancias clínicas relevantes.
Uno de los hallazgos más significativos fue la ausencia de correlación entre los niveles de biomarcadores y los puntajes del MoCA obtenidos antes de la cirugía. Este resultado contrasta con la evidencia previa, que ha vinculado biomarcadores como TAU y NFL con daño axonal y degeneración neuronal, tanto en enfermedades neurodegenerativas como en la disfunción cognitiva posoperatoria (DCPO)[11]-[14]. Esta discrepancia sugiere que los puntajes obtenidos en las pruebas cognitivas inmediatamente antes del procedimiento quirúrgico podrían subestimar el grado de deterioro cognitivo en estos pacientes.
Por otro lado, los niveles basales de los biomarcadores preoperatorios -con excepción de dos pacientes- se encontraron dentro de rangos normales, a pesar de que nueve pacientes presentaron un puntaje MoCA igual o inferior a 24, y cinco de ellos igual o inferior a 21. Según reportes previos, estos valores podrían indicar un mayor riesgo de desarrollar DCPO[15]. Este hallazgo plantea la posibilidad de que los biomarcadores, por sí solos, no sean suficientes para predecir el rendimiento cognitivo, dado que el deterioro perioperatorio constituye un fenómeno multifactorial que probablemente requiere un enfoque diagnóstico multimodal e integrador.
Un hallazgo particularmente interesante fue la escasa variabilidad en los niveles de GFAP entre los grupos, lo que podría indicar que, en esta población o bajo las condiciones específicas del estudio, el componente astrocítico del daño cerebral -reflejado por GFAP- no desempeñó un rol predominante, o bien que la cinética de su liberación no coincidió con el momento de la toma de muestras. Esto contrasta con estudios previos que han propuesto a GFAP como un marcador sensible de daño glial agudo, especialmente en contextos de trauma o encefalopa- tías[16].
Este estudio aporta hallazgos preliminares prometedores sobre la evaluación cognitiva en el contexto prequirúrgico. No obstante, es importante reconocer sus limitaciones. En primer lugar, el tamaño reducido de la muestra (n = 15) limita considerablemente la potencia estadística del análisis y la generalización de los resultados. En segundo lugar, las mediciones se basaron en muestras únicas de sangre periférica, cuya relación con los procesos intracraneales aún es motivo de investigación. En tercer lugar, la notable heterogeneidad cultural presente en Chile podría influir en el factor de sensibilidad cultural[17], un componente clave para la correcta aplicación e interpretación del MoCA. Esta variabilidad podría afectar los puntajes obtenidos y, en consecuencia, su comparación con los niveles plasmáticos de biomarcadores. Finalmente, la ausencia de un seguimiento posoperatorio impide determinar si los niveles preoperatorios se asocian con eventos cognitivos posteriores, como la DCPO.
-
Conclusiones
En nuestro estudio no se evidenció correlación entre los puntajes del cuestionario MoCA y los niveles plasmáticos de los biomarcadores de daño cerebral UCH-L1, TAU, NFL y GFAP en pacientes mayores de 60 años sometidos a cirugía electiva bajo anestesia general. Estos resultados subrayan la complejidad de evaluar el deterioro cognitivo en contextos perioperatorios y refuerzan la necesidad de implementar enfoques diagnósticos multimodales que integren tanto elementos clínicos como parámetros biológicos. Es probable que la aplicación de pruebas cognitivas en el período inmediatamente previo a la cirugía no refleje con precisión el estado cognitivo real de los pacientes, ya que la inminencia del evento quirúrgico podría influir negativamente en su rendimiento.
Figura 1. Correlaciones entre los valores de MoCA y los valores de cada uno de los biomarcadores estudiados. En cada gráfico se muestra la regresión lineal representada con una línea roja y el coeficiente de correlación p para las correlaciones de MoCA con UCH-L1, TAU, NFL y GFAP.
Fuente de financiamiento: sin financiamiento.
Conflicto de intereses: sin conflictos a declarar.
-
Referencias
1. Lakshminarayanan S, Aboobacker M, Brar A, Manoj MP, Elsaid Ismail Elnimer MM, Marepalli A, et al. Advancing perioperative neurocognitive health: A critical review of predictive tools, diagnostic methods, and interventional strategies. Cureus. 2024 May;16(5):e59436. https://doi.org/10.7759/cureus.59436 PMID:38826940
2. Viderman D, Nabidollayeva F, Aubakirova M, Yessimova D, Badenes R, Abdildin Y. Postoperative delirium and cognitive dysfunction after general and regional anesthesia: A systematic review and meta-analysis. J Clin Med. 2023 May;12(10):3549. https://doi.org/10.3390/jcm12103549 PMID:37240655
3. Piel JH, Bargemann L, Leypoldt F, Wandinger KP, Dargvainiene J. Serum NFL and tau, but not serum UCHL-1 and GFAP or CSF SNAP-25, NPTX2, or sTREM2, correlate with delirium in a 3-year retrospective analysis. Front Neurol. 2024 Mar;15:1356575. https://doi.org/10.3389/fneur.2024.1356575 PMID:38566855
4. Dunne SS, Coffey JC, Konje S, Gasior S, Clancy CC, Gulati G, et al. Biomarkers in delirium: A systematic review. J Psychosom Res. 2021 Aug;147(110530):110530. https://doi.org/10.1016/j.jpsychores.2021.110530 PMID:34098376
5. Huibregtse ME, Bazarian JJ, Shultz SR, Kawata K. The biological significance and clinical utility of emerging blood biomarkers for traumatic brain injury. Neurosci Biobehav Rev. 2021 Nov;130:433–47. https://doi.org/10.1016/j.neubiorev.2021.08.029 PMID:34474049
6. Delgado C, Araneda A, Behrens MI. Validación del instrumento Montreal Cognitive Assessment en español en adultos mayores de 60 años. Neurol (Engl Ed). 2019;34(6):376–85. https://doi.org/10.1016/j.nrl.2017.01.013.
7. Gill J, Latour L, Diaz-Arrastia R, Motamedi V, Turtzo C, Shahim P, et al. Glial fibrillary acidic protein elevations relate to neuroimaging abnormalities after mild TBI. Neurology. 2018 Oct;91(15):e1385–9. https://doi.org/10.1212/WNL.0000000000006321 PMID:30209234
8. Janelidze S, Mattsson N, Palmqvist S, Smith R, Beach TG, Serrano GE, et al. Plasma P-tau181 in Alzheimer’s disease: relationship to other biomarkers, differential diagnosis, neuropathology and longitudinal progression to Alzheimer’s dementia. Nat Med. 2020 Mar;26(3):379–86. https://doi.org/10.1038/s41591-020-0755-1 PMID:32123385
9. Khalil M, Teunissen CE, Otto M, Piehl F, Sormani MP, Gattringer T, et al. Neurofilaments as biomarkers in neurological disorders. Nat Rev Neurol. 2018 Oct;14(10):577–89. https://doi.org/10.1038/s41582-018-0058-z PMID:30171200
10. Pereira JB, Janelidze S, Smith R, Mattsson-Carlgren N, Palmqvist S, Teunissen CE, et al. Plasma GFAP is an early marker of amyloid-β but not tau pathology in Alzheimer’s disease. Brain. 2021 Dec;144(11):3505–16. https://doi.org/10.1093/brain/awab223 PMID:34259835
11. Evered L, Silbert B, Knopman DS, Scott DA, DeKosky ST, Rasmussen LS, et al.; Nomenclature Consensus Working Group. Recommendations for the nomenclature of cognitive change associated with anaesthesia and surgery-2018. Anesth Analg. 2018 Nov;127(5):1189–95. https://doi.org/10.1213/ANE.0000000000003634 PMID:30325748
12. Mattsson N, Cullen NC, Andreasson U, Zetterberg H, Blennow K. Association between longitudinal plasma neurofilament light and neurodegeneration in patients with Alzheimer’s disease. JAMA Neurol. 2019 Jul;76(7):791–9. https://doi.org/10.1001/jamaneurol.2019.0765 PMID:31009028
13. Deiner S, Silverstein JH. Postoperative delirium and cognitive dysfunction. Br J Anaesth. 2009 Dec;103(Suppl 1 Suppl 1):i41–6. https://doi.org/10.1093/bja/aep291 PMID:20007989
14. Perez-Belmonte LM, Morales-Ortega A, García-García A. Biomarkers for delirium diagnosis and prediction: a narrative review. J Clin Med. 2021;10(7).
15. Gutierrez R, Egaña JI, Saez I, Reyes F, Briceño C, Venegas M, et al. Intraoperative Low Alpha Power in the Electroencephalogram Is Associated With Postoperative Subsyndromal Delirium. Front Syst Neurosci. 2019 Oct;13(56):56. https://doi.org/10.3389/fnsys.2019.00056 PMID:31680886
16. Papa L, Lewis LM, Falk JL, Zhang Z, Silvestri S, Giordano P, et al. Elevated levels of serum glial fibrillary acidic protein breakdown products in mild and moderate traumatic brain injury are associated with intracranial lesions and neurosurgical intervention. Ann Emerg Med. 2012 Jun;59(6):471–83. https://doi.org/10.1016/j.annemergmed.2011.08.021 PMID:22071014
17. Thomas-Antérion C, Hugonot-Diener L. Comment faire passer le MoCA ? Prat Neurol – FMC. 2014;5(1):57–60. https://doi.org/10.1016/j.praneu.2013.12.005.

 ORCID
ORCID