Pablo Miranda 1 a, Roberto Coloma 1 b, Fernando Rueda 1 c, Marcia Corvetto 1 d
Recibido: 19-11-2019
Aceptado: 19-11-2019
©2020 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 49 Núm. 1 pp. 103-113|https://doi.org/10.25237/revchilanestv49n01.08
PDF|ePub|RIS
Local anesthetics systemic toxicity: update in management
Abstract
Systemic toxicity by local anesthetics an adverse reaction that occurs when local anesthetics (AL) reach significant systemic levels, primarily affects the central and cardiovascular nervous system, and while it is an infrequent event, it can be potentially fatal. The main determinant of the toxicity is the plasma concentration of LA, especially the free fraction. The most serious symptoms are seizures and cardiac arrest, which can occur with the administration of any LA. Bupivacaine is the most cardiotoxic of the commonly used LAs, followed in decreasing order by levobupivacaine, ropivacaine and lidocaine.
Resumen
La intoxicación sistémica por anestésicos locales (ISAL), una reacción adversa que ocurre cuando los anestésicos locales (AL) alcanzan niveles sistémicos significativos, afecta principalmente al sistema nervioso central y cardiovascular, y si bien, es un evento infrecuente, puede ser potencialmente fatal. El principal determinante de la ISAL es la concentración plasmática de AL, en especial la fracción libre. Los síntomas más graves son las convulsiones y paro cardíaco, los cuales pueden ocurrir con la administración de cualquier AL. La bupivacaína es el más cardiotóxico de los AL comúnmente utilizados, seguido en orden decreciente por levobupivacaína, ropivacaína y lidocaína.
-
Introducción
Los AL son fármacos que bloquean de manera reversible la generación y transmisión de impulsos nerviosos, en cualquier parte del sistema nervioso a la que se apliquen. En clínica se utilizan principalmente con la finalidad de suprimir los impulsos nociceptivos.
Estos fármacos son utilizados en la práctica clínica por muchos especialistas, incluidos anestesiólogos, cirujanos, urgenciólogos, dentistas y otros. Debido a la masificación de su uso, es nuestro rol como anestesiólogos tener conciencia y conocimiento del manejo de la complicación más grave que podemos experimentar con su utilización: intoxicación sistémica por anestésicos locales (ISAL)[1].
La ISAL siempre es una complicación potencial, y puede ocurrir con todos los AL y a través de cualquier vía de administración. Cuando ocurre, afecta principalmente al sistema nervioso central y al sistema cardiovascular, con pronóstico variable: desde la recuperación completa, hasta la muerte. El objetivo de esta revisión narrativa es describir qué es la ISAL, su epidemiología, fisiopatología, presentación clínica, factores de riesgo y actualizaciones en su prevención y tratamiento según la última evidencia disponible.
-
Epidemiología
La incidencia reportada de eventos graves por ISAL asociados con la anestesia regional es muy baja. En un estudio de Mörwald y cols[2] publicado en 2017, se revisaron los datos de 238.473 pacientes que recibieron un bloqueo de nervio periférico (BNP) para artroplastia total articular (ATA) – de hombro, cadera o rodilla – entre 2006 y 2014. La incidencia general de ISAL (definida como la aparición de paro cardíaco, convulsiones y/o administración de emulsión lipídica el día de la cirugía) fue de 1,8 por 1.000 pacientes. La incidencia de esta complicación disminuyó con el tiempo (de 8,2 por 1.000 pacientes en 2006 a 2,5 por 1.000 en 2014), mientras que la administración de Terapia con emulsión Lipídica (TEL) aumentó de 0,2 a 2,6 por 1.000 pacientes durante el mismo período de tiempo. En otra revisión de Rubin y cols de 2018[3], 710.327 pacientes que se sometieron a una ATA con BNP entre 1998 y 2013, la incidencia de ISAL fue de 1,04 por cada 1.000 pacientes. La incidencia de ISAL disminuyó en un 10% por año durante el período de estudio. Una revisión de los datos del Registro de Anestesia Regional de Australia y Nueva Zelanda (AURORA) incluyó 25.300 BNP realizados entre 2008 y 2012. La incidencia general de ISAL fue de 0,87 por 1.000 bloqueos. El uso de ultrasonido se asoció con una disminución del riesgo de desarrollar ISAL (OR 0,36)[4].
-
Fisiopatología
Todos los anestésicos locales ejercen su efecto principalmente al bloquear los canales de sodio voltaje-dependientes[5]. Este bloqueo de conducción impide la transmisión del estímulo nociceptivo de las células neuronales a la corteza cerebral. Característicamente las reacciones de toxicidad sistémica son reacciones dosis-dependientes, con manifestaciones clínicas progresivas, observables a medida que ascienden sus niveles plasmáticos (Figura 1)[6]. La toxicidad ocurre cuando los AL afectan los canales de sodio cardíacos[7] o las neuronas talamocorticales en el cerebro[8]. Los AL también tienen otros efectos, como el bloqueo de los canales de potasio y calcio, la interacción con los receptores colinérgicos o N-metil-D-aspartato (NMDA) y la interferencia con los procesos metabólicos celulares tales como la fosforilación oxidativa, utilización de ácidos grasos libres y producción de adenosina monofosfato cíclico. Dichos efectos pueden explicar algunos aspectos de la toxicidad cardiovascular y pueden estar relacionados con el mecanismo de reversión de la ISAL con emulsión lipídica intravenosa.
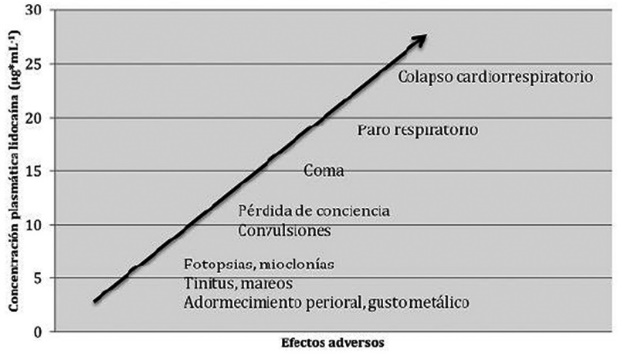
Figura 1. Progresión síntomas ISAL según concentraciones plasmáticas del AL.
La ISAL puede ocurrir después de cualquier vía de administración de AL:
1. Anestesia regional: la mayoría de los casos notificados de ISAL se produjeron después de una inyección intravenosa accidental de AL. Sin embargo, la absorción sistémica desde los sitios de administración de AL también puede causar niveles plasmáticos tóxicos. La infusión continua de AL para la analgesia regional post operatoria puede causar ISAL por migración intravascular del catéter o absorción sistémica, y el inicio de los síntomas puede ocurrir horas o días después de la colocación inicial del catéter.
2. Aplicación tópica: ISAL también puede ocurrir después de la administración tópica de AL, especialmente cuando el medicamento se aplica a las membranas mucosas en dosis repetidas o altas. La lidocaína utilizada para la anestesia orofaríngea tópica se absorbe a través de las membranas mucosas y del tracto gastrointestinal cuando se ingiere. Existen múltiples reportes de casos de convulsiones y paro cardíaco con altas dosis de lidocaína oral, en adultos[9] y niños[10].
-
Presentación clínica
La presentación clínica de ISAL es muy variable, y se debe tener una alta sospecha cuando ocurran cambios fisiológicos posterior a la administración de AL. La ISAL progresa a través de la excitación del sistema nervioso central (SNC), la inhibición del SNC, la excitación cardiovascular y, en casos extremos, la inhibición y el paro cardiovascular. Sin embargo, en una revisión de Di Gregorio y cols de 2010[11], de 93 eventos informados de ISAL entre 1979 y 2009, solo el 60% siguió esta presentación clínica. Otra publicación de Vasques y cols en 2015[12] reportó 67 casos de ISAL entre 2010 y 2014, en los cuales los síntomas y signos tuvieron un inicio más de 10 minutos después de la inyección de AL en un 42% de los casos y más de 30 minutos después de la inyección en un 22%. Gitman y cols en 2018[13] reportaron 47 casos de ISAL ocurridos entre 2014 y 2016, ocurriendo el inicio de los síntomas después de 10 minutos de inyección de AL en el 43% de los casos, y después de 60 minutos en el 23%. La presentación clínica y la velocidad de progresión de los síntomas depende de la vía de absorción sistémica, el nivel plasmático de AL, la rapidez con que aumenta la concentración plasmática y las características específicas de cada AL.
Efectos en el sistema nervioso central : el sistema nervioso central es más susceptible de ISAL en comparación al sistema cardiovascular y los síntomas neurológicos se manifiestan con menores niveles plasmáticos de AL. En el cerebro inicialmente se bloquean las vías inhibitorias corticales y, por lo tanto, pueden causar signos y síntomas excitatorios, como adormecimiento perioral, gusto metálico, cambios en el estado mental o ansiedad, cambios visuales, contracciones musculares y, en última instancia, convulsiones. El aumento progresivo de los niveles plasmáticos provoca una depresión generalizada del SNC, que puede provocar somnolencia, coma y depresión respiratoria.
Efectos cardiovasculares : los síntomas y signos cardiovasculares generalmente ocurren después o junto con los síntomas del SNC durante ISAL, aunque pueden ocurrir por sí solos. La activación simpática inicial puede causar taquicardia e hipertensión. Sin embargo, la bradicardia y la hipotensión a menudo se han descrito como los primeros cambios en los signos vitales. La toxicidad CV puede progresar a arritmias ventriculares y/o asistolia.
-
Factores de riesgo
La presentación de una ISAL es multifactorial, incluyendo factores de riesgo relacionados con el paciente, la droga y sitio de administración[14].
1) Factores de riesgo del paciente : la fracción libre de AL puede aumentar por bajos niveles de alfa 1 glicoproteína ácida (AGA), ya que los AL se unen de forma importante a esta proteína.
• Edades extremas: los lactantes menores de 4 meses tienen niveles bajos de AGA, lo que aumenta la fracción plasmática libre de AL y pueden tener un mayor riesgo de ISAL[14]. También tienen inmadurez de los sistemas de metabolismo y excreción, por lo cual en los lactantes menores de 4 meses y prematuros se recomienda disminuir la dosis de AL en un 15% con respecto a las dosis estándar publicadas para otras edades[16]. En pacientes adultos mayores, el clearance de AL puede verse reducido debido al deterioro de la función renal y perfusión hepática[17]. Por esta razón, se recomienda disminuir las dosis de AL entre un 10-20% sobre los 70 años[18],[19].
• Enfermedad cardíaca: la insuficiencia cardíaca muy avanzada que afecte la perfusión hepática y renal puede reducir el clearance de AL y aumentar el riesgo de ISAL con la administración repetida o continua[20].
• Insuficiencia renal: la circulación hiperdinámica de los pacientes urémicos provoca un aumento rápido de los niveles plasmáticos de AL después de un bloqueo nervioso donde se utilizan grandes volúmenes de AL, pero sus altos niveles de AGA reducen el nivel de fármaco libre[21]. La disfunción renal no aumenta el riesgo de toxicidad, a menos que se produzca acidosis metabólica.
• Enfermedad hepática: la disfunción hepática en sí no aumenta el riesgo de toxicidad con bloqueos nerviosos de inyección única, a menos que la enfermedad hepática esté en etapa terminal o esté asociada con otras comorbilidades. El clearance reducido de AL se compensa con un mayor volumen de distribución para la inyección inicial y la síntesis de AGA generalmente se conserva a pesar de la enfermedad grave[22].
• Embarazo: las pacientes embarazadas, especialmente de término, tienen un mayor riesgo de ISAL, ya que los cambios hormonales pueden aumentar la sensibilidad del tejido neural y cardiotoxicidad a los bloqueos[23],[24]. Además, los niveles reducidos de AGA y albúmina pueden aumentar la fracción libre de algunos AL en pacientes embarazadas[25].
2) Factores de riesgo de la droga : todos los AL pueden causar ISAL en niveles plasmáticos tóxicos. Los anestésicos locales más potentes, como la bupivacaína, son más cardiotóxicos. La ropivacaína y la levobupivacaína, que se preparan en forma de isómero S casi puro, son ligeramente menos cardiotóxicos[26] y producen menos síntomas del SNC[27] que la bupivacaína.
3) Factores de riesgo del sitio de bloqueo : la inyección de AL en sitios altamente vascularizados puede aumentar el riesgo de inyección intravascular directa y la absorción sistémica de AL. Los procedimientos de anestesia regional que se dirigen a sitios particularmente vascularizados incluyen – en orden de disminución del riesgo – bloqueos intercostales, anestesia caudal y epidural, bloqueos del plano interfascial del abdomen, bloqueos del compartimento del psoas, bloqueos ciáticos y bloqueos del plexo cervical y braquial.28 Los bloqueos que requieren grandes volúmenes y dosis de AL pueden aumentar el riesgo de absorción sistémica, como el bloqueo de transverso abdominal (TAP Block)[29].
En la Tabla 1 se encuentran los factores de riesgo de ISAL, propuestos por la Sociedad Americana de Anestesia Regional y Medicina del Dolor (ASRA) en 2017[30].
| Tabla 1. Factores de riesgo de ISAL, propuestos por la ASRA |
|
Factores de riesgo para ISAL |
|
1) Características del paciente |
|
• Edades extremas: menores de 16 años y mayores de 60 años |
|
• Masa muscular baja, particularmente con neonatos, niños y ancianos debilitados |
|
• Mujeres > hombres |
|
• Enfermedad cardíaca, especialmente arritmias, anomalías de conducción, isquemia e insuficiencia cardíaca congestiva |
|
• Enfermedad hepática |
|
• Enfermedad metabólica, especialmente diabetes mellitus, acidemia isovalérica, enfermedad mitocondrial y deficiencia de carnitina |
|
• Enfermedades del SNC |
|
• Baja unión a proteínas plasmáticas: enfermedad hepática, desnutrición, lactantes, embarazo |
|
2) Características de los AL |
|
• La bupivacaína tiene un margen de seguridad más bajo y la reanimación es más difícil en el caso de ISAL, pero los anestésicos locales como la ropivacaína y la lidocaína también representan una proporción significativa de eventos de ISAL |
|
• El sitio de bloqueo, la dosis total de anestésico local, la dosis de prueba y las comorbilidades del paciente predicen más los niveles plasmáticos altos de anestésico local que el peso corporal o el índice de masa corporal |
|
• Las infusiones anestésicas locales son particularmente problemáticas después de 1 a 4 días y en pacientes de masa corporal pequeña |
|
• La convulsión es hasta 5 veces más probable después de BNP que el bloqueo epidural |
|
3) Entorno de práctica |
|
• Hasta el 20% de los casos de ISAL ocurren fuera del entorno hospitalario |
|
• No anestesiólogos están involucrados en hasta un 50% de los casos de ISAL |
-
Prevención de ISAL
Se utilizan varias técnicas para reducir el riesgo de ISAL, incluidas la utilización de la dosis efectiva más baja, las técnicas de inyección seguras, el uso de ultrasonido y evitar la sedación profunda.
Dosis de anestesia local : la dosis total de AL administrada debe ser la dosis más baja requerida para la extensión y duración deseadas del bloqueo. Las dosis máximas permitidas que aparecen en varias publicaciones son pautas aproximadas que no están basadas en evidencia y no tienen en cuenta el sitio o la técnica de administración de AL o los factores del paciente que aumentan el riesgo de toxicidad. No obstante, las dosis máximas recomendadas publicadas se pueden usar como punto de partida para tomar decisiones, considerando que el riesgo de presentar ISAL es multifactorial, siendo la dosis de AL como uno de los múltiples factores considerar (Tabla 2).[18],[19].
| Tabla 2. Máxima dosis de AL recomendada en diversos países | |||
| Máxima dosis de AL recomendada en diversos países | |||
|
EE. UU. |
Finlandia |
Alemania |
|
|
Lidocaína / con Epinefrina |
300 mg / 500 mg |
200 mg / 500 mg |
200 mg/ 500 mg |
|
Bupivacaína / con Epinefrina |
175 mg / 225 mg |
175 mg / 400 mg |
150 mg / 150 mg |
|
Levobupivacaína / con Epinefrina |
150 mg |
150 mg |
150 mg |
|
Ropivacaína / con Epinefrina |
225 mg / 225 mg |
225 mg / 225 mg |
No mencionan |
Técnicas de inyección segura[30]:
• No existe una medida única que pueda prevenir ISAL en la práctica clínica.
• El uso de ultrasonido reduce significativamente el riesgo de ISAL en humanos sometidos a BNP.
• Use la dosis efectiva más baja de anestésico local.
• Use una dosis de inyección incremental de AL: administre de a 3 a 5 ml, haciendo una pausa de 15 a 30 segundos entre cada inyección.
• Aspire la aguja o el catéter antes de cada inyección, reconociendo que hay una tasa de falsos negativos cercana al 2% para este método diagnóstico.
• La inyección intravascular de epinefrina 10-15 µg/ml como marcador en adultos produce un aumento de la frecuencia cardíaca ≥ 10 latidos por minuto o de la presión arterial sistólica ≥ 15 mm Hg. La adición de epinefrina a las soluciones de AL puede disminuir la absorción sistémica de estos en un 20 a 50% y reducir los niveles plasmáticos máximos, dependiendo del sitio de inyección.
• Incluya los parámetros de dosificación de AL y las consideraciones en los pacientes de riesgo, como parte de la pausa de seguridad quirúrgica.
Evitar la sedación intensa o la anestesia general : se sugiere, en adultos, evitar la sedación profunda durante la realización de técnicas de anestesia regional, y realizarlas bajo anestesia general solo cuando es absolutamente necesario. La retroalimentación del paciente puede ayudar a detectar – entre otras cosas – signos tempranos de ISAL. La anestesia regional se realiza rutinariamente bajo anestesia general para pacientes pediátricos, y el riesgo de ISAL parece ser muy bajo cuando se utilizan técnicas de inyección seguras. En una revisión de más de 100.000 bloqueos regionales reportados por la Red de Anestesia Regional Pediátrica (PRAN) en 2018[31], la incidencia de ISAL fue de 0,75 por cada 10.000 pacientes y no se encontraron mayores complicaciones al realizar los bloqueos bajo anestesia general, al compararlos con pacientes despiertos.
Uso de ultrasonido: el ultrasonido puede disminuir el riesgo de ISAL por varios mecanismos:
• Reduce la punción vascular por visualización directa[32].
• Visualización del depósito del AL como confirmación de inyección extravascular[33].
• Reducción de la dosis total de AL, en comparación con las técnicas basadas en reparos anatómicos o en la neuroestimulación.
Una revisión de más de 25.000 bloqueos en una base de datos de registro multicéntrico (AURORA)[4] encontró que el ultrasonido redujo la incidencia de ISAL. Sin embargo, el número total de eventos de ISAL fue pequeño. Por lo tanto, no se pueden sacar conclusiones definitivas sobre una reducción de ISAL con el uso de ultrasonido. Además, se debe considerar que la ecografía es un método operador dependiente, por lo que se debe tener un adecuado entrenamiento para lograr tener los beneficios antes descritos.
-
Tratamiento
Nuestro enfoque para el manejo de ISAL es consistente con las pautas y listas de verificación publicadas por la Sociedad Americana de Anestesia Regional y Manejo del Dolor (ASRA)[30]. Si aparecen síntomas y signos y síntomas de ISAL, se deben seguir los siguientes pasos:
1) Suspender la administración de AL.
2) Pedir ayuda. Solicitar kit de toxicidad de lípidos y guías de ayuda de memoria. Solicitar apoyo posible de equipo bypass cardiopulmonar.
3) Manejo rápido y efectivo de la vía aérea: es crucial para prevenir la hipoxia, la hipercapnia y la acidosis, elementos que perpetúan la ISAL.
4) Terapia de emulsión lipídica (Tabla 3):[30]:
• Administrar a los primeros signos de ISAL, en simultáneo con el manejo de la vía aérea.
• La prontitud de la emulsión lipídica es más importante que la modalidad de administración (bolo versus infusión).
• BOLO de emulsión lipídica al 20%.
– 100 ml durante 2-3 minutos si el paciente pesa más de 70 kg.
– 1,5 ml / kg durante 2-3 minutos si el paciente pesa menos de 70 kg.
• INFUSIÓN de emulsión lipídica al 20%.
– 200-250 ml durante 15-20 min si el paciente pesa más de 70 kg.
– 0,25 ml/kg/min si el paciente pesa menos de 70 kg (peso corporal ideal).
• Si no se logra la estabilidad hemodinámica, considere nuevos bolos o aumentar la infusión a 0,5 ml/kg/min.
• Continúe la infusión durante al menos 10 minutos después de alcanzar la estabilidad hemodinámica.
• Se recomienda aproximadamente 12 ml/kg de emulsión lipídica como límite superior para la dosificación inicial.
• El propofol NO es un sustituto de la emulsión lipídica.
| Tabla 3. Adaptada de figura manejo de ISAL con emulsión lipídica según Guía ASRA | |
| Emulsión lipídica 20% | |
|
Más de 70 Kg |
Menos de 70 Kg |
|
– Bolo de 100 ml de emulsión lipídica 20% rápido en 2-3 minutos – Infusión emulsión lipídica 20% 200-250 ml en 15-20 minutos |
– Bolo de 1,5 ml/Kg emulsión lipídica 20% rápido en 2-3 minutos – Infusión emulsión lipídica 20% 0,25 ml/Kg/min (peso ideal) |
|
Si paciente persiste inestable: |
|
|
– Dar un nuevo bolo por 1 o 2 veces a la misma dosis y duplicar la tasa de infusión, dosis máxima 12 ml/Kg. |
|
|
– Volumen total emulsión lipídica 20% cercano a 1L en una resucitación prolongada (más de 30 minutos) |
|
5) Control de convulsiones:
• Si se producen convulsiones, deben tratarse con benzodiacepinas. Si las benzodiacepinas no están disponibles, emulsión lipídica o pequeña dosis de propofol son aceptables.
• Aunque el propofol puede detener las convulsiones, grandes dosis deprimen aún más la función cardíaca. Se debe evitar el propofol cuando haya signos de compromiso cardiovascular.
• Si las convulsiones persisten a pesar de las benzodiacepinas, se deben considerar pequeñas dosis de succinilcolina o un bloqueador neuromuscular similar para minimizar la acidosis y la hipoxemia.
6) Si se produce un paro cardíaco:
• Si se usa epinefrina, se prefieren pequeñas dosis iniciales (≤ 1 µg/kg).
• No se recomienda la vasopresina.
• Evite los bloqueadores de los canales de calcio y los bloqueadores de los receptores b-adrenérgicos.
• Si se desarrollan arritmias ventriculares, se prefiere la amiodarona. El tratamiento con AL (lidocaína o procainamida) no es recomendado.
7) La falta de respuesta a la emulsión de lípidos y la terapia con vasopresores debe impulsar la instalación de Bypass Cardio Pulmonar (BCP).
8) Los pacientes con un evento cardiovascular significativo deben controlarse durante al menos 4-6 h. Si el evento se limita a los síntomas del SNC que se resuelven rápidamente, deben controlarse durante al menos 2 h.
9) Utilice listas de verificación escritas o electrónicas como ayudas cognitivas durante el manejo de ISAL.
-
Terapia de emulsión lipídica
La terapia de emulsión lipídica (TEL) se recomienda ampliamente para el tratamiento de la ISAL, aunque la preparación óptima de los lípidos, la dosis de administración y el mecanismo de acción de estos no están del todo claros.
Eficacia: numerosos reportes de casos describen una reanimación exitosa de un paro cardíaco relacionado con ISAL por TEL, después de que los pacientes no respondieron al soporte vital cardíaco avanzado estándar (ACLS). Una revisión sistemática de estudios en humanos y animales[34] que involucran TEL para ISAL concluyó que la evidencia publicada era limitada y que TEL puede ser efectiva para la reversión de secuelas cardíacas o neurológicas en algunos casos de ISAL. No hubo evidencia consistente para apoyar la terapia con TEL por sobre los vasopresores, o para determinar si un tratamiento debe preceder al otro. Sin embargo, esta revisión sistemática en sí misma estuvo severamente limitada por la falta de ensayos aleatorizados controlados en humanos, una gran dependencia de los estudios en animales y la heterogeneidad en el diseño del estudio, el modelo animal utilizado y los resultados informados.
Mecanismo de acción: la terapia de emulsión de lípidos por vía intravenosa proporciona un beneficio de reanimación multimodal que incluye componentes “eliminadores” o scavenging (como el transporte de lípidos) como “no eliminadores” o no scavenging. El compartimento lipídico intravascular elimina el fármaco de los órganos susceptibles de toxicidad y acelera la redistribución a los órganos donde el fármaco se almacena, desintoxica y luego se excreta. Además, los lípidos ejercen efectos no eliminadores que incluyen el posacondicionamiento (a través de la activación de las quinasas de supervivencia) junto con beneficios cardiotónicos y vasoconstrictores. Estos efectos protegen el tejido del daño isquémico y aumentan la perfusión del tejido durante la recuperación de la toxicidad. Otros mecanismos no cuentan con evidencia: efectos directos sobre las corrientes de los canales (calcio) y el efecto de masa que domina un bloqueo en el metabolismo mitocondrial[35].
Formulaciones disponibles: la formulación más comúnmente utilizada ha sido emulsión lipídica al 20% (por ejemplo, Intralipid, Liposyn III 20% o Nutrilipid), que está ampliamente disponible en los formularios hospitalarios para el soporte nutricional. Algunas formulaciones también están disponibles en concentraciones de 10% y 30%, y los estudios en animales sugieren que al menos algunos aspectos del rescate de lípidos pueden depender de la dosis[36]. Se requieren más estudios antes de recomendar concentraciones de emulsión lipídica que no sean del 20% para el tratamiento de ISAL.
Los fabricantes afirman que la emulsión lipídica debe administrarse solo por infusión intravenosa, pero se informó la administración intraósea en un caso en el que se perdió el acceso intravenoso[37].
-
Entrenamiento con simulación
La educación médica basada en simulación se ha utilizado ampliamente para el entrenamiento de habilidades y de trabajo en equipo[38].
En relación al uso de simulación en la enseñanza de anestesiología esta se implementó hace más de 40 años[39]. Adaptándose de la formación de los pilotos de líneas aéreas en relación a situaciones que podrían poner en peligro la seguridad de los pasajeros[40]. Utilizándose tanto para la adquisición de conocimiento, el entrenamiento de habilidades motoras41 y manejo de situaciones de crisis[42]. En el último tiempo se ha incorporado como una herramienta de evaluación y certificación[43].
Actualmente, hay evidencia que el entrenamiento en eventos críticos realizado con más de 600 anestesiólogos determinó que este tipo de metodología debería ser promovida, ya que contribuye a un manejo más eficiente de las emergencias en anestesia y mejora la seguridad de los pacientes[44]. En nuestro país, existen residencias de Anestesiología que tienen incorporado el entrenamiento de situaciones críticas en su currículum, hace algunos años[45].
Específicamente el entrenamiento en simulación para manejo de ISAL, ha sido descrito en la literatura. Neal evaluó la performance de residentes de anestesia para manejar un caso simulado de ISAL. Los residentes fueron randomizados para manejar el caso, 12 de ellos con el checklist de la ASRA y 13 sin el checklist. Los residentes del grupo checklist tuvo mejor manejo médico de la crisis y mejores habilidades no técnicas[46].
Más recientemente, Mc Evoy demostró en un estudio prospectivo, randomizado y ciego, que un lector designado con una herramienta electrónica de soporte de toma decisiones, mejoró el cumplimiento de las pautas en el manejo de una simulación in situ de ISAL[47].
-
Conclusiones
• La intoxicación sistémica por anestésicos locales (ISAL) afecta principalmente al sistema nervioso central y al sistema cardiovascular, y puede ser fatal. Los síntomas más graves (convulsiones y / o paro cardíaco) son poco frecuentes y pueden ocurrir con la administración de cualquier anestésico local (AL), por cualquier vía.
• Todos los AL tienen el potencial de causar ISAL. La toxicidad cardíaca y la relación entre la toxicidad cardiovascular y la toxicidad del sistema nervioso central (SNC) varían entre los AL. La bupivacaína es el más cardiotóxico de los AL comúnmente utilizados, seguido en orden decreciente de cardiotoxicidad por levobupivacaína, ropivacaína y lidocaína.
• La presentación clínica de ISAL es muy variable, pero a menudo incluye síntomas y signos iniciales de excitación del SNC (adormecimiento perioral, gusto metálico, cambios en el estado mental o ansiedad, cambios visuales, espasmos musculares y convulsiones), seguidos de síntomas inhibitorios del SNC (somnolencia, coma y depresión respiratoria). Los síntomas y signos cardiovasculares pueden aparecer junto con o después de los síntomas del SNC, y pueden incluir hipertensión o hipotensión, taquicardia o bradicardia, seguidas de arritmias ventriculares y/o asistolia.
• Los factores del paciente que aumentan el riesgo de ISAL incluyen edades extremas, enfermedad renal, hepática o cardíaca, embarazo y trastornos metabólicos.
• El riesgo de ISAL puede aumentar para sitios de bloqueo altamente vascularizados y aquellos que requieren grandes volúmenes de AL.
• Las medidas preventivas que pueden reducir el riesgo de ISAL durante la anestesia regional incluyen limitar la dosis de AL a la mínima dosis efectiva, usar una inyección incremental lenta y aspiración antes de la inyección, el uso de una dosis de prueba intravascular, evitar la sedación intensa o la anestesia general durante la ejecución de bloqueos, y utilización de ultrasonido.
• ISAL debe reconocerse y tratarse rápidamente, con prioridades que incluyan evitar la hipoxia y la acidosis.
• Recomendamos la administración de TEL intravenosa para pacientes con ISAL que presenten convulsiones o signos de toxicidad cardiovascular (es decir, arritmias, hipotensión grave o paro cardíaco) y siguiendo el algoritmo de Soporte Cardiaco Vital Avanzado (ACLS).
• Los datos que respaldan la eficacia de la TEL se limitan a informes de casos, estudios en animales y de laboratorio. Además, el mecanismo de acción de la emulsión lipídica para la reversión de ISAL aún no se ha dilucidado completamente, y la dosis y formulación óptimas aún no se han determinado. Sin embargo, se recomienda su uso porque ISAL puede ser fatal y los efectos adversos significativos de TEL parecen ser raros.
Referencias
1. Sagir A, Goyal R. An assessment of the awareness of local anesthetic systemic toxicity among multi-specialty postgraduate residents. J Anesth. 2015 Apr;29(2):299–302. https://doi.org/10.1007/s00540-014-1904-9 PMID:25138822
2. Mörwald EE, Zubizarreta N, Cozowicz C, Poeran J, Memtsoudis SG. Incidence of Local Anesthetic Systemic Toxicity in Orthopedic Patients Receiving Peripheral Nerve Blocks. Reg Anesth Pain Med. 2017 Jul/Aug;42(4):442–5. https://doi.org/10.1097/AAP.0000000000000544 PMID:28079735
3. Rubin DS, Matsumoto MM, Weinberg G, Roth S. Local Anesthetic Systemic Toxicity in Total Joint Arthroplasty: Incidence and Risk Factors in the United States From the National Inpatient Sample 1998-2013. Reg Anesth Pain Med. 2018 Feb;43(2):131–7. PMID:29280923
4. Barrington MJ, Kluger R. Ultrasound guidance reduces the risk of local anesthetic systemic toxicity following peripheral nerve blockade. Reg Anesth Pain Med. 2013 Jul-Aug;38(4):289–99. https://doi.org/10.1097/AAP.0b013e318292669b PMID:23788067
5. Catterall WA. Voltage-gated sodium channels at 60: structure, function and pathophysiology. J Physiol. 2012 Jun;590(11):2577–89. https://doi.org/10.1113/jphysiol.2011.224204 PMID:22473783
6. Nazar C, Zamora M, Vega E. Cirugía plástica y sus complicaciones: ¿En qué debemos fijarnos? Rev Chil Cir. 2014;66(6):603. https://doi.org/10.4067/S0718-40262014000600016.
7. El-Boghdadly K, Chin KJ. Local anesthetic systemic toxicity: Continuing Professional Development. Can J Anaesth. 2016 Mar;63(3):330–49. https://doi.org/10.1007/s12630-015-0564-z PMID:26830640
8. Meuth SG, Budde T, Kanyshkova T, Broicher T, Munsch T, Pape HC. Contribution of TWIK-related acid-sensitive K+ channel 1 (TASK1) and TASK3 channels to the control of activity modes in thalamocortical neurons. J Neurosci. 2003 Jul;23(16):6460–9. https://doi.org/10.1523/JNEUROSCI.23-16-06460.2003 PMID:12878686
9. Hess GP, Walson PD. Seizures secondary to oral viscous lidocaine. Ann Emerg Med. 1988 Jul;17(7):725–7. https://doi.org/10.1016/S0196-0644(88)80623-1 PMID:3382075
10. Dayan PS, Litovitz TL, Crouch BI, Scalzo AJ, Klein BL. Fatal accidental dibucaine poisoning in children. Ann Emerg Med. 1996 Oct;28(4):442–5. https://doi.org/10.1016/S0196-0644(96)70013-6 PMID:8839533
11. Di Gregorio G, Neal JM, Rosenquist RW, Weinberg GL. Clinical presentation of local anesthetic systemic toxicity: a review of published cases, 1979 to 2009. Reg Anesth Pain Med. 2010 Mar-Apr;35(2):181–7. https://doi.org/10.1097/AAP.0b013e3181d2310b PMID:20301824
12. Vasques F, Behr AU, Weinberg G, Ori C, Di Gregorio G. A Review of Local Anesthetic Systemic Toxicity Cases Since Publication of the American Society of Regional Anesthesia Recommendations: To Whom It May Concern. Reg Anesth Pain Med. 2015 Nov-Dec;40(6):698–705. https://doi.org/10.1097/AAP.0000000000000320 PMID:26469367
13. Gitman M, Barrington MJ. Local Anesthetic Systemic Toxicity: A Review of Recent Case Reports and Registries. Reg Anesth Pain Med. 2018 Feb;43(2):124–30. https://doi.org/10.1097/AAP.0000000000000721 PMID:29303925
14. Scott DB, Jebson PJ, Braid DP, Ortengren B, Frisch P. Factors affecting plasma levels of lignocaine and prilocaine. Br J Anaesth. 1972 Oct;44(10):1040–9. https://doi.org/10.1093/bja/44.10.1040 PMID:4639822
15. Anell-Olofsson M, Ahmadi S, Lönnqvist PA, Eksborg S, von Horn H, Bartocci M. Plasma concentrations of alpha-1-acid glycoprotein in preterm and term newborns: influence of mode of delivery and implications for plasma protein binding of local anaesthetics. Br J Anaesth. 2018 Aug;121(2):427–31. https://doi.org/10.1016/j.bja.2018.01.034 PMID:30032881
16. Larsson BA, Lönnqvist PA, Olsson GL. Plasma concentrations of bupivacaine in neonates after continuous epidural infusion. Anesth Analg. 1997 Mar;84(3):501–5. PMID:9052290
17. Veering BT, Burm AG, van Kleef JW, Hennis PJ, Spierdijk J. Epidural anesthesia with bupivacaine: effects of age on neural blockade and pharmacokinetics. Anesth Analg. 1987 Jul;66(7):589–93. https://doi.org/10.1213/00000539-198707000-00001 PMID:3605667
18. Rosenberg PH, Veering BT, Urmey WF. Maximum recommended doses of local anesthetics: a multifactorial concept. Reg Anesth Pain Med. 2004 Nov-Dec;29(6):564–75. https://doi.org/10.1097/00115550-200411000-00010 PMID:15635516
19. Altermatt F. Dosis máximas de anestésicos locales. Rev Chil Anestesia. 2007;36:71–769.
20. Thomson PD, Melmon KL, Richardson JA, Cohn K, Steinbrunn W, Cudihee R, et al. Lidocaine pharmacokinetics in advanced heart failure, liver disease, and renal failure in humans. Ann Intern Med. 1973 Apr;78(4):499–508. https://doi.org/10.7326/0003-4819-78-4-499 PMID:4694036
21. Pere P, Salonen M, Jokinen M, Rosenberg PH, Neuvonen PJ, Haasio J. Pharmacokinetics of ropivacaine in uremic and nonuremic patients after axillary brachial plexus block. Anesth Analg. 2003 Feb;96(2):563–9. PMID:12538213
22. Oni G, Brown S, Burrus C, Grant L, Watkins J, Kenkel M, et al. Effect of 4% topical lidocaine applied to the face on the serum levels of lidocaine and its metabolite, monoethylglycinexylidide. Aesthet Surg J. 2010 Nov-Dec;30(6):853–8. https://doi.org/10.1177/1090820X10386944 PMID:21131461
23. Butterworth JF 4th, Walker FO, Lysak SZ. Pregnancy increases median nerve susceptibility to lidocaine. Anesthesiology. 1990 Jun;72(6):962–5. https://doi.org/10.1097/00000542-199006000-00002 PMID:2350034
24. Moller RA, Datta S, Fox J, Johnson M, Covino BG. Effects of progesterone on the cardiac electrophysiologic action of bupivacaine and lidocaine. Anesthesiology. 1992 Apr;76(4):604–8. https://doi.org/10.1097/00000542-199204000-00018 PMID:1550285
25. Tsen LC, Tarshis J, Denson DD, Osathanondh R, Datta S, Bader AM. Measurements of maternal protein binding of bupivacaine throughout pregnancy. Anesth Analg. 1999 Oct;89(4):965–8. PMID:10512273
26. Bardsley H, Gristwood R, Baker H, Watson N, Nimmo W. A comparison of the cardiovascular effects of levobupivacaine and rac-bupivacaine following intravenous administration to healthy volunteers. Br J Clin Pharmacol. 1998 Sep;46(3):245–9. https://doi.org/10.1046/j.1365-2125.1998.00775.x PMID:9764965
27. Knudsen K, Beckman Suurküla M, Blomberg S, Sjövall J, Edvardsson N. Central nervous and cardiovascular effects of i.v. infusions of ropivacaine, bupivacaine and placebo in volunteers. Br J Anaesth. 1997 May;78(5):507–14. https://doi.org/10.1093/bja/78.5.507 PMID:9175963
28. Tucker GT, Mather LE. Clinical pharmacokinetics of local anaesthetics. Clin Pharmacokinet. 1979 Jul-Aug;4(4):241–78. https://doi.org/10.2165/00003088-197904040-00001 PMID:385208
29. Rahiri J, Tuhoe J, Svirskis D, Lightfoot NJ, Lirk PB, Hill AG. Systematic review of the systemic concentrations of local anaesthetic after transversus abdominis plane block and rectus sheath block. Br J Anaesth. 2017 Apr;118(4):517–26. https://doi.org/10.1093/bja/aex005 PMID:28403398
30. Neal JM, Barrington MJ, Fettiplace MR, Gitman M, Memtsoudis SG, Mörwald EE, et al. The Third American Society of Regional Anesthesia and Pain Medicine Practice Advisory on Local Anesthetic Systemic Toxicity: executive Summary 2017. Reg Anesth Pain Med. 2018 Feb;43(2):113–23. https://doi.org/10.1097/AAP.0000000000000720 PMID:29356773
31. Walker BJ, Long JB, Sathyamoorthy M, Birstler J, Wolf C, Bosenberg AT, et al.; Pediatric Regional Anesthesia Network Investigators. Complications in Pediatric Regional Anesthesia: An Analysis of More than 100,000 Blocks from the Pediatric Regional Anesthesia Network. Anesthesiology. 2018 Oct;129(4):721–32. https://doi.org/10.1097/ALN.0000000000002372 PMID:30074928
32. Neal JM. Ultrasound-guided regional anesthesia and patient safety: an evidence-based analysis. Reg Anesth Pain Med. 2010 Mar-Apr;35(2 Suppl):S59–67. https://doi.org/10.1097/AAP.0b013e3181ccbc96 PMID:20216027
33. Eren G, Altun E, Pektas Y, Polat Y, Cetingok H, Demir G, et al. To what extent can local anesthetics be reduced for infraclavicular block with ultrasound guidance? Anaesthesist. 2014 Oct;63(10):760–5. https://doi.org/10.1007/s00101-014-2361-4 PMID:25098777
34. Hoegberg LC, Bania TC, Lavergne V, Bailey B, Turgeon AF, Thomas SH, et al.; Lipid Emulsion Workgroup. Systematic review of the effect of intravenous lipid emulsion therapy for local anesthetic toxicity. Clin Toxicol (Phila). 2016 Mar;54(3):167–93. https://doi.org/10.3109/15563650.2015.1121270 PMID:26853119
35. Fettiplace MR, Weinberg G. The Mechanisms Underlying Lipid Resuscitation Therapy. Reg Anesth Pain Med. 2018 Feb;43(2):138–49. https://doi.org/10.1097/AAP.0000000000000719 PMID:29356774
36. Fettiplace MR, Ripper R, Lis K, Lin B, Lang J, Zider B, et al. Rapid cardiotonic effects of lipid emulsion infusion. Crit Care Med. 2013 Aug;41(8):e156–62. https://doi.org/10.1097/CCM.0b013e318287f874 PMID:23531591
37. Sampson CS, Bedy SM. Lipid emulsion therapy given intraosseously in massive verapamil overdose. Am J Emerg Med. 2015 Dec;33(12):1844.e1. https://doi.org/10.1016/j.ajem.2015.04.061 PMID:26003744
38. McGaghie WC, Issenberg SB, Petrusa ER, Scalese RJ. A critical review of simulation-based medical education research: 2003-2009. Med Educ. 2010 Jan;44(1):50–63. https://doi.org/10.1111/j.1365-2923.2009.03547.x PMID:20078756
39. Issenberg SB, McGaghie WC, Hart IR, Mayer JW, Felner JM, Petrusa ER, et al. Simulation technology for health care professional skills training and assessment. JAMA. 1999 Sep;282(9):861–6. https://doi.org/10.1001/jama.282.9.861 PMID:10478693
40. Flin R, Patey R. Non-technical skills for anaesthetists: developing and applying ANTS. Best Pract Res Clin Anaesthesiol. 2011 Jun;25(2):215–27. https://doi.org/10.1016/j.bpa.2011.02.005 PMID:21550546
41. Good ML. Patient simulation for training basic and advanced clinical skills. Med Educ. 2003 Nov;37(s1 Suppl 1):14–21. https://doi.org/10.1046/j.1365-2923.37.s1.6.x PMID:14641634
42. Gaba DM, Howard SK, Fish KJ, et al. Simulation-based training in anesthesia crisis resource management (ACRM): a decade of experience. Simulation \& Gaming. 2001; 32(2):175–93.
43. Berkenstadt H, Ziv A, Gafni N, Sidi A. The validation process of incorporating simulation-based accreditation into the anesthesiology Israeli national board exams. Isr Med Assoc J. 2006 Oct;8(10):728–33. PMID:17125130
44. Welke TM, LeBlanc VR, Savoldelli GL, et al. Personalized oral debriefing versus standardized multimedia instruction after patient crisis simulation. Anesthesia \& Analgesia. 2009;109(1):183–9. https://doi.org/10.1213/ane.0b013e3181a324ab.
45. Corvetto MA, Bravo MP, Montaña RA, Altermatt FR, Delfino AE. [Bringing clinical simulation into an Anesthesia residency training program in a university hospital. Participants’ acceptability assessment]. Rev Esp Anestesiol Reanim. 2013 Jun-Jul;60(6):320–6. https://doi.org/10.1016/j.redar.2013.02.007 PMID:23582586
46. Neal JM, Hsiung RL, Mulroy MF, Halpern BB, Dragnich AD, Slee AE. ASRA checklist improves trainee performance during a simulated episode of local anesthetic systemic toxicity. Reg Anesth Pain Med. 2012 Jan-Feb;37(1):8–15. https://doi.org/10.1097/AAP.0b013e31823d825a PMID:22157743
47. McEvoy MD, Hand WR, Stoll WD, Furse CM, Nietert PJ. Adherence to guidelines for the management of local anesthetic systemic toxicity is improved by an electronic decision support tool and designated “Reader”. Reg Anesth Pain Med. 2014 Jul-Aug;39(4):299–305. https://doi.org/10.1097/AAP.0000000000000097 PMID:24956454

 ORCID
ORCID