Julián Aliste M. 1 y Fernanda Baeza G. 2
Rev Chil Anest Vol. 40 Núm. 3 pp. 263-271|doi:
PDF|ePub|RIS
Introducción
Clásicamente se ha descrito al bloqueo epidural torácico como el gold standard de la analgesia en cirugía torácica y abdominal para dolor moderado a severo. Sabemos que el dolor a nivel torácico en general tiene un difícil manejo por su relación con la respiración o la tos, situaciones muchas veces inevitables en estos pacientes y donde el reposo y la inmovilización no son alternativas. Por otro lado, a pesar de lo importante que es otorgar una adecuada analgesia, en algunos pacientes está contraindicado o es cuestionable el uso del bloqueo epidural torácico, por ejemplo: sepsis, terapia anticoagulante, deformidades anatómicas importantes, traumatismo reciente, inestabilidad hemodinámica, etc.
En el presente artículo se revisará el bloqueo paravertebral torácico (BPVT), que se sitúa como una alternativa atractiva frente al bloqueo peridural torácico en cirugías de tórax o abdomen alto. Sin embargo, ya que es una práctica poco habitual en nuestro medio nos parece interesante revisar aspectos anatómicos, técnicos y clínicos que son fundamentales para una mejor práctica.
-
Historia
Este bloqueo fue descrito por Hugo Sellheim en 1906, pero el iniciador de la técnica fue Kappis en 1912, siendo posteriormente Lawen quien le diera su nombre. En 1919 Kappis desarrolló la técnica como la conocemos hasta hoy, siendo muy popular a comienzos del siglo pasado, revitalizándose después de la Segunda Guerra Mundial. En esa época lo consideraban una epidural parcial y creían que los espacios paravertebrales estaban sellados y carecían de comunicaciones entre sí. Daniel Moore, considerado un maestro de la anestesia regional, aconsejó este bloqueo para cirugía torácica, de pared abdominal y para el diagnóstico diferencial de neuralgias, causalgias y dolor de origen miocárdico.
La técnica de Moore era muy similar a la actual y consideraba los espacios como cavidades cerradas, aconsejando múltiples bloqueos. En 1979 Eason y Wyatt “desenterraron” este bloqueo y desde 1998 la literatura reporta muchos artículos que analizan su práctica 1 – 4 .
-
Anatomía
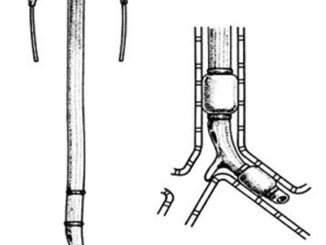
El espacio paravertebral torácico esquematizado en la Figura 1, yace a cada lado de la columna vertebral y a diferencia de lo que se creía originalmente se comporta con continuidad cráneo-caudal, no conociéndose un límite claro superior o inferior. Existe continuidad en segmentos cervicales y lumbares, pero la extensión cervical es rara de ver y a nivel lumbar el músculo psoas ejercería un cierto margen anatómico. Lateralmente existe continuidad con el espacio intercostal, a medial con el espacio epidural a través de los forámenes intervertebrales y por vía anterior con el espacio paravertebral contralateral gracias a la existencia de la fascia prevertebral 4 – 6 .
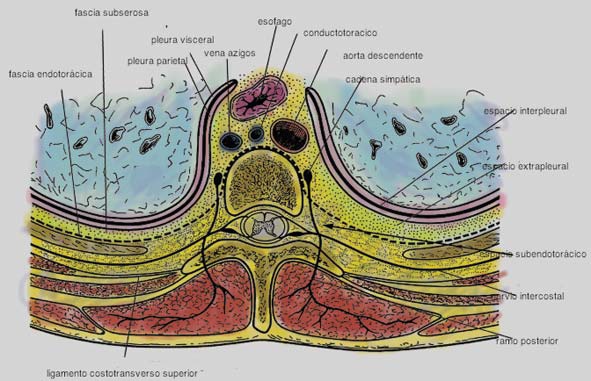
Figura 1 Esquema de la anatomía del espacio paravertebral (Adaptado de Karmakar 4 ).
Clásicamente se han descrito límites referenciales para este espacio. Hacia medial encontramos los cuerpos vertebrales, disco intervertebral, foramen intervertebral y su contenido. A posterior limita con la superficie interna del proceso transverso, el cuello de la costilla y el ligamento costotransverso superior, que es una estructura anatómica clave y se extiende desde el borde inferior del proceso transverso superior hasta el borde superior del proceso transverso inferior, continuándose lateralmente con la costilla y el músculo intercostal. Estos se unen con la pleura parietal, que constituye la pared anterior del espacio 3 , 6 , 7 .
Interpuesta entre la pleura parietal y el ligamento costotransverso superior está la fascia endotorácica, que es fibroelástica y constituye la fascia profunda del tórax. A nivel paravertebral, la fascia endotorácica está aplicada a las costillas y a nivel medial se fusiona con el periostio a nivel del cuerpo vertebral. Entre la pleura parietal y la fascia endotorácica hay tejido conectivo llamado fascia subserosa 4 – 9 .
El espacio paravertebral torácico contiene: grasa, nervios intercostales (espinales), ramos comunicantes y en su porción anterior la cadena simpática. Los nervios espinales a este nivel son muy susceptibles a los anestésicos locales porque están subsegmentados en pequeños ramos que yacen libremente entre la grasa y están desprovistos de una vaina facial, sin epineuro ni perineuro 3 – 4 . Los nervios intercostales emergen del foramen intervertebral y atraviesan el espacio de lado a lado, con ramos comunicantes a la cadena simpática. La rama posterior del nervio espinal yace en el espacio y sólo lo abandona pasado el borde medio del ligamento costotransverso superior 9 .
-
Técnica
-
Clásica
Este bloqueo se ha descrito en posición sentada o en decúbito (lateral o prono). La ventaja de la primera es la mejor identificación de los puntos de reparo; las ventajas de la segunda son: la comodidad del paciente, la mejor estabilidad hemodinámica o precaución frente a respuestas vagales y la posibilidad de realizar el procedimiento con el paciente en diversos niveles de sedación, e incluso como se ha reportado, con el paciente ya con anestesia general 4 , 8 , 9 .
Cualquiera sea la posición, se procede a identificar los reparos anatómicos, que para este bloqueo son las apófisis espinosas, que permiten identificar la línea media. En adultos, el sitio de punción se encuentra a 2,5 cm de la línea media, en relación con la apófisis transversa de la misma vértebra (más frecuente en vértebras torácicas superiores e inferiores) o la vértebra inmediatamente inferior (columna torácica media) 1 – 4 , 8 , 9 .
La técnica clásica (Figura 2), describe insertar el trócar perpendicular a la piel y avanzar hasta obtener contacto con la apófisis transversa, profundidad que resultará variable dependiendo de la contextura y edad del paciente. Una vez identificada dicha estructura, se recomienda retirar el trócar, dar una angulación de 10-15° y cabalgar por el borde superior o inferior de ésta, avanzando no más de 2 cm, aunque para la mayoría con 1 cm bastaría, dado que independiente de la contextura, las variaciones en la distancia desde la apófisis al espacio paravertebral son mínimas 2 , 4 , 9 . En este punto se atraviesa el ligamento costovertebral, lo que puede o no dar la sensación de un “pop” y si se utiliza una jeringa de baja resistencia, se podría objetivar la pérdida de esta. Sin embargo, ambas sensaciones por ser de alta subjetividad, no debieran superar la premisa de solo avanzar lo previamente recomendado y así minimizar el riesgo de complicaciones 2 , 8 , 9 , 11 . En pediatría, hay fórmulas descritas tanto para la distancia lateral [10,2 + (0,12 x peso en kg) = mm], como para la profundidad [21,2 + (0,53 x peso en kg) = mm] 4 . Una vez alcanzado el espacio se procede a la inyección de la solución anestésica, la instalación del catéter, o ambas acciones según sea lo predeterminado.
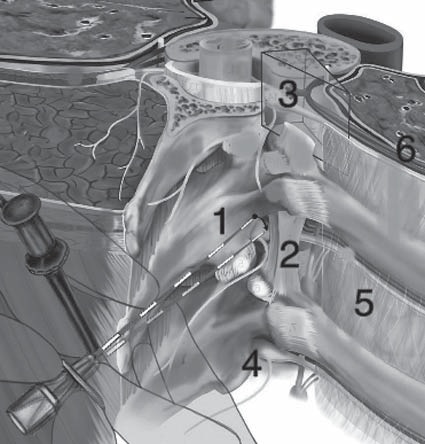
Figura 2 1. Apófisis transversa, 2. Ligamento costotransverso, 3. Emergencia del nervio espinal, 4. Cadena simpática, 5. Pleura parietal y visceral (Adaptado de Boezaart et al 9 ).
Para evitar complicaciones con la punción se recomienda no dirigir la aguja hacia medial para evitar acercarse al neuroeje y minimizar las consecuencias de una inyección anestésica a este nivel, ya sea peridural o intratecal 2 , 4 . También se recomienda que idealmente el cabalgamiento sea inferior, sobre todo en punciones bajo T7, dado que al haber mayor proximidad de la pleura parietal a este nivel, con este ángulo disminuiría la posibilidad de punción de esta estructura 4 , 9 . Por último recordar que la distancia piel-apófisis transversa puede ser el doble a nivel de T1-2 o lumbar que a nivel torácico medio 2 , 4 , 8 , 9 .
-
Una o varias punciones
En sus orígenes este bloqueo se basaba en múltiples punciones dependiendo de la cantidad de niveles que se deseaba bloquear. En la evolución de su uso y basándose en estudios en animales, cadáveres humanos con tinta india y posteriormente soluciones con medio de contraste in vivo, se ha demostrado la continuidad del espacio paravertebral en sentido cráneo caudal (Figura 3). Algunos han denominado al espacio paravertebral “gotera paravertebral”, pudiendo incluso extenderse hacia el espacio paravertebral cervical y a nivel lumbar hasta la emergencia del músculo psoas 4 , 9 , 11 También se ha determinado que existe continuidad con el espacio peridural hacia medial y con el espacio intercostal hacia lateral. Cuando se deposita una solución a este nivel se distribuirá en el espacio paravertebral y, a mayor volumen, se bloqueará una mayor cantidad de niveles; sin embargo, con mayor frecuencia, también la solución puede extenderse hacia los espacios contiguos 9 – 12 . Así, cuando se ha estudiado la efectividad de un mismo volumen de solución anestésica distribuida en una versus varias punciones, tanto la distribución imagenológica del anestésico local (AL), como el nivel de anestesia fue mejor en la técnica de multipunción 13 .
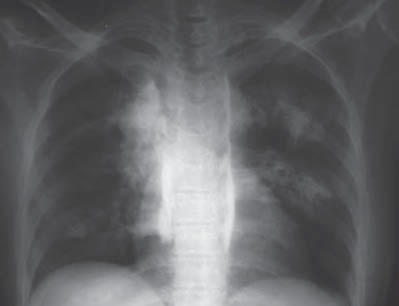
Figura 3 Radiografía de tórax con spread contraste en gotera paravertebral.
Dentro de lo descrito, parece una buena alternativa la punción única cuando se quiere bloquear hasta 3 niveles y cuando el objetivo comprende más de 3 niveles podría dividirse la masa total de solución en 2 punciones separadas por 1 o 2 niveles, pudiendo lograr una mayor extensión de bloqueo sin tantas punciones cutáneas 13 – 14 .
Por último, siempre está la opción altamente eficaz de inyectar una dosis proporcional del total de la solución en cada nivel que se desea bloquear. Sin embargo, esto implica tomar en cuenta la dosis total de anestésico empleada, sumando lo utilizado para las infiltraciones cutáneas respectivas 15 , 16 , 18 , 19 .
Aunque la punción multinivel daría un mejor bloqueo, se reporta que la duración analgésica de este bloqueo sería en promedio de 10 horas, comparado con la inyección única que puede alcanzar hasta 18 horas 2 , 4 , 7 , 11 , 17 , 18 , 21 . Por lo tanto, cuando lo que se busca es analgesia postoperatoria sin una infusión continua, la inyección en un nivel sería lo más adecuado, debiéndose determinar a qué altura tendría mayor rendimiento.
-
Bloqueos continuos
Está documentado que cuando se requiere prolongar la analgesia por más de 24 horas, lo más adecuado es instalar un catéter que permita administrar una infusión continua 11 , 18 , 19 , 39 . Existen series que muestran con claridad la eficacia de un catéter para la analgesia de un hemitórax, no encontrando series que se refieran a la instalación de más de un catéter por lado.
Lo descrito en caso de un dolor localizado como en la toracotomía o una fractura costal, es instalar el catéter uno o dos niveles bajo la lesión y cuando el objetivo del bloqueo y analgesia es más amplio una inserción a nivel intermedio 2 – 4 – 12 – 20 .
En lo técnico, una vez alcanzado el espacio paravertebral con el trócar, se debiera crear un bolsillo con unos 5 ml de solución salina o, en caso de utilizar neuroestimulación, dextrosa 5%, luego avanzar el catéter idealmente con el bisel del trócar orientado hacia craneal, y principalmente evitando la dirección medial, teóricamente para evitar la introducción peridural de este, aun cuando la efectividad de esta maniobra todavía no se ha podido demostrar. Se recomienda avanzar unos 5 cm, distal a la punta del trócar y en este punto realizar una prueba con unos 6-8 ml de anestésico local y sólo una vez corroborado el efecto deseado, evidenciando el bloqueo autonómico o sensitivo, se podría completar la dosis total y fijar el catéter. No está demás agregar que siempre debe descartarse el reflujo de sangre o LCR por el catéter antes de inyectar el AL 2 , 4 , 8 , 48 .
En las infusiones continuas se utiliza habitualmente una solución a la mitad o, con menos frecuencia, a la cuarta parte de la concentración de bloqueo inicial (0,25-0,125%); la menor concentración se usa más frecuentemente en los pacientes pediátricos 12 , 22 , 34 .
Aunque los diversos estudios de infusiones continuas, algunos con dosis totales bastante elevadas, muestran una baja incidencia de intoxicación sistémica por anestésicos locales, sí muestran una tendencia a la acumulación y elevación de los niveles plasmáticos después de 24 horas de infusión 8 , 20 , 22 , por lo cual se sugiere que se debe considerar el uso de AL menos cardiotóxicos. La vigilancia de pacientes con técnicas analgésicas continuas es fundamental; el control periódico debería realizarse por un equipo médico adiestrado que no sólo evalúe la analgesia sino una pesquisa precoz de eventuales complicaciones.
-
Bloqueo bilateral
Existe suficiente evidencia que cuando existe la necesidad de bloqueo bilateral, se puede realizar sin complicaciones la modalidad paravertebral, tanto con fines anestésicos o analgésicos, con la posibilidad de instalar catéteres para analgesia prolongada 12 , 20 , 22 . En un reciente análisis de Richardson y Lönquist, con un total de más de 500 bloqueos bilaterales, demuestran igual eficacia y seguridad, con diferentes técnicas y anestésicos en diversas series que incluyen varios tipos de cirugía: torácica, abdominal e incluso un reporte de uso en dolor en trabajo de parto 22 .
Lo que está claro es que en bloqueos bilaterales se usa una mayor masa de droga, y lo que recomiendan series y revisiones recientes, es el uso de AL con un mayor perfil de seguridad y menos cardiotoxicidad, como levobupivacaina y ropivacaina 8 , 20 , 22 .
-
Ultrasonido
La incorporación del ultrasonido (US) a la anestesia regional, ha permitido que cada vez con mayor frecuencia se realicen bloqueos ecoguiados. Destacan varios trabajos realizando BPVT bajo US, con técnicas variadas, describiéndose abordajes sagitales transversales y oblicuos, con visualización de la aguja en plano y fuera de plano 23 – 29 .
Los resultados presentados han sido variados, algunos prometedores, pero aún sin la potencia suficiente. A primera vista llama la atención el estudio de Renes y cols, tanto por la técnica como por los resultados demostrados, en que se realiza el abordaje en un eje transverso con la aguja en plano, efectuando una punción desde lateral a medial (Figura 4), con objetivos imagenológicos claros, en el cual se puede objetivar adecuadamente la distribución del anestésico en la gotera paravertebral. Sus resultados demuestran 100% de efectividad y sin complicaciones asociadas, lo que lo hace interesante 28 . Sin embargo, la dirección medial de la aguja y la posibilidad de perder la visión de esta al acercarse al espacio paravertebral, favorecido por la sombra acústica que genera la apófisis transversa, nos hace pensar en el riesgo implícito de avanzar más de lo debido hacia el neuroeje. La revisiones más extensas que se han publicado referente a BPVT, concluyen que aún falta información y series más grandes para determinar el verdadero rol del US como aporte a una técnica que en su modo clásico es considerada como efectiva y segura 11 , 12 , 20 , 22 . No obstante, podría haber un aporte del US en disminuir el índice de falla al certificar la ubicación del AL en el lugar deseado.
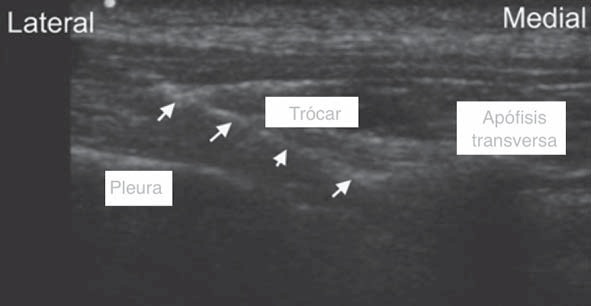
Figura 4 Punción en eje transverso ecoguiada en plano.
Corresponde también agregar que la técnica clásica es simple de aprender y efectuar, y así esta se define como segura y eficaz, por lo tanto, se debe sopesar muy bien el aporte del US, tomando en cuenta que la experiencia del operador con esta herramienta de neurolocalización es fundamental en el éxito del bloqueo y en la disminución de complicaciones.
-
Neuroestimulación
Existen series recientes que utilizan este método para identificar los nervios espinales en su emergencia del canal intervertebral, objetivando la contracción de la musculatura correspondiente 30 – 32 . Lo descrito es puncionar con una corriente de 2,5 mA hasta encontrar respuesta, luego disminuirla hasta mantener contracción muscular con 0,5 mA y entonces proceder con la inyección.
Al igual que el US, la neuroestimulación no ha demostrado ser superior a la técnica tradicional, y se enfrenta el riesgo que por perseguir una respuesta muscular se pierda la premisa de mantener un margen de seguridad en la profundidad de la punción. Por lo tanto, aún falta más análisis y series de mayor tamaño que muestren un real beneficio del uso de esta técnica antes de que sea un estándar como en otras técnicas regionales.
-
Anestésicos
Se ha reportado el uso de una gama variada de AL en este bloqueo, sin embargo, los más empleados se muestran en la Tabla 1, con las latencias reportadas y las dosis recomendadas en forma clásica 2 , 4 , 8 , 11 , 12 , 20 , 22 . No obstante, al analizar la literatura claramente los AL más utilizados tanto para bloqueos de punción única, multipunción y para infusión continua son bupivacaína y levobupivacaína (con y sin epinefrina) y ropivacaína 11 , 20 , 22 . Hasta la fecha no existe evidencia que refiera ventajas de un AL sobre otro tanto en eficacia de bloqueo como en seguridad; lo que sí se describe es que bloqueos en que se utiliza mayor masa de droga total, tanto para bloqueo inicial como para infusión continua, fueron superiores en eficacia, alcanzándose en estos últimos dosis de 900-1.000 mg de bupivacaína en 24 horas, con un máximo reportado de toxicidad sistémica por AL con cardiotoxicidad de 1%. En series que describen menos masa de droga no se reportan casos de intoxicación sistémica 8 , 22 . También se han realizado estudios analizando la farmacocinética de diferentes AL cuando son depositados a nivel paravertebral, destacando que en bloqueos únicos las concentraciones plasmáticas no superan los rangos que clásicamente se han definido como seguros. Sin embargo, destaca que en infusiones continuas estos rangos son generalmente superados frecuentemente al acercarse a las 24 horas, aunque no se ha demostrado correlación con cardiotoxicidad 8 , 22 , 34 , 35 .
Tabla 1 Anestésicos locales, latencias y dosis recomendadas en BPVT
|
Anestésico local |
Latencia (min)
|
Duración Anestesia Dosis única (horas) |
Duración Analgesia Dosis única (horas) |
Dosis bolo |
Dosis infusión continua |
| Lidocaína 1-2% |
10-15 |
2-3 |
3-4 |
300 mg |
1 mg•kg-1•h-1 |
| Ropivacaína 0,5% |
15 – 25 |
3 – 5 |
8 – 12 |
2 mg•kg-1 |
0,5 mg•kg-1•h-1 |
| Ropivacaína 0,75% |
10-15 |
4-6 |
12-18 |
2 mg•kg-1 |
– |
| Bupivacaína 0,5% |
15 – 25 |
4 – 6 |
12 – 18 |
1,5 mg•kg-1 |
0,25-0,5 mg•kg-1•h-1 |
| Levobupivacaína 0,5% |
15-25 |
4-6 |
12-18 |
1,5 mg•kg-1 |
0,5 mg•kg-1•h-1 |
Con respecto al uso de epinefrina en concentración de 1:200.000 (5 µg·ml-1), ya sea como marcador de inyección intravascular o para disminuir el barrido del AL por vasoconstricción local, no se ha demostrado diferencias significativas que demuestren un aporte del uso de esta droga cuando se utilizan drogas de vida media larga y altamente lipofílicas como bupivacaína y similares 8 , 22 , 33 , 36 .
Por otro lado, hasta la fecha no se ha reportado beneficio alguno del uso de coadyuvantes en la solución anestésica, siendo los opioides los más estudiados, seguidos por clonidina. Ambos sólo se han asociado a un aumento de las complicaciones 8 .
-
Indicaciones
La diversidad de usos que se le ha dado al BPVT se enuncia en detalle en la Tabla 2, sin embargo, donde clásicamente ha sido utilizado más extensamente es en cirugía de tórax, como técnica principalmente analgésica postoperatoria para toracotomía y toracoscopía 1 , 2 , 4 , 10 , 12 , 17 , 18 . También tiene indicación en la cirugía de mama, principalmente en la cirugía de tipo oncológica, donde esta técnica se ha posicionado en los últimos años no sólo como técnica analgésica, sino que también como técnica anestésica sin requerimientos de anestesia general, existiendo series que reportan hasta un 100% de eficacia 20 , 22 , 45 , 46 .
Tabla 2 Indicaciones del BPVT
| Analgesia postoperatoria |
| Cirugía Torácica abierta |
| Cirugía videtoracoscópica |
| Cirugía de mama |
| Cirugía renal y ureteral |
| Herniorrafia inguinal |
| Apendicectomía |
| Anestesia quirúrgica |
| Cirugía de mama |
| Herniorrafia inguinal |
| Exploración de herida torácica |
| Misceláneos |
| Neuralgia post Herpética |
| Fracturas costales |
| Dolor cápsula hepática postraumático |
| Hiperhidrosis |
La indicación de BPVT no está limitado a cirugía torácica; también ha sido empleada en cirugía abdominal, describiéndose que con punciones bajas se ha logrado obtener bloqueos satisfactorios para hernioplastías inguinales 37 – 41 . En cirugía cardiaca el uso de un BPVT bilateral ha mostrado buenos resultados para analgesia postoperatoria y, aunque todavía no existen series con casuísticas de suficiente tamaño para asumir los mismos beneficios cardiovasculares que el bloqueo epidural, se cree que un mismo nivel de bloqueo debiera seguir la misma senda de resultados 11 , 12 , 17 , 44 .
Otro importante rol que se le ha dado al BPVT es en el manejo de dolor crónico, como en el síndrome post toracotomía y en el dolor herpético 2 , 4 , 8 , 12 , 45 – 47 .
En el escenario de la urgencia y el trauma se ha utilizado para el manejo de fracturas costales, donde hace mucho tiempo superó al bloqueo intercostal tanto en eficacia, duración y seguridad. El BPVT permite realizar una punción habitualmente más alejada del foco de lesión, acceso quirúrgico o instalación de pleurotomía, minimizando las molestias tanto para el paciente como para el cirujano 4 , 42 . Utilizado e indicado inicialmente para el manejo de cualquier fractura costal, las revisiones más recientes no han demostrado superioridad del BPVT en pacientes jóvenes, sanos y con menos de 2 fracturas, cuando se compara con analgesia sistémica con opiodes y antiinflamatorios no esteroidales. Sin embargo, cuando estas condiciones no están dadas, su superioridad queda manifiesta 43 .
Tanto el hecho de que el BPVT logra bloquear efectivamente la cadena simpática al nivel del sitio quirúrgico, como el menor uso de opioides (a los cuales se les ha atribuido cierto rol inmunosupresor e inmunomodulador), han sido sugeridos como los factores relacionados con la menor incidencia de dolor crónico post toracotomía y menor recurrencia tumoral post cirugía en cáncer mamario 20 , 22 – 45 – 47 .
-
Complicaciones
A pesar que desde su incorporación, se han descrito complicaciones clásicas de este bloqueo, por lo demás, en nada muy distintas de otros bloqueos regionales, en las series y revisiones que se han publicado más recientemente las complicaciones siempre se han considerado infrecuentes y en general es un bloqueo que bien ejecutado se ha reportado incluso más seguro que el bloqueo epidural 8 , 12 , 20 , 48 , 49 . En la Tabla 3 se describen las complicaciones más frecuentemente reportadas. Al clasificarlas se puede diferenciar entre las que están en relación con la punción y al bloqueo propiamente tal.
Tabla 3 Complicaciones del BPVT
|
Complicación |
Frecuencia descrita |
| Falla anestesia | Hasta 13% |
| Falla analgesia | Hasta 6% |
| ISAL
– Neurotoxicidad – Cardiotoxicidad |
Hasta 1,8% Hasta 1,2% |
| Mortalidad | Ninguna |
| Punción vascular | 3,8% |
| Hipotensión | 4,6% |
| Punción pleural | 1,1% |
| Neumotórax | 0,5% |
| Daño neurológico directo | Descrito, pero raro |
| Punción dural | Descrita, pero rara |
| Síndrome de Horner | Descrito |
Dentro de las complicaciones más temidas están: el daño neurológico directo, principalmente de neuroeje; la intoxicación sistémica por AL; la extensión del bloqueo con un patrón neuroaxial, incluso tipo espinal total; la punción pleural y el neumotórax. A pesar que estas complicaciones han sido reportadas, no se ha publicado mortalidad asociada. Hasta la fecha las complicaciones menos graves son las más frecuentes: bloqueo fallido, alteraciones hemodinámicas moderadas, hematoma y Síndrome de Claude Bernard-Horner 8 , 12 , 48 .
Cabe destacar que una técnica adecuada en que se evite la medialización de la aguja, que no se profundice más de lo recomendado tras la apófisis transversa y utilizando las dosis recomendadas de AL, rara vez estaría asociada a complicaciones.
-
Comparación con epidural
Recientes revisiones de grupos como el de Myles y cols, y otras revisiones, han demostrado que el BPVT ofrece analgesia equiparable a aquella que se logra con técnica epidural 49 – 51 .
Lo más destacable de todos los análisis que se han hecho comparando estas dos técnicas es el amplio beneficio otorgado al BPVT en lo que respecta a seguridad, menos incidencia de complicaciones graves, mayor estabilidad hemodinámica, mejor función respiratoria, menos reacciones adversas y mejor aceptación por el paciente, entre otras. En la Tabla 4 se describe una serie de indicaciones donde se favorece el BPVT por sobre la analgesia peridural 51 – 54 .
Tabla 4 Ventajas del BPVT sobre la analgesia epidural
| Ventajas sobre epidural |
| Menos contraindicaciones |
| Efecto unilateral o bilateral |
| Realizable con seguridad en pacientes sedados o AG |
| Instalación bajo visión en cirugía de tórax |
| Menos requerimiento de enfermería postoperatoria |
| Mayor estabilidad hemodinámica |
| Mejores resultados respiratorios |
| Menos náuseas y vómitos |
| Menos retención urinaria |
| Menos riesgo de lesión espinal permanente |
Conclusiones
Destaca que en la literatura se evidencia un aumento del uso del BPVT en los últimos 10 años, transformándose en una real alternativa con gran eficacia y bajos riesgos reportados. Son varios los grupos que le han depositado una gran confianza avalada por los resultados obtenidos. Además, el reciente y cada vez más desarrollado uso de técnicas de neurolocalización, destinado a disminuir los errores de una técnica ciega, abre la puerta a posibles mejoras en las escasas deficiencias de este bloqueo.
Estimamos que a pesar de que los reportes muestran una relativa seguridad y baja incidencia de intoxicación por AL con bupivacaína, la disponibilidad cada vez mayor de alternativas con un perfil de mayor seguridad determinado principalmente por menor cardiotoxicidad, sin descuidar las medidas básicas de prevención de complicaciones, permitirá desarrollar este bloqueo con mayor confianza en nuestro medio en un futuro cercano.
REFERENCIAS
- Eason MJ, Wyatt R. Paravertebral thoracic block-a reappraisal. Anaesthesia 1979; 34: 638-642.
- Hadzic A, Vloka J. Peripheral nerve blocks. Principles and practice. New York school of regional Anesthesia 2004.
- Richardson J, Lönnqvist PA. Thoracic paravertebral blockade. A review. Br J Anaesth 1998; 81: 230-238.
- Karmakar MK. Thoracic paravertebral block. Anesthesiology 2001; 95: 771-780.
- Naja MZ, Ziade MF, El Rajab M, et al. Varying anatomical injection points within the thoracic paravertebral space: effect on spread of solution and nerve blockade. Anaesthesia 2004; 59: 59-64.
- Saito T, Den S, Tanuma Y, et al. Anatomical bases for paravertebral anesthetic block: fluid communication between the thoracic and lumbar paravertebral regions. Surg Radiol Anat 1999; 21: 359-363.
- Karmakar MK, Kwok WH, Kew J. Thoracic paravertebral block: Radiological evidence of contralateral spread anterior to the vertebral bodies. Br J Anaesth 2000; 84: 263-265.
- Kotzé A, Scally A, Howell S. Efficacy and safety of different techniques of paravertebral block for analgesia after thoracotomy: a systemic review and metaregression. Br J Anaesth 2009; 103: 626-636.
- Boezaart A, Lucas S. Elliott C. Paravertebral block: cervical, thoracic, lumbar, and sacral. Curr Op Anaesth 2009; 22: 637-643.
- Joshi GP, Bonnet F, Shah R, et al. A systematic review of randomized trial evaluating regional techniques for postthoracotomy analgesia. Anesth Analg 2008; 107: 1026-1040.
- Thavaneswaran P, Rudkin G, Cooter R, Moyes D. Paravertebral Block for Anesthesia: A Systematic Review. Anesth Analg 2010; 110:1740-1744.
- Daly D, Myles PS. Update on the role of paravertebral blocks for thoracic surgery: are they worth it? Curr Op Anaesth 2009; 22: 38-43.
- Naja ZM, El-Rajab M, Al-Tannir MA, et al. Thoracic paravertebral block: influence of the number of injections. Reg Anesth Pain Med 2006; 31: 196-201.
- Hill SE, Keller RA, Stafford-Smith M, et al. Efficacy of single-dose, multilevel paravertebral nerve blockade for analgesia after thoracoscopic procedures. Anesthesiology 2006; 104: 1047-1053.
- Kaya FN, Turker G, Basagan-Mogol E, et al. Preoperative multiple-injection thoracic paravertebral blocks reduce postoperative pain and analgesic requirements after video-assisted thoracic surgery. J Cardiothorac Vasc Anesth 2006; 20: 639-643.
- Myles PS, Power I. Clinical update: postoperative analgesia. Lancet 2007; 369: 810-812.
- Myles PS, Bain C. Underutilization of paravertebral block in thoracic surgery. J Cardiothorac Vasc Anesth 2006; 20: 635-638.
- Wenka M, Schug S. Perioperative pain management after thoracotomy. Currt Op Anesth 2011; 24: 8-12.
- Moller J, Nikolajsen L, Aage S. Thoracic Paravertebral Block for Breast Cancer Surgery: A Randomized Double-Blind Study. Anesth Analg 2007; 105: 1848-1851.
- Schnabel A, Reichl A, Kranke P, et al. Efficacy and safety of paravertebral blocks in breast surgery: A meta-analysis of randomized controlled trials. Br J Anaesth 2010; 105: 842-852.
- Vogt D, Stieger S, Theurillat C, Curatolo M. Single-injection thoracic paravertebral block for postoperative pain treatment after thoracoscopic surgery. Br J Anaesth 2005; 95: 816-821.
- Richardson J, Lönnqvist P, Naja Z. Bilateral thoracic paravertebral block: potential and practice. Br J Anaesth 2011; 106: 164-171.
- Luyet C, Eichenberger U, Greif1 R, et al. Ultrasound-guided paravertebral puncture and placement of catheters in human cadavers: an imaging study. Br J Anaesth 2009; 102: 534-539.
- Hara K, Sakura S, Nomura T, et al. Ultrasound guided thoracic paravertebral block in breast surgery. Anaesthesia 2009; 64: 223-227.
- Pusch F, Wildling E, Klimscha W, et al. Sonographic measurement of needle insertion depth in paravertebral blocks in women. Br J Anaesth 2000; 85: 841-846.
- O’Riain SC, Donnell BO, Cuffe T, et al. Thoracic paravertebral block using real-time ultrasound guidance. Anesth Analg 2010; 110: 248-251.
- Seosamh C, O’Riain SC, Brian O, et al. Thoracic Paravertebral Block Using Real-Time Ultrasound Guidance. Anesth Analg 2010; 110: 248-251.
- Renes S, Bruhn J, Gielen M. In-Plane Ultrasound-Guided Thoracic Paravertebral Block. A Preliminary Report of 36 Cases With Radiologic Confirmation of Catheter Position. Reg Anesth Pain Med 2010; 35: 212 -216.
- Ben-Ari A, Moreno M, Chelly J, Bigeleisen P. Ultrasound-Guided Paravertebral Block Using an Intercostal Approach. Anesth Analg 2009;109: 1691-1694.
- Lang SA. The use of a nerve stimulator for thoracic paravertebral block. Anesthesiology 2002; 97: 521.
- Naja MZ, Ziade MF, Lonnqvist PA. Nerve-stimulator guided paravertebral blockade vs. general anaesthesia for breast surgery: a prospective randomized trial. Eur J Anaesthesiol 2003; 20: 897.
- Lang SA, Saito T. Thoracic paravertebral nerve block, nerve stimulator guidance and the endothoracic fascia. Anaesthesia 2005; 60: 930.
- Garutti I, Olmedilla L, Cruz P. Comparison of the Hemodynamic Effects of a Single 5 mg/kg Dose of Lidocaine With or Without Epinephrine for Thoracic Paravertebral Block. Reg Anesth Pain Med 2008; 33: 57-63.
- Cheung SLW , Booker PD, Franks R, Pozzi M. Serum concentrations of bupivacaine during prolongued continuous paravertebral infusin in young infants. Br J Anaesth 1997; 79: 9-13.
- Snowden CP, Bower S, Conacher I. Plasma bupivacaine levels in paravertebral blockade in adults. Anaesthesia 1994; 49: 546.
- Karmakar M, Ho A, Law B. Arterial and Venous Pharmacokinetics of Ropivacaine with and without Epinephrine after Thoracic Paravertebral Block. Anesthesiology 2005; 103:704-711.
- Naja MZ, Ziade MF, Lönnqvist PA. General anaes thesia combined with bilateral paravertebral blockade (T5-6) vs general anaesthesia for laparoscopic cholecystectomy: a prospective, randomized clinical trial. Eur J Anaesthesiol 2004; 21: 489-495.
- Hall H, Leach A. Paravertebral block in the management of liver capsule pain after blunt trauma. Br J Anaesth 2000; 83: 819-821.
- Naja Z, Ziade MF, Lönnqvist PA. Bilateral paravertebral somatic nerve block for ventral hernia repair. Eur J Anesthesiol 2002; 19: 197-202
- Hadzic A, Kerimoglu B, Loreio D, et al. Paravertebral blocks provide superior same-day recovery over general anesthesia for patients undergoing inguinal hernia repair. Anesth Analg 2006; 102: 1076-1081.
- Wassef MR, Randazzo T, Ward W. The paravertebral nerve root block for inguinal herniorrhaphy- a comparison with the field block approach. Reg Anesth Pain Med 1998; 23: 451-456.
- Karmakar M, Ho AM. Acute Pain Management of Patients with Multiple Fractured Ribs. J Trauma 2003; 54: 615-625.
- Ho AM, Karmakar MK , Critchley LA. Acute pain management of patients with multiple fractured ribs: a focus on regional techniques. Curr Opin Crit Care 2011; 17: 323-327.
- Canto M, Sánchez MJ, Casas MA, Bataller ML. Bilateral paravertebral blockade for conventional cardiac surgery. Anaesthesia 2003; 58: 365-370.
- Kairaluoma PM, Bachmann MS, Korpinen AK, et al. Preincisional paravertebral block reduces the prevalence of chronic pain alter breast surgery. Anesth Analg 2006; 103: 703-708.
- Exadaktylos AK, Buggy DJ, Moriarty DC, et al. Can anesthetic technique for primary breast cancer surgery affect recurrence or metastasis? Anaesthesiology 2006; 105: 660-664.
- Lonnqvist PA. Preemptive analgesia with thoracic paravertebral blockade? Br J Anaesth 2005; 95: 727-728.
- Naja MZ, Lönnqvist PA. Somatic paraverebral nerve blockade: incidence of failed block and complications. Anaesthesia 2001; 56: 1184-1190.
- Richardson J, Sabanathan S, Jones J, et al. A prospective, randomized comparison of preoperative and continuous balanced epidural or paravertebral bupivacaine on postthoracotomy pain, pulmonary function and stress responses. Br J Anaesth 1999; 83: 387-392.
- Casati A, Alessandrini P, Nuzzi M, et al. A prospective, randomized, blinded comparison between continuous thoracic paravertebral and epidural infusión of 0.2% ropivacaine after lung resection surgery. Eur J Anaesthesiol 2006; 23: 999-1004.
- Davies RG, Myles PS, Graham JM. A comparison of the analgesic efficacy and side effects of paravertebral vs epidural blockade for thoracotomy- a systemic review and meta-analysis of randomized trials. Br J Anaesth 2006; 96: 418-426.
- Conlon NP, Shaw AD, Grichnik KP. Postthoracotomy paravertebral analgesia: will it replace epidural analgesia? Anesthesiol Clin 2008; 26: 369-380.
- Stopar T, Potocnik I, Hadzic A. Comparison of Continuous Thoracic Epidural With Paravertebral Block on Perioperative Analgesia and Hemodynamic Stability in Patients Having Open Lung Surgery. Reg Anesth Pain Med 2011; 36: 256 –260.
- Messina M, Borolli F, Landoni G. A Comparison of epidural and paravertebral vs blockade in thoracic surgery. Minerva Anestesiol 2009; 75: 616-621.


 Creative Commons Attribution
Creative Commons Attribution