Juan Carlos Devoto G. 1 , 2 , Mirtha Tapia P. 3
Rev Chil Anest Vol. 45 Número 1 pp. 6-15|https://doi.org/10.25237/revchilanestv45n01.01
PDF|ePub|RIS
Antecedentes
La administración de anestesia para la reparación prenatal del mielomeningocele revela condiciones que están ligadas a esta nueva forma de tratamiento: el bienestar fetal, el contexto quirúrgico y la perfusión uterina.
La descripción, el análisis y la comprensión de las distintas variables que están involucradas permitirá disminuir el elevado riesgo que carga esta cirugía.
Objetivo: Esta revisión entrega un enfoque sistemático a los nuevos desafíos que plantea la cirugía fetal.
Introducción
El estudio comparativo sobre el manejo del mielomeningocele (MMC), tan apropiadamente llamado “MOMS” (Management of myelomeningocele study, por su sigla en inglés), fue publicado por primera vez en el New England Journal of Medicine en Marzo 2011 1 .
Los hallazgos de este estudio demuestran los beneficios del tratamiento prenatal y sus conclusiones desplazan las fronteras del conocimiento más allá de los convencionales paradigmas de la terapia en Medicina y abren las puertas a un nuevo desafío para los Anestesiólogos: La Cirugía Fetal.
Así como la descripción de Vandam2 sobre las consideraciones anestésicas para el trasplante renal o la de Aldrete3 en el trasplante hepático o la reciente publicación de Klein4 sobre las implicancias anestesiológicas en la inserción de la válvula aortica por cateterismo, el trabajo de Adzick 1 da inicio a una nueva era en el desarrollo de la anestesiología donde deberemos contestar preguntas que no nos habíamos formulado y donde deberemos profundizar en áreas que esta emergente técnica nos obligará a desarrollar.
Esta publicación esta basada en la experiencia adquirida en los primeros 29 casos realizados en Chile. Se describen los defectos del tubo neural y se analizan las principales variables a considerar:
• El dolor fetal.
• La técnica anestésica.
• La monitorización.
• La relajación uterina.
• La reposición de fluidos.
Epidemiología de los defectos del tubo neural
En Chile ocurren alrededor de 250.000 nacimientos por año, con una tasa de natalidad de 13,4 /1.000 habitantes para el año 2013, y con más del 99% de atención profesional del parto. Las tasas de mortalidad infantil (MI, mortalidad en menores de un año por cada 1.000 recién nacidos vivos) van en brusco descenso en los últimos 30 años, con tasas de 79/1.000 en 1970, a tasas menores de un dígito a partir de la década del 2000. Así, en Chile, las malformaciones congénitas (MC) tienden a ocupar los primeros lugares dentro de las causas de MI, al igual que en los países desarrollados donde se alcanzan cifras de MI menores de 10 /1.000. En la evaluación del desarrollo de un país uno de los indicadores más importantes es la disminución de la MI y entre sus causas las MC han ido aumentando proporcionalmente de un 4% a un 33% entre los años 1970 y 2000.
De todas las malformaciones descritas, los defectos del tubo neural (DTN) clásicos (acránea/anencefalia, espina bífida, cefalocele e iniencefalia) corresponden al grupo más frecuente de malformaciones estructurales después de las cardiopatías congénitas.
Los defectos del tubo neural tienen hoy día una incidencia muy variable en todo el mundo, que oscila entre uno y dos dígitos dependiendo de la raza, región geográfica, posibilidad de interrupción del embarazo y programas de fortificación de alimentos con ácido fólico.
Los datos nacionales están restringidos casi exclusivamente a las publicaciones del Estudio Colaborativo Latino Americano de Malformaciones Congénitas (ECLAMC), que realiza un programa de seguimiento epidemiológico e incluye los datos aportados sólo por 16 Hospitales Chilenos que participan en forma intermitente y que para nuestro país en el período 2001-2010 refería una tasa total de DTN de 9,58 por 10.000 RN. y de espina bífida (EB) para ese mismo período una tasa de 4,48 por 10.000 RN5. El año 2010 en particular, la incidencia de EB fue de 4,2 por cada 10.000 nacidos vivos y muertos mayores de 500 gramos. Esto en términos prácticos significa que en Chile cada año nacerán entre 80 y 100 niños con EB.
La EB se puede presentar en forma cubierta (5 – 25% de la población) o abierta, esta última como meningocele, mielomeningocele o su forma más grave, raquisquisis, presentación que es incompatible con la vida. De todas las formas de presentación es el mielomeningocele la más frecuente.
Las causas etiológicas de los DTN actualmente se desconocen, sin embargo, se asocian a factores ambientales, genéticos y nutricionales. De los factores ambientales se sabe por ejemplo que es más frecuente en la quinta, sexta y octava región, se asocia también al estado socio-económico, siendo mayor en estratos socio-económicos de bajos ingresos, a niveles elevados de arsénico o plomo en el agua, como también a drogas antiepilépticas (ácido valproico, carbamazepina), a la ingesta de alcohol durante el embarazo, a exposición a altas temperatura en etapas embrionarias de la gestación.
Entre los factores genéticos se han descrito algunos casos asociados a alteraciones cromosómicas como trisomía 13 y 18 o algunas que comprometen al cromosoma 21, existe asimismo una mayor recurrencia entre madres que han tenido un hijo con EB (4%) y esta aumenta hasta un 10% cuando son dos los hijos afectados; lo que habla a favor de la predisposición genética de estas malformaciones.
Desconocer las causas etiológicas significa que sólo un pequeño porcentaje podrán ser prevenidos, esto no ocurre para los factores nutricionales donde hay una clara asociación entre el déficit de ácido fólico y los DTN, esto motivo a que el año 2000 en Chile se implementara un programa de fortificación de la harina de trigo con ácido fólico6, medida que ha tenido un importante impacto en la disminución de la frecuencia de DTN y muy especialmente en la de EB de un 8,6/10.000 (pre fortificación 1969-1999) a un 4,48/10.000 (post fortificación 2001-2010), lo que representa una disminución porcentual de un 47,9%.
Se sabe que los folatos en general y su forma sintética el ácido fólico, (que es más estable y tiene una mejor metabolización) participan de varias vías metabólicas cruciales para la síntesis de aminoácidos y formación de ADN celular, etapa fundamental en la duplicación celular y génesis del sistema nervioso central.
Se sabe también que el cierre del tubo neural finaliza a los 28 días de gestación, entonces cualquier medida de prevención deberá ser aplicada en las primeras etapas del desarrollo embrionario lo que significa que suplementar la dieta con ácido fólico a partir del tercer mes de vida no tendrá mayor impacto en prevenir la aparición de esta MC.
Descripción de la enfermedad
Aunque el MMC es una malformación que no compromete la vida es, desde el punto de vista del futuro neurológico del recién nacido, una enfermedad devastadora.
La característica anatómica del MMC es la protrusión de las meninges y tejidos neurales (médula espinal y raíces nerviosas) a través de la fusión incompleta de los arcos neurales, con la formación de un saco cubierto por una delgada membrana probablemente aracnoides, que se rompe con facilidad; la perdida de líquido cefalorraquídeo (LCR) a través del defecto es lo que determina los otros hallazgos que identifican a esta malformación. Por una parte, el descenso del tronco cerebral, lo que se conoce como malformación de Arnold-Chiari tipo 2 que en el examen de imagen se manifiesta como una fosa posterior y un cuarto ventrículo pequeños, herniación de las amígdalas cerebelosas, vermis y cuarto ventrículo hacia el foramen magno. Esta herniación del tronco cerebral lleva a la otra manifestación, una circulación anormal del LCR y como consecuencia al desarrollo de hidrocefalia. Ambas se presentan en grado variable pero con mucha frecuencia.
Aproximadamente 10% de los niños que nacen con MMC muere durante su infancia. La mortalidad global es un 25% durante los primeros 25 años de vida, con un expectativa de vida de 30 años 7,8 .
Los niños portadores de MMC requieren el cierre quirúrgico de su lesión en los primeros días de vida con el fin de proteger el tejido neural y a menudo necesitan también la inserción de una válvula ventrículo peritoneal para evitar las complicaciones derivadas de la hidrocefalia. La ubicación más frecuente de la lesión es en la región lumbo-sacra (70%), se ha visto además que el grado de discapacidad sensorial y motora se asocia con el nivel vertebral del defecto, sin embargo, frecuentemente el nivel funcional del déficit neurológico es uno o dos niveles más alto que el defecto anatómico9.
La gravedad de la enfermedad se relaciona tanto con el tamaño de la anomalía como con su ubicación, mientras más cefálico y de mayor tamaño, mayor será la discapacidad.
La alteración del desarrollo de las fibras nerviosas representa un severo déficit neurológico que compromete no sólo la función motora de las extremidades inferiores, sino que muchas veces también la función vesical y anal. Aproximadamente todos los niños presentan manifestaciones neurológicas supra espinales.
La malformación de Arnold- Chiari puede manifestarse como hipoventilación o apneas de origen central, disfunción oromotoras, alteraciones de la movilidad de cuerdas vocales o problemas con la deglución, todos secundarios a alteraciones de los pares craneanos comprometidos. Con el fin de evitar la alta mortalidad asociada a esta complicación, si los síntomas están presentes y ponen al niño en riesgo; entonces requerirá el tratamiento del Chiari propiamente tal. Además los niños portadores de una válvula ventrículo peritoneal necesitan ser vigilados a lo largo de toda su vida y muchas veces precisarán revisiones quirúrgicas del shunt 10 .
Se ha visto también en estos pacientes, que su desarrollo intelectual se encuentra disminuido (coeficiente intelectual promedio 80) especialmente en aquellos que han necesitado de la colocación de un shunt derivativo 11 .
Cirugía fetal en Chile
El desarrollo de la cirugía fetal por su complejidad ha demandado un largo proceso. Los estudios actualmente disponibles fueron llevados a cabo en una población de pacientes altamente seleccionada, donde la cirugía prenatal del MMC ofrece las máximas oportunidades de beneficios. La evaluación ecográfica de los fetos portadores de MMC durante el transcurso de su gestación ha mostrado que el daño sobre el sistema nervioso central es progresivo, se aprecia un deterioro en la movilidad de las extremidades inferiores y en muchos casos también un incremento en la hidrocefalia y el Arnold Chiari presente. Se postuló entonces la teoría de los dos impactos, en el cual el mal resultado neurológico obtenido, es consecuencia de la combinación de dos eventos, por una parte la alteración en la formación embriológica del tubo neural en las primeras etapas del desarrollo y luego por la exposición del tejido neural al ambiente intrauterino.
Estas observaciones junto a estudios realizados en animales, donde se pudo comprobar que la protección intrauterina de la lesión permitía preservar la función neurológica, llevo finalmente a plantear que la corrección del MMC en forma prenatal podría aminorar la discapacidad neurológica.
Reproducir estos resultados en Chile no ha sido tarea fácil, requiriendo de un extenso trabajo de estudio, investigación y perfeccionamiento.
Los primeros pasos fueron dados realizando biopsias de vellosidades coriales, amniocentesis, cordocentesis. El nivel de complejidad fue aumentando con procedimientos como ablación de vasos placentarios con laser o con embolización de malformaciones congénitas adenomatoides quísticas pulmonares y luego en inserción de shunts en obstrucciones urinarias bajas 12,13,14,15,16,17 .
Finalmente la experiencia adquirida a lo largo de este proceso es lo que ha permitido poder realizar la neurorrafia prenatal del MMC.
Anestesia para cirugía fetal
-
Dolor Fetal
La cirugía fetal, desde la perspectiva anestesiológica, plantea múltiples interrogantes que deben ser descifradas antes de poder definir cual es la técnica anestésica más adecuada. Lo primero que debemos responder por su preponderancia, es en qué momento de su desarrollo el feto es capaz de percibir dolor, si entendemos que el dolor, por definición, involucra a dos sistemas: una reacción hormonal o neuroendocrina conocida como respuesta de stress y una percepción cortical emocionalmente negativa.
Giannakoulopoulos nos revela que el feto es capaz de montar una respuesta hormonal similar a la de niños mayores y adultos ante estímulos considerados dolorosos 18 . Por su parte, Teixeira en su estudio en fetos, evidencia que estos estímulos dolorosos también generan una respuesta hemodinámica, manifestada por la dilatación de la arteria cerebral media 19 .
Se sabe que el desarrollo embriológico del sistema nervioso ya muestra receptores sensoriales cutáneos en el área perioral a las 7 semanas, los que se extienden al resto de la cara, las palmas de las manos y las plantas de los pies por la semana 11, el tronco, las partes proximales de los brazos y las piernas en la semana 15 y para todas las superficies cutáneas en forma abundantes a las 20 semanas 20 . Las vías nociceptivas alcanzan las astas medulares posteriores tan precozmente como a las 8 semanas de gestación; los haces espino-talámicos se completan a las 20 semanas y finalmente los haces tálamo-corticales se desarrollan entre las 26 y 30 semanas 21 .
Aunque la corteza cerebral no ha terminado su desarrollo al final del embarazo, se ha observado que otras zonas cerebrales como hipotálamo y placa subcortical ya están activas y su maduración es a través de un proceso de plasticidad que es estímulo dependiente.
Las ventajas de la corrección prenatal son obtenidas cuando la cirugía es realizada entre las semanas 19 y 25,9. Cualquier reparación fuera de este intervalo gestacional es por una parte técnicamente difícil por el pequeño tamaño de la lesión y por otra sin evidencias de beneficios como lo demostraron los estudios pre-MOMS realizados en Vanderbilt a edades gestacionales mayores. Entonces probablemente el feto puede sentir dolor a esa edad gestacional pero la percepción del dolor posiblemente no involucre las mismas estructuras que las del adulto.
-
Técnica Anestésica y Feto
Esta modulación cerebral dependiente de los estímulos nos plantea entonces otra cardinal interrogante: que anestésicos podemos emplear con seguridad en un período del desarrollo que es altamente sensible a las injurias ambientales, donde la vulnerabilidad está dada por los críticos procesos de proliferación, migración, diferenciación, sinaptogénesis, mielinización y apoptosis neuronal 22 . Se sabe que el desarrollo neurológico en animales se ve alterado con la administración de anestésicos generales aún por periodos cortos. Estudios preclínicos en fetos de roedores, cerdos y monos han mostrado que la exposición a anestésicos inhalatorios y drogas sedantes causa apoptosis neuronal 23,24 , exposición que también ha demostrado asociarse con trastornos del aprendizaje 25 . Este tema largamente debatido y que ha sido motivo de varias editoriales en revistas anestesiológicas 26,27,28 permanece aún siendo controversial.
Otro punto importante que debemos considerar en la elección de la técnica, son los efectos que los anestésicos podrían tener sobre el sistema cardiovascular del feto. Estudios in vitro han demostrado que el desflurano deprime la fuerza contráctil de la fibra miocárdica en una forma dosis dependiente 29 . Disfunción ventricular y regurgitación valvular intraoperatoria cuando se utilizan agentes inhalatorios en altas concentraciones han sido reportados en fetos 30 . Efecto que puede ser aminorado cuando se suplementa con anestesia endovenosa 31 .
Por otra parte, agentes anestésicos endovenosos como el remifentanil, opiáceo sintético desarrollado en 1993, con características farmacocinéticas únicas que lo hacen fácil de administrar (un rápido inicio y una acción ultracorta), cuando es utilizado en embarazadas en infusión continua posee un significante grado de paso placentario como se evidencian por su relación vena umbilical/arteria materna (UV/MA) de 0,88 y un rápido metabolismo o distribución sugerido por su baja relación arteria umbilical/vena umbilical (UA/UV) de 0,29 32 . Si además agregamos que el feto a las 26 semanas ya posee suficiente actividad de esterasas plasmáticas no especificas que le permiten una rápida metabolización de este potente analgésico 33 y a pesar de no poder disponer de estudios que permitan saber su cinética en el feto, probablemente sea una alternativa que debemos considerar.
-
Monitorización Fetal
Durante la cirugía han sido empleadas múltiples formas de vigilar el bienestar fetal: desde la utilización del registro intermitente o continuo de la frecuencia cardiaca, la medición del contenido de oxígeno en su sangre, la velocidad del flujo en los vasos fetales o la medición de esta velocidad en los vasos uterinos. Si pensamos que esta vigilancia intenta pesquisar en forma precoz alteraciones de la perfusión fetal y por ende fenómenos de hipoxia fetal, probablemente la fisiología de la isquemia nos orientará mejor a saber cuales son los métodos que permiten detectar ésta en forma oportuna, donde claramente la alteraciones de la frecuencia cardiaca fetal estará entre los últimos eventos de esta cascada. Hoy por hoy, los sucesos isquémicos iniciales llámense modificaciones de velocidades en la diástole ventricular o alteraciones del flujo coronario 34 no son fáciles de seguir en forma directa, aunque muestran que el ultrasonido en tiempo real debe jugar un rol importante como método de monitorización intraoperatoria. Tal vez interpolar otras formas de monitorización, desarrolladas para evaluar las condiciones hemodinámicas fetales durante el embarazo al intraoperatorio, nos permita anteponernos a los eventos adversos, por ejemplo en el examen de ultrasonido con doppler de la arteria umbilical, la presencia de flujo diastólico ausente o reverso es considerado un signo de insuficiencia placentaria. Alternativamente el doppler del ductus venoso nos provee de información privilegiada de la eficiencia del trabajo cardíaco fetal 35 , esto debido a que por su ubicación anatómica y directa conexión con la aurícula nos permite detectar cambios en la compliance ventricular. Otra importante característica del ductus venoso se refiere a la respuesta frente a situaciones de hipoxia, donde la vasodilatación parece ser su principal reacción, probablemente para asegurar un adecuado aporte de oxígeno y glucosa a importantes órganos vitales como el corazon y cerebro 36,37.
De igual modo el istmo aórtico, como efectivo shunt entre dos circulaciones paralelas que perfunden la parte superior e inferior del feto, la monitorizacion del patrón de su flujo entrega fiable información tanto de la oxigenación cerebral como del flujo placentario 38 .
-
Relajación Uterina
Una condición clave para llevar a cabo la cirugía es asegurar una profunda relajación del miometrio, especialmente en el momento en que se realiza la histerotomía; la extracción del líquido amniótico con un útero abierto, de no haber una adecuada relajación, puede significar la compresión del feto, de su cordón umbilical o el desprendimiento de la placenta (Figura 1).
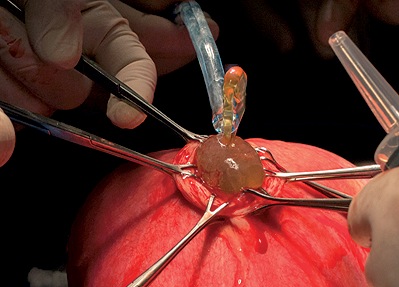
Figura 1. Relajación Uterina Inadecuada. Nótese la presión del líquido amniótico.
¿Como podemos lograr una intensa relajación uterina?
Las revisiones sistematizadas y los meta análisis han sido desarrollados sobre la prevención del parto prematuro y no sobre tocolisis aguda o del intraoperatorio. La inhibición de las contracciones uterinas es la base de las drogas utilizadas en la prevención del parto prematuro, pero no hay un consenso por una parte acerca de cual es el mejor tocolítico y por otra de su potencia. Si analizamos las distintas drogas que se han utilizado en cuanto a su capacidad de relajar el miometrio, efecto que va más allá de inhibir las contracciones, y consideramos solo a aquellas que pueden ser empleadas durante el intraoperatorio, entonces podemos referirnos a las siguientes: (Tabla 1).
|
Tabla 1. Dosis Intraoperatoria de Tocolíticos (*cam: Concentración alveolar mínima) |
|
| Drogas Tocolíticas | Dosis |
| Trinitrato de glicerilo | Hasta 10 mcg/kg/min |
| Salbutamol | 10 – 30 mcg/min |
| Sulfato de magnesio | 2 – 4 g (bolo); 1-2 g/h |
| Atósiban | 6,75 mg (bolo); 300 mcg/min (3h); 100 mcg/min (45h) |
| Anestésicos halogenados | 2 – 3 cam* |
-
Liberadores de oxido nítrico
El más utilizado es el trinitrato de glicerilo (Nitroglicerina) de acción ultra corta; actúa liberando óxido nítrico desde el endotelio vascular, aumentando la guanosina monofosfato cíclico (cGMP) y por medio de un segundo mensajero una proteína Kinasa G (PKG) impide la entrada de calcio a la célula y de esta forma relaja el miometrio.
Ventajas: Rápido inicio y corta duración, fácil de titular (vida media de 2 minutos), también ha sido usado para relajar el útero durante cirugía fetal, no han sido descritos efectos deletéreos en el feto.
Desventajas: Potencia intermedia, además de sus efectos hemodinámicos conocidos, tiene una biodisponibilidad altamente variable entre los sujetos por su pronunciado metabolismo hepático, pulmonar y placentario 39 .
-
Agonistas Beta adrenérgicos
Terbutaline, Ritodrine, Salbutamol. Actúan estimulando los receptores beta adrenérgicos, (B -AR) aumentando la adenosina mono fosfato cíclico (cAMP) y así activando la PKG. Existen tres subtipos de B -AR en el miometrio que varían en su expresión hacia el término de la gestación, B2-AR es la forma predomínate (80%).
Ventajas: De acción rápida, mayor potencia que los liberadores de NO.
Desventajas: Su unión a los receptores es prolongada e irreversible en el corto tiempo, la amplia distribución de B2-AR resulta en una amplia gama de efectos colaterales entre los que se describe el edema pulmonar.
-
Antagonistas del Calcio
A diferencia de los bloqueadores de los canales de Calcio que actúan en la membrana celular (como Nifedipine), el magnesio compite con Ca a nivel intracelular posiblemente impidiendo la liberación de Ca a nivel de retículo sarcoplásmico y de ese modo afecta a múltiples vías intracelulares.
Ventajas: De mayor potencia tocolítica, ampliamente utilizado en el mundo.
Desventajas: Requiere dosis de carga, de efecto prolongado e interactúa con drogas anestésicas.
-
Antagonistas de la oxitocina
Su efecto es compitiendo con la oxitocina a nivel de sus receptores. Atósiban derivado de la oxitocina, es un inhibidor competitivo de los receptores de oxitocina al igual que en los receptores de vasopresina.
Ventajas: De igual potencia que los agonistas B -AR con menos efectos colaterales.
Desventajas: Requiere al igual que el Magnesio una dosis de carga lo que entorpece su uso durante el intraoperatorio, además actúa a nivel de los receptores de vasopresina.
-
Anestésicos Halogenados
Al día de hoy no se conoce el exacto mecanismo por el cual ejercen su efecto los anestésicos inhalatorios halogenados, se postuló inicialmente que su elevada solubilidad lipídica explicaría su efecto. En los últimos 10 años han habido grandes avances en el conocimiento molecular de su acciones que ha permitido un giro de la teoría unitaria a una teoría de múltiples mecanismos 40 . Recientes estudios de los canales iónicos de Na+ y K+ sugieren fuertemente que los anestésicos halogenados interactúan con regiones de estos canales para modular su función. Esto explicaría algunos de los efectos de los anestésicos inhalatorios, si consideramos que los canales de Na+ regulados por voltaje son los responsables de la fase de despolarización rápida del potencial de acción en células excitables como los nervios, corazón o miometrio 41 . La diferente capacidad en que estos anestésicos bloquean estos canales de Na+ pareciera ser que se relaciona con el perfil farmacológico especifico del agente, donde el desflurano es el inhibidor más efectivo en el bloqueo de estas corrientes de voltaje 42 . Una implicancia clínica de estos hallazgos podría relacionar la inhibición de estos canales de Na+ regulados por voltaje con el efecto relajante muscular dada la alta densidad de estos canales en la unión neuromuscular (Figura 3).
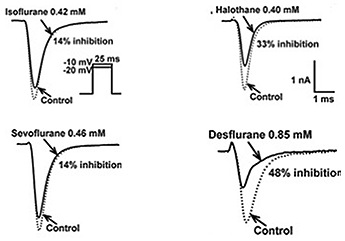
Figura 3. Efecto de los Halogenados en la función de los canales de Na+ regulados por voltaje. (adaptado de ref. 42).
Ventajas: Extremadamente potentes en su capacidad de relajar el miometrio, efecto que es dosis dependiente; rápidamente alcanzan las concentraciones clínicas necesarias, especialmente los agentes con menor solubilidad en sangre como el desflurano quien además posee una elevada estabilidad: menos del 0,02% es metabolizado por el organismo.
Desventajas: Requieren concentraciones elevadas para relajar el miometrio (2-3 MAC) lo que implica importantes efectos hemodinámicos maternos y fetales.
Podemos concluir que la relajación uterina es un factor esencial y crítico de la cirugía del MMC y no obstante que se dispone de una amplia gama de alternativas terapéuticas para obtenerla, los conocimientos actuales apoyan pero no prueban la mejor opción. Basándonos en estos conocimientos y en la experiencia adquirida, probablemente la utilización combinada de desflurano en bajas concentraciones y nitroglicerina en infusión contínua nos enfoque en el camino correcto (Figura 2).
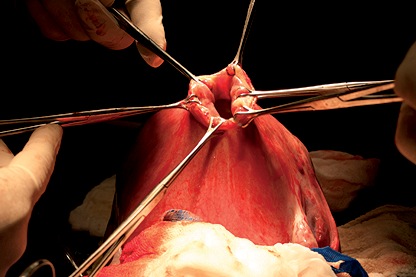
Figura 2. Relajación Uterina obtenida con Desflurane y Nitroglicerina.
-
Reposición de fluidos
Las pacientes que se presentan para cirugía fetal reúnen condiciones únicas que facilitan el desarrollo de congestión pulmonar. Los cambios fisiológicos ya conocidos, presentes en el segundo trimestre del embarazo, como el aumento del volumen intravascular, la hipertrofia ventricular que determina remodelación del ventrículo y caída de su complacencia 43 , la disminución de las proteínas y del Na+ plasmático que hacen que la gestación se caracterice por una reducción verdadera de la osmolalidad plasmática, lo que condiciona una aumento del gradiente transcapilar pulmonar y favorece el edema pulmonar con presiones menores que las observadas en la no gestantes. Adzick reporta en una serie de pacientes operadas en Vanderbilt una ocurrencia de edema pulmonar en el postoperatorio inmediato de aproximadamente 8% 44 . Esta alta incidencia se relaciona con uso de tocolíticos durante el intraoperatorio 45 , tratamiento que necesariamente se extiende a las siguientes 48 h del postoperatorio. Reportes de congestión pulmonar han sido descritos especialmente con nitroglicerina 46,47 y agonistas Beta miméticos 48 , aunque en nuestra experiencia el único caso de congestión pulmonar fue en una paciente que recibió nitroglicerina como tocolisis durante el intraoperatorio y se mantuvo con Atósiban posteriormente.
Entonces estas condiciones mencionadas deben hacernos pensar en una terapia de fluidos restrictiva y dirigida a un objetivo, donde la reposición de volumen durante la cirugía sea guiada por la monitorización y dirigida a optimizar la entrega de oxígeno a los tejidos. Si pensamos que la monitorización tradicional utilizada para guiar el manejo de fluidos, como frecuencia cardiaca, presión arterial, débito urinario, presión venosa central o presión capilar pulmonar son pobres indicadores del estado de la volemia, necesitamos emplear entonces otros marcadores dinámicos que nos informen sobre el estado de la volemia frente a los cambios generados por la anestesia, las drogas empleadas o la cirugía. La búsqueda de una respuesta a esta necesidad se puede ver actualmente en el intenso desarrollo que han tenido los sistemas de monitoreo, que evalúan las variaciones del volumen eyectado provocados por las modificaciones de la presión intratoráxica en pacientes en ventilación mecánica, variación que es acentuada por la hipovolemia. Esto también puede ser examinado mediante ecocardiografía doppler, donde la curva de la integral de la velocidad del flujo en un vaso sanguíneo, válvula o tracto de salida (generada por la señal doppler) multiplicada por el área de sección transversal en ese punto es el volumen eyectado. Otra forma que podemos emplear con ecocardiografía es la medición de las áreas del ventrículo, conociendo las limitaciones que significa extrapolar áreas con volúmenes, sabiendo que el ventrículo no se contrae uniformemente, nos permite hacer un seguimiento de los cambios del volumen eyectado 49 . Podemos entonces saber en que punto de la curva de Frank-Starling nos encontramos y así guiar nuestro aporte de volumen.
Conclusión
Esta revisión sistematizada entrega información sobre las características más relevantes de la anestesia para cirugía del MMC, factores que en forma independiente o no, por su importancia, pueden manifiestamente comprometer el resultado. Desde la comprobación, publicada por Adzick, de los potenciales beneficios de la cirugía prenatal a expensas de un alto riesgo, como era esperable, diferentes centros han intentado reproducir ese beneficio en sus pacientes y en pocas oportunidades como ésta ha sido tan evidente para los anestesiólogos que la técnica anestésica puede influir en el resultado. Aún no se sabe cual es la mejor técnica anestésica ni cuales serán los efectos de nuestra elección, pero identificar las variables que están involucradas ayudará a encontrar la respuesta. Podemos ver que por su complejidad, se requiere de un elevado nivel de preparación, donde la tecnología es un pilar importante. Podemos ver que las soluciones pueden ser aportadas por diferentes especialidades como por ejemplo cardiología fetal o neuroradiología. Podemos ver también que no es fácil encontrar las mejores respuestas a estos problemas, pero claramente si queremos disminuir la morbilidad asociada debemos seguir investigando.
Referencias
1. Adzick S, Thorn E, Spong C et al. A randomized trial of prenatal versus postnatal repair of Myelomeningocele. N Engl J Med 2011;364(11):993–1004. http://dx.doi.org/10.1056/NEJMoa1014379.
2. Vandam L, Harrison H, Murray JE, Merrill JP. Anesthetic Aspect of Renal Homotransplantation. Anesthesiology 1962;23(6):783–92. http://dx.doi.org/10.1097/00000542-196211000-00008.
3. Aldrete JA, Goldman E, de Campo T. Anesthetic implications in hepatic transplantation. Contemp Anesth Pract 1981;4:111–22.
4. Klein A, Webb ST, Tsui S, Sudarshan C, Shapiro L, Densem C. Transcatheter aortic valve insertion: anaesthetic implications of emerging new technology. Br J Anaesth 2009;103(6):792–9. http://dx.doi.org/10.1093/bja/aep311.
5. Nazer J, Cifuentes L. Resultados del Programa de Prevención de Defectos de Tubo Neural en Chile mediante la fortificación de la harina con ácido fólico. Período 2001-2010. Rev Med Chil 2013;141(6):751–7. http://dx.doi.org/10.4067/S0034-98872013000600009.
6. Gobierno de Chile. Ministerio de Salud. Norma técnica para la fortificación de la harina de trigo con vitaminas y minerales. Diciembre 1999.
7. Thompson DN. Postnatal management and outcome for neural tube defects including spina bifida and encephalocoeles. Prenat Diagn 2009;29(4):412–9. http://dx.doi.org/10.1002/pd.2199.
8. Davis B, Daley CM, Shurtleff DB, Duguay S, Seidel K, Loeser JD et al. Long term survival of individuals with myelomeningocele. Pediatr Neurosurg 2005;41(4):186–91. http://dx.doi.org/10.1159/000086559.
9. Rintoul NE, Sutton LN, Hubbard AM, Cohen B, Melchionni J, Pasquariello PS et al. A new look at myelomeningoceles: functional level, vertebral level, shunting, and the implications for fetal intervention. Pediatrics 2002;109(3):409–13. http://dx.doi.org/10.1542/peds.109.3.409.
10. Tuli S, Drake J, Lamberti-Pasculli M. Long-term outcome of hydrocephalus management in myelomeningoceles. Childs Nerv Syst 2003;19(5-6):286–91. http://dx.doi.org/10.1007/s00381-003-0759-4.
11. Oakeshott P, Hunt GM. Long-term outcome in open spina bífida. Br J Gen Pract 2003;53:632–6.
12. Sepúlveda W, Mena F, Ortega X. Successful percutaneous embolization of feeding vessels of a lung tumor in a hydropic fetus. J Ultrasound Med 2010;29:639–43.
13. Sepúlveda W, Wong AE, Bustos JC, Flores X, Alcalde JL. Acardiac fetus complicating a triplet pregnancy: management and outcome. Prenat Diagn 2009;29(8):794–9. http://dx.doi.org/10.1002/pd.2291.
14. Sepúlveda W, Wong AE, Herrera L, Dezerega V, Devoto JC. Endoscopic laser coagulation of feeding vessels in large placental chorioangiomas: report of three cases and review of invasive treatment options. Prenat Diagn 2009;29(3):201–6. http://dx.doi.org/10.1002/pd.2197.
15. Sepúlveda W, Wong AE, Dezerega V, Devoto JC, Alcalde JL. Endoscopic laser surgery in severe second-trimester twin-twin transfusion syndrome: a three-year experience from a Latin American center. Prenat Diagn 2007;27(11):1033–8. http://dx.doi.org/10.1002/pd.1829.
16. Sepúlveda W, Hasbun J, Dezerega V, Devoto JC, Alcalde JL. Successful sonographically guided laser ablation of a large acardiac twin at 26 weeks gestation. J Ultrasound Med 2004;23:1663–6.
17. Sepúlveda W, Wong AE, Alcalde JL, Dezerega V, Barrera C, de la Fuente S. Discordant lower urinary tract obstruction in early twin gestations: management and outcome. Obstet Gynecol 2005;106(4):797–801. http://dx.doi.org/10.1097/01.AOG.0000175833.65983.ee.
18. Giannakoulopoulos X, Sepúlveda W, Kourtis P, Glover V, Fisk NM. Fetal plasma cortisol and β-endorphin response to intrauterine needling. Lancet 1994;344(8915):77–81. http://dx.doi.org/10.1016/S0140-6736(94)91279-3.
19. Teixeira JM, Glover V, Fisk NM. Acute cerebral redistribution in response to invasive procedures in the human fetus. Am J Obstet Gynecol 1999;181(4):1018–25. http://dx.doi.org/10.1016/S0002-9378(99)70340-6.
20. Anand KJ, Hickey PR. Pain and its effects in the human neonate and fetus. N Engl J Med 1987;317(21):1321–9. http://dx.doi.org/10.1056/NEJM198711193172105.
21. Lowery CL, Hardman MP, Manning N, Clancy B, Whit Hall R, Anand KJ. Neurodevelopmental changes of fetal pain. Semin Perinatol 2007;31(5):275–82. http://dx.doi.org/10.1053/j.semperi.2007.07.004.
22. Rice D, Barone S. Critical periods of vulnerability for the developing nervous system: evidence from humans and animal models. Environ Health Perspect 2000;108(s3 Suppl 3):511–33. http://dx.doi.org/10.1289/ehp.00108s3511.
23. Creeley CE, Dikranian KT, Dissen G, Back S, Olney JW, Brambrink AM. Isoflurane-induced apoptosis of neurons and oligodendrocytes in the fetal rhesus macaque brain. Anesthesiology 2014;120(3):626–38. http://dx.doi.org/10.1097/ALN.0000000000000037.
24. Creeley C, Dikranian K, Dissen G, Martin L, Olney J, Brambrink A. Propofol induced apoptosis of neurones and oligodendrocytes in fetal and neonatal rhesus macaque brain. Br J Anaesth 2013;110 Suppl 1:29–38. http://dx.doi.org/10.1093/bja/aet173.
25. Palanisamy A, Baxter MG, Keel PK, Xie Z, Crosby G, Culley D. Rats exposed to isoflurane in utero during early gestation are behaviorally abnormal as adults. Anesthesiology 2011;114(3):521–8. http://dx.doi.org/10.1097/ALN.0b013e318209aa71.
26. Lena S, Guohua L. Anesthesia and Neurodevelopment in Children: time for an Answer. Anesthesiology 2008;109(5):757–61. http://dx.doi.org/10.1097/ALN.0b013e31818a37fd.
27. Davidson AJ, McCann ME, Norton N. Anesthesia and Outcome after Neonatal Surgery. Anesthesiology 2008;109(6):941–4. http://dx.doi.org/10.1097/ALN.0b013e31818e3f79.
28. Hansen TG, Flick R. Anesthetic effects on the developing brain: insights from epidemiology. Anesthesiology 2009;110(1):1–3. http://dx.doi.org/10.1097/ALN.0b013e3181915926.
29. Park WK, Pancrazio JJ, Suh CK, Lynch C. Myocardial depressant effects of sevoflurane. Mechanical and electrophysiologic actions in vitro. Anesthesiology 1996;84(5):1166–76. http://dx.doi.org/10.1097/00000542-199605000-00019.
30. Rychik J, Cohen D, Tran KM, Szwast A, Natarajan SS, Johnson MP et al. The Role of Echocardiography in the Intraoperative Management of the Fetus Undergoing Myelomeningocele Repair. Fetal Diagn Ther 2014;37(3):172–8. http://dx.doi.org/10.1159/000364863.
31. Boat A, Mahmoud M, Michelfelder EC, Lin E, Ngamprasertwong P, Schnell B et al. Supplementing desflurane with intravenous anesthesia reduces fetal cardiac dysfunction during open fetal surgery. Paediatr Anaesth 2010;20(8):748–56. http://dx.doi.org/10.1111/j.1460-9592.2010.03350.x.
32. Kan R, Hughes S, Rosen MA, Kessin C, Preston PG, Lobo EP. Intravenous Remifentanil Placental Transfer, Maternal and Neonatal Effects. Anesthesiology 1998;88(6):1467–74. http://dx.doi.org/10.1097/00000542-199806000-00008.
33. Roth B, Mueller C. Remifentanil Degradation in Umbilical Cord Blood of Preterm Infants. Anesthesiology 2011;114(3):570–7. http://dx.doi.org/10.1097/ALN.0b013e318204e043.
34. Rychik J, Cohen D, Tran KM, Szwast A, Natarajan SS, Johnson MP et al. The Role of Echocardiography in the Intraoperative Management of the Fetus Undergoing Myelomeningocele Repair. Fetal Diagn Ther 2014;37(3):172–8. http://dx.doi.org/10.1159/000364863.
35. Sosa A, Zurita J, Giugny G, Bermudez A, Díaz L, Martínez L. Anatomía vascular del sistema umbílico-porto-ductal en fetos de 20 a 25 semanas de gestación. Rev Obstet Ginecol Venez 2004;64(2):69–75.
36. Kiserud T, Rasmussen S, Skulstad S. Blood flow and the degree of shunting through the ductus venosus in the human fetus. Am J Obstet Gynecol 2000;182(1):147–53. http://dx.doi.org/10.1016/S0002-9378(00)70504-7.
37. Bellotti M, Pennati G, De Gasperi C, Battaglia FC, Ferrazzi E. Role of ductus venosus in distribution of umbilical blood flow in human fetuses during second half of pregnancy. Am J Physiol Heart Circ Physiol 2000; 279: H 1256-1263.
38. Fouron JC. The unrecognized physiological and clinical significance of the fetal aortic isthmus. Ultrasound Obstet Gynecol 2003;22(5):441–7. http://dx.doi.org/10.1002/uog.911.
39. Noonan P, Benet L. Incomplete and delayed bioavailability of sublingual nitroglycerin. Am J Cardiol 1985;55(1):184–7. http://dx.doi.org/10.1016/0002-9149(85)90325-X.
40. Torri G. Inhalation anesthetics: A review. Minerva Anestesiol 2010;76(3):215–28.
41. Hemmings HC. Sodium channels and the synaptic mechanisms of inhaled anaesthetics. Br J Anaesth 2010;103(1):61–9. http://dx.doi.org/10.1093/bja/aep144.
42. Ouyang W, Herold KF, Hemmings HC Jr. Comparative effects of halogenated inhaled anesthetics on voltage-gated Na channel function. Anesthesiology 2009;110(3):582–90. http://dx.doi.org/10.1097/ALN.0b013e318197941e.
43. Simmons LA, Gillin AG, Jeremy RW. Structural and functional changes in left ventricle during normotensive and preeclamptic pregnancy. Am J Physiol Heart Circ Physiol 2002;283(4):H1627–33. http://dx.doi.org/10.1152/ajpheart.00966.2001.
44. Adzick S, Thorn E, Spong C. Management of Myelomeningocele Study (MOMS) A Randomized Trial of Prenatal Versus Postnatal Repair of Myelomeningocele Protocol. N Engl J Med 2011;364(11):993–1004. http://dx.doi.org/10.1056/NEJMoa1014379.
45. Rassler B. Contribution of – and -Adrenergic Mechanisms to the Development of Pulmonary Edema. Scientifica 2011;(1) 11 pages.
46. DiFederico EM, Burlingame JM, Kilpatrick SJ, Harrison M, Matthay MA. Pulmonary edema in obstetric patients is rapidly resolved except in the presence of infection or of nitroglycerin tocolysis after open fetal surgery. Am J Obstet Gynecol 1998;179(4):925–33. http://dx.doi.org/10.1016/S0002-9378(98)70190-5.
47. DiFederico EM, Harrison M, Matthay MA. Pulmonary edema in a woman following fetal surgery. Chest 1996;109(4):1114–7. http://dx.doi.org/10.1378/chest.109.4.1114.
48. Rassler B. Contribution of and Adrenergic Mechanisms to the Development of Pulmonary Edema. Scientifica 2012; (1): 11 pages.
49. Brown JM. Use of echocardiography for hemodynamic monitoring. Crit Care Med 2002;30(6):1361–4. http://dx.doi.org/10.1097/00003246-200206000-00039.
