Santi Sánchez 1
Recibido: 19-02-2019
Aceptado: 04-04-2019
©2019 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 48 Núm. 4 pp. 298-307|https://doi.org/10.25237/revchilanestv48n04.04
PDF|ePub|RIS
Interscalene block in the era of ultrasound guided regional anesthesia
Abstract
Introduction: The introduction of ultrasound to regional anesthesia has redefined our understanding on this field; moreover, through ultrasound, regional anesthesia techniques have developed rapidly in response to more specific and complex needs. In this context, some changes and new concepts have raised around interscalene block. Objective: To revise recent advances as regards our knowledge of interscalene block since the ultrasound was introduced to regional anesthesia; as well as to evaluate different strategies to avoid hemidiaphragmatic paralysis. Material and Methods: A search was carried out in medical data bases (PubMed and Cochrane) and anesthesiology journals (Regional Anesthesia and Pain Medicine, Anesthesiology Journal, British Journal of Anesthesiology, among others). Search terms were as follows: interscalene block, hemidiaphragmatic paralysis, shoulders surgery, ultrasound guided interscalene block. Discussion: New concepts around interscalene block are quoted (traffic lighter sign-long thoracic and dorsal scapular nerve), as well as a short review about the respiratory compromise that follows this regional anesthesia technique and some strategies to avoid it. Conclusions: The introduction of ultrasound to regional anesthesia has redefined our understanding towards this field. It is mandatory for the regional anesthesiologist to comprehend these new concepts in order to provide a safe and effective regional anesthesia.
Resumen
Introducción: La introducción del ultrasonido a la anestesia regional ha redefinido nuestro entendimiento hacia estas prácticas, las cuales han crecido en complejidad y cantidad en respuesta a necesidades cada vez más técnicas y específicas. En este contexto es que han surgido múltiples variaciones y nuevos conceptos en torno al abordaje clásico a nivel interescalénico del plexo braquial. Objetivo: Revisar los recientes avances en el entendimiento del bloqueo interescalénico desde la llegada del ecógrafo así como evaluar las diferentes estrategias para evitar la parálisis hemidiafragmática asociado a este abordaje. Material y Métodos: Se ha realizado una búsqueda bibliográfica vinculada a bloqueo interescalénico en bases de datos médicas (Cochrane, PubMed) y revistas especializadas (Regional Anesthesia and Pain Medicine, Anesthesiology Journal, British Journal of Anesthesiology, entre otras). Las palabras claves que se han utilizado son: bloqueo interescalénico, parálisis hemidiafragmática, cirugía de hombro, bloqueo interescalénico ecoguiado. Discusión: Se describen nuevos conceptos en torno al abordaje interescalénico del plexo braquial (signo del semáforo-identificación sistemática de los nervios dorsal de la escápula y torácico largo) como así también una pequeña reseña del compromiso respiratorio que caracteriza la realización de este bloqueo y estrategias para evitarlo. Conclusión: La llegada del ultrasonido a la anestesia regional ha redefinido nuestro entendimiento hacia este campo de la anestesia. Resulta necesario conocer estos nuevos conceptos en torno al bloqueo interescalénico para hacer de esta técnica una práctica segura y efectiva para nuestros pacientes.
-
Introducción
El dolor postoperatorio en la cirugía de hombro es catalogado como una entidad de intensidad severa y en caso de no tratarlo, puede interferir significativamente en la rehabilitación postquirúrgica de nuestros pacientes[1 ]. Existen múltiples procedimientos destinados a paliar dicho síntoma, sin embargo, se considera al bloqueo interescalénico como la técnica de anestesia regional más utilizada en todo el mundo para la cirugía y el tratamiento del dolor postoperatorio en toda patología que involucre al miembro superior desde el hombro hasta el codo[2], siendo la cirugía de hombro su indicación más habitual. El advenimiento de la ecografía en el campo de la anestesia regional ha modificado el clásico abordaje interescalénico descripto por Winnie[3] desplazándolo hacia posterior, a través del escaleno medio[4] (transescalénico). Por otro lado, el uso del ultrasonido, ha redefinido nuestro entendimiento hacia esta técnica ya que la información visual que nos brinda el ecógrafo plantea nuevos desafíos en la realización de este bloqueo.
Anatomía
La inervación de la articulación del hombro, es rica y se encuentra provista casi en su totalidad por el plexo braquial. Recientemente, tras disección cadavérica, Eckmann y cols[5 ], describen que la inervación de la articulación glenohumeral y tegumentos asociados es provista por los siguientes nervios:
• Nervio supraescapular (inerva la región postero lateral): ramo del tronco superior del plexo braquial tiene su origen en C5 y C6. Discurre por el triángulo posterior del cuello en estrecha relación con la escotadura supraescapular y supraglenoidea; desde allí se divide en dos ramos articulares (superior e inferior) junto con un ramo motor que inerva al músculo supra e infraespinoso. En su trayecto por la escotadura supraglenoidea, el nervio supraescapular es acompañado por la vena y arteria homónimas. Además, de las estructuras antes mencionadas, el nervio supraescapular provee sensibilidad a la articulación acromioclavicular, bursa subacromial y los ligamentos coracoacromial y coracohumeral.
• Nervio pectoral lateral: su origen es a partir de C5-C7, provee de inervación muscular al pectoral mayor y deltoides, como así también a la articulación glenohumeral y acromioclavicular.
• Nervio axilar: ramo del tronco posterior atraviesa el espacio cuadrangular de Velpeau (espacio delimitado a nivel superior por el músculo redondo menor, a nivel inferior por el músculo redondo mayor, siendo finalmente el vasto medial del tríceps y el cuello quirúrgico del húmero los límites medial y lateral respectivamente Figura 2) en compañía de la arteria y vena circunfleja posterior del húmero, a partir de ahí, se divide en un ramo anterior y otro posterior los cuales proveen de inervación al músculo deltoides y redondo menor, articulación y cápsula glenohumeral (cara anterior y en menor medida su aspecto posterior) como así también piel y tejido celular subcutáneo por encima del deltoides.
• Nervio subescapular: algunos autores[6 ] incluyen a este nervio (ramo del tronco posterior) como elemento interviniente en la inervación de la región anterior de la cápsula articular.
• Plexo cervical superficial (ramos supraclaviculares): inervan la región cutánea correspondiente a la articulación acromioclavicular y regiones aledañas (Figuras 1, 2 y 3).
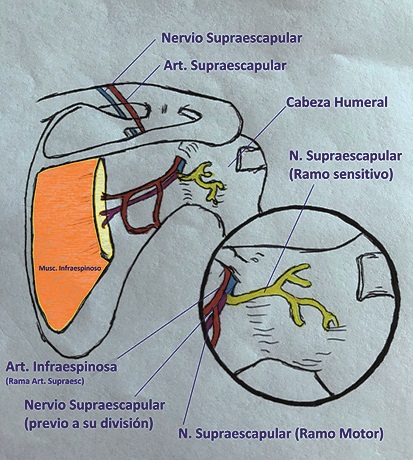
Figura 1. Inervación del hombro cara posterior; nervio supraescapular: salida del nervio supraescapular por la escotadura espinoglenoidea y su posterior división en ramos motores (músculo infraespinoso) y ramo sensitivos a la cápsula glenohumeral.
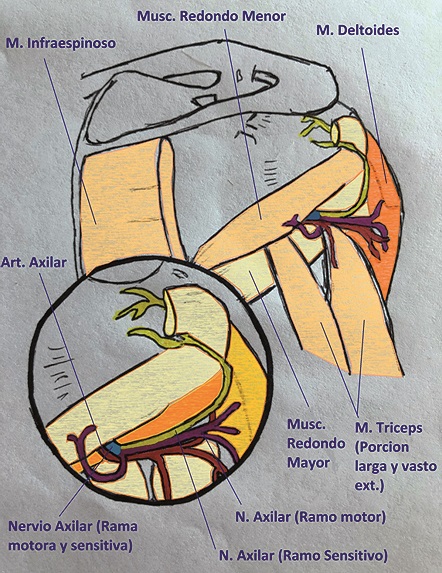
Figura 2. Inervación del hombro cara posterior (nervio axilar): Se observa la salida del nervio axilar por el espacio cuadrangular de Velpeau (delimitado por el músculo redondo menor a nivel superior, por el músculo redondo mayor a nivel inferior, siendo, finalmente, el vasto medial del tríceps y el cuello quirúrgico del húmero los limites medial y lateral respectivamente, nota el húmero se encuentra cubierto por el músculo tríceps en esta imagen) y dividiéndose en sus ramos motores (músculo deltoides) y ramos sensitivo (cara posterolateral de la cápsula glenohumeral).
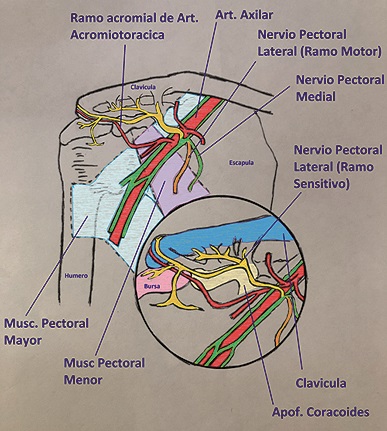
Figura 3. Inervación del hombro cara anterior (nervios pectorales): en esta imagen se observa la salida de los nervios pectoral lateral y medial desde el plexo braquial, enviando un ramo motor al músculo pectoral mayor y un ramo sensitivo puro que acompaña a la rama acromial de la arteria toracoacromial e inerva a la cara anterior de la articulación glenohumeral y el ligamento coracoacromial.
Parece pertinente hacer una breve reseña respecto a la anatomía nervio frénico dado su relevancia en los temas a tratar a posterior y por la estrecha relación que mantiene este nervio con el plexo braquial. El nervio frénico, inerva al diafragma y se origina a partir del ramo ventral de C4, recibiendo colaterales variables de C3 y/o C5. A partir de su origen, existen ciertas variaciones en el recorrido de este nervio, recibiendo en algunas oportunidades ramos directamente desde el plexo braquial o incluso un nervio frénico accesorio el cual nace a partir de C5-C6. Desde su origen el nervio frénico guarda estrecha relación con el plexo braquial, particularmente a nivel de C5-C6 (donde la distancia media entre ambas estructuras es de 0,18 mm), para ir separándose de él a medida que avanzan en sentido caudal por la regional supraclavicular (distancia media de 1,08 cm pasados los 3 cm por debajo de C5-C6). Como se verá más adelante este concepto es de vital importancia a la hora de entender el compromiso del nervio frénico al realizar un bloqueo del plexo braquial a nivel interescalénico, así como las diferentes técnicas que han sido descriptas para evitar esta complicación (Figura 4).
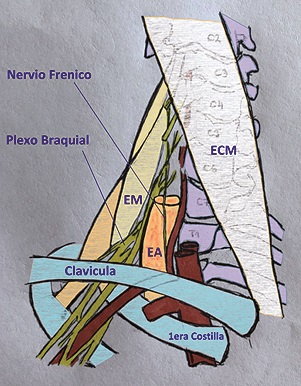
Figura 4. Relación del nervio frénico con el plexo braquial: Tal como se puede observar en este esquema, el nervio frénico tiene su origen en C4 muy próximo al plexo braquial. Conforme su recorrido se hace más caudal, la distancia entre ambos aumenta, llegando a 1,08 cm a la altura de C5 – C6. EM: Músculo escaleno medio, ECM: Músculo esternocleidomastoideo, EA: Músculo escaleno anterior.
Conceptos actuales en torno al bloqueo interescalénico
-
Utilidad del signo del semáforo
Clásicamente se describe la visualización ultrasonográfica del plexo braquial a nivel del surco interescalénico, como tres estructuras hipoecoicas redondeadas con finos halos hiperecoicos, alineadas en sentido cráneo caudal[7] dispuestas entre dos estructuras musculares, a saber: los músculos escaleno medio y escaleno anterior. Esta disposición ha sido llamada, con fines pedagógicos, el “signo del semáforo”[8 ], ya que asemeja a dicha artefacto. Si bien esta comparación es útil para el alumno, no está del todo claro qué porción del plexo representa dicha imagen, siendo para algunos autores las raíces nerviosas de C5 – C6 – C7 o bien los troncos del plexo braquial[9].
Sin embargo, más allá de la correlación que hay entre la imagen del plexo braquial a nivel interescalénico y la de un semáforo existe una implicancia clínica a tener en cuenta al momento de realizar un bloqueo regional a este nivel. Como se señaló previamente, no existe consenso en cuanto a qué representa cada una de estas estructuras hipoecoicas, siendo comúnmente interpretadas como troncos o bien raíces nerviosas individuales. Sin embargo, disecciones cadavéricas[9 ] encontraron que las raíces nerviosas de C6 y C7 están constituidas por 2 o más fascículos macroscópicos los cuales son evidenciables tras remover el epineurio que los envuelve. Este hallazgo es de vital importancia si se entiende que estos “macro fascículos”, que componen un mismo nervio, pueden ser visualizados con la ecografía e interpretados como dos estructuras nerviosas independientes. Este error conceptual, perpetuado por la interpretación errónea que se le da al “signo del semáforo”, puede llevar al anestesiólogo principiante a puncionar entre la “segunda y tercera luz del semáforo” creyendo que se encuentra entre C6 y C7 cuando en realidad está realizando una punción intraneural al colocar la punta de la aguja entre los dos macro fascículos de C6. Si bien es cierto que en la actualidad está en discusión el efecto perjudicial de la punción intraneural, es considerado una práctica segura evitar la punción y deposición de anestésico local a dicho nivel por considerarse precursora de lesión neurológica (Figuras 5 y 6).
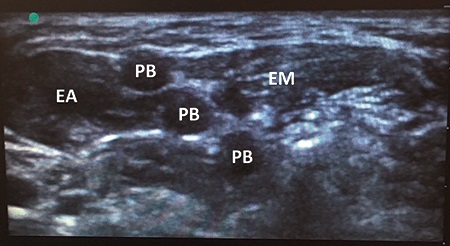
Figura 5. Signo del semáforo: Sonoanatomía del plexo braquial a nivel interescalénico. Referencias: se observa la disposición del plexo cual luces del semáforo. EA: Músculo escaleno anterior. EM: Músculo escaleno medio. PB: Plexo braquial.
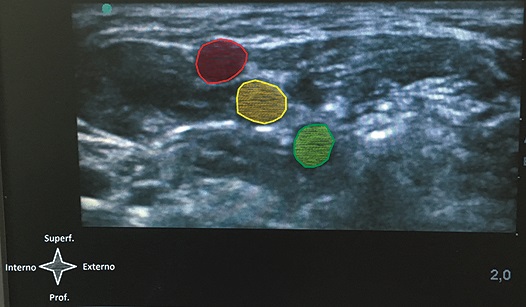
Figura 6. Signo del semáforo. Si bien no hay consenso acerca de qué estructuras conforman la imagen del semáforo es clara su asociación con el mismo y su utilidad pedagógica.
-
Identificación sistemática de los nervios dorsal de la escápula y torácico largo durante la realización del bloqueo interescalénico
Tal como se comentó en párrafos previos, el uso del ultrasonido en anestesia regional ha redefinido el sitio de punción del plexo braquial a nivel interescalénico[4 ]. El abordaje en plano de lateral a medial que se utiliza habitualmente para este bloqueo dista del descrito por Winnie[3] en 1970, haciendo que el sitio de punción sea más posterior y “transescalénico”, correspondiéndose más con el propuesto por Pippa[10]. Esta ligera modificación, tal como lo expone Kessler y cols[11 ], busca alejar el sitio de punción del recorrido del nervio frénico, el cual discurre por delante del escaleno anterior. Sin embargo, plantea nuevos aspectos a la hora de su realización ya que en el espesor del músculo escaleno medio discurren dos ramos del plexo braquial: el nervio dorsal de la escápula y el nervio torácico largo[12]. Tal como plantea Hanson y cols[12], si bien la visualización directa a través del ultrasonido ronda el 77% para el nervio dorsal de la escápula y 23% para el nervio torácico largo, existe un riesgo real de lesión nerviosa si es que no se los tiene en cuenta al momento de la realización del bloqueo. Por otro lado, es bien sabido que la cirugía ortopédica de hombro, tiene una de las tasas más altas de lesión neurológica perioperatoria llegando hasta un 30% de incidencia según algunos autores[13], más aún el bloqueo interescalénico figura entre los bloqueos periféricos con mayor incidencia de complicaciones según el ASA Closed Claims Project 2011[14]. Teniendo en cuenta estos datos, a partir de los hallazgos propuestos por Hanson y cols[12], hacer uso del neuroestimulador en forma concomitante con el ultrasonido durante el trayecto transescalénico de la aguja para facilitar la identificación y prevención de lesiones de estos pequeños ramos al constatar la contracción del músculo serrato anterior (inervado por el nervio torácico largo) o el músculo elevador de la escápula (inervado por el nervio dorsal de la escápula) es una alternativa razonable (Figuras 7 y 8).
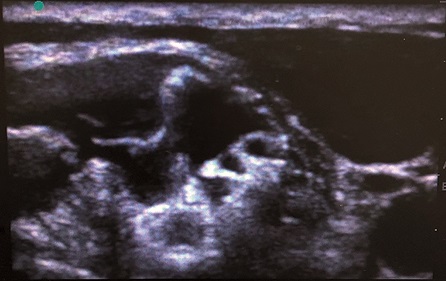
Figura 7. Nervios dorsal de la escápula y torácico largo: Se observa en el espesor del escaleno medio imágenes hiperecoicas en estrecha relación con el plexo braquial, las cuales se corresponden al nervio dorsal de la escápula y torácico largo. Ver referencias en imagen siguiente.
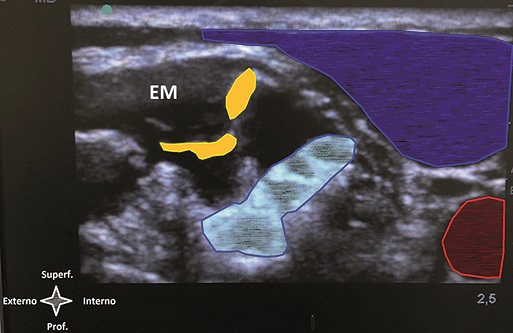
Figura 8. Identificación de los nervios dorsal de la escápula y torácico largo. Referencias: EM: Músculo escaleno medio. En rojo: Arteria carótida. Celeste: Plexo braquial. Amarillo: Nervio dorsal de la escápula (sup) – nervio torácico largo (inf). Azul: Vena yugular interna.
-
Avances en la reducción del impacto respiratorio del bloqueo interescalénico
Está establecido que el bloqueo interescalénico disminuye el consumo de opiáceos, mejora la satisfacción del paciente y acorta los tiempos de internación[15] en la cirugía de hombro, sin embargo, no es una práctica exenta de complicaciones. Urmey y cols[16], demostraron que esta técnica de anestesia regional tiene una incidencia de hasta un 100% de parálisis hemidiafragmática (PHD) ipsilateral, lo cual se asocia a una reducción de 27% de la capacidad vital forzada (CVF) y un 26,4% del volumen espiratorio forzado al primer segundo (VEF1)[17]. Desde el punto de vista gasométrico, Fujimura y cols.[18], observaron que la PHD posbloqueo interescalénico no provoca alteraciones significativas en la PaCo2, volumen tidal ni volumen minuto, no así en la PaO2 en la cual se observó una leve, aunque representativa, disminución (84,7 mmHg vs 78 mmHg). Estas alteraciones en la función pulmonar suelen ser bien toleradas por pacientes sanos, ya que están preparados para compensarlas a expensas de músculos respiratorios accesorios. Sin embargo, existen enfermos que no son incapaces de soportar dichas reducciones siendo éstos los que paradójicamente se beneficiarían aún más de las ventajas de esta técnica de anestesia regional en términos de manejo de vía aérea, uso de opiáceos, etc.
El mecanismo por el cual se produce el compromiso del nervio frénico tras un bloqueo interescalénico obedece a dos teorías[11]: migración rostral del anestésico local a través del surco interescalénico y/o difusión anteromedial del mismo por delante del escaleno anterior, que es por donde discurre el nervio frénico. Ambas podrían vincularse al sitio de inyección, volumen y difusión del anestésico local utilizado. El advenimiento de la ecografía en el campo de la anestesia regional ha permitido no solo visualizar el sitio donde se realiza el depósito del anestésico local, sino también la difusión del mismo. Desde entonces se han generado múltiples estudios destinados a disminuir la incidencia de PHD mediante la manipulación de las diferentes variables que podrían afectar el “desplazamiento del anestésico local” a lo largo del surco interescalénico, a saber:
• Presión proximal al sitio de punción.
• Volumen inyectado.
• Masa de droga (dosis).
• Sitio de inyección – tal como se señaló previamente, el plexo braquial y el nervio frénico se alejan entre sí conforme ambos elementos discurren caudalmente por la fosa supraclavicular.
En términos generales, múltiples investigaciones descartan la utilidad de la maniobra de presión proximal al sitio de punción para evitar la migración rostral de anestésico local[19]-[20], por lo cual es una práctica que ha caído en desuso. Sin embargo, la reducción de volúmenes a inyectar (volúmenes de hasta 5 ml según diversos autores[21]-[22]), la utilización de concentraciones más bajas de anestésico local[23] y la infiltración extrafascial del anestésico 4 mm lateral al plexo braquial (Palhais y cols[24]) sí han demostrado cierta utilidad en reducir la incidencia de PHD asociada al bloqueo interescalénico, aunque no logran evitarla por completo.
Más allá de que, según la evidencia, es posible disminuir la incidencia de bloqueo frénico relacionado a esta técnica de anestesia regional a valores tan bajos como un 20%[25], parece improbable anular por completo esta complicación, siendo un evento inherente a esta práctica[26]. Futuras investigaciones debieran orientarse al uso combinado de las diferentes variables que han demostrado efectividad (concentración, volumen, sitio de inyección) para demostrar si es posible reducir aún más el riesgo de aparición de esta entidad.
-
Técnicas alternativas de anestesia regional para cirugía de hombro
Como fue comentado previamente, el nervio frénico se aleja del plexo braquial conforme ambos avanzan en su recorrido hacia caudal; este hecho llevó a Renes y cols[27] plantear la hipótesis de que era posible un abordaje distal del plexo braquial a nivel interescalénico infiltrando dosis bajas de anestésico local a nivel de C7 con mínima repercusión sobre la función pulmonar. Para ello comparó 2 grupos de pacientes candidatos a cirugía de hombro, al primero de ellos le practicó el abordaje interescalénico clásico utilizando solo neuroestimulación (ropivacaína 0,75%-10 ml) mientras que en el segundo grupo se valió de la ecografía para depositar la misma dilución de anestésico local a nivel del borde posterolateral de C7, cercano a su origen, tomando como reparo la apófisis transversa de la vértebra homónima. Este estudio demostró un menor compromiso del nervio frénico al realizar el abordaje ecoguiado a nivel de C7 (13% vs 93%; p < 0,001), asociado a una dispersión más caudal del anestésico local, lo cual se correlacionó clínicamente con los dermatomas comprometidos al momento del examen físico, más aun, el consumo de opiáceos y los niveles de analgesia no demostraron diferencias estadísticamente significativas entre ambos grupos.
Ya en 2010, Renes y cols.[28], avanzan sobre estos resultados y diseñan un estudio de dosis buscando el VEM (Volumen Efectivo Mínimo) de ropivacaína 0,75% para alcanzar un bloqueo efectivo de C5 y C6 tras la infiltración ecoguiada de la raíz de C7. A su vez se evaluó por ecografía y pruebas funcionales espirométricas el impacto respiratorio de esta técnica. Finalmente, este estudio arroja como resultado un VEM50 de 2,9 ml (95% CI, 2,4-3,5 ml), llegándose a utilizar infiltraciones de hasta 6 ml. Lo interesante de este trabajo es que en ninguno de los 20 pacientes enrolados se constató afección del nervio frénico.
-
Bloqueo supraclavicular
El bloqueo del plexo braquial a nivel supraclavicular ha demostrado su utilidad como alternativa analgésica al bloqueo interescalénico en cirugía artroscópica de hombro[29 ]. Más aún en 2009, Renes y cols.[30 ], describen una ligera variación en el abordaje supraclavicular que evita el compromiso del nervio frénico. Esta modificación consistía en abordar el plexo braquial supraclavicular en sentido lateromedial a nivel del “corner pocket” en donde se depositaban 3 ml de ropivacaína 0,75% para luego depositar 17 ml de la misma dilución en el borde posterolateral del plexo (se buscaba que la difusión del anestésico local quedara caudal y posterolateral al plexo, sin dispersión rostral ni medial a la arteria subclavia). Con esta técnica, Renes y cols refieren una incidencia nula de PHD en cirugía de mano, antebrazo y codo.
Finalmente, en 2018 Aliste y cols.[31], combinan los conceptos antes propuestos, diseñando un estudio comparativo y randomizado del abordaje supraclavicular propuesto por Renes versus el bloqueo interescalénico ecoguiado clásico (en ambas técnicas se utilizó levobupivacaína 0,5% 20 ml + adrenalina 5 mcg/ml) para cirugía artroscópica de hombro. Los resultados muestran una mayor incidencia de PHD a favor del abordaje interescalénico (95% vs 9%, p < 0,001) y ninguna diferencia estadísticamente significativa en lo que respecta a consumo intraoperatorio y postoperatorio de opiáceos, EVN (Escala Verbal Numérica) en las primeras 24 h posoperatorias ni satisfacción del paciente.
Como conclusión, es posible decir que más allá de los resultados alentadores que se han obtenido en cuanto a la incidencia de parálisis frénica mediante el uso del bloqueo supraclavicular para la cirugía de hombro, su utilidad en este contexto quirúrgico es cuestionable ya que no garantiza indemnidad del sistema respiratorio. Por esta razón, su práctica debe ser sopesada cuidadosamente, ya que existiría riesgo de insuficiencia respiratoria, al menos durante el postoperatorio inmediato, en pacientes con patología respiratoria.
-
Bloqueos de nervios periféricos
Como mencionamos previamente, la articulación del hombro recibe inervación a partir de cinco componentes nerviosos: nervio supraescapular, nervios subescapulares, nervio pectoral lateral, nervio axilar y ramos supraclaviculares del plexo cervical superficial.
Se puede atribuir a Price y cols.[32] la descripción del bloqueo combinado del nervio axilar y nervio supraescapular como alternativa al bloqueo interescalénico en cirugía de hombro[26]. Tal como lo refieren sus autores, la “calidad analgésica” provista por este bloqueo combinado es menor cuando se lo comparaba con el bloqueo interescalénico[33]-[34] en este tipo de cirugías, lo cual queda evidenciado en términos de consumo de opiáceos durante el intra y posoperatorio, como así también en satisfacción del paciente. Esto se explica porque existen estructuras, como el manguito rotador, que no son cubiertas en su totalidad por el bloqueo conjunto del nervio axilar y supraescapular. Por este motivo, este bloqueo parece ser más útil en procedimientos artroscópicos menores como una acromioplastía[2 ]. Esta técnica tiene como gran punto a favor, su bajo riesgo de PHD, la cual al ser nula, se vuelve una opción más que óptima para pacientes con compromiso respiratorio en cirugía que involucren la articulación glenohumeral. Estudios futuros debieran apuntar a complementar esta técnica con el bloqueo del plexo cervical superficial y/o el pectoral lateral (PEC1 – bloqueo interpectoral tipo 1), con el fin de optimizar la calidad analgésica de este bloqueo en comparación a la provista por el abordaje interescalénico del plexo braquial.
-
Conclusión
El advenimiento del ultrasonido aplicado a la anestesia regional nos ha planteado múltiples desafíos en nuestra práctica diaria. Por un lado, demanda no solo un mayor conocimiento anatómico y manejo de nuevas tecnologías, sino también el dominio de destrezas manuales, que permitan hacer de nuestra práctica algo seguro y eficiente para nuestros pacientes. Sin embargo, el ultrasonido también nos ha permitido tener un conocimiento más cabal de la anestesia regional en sí. Tal es así como en estos últimos años han proliferado múltiples técnicas de anestesia regional, las cuales tienen algunas características en común:
• Buscan como objetivo, estructuras nerviosas cada vez más periféricas o sitio específicas.
• Se valen de planos tisulares que serían muy difíciles de identificar si no tuviéramos visualización de los mismos a través del ultrasonido.
• Son diseñadas a partir de necesidades cada vez más técnicas y precisas.
Estas tendencias se encuentran presentes hoy por hoy en el abordaje interescalénico del plexo braquial. Como se ha expuesto a lo largo de esta revisión, el ultrasonido ha redifinido nuestro entendimiento en torno a este bloqueo permitiéndonos comprender que la difusión del anestésico local es un concepto muy importante a la hora de prevenir el compromiso del nervio frénico. Siguiendo este concepto, se pudo descartar que la compresión digital proximal al sitio de punción pudiera evitar la difusión rostral del anestésico local, como así también permitió diseñar nuevas variantes las cuales, a través de la manipulación de los volúmenes o sitios de inyección evitarían la difusión del anestésico local hacia el nervio frénico. Más aun, el ultrasonido plantea nuevos desafíos al objetivar posibles complicaciones que pueden surgir de una mala interpretación de las imágenes (“signo del semáforo”), como así también nos demostró la necesidad de tener presente estructuras como el nervio dorsal de las escápula y/o el nervio torácico largo a la hora de realizar nuestros bloqueos para prevenir lesiones. Finalmente, la búsqueda continua de alternativas frente a “antiguas” complicaciones como la PHD, llevó a describir otros abordajes alternativos al bloqueo interescalénico, como son los bloqueos combinados de nervios periféricos los cuales representan una de las opciones más adecuadas para el paciente candidato a cirugía de hombro que no sea capaz de soportar una reducción en su función respiratoria.
Referencias
1. Borgeat A, Ekatodramis G. Anaesthesia for shoulder surgery. Best Pract Res Clin Anaesthesiol. 2002 Jun;16(2):211–25. https://doi.org/10.1053/bean.2002.0234 PMID:12491553
2. Bollini C. Bloqueo interescalénico del plexo braquial. Rev. Arg. Anest. 2004;62(6):410–9.
3. Winnie AP. Interscalene brachial plexus block. Anesth Analg. 1970 May-Jun;49(3):455–66. https://doi.org/10.1213/00000539-197005000-00029 PMID:5534420
4. Mariano ER, Loland VJ, Ilfeld BM. Interscalene perineural catheter placement using an ultrasound-guided posterior approach. Reg Anesth Pain Med. 2009 Jan-Feb;34(1):60–3. https://doi.org/10.1097/AAP.0b013e3181933af7 PMID:19258989
5. Maxim S. Eckmann. Cadaveric Study of the Articular Branches of the Shoulder Joint. Reg Anesth Pain Med. 2017;42:564–70. https://doi.org/10.1097/AAP.0000000000000652 PMID:28786899
6. Aszmann OC, Dellon AL, Birely BT, McFarland EG. Innervation of the human shoulder joint and its implications for surgery. Clin Orthop Relat Res. 1996 Sep;330:202–7. https://doi.org/10.1097/00003086-199609000-00027 PMID:8804294
7. Brown D. Atlas of Regional Anesthesia. 4th ed. Philadelphia (PA): Saunders Elsevier; 2010.
8. Moore CL. Ultrasound-guided procedures in emergency medicine. Ultrasound Clin. 2011;6(2):277–89. https://doi.org/10.1016/j.cult.2011.03.005.
9. Franco CD, Williams JM. Ultrasound-Guided Interscalene Block: Reevaluation of the “Stoplight” Sign and Clinical Implications. Reg Anesth Pain Med. 2016 Jul-Aug;41(4):452–9. https://doi.org/10.1097/AAP.0000000000000407 PMID:27203394
10. L. Aliaga. “Anestesia regional hoy”. 3 era Edición. 2006
11. Kessler J, Schafhalter-Zoppoth I, Gray AT. An ultrasound study of the phrenic nerve in the posterior cervical triangle: implications for the interscalene brachial plexus block. Reg Anesth Pain Med. 2008 Nov-Dec;33(6):545–50. https://doi.org/10.1097/00115550-200811000-00006 PMID:19258969
12. Hanson NA, Auyong DB. Systematic ultrasound identification of the dorsal scapular and long thoracic nerves during interscalene block. Reg Anesth Pain Med. 2013 Jan-Feb;38(1):54–7. https://doi.org/10.1097/AAP.0b013e31826f0a63 PMID:23080352
13. Hardman D. Nerve injury after peripheral nerve block: Bests Practices and Medical-Legal Protection Strategies. Anesthesiology News July, 2015
14. Lee LA, Posner KL, Kent CD, Domino KB. Complications associated with peripheral nerve blocks: lessons from the ASA Closed Claims Project. Int Anesthesiol Clin. 2011;49(3):56–67. https://doi.org/10.1097/AIA.0b013e31821a0294 PMID:21697670
15. Abdallah FW, Halpern SH, Aoyama K, Brull R. Will the real benefits of single-shot interscalene block please stand up? A systematic review and meta-analysis. Anesth Analg. 2015 May;120(5):1114–29. https://doi.org/10.1213/ANE.0000000000000688 PMID:25822923
16. Urmey WF, Talts KH, Sharrock NE. One hundred percent incidence of hemidiaphragmatic paresis associated with interscalene brachial plexus anesthesia as diagnosed by ultrasonography. Anesth Analg. 1991 Apr;72(4):498–503. https://doi.org/10.1213/00000539-199104000-00014 PMID:2006740
17. Urmey WF, McDonald M. Hemidiaphragmatic paresis during interscalene brachial plexus block: effects on pulmonary function and chest wall mechanics. Anesth Analg. 1992 Mar;74(3):352–7. https://doi.org/10.1213/00000539-199203000-00006 PMID:1539813
18. Fujimura N, Namba H, Tsunoda K, Kawamata T, Taki K, Igarasi M, et al. Effect of hemidiaphragmatic paresis caused by interscalene brachial plexus block on breathing pattern, chest wall mechanics, and arterial blood gases. Anesth Analg. 1995 Nov;81(5):962–6. PMID:7486085
19. Urmey WF, Grossi P, Sharrock NE, Stanton J, Gloeggler PJ. Digital pressure during interscalene block is clinically ineffective in preventing anesthetic spread to the cervical plexus. Anesth Analg. 1996 Aug;83(2):366–70. https://doi.org/10.1213/00000539-199608000-00028 PMID:8694320
20. Bennani SE, Vandenabele-Teneur F, Nyarwaya JB, Delecroix M, Krivosic-Horber R. An attempt to prevent spread of local anaesthetic to the phrenic nerve by compression above the injection site during the interscalene brachial plexus block. Eur J Anaesthesiol. 1998 Jul;15(4):453–6. https://doi.org/10.1097/00003643-199807000-00011 PMID:9699103
21. Riazi S, Carmichael N, Awad I, Holtby RM, McCartney CJ. Effect of local anaesthetic volume (20 vs 5 ml) on the efficacy and respiratory consequences of ultrasound-guided interscalene brachial plexus block. Br J Anaesth. 2008 Oct;101(4):549–56. https://doi.org/10.1093/bja/aen229 PMID:18682410
22. Lee JH, Cho SH, Kim SH, Chae WS, Jin HC, Lee JS, et al. Ropivacaine for ultrasound-guided interscalene block: 5 mL provides similar analgesia but less phrenic nerve paralysis than 10 mL. Can J Anaesth. 2011 Nov;58(11):1001–6. https://doi.org/10.1007/s12630-011-9568-5 PMID:21858614
23. Thackeray EM, Swenson JD, Gertsch MC, Phillips KM, Steele JW, Burks RT, et al. Diaphragm function after interscalene brachial plexus block: a double-blind, randomized comparison of 0.25% and 0.125% bupivacaine. J Shoulder Elbow Surg. 2013 Mar;22(3):381–6. https://doi.org/10.1016/j.jse.2012.06.011 PMID:22947235
24. Palhais N, Brull R, Kern C, Jacot-Guillarmod A, Charmoy A, Farron A, et al. Extrafascial injection for interscalene brachial plexus block reduces respiratory complications compared with a conventional intrafascial injection: a randomized, controlled, double-blind trial. Br J Anaesth. 2016 Apr;116(4):531–7. https://doi.org/10.1093/bja/aew028 PMID:26994230
25. Boezaart AP, de Beer JF, du Toit C, van Rooyen K. A new technique of continuous interscalene nerve block. Can J Anaesth. 1999 Mar;46(3):275–81. https://doi.org/10.1007/BF03012610 PMID:10210055
26. De QH. Tran, Maria Francisca Elgueta, Julian Aliste, Roderick J. Finlayson. Diaphragm-Sparing Nerve Blocks for Shoulder Surgery. Reg Anesth Pain Med. 2017;42(1):32–8. https://doi.org/10.1097/AAP.0000000000000529.
27. Renes SH, Rettig HC, Gielen MJ, Wilder-Smith OH, van Geffen GJ. Ultrasound-guided low-dose interscalene brachial plexus block reduces the incidence of hemidiaphragmatic paresis. Reg Anesth Pain Med. 2009 Sep-Oct;34(5):498–502. https://doi.org/10.1097/AAP.0b013e3181b49256 PMID:19920426
28. Renes SH, van Geffen GJ, Rettig HC, Gielen MJ, Scheffer GJ. Minimum effective volume of local anesthetic for shoulder analgesia by ultrasound-guided block at root C7 with assessment of pulmonary function. Reg Anesth Pain Med. 2010 Nov-Dec;35(6):529–34. https://doi.org/10.1097/AAP.0b013e3181fa1190 PMID:20975468
29. Finlayson RJ, Etheridge JP, Chalermkitpanit P, Tiyaprasertkul W, Nelems B, Tran DQ, et al. Real time detection of periforaminal vessels in the cervical spine: an ultrasound survey. Reg Anesth Pain Med. 2016 Mar-Apr;41(2):130–4. https://doi.org/10.1097/AAP.0000000000000363 PMID:26866297
30. Renes SH, Spoormans HH, Gielen MJ, Rettig HC, van Geffen GJ. Hemidiaphragmatic paresis can be avoided in ultrasound-guided supraclavicular brachial plexus block. Reg Anesth Pain Med. 2009 Nov-Dec;34(6):595–9. https://doi.org/10.1097/AAP.0b013e3181bfbd83 PMID:19916254
31. Aliste J, Bravo D, Fernández D, Layera S, Finlayson RJ, Tran DQ. A Randomized Comparison Between Interscalene and Small-Volume Supraclavicular Blocks for Arthroscopic Shoulder Surgery. Reg Anesth Pain Med. 2018 Aug;43(6):590–5. https://doi.org/10.1097/AAP.0000000000000767 PMID:29630033
32. Price DJ. The shoulder block: a new alternative to interscalene brachial plexus blockade for the control of postoperative shoulder pain. Anaesth Intensive Care. 2007 Aug;35(4):575–81. https://doi.org/10.1177/0310057X0703500418 PMID:18020078
33. Pitombo PF, Meira Barros R, Matos MA, Pinheiro Módolo NS. Selective suprascapular and axillary nerve block provides adequate analgesia and minimal motor block. Comparison with interscalene block. Braz J Anesthesiol. 2013 Jan-Feb;63(1):45–51. https://doi.org/10.1016/j.bjane.2012.04.002 PMID:23438800
34. Dhir S, Sondekoppam RV, Sharma R, Ganapathy S, Athwal GS. A comparison of combined suprascapular and axillary nerve blocks to interscalene nerve block for analgesia in arthroscopic shoulder surgery: an equivalence study. Reg Anesth Pain Med. 2016 Sep-Oct;41(5):564–71. https://doi.org/10.1097/AAP.0000000000000436 PMID:27380105

 ORCID
ORCID


 Creative Commons Attribution
Creative Commons Attribution