Renato Chacón A. 1 , Luciano González J. 2 y Carlos Montalbán R. 3
Rev Chil Anest Vol. 39 Núm. 2 pp. 141-151|doi:
PDF|ePub|RIS
La cirugía de vía aérea superior enfrenta al anestesiólogo a un problema agregado: tener que compartirla con el resto del equipo quirúrgico. La presencia del cirujano trabajando en ella, priva inevitablemente al anestesista de la autonomía en el manejo de un terreno que siente como propio, y dificulta la consecución de dos objetivos habituales en nuestra práctica: obtener una buena oxigenación y en lo posible también una buena ventilación.
Los procedimientos involucrados son de carácter quirúrgico y no quirúrgico y se realizan con fines diagnósticos y/o terapéuticos. Dentro de ellos, hay algunos como la traqueostomía, de común realización en muchos hospitales y por lo mismo habitual para muchos anestesistas, así como hay otros que se realizan en hospitales de sub-especialidad o que siendo procedimientos comunes, en general no requieren asistencia de un anestesista, salvo en situaciones especiales. Dentro de ellos podemos incluir:
-
Fibrobroncoscopía.
-
Broncoscopía rígida.
-
Resección y reconstrucción traqueal.
Dado el carácter diverso de estos procedimientos, las alternativas de abordaje y control de la vía aérea por parte del anestesiólogo son también diversas e involucran soluciones simples en algunos casos y más complejas en otros.
I- FIBROBRONCOSCOPÍA
La fibrobroncoscopía es habitualmente realizada bajo efecto de una sedación suave regulada por el propio neumotisiólogo y en ventilación espontánea, de manera que los escasísimos casos en que este procedimiento requiere de la asistencia de un anestesiólogo son aquellos en que la complejidad del procedimiento es mayor o en que la patología asociada del paciente hace el examen más riesgoso.
De la combinación de ambas circunstancias se deduce que la intervención del anestesiólogo se requerirá cuando el procedimiento implique mayor riesgo de hipoventilación e hipoxia o cuando éstas sean peor toleradas por el paciente.
La ventilación jet de alta frecuencia se ha utilizado exitosamente como alternativa de control de la vía aérea en procedimientos fibrobroncoscópicos diagnósticos y terapéuticos 1 , 2 . Se realiza introduciendo en la tráquea, en forma paralela al fibrobroncoscopio, un delgado catéter que será el encargado de inyectar al árbol traqueobronquial una mezcla con alta FiO2, sin estorbar en la realización del examen. Ese flujo de gases frescos ayudará a mantener una saturación de oxígeno arterial adecuada a través de mecanismos que serán descritos posteriormente.
No contando con esta tecnología, las alternativas existentes para controlar la ventilación del paciente son la intubación traqueal o el uso de máscara laríngea, realizando la fibrobroncoscopía a través del lumen de cualquiera de ellos 3 , 4 .
Para efectos de la realización del examen, la única diferencia entre ambas alternativas es que el uso de una máscara laríngea expone la vía aérea desde las mismas cuerdas vocales, mientras que el tubo traqueal lo hace desde varios centímetros por debajo de la glotis.
Ventilar al paciente en paralelo a la realización del examen, exige el uso de una pieza en T con una conexión lateral para el circuito anestésico y una abertura en el plano longitudinal por donde se pueda introducir el fibrobroncoscopio. Una buena alternativa es el uso de un codo de ventilación de un tubo de doble lumen, cuya abertura longitudinal posee un diafragma de goma con un pequeño orificio circular, destinado al paso de sondas de aspiración. El fibrobroncoscopio franquea el diafragma a través de dicho orificio, obteniéndose un razonable sello de la vía aérea, que permite realizar ventilación a presión positiva con mínima pérdida de gases hacia el ambiente (Figura 1).
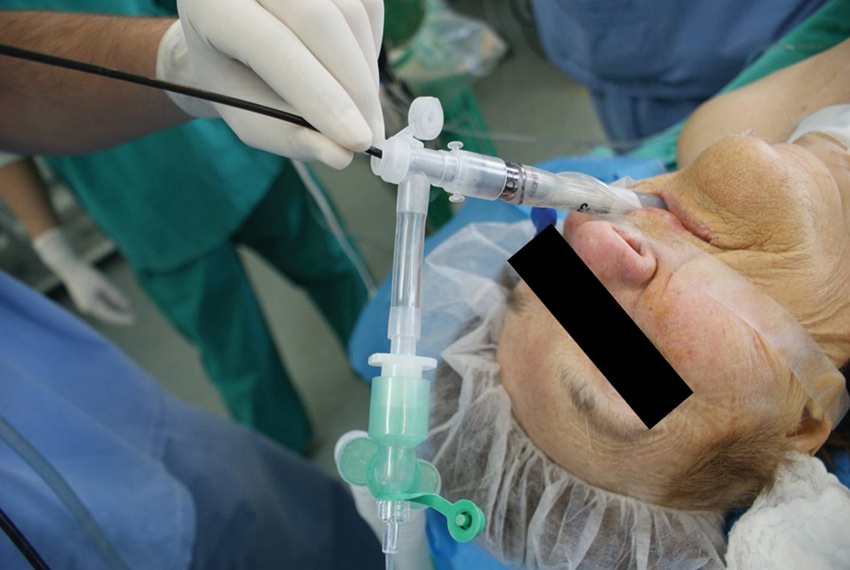
Figura 1 Fibrobroncoscopía a través de una máscara laríngea. Uso de una conección en T de un tubo de doble lumen para ventilar al paciente.
II- ASPECTOS CLÍNICOS DE LAS LESIONES TRAQUEALES
La broncoscopía rígida y la resección y reconstrucción traqueal son procedimientos que involucran lesiones complejas, respecto de las cuales se debe conocer su etiología, su clínica y las alternativas de evaluación preoperatoria y manejo intraoperatorio.
Exceptuando el trauma del árbol traqueo-bronquial, el resto de las lesiones son en general de tipo obstructivo, y la cirugía consiste en dilatar o resecar la zona que produce dicha obstrucción. Estas lesiones son denominadas fijas, cuando obstruyen la vía aérea de igual modo en inspiración o espiración, o variables, cuando acentúan o reducen la obstrucción en diferentes períodos del ciclo respiratorio. Su etiología es variada e incluye: lesiones congénitas, tumorales (Figura 2), daño postintubación (Figura 3), traumáticas, secundarias a enfermedades infecciosas y sistémicas. Dentro de este amplio espectro, lejos la lesión más frecuente es la estenosis post-intubación, pese a que su incidencia ha disminuido desde la introducción de tubos endotraqueales con cuff de alto volumen y baja presión 5 .
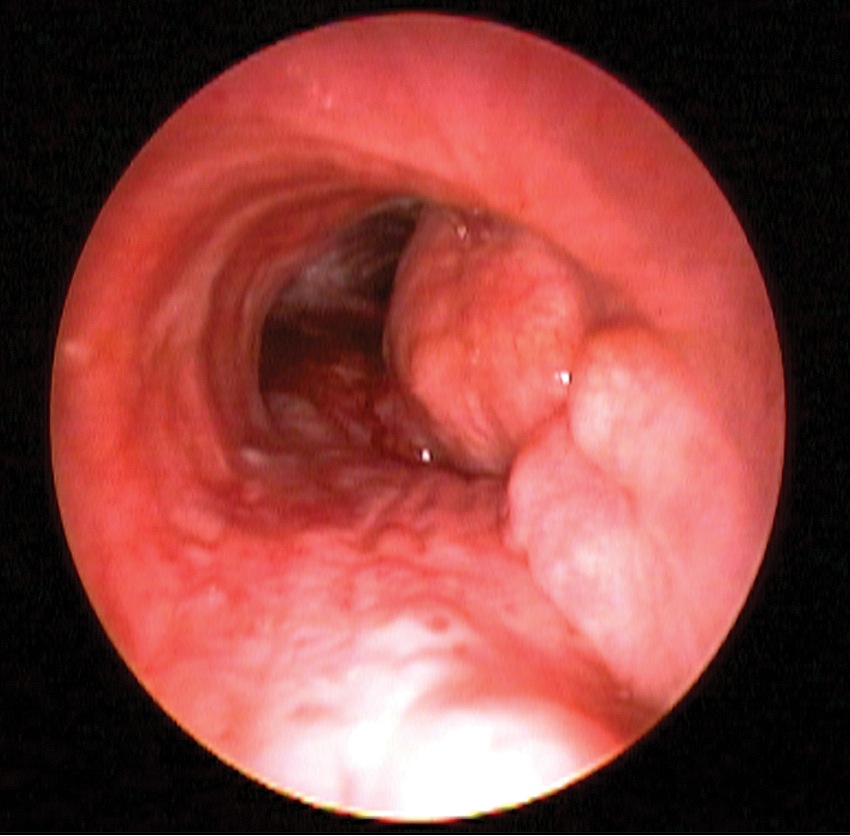
Figura 2 Tumor endotraqueal.
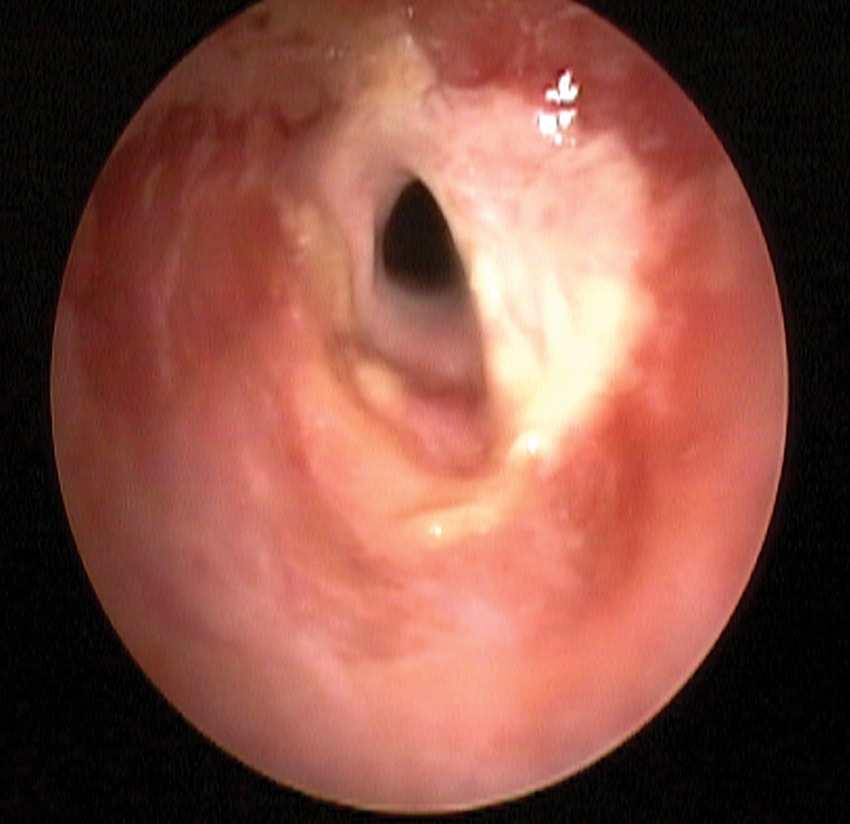
Figura 3 Estenosis traqueal postintubación.
El año 2004, Wright y Grillo publicaron una extensa serie de 901 pacientes sometidos a resección traqueal entre los años 1975 y 2003: 589 de ellos presentaban una lesión estenótica postintubación 6 . Clínicamente, estos pacientes pueden presentar una historia de disnea progresiva, dificultad para expectorar, hemoptisis, tos persistente, nula respuesta al tratamiento broncodilatador y por cierto el antecedente de haber tenido una intubación traqueal previa, que pudiera haber producido el daño. También puede existir disfagia y disfonía, si la lesión compromete un nervio laríngeo recurrente. Al examen físico se pueden encontrar signos inespecíficos como disnea, sibilancias y uso de musculatura accesoria. La aparición de estridor con el ejercicio se correlaciona con un diámetro traqueal del segmento estenótico inferior a 8 mm y en caso de estridor de reposo se puede presumir un diámetro aún inferior a 5 mm 7 . En consecuencia, la vía aérea de un paciente con estridor de reposo debe ser manejada con sumo cuidado y obliga a contar con todos los elementos necesarios para enfrentar un escenario de emergencia.
El estudio preoperatorio debe incluir análisis de función pulmonar e imágenes radiológicas. Dentro de los análisis de función pulmonar, el más útil es la curva de flujo-volumen, que de acuerdo a los niveles de flujo inspiratorio-espiratorio obtenidos, permite categorizar la lesión en tres tipos: fija, variable extratorácica o variable intratorácica (Figura 4).
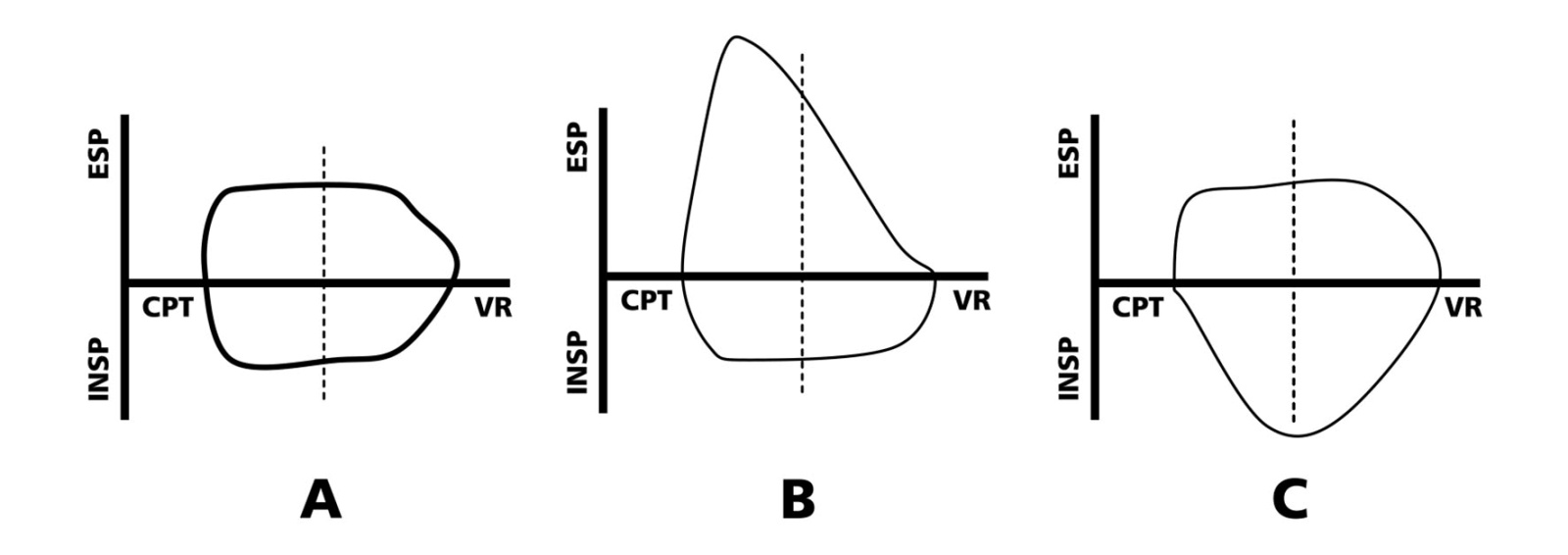
Figura 4 Curva de flujo volumen. De acuerdo a la disminución del flujo inspiratorio y/o espiratorio, se puede clasificar la lesión en: A – Lesión fija; B – Lesión variable extratorácica; C – Lesión variable intratorácica.
Esta categorización es importante para predecir el comportamiento que puede tener la lesión cuando es sometida a variación de las presiones intra y extraluminales: la predicción de un eventual empeoramiento de la estenosis, de acuerdo a la relación entre estas presiones, puede finalmente hacernos optar por determinado tipo de inducción anestésica (ventilación a presión positiva vs ventilación espontánea).
El estudio radiológico, permite categorizar la lesión de acuerdo a su cuantía y ubicación. La radiografía de tórax puede mostrar una tráquea estenótica (Figura 5), sin embargo, las lesiones obstructivas pueden pasar fácilmente desapercibidas.
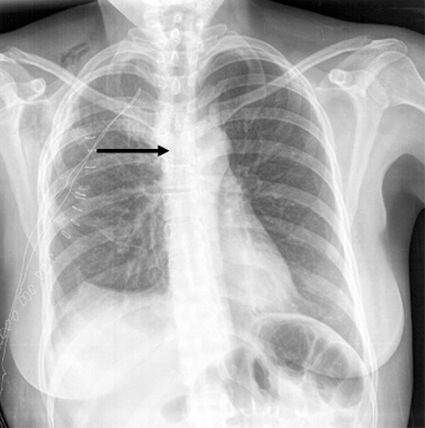
Figura 5 Estenosis de la tráquea intratorácica en una radiografía de tórax.
La tomografía computarizada en cambio, no sólo permite un diagnóstico exacto de la localización y severidad de la estenosis (Figura 6), sino también permite evaluar el compromiso extratraqueal de las lesiones tumorales.
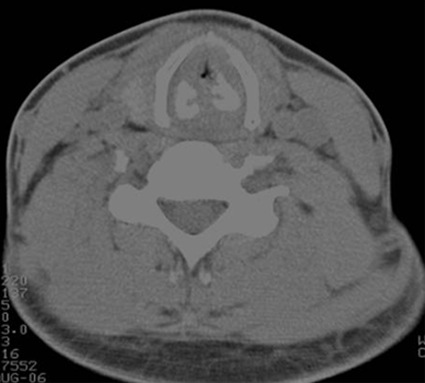
Figura 6 Estenosis severa de tráquea cervical en TAC de cuello.
Todos los pacientes portadores de lesiones traqueales requerirán estudio broncoscópico para hacer un diagnóstico exacto de la naturaleza de la lesión (biopsia), localización, longitud y grado de obstrucción. Además, con el paciente respirando espontáneamente, permitirá identificar zonas de traqueomalacia.
La fibrobroncoscopía permite gran parte de este diagnóstico bajo anestesia local y sedación, sin embargo, se debe tener en consideración que obstrucciones severas pueden verse agravadas producto de edema, sangrado, inflamación o por la propia presencia del fibrobroncoscopio en el lumen estrecho.
La broncoscopía rígida en cambio, continúa siendo el gold standard por varias razones:
-
El broncoscopio posee un lumen amplio a través del cual se puede realizar extirpación de tumores o cuerpos extraños.
-
A través del mismo lumen se puede realizar hemostasia y aspiración de secreciones en forma más efectiva.
-
El paso del broncoscopio rígido, por si sólo, constituye una maniobra dilatadora de la estenosis, que si bien suele no ser definitiva, muchas veces se utiliza como método de resolución de la emergencia, en espera de la cirugía de resección traqueal 8 .
La realización de broncoscopía rígida, sea en forma diferida o inmediatamente previo a la cirugía de resección traqueal, requiere inevitablemente de anestesia general, y por lo tanto, nos enfrenta al dilema de cómo realizar una inducción segura, disminuyendo el riesgo de perder la vía aérea.
En la literatura existen muchas publicaciones sugiriendo distintas alternativas de inducción anestésica en este tipo de pacientes: endovenosa con bloqueo neuromuscular 9 – 17 , inhalatoria en ventilación espontánea 7 , 18 , 19 e incluso con circulación extracorpórea preparada y canulación femoral preparada 10 . Sin embargo, el grueso de estas publicaciones involucra un pequeño número de pacientes o son reportes de casos aislados, de manera que es difícil, en base a estos datos, decidir cuál debe ser la conducta correcta. Además, para prácticamente todas estas técnicas existen publicaciones que, en sentido contrario, reportan pérdida del control de la vía aérea 20 , 21 .
Hay varios ejemplos de drogas que pueden tener efectos contrapuestos:
-
En pacientes con estenosis traqueales moderadas, un nivel de sedación suave puede permitir menor hiperventilación y con ello menos resistencia de la vía aérea, pero en estenosis severas la depresión respiratoria asociada puede desembocar en una emergencia respiratoria.
-
Los antisialogogos pueden ser beneficiosos, si evitan el exceso de secreciones en el árbol traqueobronquial, pero del mismo modo pueden secar las secreciones existentes, produciendo un tapón de mucus que obstruya el pequeño lumen remanente a nivel de la estenosis.
III – BRONCOSCOPÍA RÍGIDA
La broncoscopía rígida se realiza a través de un tubo metálico que permite utilizar su lumen como canal de trabajo introduciendo pinzas, succión y otros implementos (Figura 7).
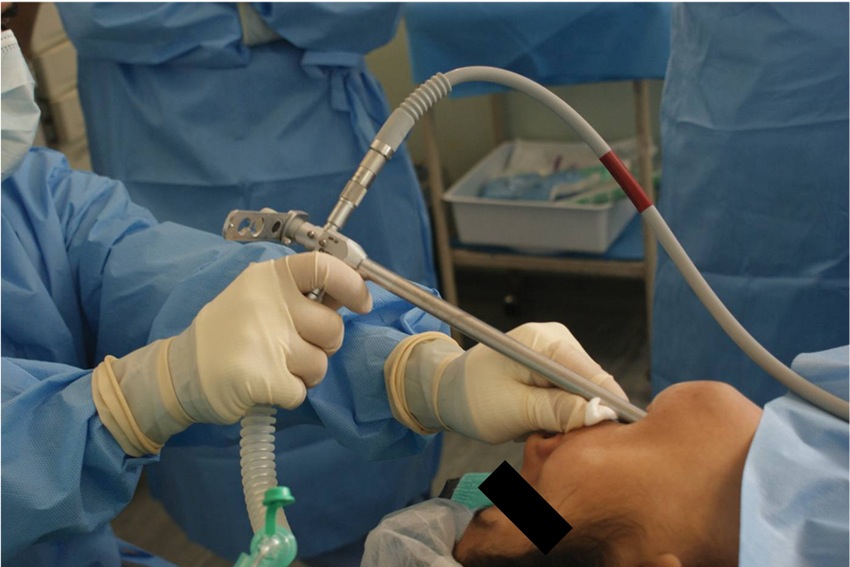
Figura 7 Broncoscopía rígida.
Como se señaló, muchas veces es el mismo paso del broncoscopio rígido el que sirve como maniobra para dilatar en forma bastante cruenta la zona estenótica. Sin embargo, disponer de un lumen amplio permite realizar otro tipo de maniobras terapéuticas (Tabla 1).
Tabla 1 Procedimientos que se realizan a través del lumen del broncoscopio rígido
|
– Diagnóstico |
|
– Dilatación de la vía aérea |
|
– Extracción de cuerpos extraños |
|
– Extirpación de tumores |
|
– Electrocauterización |
|
– Coagulación argón-plasma |
|
– Terapia láser |
|
– Terapia fotodinámica |
|
– Crioterapia |
|
– Instalación y remoción de stent |
Durante la broncoscopía rígida, el circuito de la máquina de anestesia se puede conectar al extremo proximal del broncoscopio, haciendo pasar el flujo de gases a través de un delgado tubo metálico que va por dentro de su lumen y que libera el flujo de gases en su extremo distal (Figura 8).
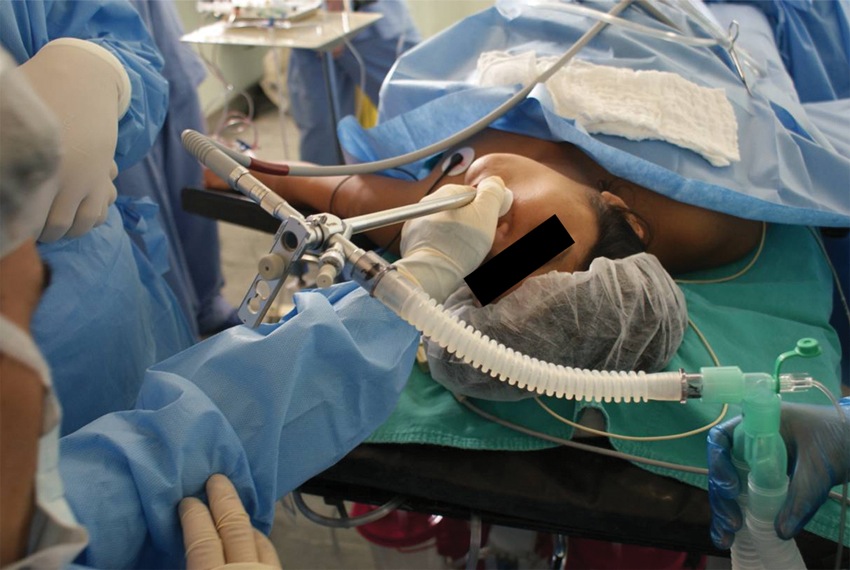
Figura 8 Circuito de la máquina de anestesia conectado al broncoscopio.
De este modo se puede realizar ventilación a presión positiva intermitente. Sin embargo, respecto a esta técnica de ventilación se deben tener en cuenta los siguientes aspectos:
-
El estímulo que produce la introducción del broncoscopio rígido en la vía aérea es muy intenso, por lo que requiere de un nivel profundo de anestesia y de bloqueo neuromuscular 22 , y no es posible realizar bajo ventilación espontánea.
-
El broncoscopio cuenta con un visor transparente que permite sellar el lumen de trabajo (Figura 9). Sin embargo, cuando se trabaja a través del lumen se debe abrir este visor (Figura 10), haciendo imposible realizar ventilación a presión positiva.
-
Aun manteniendo el lumen cerrado, el broncoscopio nunca sella completamente la vía aérea, puesto que no posee cuff, por lo tanto, la ventilación a presión positiva intermitente suele ser difícil, perdiéndose mucho gas fresco hacia el ambiente.
-
En estas condiciones, es posible recurrir al uso de métodos de ventilación aplicables en vía aérea abierta. Éstos incluyen la ventilación jet de baja frecuencia (LFJV), también denominada ventilación jet manual 23 y la ventilación de alta frecuencia en cualquiera de sus modalidades: ventilación a presión positiva de alta frecuencia (HFPPV) 24 , ventilación jet de alta frecuencia (HFJV) y ventilación oscilatoria de alta frecuencia (HFOV) 25 .
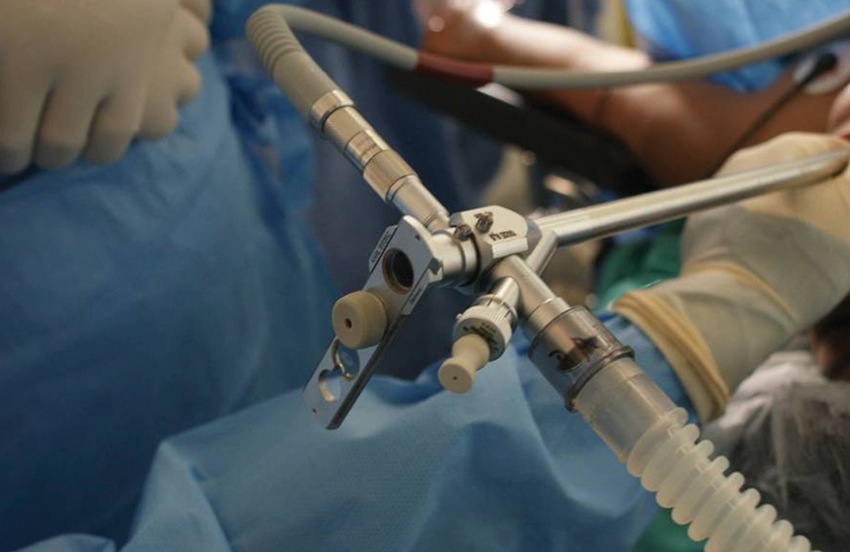
Figura 9 Broncoscopio rígido con el lumen de trabajo cerrado por el visor transparente.
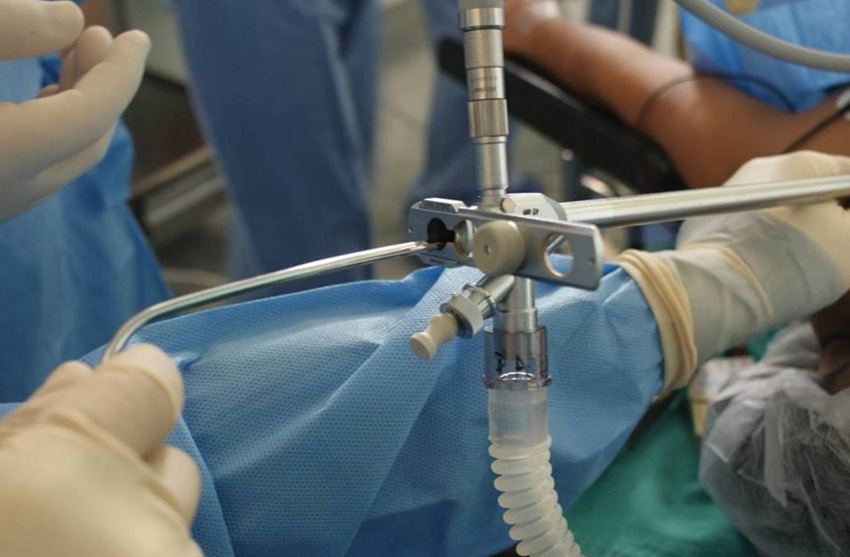
Figura 10 Broncoscopio rígido con el lumen de trabajo abierto para permitir el paso de un implemento de aspiración.
IV – MÉTODOS DE VENTILACIÓN EN VÍA AÉREA ABIERTA
Los métodos de ventilación enumerados previamente han sido utilizados en broncoscopía rígida, en cirugía de resección traqueal y en cirugía de resección pulmonar 23 – 32 . Algunos de ellos, como la ventilación oscilatoria de alta frecuencia, también han sido utilizados en pacientes con falla pulmonar catastrófica, en que la ventilación mecánica convencional no es efectiva o somete al paciente a un riesgo muy alto de barotrauma 33 , 34 .
En general, todos estos tipos de ventilación requieren una fuente de oxígeno de alta presión y cánulas de insuflación angostas y de baja compliance, que permitan que los pequeños volúmenes de gas que se están movilizando (en algunos casos inferiores al espacio muerto anatómico) ingresen efectivamente hacia el árbol traqueo-bronquial. Además, en caso de ventilación prolongada, se requiere un sistema de humidificación del gas para evitar desecar la mucosa respiratoria.
Con sus variaciones, los patrones respiratorios usados se caracterizan por frecuencias altas, volúmenes bajos, tiempos espiratorios cortos que producen algún grado de atrapamiento aéreo, pulmones constantemente distendidos con presiones de vía aérea constantemente positivas y presiones peak de vía aérea bajas.
-
Ventilación jet de baja frecuencia:
El sistema consta de una conexión a una fuente de oxígeno de alto flujo, una válvula manual y una manguera de baja compliance, que se conecta al broncoscopio o a un catéter que libera el flujo de gas en la vía aérea del paciente (Figura 11). Mientras la válvula está cerrada, el sistema acumula presión; cuando se abre la válvula, se libera el jet de oxígeno (Figura 12).
Este sistema es extremadamente simple y por lo mismo fácil de usar en procedimientos de corta duración, sin embargo siendo manual, sus parámetros ventilatorios son eminentemente variables, dependiendo del tiempo y de la frecuencia de apertura de la válvula. Considerando esto, y que no es posible medir la presión de vía aérea distal al jet, se debe tener en cuenta que en caso de estenosis severas de tráquea el paso de un catéter o del broncoscopio puede dejar prácticamente sellada la vía aérea con el consiguiente riesgo de PEEP inadvertido y de barotrauma.
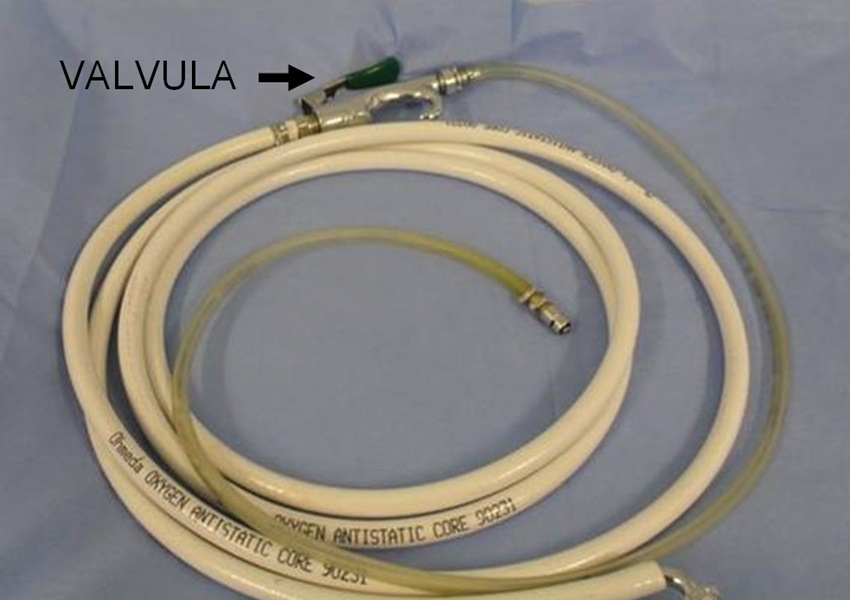
Figura 11 Sistema de ventilación jet de baja frecuencia.
Figura 12 Ventilación jet de baja frecuencia (control manual) en broncoscopía rígida.
-
Ventilación a presión positiva de alta frecuencia:
Fue el primer sistema de ventilación de alta frecuencia usado para cirugía mayor de vía aérea 24 . Este tipo de ventilación se puede realizar cambiando los parámetros de un ventilador convencional, elevando la frecuencia respiratoria a 50 a 60/minuto y disminuyendo el volumen corriente a 3 a 5 ml·kg-1, siempre teniendo en cuenta que el sistema de cánulas debe tener un espacio muerto pequeño y una compliance baja.
-
Ventilación jet de alta frecuencia:
Utiliza una consola de control neumático o electrónico. No existe una programación óptima de los patrones ventilatorios. Estos deben ser ajustados caso a caso de acuerdo a las condiciones de oxigenación obtenidas. En general, el volumen corriente varía entre 2 y 4 ml·kg-1, la frecuencia respiratoria entre 100 y 400 ciclos/minuto y el tiempo inspiratorio entre 20 y 40% del total del ciclo.
-
Ventilación oscilatoria de alta frecuencia:
Este sistema utiliza una compleja consola que entrega volúmenes cercanos a 1 ml·kg-1 a frecuencias de hasta 50 hertz (3.000 ciclos por minuto). En estas condiciones es un pistón el que hace oscilar el gas en forma sinusoidal, asumiendo en forma activa el control de ambas fases del ciclo (inyección y retiro del gas desde la vía aérea).
-
Principios de transporte de gas durante la ventilación de alta frecuencia
En ventilación espontánea y en ventilación mecánica convencional, en que el volumen corriente que se moviliza es muy superior al volumen del espacio muerto anatómico, el flujo de masa convectivo es el responsable principal del movimiento de gas hacia y desde los alvéolos.
En la ventilación oscilatoria de alta frecuencia, en que el volumen corriente es inferior al espacio muerto anatómico, hay una combinación de mecanismos que contribuyen al transporte final del gas hacia los alvéolos 35 , 36 . Muy probablemente, estos mecanismos juegan un rol variable en todos los tipos de ventilación jet o de alta frecuencia. Estos mecanismos son:
-
Flujo axial de masas: Por efecto del roce molecular, la inyección del jet de gas con alta fracción inspirada de oxígeno arrastra hacia los alvéolos el gas que se encuentra detenido en la tráquea, produciendo ventilación alveolar directa con un volumen mayor y una fracción inspirada menor que la del jet original. Este fenómeno probablemente sólo está involucrado en la ventilación de las unidades alveolares proximales.
-
Efecto Pendelluft: Explica la redistribución de gas entre unidades alveolares que poseen distintas constantes de tiempo de inflación y deflación.
-
Dispersión de Taylor: Ocurre cuando ramificaciones del árbol traqueobronquial producen dispersión turbulenta de gas.
-
Mezcla cardiogénica: Es la contribución a la mezcla de gas que ejerce la agitación mecánica producida por el latido cardiaco.
-
Perfil de velocidad asimétrica: Se denomina así al movimiento de gas en el centro de la vía aérea en dirección opuesta al gas cercano a la pared de la misma.
-
Difusión molecular: Es la movilización de moléculas entre diferentes zonas del árbol traqueobronquial por simple diferencia de concentración.
V- RESECCIÓN Y RECONSTRUCCIÓN TRAQUEAL
Tratándose de la misma lesión y siendo la broncoscopía rígida muchas veces el paso previo a la resección traqueal, todas las consideraciones anestésicas previamente señaladas que dicen relación con la evaluación preoperatoria, la inducción anestésica y el control de la vía aérea tienen el mismo valor en este escenario.
Se debe considerar, como señala Pinsonneault 7 , que en cirugía de resección traqueal, el anestesiólogo debe proveer adecuada ventilación y oxigenación a un paciente que tendrá una “vía aérea crítica” en el preoperatorio, luego una “vía aérea abierta” en el intraoperatorio y finalmente una “vía aérea precaria” en el postoperatorio, producto del edema e inflamación derivado de la manipulación y de la posición de flexión cervical en que se debe mantener a estos pacientes por los siguientes 7 a 10 días para evitar la tracción de la sutura.
La literatura reporta diferentes formas de controlar la vía aérea. Ello incluye el uso de tubo endotraqueal, máscara laríngea, broncoscopio rígido y ventilación jet en cualquiera de sus modalidades37.
Igualmente, la literatura reporta interesantes combinaciones de estos implementos para lograr una adecuada ventilación en las diferentes etapas de la cirugía: Adelsmayr 38 , publica su experiencia utilizando una máscara laríngea para ventilar al paciente previo a la apertura de la tráquea, insertando un catéter a través de la misma máscara hacia distal de la lesión para realizar ventilación jet durante el período de tráquea abierta y continuando con la máscara laríngea una vez concluida la sutura traqueal; Mentzelopuolos 39 describe su técnica insertando un tubo 6,0 por sobre la estenosis, pasando un catéter de Fogarty a distal de la lesión y utilizando un fibrobroncoscopio como guía para pasar el tubo más allá de la lesión mientras el balón del Fogarty se mantiene inflado para evitar el desplazamiento hacia los pulmones de sangre o restos de tumor provenientes del paso cruento del tubo por la zona estenótica.
Nuevamente, éstas y otras experiencias publicadas, son reportes de casos que aportan ingeniosas alternativas, pero que no sirven para establecer un patrón de conducta.
La técnica de intubación traqueal y ventilación a presión positiva es lejos la más utilizada para cirugía de tráquea. Inicialmente, el anestesista ubicaba el tubo por encima de la lesión estenótica y una vez abierta la tráquea el tubo era empujado a través de la estrechez, mientras el cirujano lo posicionaba en la tráquea distal. Esta técnica tenía varios inconvenientes: desplazaba restos de tumor y sangre, contaminaba el lecho quirúrgico con un tubo que había pasado por la boca y colocaba un elemento extraño estorbando para la realización de la sutura.
En 1969, Geffin 18 describió una forma distinta de realizar lo mismo, evitando todos estos inconvenientes, técnica que hasta el día de hoy es ampliamente usada por ser segura y extremadamente simple: la intubación traqueal distal con ventilación a presión positiva intermitente (Figura 13).
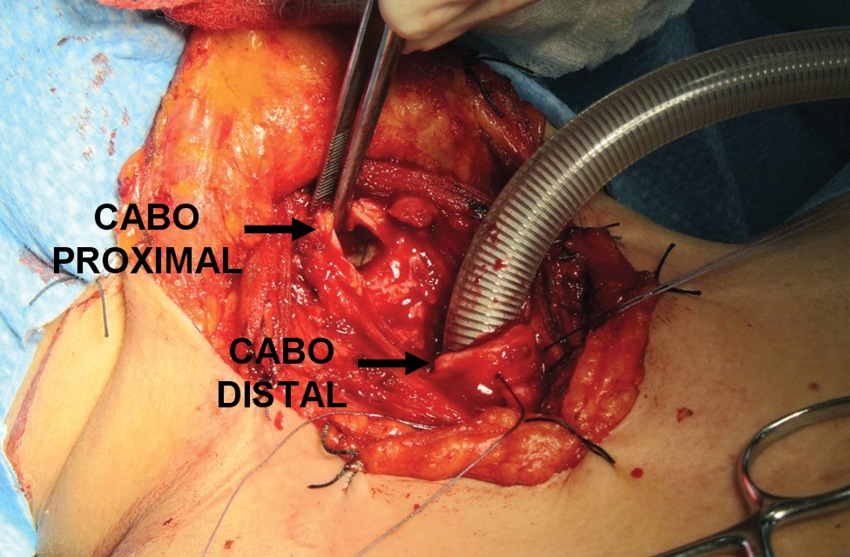
Figura 13 Intubación del cabo distal en resección de tráquea.
La técnica consta de los siguientes pasos:
-
Se intuba al paciente dejando el extremo distal por sobre la estenosis (Figura 14 A). La presión de vía aérea en el circuito anestésico será alta, pero sólo refleja la situación proximal a la estenosis, por lo que el anestesista debe tolerar dichas presiones en cuanto permitan una adecuada ventilación y oxigenación del paciente. Del mismo modo, se debe estar atento a que durante este período una estenosis crítica no se transforme en obstrucción total de la vía aérea, producto del desplazamiento de restos tumorales, sangre o secreciones, o a la aparición de edema producto de la manipulación traqueal.
-
Previo a la transección de la tráquea, el anestesista debe estar seguro que el tubo se encuentra proximal al sitio de incisión para evitar que se dañe el cuff, teniendo el cuidado de no retirarlo completamente.
-
Una vez seccionada la tráquea, el cirujano introduce un tubo endotraqueal estéril en su cabo distal, conectándolo a un circuito de anestesia también estéril. El anestesista recibe ambas mangueras proximales del circuito estéril que deben ser conectados a la máquina de anestesia reemplazando el circuito original, luego de lo cual inicia la ventilación a través de este tubo (Figura 14 B y Figura 15).
-
La distancia existente entre la zona estenótica y la carina determinará si existe suficiente tráquea distal a la sección como para introducir el tubo, inflar el cuff y permitir ventilación bipulmonar. En caso de no ser así, el cirujano debe dirigir el tubo hacia el bronquio fuente izquierdo, realizando esta etapa de la cirugía en ventilación monopulmonar.
-
El cirujano extirpa el segmento de tráquea estenótica, regulariza los cabos de tráquea e inicia la instalación de los puntos para la anastomosis término-terminal. Durante esta etapa de la cirugía, con el fin de obtener un mejor campo quirúrgico para pasar los puntos, sobre todo los de la pared posterior, retira en forma intermitente el tubo desde el cabo distal, sometiendo al paciente a períodos de apnea (Figura 15). No existe la definición de un tiempo óptimo de apnea. En algunas instituciones poseen protocolos que determinan tiempos máximos permitidos baje o no la saturación arterial de oxígeno 8 , sin embargo, en otras instituciones simplemente reinician la ventilación cuando la oximetría se aproxima a 90%.
-
Cuando se reinicia la ventilación el paciente debe recibir oxígeno 100% para asegurar una capacidad residual funcional rica en oxígeno y ser ventilado hasta lograr niveles normales de capnografía, todo esto con el fin de preparar al paciente para el próximo período de apnea.
-
Una vez instalados todos los puntos de la anastomosis, el cirujano aproxima los cabos de la tráquea, mientras el anestesista procede a flexionar la cabeza del paciente para permitir dicha aproximación. En este momento se debe retirar el tubo traqueal inserto en el cabo distal (Figura 14 C y Figura 16).
-
Una vez retirado el tubo traqueal desde el cabo distal, el anestesista reintroduce el tubo que se encuentra insinuado en la tráquea haciéndolo pasar hacia distal de la anastomosis, reconecta el circuito anestésico original y reinicia la ventilación por esta vía (Figura 14 D, Figura 17 y Figura 18).
-
Cerrada la incisión, se debe asegurar que el paciente no extienda la cabeza para no ejercer tracción sobre la sutura traqueal. Para ello se han diseñado varios implementos y técnicas. Una de las más utilizadas es la colocación de puntos de tracción entre el mentón y la cara anterior del tórax (Figura 19), técnica que aunque parece muy cruenta, es muy eficiente y bien tolerada por los pacientes. El paciente debe permanecer entre 7 y 10 días con esta tracción.
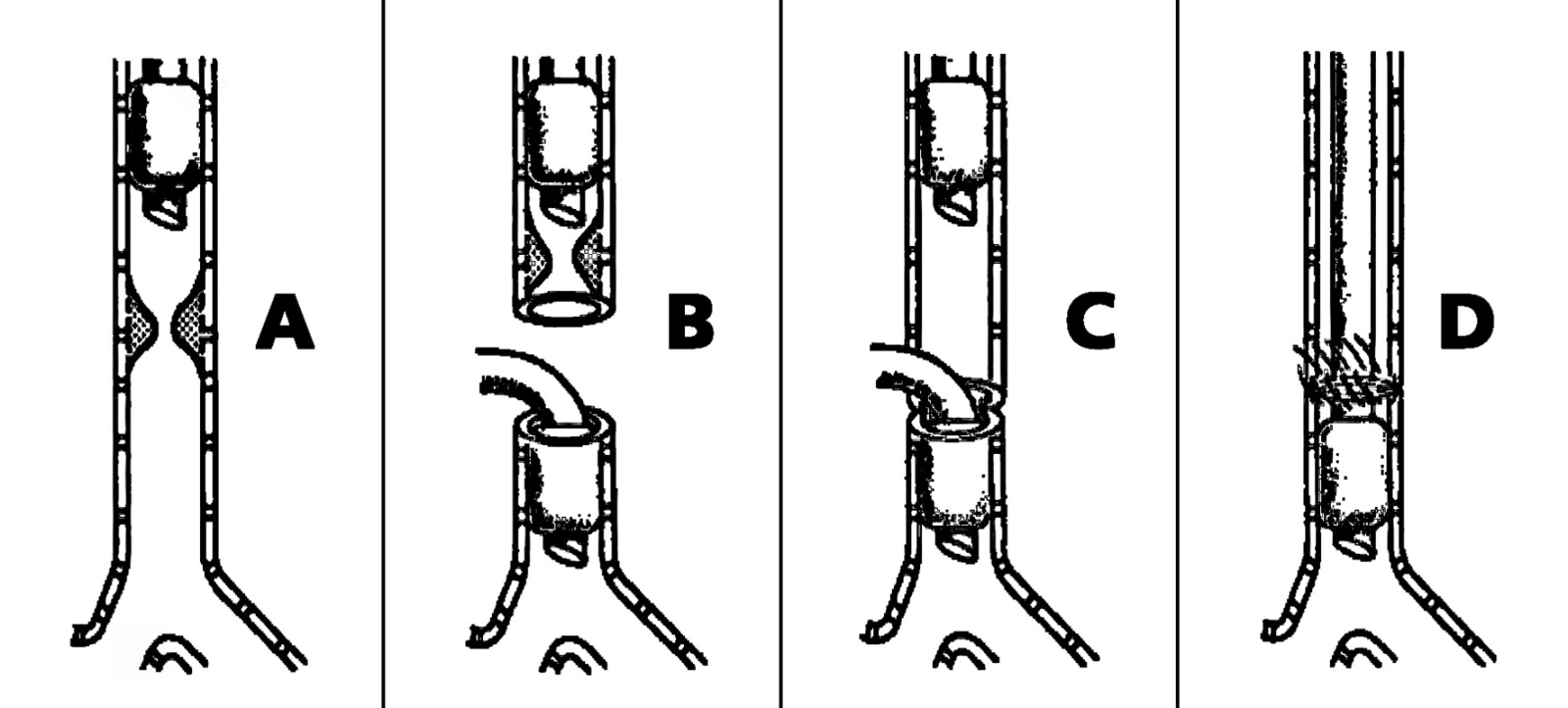
Figura 14 Esquema de las etapas de intubación traqueal distal en cirugía de resección y reconstrucción traqueal.
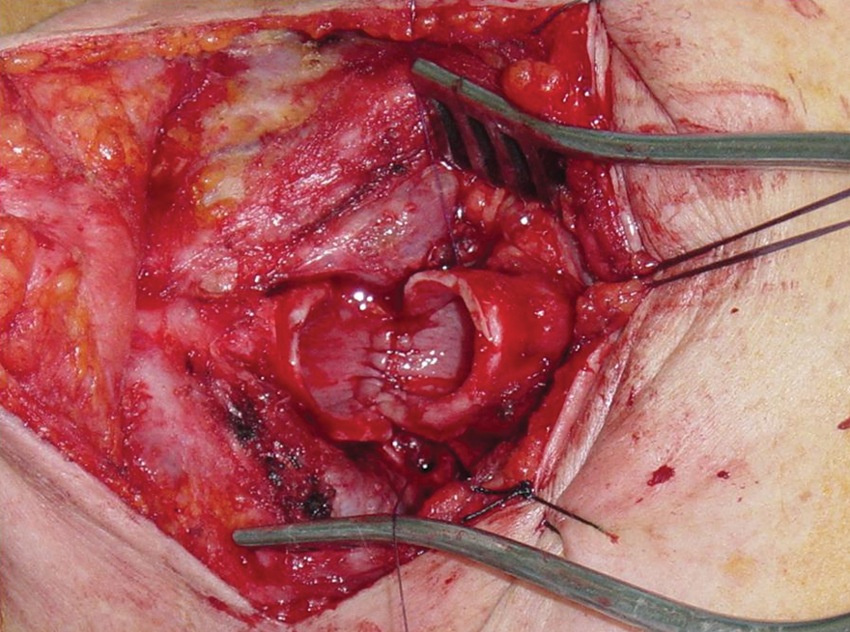
Figura 15 Anastomosis de la pared posterior de la tráquea. Paciente en apnea.
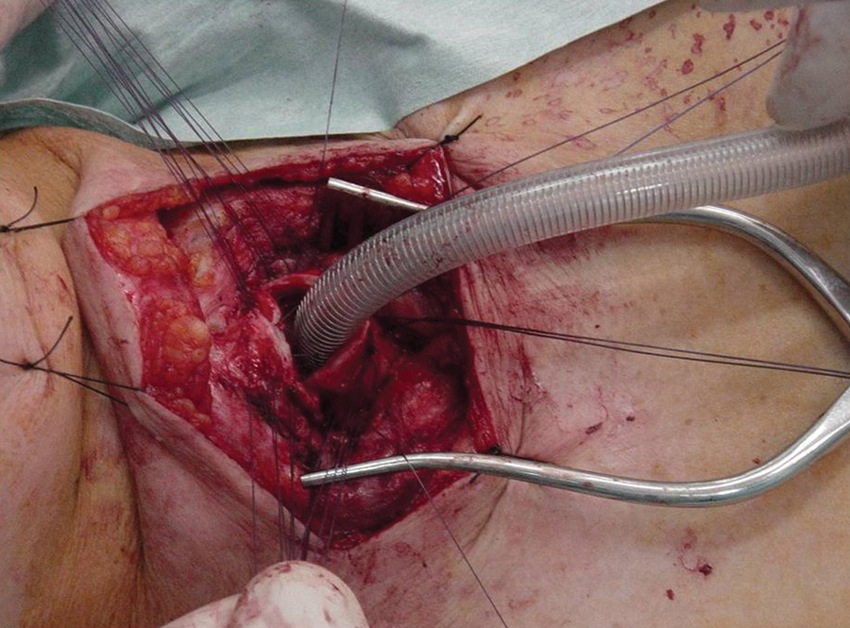
Figura 16 Cabos de la tráquea aproximados. Se debe retirar el tubo traqueal para anudar la pared anterior.
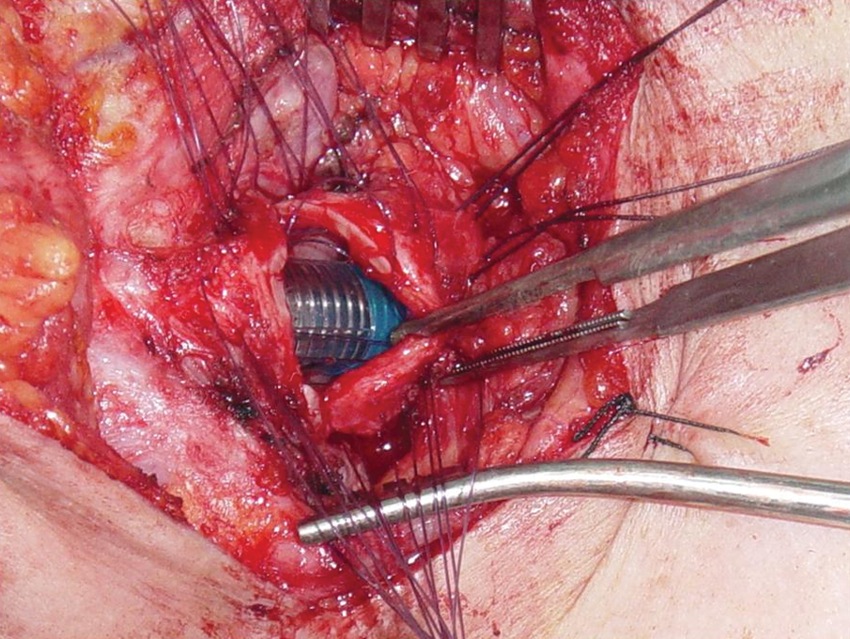
Figura 17 Tubo endotraqueal introducido a distal de la anastomosis. Se reinicia la ventilación por el tubo original.
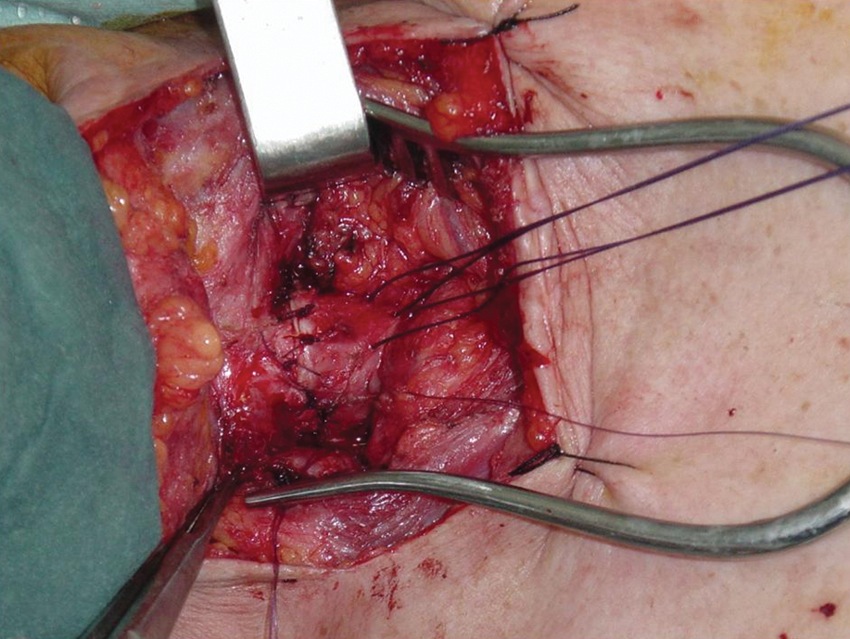
Figura 18 Tráquea suturada.
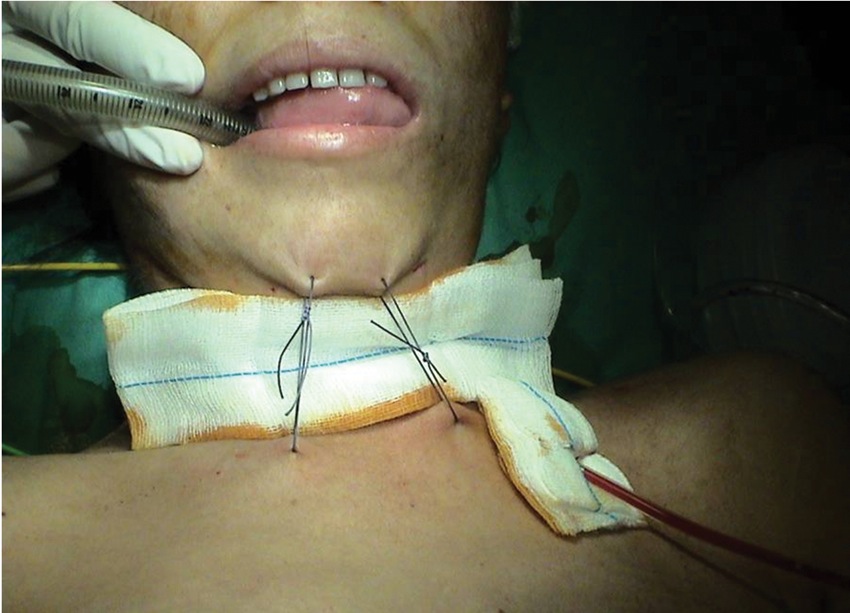
Figura 19 Puntos de tracción de mentón.
Una vez concluida la cirugía, el paciente debe ser extubado lo antes posible. La presencia de un tubo endotraqueal a nivel de la anastomosis puede conducir a una dehiscencia de la sutura por muchas causas (alteración de la irrigación, infección, movimientos de rechazo del tubo que ejerzan tracción sobre la sutura, etc.).
Extubar al paciente inmediatamente concluida la cirugía puede ocasionar las siguientes dificultades:
-
Aunque se haya hecho un aseo prolijo, puede haber sangre y secreciones traqueales.
-
Puede existir cierto grado de edema e inflamación.
-
El paciente no debe extender la cabeza.
En estas condiciones, es bueno seguir las siguientes recomendaciones:
-
Instruir al paciente en el preoperatorio sobre la necesidad de no extender la cabeza.
-
Elegir una técnica anestésica que ofrezca un despertar tranquilo y rápido.
-
Utilizar corticoides al inicio de la cirugía.
-
Solicitar al cirujano una hemostasia y un aseo prolijo de la tráquea previo a cerrar la sutura.
-
Mantener disponibles en pabellón los implementos de vía aérea difícil para utilizarlos en caso de necesitar reintubar al paciente.
Bibliografía
- Hautmann H, Gamarra F, Henke M, et al. High frequency jet ventilation in interventional fiberoptic bronchoscopy. Anesthesia Analgesia 2000; 90: 1436-1440.
- David I, Marel M, Pipková R, et al. Jet ventilation for fiberoptic bronchoscopy. Anesthesiology 2001; 94: 930-932.
- Bouaggad A, Bennani F, Al Harrar R, et al. Anesthesia for patient with tracheal tumor using laryngeal mask airway. Anesth Analga 2006; 103: 258-259.
- Okada Sh, Ishimori Sh, Sato M, et al. Endoscopic surgery with use of a laryngeal mask and a fiberoptic flexible bronchoscope. J Thoracic Cardiovasc Surg 2001; 121: 1196-1197.
- Grillo HC, Donahue DM. Post intubation tracheal stenosis. Semin Thorac Cardiovasc Surg 1996; 8: 370-380.
- Wright C, Grillo HC, Wain J, et al. Anastomotic complications after tracheal resection: Prognosis factors and management. Journal Thoracic Cardiovascular Surgery 2004; 128: 731-739.
- Pinsonneault C, Portier J, Donati F. Tracheal resection and reconstruction. Can J Anaesth 1999; 46: 439-455.
- Grillo HC, Donahue DM. Postintubation tracheal stenosis. Chest Surg Clin N Am 1996; 6: 725-731.
- Kamvyssi-Dea S, Kritikou P, Exarhos N, et al. Anaesthetic management of reconstruction of the lower portion of the trachea. Case report. Br J Anaesthesia 1975; 47: 82-84.
- Dodge TL, Mahaffey JE, Thomas J. The anesthetic management of a patient with an obstructing intratracheal mass: A case report. Anesth Analg 1977; 56: 295-298.
- Baraka A. Oxygen-jet ventilation during tracheal reconstruction in patients with tracheal stenosis.Anesth Analg 1977; 56: 429-432.
- Abou-Madi MN, Cuadrado L, Domb B, et al. Anaesthesia for tracheal resection: a new way to manage the airway. Can Anaesth Soc J 1979; 26: 26-28.
- Baraka A, Mansour R, Jaoude CA, et al. Entrainment of oxygen and halothane during jet ventilation in patients undergoing excision of tracheal and bronchial tumors. Anesth Analg 1986; 65: 191-194.
- Perera ER, Vidic D, Zivot J. Carinal resection with two high-frequency jet ventilation delivery sistems. Can J Anaesth 1993; 40: 59-63.
- Lippmann M, Mok MS. Tracheal cylindroma: anaesthetic management. Br J Anaesth 1977; 49: 383-386.
- El-Baz N, Holinger L, El-Ganzouri A, et al. High-frequency positive-pressure ventilation for tracheal reconstruction supported by tracheal T-tube. Anesth Analg 1982; 61: 796-800.
- Crinquette V, Wurtz A, Leroy S, et al. Separate two lung high frequency jet ventilation for carinal resection and reconstruction. Ann de Chir 1989; 43: 673-676.
- Geffin B, Bland J, Grillo HC. Anesthetic management of tracheal resection and reconstruction. Anesthe Analg 1969; 48: 884-890.
- Donlon JV. Anesthesia and eye, ear, nose, and trota surgery. En: Miller RD (Ed.) Anesthesia, 4th ed. New York: Churchill Livingston, 1994; 2: 2175-2196.
- Benumof JL, Alfery DD. Anesthesia for thoracic surgery. En: Millar Rd (Ed.) Anesthesia, 5th ed. New York: Churchill Livingston, 2000; 1665-1752.
- Asai T, Shingu K. Airway obstruction in a child with asymptomatic tracheobronchomalacia. Can J Anaesth 2001; 48: 684-687.
- Müller S, Concha M, Ramos M, et al. TIVA para broncoscopía rígida: CE sitio efecto mínima de Remifentanil para una concentración establecida de Propofol. Rev Chil Anestesia 2006; 35: 136.
- Baraka A, Siddik S, Taha S, et al. Low frequency jet ventilation for stent insertion in a patient with tracheal stenosis. Can J Anaesth 2001; 48: 701-704.
- Ericsson I, Nilsson L-G, Nordström S, et al. High-frequency positive-pressure ventilation (HFPPV) during transthoracic resection of tracheal stenosis and during peroperative bronchoscopic examination. Acta Anaesthesiol Scand 1975; 19: 113-119.
- Glenski JA, Crawford M, Rehder H. High-frequency small-volume ventilation during thoracic surgery. Anesthesiology 1986; 64: 211-214.
- El-Baz N, El-Ganzouri A, Gottschalk W, et al. One-lung high-frequency pressure ventilation for sleeve pneumonectomy: an alternative technique. Anesth Analg 1981; 60: 683-686.
- Guinta F, Chiaranda M, Manani G, et al. Clinical uses of high frequency jet ventilation in anesthesia. Br J Anaesth 1989; 63: S102-106.
- Rogers RC, Gibbons J, Cosgrove J et al. High-frequency jet ventilation for tracheal surgery. Anaesthesia 1985; 40: 32-36.
- Obara H, Maekawa N, Iwai S, et al. Reconstruction of the trachea in children with tracheal stenosis by using jet ventilation. Anesthesiology 1988; 68: 441-443.
- Schur MS, Maccioli GA, Azizkhan RG, et al. High-frequency jet ventilation in the management of congenital tracheal stenosis. Anesthesiology 1988; 68: 952-955.
- Magnusson L, Lang F, Monnier PH, et al. Anaesthesia for tracheal resection: report of 17 cases. Can J Anaesth 1997; 44: 1282-1285.
- Klein U, Karzai W, Gottschall R, et al. Respiratory gas monitoring during high-frequency jet ventilation for tracheal resection using a double-lumen jet catheter. Anesth Analg 1999; 88: 224-226.
- Froese AB. High-frequency oscillatory ventilation for adult respiratory distress syndrome: let’s get it right this time. Crit Care Med 1997; 25: 906-908.
- Clark RH, Gerstmann DR, Null DM, et al. Prospective randomized comparison of high-frequency oscillatory and conventional ventilation in respiratory distress syndrome. Pediatrics 1992; 89: 5-12.
- Graciano AL, Freid E. High-frequency oscillatory ventilation in infants and children. Curr Opin Anaesthesil 2002; 15: 161-166.
- Chang HK. Mechanisms of gas transport during ventilation by high frequency oscillation. J Appl Physiol 1984; 56: 553-563.
- Mentzelopoulos S, Tzoufi M. Curr Opin Anaesthesiol 2002; 15: 85-94.
- Adelsmayr E, Keller C, Erd G, et al. The laryngeal mask and high-frequency jet ventilation for resection of high tracheal stenosis. Anesth Analg 1998; 86: 907-908.
- Mentzelopoulos S, Romana C, Hatzimichalis A, et al. Anesthesia for tracheal resection: a new technique of airway management in a patient with severe stenosis of the midtrachea. Anesth Analg 1999; 89: 1156-1160.
