Mariana Varas R. * , Luciano González J. * , Carlos López M. **** , Rafael Prats M. ** , Christian Espinoza S. *** y Alex Reyes L.*****
Reve Chil Anest Vol. 41 Número 2 pp. 135-139|doi:
PDF|ePub|RIS
INTRODUCCIÓN
La membrana de oxigenación extracorpórea (ECMO) se utiliza en la insuficiencia respiratoria grave 1 – 3 para mantener un adecuado intercambio gaseoso. Las publicaciones de esta tecnología se remiten fundamentalmente al manejo de la falla respiratoria grave en unidades de cuidados intensivos, aunque en los últimos dos años, se observa en forma creciente algunos reportes sobre su uso intraoperatorio, para cirugía torácica, fundamentalmente en resecciones pulmonares (abscesos, tumores, hemoptisis, aspergilomas, etc.), en los cuales subyace una enfermedad pulmonar avanzada, que compromete gravemente el intercambio gaseoso, lo que hace imposible períodos de aislación pulmonar y ventilación monopulmonar.
Se presenta el caso de una paciente, previa firma de autorización para publicación de detalles de su historial clínico en revistas científicas y para ser parte de material docente de los autores, con el antecedente de un sarcoma de pared torácica izquierda (resección quirúrgica hace 5 años), que desarrolla una destrucción pulmonar del mismo lado, debido a secuelas postquirúrgicas y radioterapia. Cuatro años después evoluciona con tres metástasis en el lóbulo inferior derecho, por lo que se plantea realizar una metastasectomía por toracotomía.
Dada la dificultad técnica de realizar dicho procedimiento sin el colapso del pulmón no dependiente con técnicas habituales sin comprometer la oxigenación), se plantea la utilización de una membrana de oxigenación extracorpórea (ECMO) intraoperatoria, para proveer un intercambio gaseoso adecuado durante el período quirúrgico.
-
Descripción del caso
Paciente de sexo femenino de 53 años, con antecedentes de hipertensión arterial en tratamiento, hipotiroidismo en tratamiento y fibrilación auricular con tratamiento anticoagulante oral. En julio del año 2007 se pesquisó una masa en la pared torácica izquierda que tras resección es clasificada en su margen vertebral como sarcoma de células fusadas de grado intermedio (G2) y en el borde costal un neurofibrosarcoma, sin compromiso pleural. Inmediatamente después de la cirugía inicia radioterapia localizada en hemitórax izquierdo durante 3 semanas.
Dos años después (octubre de 2009) en tomografía axial computada (TAC) de tórax de control se describe atelectasia organizada del pulmón izquierdo con secuelas postquirúrgicas de la pared torácica superior sin evidencias de recidiva en ese hemitórax y un nódulo lobar inferior derecho (Figura 1), que fue resecado a través de una toracotomía bajo anestesia general con ventilación mecánica a través de un tubo orotraqueal simple con ventilación bipulmonar intercalada con episodios de apnea según requerimientos quirúrgicos, sin que esto haya determinado empeoramiento de la oxigenación. La biopsia diferida lo cataloga como una metástasis del sarcoma operado en el 2007.
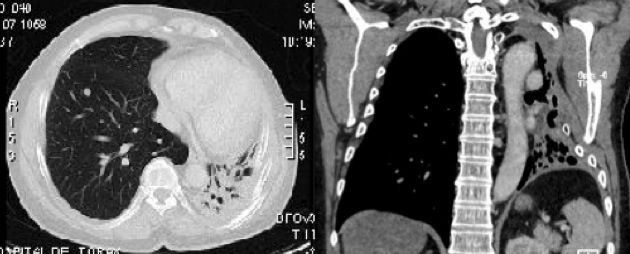
Figura 1 TAC de tórax de octubre de 2009: organizada del pulmón izquierdo y nódulo lobar inferior derecho.
El control radiológico de diciembre de 2011 (Figura 2) muestra un nivel mayor de destrucción pulmonar izquierdo, ya que a la atelectasia organizada descrita el 2009, se agrega una gran retracción pulmonar y signos de fibrosis pulmonar, que son concordantes con el estudio funcional respiratorio que muestra patrón restrictivo leve. El mismo estudio revela la aparición de 3 nódulos en el lóbulo inferior derecho de 4, 6 y 9 mm, planteándose la resección de las probables metástasis.
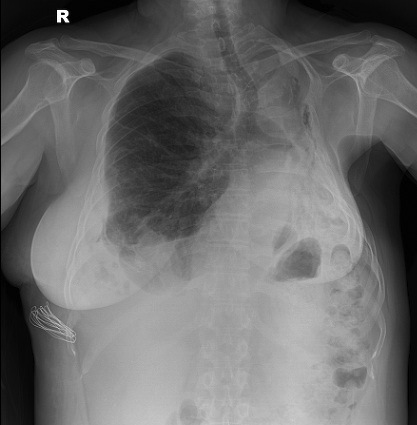
Figura 2 Radiografía de tórax de diciembre de 2011; mayor nivel de destrucción de pulmón izquierdo, retracción pulmonar y signos de fibrosis pulmonar.
Debido a la mayor destrucción pulmonar izquierda desarrollada desde el año 2009 y de una mayor dificultad quirúrgica (3 nódulos) es necesario el colapso pulmonar derecho, lo que se hace imposible con las técnicas habituales de aislación pulmonar sin comprometer la oxigenación (pulmón dependiente destruido). Es por esto que se plantea la utilización de una membrana de oxigenación extracorpórea (ECMO) intraoperatoria.
Posterior a la firma de los consentimientos informados de cirugía y anestesia, se realiza la monitorización con electrocardiograma, oxímetro de pulso, presión arterial invasiva, presión venosa central, diuresis, capnografía, temperatura, analizador de gases clínicos y profundidad del bloqueo neuromuscular. La inducción anestésica se realiza con 3 µg·kg-1 de fentanilo, 2 mg·kg-1 de propofol 2 mg·kg-1, y 0,6 mg·kg-1 de rocuronio; como profilaxis antibiótica se administra 1 g de cefazolina y como analgesia 100 mg de ketoprofeno. Se intuba con tubo orotraqueal simple 7,5. La mantención de la anestesia se hace con isoflorano conservando una fracción espirada > 0,7. Previo a canulaciones venosas para ECMO, se administran 100 UI·kg-1 de heparina, constatándose un tiempo de coagulación activado (TCA) > 300 s. Se realizan canulaciones venosas bajo visión radioscópica para ECMO (Figura 3) en vena yugular interna derecha (de retorno / 17 Fr / Biomedicus®) y en vena femoral derecha (de drenaje / 20 Fr / Edwards®). Se inicia ECMO (Figura 4) con una consola Maquet Rotaflow®, oxigenador Capiox RX15 y tubuladuras Terumo® estándar para cirugía cardiaca; los flujos se calcularon entre el 40% y 60% del gasto cardiaco estimado para la paciente, una fracción de oxígeno de 1,0 y una relación ventilación/perfusión de 0,8 a 1,0. El TCA de mantención fue > 180 s.
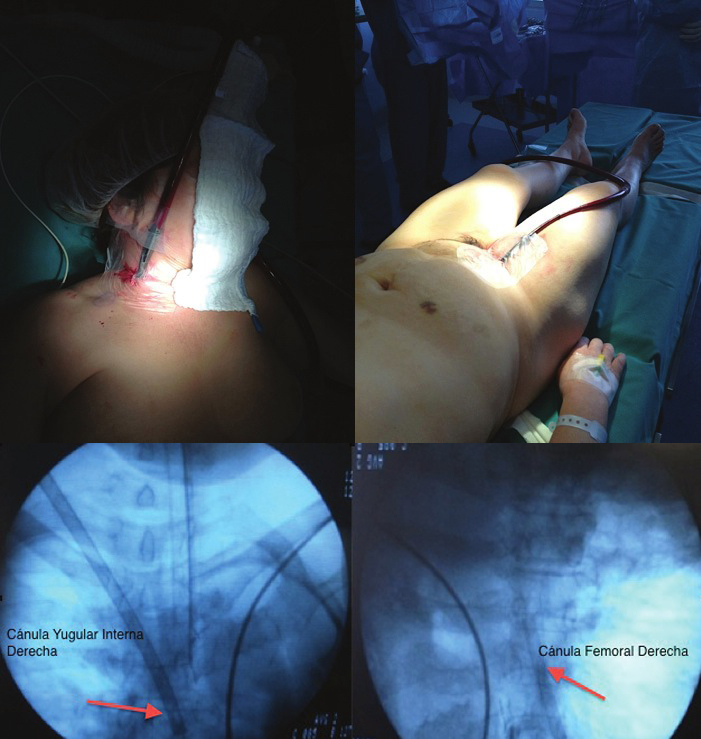
Figura 3 Canulación venosa yugular interna derecha y femoral derecha bajo radioscopia. (Arriba: procedimiento; abajo: radioscopia.

Figura 4 Oxigenador (izquierda) y consola (derecha).
Se suspende la ventilación mecánica y al comprobarse que la saturación de oxígeno con el pulsioxímetro de pulso se mantuvo constante entre 96 y 98% adoptándose se modifica la posición quirúrgica a decúbito lateral izquierdo. Se realizan toracotomía derecha posterolateral a nivel de T5-6, comprobándose colapso pulmonar satisfactorio, lo que permite la realización de las 3 metastasectomías sin incidentes.
El intraoperatorio (190 min de cirugía y 150 min de ECMO) se caracterizó por estabilidad hemodinámica, sin requerimientos de drogas vasoactivas ni transfusiones. La saturación de oxígeno se mantuvo > 96% y los exámenes de laboratorio controlados durante la cirugía (gases arteriales, electrolitos plasmáticos, hematocrito, recuento de plaquetas y hemoglucotest) fueron todos normales (Tabla 1). La discontinuación del ECMO se realizó de forma habitual sin incidentes. Al término de la cirugía se retiran las cánulas de ECMO. No se revierte la anticoagulación ya que el TCA de control al momento de discontinuar la ECMO es de 150 s. Se realiza un bloqueo paravertebral con un bolo de 0,4 ml·kg-1 de peso ideal de bupivacaína 0,25% con adrenalina al 1:200.000 y se deja catéter para infusión en el postoperatorio (PO): infusión basal de 5 ml·h-1 y bolos de 5 ml, con un retraso de 20 minutos. Asegurándose la ausencia de bloqueo neuromuscular con ENP, además de buena mecánica respiratoria, estabilidad hemodinámica y buena perfusión tisular, se extuba a la paciente, que tiene una satisfactoria emergencia de la anestesia, siendo luego trasladada a la UCI.
Tabla 1 Exámenes de laboratorio intraoperatorios
|
09:05 |
10:20 |
12:53 |
|
|
PaO2 / PaFi |
291 / 291 |
232 / 232 |
228 / 228 |
|
PaCO2 |
39 |
36 |
42 |
|
EB |
-1,4 |
-4,5 |
-7,0 |
|
Ph |
7,39 |
7,37 |
7,28 |
|
Hto/hb |
– |
36 / 12,2 |
30 / 10,2 |
|
Rto. Plaquetas |
– |
303.000 |
269.000 |
|
Sodio / Potasio |
138 / 3,7 |
136 / 4,0 |
136 / 4,7 |
En el PO inmediato la paciente cursa con estabilidad hemodinámica, sin apoyo de drogas vasoactivas y sin insuficiencia respiratoria. Se controlaron exámenes de forma habitual en la UCI (Tabla 2), que al ingreso no muestran alteraciones, excepto por la caída del hematocrito de 29 a 24% a las 12 h del PO, por lo que se indican 2 unidades de glóbulos rojos. El manejo analgésico se realiza en forma multimodal con analgesia endovenosa con AINES, paracetamol oral y la infusión de anestésicos locales a través del catéter paravertebral ya descrita. Al completar el las primeras 24 h del PO el sangrado acumulado por los drenajes es de 660 ml. Debido a su evolución favorable, completando el segundo día del PO es trasladada a unidad de intermedio respiratorio, para ser dada de alta posteriormente al octavo día luego de la cirugía.
Tabla 2 Exámenes de laboratorio postoperatorios
|
Ingreso UCI |
12 hrs PO |
|
|
PaO2 / PaFi |
86 / 245 |
107 / 305 |
|
PaCO2 |
43 |
49 |
|
EB |
-7,2 |
2,3 |
|
Ph |
7,27 |
7,36 |
|
Hto/hb |
29 / 10 |
24 / 8 |
|
Rto. Plaquetas |
291.000 |
217.000 |
|
Sodio / Potasio |
138 / 4,3 |
141 / 3,4 |
|
Glicemia/HGT |
351 |
135 |
|
TP / TTPa |
78 % / 35 s |
100 % / 28 s |
En el control ambulatorio, al mes de la cirugía, no se pesquisa ningún tipo de complicación y el resultado de las biopsias diferidas demuestran nuevamente tratarse de un sarcoma.
DISCUSIÓN
El soporte con ECMO es cada vez más utilizado en el manejo de la insuficiencia respiratoria grave 1 como un puente para el trasplante de pulmón 2 y en el manejo de la disfunción primaria del injerto post-trasplante pulmonar 3 , permitiendo el mantenimiento adecuado del intercambio gaseoso.
El uso de ECMO intraoperatorio nos abre la posibilidad de intervenir quirúrgicamente a pacientes que tienen un intercambio gaseoso tan comprometido que son impracticables los períodos de aislación pulmonar o de apnea requeridos por los cirujanos, por lo que este grupo de pacientes hasta hace pocos años estaban fuera del alcance quirúrgico. Las publicaciones de este tipo de casos comienzan a principios de esta década. Lang et al 4 , describen 9 casos de tumores malignos torácicos con compromiso de la vía aérea o de grandes vasos. También se reporta el caso de un paciente con aspergiloma pulmonar izquierdo y con compromiso infiltrativo del pulmón derecho 5 y otro caso de un paciente politraumatizado, con múltiples injurias por un grave trauma torácico derecho, que cursa con una neumonía asociada a ventilación mecánica, que cursó con un absceso pulmonar izquierdo y empiema pleural, al cual se le realizó una lobectomía asociada a decorticación y pleurectomía bajo ECMO 6 .
Para la implementación de esta tecnología en cirugía torácica es imprescindible una coordinación multidisciplinaria (cirujanos de tórax, cardiocirujanos, anestesiólogos cardiovasculares, enfermeros perfusionistas, broncopulmonares e intensivistas), ya que al momento de planificar este tipo de pacientes se yuxtaponen los diferentes conocimientos y destrezas.
Debido a la complejidad de este tipo de intervenciones pareciera ser conveniente que en los centros en que se pretenda realizar estas intervenciones excepcionales, tengan previamente un manejo y experiencia en cirugía cardiaca, así como en el uso de dispositivos de asistencia circulatoria extracorpórea para la resolución expedita de cualquier complicación.
Para la publicación de este artículo, los autores declaran no poseer conflicto de interés de ningún tipo con empresas relacionadas con el desarrollo de las tecnologías descritas.
Referencias
-
Brogan TV, Thiagarajan RR, Rycus PT, et al. Extracorporeal membrane oxygenation in adults with severe respiratory failure: a multicenter database. Intensive Care Med 2009; 12: 2105-2114.
-
Mangi AA, Mason DP, Yun JJ, et al. Bridge to lung transplantation using short-term ambulatory extracorporeal membrane oxygenation. J Thorac Cardiovasc Surg 2010; 140: 713-715.
-
Bermúdez CA, Adusumilli PS, McCurry KR, et al. Extracorporeal membrane oxygenation for primary graft dysfunction after lung transplantation: long-term survival. Ann Thorac Surg 2009; 87: 854-860.
-
Lang G, Taghavi S, Aigner C, et al. Extracorporeal Membrane Oxygenation Support for Resection of Locally Advanced Thoracic Tumors. Ann Thorac Surg 2011; 92: 264-271.
-
Souilamas R, Souilamas JI, Alkhameesl K, et al. Extra corporal membrane oxygenation in general thoracic surgery: a new single veno-venous cannulation. J Cardiothorac Surg 2011; 6: 52.
-
Brenner M, O’Connor JV, Scalea TM. Use of ECMO for Resection of Post-Traumatic Ruptured Lung Abscess With Empyema. Ann Thorac Surg 2010; 90: 2039-2041.
