Giancarlo Ferretiz G. 1 , Neftalí Cárdenas 1
Recibido: 22-04-2019
Aceptado: 28-05-2019
©2019 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 48 Núm. 4 pp. 331-343|https://doi.org/10.25237/revchilanestv48n04.08
PDF|ePub|RIS
Postoperative nausea and vomiting after mastectomy
Abstract
Background: Postoperative nausea and vomiting (PONV) are a frequent problem in surgical patients, with an incidence of 50% and 30% respectively. In patients with the risk of presenting this complication, the incidence frows up to 80%. PONV can extend the length of stay in the postoperative recovery unit with the time of surgery. Each episode of vomiting can increase the stay in a postoperative recovery unit by 20 minutes. In addition, the main cause of hospitalization is not scheduled in the context of outpatient surgery. The anesthesiologist before a mastectomy must determine the strategies according to the pathology, proposing the necessary resources to avoid the presence of postoperative nausea and vomiting. Objective: Evaluation of the incidence of postoperative nausea and vomiting in the patient in outpatient surgery of the breast in the ambulatory surgery unit of the National Cancer Institute. Material and Methods: An observational, analytical, cross-sectional and retrospective study was carried out in which the clinical files of the patients of the National Institute of Cancerology were reviewed and a surgical procedure with the diagnosis of breast cancer in the outpatient surgery unit was scheduled. a period comprised between May 1 and October 15, 2017. The descriptive and inferential statistical analysis was performed in SPSS version 23. Results: 165 women with an average age of 52.8 ± 11.2 years were included, 154 were send home (93.4%), the remaining 11 patients (6.7%) required hospitalization for pain (4.2%), pain and hematoma (1.8%). and re intervention (0.6%), none for PONV. A history of nausea and vomiting was observed in 21.2%. Only 3 patients presented postoperative nausea and vomiting (1.8%). Antiemetic treatment was applied in all patients with a combination of any of three drugs (metoclopramide, dexamethasone and ondansetron). A history of nausea and vomiting was found to be a risk factor for PONV with an MRI of 28.1 (1.42 – 55.8); the second risk factor was to receive RM-isolated chemotherapy of 22.6 (1.14 – 44.8) and the third risk factor was to receive some treatment (QT, RT or QT + RT) MRI of 15.2 (0.77-29.9). Conclusions: In our study we observed a very low rate of PONV and it was possible to demonstrate that the pre-medication prior to the surgical event in patients with breast cancer significantly decreases the presence and control of postoperative nausea and vomiting, improving comfort during their Hospital stay and immediate discharge. It is necessary to carry out studies that deepen these findings in our population and allow to discriminate in an experimental, prospective and longitudinal design the effectiveness of the pharmacological treatment of PONV.
Resumen
Introducción: La náusea y vómito postoperatorio (NVPO) son un problema frecuente en los pacientes quirúrgicos, con una incidencia de 50% y de 30% respectivamente. En pacientes con alto riesgo de presentar esta complicación pueden aumentar la incidencia de hasta 80%. La NVPO puede prolongar significativamente el tiempo de estadía en la Unidad de Recuperación Posoperatoria con incremento de forma relevante en los costos de la cirugía. Cada episodio de vómitos puede llegar a aumentar en 20 min la estadía en una Unidad de Recuperación Posoperatoria. Además, son la principal causa de hospitalización no programada en el contexto de la cirugía ambulatoria. El anestesiólogo ante una cirugía de mama debe determinar las estrategias de acuerdo con la patología, proponiendo los recursos necesarios para evitar la presencia de náusea y vomito posoperatorio. Objetivo: Evaluar la incidencia de náusea y vomito posoperatorio en el paciente sometido a cirugía ambulatoria de mama en la unidad de cirugía ambulatoria del Instituto Nacional de Cancerología. Material y Métodos: Se realizó un estudio observacional, analítico, transversal y retrospectivo en el que se revisaron los expedientes clínicos de pacientes del Instituto Nacional de Cancerología programadas a procedimiento quirúrgico con diagnóstico de cáncer de mama en la unidad de cirugía ambulatoria, en un período comprendido entre el 1 de mayo al 15 de octubre de 2017. Se realizó el análisis estadístico descriptivo e inferencial en SPSS versión 23. Resultados: Se incluyeron 165 mujeres con edad promedio de 52,8 ± 11,2 años, 154 fueron egresados a su domicilio (93,4%), las restantes 11 pacientes (6,7%) requirieron internamiento por dolor (4,2%), dolor y hematoma (1,8%) y re intervención (0,6%), ninguna por NVPO. Se observó antecedente de náusea y vómito en 21,2%. Solo 3 pacientes se presentaron náuseas y vómito postoperatorios (1,8%). El tratamiento antiemético se aplicó en todas las pacientes con una combinación de cualquiera de tres fármacos (metoclopramida, dexametasona y ondansetrón). El antecedente de náusea y vómito, resultó ser un factor de riesgo para presentar NVPO con una RM de 28,1 (1,42-55,8); el segundo factor de riesgo fue recibir quimioterapia aislada RM de 22,6 (1,14-44,8) y el tercer factor de riesgo fue recibir algún tratamiento (QT, RT o QT + RT) RM de 15,2 (0,77-29,9). Conclusiones: En nuestro estudio observamos una tasa muy baja de NVPO y fue posible demostrar que la pre-medicación previa al evento quirúrgico en pacientes con cáncer de mama disminuye de manera significativa la presencia y control de náusea y vómito post operatorio mejorando el confort durante su estancia hospitalaria y su egreso inmediato. Es necesario realizar estudios que profundicen en estos hallazgos en nuestra población y permitan discriminar en un diseño experimental, prospectivo y longitudinal la efectividad del tratamiento farmacológico de las NVPO.
-
Introducción
La cirugía mayor ambulatoria y de corta estadía constituye un método eficaz y seguro con la premisa de una selección adecuada de los pacientes, utilizando técnicas quirúrgicas estandarizadas, con la creación consecuente de la infraestructura necesaria para tales fines[1],[5].
Los avances tecnológicos en medicina, así como la evolución y el advenimiento de técnicas anestésicas y quirúrgicas, han propiciado que la práctica de cirugía mayor ambulatoria se lleve a cabo con mayor frecuencia para la atención de un gran número de patologías. Mediante este tipo de procedimientos quirúrgicos, es posible alcanzar los resultados terapéuticos esperados y al mismo tiempo garantizar que la recuperación del paciente se logre con los más altos estándares de calidad y seguridad, evitando hospitalizaciones innecesarias [6],[7].
Tradicionalmente, la cirugía para cáncer de mama ha requerido ingreso hospitalario por motivos como es el riesgo de hemorragia posoperatoria, la necesidad de control de drenajes quirúrgicos, recuperación anestésica, etc. Internacionalmente, esto ha cambiado tras la introducción de nuevas técnicas quirúrgicas, especialización de los grupos de cirugía en afecciones de la mama y el advenimiento de nuevas tecnologías, se ha implementado el concepto de egresar al paciente a domicilio el mismo día, promoviendo además de que el paciente permanezca menos de 24 horas en una unidad hospitalaria[8],[9].
Los procedimientos que pueden considerarse como posibles factores de riesgo para la presencia de náusea y vómito posoperatorio incluyen los procedimientos intraabdominales, laparoscópicos, ortopédicos, ginecológicos, otorrinolaringológicos, tiroides, cirugía plástica, de mama y procedimientos neuroquirúrgicos. Náusea y vómito postoperatorio (NVPO) son un problema frecuente en los pacientes quirúrgicos, con una incidencia de 50% y de 30% respectivamente. En pacientes con alto riesgo de presentar esta complicación pueden aumentar la incidencia de hasta el 80%. La NVPO puede prolongar significativamente el tiempo de estadía en la Unidad de Recuperación Posoperatoria (URP) con incremento de forma relevante en los costos de la cirugía. Cada episodio de vómitos puede llegar a aumentar en 20 min la estadía en una Unidad de recuperación postoperatoria[10]-[14].
La náusea y vómito postoperatorios (NVPO) son la principal causa de hospitalización no programada en un contexto de cirugía ambulatoria[15 ].
Al no existir evidencia reportada sobre la presencia y prevalencia de náusea y vómito posoperatorio en cirugía ambulatoria de mama, siendo esta una de las complicaciones postquirúrgicas más frecuentes lo que conlleva de manera significativa la estancia hospitalaria prolongada o el reingreso hospitalario, no se ha planeado o estandarizado un manejo adecuado para la población susceptible a estas complicaciones posquirúrgicas en el Instituto Nacional de Cancerología, en base a las características poblacionales actuales.
La hipótesis fue que la utilización de la pre-medicación para el manejo de náusea y vómito postoperatorio será efectivo disminuyendo la incidencia de esta complicación en la Unidad de Cirugía Ambulatoria en el Instituto Nacional de Cancerología.
-
Material y Métodos
Se realizó un estudio observacional, analítico, transversal y retrospectivo.
El estudio se llevó a cabo en la Unidad de Cirugía Ambulatoria del Instituto Nacional de Cancerología, Ciudad de México, México.
Pacientes programados a procedimiento quirúrgico con diagnóstico de cáncer de mama en la Unidad de Cirugía Ambulatoria en el Instituto Nacional de Cancerología, en un período comprendido entre el 1 de mayo al 15 de octubre de 2017.
Se incluyeron en el estudio a pacientes mayores de 18 años, femeninas, en el período comprendido entreb el 1 de mayo de 2017 a 15 de octubre de 2017 que contaron con expediente electrónico completo con nota posanestésica.
Se excluyeron a pacientes con expedientes incompletos, programados en fecha y forma, pero el procedimiento médico quirúrgico no se realizó en la Unidad de Cirugía Ambulatoria.
El cálculo de la muestra se realizó por medio de la fórmula para conocer el tamaño muestral para determinar una proporción en población finita (165 pacientes), tomando un nivel de confianza del 95% (α = 0,05), una precisión de 95% (β= 0,05) y una proporción esperada de 30% que es la incidencia de vómito reportada en un estudio similar, se requiere una muestra de al menos 109 pacientes, considerando un 20% de pérdidas, se utilizará una muestra de 121 pacientes.
El análisis inferencial para determinar la relación entre las variables independientes y la variable dependiente del estudio, considerando esta última es de tipo dicotómica (presencia/ausencia de vómito y presencia/ausencia de náusea): en el caso de variables independientes cualitativas se realizó utilizando la prueba chi cuadrado en tablas de contingencia y se calculó la razón de momios para medir la asociación.
En el caso de variables independientes cuantitativas se utilizó la prueba t de Student para muestras independientes si la variable tenía distribución normal, de lo contrario, se empleó la prueba no paramétrica U de Mann-Whitney. En todos los casos se utilizó un nivel de significancia p ≤ 0,05.
Los datos se procesaron en el programa IBM SPSS Statistics para Windows, Versión 23.0 (Armonk, NY: IBM Corp).
-
Resultados
De un total de 200 procedimientos programados en hoja diaria y de expedientes electrónicos revisados y cumpliendo los criterios de inclusión y exclusión nuestra población final estudiada fue de 166 expedientes.
De los cuales 17 (8,5%) fueron expedientes incompletos, 10 (5%) correspondieron a procedimientos realizados en sala fuera del área de cirugía ambulatoria, tres (1,5%) procedimientos no de mama, pero relacionado con pacientes con Ca de mama y dos (1%) procedimientos sin relación a cáncer de mama.
Del total de 166 pacientes que se presentaron durante el período de observación entre el 1 de mayo de 2017 a 15 de octubre de 2017, que cumplieron los criterios de selección, fueron 165 mujeres (99,4%), y 1 hombre (0,6%), mismo que se excluyó de la muestra final (Tabla 1). La edad promedio de las pacientes al momento del estudio fue de 52,8 años (x = 52,8, s = 11,2, Me = 53, Mo = 59 años) siendo el rango de 22 a 85 años (Tabla 2) (Figura 1). Se observó distribución normal en la edad de acuerdo a la prueba normalidad de Kolmogorov-Smirnov.
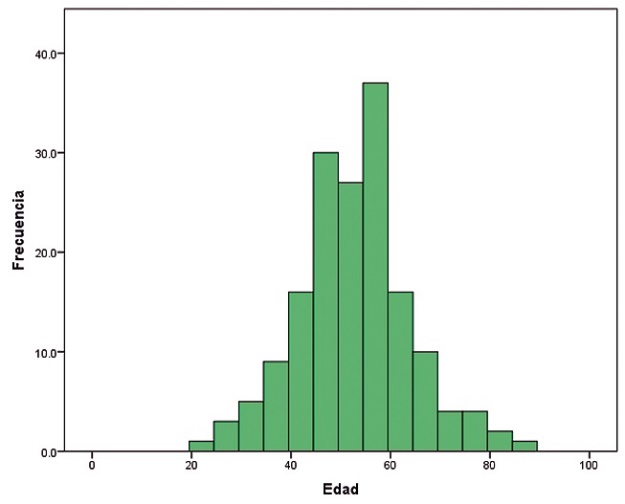
Figura 1. Histograma de la edad de las pacientes.
Los procedimientos realizados en la Unidad de Cirugía Ambulatoria fueron por orden de frecuencia: Cirugía conservadora + ganglio centinela en 58 pacientes (35,2%), mastectomía simple en 25 pacientes (15,2%), mastectomía radical en 12 pacientes (7,3%), reconstrucción de colgajo en 9 pacientes (5,5%), extracción y retiro de implantes en 9 pacientes (5,5%) y otros procedimientos con menor frecuencia en las restantes 52 pacientes (Tabla 1) (Figura 2).
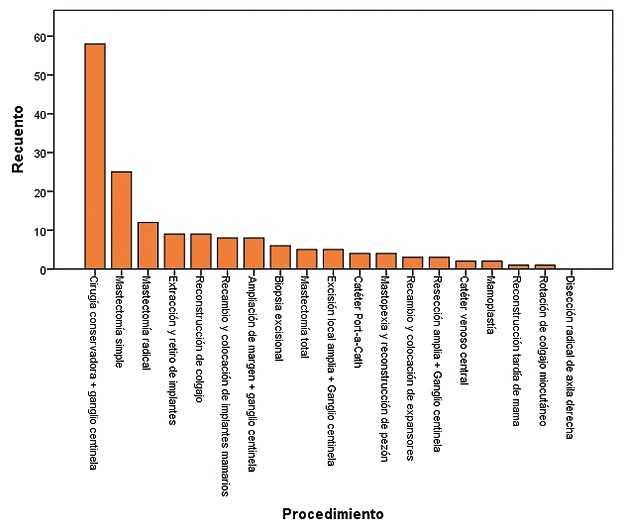
Figura 2. Procedimiento realizado en la Unidad de Cirugía Ambulatoria.
Del total de pacientes, 154 fueron egresados a su domicilio (93,4%), las restantes 11 pacientes (6,7%) requirieron internamiento por dolor (4,2%), dolor y hematoma (1,8%) y reintervención (0,6%) (Tabla 1) (Figura 3). La técnica anestésica utilizada fue con mayor frecuencia la anestesia general balanceada (99,4%), en una paciente (0,6%) se utilizó la anestesia general balanceada + PEC (bloqueo de nervios pectorales).
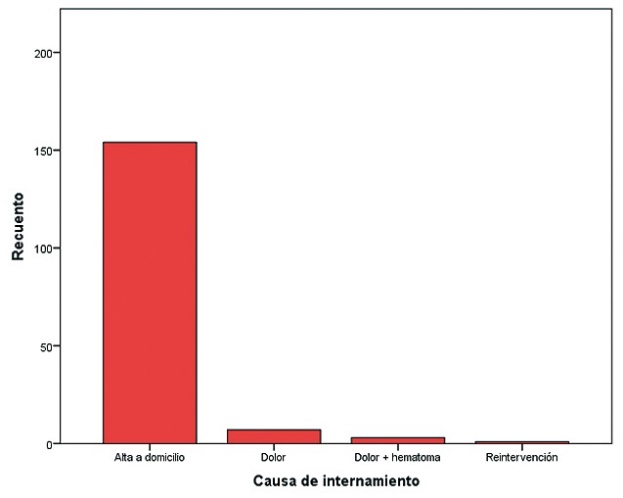
Figura 3. Destino del paciente.
En relación al tratamiento, 54 pacientes recibían quimio y/o radioterapia (32,7%), mientras que 111 no tenían tratamiento alguno (67,3%). Específicamente, 41 pacientes recibían sólo quimioterapia (24,8%), 10 recibían quimioterapia más radioterapia (6,1%) y tres pacientes sólo radioterapia (1,8%) (Tabla 1) (Figura 4).
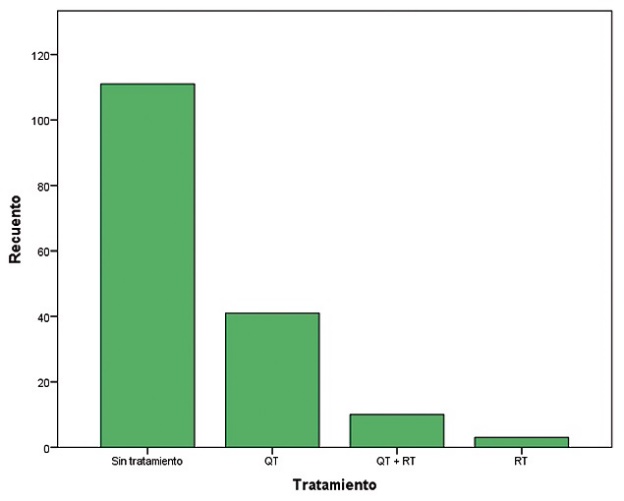
Figura 4. Modalidad de tratamiento.
De las 54 pacientes que recibían tratamiento, el esquema más frecuente fue paclitaxel en 16 pacientes (29,6%), paclitaxel y radioterapia en 7 pacientes (13,0%), tamoxifeno en 4 pacientes (7,4%), paclitaxel más adriamicina en 4 pacientes (7,4%), paclitaxel y trastuzumab en 4 pacientes (7,4%), el resto de los pacientes recibieron otros esquemas en mucho menor frecuencia (Tabla 1) (Figura 5). En total, 13 pacientes recibían radioterapia (7,9%).
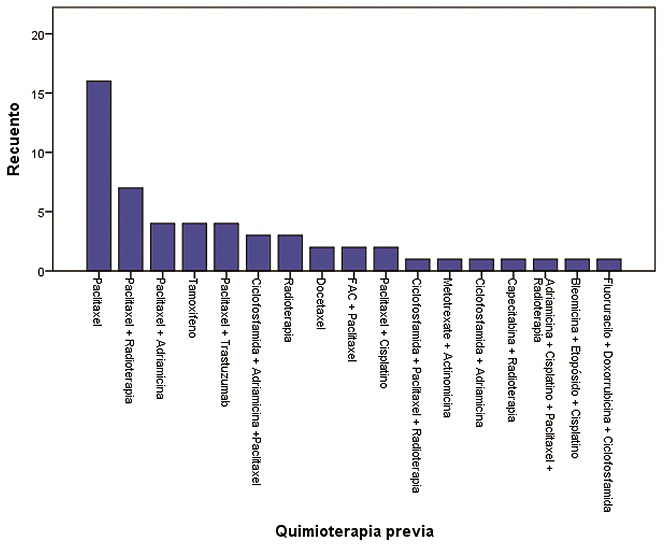
Figura 5. Quimioterapia previa.
Se observó antecedente de náusea y vómito en 35 pacientes (21,2%). No se observaron náuseas y vómito preoperatorios (0%), mientras que en solo 3 pacientes se presentaron náuseas y vómito postoperatorios (1,8%) (Tabla 1) (Figura 6). El tratamiento antiemético se aplicó en todas las pacientes, las combinaciones utilizadas fueron: metoclopramida 10 mg + dexametasona 8 mg en 85 pacientes (51,5%), Metoclopramida 10 mg + dexametasona 8 mg + ondansetrón 8 mg en 41 pacientes (24,8%), metoclopramida 10 mg + dexametasona 8 mg + ondansetrón 4 mg en 33 pacientes (20,0%), Metoclopramida 10 mg en 4 pacientes (2,4%) y Dexametasona 8 mg + Ondansetrón 4 mg en 2 pacientes (1,2%) (Tabla 1) (Figura 7).
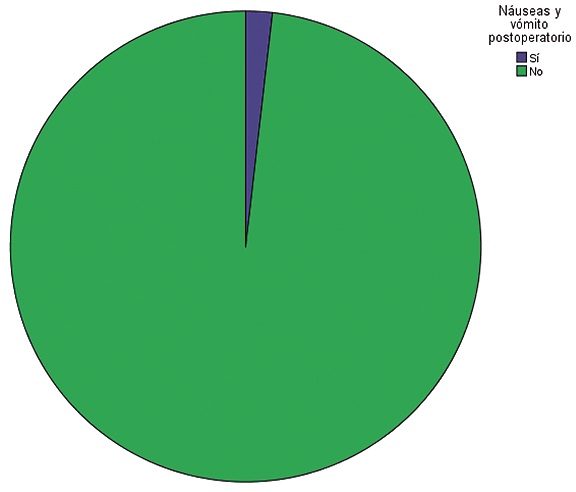
Figura 6. Náuseas y vómito postoperatorio.
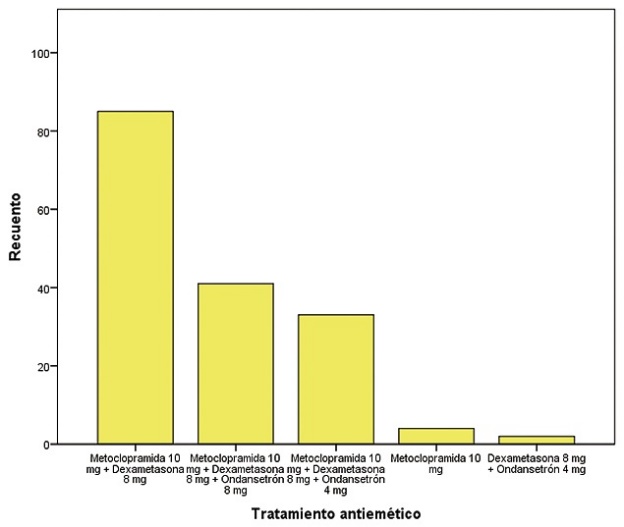
Figura 7. Tratamiento antiemético recibido.
Se observó que, de las 35 pacientes con antecedente de náusea y vómito, 3 presentaron (NVPO), mientras que 130 pacientes sin antecedente de náusea y vómito, ninguna presentó (NVPO); estas diferencias resultaron estadísticamente significativas mediante la prueba de chi cuadrado (χ2 = 11,4, p = 0,09) tras el análisis en la tabla de contingencia.
En relación al tratamiento recibido, se observó que de las 4 pacientes que recibían paclitaxel + adriamicina, una presentó (NVPO) (25%); mientras que de las 3 pacientes que recibían ciclofosfamida + adriamicina + paclitaxel, dos presentaron (NVPO) (66,7%), en el resto de los esquemas de tratamiento la proporción de (NVPO) fue de 0%; estas diferencias fueron estadísticamente significativas mediante la prueba de chi cuadrado (χ2 = 27,0, p = 0,04).
Por otra parte, de las 54 pacientes que recibían algún tratamiento, tres presentaron NVPO (5,6%), en cambio, ninguna de las pacientes que no recibían algún tratamiento presentaron NVPO (0%), esta diferencia fue estadísticamente significativa mediante la prueba de chi-cuadrado (2 = 6,3, p = 0,03). En cuanto a la modalidad de tratamiento, las 3 pacientes que presentaron NVPO recibían únicamente QT (7,3%), mientras que ninguna de las pacientes que recibían quimioterapia + radioterapia, ni radioterapia sola presentaron QT; estas diferencias también fueron estadísticamente significativas (χ2 = 9,24, p = 0,03).
No se observaron diferencias estadísticamente significativas en la proporción de NVPO en las pacientes de acuerdo a si recibían o no radioterapia, el tipo de procedimiento quirúrgico, la causa de internamiento ni la técnica anestésica utilizada (p ≥ 0,05) en la prueba de chi cuadrado. La NVPO se presentó en dos de 85 pacientes (2,4%) que recibieron metoclopramida 10 mg + dexametasona 8 mg; y en una de 41 pacientes (2,4%) que recibieron metoclopramida 10 mg + dexametasona 8 mg + ondansetrón 8 mg; sin embargo, estas diferencias en la frecuencia de NVPO de acuerdo al esquema recibido no fueron estadísticamente significativas (p ≥ 0,05).
En cuanto a la edad de las pacientes, la media en las que presentaron NVPO fue de 53,3 años (x = 53,3, s = 9,5 años) y en las que no presentaron NVPO fue de 52,8 años (x = 52,8, s = 11,3 años); sin embargo, estas diferencias no fueron estadísticamente significativas mediante la prueba t de Student para muestras independientes (t = 0,8, p ≥ 0,05).
Se calculó la razón de momios de las variables dicotómicas para establecer su fuerza de asociación con las NVPO. En relación al antecedente de náusea y vómito, este resultó ser un factor de riesgo para presentar NVPO con una RM de 28,1 (RM = 28,1, IC 95% 1,42 – 55,8).
El segundo factor de riesgo para la presencia de NVPO fue el recibir quimioterapia aislada observándose una RM de 22,6 (RM = 22,6, IC 95% 1,14-44,8). El tercer factor de riesgo para la presencia de NVPO fue el recibir algún tratamiento (QT, RT o QT + RT) con una RM de 15,2 (RM = 15,2, IC 95% 0,77 – 29,9) (Tabla 3).
-
Discusión
Nuestro estudio se desarrolló en forma retrospectiva mediante la metodología de casos y controles, con un total de 165 pacientes, incluyéndose prácticamente la totalidad de la población, por lo que se obtuvo un número considerable para efectuar inferencias estadísticas con niveles adecuados de confianza y poder estadístico. El método de muestreo no probabilístico elegido pudo ser fuente de sesgo, sin embargo, se justificó su uso debido a la población limitada de interés en el período de estudio establecido.
Las características sociodemográficas de la muestra fueron adecuadas por lo que no fue necesaria la estratificación en el análisis estadístico. Llamó la atención una distribución amplia de la edad con media en la sexta década de la vida, incluyéndose en el grupo final solo mujeres.
Aunque en la Unidad de Cirugía Ambulatoria se realizaron una considerable diversidad de procedimientos, la mayor parte de las pacientes se sometieron a cirugía conservadora y ganglio centinela, mastectomía simple y mastectomía radical. La tasa de egreso a domicilio fue muy alta con 93,4% de las pacientes, y la tasa de ingreso fue de 6,7%, cabe señalar que ninguna de las hospitalizaciones se debió a la presencia de NVPO.
El mayor número de pacientes no tenía tratamiento alguno (67,3%) y en las que sí lo recibían la mayoría se encontraban sólo en quimioterapia. En relación a esta modalidad, se observaron diversos esquemas, de los cuales el paclitaxel, tamoxifeno, paclitaxel más adriamicina y paclitaxel más trastuzumab fueron los más frecuentes. El uso de radioterapia se reportó en un pequeño grupo de pacientes, sin llegar al 10%, lo cual consideramos se atribuye a la estadificación del tumor primario.
En relación a uno de los objetivos primarios del estudio, la tasa de náuseas y vómito preoperatorio fue de 0% y la tasa de náuseas y vómito preoperatorio fue muy baja (1,8%). El antecedente de náusea y vómito fue mucho más frecuente (21,2%). En este sentido, podemos asumir que el tratamiento antiemético aplicado fue muy efectivo; los esquemas utilizados fueron acordes a las recomendaciones y evidencias reportadas a nivel mundial aplicándose en cualquiera de sus combinaciones metoclopramida, dexametasona y ondansetrón.
Debido a los alcances del estudio y a la baja presentación de NVPO no fue posible diferenciar cuál de los esquemas mostró mayor efectividad, ya que para ello se requiere, además de un diseño prospectivo con un período de observación más largo, efectuar la comparación con placebo en un ensayo clínico controlado aleatorizado.
Fue posible identificar tres factores de riesgo asociados a la presencia de NVPO en pacientes con cáncer de mama que se someten a procedimiento quirúrgico en la Unidad de Cirugía Ambulatoria, en orden de importancia fueron el antecedente de náusea y vómito, recibir tratamiento con QT aislada y recibir cualquier tratamiento (QT, QT + RT o RT).
En nuestra institución las características generales de nuestra población no difirieron significativamente de las reportadas en otras poblaciones o los procedimientos quirúrgicos realizados, pero al tener un índice de reingreso bajo podemos demostrar que la pre-medicación previa al evento quirúrgico disminuye de manera significativa la presencia y control de náusea y vómito postoperatorio mejorando el confort durante su estancia hospitalaria y su egreso inmediato[16]-[24].
Las principales limitantes son que al tratarse de un estudio retrospectivo se debe considerar sesgo de selección. Se identificó sesgo de información como cirugías programadas en la unidad ambulatoria que se realizaron fuera de la Unidad de Cirugía Ambulatoria, o programación de procedimientos medico quirúrgicos que no fueras de cirugía de mama.
Las principales conclusiones fueron: en nuestro estudio observamos una tasa muy baja de NVPO y fue posible demostrar que, en una Unidad de Cirugía Ambulatoria, la pre-medicación previa al evento quirúrgico en pacientes con cáncer de mama disminuye de manera significativa la presencia y control de náusea y vómito postoperatorio mejorando el confort durante su estancia hospitalaria y su egreso inmediato. Fue posible identificar tres factores de riesgo asociados a la presencia de NVPO que por orden de importancia fueron el antecedente de náusea y vómito, recibir tratamiento con QT aislada y recibir cualquier tratamiento (QT, QT + RT o RT)[25],[26],[27].
El manejo integral de la náusea y vómito postoperatorio en nuestra población demostró una incidencia menor a lo que se encuentra registrado en la literatura mundial por lo que el desarrollar una selección adecuada del paciente, así como de los medicamentos antieméticos indicados de acuerdo a las características de cada uno de nuestros pacientes ayudara de manera significativa no solo la evolución sino su recuperación y egreso oportuno[28]-[32].
Es necesario realizar estudios que profundicen en estos hallazgos en nuestra población y permitan discriminar con precisión, en un diseño experimental, prospectivo y longitudinal la efectividad del tratamiento farmacológico de las NVPO[33]-[47].
| Tabla 1. Resumen de las variables cualitativas del estudio | |||
|
Variable |
Recuento | Porcentaje | |
|
Procedimiento |
Cirugía conservadora + ganglio centinela |
58 | 35,2% |
|
Mastectomía simple |
25 | 15,2% | |
|
Mastectomía radical |
12 | 7,3% | |
|
Extracción y retiro de implantes |
9 | 5,5% | |
|
Reconstrucción de colgajo |
9 | 5,5% | |
|
Recambio y colocación de implantes mamarios |
8 | 4,8% | |
|
Ampliación de margen + ganglio centinela |
8 | 4,8% | |
|
Biopsia excisional |
6 | 3,6% | |
|
Excisión local amplia + ganglio centinela |
5 | 3,0% | |
|
Mastectomía total |
5 | 3,0% | |
|
Catéter Port-a-Cath |
4 | 2,4% | |
|
Mastopexia y reconstrucción de pezón |
4 | 2,4% | |
|
Resección amplia + ganglio centinela |
3 | 1,8% | |
|
Recambio y colocación de expansores |
3 | 1,8% | |
|
Catéter venoso central |
2 | 1,2% | |
|
Mamoplastía |
2 | 1,2% | |
|
Reconstrucción tardía de mama |
1 | 0,6% | |
|
Rotación de colgajo miocutáneo |
1 | 0,6% | |
|
Disección radical de axila derecha |
0 | 0,0% | |
|
Total |
165 | 100,0% | |
|
Causa de internamiento |
Alta a domicilio |
154 | 93,3% |
|
Dolor |
7 | 4,2% | |
|
Dolor + hematoma |
3 | 1,8% | |
|
Reintervención |
1 | 0,6% | |
|
Total |
165 | 100,0% | |
|
Antecedente de náusea y vómito |
Sí |
35 | |
|
No |
130 | ||
|
Total |
165 | ||
|
Náusea y vómito preoperatorio |
Sí |
0 | |
|
No |
165 | ||
|
Total |
165 | ||
|
Náuseas y vómito postoperatorio |
Sí |
3 | |
|
No |
162 | ||
|
Total |
165 | ||
|
Quimioterapia previa |
Tamoxifeno |
4 | 2,4% |
|
Paclitaxel |
16 | 9,7% | |
|
Ciclofosfamida + adriamicina |
1 | 0,6% | |
|
Docetaxel |
2 | 1,2% | |
|
Paclitaxel + adriamicina |
4 | 2,4% | |
|
Quimioterapia previa |
Metotrexate + actinomicina |
1 | 0,6% |
|
Ciclofosfamida + adriamicina + paclitaxel |
3 | 1,8% | |
|
Ciclofosfamida + paclitaxel + radioterapia |
1 | 0,6% | |
|
Fluoruracilo + doxorrubicina + ciclofosfamida |
1 | 0,6% | |
|
Paclitaxel + cisplatino |
2 | 1,2% | |
|
FAC + paclitaxel |
2 | 1,2% | |
|
Bleomicina + etopósido + cisplatino |
1 | 0,6% | |
|
Paclitaxel + radioterapia |
7 | 4,2% | |
|
Paclitaxel + trastuzumab |
4 | 2,4% | |
|
Adriamicina + cisplatino + paclitaxel + radioterapia |
1 | 0,6% | |
|
Capecitabina + radioterapia |
1 | 0,6% | |
|
Radioterapia |
3 | 1,8% | |
|
Total |
54 | 100,0% | |
|
Técnica anestésica |
AGB |
164 | 99,4% |
|
AGB + PEC |
1 | 0,6% | |
|
Total |
165 | 100,0% | |
|
Tratamiento antiemético |
Metoclopramida 10 mg |
4 | 2,4% |
|
Metoclopramida 10 mg + dexametasona 8 mg |
85 | 51,5% | |
|
Metoclopramida 10 mg + dexametasona 8 mg + ondansetrón 4 mg |
33 | 20,0% | |
|
Metoclopramida 10 mg + Dexametasona 8 mg + ondansetrón 8 mg |
41 | 24,8% | |
|
Dexametasona 8 mg + ondansetrón 4 mg |
2 | 1,2% | |
|
Total |
165 | 100,0% | |
|
Tratamiento |
Recibe tratamiento |
54 | 32,7% |
|
No recibe tratamiento |
111 | 67,3% | |
|
Total |
165 | 100,0% | |
|
Tratamiento |
QT + RT |
10 | 6,1% |
|
RT |
3 | 1,8% | |
|
QT |
41 | 24,8% | |
|
Sin tratamiento |
111 | 67,3% | |
|
Total |
165 | 100,0% | |
|
Radioterapia |
Con radioterapia |
13 | 7,9% |
|
Sin radioterapia |
152 | 92,1% | |
|
Total |
165 | 100,0% | |
| Tabla 2. Resumen de la variable edad | ||||
| Edad | ||||
| Media | Mediana | Desviación estándar | Mínimo | Máximo |
| 52,8 | 53,0 | 11,21 | 22 | 85 |
| Tabla 3. Razones de momios calculadas en el estudio | ||||
| Factor de riesgo | RM | IC 95% | 2 | Valor de p |
|
Antecedente de náusea y vómito |
28,1 | 1,42 – 55,8 | 11,35 | 0,009 |
|
QT aislada |
22,6 | 1,14 – 44,8 | 9,24 | 0,026 |
|
Recibe algún tratamiento (QT, QT + RT o RT) |
15,2 | 0,77 – 29,9 | 6,3 | 0,012 |
Referencias
1. Urman RD, Desai SP. History of anesthesia for ambulatory surgery. Curr Opin Anaesthesiol. 2012 Dec;25(6):641–7. PMID:23032681
2. Rojas E. Evolución de la cirugía ambulatoria. Rev Mex Anest. 2012;35 S1:108–11.
3. Glass PS. The future and safety of ambulatory surgery. S Afr J Anaesthesiol Analg. 2014;20(1):59–61.
4. Frederico C. El reto de la cirugía ambulatoria; tendencias actuales. Rev Mex Anest. 2013;36(S1).
5. Secretaría de Salud. NOM-026-SSA3-2012, Para la práctica de la cirugía mayor ambulatoria. Diario Oficial de la Federación. 2012 Aug 7;107–12.
6. Kolodzie K, Apfel CC. Nausea and vomiting after office-based anesthesia. Curr Opin Anaesthesiol. 2009 Aug;22(4):532–8. https://doi.org/10.1097/ACO.0b013e32832dba81 PMID:19512914
7. Sánchez-García S, Pardo-García R, Manzanares Campillo MC, Muñoz-Atienza V, García-Santos EP, Martín Fernández J; Experiencia en el Hospital General de Ciudad Real. Tratamiento quirúrgico ambulatorio del cáncer de mama. Experiencia en el Hospital General de Ciudad Real. Rev Senol y Patol Mamar. 2015;28(4):168–71. https://doi.org/10.1016/j.senol.2015.08.001.
8. Davis JE. The future of major ambulatory surgery. Surg Clin North Am. 1987 Aug;67(4):893–901. https://doi.org/10.1016/S0039-6109(16)44291-X PMID:3603338
9. Verde L, López E. Índices de Calidad en cirugía ambulatoria. Cir May Amb. 2013;18(3):114–6.
10. Vergara F, Freitas Ramírez A, Gispert R, Coll JJ, Saltó E, Trilla A. Evolución de la cirugía mayor ambulatoria en Cataluña, 2001-2011. Gac Sanit. 2015 Nov-Dec;29(6):451–3. https://doi.org/10.1016/j.gaceta.2015.06.006 PMID:26249313
11. Tan EY, Pek CH, Tey BL. Ambulatory surgery for the patient with breast cancer: current perspectives. Open Access Surg. 2016 Aug;9:65–70. https://doi.org/10.2147/OAS.S97551.
12. Julià E, Picart G, Serra C, Nieto M, Hernández GM, Gubern JM. Programa de cirugía mayor ambulatoria para cáncer de mama: experiencia en el Hospital de Mataró. Rev Senol y Patol Mamar. 2017 Jan;30(1):10–4. https://doi.org/10.1016/j.senol.2017.01.002.
13. Hocking G, Weightman WM, Smith C, Gibbs NM, Sherrard K. Measuring the quality of anaesthesia from a patient’s perspective: development, validation, and implementation of a short questionnaire. Br J Anaesth. 2013 Dec;111(6):979–89. https://doi.org/10.1093/bja/aet284 PMID:23985532
14. Nazar JC, Bastidas EJ, Coloma DR, Zamora HM, Fuentes HR. Prevención y tratamiento de pacientes con náuseas y vómitos postoperatorios. Vol. 69. Rev Chil Cir. 2017;69(5):421–8. https://doi.org/10.1016/j.rchic.2017.02.009.
15. Carlos LA, Sergio QE. Profilaxis y tratamiento de las náuseas y vómitos postoperatorios. Rev Chil Anest. 2009;38(1):24–33.
16. Veiga-Gil L, Pueyo J, López-Olaondo L. Náuseas y vómitos postoperatorios: fisiopatología, factores de riesgo, profilaxis y tratamiento. Rev Esp Anestesiol Reanim. 2017 Apr;64(4):223–32. https://doi.org/10.1016/j.redar.2016.10.001 PMID:28041609
17. Carrillo R, Espinoza I, Nava JA. Náusea y vómito postoperatorio. Rev Mex Anestesiol. 2012;35(2):122–31.
18. Apfel CC, Heidrich FM, Jukar-Rao S, Jalota L, Hornuss C, Whelan RP, et al. Evidence-based analysis of risk factors for postoperative nausea and vomiting. In: British Journal of Anaesthesia. 2012. p. 742–53. https://doi.org/10.1093/bja/aes276.
19. Gan TJ, Diemunsch P, Habib AS, Kovac A, Kranke P, Meyer TA, et al.; Society for Ambulatory Anesthesia. Consensus guidelines for the management of postoperative nausea and vomiting. Anesth Analg. 2014 Jan;118(1):85–113. https://doi.org/10.1213/ANE.0000000000000002 PMID:24356162
20. Apfel CC, Philip BK, Cakmakkaya OS, Shilling A, Shi YY, Leslie JB, et al. Who is at risk for postdischarge nausea and vomiting after ambulatory surgery? Anesthesiology. 2012 Sep;117(3):475–86. https://doi.org/10.1097/ALN.0b013e318267ef31 PMID:22846680
21. García Gómez J, Pérez López ME, Alonso Bermejo M, Escobar Álvarez Y, García Mata J; SEOM. SEOM guide to antiemetic prophylaxis in cancer patients treated with chemotherapy 2013. Clin Transl Oncol. 2013 Dec;15(12):1030–6. https://doi.org/10.1007/s12094-013-1093-2 PMID:24019035
22. Basch E, Hesketh PJ, Kris MG, Prestrud AA, Temin S, Lyman GH. Antiemetics: american society of clinical oncology clinical practice guideline update. J Oncol Pract. 2011 Nov;7(6):395–8. https://doi.org/10.1200/JOP.2011.000397 PMID:22379425
23. Grunberg SM, Osoba D, Hesketh PJ, Gralla RJ, Borjeson S, Rapoport BL, et al. Evaluation of new antiemetic agents and definition of antineoplastic agent emetogenicity—an update. Support Care Cancer. 2005 Feb;13(2):80–4. https://doi.org/10.1007/s00520-004-0718-y PMID:15599601
24. Roila F, Molassiotis A, Herrstedt J, Aapro M, Gralla RJ, Bruera E, et al.; participants of the MASCC/ESMO Consensus Conference Copenhagen 2015. 2016 MASCC and ESMO guideline update for the prevention of chemotherapy- and radiotherapy-induced nausea and vomiting and of nausea and vomiting in advanced cancer patients. Ann Oncol. 2016 Sep;27 suppl 5:v119–33. https://doi.org/10.1093/annonc/mdw270 PMID:27664248
25. Valle AE, Cervantes G, Franco EE, García G, Hernández GA, López M, et al. Guías de Manejo de Antieméticos en Oncología,Hematología y Radioterapia. Gac Mex Oncol. 2011;10 S4:3–11.
26. Cervantes G, Ochoa FJ, Acosta A, Alvarado M, Arreguín FE, Enríquez MI, et al. Guía para el manejo de antieméticos en oncología, hematología y radioterapia. Gac Mex Oncol. 2016;15 S2:3–34.
27. Berger MJ, Ettinger DS, Aston J, Barbour S, Bergsbaken J, Bierman PJ, et al. NCCN Guidelines Insights: Antiemesis, Version 2.2017. J Natl Compr Canc Netw. 2017 Jul;15(7):883–93. https://doi.org/10.6004/jnccn.2017.0117 PMID:28687576
28. Molassiotis A, Aapro M, Herrstedt J, Gralla R, Roila F. MASCC/ESMO Antiemetic Guidelines: introduction to the 2016 guideline update. Support Care Cancer. 2017 Jan;25(1):267–9. https://doi.org/10.1007/s00520-016-3324-x PMID:27501964
29. Kaye AD, Cornett EM, Chalabi J, Naim NZ, Novitch MB, Creel JB, et al. Pharmacology of Antiemetics: Update and Current Considerations in Anesthesia Practice. Anesthesiol Clin. 2017 Jun;35(2):e41–54. https://doi.org/10.1016/j.anclin.2017.01.003 PMID:28526160
30. Berrío Valencia MI, Botero Aguirre JP. Eficacia del aprepitant para la prevención de la náusea y el vómito postoperatorios. Revisión sistemática y metaanálisis de ensayos clínicos. Vol. 27, Iatreia. scieloco; 2014. p. 386–97.
31. Bodge M, Shillingburg A, Paul S, Biondo L. Safety and efficacy of aprepitant for chemotherapy-induced nausea and vomiting in pediatric patients: a prospective, observational study. Pediatr Blood Cancer. 2014 Jun;61(6):1111–3. https://doi.org/10.1002/pbc.24901 PMID:24357337
32. De Oliveira GS Jr, Almeida MD, Benzon HT, McCarthy RJ. Perioperative single dose systemic dexamethasone for postoperative pain: a meta-analysis of randomized controlled trials. Anesthesiology. 2011 Sep;115(3):575–88. https://doi.org/10.1097/ALN.0b013e31822a24c2 PMID:21799397
33. Bataille A, Letourneulx JF, Charmeau A, Lemedioni P, Léger P, Chazot T, et al. Impact of a prophylactic combination of dexamethasone-ondansetron on postoperative nausea and vomiting in obese adult patients undergoing laparoscopic sleeve gastrectomy during closed-loop propofol-remifentanil anaesthesia: A randomised double-blind place. In: European Journal of Anaesthesiology. 2016. p. 898–905. https://doi.org/10.1097/EJA.0000000000000427.
34. Mizukami N, Yamauchi M, Koike K, Watanabe A, Ichihara K, Masumori N, et al. Olanzapine for the prevention of chemotherapy-induced nausea and vomiting in patients receiving highly or moderately emetogenic chemotherapy: a randomized, double-blind, placebo-controlled study. J Pain Symptom Manage. 2014 Mar;47(3):542–50. https://doi.org/10.1016/j.jpainsymman.2013.05.003 PMID:23856100
35. Hesketh PJ, Bohlke K, Lyman GH, Basch E, Chesney M, Clark-Snow RA, et al.; American Society of Clinical Oncology. Antiemetics: american Society of Clinical Oncology focused guideline update. J Clin Oncol. 2016 Feb;34(4):381–6. https://doi.org/10.1200/JCO.2015.64.3635 PMID:26527784
36. Smith HS, Smith JM, Seidner P. Opioid-induced nausea and vomiting. Ann Palliat Med. 2012 Jul;1(2):121–9. PMID:25841472
37. Chelkeba L, Gidey K, Mamo A, Yohannes B, Matso T, Melaku T. Olanzapine for chemotherapy-induced nausea and vomiting: systematic review and meta-analysis. Pharm Pract (Granada). 2017 Jan-Mar;15(1):877. https://doi.org/10.18549/PharmPract.2017.01.877 PMID:28503222
38. Rojas S, Velázquez P, Segura M. Cannabinoides: utilidad actual en la práctica clínica. Acta Med Grupo Ángeles. 2015;13(4):244–50.
39. Veiga-Gil L, López-Olaondo L, Pueyo J, Callejas R, Duque P, Carrascosa F. Dosis bajas de haloperidol en combinación con ondansetrón no son eficaces para la profilaxis de náuseas y vómitos postoperatorios en pacientes propicios a esta complicación. Cir Esp. 2015;93(2):110–6. https://doi.org/10.1016/j.ciresp.2014.01.011 PMID:24629922
40. Chaparro C, Moreno D, Ramírez V, Fajardo A, González D, Sanín A, et al. Haloperidol como profilaxis para náuseas y vómito postoperatorios: revisión sistemática. Rev Colomb Anestesiol. 2013 Jan;41(1):34–43. https://doi.org/10.1016/j.rca.2012.07.010.
41. Grant MC, Kim J, Page AJ, Hobson D, Wick E, Wu CL. The effect of intravenous midazolam on postoperative nausea and vomiting: A meta-analysis. Anesth Analg. 2016 Mar;122(3):656–63. https://doi.org/10.1213/ANE.0000000000000941 PMID:26332858
42. Ahn EJ, Kang H, Choi GJ, Baek CW, Jung YH, Woo YC. The Effectiveness of Midazolam for Preventing Postoperative Nausea and Vomiting: A Systematic Review and Meta-Analysis. Anesth Analg. 2016 Mar;122(3):664–76. https://doi.org/10.1213/ANE.0000000000001062 PMID:26516802
43. Lee Y, Wang JJ, Yang YL, Chen A, Lai HY. Midazolam vs ondansetron for preventing postoperative nausea and vomiting: a randomised controlled trial. Anaesthesia. 2007 Jan;62(1):18–22. https://doi.org/10.1111/j.1365-2044.2006.04895.x PMID:17156222
44. Unlugenc H, Guler T, Gunes Y, Isik G. Comparative study of the antiemetic efficacy of ondansetron, propofol and midazolam in the early postoperative period. Eur J Anaesthesiol. 2004 Jan;21(1):60–5. https://doi.org/10.1097/00003643-200401000-00010 PMID:14768925
45. Naghibi K, Kashefi P, Azarnoush H, Zabihi P. Prevention of postoperative nausea and vomiting with a subhypnotic dose of Propofol in patients undergoing lower abdominal surgery: A prospective, randomized, double-blind study. Adv Biomed Res. 2015 Feb;4(1):35. https://doi.org/10.4103/2277-9175.151239 PMID:25789261
46. Wallenborn J, Gelbrich G, Bulst D, Behrends K, Wallenborn H, Rohrbach A, et al. Prevention of postoperative nausea and vomiting by metoclopramide combined with dexamethasone: randomised double blind multicentre trial. BMJ. 2006 Aug;333(7563):324. https://doi.org/10.1136/bmj.38903.419549.80 PMID:16861255
47. Blaudszun G, Lysakowski C, Elia N, Tramèr MR. Effect of perioperative systemic α2 agonists on postoperative morphine consumption and pain intensity: systematic review and meta-analysis of randomized controlled trials. Anesthesiology. 2012 Jun;116(6):1312–22. https://doi.org/10.1097/ALN.0b013e31825681cb PMID:22546966

 ORCID
ORCID