Alexo López Á.*, Adriana Román F.*, Vanesa Vilanova V.*, María del Carmen Corujeira R.*, Iván Areán G.* y José Luis Barreiro C.*
Reve Chil Anest Vol. 42 Número 2 pp. 180-182|doi:
PDF|ePub|RIS
Introducción
La obesidad en los países desarrollados está creciendo hasta alcanzar proporciones epidémicas, con gran impacto sobre las políticas sanitarias; cada vez es más frecuente en nuestra práctica clínica enfrentarnos a complicaciones de esta patología y de los tratamientos a los que son sometidos estos pacientes.
El tratamiento quirúrgico de la obesidad se considera la única opción útil encaminada a la reducción ponderal mantenida en pacientes con índice de masa corporal mayor de 40 Kg·m2, o mayor de 35 Kg·m2 si se acompaña de otras comorbilidades. Los diferentes tipos de intervención realizadas, se clasifican en malabsortivas, restrictivas y mixtas. El by-pass gástrico en Y-de-Roux (BGYR) es uno de los procedimientos habituales, y consiste en crear un pequeño reservorio gástrico que se anastomosa al extremo del asa de Roux, aunque posiblemente sea más frecuente la manga gástrica.
A continuación exponemos una paciente que después de ser sometida a un BGYR laparoscópico, sufrió una estenosis de la anastomosis gastro-yeunal por lo que requirió dilataciones endoscópicas por el Servicio de Digestivo.
Caso clínico
Una mujer, de 42 años, fue programada para un BGYR laparoscópico. Su IMC era de 52 Kg·m2, tenía antecedentes de alergia al ácido acetil salicílico y su tratamiento previo incluía metoclopramida, enoxaparina y pantoprazol. Aproximadamente 4 meses después empieza a presentar intolerancia a la alimentación oral, especialmente de sólidos, diagnosticándose una estenosis de la anastomosis gastro-yeyunal, por lo que se le realizan dilataciones endoscópicas bajo anestesia general. Tras la 3ª sesión la paciente ingresa en la Sala de Recuperación con hipotensión de 80/40 mmHg, taquicardia a 110 lpm y con dolor abdominal intenso y distensión abdominal aunque sin signos de peritonismo. Realizamos una radiografía abdominal que muestra aire subdiafragmático bilateral, siendo diagnosticado une neumoperitoneo por perforación intestinal, sin poder precisar a qué nivel se encontraba la perforación. Se le administra sueroterapia agresivamente (1.000 ml de cristaloides y 1.000 ml de coloides), se realiza sondaje urinario y nasogástrico y se trata el dolor con bolos de cloruro mórfico, aliviándose parcialmente el cuadro. En los exámenes de ingreso la paciente presenta leucocitosis con desviación a izquierda, plaquetopenia, insuficiencia renal y una llamativa coagulopatía, con 35% de actividad de protrombina (APT) y 125 segundos de tiempo de tromboplastina (TTPA), elevándose la GOT hasta 12.167 UI/L. Se realiza tránsito intestinal, que demuestra estenosis de la anastomosis gastro-yeyunal, impidiendo el paso de contraste pero sin embargo no de la sonda nasogástrica.
El estado de la paciente se deteriora progresivamente en el curso de una hora, apareciendo acidosis metabólica, oligoanuria e hipotensión que ya no responde a la administración de volumen intravascular, lo que obliga a iniciar infusión de noradrenalina en un intento de mantener una presión de perfusión tisular aceptable.
Debido al agravamiento general que presenta se solicita un TAC abdominal que muestra un gran neumoperitoneo sin signos de colangitis, y de nuevo sin conseguir localizar el punto de perforación. Al repetir los exámenes de laboratorio se constata un empeoramiento muy importante de la coagulopatía, llegando la APT a un 9%, un descenso de GOT hasta 4.121 UI/L, y persistencia de leucocitosis con cayados. Se decide tratamiento quirúrgico; intentamos canalizar catéter venoso central en vena yugular interna derecha sin éxito, implantando finalmente el catéter en vena femoral izquierda. Medimos una presión intraabdominal a través de la sonda urinaria, arrojando un resultado de 25 cm de H20 (18,3 mm de Hg).
La intubación en quirófano resulta dificultosa por desplazamiento de la vía aérea debido al hematoma provocado por el intento de canalizar la vía central, persiste hipotensa, oligúrica y acidótica a pesar de la perfusión de noradrenalina a dosis altas. A pesar de la grave situación de la paciente, y dado que se encontraba de guardia un cirujano con experiencia muy amplia en cirugía bariátrica, se decide iniciar la revisión quirúrgica a través de laparoscopia con la intención de realizar una laparotomía según los hallazgos. Se implantan los trocares de laparoscopia sin necesidad de insuflar aire en la cavidad abdominal, se realiza punción-aspiración de la cavidad gástrica, cuya gran dilatación parecía en arte responsable del cuadro de hipertensión abdominal objetuvado, y se encuentra una perforación en la anastomosis gastro-yeyunal que se sutura de forma directa. Al reingreso en reanimación procedente del quirófano persiste la coagulopatía y el sangrado, y se le administran 8 concentrados de hematíes, 2.000 mL de plasma fresco congelado y 2 pool de plaquetas. En el primer día de postoperatorio se realiza ecocardiograma que demuestra función sistólica conservada y ausencia de dilatación de cavidades derechas, siguiendo precisando vasopresores y hemoderivados. En total requirió 13 concentrados de hematíes, 3.000 mL de PFC, 2 pools de plaquetas, fibrinógeno y concentrado de factores II, V, IX y X. Se inicia hemodiafiltración veno-venosa continua por la anuria, acidosis metabólica incontrolable y sobrecarga de volumen. A pesar de todos los esfuerzos, la paciente fallece por un fracaso multiorgánico el 2º día tras el procedimiento.
Discusión
La paciente sufrió una complicación frecuente dentro del tipo de intervención bariátrica realizado, la estenosis de la anastomosis gastro-yeyunal, con incidencias entre un 4 y 27% de los pacientes intervenidos, y su momento de aparición habitual es precisamente dentro de los primeros 6 meses de postoperatorio 1 . La primera cuestión que surge es si está justificada la actitud expectante ante un neumoperitoneo en este contexto. La literatura muestra variedad de casos de neumoperitoneo manejados conservadoramente, tanto espontáneos como tras procedimientos endoscópicos. Entre las causas de neumoperitoneo, la mayoría son de tipo iatrogénicos, como la cirugía abdominal abierta (60%), la colecistectomía laparoscópica (25%), la diálisis peritoneal crónica (30-33%), y muy lejos se citan la colonoscopía diagnóstica (1% del total de neumoperitoneos no quirúrgicos) y la colonoscopía terapéutica (3%) 2 . De hecho la mayoría de los procedimientos endoscópicos se asocia a la presencia de neumoperitoneo, y el manejo conservador se supone seguro incluso ante signos de irritación peritoneal. Casi todas las perforaciones tras esfinterotomías endoscópicas admiten un manejo conservador exitoso 3 ,4 .
Si buscamos en la bibliografía información referente a la posibilidad de hacer un manejo no quirúrgico (drenaje-succión nasogástrica, antibióticos de amplio espectro, reposo digestivo, nutrición parenteral, monitorización intensiva e implantación de stent si la perforación es de origen maligno o existe fístula traqueo-esofágica) de las perforaciones gastrointestinales altas, independientemente de su origen iatrogénico, encontramos que en casos seleccionados, y siempre de acuerdo con el equipo quirúrgico se puede realizar si el dolor es moderado, no existen signos de shock, la leucocitosis es moderada y no existe evidencia de sepsis 5 ,6 .
Los mecanismos causales que se podrían invocar en este caso son principalmente la presencia de la perforación intestinal, que por sí sola explicaría la aparición de un síndrome de respuesta inflamatoria sistémica con shock secundario a vasoplejia y coagulopatía e insuficiencia renal como la observada. El compromiso hepático secundario a sepsis nos parece más improbable dada la rapidez de la evolución y la edad de la paciente, aun teniendo en cuenta las alteraciones inmunológicas asociadas a la obesidad y la conocida presencia de esteatosis hepática en el obeso mórbido, que alcanza hasta una prevalencia del 84% 7 . En cambio el fallo hepático como elemento central del cuadro sí que nos parece más concordante con la hipertensión abdominal observada.
Se sabe que el neumoperitoneo quirúrgico de 14 mm de Hg en la cirugía laparoscópica se asocia a una reducción del flujo portal de 54%, conduciendo a la elevación de transaminasas tras colecistecomías laparoscópicas, que retornan habitualmente a cifras normales a las 72 h del procedimiento7. Por eso creemos que la isquemia hepática secundaria a un síndrome compartimental abdominal (S.C.A.) explica de forma más plausible la evolución clínica y analítica. Nuestra paciente tiene varios factores de riesgo para desarrollar una hipertensión abdominal, como la presencia de acidosis, la disfunción hepática, la resucitación masiva con líquidos, el índice de masa corporal elevada y la distensión abdominal 8 .
No disponemos de las cifras de presión intraabdominal al ingreso en nuestra unidad, y lo que aún sería más importante, tampoco conocemos las cifras de presión intraabdominal ni la cantidad de aire insuflada durante el procedimiento endoscópico que desencadenó los acontecimientos, pero creemos que fue importante dada la cantidad observada en las imágenes radiológicas en la cavidad gástrica puenteada, y que tuvo que recorrer toda el asa desde la anastomosis desde donde se realizaba la dilatación.
Las guías sobre el manejo del S.C.A. aconsejan un manejo quirúrgico desde cifras de 20-25 mm Hg, aunque condicionado a la repercusión clínica provocada8. Existe información bibliográfica de un cuadro denominado taponamiento abdominal agudo o neumoperitoneo a tensión; en estas referencias se recomienda considerar la necesidad de realizar una punción con aguja a través de la pared abdominal para una descompresión inmediata aún sin confirmación radiológica 9 ,10 . Es interesante que se haga referencia como base de un diagnóstico definitivo a la presencia radiológica de un desplazamiento medial e inferior del hígado, que nuestra paciente presentaba en la radiografía abdominal simple (Figura 1). En pacientes sometidas a dilataciones endoscópicas debe haber un elevado índice de sospecha de este cuadro y se debería incorporar la monitorización de la presión intraabdominal a la práctica habitual de las Unidades de Reanimación, como una herramienta sencilla y valiosa en nuestros algoritmos de toma de decisiones.
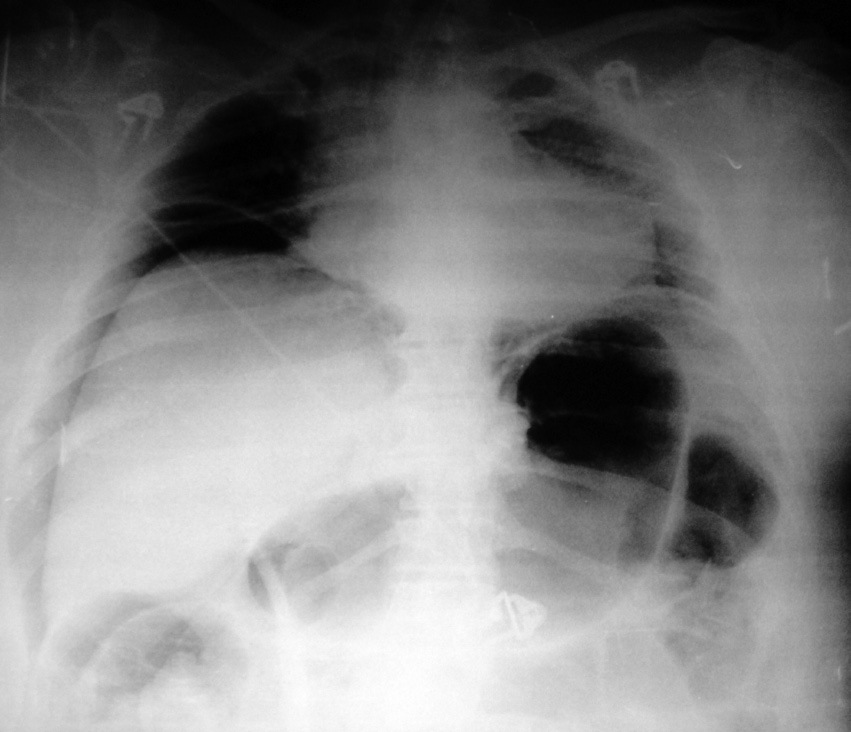
Figura 1 Imagen procedente de estudio digestivo gastroduodenal con contraste.
REFERENCIAS
- Osviowitz M, Kanagarajan N, Ahmad A. Endoscopic issues in the post-gastric by-pass patient. Gastrointest Endoscopy Clin N Am 2006; 16: 121-132.
- Mularski R, Sippel J, Osborne M. Pneumoperitoneum: a review of non-surgical causes. Crit.Care Med 2000; 28: 2638-2644.
- Cotton PB, Lehman G, Vennes J, et al. Endoscopic sphincterotomy complications and their management: An attempt at consensus. Gastrointest Endosc 1991; 37: 383-393.
- García Martínez T, Ruano A, Galán L, et al. Neumoperitoneo tras colangiografía retrógrada endoscópica. Rev Esp Enferm Dig 2007; 99: 427-429.
- Hochberger J, Rabenstein T, Muhldorfer S, et al. Management of complications of upper and lower gastrointestinal endoscopy. Acta Endoscopica 1998; 28: 689-693.
- Ginzburg L, Greenwald D, Cohen J. Complications of endoscopy. Gastrointestinal Endoscopic Clinics of North America, 2007; 17: 405-432.
- Nguyen N, Wolfe B. The physiologic effects of pneumoperitoneum in the morbid obese patient. Annals of Surgery 2005; 241: 219-226.
- Cheatham ML, Malbrain ML, Kirkpatrick A, et al. Results from the International conference of experts on intra-abdominal hypertension and abdominal compartment syndrome. Intensive Care Med 2007; 33: 951-962.
- Ortega Carnicer J, Ambrós Checa A. Neumoperitoneo a tensión. Med Intensiva 2005; 29: 114.
- Lin WB, Thanassi W. Tension pneumoperitoneum. The Journal of Emergency Medicine 2008, 38: 57-59.
