Tania Campos 1 , Sebastián Eulufi 2 , María Alexandra Fajardo Razmilic 3 , Katia Elisa Guerra Hollstein 4 , Isabel Margarita María Pérez Díaz 5 , Waldo Merino U. 6 , Liliana Elena Ramos Ramos 7 , María Antonieta Ribal Laiz 8
Recibido: 21 de diciembre de 2017
Aceptado: 10 de enero de 2018
©2018 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Rev Chil Anest Vol. 47 Núm. 1 pp. 46-63|https://doi.org/10.25237/revchilanestv47n01.09
PDF|ePub|RIS
1 Enfermera de Anestesia Hospital Dr. Luis Calvo Mackenna 2 Anestesiólogo Hospital Dr. Luis Calvo Mackenna. Profesor Instructor Universidad de Chile 3 Anestesiólogo Jefe Departamento de Anestesia Hospital Roberto del Río; Anestesiólogo Clínica Alemana Santiago 4 Anestesiólogo Hospital Roberto del Río, Anestesiólogo Hospital Clínico Pontificia Universidad Católica de Chile. Docente Pontificia Universidad Católica de Chile. 5 Anestesiólogo Hospital Roberto del Río, Anestesiólogo Clínica Las Condes Santiago. Coordinadora responsable del centro Hospital Roberto del Río. 6 Anestesiólogo Profesor Asistente, Departamento de Cirugía, Traumatología y Anestesia Universidad de La Frontera. Representante del Comité de Recomendaciones Clínicas de la Sociedad de Anestesiología de Chile 7 Anestesiólogo Hospital Roberto del Río. Anestesiólogo Clínica Santa María Santiago. 8 Anestesiólogo Jefe Departamento de Anestesia Hospital Dr. Luis Calvo Mackenna. Anestesiólogo Clínica Santa María Santiago. Profesor Instructor Universidad de Santiago. Profesor Instructor Universidad de los Andes. Docente Universidad del Desarrollo. Coordinadora responsable del centro Hospital Dr. Luis Calvo Mackenna
-
1.3 Publicación de la Recomendación Clínica
11 de noviembre de 2017. 45º Congreso de Anestesiología de Chile. Santiago. Chile.
-
1.4. Agradecimientos
-
A los pacientes que atendemos día a día y que inspiraron esta recomendación.
-
A quienes nos permitieron participar de la creación de este documento.
-
A quienes previamente trabajaron y documentaron el tema de esta recomendación.
-
A nuestros colegas que harán uso de este documento, permitiendo compartir nuestra visión y respaldarla, mejorando la atención del manejo del dolor perioperatorio en niños.
-
A nuestras familias y núcleo cercano quienes compartieron su tiempo para que este trabajo fuese posible.
2. Resumen estructurado
Existe evidencia que sugiere que las guías de práctica clínica realizadas rigurosamente logran transferir el conocimiento y mejorar la calidad de la salud en indicadores de estructuras, procesos y resultados. Por ello, la SACH ha planteado como una política de nuestra institución la elaboración de recomendaciones clínicas que, desde el año 2003 a la fecha, respalden el trabajo profesional de nuestros asociados a lo largo del país, con estándares de calidad adecuados a los tiempos, señalando la mejor evidencia disponible, para un mejor desempeño clínico y profesional, en beneficio de nuestros pacientes y la salud pública de nuestro país.
La presente recomendación clínica es una actualización de la publicada en el año 2007 “Recomendaciones para el Manejo del Dolor Agudo en Niños”, establece en su objetivo el constituir una referencia actualizada y basada en la evidencia, para el médico anestesiólogo que trabaja en el ámbito hospitalario nacional, que se enfrenta al manejo del dolor agudo perioperatorio en el paciente pediátrico entre 1 mes y 18 años de edad. En su calidad de recomendación, esta guía no pretende reemplazar el buen juicio clínico del anestesiólogo o de cualquier médico que la utiliza en un contexto particular. Esta Recomendación Clínica: “Manejo del Dolor Agudo Perioperatorio en Niños” de la SACH, con rigurosidad metodológica y con la evidencia disponible, señala las condiciones de infraestructura, equipamiento, farmacológicos y orientación clínica necesarios para un buen desempeño profesional. Específicamente señala las mejores estrategias en el manejo del dolor perioperatorio en niños, información relevante para los anestesiólogos del país, autoridades sanitarias, pacientes y familiares.
El MINSAL ha desarrollado una definición precisa de los contenidos y condiciones de calidad que deben cumplir las RCs, para guiar a los grupos técnicos en el proceso de formulación a través de diferentes documentos sintetizados en el instructivo que “Establece Requisitos Básicos para la Elaboración de Guías Clínicas y Protocolos del Ministerio de Salud”[7].
Nuestras RCs se adhiere a las indicaciones del MINSAL y como sociedad científica ha establecido un proceso de actualización permanente de la RCs y la formulación de nuevas de acuerdo a las necesidades del país, dando cuenta de la nueva evidencia disponible, avances tecnológicos e interés de la SACH, entre sus socios y pacientes.
En su elaboración se conformó un equipo de trabajo de anestesiólogos pertenecientes a los Hospitales Dr. Luis Calvo Mackenna y Dr. Roberto del Río. Este equipo trabajó durante los años 2016 y 2017, de acuerdo al formato de RCs de la SACH, que señala objetivos generales, ámbito de influencia, sustento técnico, entre otros. Aspectos que están desarrollados en el marco de criterios técnicos claros, exigencias metodológicas actualizadas y fundamentadas en la evidencia disponible, según las indicaciones detalladas en el documento “Orientaciones para la elaboración y actualización de Recomendaciones Clínicas de la Sociedad de Anestesiología de Chile” Comité de Recomendaciones Clínicas SACH 2017.
-
Recomendamos utilizar escalas validadas en niños para la evaluación del dolor postoperatorio, de acuerdo a las características de cada paciente. Calidad baja. Recomendación fuerte.
-
Recomendamos utilizar la Escala FPS-R o Escala de caritas de Wong Baker en niños mayores de 3 años. Escala FLACC en niños menores de 3 años. Escala COMFORT en niños intubados o bajo sedación en UCI/UTI. Calidad baja. Recomendación fuerte.
-
Recomendamos evaluar el dolor en forma periódica por el personal de salud que participa del cuidado del niño en el perioperatorio, durante las primeras 24 horas. Calidad baja. Recomendación fuerte.
-
Recomendamos utilizar intervenciones no farmacológicas como complemento de la terapia farmacológica. Calidad baja. Recomendación fuerte.
-
En cuanto a la terapia farmacológica, recomendamos un enfoque escalonado de elección de fármacos, su administración regular y por la vía adecuada.
-
Recomendamos el uso de paracetamol como primera línea en dolor leve a moderado. Además como complemento al usar terapia analgésica multimodal con AINES y/o opioides. Calidad de la evidencia alta. Recomendación fuerte.
-
Recomendamos utilizar metamizol como analgésico, como primera línea o alternativa. Calidad baja. Recomendación débil.
-
Recomendamos el uso de AINES por periodos cortos de tiempo y en mayores de 6 meses. Recomendamos no usar aspirina en niños. Calidad alta. Recomendación fuerte.
-
Recomendamos usar dosis bajas de ketamina como analgésico por vía endovenosa en el perioperatorio de niños. Calidad moderada. Recomendación fuerte.
-
Recomendamos usar dexametasona endovenosa como adyuvante analgésico en el perioperatorio de niños. Calidad moderada. Recomendación fuerte.
-
Recomendamos usar dexmedetomidina endovenosa como analgésico en el perioperatorio de pacientes pediátricos en ventilación mecánica. Calidad moderada. Recomendación fuerte.
-
Recomendamos usar analgésicos opioides en dolor moderado a severo, ajustando dosis según edad, peso, comorbilidades y etnia, y titular. Calidad alta. Recomendación fuerte.
-
No recomendamos utilizar tramadol ni codeína como analgésicos en niños, dado su potencial efecto depresor respiratorio. Calidad alta. Recomendación fuerte.
-
Recomendamos usar morfina endovenosa en dolor moderado a severo por tiempos limitados. Calidad alta. Recomendación fuerte.
-
Recomendamos usar fentanilo endovenoso en dolor moderado a severo por tiempos limitados. Dada su mayor potencia, su uso debe restringirse a unidades de cuidados críticos o similares. Calidad débil. Recomendación fuerte.
-
Recomendamos usar metadona endovenosa sólo en bolo, para el manejo perioperatorio del dolor moderado a severo en niños mayores de 1 año. Calidad baja. Recomendación fuerte.
-
Recomendamos el uso de PCA en niños mayores de 5 años y P-NCA cuando el niño no puede manejar la PCA. Calidad moderada. Recomendación fuerte.
-
Recomendamos siempre que sea posible el uso de técnicas de anestesia regional como parte de la analgesia multimodal en niños. Calidad moderada. Recomendación fuerte.
3. Lista de abreviaturas
-
SACH: Sociedad Chilena de Anestesiología.
-
RCs: Recomendaciones Clínicas.
-
URPA: Unidad de Recuperación Postanestésica.
-
ECG: Electrocardiograma.
-
BNM: Bloqueo Neuromuscular.
-
EtCO2: Concentración de CO2 al final de la espiración.
-
TIVA: Anestesia Total Intravenosa.
-
MINSAL: Ministerio de Salud, Chile.
-
PCA: Analgesia Controlada por el Paciente.
-
P-NCA: Analgesia Controlada por Enfermera o Padres del Paciente.
-
UCI/UTI: Unidad de cuidado intensivo/Unidad de tratamiento intermedio.
-
PACU: Unidad de Cuidados Postanestésicos.
-
AINES: Antiinflamatorios no esteroidales.
-
NMDA: N-metil-D-aspartato.
4. Definición de términos
-
Anestesia general : Estado reversible de pérdida de conciencia inducida por fármacos.
-
Anestesia regional : Conjunto de variadas técnicas anestésicas que permiten la inducción de insensibilidad en una zona del cuerpo, de forma controlada y reversible.
-
Evaluación ASA : Sistema de clasificación que utiliza la Sociedad Americana de Anestesiólogos (ASA), para estimar el riesgo de mortalidad basándose en el estado fisiológico de los pacientes.
-
Evaluación preanestésica : Proceso de evaluación y estudio que precede a la administración de anestesia, tanto para procedimientos quirúrgicos como no quirúrgicos.
-
Perioperatorio : Corresponde al período que se extiende desde que se indica la realización o necesidad de cirugía, hasta el momento en que el paciente es dado de alta.
-
Sedación : Estado farmacológico de depresión variable del estado de conciencia, cuya intención es facilitar el correcto desarrollo de procedimientos diagnósticos o terapéuticos, a la vez que proporciona comodidad y cooperación del paciente.
-
Unidad de cuidados postanestésicos : Sala destinada a proveer cuidados postanestésicos inmediatos de pacientes que han sido sometidos a cirugías o procedimientos diagnósticos o terapéuticos bajo anestesia, hasta que se alcancen criterios de alta predefinidos.
-
PCA : Bomba de infusión que permite la administración contínua de algún medicamento y además bolos de refuerzo programados, los cuales puede autoadministrarse el mismo paciente en el caso de las PCA o ser administrado por los padres o enfermera a cargo del paciente en el caso de las N-PCA.
5. Declaración de conflicto de interés de los participantes: Los autores no declaran tener conflictos de interés
6. Desarrollo de la RC
-
6.1. Introducción
Uno de los estándares internacionales de atención en salud es el adecuado manejo del dolor en los pacientes que consultan. En el año 2004, Chile manifestó su importancia públicamente al declararlo como el quinto signo vital a través de la Circular Ministerial 2A/46 del año 2004[1]. En nuestro país, es un derecho del paciente el recibir atención de calidad y segura[2]. La presente recomendación pretende entregar herramientas para dar respuesta a este derecho, convirtiéndose en una guía para las adaptaciones locales de las diferentes realidades a lo largo del país, intentando optimizar específicamente el manejo del dolor agudo en la población pediátrica entre 1 mes y 18 años, que consulta en un centro hospitalario de salud nacional.
La evaluación y manejo del dolor agudo perioperatorio en niños debe realizarse de manera agresiva y proactiva para evitar las consecuencias que genera si no es bien tratado[3]. Al intentar definir la mejor manera de evaluar el dolor en niños, encontramos que existe gran diversidad de escalas en el mundo, aplicadas a diferentes edades y contextos relacionados con salud. Sin embargo, está claro que al elegir un mecanismo de evaluación del dolor postoperatorio en el niño, este debe realizarse con instrumentos estandarizados y validados; conocidos por el equipo de salud involucrado en el perioperatorio; adecuados a la edad, diagnóstico y contexto del paciente. Lo mismo ocurre en cuanto a la terapia[4]. La gran mayoría de medicamentos que existen para el tratamiento del dolor son derivados de estudios realizados en población adulta, las guías pediátricas son escasas y hay diferentes enfoques terapéuticos por diversos motivos[5].
Chile no se escapa a esta heterogeneidad de escalas de evaluación y tratamientos para el dolor. Las recomendaciones anteriores del 2007 mencionan los pilares de este tema[6], sin embargo, es necesario actualizarlas, revisar los avances de estos últimos 10 años, establecer recomendaciones claras y aplicables a nuestra realidad nacional e idealmente, motivar la creación de un registro nacional de efectos adversos par ir mejorando cada día la atención de nuestra población.
-
6.2. Objetivos.
Las presentes recomendaciones clínicas fueron diseñadas con el fin de constituir una referencia actualizada y basada en la evidencia para el médico anestesiólogo que trabaja en el ámbito clínico hospitalario nacional, que se enfrenta al manejo del dolor agudo perioperatorio en el paciente pediátrico entre 1 mes y 18 años de edad.
-
6.2.1. Escenarios clínicos a los que se refiere la RC y condiciones de aplicación.
Las siguientes recomendaciones clínicas se aplican a todos los procedimientos que se realicen en pabellón bajo anestesia general, sedación y/o anestesia regional. Así como también a los procedimientos anestésicos realizados fuera de pabellón, que requieran del manejo del dolor agudo perioperatorio en el paciente pediátrico entre 1 mes y 18 años de edad.
-
6.2.2. Eventuales situaciones en las que no es aplicable la RC.
Las presentes recomendaciones clínicas de manejo del dolor agudo perioperatorio en niños no se aplicarán en los siguientes casos:
– Pacientes pediátricos menores a 1 mes o mayores de 18 años de edad.
– Pacientes pediátricos que consultan de manera ambulatoria.
– Pacientes pediátricos con dolor crónico oncológico o no oncológico.
– Pacientes pediátricos con dolor agudo no quirúrgico.
-
6.3. Métodos:
-
6.3.1. Identificación de documentos fuente. Síntesis de evidencia:
Realizamos una búsqueda dirigida de las publicaciones de los últimos 10 años atingentes al tema en las bases de datos de PubMed, Embase y Lilacs.
Las palabras claves utilizadas en PUBMED fueron ((“Pain Management”[Mesh] AND “Pain, Postoperative” [Mesh]) AND (“Child”[Mesh] OR “Infant”[Mesh] OR “Adolescent”[Mesh])), obteniendo 204 resultados. Se procedió a aplicar los siguientes filtros: “full text”, “humans”, “english”, “child birth-18 years”, “MEDLINE” y “Core clinical journals”, con lo cual se limitó la búsqueda a 169 resultados.
Las palabras claves utilizadas en EMBASE fueron [(Postoperative Pain Management) AND (Pediatric) Journals (Medicine)] obteniendo 17 resultados.
Las palabras claves utilizadas en LILACS fueron [(Postoperative Pain), filtrado por tipo de estudio (Ensayos clínicos controlados, Revisiones sistemáticas y Guías de práctica clínica), Pacientes (Adolescentes, Niños, Preescolar, Lactante)], obteniendo 2 resultados.
Se conformó un equipo de trabajo de 3 anestesiólogos, representantes de las instituciones públicas y privadas que se dedican a anestesia pediátrica en nuestro país, los cuales seleccionaron dentro de esta búsqueda los artículos que les parecieron más relevantes, para construir estas recomendaciones.
Se eliminaron artículos duplicados y se seleccionaron por título y abstract 37 artículos, luego se agregaron artículos en consenso de los 3 anestesiólogos que parecieron relevantes de incluir aunque no aparecieran en la búsqueda inicial, trabajando finalmente con 43 artículos como referencia, los cuales se encuentran en la bibliografía.
-
6.3.1.1. Identificación de prestaciones vinculadas al problema de salud.
Se consideraron como prestaciones vinculadas al problema de salud planteado aquellas relacionadas a la optimización de la analgesia postoperatoria en los pacientes pediátricos entre 1 mes y 18 años de edad, que requieran sedación o anestesia para cirugías o procedimientos quirúrgicos en un centro clínico hospitalario de Chile.
-
6.3.1.2. Efectividad de las intervenciones.
Las intervenciones señaladas en la recomendación clínica consideran efectivas al momento de lograr una analgesia apropiada para el paciente en su contexto (EVA < 4 o su equivalente), permitiéndole obtener un estado de confort.
-
6.3.1.3. Efectos adversos de las intervenciones.
Efectos adversos propios de la intervenciones farmacológicas y procedimentales señaladas en el desarrollo de la recomendación.
-
6.3.1.4. Condiciones de calidad de las intervenciones.
La evaluación preanestésica de un paciente que será sometido a una cirugía debe ser realizada en un ambiente protegido para el paciente. El examen físico es una parte relevante de la evaluación, por lo que ésta debe ser llevada a cabo con el paciente presente.
-
El lugar en que se realiza debe ser privado, debido a que la entrevista contiene preguntas sensibles. Si no se cuenta con una consulta privada para realizarla, recomendamos la unidad de cuidados postanestésicos como una opción.
-
El lugar debe contar con los implementos necesarios que permitan examinar y tomar los signos vitales del paciente. Salas con los requerimientos adecuados para la monitorización (Ver: Recomendaciones clínicas Monitorización perioperatoria) de pacientes con analgesia en base a PCA.
-
Debe existir un registro de los procedimientos, que incluya tanto los medicamentos como las dosis administrada, con la finalidad de obtener un documento que permanezca entre los antecedentes del paciente. Este registro debe explicitar adecuadamente los medicamentos como las infusiones administradas.
-
Se debe contar con personal idóneo y capacitado.
-
La educación de los padres debe ser entregada tanto por el anestesiólogo como por el equipo de enfermería, para hacerlos partícipes del manejo.
-
6.3.2. Métodos de consenso utilizados para la formulación de recomendaciones.
En la formulación de la RC se establecieron controversias que pudieron encontrarse en la apreciación de la evidencia disponible con respecto a:
-
La validez de los estudios para el contexto chileno.
-
La relevancia clínica de los resultados.
-
El balance entre los desenlaces favorables y desfavorables.
-
La condiciones de aplicabilidad o el impacto esperado de las recomendaciones.
-
Incorporación de nuevos artículos en la búsqueda de evidencia o bibliografía.
-
Las evidencias encontradas resulten contradictorias o las condiciones locales no hagan aplicable la recomendación.
-
Para resolver estas diferencias aplicaron métodos de consenso, que aseguraron:
-
Representatividad: Todos los autores o al menos tres de ellos y eventualmente el miembro del comité de RCs participaron de su resolución.
-
Todos los miembros del grupo a cargo de la elaboración del documento dispusieron del mismo nivel de información básica para la toma de decisiones.
-
Las diferencias se resolvieron a través de votación por mayoría simple cuando no se alcanzó consenso o para la aprobación de éste.
-
6.3.3. Grados de evidencia y niveles de recomendación utilizados en la RCs.
Actualmente, en Chile, se han elaborado guías de práctica clínica en el contexto del Régimen de Garantías Explícitas (AUGE-GES) y desde el año 2010 se ha elaborando un manual metodológico incorporando la metodología GRADE. Esta metodología sistema de graduación de recomendaciones es explícita, fácil de entender, transparente y pragmática, y fue llamado “The Grading of Recommendations Assessment, Development and Evaluation” (GRADE), el cual ha sido adoptado por más de 80 organizaciones elaboradoras de guías clínicas como: World Health Organization, Cochrane Collaboration, National Institute for Clinical Excellence (NICE), The Scottish Intercollegiate Guidelines Network (SIGN), Canadian Task Force on Preventive Health Care, British Medical Journal (BMJ), The Canadian Agency for Drugs and Technologies in Health (CADTH), UpToDate, entre otras[7].
“Las ventajas del sistema GRADE sobre los otros sistemas de graduación de recomendaciones radican en que este fue desarrollado por un grupo amplio y representativo de elaboradores de guías a nivel internacional, posee una clara separación entre la calidad de la evidencia y la fuerza de la recomendación, posee un evaluación explícita de la importancia de los desenlaces para estrategias alternativas, posee un sistema de evaluación de la calidad de la evidencia claro y explícito, realiza las recomendaciones a través de un proceso transparente, toma de forma explícita los valores y preferencias de los pacientes, la interpretación de la fuerza de la recomendación para los clínicos, pacientes y tomadores de decisión es clara y pragmática y también puede ser utilizada para la elaboración de evaluación de tecnologías sanitarias y revisiones sistemáticas”[7].
Así, para la evaluación y redacción de las recomendaciones se utilizó el sistema GRADE recomendado por el MINSAL. Este clasifica la calidad de la evidencia como sigue:
Nivel de la calidad de la Evidencia [8]
|
Alto |
Estamos relativamente seguros de que el efecto real de la intervención se encuentra cerca de nuestra estimación |
|
Moderado |
El efecto real de la intervención probablemente se encuentra cerca de nuestra estimación, pero existe la posibilidad de que sea sustancialmente diferente |
|
Bajo |
El efecto real de la intervención puede ser sustancialmente diferente de nuestra estimación |
|
Muy bajo |
Es probable que el efecto real de la intervención sea sustancialmente diferente de nuestra estimación |
El curso de acción de acuerdo a la fuerza de la recomendación.
Recomendaciones fuertes y débiles en el sistema GRADE [8]
|
Recomendaciones fuertes |
Recomendaciones débiles |
|
|
Significado |
La alternativa recomendada puede ser seguida con todos o casi todos los pacientes. Una conversación detallada con el paciente o una revisión cuidadosa de la evidencia que fundamenta la recomendación pudiera no ser necesaria |
Si bien la alternativa recomendada es apropiada para la mayoría de los pacientes, la decisión debiera ser individualizada, idealmente mediante un enfoque de decisiones compartidas |
|
Se cumplen TODAS estas condiciones |
Se cumple ALGUNA de estas condiciones |
|
|
Calidad de la Evidencia |
Alta o moderada (o baja o muy baja en circunstancias excepcionales) |
Baja o muy baja |
|
Balance de beneficios y riesgos |
Una alternativa es claramente superior |
El balance de beneficios y riesgos es cercano |
|
Valores y preferencias de los pacientes |
Todos o casi todos los pacientes informados toman la misma decisión |
Existe variabilidad o incertidumbre respecto de lo que decidirán pacientes informados |
|
Consideraciones de recursos |
El costo de la intervención está plenamente justificado |
El costo de la intervención pudiera no estar justificado en algunas circunstancia |
-
6.3.4. Consideraciones ético-sociales.
Desde hace algunos años las sociedades científicas, de distintos países, han publicado diferentes guías de práctica clínica[9]. Las Guías o RCs representan la posición oficial de las sociedades científicas sobre determinado tema y se actualizan periódicamente. Pretenden ayudar a los profesionales a tomar decisiones en el día a día, respaldados por la mejor evidencia presentada por expertos y validada por las sociedades científicas que estos representan[10]. No reemplazan el juicio clínico del anestesiólogo, que conserva el derecho de autonomía, expresado en la responsabilidad intransferible de administrar anestesia y proveer los cuidados perioperatorios necesarios a sus pacientes. Las RCs han impactado profundamente en la práctica profesional de sus asociados y en la medicina de sus respectivos países, han colaborado en el desarrollo de políticas institucionales y han facilitado la toma de decisiones de manera transparente para los pacientes y sus familias[11].
EL 31 de diciembre de 1953 la SACH establece en sus estatutos, en su artículo segundo, como un objetivo fundamental el “perfeccionar y ampliar los conocimientos de la especialidad, estudiar y divulgar problemas científicos y, en general, propender al progreso de la Anestesia”. Así, las RCs pretende aportar con rigurosidad metodológica y alto estándar de calidad, señalando los aspectos necesarios que permitan un buen desempeño profesional. Para ello se ha conformado un equipo de trabajo que han elaborado esta recomendación entendiendo que “La medicina basada en la evidencia surge por la necesidad de sustentar la práctica clínica en algo de mayor fortaleza que la experiencia, y de ella se derivan las recomendaciones clínicas”[12].
A través de estas RCs la SACH contribuye en el cumplimiento de su propósito, de su responsabilidad ética y su compromiso con el país, desarrollando, y participando en actividades que aporten al mejoramiento de la comunidad y la salud pública, difundiendo y promoviendo los conocimientos científicos, poniendo a disposición de los pacientes, autoridades sanitarias y anestesiólogos, información pertinente para apoyar la práctica de los colegas, en beneficio de sus pacientes.
7. Recomendaciones
-
7.1 Evaluación del dolor
La evaluación y manejo del dolor son componentes esenciales en el cuidado del paciente pediátrico quirúrgico, dado el componente emocional del paciente y sus padres, y la potencial morbimortalidad relacionada a un dolor no tratado adecuadamente. La evaluación del dolor en niños plantea un gran desafío para el anestesiólogo, ya que muchas veces el paciente no es capaz de comprender ni verbalizar lo que siente[13].
-
7.1.1 Escalas de evaluación del dolor
Recomendamos utilizar escalas validadas en niños para la evaluación del dolor postoperatorio, de acuerdo a las características de cada paciente.
Calidad de la evidencia es baja. Recomendación fuerte.
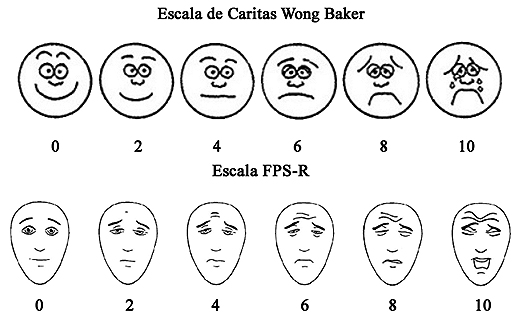

Descripción y Comentarios: Existen distintas escalas validadas para cuantificar el dolor postoperatorio. El nivel de desarrollo del niño es el que indicará cuál utilizar. Existen 3 aproximaciones para evaluar la intensidad del dolor en niños:
Auto reporte: el paciente es quien dice cuánto le duele; es considerado el estándar de oro. Debe utilizarse cuando sea posible en niños con entendimiento y capacidad de comunicación suficientes, y que no estén demasiado estresados por el dolor. Generalmente para niños mayores de 3 años.
Comportamiento: el personal de salud observa cómo se comporta el niño y evalúa la intensidad del dolor. Estas escalas se utilizan en niños en etapa preverbal, compromiso cognitivo, lactantes o niños muy estresados por dolor.
Indicadores fisiológicos: el personal de salud evalúa la intensidad del dolor basándose en signos fisiológicos del niño con dolor.
-
7.1.1.1 Escala FPS-R o Escala de caritas de Wong Baker.
Recomendamos utilizar esta escala en niños mayores de 3 años[13].
Calidad de la evidencia baja. Recomendación Fuerte.
Descripción y Comentarios: Cada carita tiene una puntuación que va de 2 en 2, la puntuación total va entre 0 y 10. La escala más difundida es la de Caritas Wong Baker, por eso decidimos incluirla; sin embargo tiene el sesgo de que los niños generalmente no indican la carita feliz pese a estar sin dolor dado que están hospitalizados fuera de su ambiente habitual y que la carita de máximo dolor está llorando, cosa que no siempre ocurre con dolor máximo. Es por eso que se creó la escala FPS-R, pero al utilizar caras más neutras no ha logrado gran incorporación al ambiente pediátrico. Teniendo en cuenta estos detalles recomendamos ambas.
-
7.1.1.2 Escala FLACC.
Recomendamos utilizar esta escala en niños menores de 3 años[13].
Calidad de la evidencia baja. Recomendación Fuerte.
Descripción y comentarios: consta de 5 variables, cada una con puntuación entre 0 y 2 puntos. El puntaje total va entre 0 y 10.
-
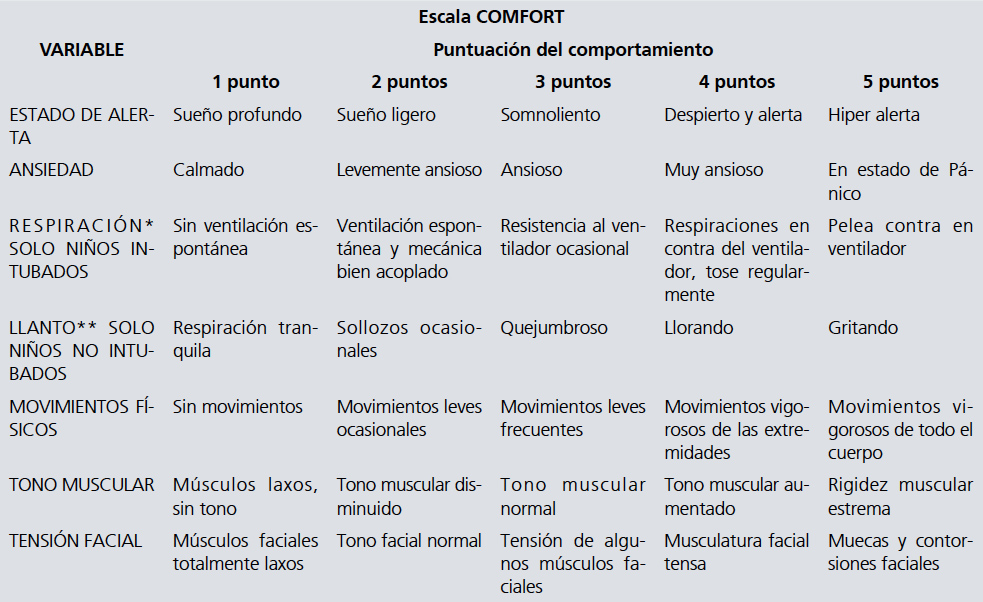
7.1.1.3 Escala COMFORT
Recomendamos utilizar esta escala en niños intubados o bajo sedación en UCI/UTI [14].
Calidad de la evidencia baja. Recomendación Fuerte.
Descripción y comentarios: Esta escala se aplica a niños de cualquier edad, consta de 7 parámetros, pero se debe escoger entre Respiración o Llanto según si el niño está intubado o no. Por lo tanto se evalúan solo 6 variables en cada paciente, cada una con un puntaje entre 1 y 5 puntos, el puntaje total va entre 6 y 30 puntos. El objetivo es lograr un puntaje menor a 14.
-
7.1.2 Dónde y cuándo evaluar el dolor
-
7.1.2.1 Recomendamos evaluar el dolor en forma periódica por el personal de salud que participa del cuidado del niño en el perioperatorio, durante las primeras 24 horas. Se debe evaluar el dolor en niños en el postoperatorio al menos en las siguientes situaciones:
-
Al despertar el paciente o emerger de la anestesia.
-
Al llegar y salir de la unidad de cuidados postanestésicos.
-
Durante su estadía en PACU, cada 10 a 15 minutos.
-
Al ser dado de alta de PACU, en cada control de signos vitales.
-
En su domicilio, cada 6 a 8 horas.
Calidad de la evidencia baja. Recomendación fuerte.
Comentario: El objetivo es prevenir siempre el dolor posquirúrgico[15].
La evidencia hallada se acota a guías clínicas que señalan este punto como opinión de expertos.
Recomendamos también en relación al manejo del dolor postoperatorio de niños que:
– el anestesiólogo que atiende al paciente pediátrico en el contexto perioperatorio inicie y planifique el manejo del dolor postoperatorio, antes de iniciar la cirugía[16],[17].
– el plan de manejo del dolor sea explicado en el preoperatorio a los padres o cuidadores y cuando sea apropiado al niño, con el fin de mejorar el manejo de la analgesia durante el postoperatorio[17],[18],[19].
– el anestesiólogo colabore y eventualmente participe de la formación y entrenamiento del personal de salud relacionado con la atención perioperatoria del paciente[16],[17],[19].
– el traslado desde la unidad de cuidados postanestésicos a una unidad de menor complejidad se lleve a cabo con un control satisfactorio del dolor y tratamiento analgésico ya iniciado[17].
– en el momento del alta hospitalaria, los familiares o cuidadores reciban información clara y detallada sobre el manejo del dolor en casa y la administración de los analgésicos indicados[17],[20].
– las instituciones hospitalarias que efectúan cirugías tengan disponible en el centro un anestesiólogo las 24 horas del día, con quien poder comunicarse eventualmente, para solicitar asesoría en el manejo del dolor perioperatorio, en caso de ser necesario.
– todo el personal de salud esté entrenado y sepa reconocer, evaluar y tratar el dolor en los niños[15],[17],[19].
– Las instituciones con un Servicio de Dolor Agudo debieran participar en el desarrollo de normas y procedimientos estandarizados para este efecto y/o implementar las normas necesarias de acuerdo a las recomendaciones nacionales establecidas en este documento[16].
– Es necesario disponer de la apropiada monitorización durante la cirugía y la recuperación postanestésica, dado que muchos de los fármacos analgésicos usados en niños actúan sinérgicamente y pueden potenciar sus efectos depresores[16],[17].
Calidad de la evidencia baja. Recomendación fuerte.
Comentario: El detalle de la recomendación para monitorización perioperatoria está desarrollada en el documento: Recomendación Clínica: “Disponibilidad y Uso de Monitorización Perioperatoria” (SACH 2017).
-
7.2 Intervenciones no farmacológicas:
Recomendamos utilizar estas intervenciones como complemento de la terapia farmacológica, principalmente técnicas de distracción y educación del paciente y su familia.
Calidad de la evidencia baja. Recomendación fuerte.
Comentario: Estas son técnicas no farmacológicas cognitivo conductuales para alivio del dolor, las publicaciones las agrupan en:
• Técnicas de Distracción; mediante películas, música o juegos.
• Hipnosis e imaginería.
• Relajación muscular, técnicas de respiración profunda, masajes.
• Educación; previa a la cirugía.
• Mixtas; involucra dos o mas de las anteriores.
A pesar de que existe evidencia a favor de todas estas técnicas para el dolor agudo asociado a procedimientos dolorosos tales como las vacunas, existe poca evidencia para el manejo del dolor agudo postoperatorio. La evidencia actual ha demostrado que sí existiría diferencia al comparar el puntaje de escalas de dolor durante las primeras 24 h postoperatorias al utilizar cualquiera de las intervenciones descritas versus no utilizarlas, pero no ha demostrado menor uso de analgésicos. Tampoco hay trabajos que comparen las diversas técnicas entre ellas21,22.
7.3 Intervenciones farmacológicas
Recomendamos que se considere lo siguiente respecto al uso adecuado de analgésicos:[13],[23],[24],[25]:
– Un enfoque escalonado de elección de fármacos analgésicos, según la severidad del dolor manifestado por el niño. Esto supone la posibilidad de disponer de un segundo escalón farmacológico en el plan original. Idealmente usar escalera analgésica de la OMS.(Ver anexo).
– Los fármacos deben ser administrados de forma regular, sobre todo en las primeras 48 horas. Debe existir un plan analgésico farmacológico a intervalos regulares, con dosis de rescate disponibles.
– Debe usarse una vía adecuada de administración a la presentación del fármaco disponible. Se debe preferir la vía oral o rectal en dolor leve a moderado.
– El manejo analgésico debe adaptarse a cada niño y su contexto.
Calidad de la evidencia moderada. Recomendación fuerte.
En la estrategia para el manejo del dolor recomendamos utilizar la referencia de la OMS:
Nivel 1: (dolor leve) analgésicos no opioides (por ejemplo, paracetamol, AINEs) a los cuales se les puede agregar un coadyuvante si es necesario. Si un no opioide ya no controla el dolor adecuadamente, se debe agregar un analgésico opioide.
Nivel 2: (dolor leve a moderado) analgésicos opioides de acción débil a los cuales se les puede agregar analgésicos no opioides y coadyuvantes si el dolor persiste o aumenta.
Nivel 3: (dolor moderado a intenso) opioides potentes a los cuales se les puede agregar analgésicos no opioides y adyuvantes.
Comentario: La mayoría de los fármacos usados como analgésicos en niños no cumplen con los permisos o justificaciones de peso para su uso en pediatría[4],[17]. Muchos de ellos son usados como segunda línea para el manejo de dolor agudo en niños en ciertos rangos de edad (mayor de 6 meses, 12 años), no siempre con las presentaciones adecuadas disponibles, lo que además varía entre diferentes países y centros[4],[13],[23],[27].
Su uso es frecuentemente extrapolado de la indicación en adultos y adaptada a los datos disponibles farmacocinéticos y farmacodinámicos pediátricos[4],[23],[17],[28].
Existe consenso en que el manejo del dolor postoperatorio agudo en niños debe tener un enfoque multimodal también para lo que a fármacos se refiere, debiendo iniciar con agentes orales simples y progresar hacia opioides más potentes[4],[17],[20],[23],[24],[26],[29],[30]. Esto mejora el outcome y disminuye los efectos adversos de la terapia farmacológica escogida[17],[20],[29],[30]. Así también, una vez escogido el plan farmacológico, este debe ser titulado y evaluado periódicamente en cada paciente[17],[20],[23],[25],[29],[30].
-
7.3.1 Analgésicos no opioides:
Corresponden a diversos fármacos con distintos mecanismos de acción y eficacia. Los más comúnmente disponibles son paracetamol, AINES, dexametasona, ketamina y tramadol[17],[28].
-
7.3.1.1 Paracetamol o Acetaminofeno:
Recomendamos el uso de paracetamol como primera línea de terapia analgésica en dolor leve a moderado. Además como complemento al usar terapia analgésica multimodal con AINES y/o opioides, disminuyendo así los requerimientos de opioides en el post operatorio.
Recomendamos en niños obesos ajustar dosis según edad y peso ideal.
Recomendamos que al indicar el paracetamol i.v. en niños, se ordene claramente la masa total de droga y el volumen al que esta corresponde, tanto en forma escrita como oral[24],[27]. Esto hará menos probable el error de dosificación asociado. En caso de producirse, se sugiere contar con un protocolo escrito disponible en todo horario, con la conducta a seguir que idealmente cuente con un pediatra.
Calidad alta/ Recomendación fuerte.
Comentario: Es el analgésico no opioide de mayor uso en niños. Su mecanismo de acción incluye bloqueo de la producción de prostaglandinas y sustancia P, además de la modulación de la producción de óxido nítrico[13],[28].
La dosis requerida para analgesia es superior a la dosis para efecto antipirético[4].
Es efectivo para el dolor leve a moderado. Su uso disminuye los requerimientos de opioides en niños tras cirugía menor y mayor (S, nivel I, PRISMA)[4],[24](alto grado, beneficio +++).
El paracetamol en rangos terapéutico puede ser considerado seguro (nivel 4)[4]. Factores de riesgo para hepatotoxicidad secundaria a su uso es el consumo prolongado, deshidratación, malnutrición crónica, prematurez y enfermedad hepática[24].
7.3.1.1.1 Recomendamos su uso en niños obesos ajustando la dosis al peso ideal[24].
Su perfil de seguridad en niños es similar al de ibuprofeno y placebo (N, nivel IV, SR)[4].
Se sugiere que la dosis segura de paracetamol ¿en niños considere la edad, el peso y la duración de la terapia[4].
La biodisponibilidad del paracetamol es dependiente de la vía de administración. La vía i.v. hace más predecible la concentración plasmática.
Dosis sugeridas en niños (o poner 7,5 – 15 mg/kg oral, rectal o i.v. hasta 4 veces al día, dependiendo de la edad del paciente[30]).
-
Mayores a 45 semanas postconcepción:
-
15 mg/kg cada 8 horas oral o rectal
-
10 a 15 mg/kg cada 6 horas i.v.
-
dosis máxima diaria 40 mg/kg/día i.v. a 60 mg/kg/día oral (nivel 3 e, nivel 4)
-
-
entre 6 meses y 12 años:
-
15 a 20 mg/kg cada 4 a 6 horas oral o rectal
-
15 mg /kg cada 6 horas i.v.
-
dosis máxima diaria 60 mg/kg/día i.v., 90 mg/kg/día oral, por 2 a 3 días (nivel PK)[4].
-
-
Se pueden presentar efectos adversos, como molestias gastrointestinales o reacciones cutáneas. Se recomienda que la administración de una dosis i.v. se realice en un periodo no menor a 10 minutos, sino puede producirse hipotensión[42].
-
7.3.1.2 Metamizol o Dipirona
Recomendamos utilizar metamizol como analgésico, ya que tiene muy baja incidencia de efectos adversos. Recomendamos su uso como alternativa a los AINES en caso de riesgo de sangrado gastrointestinal.
Calidad baja/ Recomendación débil.
Comentario: El riesgo de agranulocitosis, su complicación más controversial, varía con la dosis, duración de la indicación, uso de medicamentos concomitantes y además son reportes de casos aislados[43].
Puede ser usado por vía oral, rectal, endovenosa e intramuscular (IM). La vía IM es la menos recomendada y en ningún caso en menores de 1 año, por el dolor en la administración.
Dosis Metamizol: 15 mg/kg oral o i.v. hasta 3 veces al día. O como PCA, carga 4,5 mg/kg, con infusión de 0,5 mg/kg/hr y bolos de 1 mg/kg, lockout 30 min[30].
Tiene equivalente efecto analgésico que paracetamol en iguales dosis y en dosis mayores de hasta 40 mg/kg/dosis es equivalente a ketorolaco i.v.
Tiene efectos adversos como anafilaxia, hipersensibilidad de piel, oliguria, anuria, proteinuria, nefritis intersticial y agranulocitosis.
La administración i.v rápida puede producir hipotensión.
No se recomienda en neonatos o niños con peso menor a 5 kg. Y de preferencia en mayores de 6 meses[42].
-
7.3.1.3 AINES
7.3.1.3.1 AINES no selectivos
Recomendamos el uso de AINES no selectivos en dolor leve a moderado y/o en dolor severo asociado a algún opioide para disminuir el requerimiento de este último.
Recomendamos usarlos por cortos períodos de tiempo y en mayores de 6 meses. Entre los 3 y 6 meses evaluar la necesidad de su uso como dosis única.
Recomendamos no usar aspirina en niños.
Calidad de la evidencia alta/ Recomendación fuerte.
Se usan en dolor leve a moderado. Al asociarlos a opioides, disminuyen su requerimiento (S, nivel I, PRISMA) y sus efectos adversos[4],[24],[28].
Su uso no aumenta el riesgo de intervenciones quirúrgicas o no quirúrgicas por sangrado tras amigdalectomía en niños (S, nivel I, revisión Cochrane)[4],[24].
Comentario: Los efectos adversos graves luego del uso de AINES no selectivos son raros en niños mayores de 6 meses de edad[4],[24],[28].
Su uso no está aprobado en menores de 3 meses[4],[28].
Los más indicados habitualmente son Ibuprofeno, diclofenaco, ketorolaco, naproxeno y ketoprofeno[4],[28].
Dosis Ibuprofeno: 10 mg/kg oral o rectal hasta 4 veces al día[31]. Tiene el mejor perfil de seguridad entre los AINES usados en niños[13].
Dosis ketorolaco: 0,5 mg/kg i.v. hasta 2 a 3 veces al día[25].
Puede usarse por vía intramuscular o intravenosa, recientemente se ha descrito la vía nasal como alternativa a la vía muscular cuando no existe vía venosa disponible[24].
Diclofenaco: 1 mg/kg oral o rectal hasta 3 veces al día (en mayores de 6 años)[13],[30].
La aspirina debe ser evitada en niños (U)[4].
La inhibición de la COX-1 tiene el potencial de provocar varios efectos adversos como lo son sangrado, daño de la mucosa gastrointestinal, asma, daño renal. Pueden provocar una crisis de asma en los pacientes con Sd. de Samter[42].
Reacciones adversas menos frecuentes son reacciones cutáneas, diarrea, náuseas y vómitos[42].
-
7.3.1.3.2 AINES selectivos:
Recomendamos usar AINES selectivos cox 2 en casos especiales cuando el beneficio es mayor.
Calidad de la evidencia baja/ Recomendación débil.
Son analgésicos AINES que inhiben selectivamente la ciclooxigenasa 2.
Los COXIBS tiene un perfil de seguridad aceptable en niños y adultos, con baja presentación de contraindicaciones y alergias (N)[4],[26]. Los coxibs presentarían efectos analgésicos similares a ibuprofeno, prefiriéndose en caso de riesgos altos de sangrado[26]. Sin embargo, hacen falta mayores estudios de seguridad para facilitar su uso en niños[4].
El parecoxibs endovenoso ha sido usado como analgésico en niños con buen efecto analgésico y bajos efectos adversos, sin embargo aún se investiga la eficacia y perfil de seguridad en la práctica pediátrica, no siendo de uso rutinario en pediatría[24].
La inhibición de la COX-1 tiene el potencial de provocar varios efectos adversos como lo son sangrado, daño de la mucosa gastrointestinal, asma, daño renal. Pueden provocar una crisis de asma en los pacientes con Sd. de Samter[42].
Reacciones adversas menos frecuentes son reacciones cutáneas, diarrea, náuseas y vómitos[42].
-
7.3.1.4 Ketamina
Recomendamos usar dosis bajas de ketamina como analgésico por vía endovenosa en el perioperatorio de niños.
Calidad de la evidencia moderada/ Recomendación fuerte.
Comentario: La ketamina es un antagonista NMDA[24],[30].
El impacto de dosis analgésicas o subanestésicas de ketamina en el neurodesarrollo del niño, administradas en bolos o infusiones postoperatorias es poco clara[4],[24].
Dosis bajas de ketamina en niños, administradas ya sea en bolo endovenoso o en infusiones en el perioperatorio, tienen un efecto similar a los opioides y superior a placebo en reducir los puntaje de dolor y los requerimientos analgésicos. Así también, no afectan la incidencia postoperatoria de náuseas y vómitos, sedación, agitación, sueños o alucinaciones en niño[4],[26]. El beneficio de la ketamina perioperatoria en prevenir la hiperalgesia inducida por remifentanil no ha sido adecuadamente demostrado en cirugía pediátrica[4].
-
7.3.1.5 Dexametasona
Recomendamos usar dexametasona endovenosa en dosis de 100-150 ug/kg, como adyuvante analgésico en el perioperatorio de niños.
Calidad de la evidencia moderada/ Recomendación fuerte.
Comentario: Dexametasona disminuiría el dolor al disminuir la inflamación perioperatoria, además de las náuseas y vómitos postoperatorios[13],[24],[28].
Dosis dexametasona: 100-150 ug/kg i.v. en bolo.
-
7.3.1.6 Agonistas alfa 2
Recomendamos usar dexmedetomidina endovenosa como analgésico en el perioperatorio de pacientes pediátricos en ventilación mecánica.
Calidad de la evidencia moderada/ Recomendación fuerte.
Comentario: Dexmedetomidina es un agonista alfa 2 con efecto hipnótico y analgésico[28], que ha sido usado en el intra y postoperatorio de niños, sobre todo en aquellos pacientes en ventilación mecánica.
Usada como analgésico en el postoperatorio disminuye requerimientos de opioides[24],[28], así como náuseas y vómitos postoperatorios[26].
-
7.3.2 Analgésicos opioides
Recomendamos usar analgésicos opioides en el manejo del dolor postoperatorio moderado a severo de pacientes pediátricos, teniendo especial cuidado en ajustar su dosis a la edad, peso, comorbilidades y etnia del niño, titulando la dosis paciente a paciente.
Calidad de la evidencia alta/ Recomendación Fuerte.
Los analgésicos opioides son agonistas de receptores muy usados para dolor postoperatorio moderado a severo en niños[28]. Al ser asociados a AINES y/o paracetamol, así como a técnicas anestésicas regionales, se requieren menores dosis y disminuyen los efectos adversos asociados a su uso[20],[24],[27],[28].
Cualquier dosificación segura de opioides debe considerar siempre en niños la edad, su peso, comorbilidades asociadas y etnia[4],[23],[24].
Así también, debe contener la prescripción del manejo para cada efecto secundario asociado. En otras palabras, la dosis debe ser cuidadosamente titulada paciente a paciente[4],[13],[20],[23],[27].
Los niños menores de 3 años, los obesos y los con historia de apnea obstructiva del sueño presentan el mayor riesgo de desarrollar depresión respiratoria inducida por opioides y muerte[4].
-
7.3.2.1 Tramadol
Recomendamos no usar tramadol como analgésico en niños, dado su potencial efecto como depresor respiratorio.
Calidad de la evidencia alta/ Recomendación fuerte.
Comentario: El tramadol tiene un efecto similar a los opioides en niños en el perioperatorio, sin embargo, parece presentar menor constipación y prurito respecto a estos y similar frecuencia de náuseas y vómitos4,24. Puede presentar un comportamiento similar a codeína en los pacientes metabolizadores rápidos, aumentando el riesgo de depresión respiratoria secundaria en estos casos. Por este motivo la Food and Drug Administration (FDA) de EEUU levantó una alerta en los años 2015 y 2017, sobre su uso en menores de 18 años de edad, describiendo claramente un alto riesgo de depresión respiratoria secundaria tras su uso como analgésico tras cirugía de adenoides o amígdalas[24],[31].
-
7.3.2.2 Morfina
Recomendamos usar morfina como analgésico endovenoso para el manejo postoperatorio del dolor moderado a severo en niños, por tiempos limitados, teniendo especial cuidado en contar con guías escritas locales que respalden su prescripción y el manejo de eventuales complicaciones secundarias a su uso.
Calidad de la evidencia alta/ Recomendación fuerte.
Comentario: Morfina es el opioide más comúnmente usado en niños en el contexto postoperatorio[28].
En caso de usarla, se sugiere la existencia de guías escritas locales que respalden su prescripción; monitorización nocturna de depresión respiratoria y protocolos de respuesta ante depresión respiratoria[13],[23],[28].
Pacientes de riesgo para su uso son aquellos con insuficiencia renal, obesos o con uso de otros depresores respiratorios concomitantes[24].
En caso de presentar depresión respiratoria, la naloxona a dosis de 1 ug/kg i.v. titulada cada 3 minutos debiera ser efectiva[13].
Dosis morfina[13]:
50 – 100 ug/kg i.v. en bolo, cada 6 h.
10-40 ug/kg/hr i.v. con bomba de infusión continua.
-
7.3.2.3 Fentanilo
Recomendamos usar fentanilo endovenoso como analgésico para el manejo postoperatorio del dolor moderado a severo en niños, por tiempos limitados, teniendo especial cuidado en contar con guías escritas locales que respalden su prescripción y el manejo de eventuales complicaciones secundarias a su uso. Dada su mayor potencia, su uso debe restringirse a unidades de cuidados críticos o similares.
Calidad de la evidencia débil/ Recomendación fuerte.
Comentario: Fentanilo es usado en niños como analgésico para el manejo de dolor moderado a severo. Al ser más potente que morfina, suele ser usado bajo la supervisión médica directa en unidades de alta vigilancia, por el anestesiólogo o el intensivista pediátrico[24].
Dosis Fentanilo[13]:
1-2 ug/kg i.v. en bolo cada 2 a 4 h.
0,5 – 2 ug/kg/h con bomba de infusión continua.
-
7.3.2.4 Metadona
Recomendamos usar metadona endovenosa sólo en bolo, para el manejo perioperatorio del dolor moderado a severo en niños mayores de 1 año.
Calidad de la evidencia baja/ Recomendación fuerte.
Comentario: Metadona presenta además de su efecto opioide de larga duración un efecto de antagonista NMDA, lo que puede hacerla atractiva en el contexto perioperatorio. Su uso se recomienda en bolo endovenoso y en niños mayores de 1 año. Presenta como desventaja una inadecuada e irregular concentración plasmática, debida a una rápida redistribución tras un bolo endovenoso[13],[24].
Dosis Metadona[13]: 50 – 100 ug/kg endovenoso en bolo, cada 6 h.
-
7.3.2.5 Codeína
Recomendamos no usar codeína como analgésico en niños, dado su potencial efecto como depresor respiratorio.
Calidad de la evidencia alta/ Recomendación fuerte.
Comentario: La concentración plasmática y los efectos adversos de la codeína administrada a niños son impredecibles, debido a diferencias genéticas en la capacidad de generar el metabolito morfina. Dado lo anterior, se sugiere no usarla para el manejo del dolor agudo postoperatorio en niños, opinión respaldada también por las alertas emitidas por la Food and Drugs Administration (FDA) de EEUU en julio de 2015[4],[20],[23],[28],[32] y en el 2017.
-
7.3.3 Analgesia endovenosa controlada por el Paciente (PCA), Enfermera o por los Padres (P-NCA):
Recomendamos el uso de PCA para el manejo del dolor perioperatorio en niños mayores de 5 años y P-NCA cuando el niño no puede manejar la PCA. Todos estos pacientes deben ser adecuadamente seleccionados, educados y monitorizados.
Calidad de la evidencia moderada/ Recomendación fuerte.
Comentario: La evidencia dice que el uso de PCA o P-NCA en niños sirve para optimizar el control del dolor postoperatorio, más el diseño de los trabajos, el número de pacientes y la evaluación del efecto no son comparables entre ellos.
Las infusiones de opioides han demostrado ser efectivas y seguras para niños de todas las edades.
Los requerimientos de opioides son variables entre niños de distintas edades, según sus comorbilidades y según el tipo de cirugía. Esta técnica facilita la administración de opioides en el postoperatorio, adecuándose a los requerimientos individuales y mejorando la satisfacción del paciente, de sus padres y del personal de enfermería. Desde los 5 años de edad, los niños son capaces de entender cómo usar una PCA. Es de suma importancia una adecuada capacitación del equipo clínico, seleccionar adecuadamente al paciente y educar al niño y su familia previo a indicar una PCA o P-NCA[33].
El medicamento que más se ha utilizado para esta técnica es la Morfina y en segundo lugar el Fentanil, reservado para casos de intolerancia a morfina y en pacientes con alteración de la función renal.
Los parámetros recomendados para programar en la bomba de infusión son:
-
Dosis de carga: corresponde a la primera dosis del fármaco, que persigue alcanzar un nivel plasmático terapéutico. Si el niño ha recibido la dosis de carga antes del despertar anestésico y luego despierta sin dolor, no es necesario programar una nueva dosis de carga.
-
Dosis de demanda (bolo): es la dosis que recibirá el niño cada vez que presione el botón de la PCA.
-
Intervalo de cierre (Lockout): corresponde al tiempo de bloqueo de la PCA tras un bolo administrado, generalmente entre 5 y 15 minutos. Previene que el paciente reciba un nuevo bolo antes de que alcance el efecto máximo del bolo anterior.
-
Infusión basal: infusión de mantención de la droga.
-
Dosis máxima en 1 h o en 4 h: previene efecto acumulativo.
Existen opiniones controversiales respecto a dejar una infusión continua. El objetivo de la infusión continua es mantener una dosis plasmática cercana a la dosis terapéutica, para que cuando el niño requiera un bolo, se alcance la analgesia rápidamente y no requiera múltiples bolos. Esto permite también menos interrupciones del sueño por dolor, mejora el patrón de sueño y reduce el consumo total de opioides sin aumentar los efectos adversos[34]. Por otro lado, los detractores de la infusión continua refieren que se corre el riesgo de sedación excesiva, efecto acumulativo e hipoventilación, afortunadamente todos riesgos potenciales que se evitan con la monitorización y entrenamiento adecuados del personal a cargo del paciente[35],[36].
Las dosis recomendadas se resumen a continuación:
|
Droga |
Carga (ug/kg) |
Bolo (ug/kg) |
Lockout (min) |
Infusión (ug/kg/h) |
Dosis máxima 4 h (ug/kg) |
|
MORFINA |
25-100 |
10-20 |
8-15 |
0-20 |
250-400 |
|
FENTANIL |
0,5-1 |
0,5 |
5-10 |
0-0,5 |
7-10 |
|
(Coté and Leman ‘s. A Practice of Anesthesia for lnfants and Children. Fifth Edition, 2013). |
|||||
Las principales complicaciones asociadas al uso de PCA/P-NCA endovenosa son las respectivas a la administración de opioides endovenosos. La más temida es la depresión respiratoria asociada a sedación excesiva, cuya incidencia reportada va desde 0 a 25%[37],[38]; los factores de riesgo descritos para ésta son el efecto acumulativo de drogas, el uso de infusión continua, administración de otras drogas sedantes y comorbilidades previas del paciente. Se ha descrito mayor riesgo cuando la bomba es manejada por enfermería o por los padres (P-NCA), quienes creyendo ayudar al paciente dan bolos de rescate, independiente del estado de sedación del niño.
La Joint Commission publicó el año 2012 una alerta al respecto[39], sin embargo, existen trabajos donde no existiría una diferencia significativa entre efectos adversos demostrada, siempre recalcando la adecuada monitorización del paciente[37].
-
7.4 Anestesia regional
-
7.4.1 Recomendamos siempre que sea posible el uso de técnicas de anestesia regional como parte de la analgesia multimodal en niños.
Calidad de la evidencia moderada/ Recomendación fuerte.
-
7.4.2 Recomendamos la utilización de neuroestimulación y/o ultrasonido en los procedimientos de anestesia regional, así como la preparación técnica de los especialistas en esta área.
Calidad de la evidencia baja/ Recomendación fuerte.
Comentario: La anestesia regional es una parte importante del componente multimodal en niños[17],[24],[26],[28],[30],[40], sin embargo, existen diferencias tanto es su técnica como utilidad, aún faltan estudios específicos para algunos procedimientos, para establecer una calidad de la evidencia fuerte global[17],[24],[28],[41].
Las técnicas regionales se siguen prefiriendo como modalidad analgésica dada su baja frecuencia de complicaciones y su facilidad de implementación, así como el menor consumo de fármacos asociados[23],[24],[26],[27],[28],[40],[41].
Consideraciones prácticas incluyen la apropiada selección del bloqueo y su manejo perioperatorio. A diferencia de la práctica en adultos las técnicas regionales en niños son reutilizadas bajo anestesia general[24],[27],[30],[40]. Presenta menor incidencia de complicaciones que las técnicas neuroaxiales[17],[24],[41].
Los bloqueos hechos con técnica de ultrasonido son más seguros que aquellos realizados con técnica de neuroestimulación, pero falta estandarización individual[17],[24],[28],[41].
En relación a técnica peridural, es importante informar a la familia y los pacientes de su efecto y eventuales complicaciones, así como mantener el seguimiento y vigilancia de los catéteres peridurales fuera del área quirúrgica (en sala)[23],[30].
Especial atención debe darse a la dosis máxima de anestésico local a usar en niños, a la técnica aséptica en la instalación de la analgesia regional y a sus contraindicaciones. Así también es necesario contar con una preparación de lípidos intravenosos, para manejar una eventual toxicidad secundaria al uso de anestésicos locales[17],[25],[28].
Las dosis recomendadas para usar una PCEA (Patient Controlled Epidural Analgesia) en pediatría son:

8. Repercusiones económicas potencialmente relevantes de la aplicación de la RC
Estas recomendaciones clínicas tendrán potencialmente un impacto económico en los servicios de pabellón y unidad de recuperación debido a la necesidad eventual de adquirir fármacos, insumos y monitores, entre otros. Además de considerar la capacitación de personal y reuniones de coordinación.
Pese a este mayor costo, la evaluación y manejo del dolor agudo perioperatorio en niños debe realizarse de manera agresiva y proactiva para evitar las consecuencias que genera si no es bien tratado[8]. Esta es una guía, no hace un análisis de costo, no hace una referencia en cuanto a los costos de tratar o no tratar y sus complicaciones. Este documento intenta optimizar específicamente el manejo del dolor agudo en la población pediátrica entre 1 mes y 18 años, que consulta en un centro hospitalario de salud nacional, por este motivo a nuestra manera de ver, los costos que eventualmente generaría van en directo beneficio de nuestros pacientes en pos del mejor resultado clínico posible.
|
Alto |
Estamos relativamente seguros de que el efecto real de la intervención se encuentra cerca de nuestra estimación |
|
Moderado |
El efecto real de la intervención probablemente se encuentra cerca de nuestra estimación, pero existe la posibilidad de que sea sustancialmente diferente |
|
Bajo |
El efecto real de la intervención puede ser sustancialmente diferente de nuestra estimación |
|
Muy bajo |
Es probable que el efecto real de la intervención sea sustancialmente diferente de nuestra estimación |
|
Recomendaciones fuertes |
Recomendaciones débiles |
|
|
Significado |
La alternativa recomendada puede ser seguida con todos o casi todos los pacientes. Una conversación detallada con el paciente o una revisión cuidadosa de la evidencia que fundamenta la recomendación pudiera no ser necesaria |
Si bien la alternativa recomendada es apropiada para la mayoría de los pacientes, la decisión debiera ser individualizada, idealmente mediante un enfoque de decisiones compartidas |
|
Se cumplen TODAS estas condiciones |
Se cumple ALGUNA de estas condiciones |
|
|
Calidad de la Evidencia |
Alta o moderada (o baja o muy baja en circunstancias excepcionales) |
Baja o muy baja |
|
Balance de beneficios y riesgos |
Una alternativa es claramente superior |
El balance de beneficios y riesgos es cercano |
|
Valores y preferencias de los pacientes |
Todos o casi todos los pacientes informados toman la misma decisión |
Existe variabilidad o incertidumbre respecto de lo que decidirán pacientes informados |
|
Consideraciones de recursos |
El costo de la intervención está plenamente justificado |
El costo de la intervención pudiera no estar justificado en algunas circunstancia |
| 0 | 1 | 2 | |
|
CARA |
No tiene expresión ni sonríe |
Ocasionalmente hace muecas o frunce el ceño pero esta retraído y desinteresadado |
Frunce el ceño con frecuencia, aprieta los dientes frecuentemente, le tiembla el mentón |
|
PIERNAS |
Posición normal o relajada |
Molesto, inquieto, tenso |
Patea o levanta las piernas |
|
ACTIVIDAD |
Acostado en silencio, posición normal y se mueve con facilidad |
Se retuerce, da muchas vueltas, tenso |
Se arquea, se pone rígido o se sacude |
|
LLANTO |
No llora (despierto o dormido) |
Gime y se queja de vez en cuando |
Llora sin parar, grita o solloza y se queja constantemente |
|
CONSUELO |
Tranquilo, relajado |
Se tranquiliza cuando lo tocan, lo abrazan o le hablan, se le puede distraer |
Es difícil consolar o tranquilizarlo |
→
→
| Escala COMFORT | |||||
| VARIABLE | Puntuación del comportamiento | ||||
| 1 punto | 2 puntos | 3 puntos | 4 puntos | 5 puntos | |
|
ESTADO DE ALERTA |
Sueño profundo |
Sueño ligero |
Somnoliento |
Despierto y alerta |
Hiper alerta |
|
ANSIEDAD |
Calmado |
Levemente ansioso |
Ansioso |
Muy ansioso |
En estado de Pánico |
|
RESPIRACIÓN* SOLO NIÑOS INTUBADOS |
Sin ventilación espontánea |
Ventilación espontánea y mecánica bien acoplado |
Resistencia al ventilador ocasional |
Respiraciones en contra del ventilador, tose regularmente |
Pelea contra en ventilador |
|
LLANTO** SOLO NIÑOS NO INTUBADOS |
Respiración tranquila |
Sollozos ocasionales |
Quejumbroso |
Llorando |
Gritando |
|
MOVIMIENTOS FÍSICOS |
Sin movimientos |
Movimientos leves ocasionales |
Movimientos leves frecuentes |
Movimientos vigorosos de las extremidades |
Movimientos vigorosos de todo el cuerpo |
|
TONO MUSCULAR |
Músculos laxos, sin tono |
Tono muscular disminuido |
Tono muscular normal |
Tono muscular aumentado |
Rigidez muscular estrema |
|
TENSIÓN FACIAL |
Músculos faciales totalmente laxos |
Tono facial normal |
Tensión de algunos músculos faciales |
Musculatura facial tensa |
Muecas y contorsiones faciales |
|
Droga |
Carga (ug/kg) |
Bolo (ug/kg) |
Lockout (min) |
Infusión (ug/kg/h) |
Dosis máxima 4 h (ug/kg) |
|
MORFINA |
25-100 |
10-20 |
8-15 |
0-20 |
250-400 |
|
FENTANIL |
0,5-1 |
0,5 |
5-10 |
0-0,5 |
7-10 |
|
(Coté and Leman ‘s. A Practice of Anesthesia for lnfants and Children. Fifth Edition, 2013). |
|||||
| Bupivacaina al 0,0625% ó 0,125% + Fentanil 2 a 10 ug/ml: | ||
| Infusión basal | Bolo | Lockout |
| 0,2 ml/kg/h | 1 a 3 ml | 15 a 30 minutos |
|
Dosis máxima de bupivacaina: 0,4 mg/kg/h, en menores de 6 meses la dosis máxima recomendada disminuye a 0,2-0,3 mg/kg/h. |
||
|
Miller R. Anesthesia, Eighth Edition 2015. |
||
Referencias
1. Infante A. Circular Ministerial 2A/46: Evaluación del Dolor como Quinto Signo Vital. Ministerio de Salud Chile; 2004.
2. Carta de derechos y deberes de los pacientes, Ministerio de Salud, Chile.
3. Walker SM, Beggs S, Baccei ML. Persistent changes in peripheral and spinal nociceptive processing after early tissue injury. Exp Neurol. 2016 Jan;275(Pt 2):253–60. https://doi.org/10.1016/j.expneurol.2015.06.020 PMID:26103453
4. Schug SA, Palmer GM, Scott DA, Halliwell R, Trinca J. Acute Pain Management: Scientific Evidence. 4th ed. Working Group of the Australian and New Zealand College of Anaesthetists and Faculty of Pain Medicine; 2015.
5. Twycross A, Dowden S, Bruce E. Managing Pain in Children: A Clinical Guide. 1st Edition, United Kingdom, Willey-Blackwell 2009. https://doi.org/10.1002/9781444322743.
6. Sociedad Chilena de Anestesia. Recomendaciones para el Manejo del dolor Agudo en niños, 2007.
7. Manual Metodológico de Guías de Práctica Clínica. MINSAL. 1ª Edición, septiembre 2014, Santiago de Chile.
8. Neumann I, Pantoja T, Peñaloza B, Cifuentes L, Rada G. El sistema GRADE: un cambio en la forma de evaluar la calidad de la evidencia y la fuerza de recomendaciones. Rev Med Chil. 2014 May;142(5):630–5. https://doi.org/10.4067/S0034-98872014000500012 PMID:25427021
9. Kristensen SD, Knuuti J, Saraste A, Anker S, Bøtker HE, De Hert S et al. Saraste A y cols. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur J Anaesthesiol. 2014;31(10):517–73. https://doi.org/10.1097/EJA.0000000000000150 PMID:25127426
10. Recommendations for guidelines productions. A document for task forces members responsible for the production un updating of ESC Guidelines. Committe for Practice Guidelines of the European Society of Cardiology. https://www.escardio.org/static_file/Escardio/Guidelines/about/ESC_Guidelines_for_Guidelines_Update_2012_for_web.pdf
11. Orientaciones para la elaboración y actualización de Recomendaciones Clínicas de la Sociedad de Anestesiología de Chile. Comité de Recomendaciones Clínicas SACH, 2017.
12. Bustamante R. Editorial: recomendaciones Clínicas. Rev Chil Anest. 2012;41:163–5.
13. Rodríguez MC, Villamor P, Castillo T. Assessment and management of pain in pediatric otolaryngology. Int J Pediatr Otorhinolaryngol. 2016 Nov;90:138–49. https://doi.org/10.1016/j.ijporl.2016.09.015 PMID:27729121
14. Andersen RD, Bernklev T, Langius-Eklöf A, Nakstad B, Jylli L. The COMFORT behavioural scale provides a useful assessment of sedation, pain and distress in toddlers undergoing minor elective surgery. Acta Paediatr. 2015 Sep;104(9):904–9. https://doi.org/10.1111/apa.13045 PMID:25980339
15. Pain after surgery in children and infants. International Association for the Study of Pain 2017.
16. American Society of Anesthesiologists Task Force on Acute Pain Management. Practice guidelines for acute pain management in the perioperative setting: an updated report by the American Society of Anesthesiologists Task Force on Acute Pain Management. Anesthesiology. 2012 Feb;116(2):248–73. https://doi.org/10.1097/ALN.0b013e31823c1030 PMID:22227789
17. Good Practice in Postoperative and Procedural Pain Management. 2nd Edition. Pediatr Anesth 2012; 22(Suppl. 1):1-79.
18. Nair S, Neil M. Pediatric pain: Physiology, assessment and pharmacology. Anesthesia tutorial of the week 289, 2013.
19. Chou R, Gordon DB. de Leon-Casasola OA y cols. Guidelines on the management of postoperative pain. J Pain. 2016;17(2):131–57. https://doi.org/10.1016/j.jpain.2015.12.008 PMID:26827847
20. Walker SM. Pain after surgery in children: clinical recommendations. Curr Opin Anaesthesiol. 2015 Oct;28(5):570–6. https://doi.org/10.1097/ACO.0000000000000227 PMID:26280822
21. Davidson F, Snow S, Hayden JA, Chorney J. Psychological interventions in managing postoperative pain in children: a systematic review. Pain. 2016 Sep;157(9):1872–86. https://doi.org/10.1097/j.pain.0000000000000636 PMID:27355184
22. Sng QW, He HG, Wang W, Taylor B, Chow A, Klainin-Yobas P et al. Wang W y cols. A meta-synthesis of children’s experiences of postoperative pain management. Worldviews Evid Based Nurs. 2017 Feb;14(1):46–54. https://doi.org/10.1111/wvn.12185 PMID:27930859
23. Ingelmo P, Rivera G, Baird R. Pain control after pediatric surgery: learning from the past to perfect the future. Pain Manag. 2016;6(1):9–12. https://doi.org/10.2217/pmt.15.51 PMID:26677915
24. Russell P, von Ungern-Sternberg BS, Schug SA. Perioperative analgesia in pediatric surgery. Curr Opin Anaesthesiol. 2013 Aug;26(4):420–7. https://doi.org/10.1097/ACO.0b013e3283625cc8 PMID:23756911
25. Sohn VY, Zenger D, Steele SR. Pain management in the pediatric surgical patient. Surg Clin North Am. 2012 Jun;92(3):471–85. https://doi.org/10.1016/j.suc.2012.03.002 PMID:22595704
26. Chandrakantan A, Glass PS. Multimodal therapies for postoperative nausea and vomiting, and pain. Br J Anaesth. 2011 Dec;107(1 Suppl 1):i27–40. https://doi.org/10.1093/bja/aer358 PMID:22156268
27. Jitpakdee T, Mandee S. Strategies for preventing side effects of systemic opioid in postoperative pediatric patients. Paediatr Anaesth. 2014 Jun;24(6):561–8. https://doi.org/10.1111/pan.12420 PMID:24809837
28. Brasher C, Gafsous B, Dugue S, Thiollier A, Kinderf J, Nivoche Y et al. Postoperative pain management in children and infants: an update. Paediatr Drugs. 2014 Apr;16(2):129–40. https://doi.org/10.1007/s40272-013-0062-0 PMID:24407716
29. Lovich-Sapola J, Smith CE, Brandt CP. Postoperative pain control. Surg Clin North Am. 2015 Apr;95(2):301–18. https://doi.org/10.1016/j.suc.2014.10.002 PMID:25814108
30. Schultz-Machata AM, Weiss M, Becke K. What’s new in pediatric acute pain therapy? Curr Opin Anaesthesiol. 2014 Jun;27(3):316–22. https://doi.org/10.1097/ACO.0000000000000074 PMID:24709667
31. Drugs Safety Communications (FDA). 21 sept 2015 (https://www.fda.gov/downloads/Drugs/DrugSafety/UCM463471.pdf)
32. Drugs Safety Communications (FDA). 1 julio 2015 https://www.fda.gov/downloads/Drugs/DrugSafety/UCM453228.pdf
33. Acute Pain Management. Scientific Evidence. 4th ed. Australian and New Zealand College of Anaesthetists and Faculty of Pain Medicine; 2015.
34. Skues MA, Watson DM, O’Meara M, Goddard JM. Patient controlled analgesia in children: A comparison of two infusion techniques. Paediatr Anaesth. 1993;3(4):223–8. https://doi.org/10.1111/j.1460-9592.1993.tb00070.x.
35. Looi-Lyons LC, Chung FF, Chan VW, McQuestion M. Respiratory depression: an adverse outcome during patient controlled analgesia therapy. J Clin Anesth. 1996 Mar;8(2):151–6. https://doi.org/10.1016/0952-8180(95)00202-2 PMID:8695099
36. Walder B, Schafer M, Henzi I, Tramèr MR. Efficacy and safety of patient-controlled opioid analgesia for acute postoperative pain. A quantitative systematic review. Acta Anaesthesiol Scand. 2001 Aug;45(7):795–804. https://doi.org/10.1034/j.1399-6576.2001.045007795.x PMID:11472277
37. Voepel-Lewis T, Marinkovic A, Kostrzewa A, Tait AR, Malviya S. The prevalence of and risk factors for adverse events in children receiving patient-controlled analgesia by proxy or patient-controlled analgesia after surgery. Anesth Analg. 2008 Jul;107(1):70–5. https://doi.org/10.1213/ane.0b013e318172fa9e PMID:18635469
38. McDonald AJ, Cooper MG. Patient-controlled analgesia: an appropriate method of pain control in children. Paediatr Drugs. 2001;3(4):273–84. https://doi.org/10.2165/00128072-200103040-00004 PMID:11354699
39. The Joint Commission. Patient controlled analgesia by proxy. http://www.jointcommission.org/assets/1/18/SEA_33.PDF (accessed Oct. 5, 2012).
40. Lönnqvist PA. Blocks for pain management in children undergoing ambulatory surgery. Curr Opin Anaesthesiol. 2011 Dec;24(6):627–32. https://doi.org/10.1097/ACO.0b013e32834a276d PMID:21772142
41. Suresh S, Schaldenbrand K, Wallis B, De Oliveira GS Jr. Regional anaesthesia to improve pain outcomes in paediatric surgical patients: a qualitative systematic review of randomized controlled trials. Br J Anaesth. 2014 Sep;113(3):375–90. https://doi.org/10.1093/bja/aeu156 PMID:24907283
42. Guía Evaluación y Manejo del Dolor Agudo. Hospital de Niños Roberto del Río. 2016.
43. De Leeuw T, Dirckx M, Gonzalez A, Scoones G, Huygen F, de Wildt S. The use of dipyrone (metamizol) as an analgesic in children: What is the evidence? A review. Pediatr Anesth; 2017. pp. 1–9.
