Ana María Espinoza 1 , Carlos Bollini 2
Recibido: 24-11-2019
Aceptado: 28-11-2019
©2020 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 49 Núm. 1 pp. 114-124|https://doi.org/10.25237/revchilanestv49n01.09
PDF|ePub|RIS
Strategies and recommendations for the prevention of ischemic complications in beach chair position for shoulder surgery
Abstract
Beach chair position is require for Shoulder surgery frequently for proper resolution. The stroke associated with shoulder surgery is a rare complication and probably underreported. The objective of this article is to review the pathophysiology of the ischemic damage associated with beach chair position, learn about strategies and develop recommendations to minimize risks.
Resumen
La cirugía de hombro (CH), requiere y requerirá colocar a los pacientes en la posición en silla de playa (PSP), cada vez con mayor frecuencia para su adecuada resolución. El asociado a CH, es una complicación poco frecuente y probablmente subreportada. El objetivo de esta revisión, es repasar la fisiopatología del daño isquémico asociado a PSP, conocer estrategias y elaborar recomedaciones destinadas a minimizar riesgos.
-
Introducción
La cirugía de hombro (CH), requiere y requerirá colocar a los pacientes en la posición en silla de playa (PSP), cada vez con mayor frecuencia para su adecuada resolución. Actualmente, no sólo es utilizada para la clásica cirugía artroscópica de manguito rotador ambulatoria, muchas veces realizada bajo anestesia regional y distintos grados de sedación. También se utiliza para reemplazos parciales o totales de hombro, fracturas proximales de húmero y nuevas cirugías artroscópicas, más prolongadas y complejas, como las que se realizan con injertos tendinosos propios o cadavéricos. Estas nuevas técnicas han traido aparejado un aumento en la indicación de la técnica anestésica de bloqueo regional asociado a la anestesia general (AG) en silla de playa.
El stroke asociado a CH, es una complicación poco frecuente y probablemente subreportada, pero su manifestación clínica inesperada es devastadora para pacientes, familiares y todo el equipo médico. Los trastornos neurocognitivos menores, como consecuencia de isquemias cerebrales intraoperatorias en PSP y CH, es tema de estudio en la actualidad.
Durante la década pasada, el reporte de casos que evolucionaron con isquemia cerebral y resultado de muerte, produjo una alerta en la comunidad especializada que implicó, entre otras acciones, repasar la fisiopatología del paciente en PSP[1],[2],[3],[4],[5], generando recomendaciones de prevención.
Sentar a un paciente anestesiado posee un impacto sobre la presión arterial (PA) y la presión de perfusión cerebral (PPC). La literatura actual da cuenta de la disminución de la PPC, al reportar en forma repetida, caídas significativas de la saturación regional cerebral de oxígeno (ScO2) en pacientes bajo AG que adoptan PSP[6].
Así mismo, la CH recluta a un grupo bastante heterogéneo de pacientes, por un lado pacientes jóvenes y eventualmente sanos y por otro lado, pacientes mayores que pueden poseer diversos grados de limitación de sus reservas fisiológicas. Con este último grupo debemos tener especial consideración, no olvidando que entre los casos reportados, existen pacientes sin factores de riesgo evidentes, pero en quienes pueden existir factores vasculares anatómicos que favorecen fenómenos isquémicos[3].
El objetivo de esta revisión, es repasar la fisiopatología del daño isquémico asociado a PSP, conocer estrategias y elaborar recomendaciones destinadas a minimizar riesgos.
-
Isquemia cerebral perioperatoria, generalidades y factores de riesgo
La isquemia cerebral perioperatoria o “stroke” se define como un déficit neurológico global o focal de origen cerebrovascular, que persiste por más de 24 h (o que se interrumpe por muerte del paciente dentro de las 24 h), en el contexto de un paciente quirúrgico.
El stroke, es una complicación grave que se asocia a morbimortalidad y que se ve más frecuentemente asociado a cirugía cardíaca, vascular y neuroquirúrgica, con una incidencia de 2,2-5,2%. En el resto de la población quirúrgica, la incidencia fluctúa entre un 0,05%-2,5%/[2],[7].
La mayoría de los strokes perioperatorios son de origen isquémico, exceptuando la cirugía cardíaca en que son principalmente de origen embólico.
En el ámbito de la cirugía ortopédica, la artroplastía de cadera se asociaba a un mayor riesgo, sobre todo en pacientes con patologías predisponentes. Actualmente, la cirugía de hombro en PSP, está a la altura de la cirugía de cadera como motivo de alta preocupación anestésica preventiva del stroke[7].
La mortalidad asociada al stroke perioperatorio, oscila entre un 26-60% y es más del doble que la de los strokes ocurridos en un contexto no quirúrgico, 13 y el 46%. Esta diferencia se explicaría por el estado inflamatorio que desencadena el estímulo quirúrgico, lo que a su vez empeora los fenómenos isquémicos. Aquellos pacientes con antecedente de stroke previo poseen una mortalidad más elevada aún, estimándose en alrededor de un 87%[7].
Aquellos pacientes que poseen daño endotelial previo (aunque sea una condición subclínica) se encuentran ante un mayor riesgo de isquemia cerebral. El endotelio posee un rol fundamental en el control del tono vascular cerebral, los fenómenos inflamatorios (liberar óxido nítrico, prostaciclinas y otras sustancias mediadoras) en este endotelio “disfuncionante” será más proclive a la ruptura de placa, al vasoespasmo y a la trombosis, lo que se suma a toda la respuesta neuroendocrina e inflamatoria del contexto quirúrgico[2],[7].
Dentro de los factores de riesgo identificados podemos enumerar: pacientes añosos, stroke previo, fibrilación auricular, enfermedad cardiovascular y/o metabólica.
La hipotensión arterial intraoperatoria no se ha identificado como factor de riesgo o factor etiológico frecuente responsable de isquemia cerebral. Lo anterior se entiende porque en el período intraoperatorio los pacientes son continuamente monitorizados y los períodos de hipotensión son fenómenos aislados que rápidamente se pesquisan y se revierten. La hipotensión arterial mantenida en el tiempo y no tratada adecuadamente, probablemente sí posea otro impacto [7]. La hipotensión arterial intraoperatoria es un factor de riesgo para pacientes que cursan con “zonas de penumbra” en casos de patología cerebrovascular en período agudo, estenosis carotídea crítica y teóricamente en pacientes que presentan anomalías anatómicas como incompetencia del polígono de Willis o ausencia de una carótida.
Existe evidencia que demuestra que hasta un 45% de la población presenta anomalías del polígono de Willis o un polígono incompleto, como también un 8% puede presentar ausencia de una carótida[3].
-
Isquemia cerebral asociada a PSP
La PSP para CH se practica desde la década de los ochenta[8], en USA, 2/3 de los cirujanos prefieren esta posición[5] por sobre el decúbito lateral. Se define como PSP la elevación del toráx por sobre las piernas, en un ángulo variable sobre el plano horizontal, de 30-90 grados.
El año 2003 se reportan dos casos de daño neurológico asociado a esta posición, un caso de pérdida de visión y oftalmoplejia y otro caso que evolucionó con afasia y hemiparesia[1].
Dos años después Pohl y Cullen[2] reportaron una serie de 4 casos con resultado neurológicos graves, 3 con isquemia cerebral y uno con isquemia medular. Todos eran pacientes en la edad media de la vida, dos sin antecedentes mórbidos y dos con antecedentes de cardiopatía, pero totalmente asintomáticos al momento de la cirugía.
Es importante destacar que todos los casos se realizaron con los pacientes bajo anestesia general con ventilación mecánica, también que el período intraoperatorio fue consignado sin incidentes.
En el año 2012 se publica otro caso de isquemia cerebral focal en que se demostró la presencia de una anormalidad anatómica preexistente que pudo favorecer el stroke[3].
Friedman y cols[5] publicaron el resultado de una encuesta que realizaron a 267 cirujanos pertenecientes a la Sociedad Americana de Cirujanos de Hombro y Codo. Se reportaron 8 casos de daño neurológico, todos en PSP, estimándose una incidencia de 0,00461%.
Durante el año 2011 la Sociedad Americana de Anestesiología, en el análisis que realiza periódicamente de casos médico legales cerrados, publica que el 24% de las lesiones neurológicas cervicales ocurren en cirugías realizadas con PSP[9].
Actualmente, se conocen 23 casos de stroke asociado a PSP en CH. Los datos han sido obtenidos desde publicaciones médicas o aportados por compañías de seguro, pero desconocemos la verdadera incidencia aunque sospechamos que el número de casos puede ser mayor debido al subreporte existente[4].
Por otro lado, puede existir déficit neurológico sin llegar al stroke, existe evidencia que demuestra la asociación entre trastornos neurocognitivos y períodos de desaturación cerebral (DcO2) intraoperatoria en PSP[10]. Estos trastornos neurocognitivos menores, difíciles de constatar sin una evaluación neurocognitiva exhaustiva previa, son un nuevo campo de investigación, no solo en este tipo de cirugía si no en toda la población añosa que se somete a cirugía.
-
Cambios hemodinámicos en PSP bajo anestesia general
En individuos sin anestesia los cambios hemodinámicos que ocurren frente a cambios de posición son discretos, ya que existe compensación mediada por el sistema nervioso simpático (SNS). Si bien se produce una reducción del gasto cardíaco (GC) y de la presión arterial (PA) de un 20% y una caída de la presión de perfusión cerebral (PPC) de un 15%, estas variaciones se compensan rápidamente con el aumento de la resistencia vascular sistémica y el aumento de la frecuencia cardíaca[2],[11].
En pacientes bajo anestesia general no ocurre lo mismo, por un lado las respuestas reflejas del SNS que regulan la PA están inhibidas y por otro lado, existe una disminución del retorno venoso secundario a la vasodilatación que generan las drogas anestésicas. Lo anterior genera redistribución de flujo venoso principalmente en las extremidades inferiores, caída de la precarga, del GC, de la presión arterial media(PAM) y de la PPC[2],[11],[12].
A lo anterior hay que sumar otro factor determinante que acentúa la disminución del retorno venoso y está dado por el aumento de la presión intratorácica que genera la ventilación mecánica.
Otro factor que también han sido involucrado y puede contribuir a la disminución del retorno venoso proveniente del cerebro, es la obstrucción mecánica de la venas yugulares secundario a flexión lateral de la cabeza o compresión externa por collar de fijación. Lo anterior teóricamente también puede genera aumento de la presión intracraneal y vasoconstricción arterial secundaria. La hiperflexión anteroposterior también se ha asociado a cuadriplejia en otro tipo de cirugías y en trabajos en animales de experimentación[2].
Es difícil establecer un límite inferior de presión arterial media (PAM) para mantener asegurada la autorregulación cerebral, ya que existe mucha variabilidad interindividual, pero se sugiere no tolerar caídas de presiones sistólicas más allá de los 90 mmHg o mayores a un 20% de la presión arterial basal.
Clásicamente se ha planteado que la autorregulación de flujo cerebral (mecanismo que mantiene el flujo cerebral estable) se mantiene con PAM de 50 a 150 mm Hg en pacientes sanos. En pacientes vigiles, los signos de isquemia cerebral aparecen con PAM por debajo de 50 mmHg o frente a una reducción del flujo sanguíneo cerebral del 40%. Además hay que tener en cuenta que la autorregulación se ve afectada por comorbilidades como: HTA, diabetes mellitus, ateroesclerosis, tabaquismo, apnea obstructiva del sueño, etc.
Actualmente, se plantea que la PAM mínima necesaria para mantener la autorregulación cerebral es de 70 mmHg en sujetos normotensos, PAM menores se relacionan con una caída lineal de la PPC[13],[14], [15]. Existen condiciones desconocidas que pueden generar mayor riesgo de isquemia, como puede ocurrir en pacientes con cuadros subclínicos de estenosis arterial o población portadora de malformaciones vasculares cerebrales que favorecen isquemia cerebral. Existe evidencia de que hasta un 45% de la población puede presentar estas variaciones anatómicas[3],[16].
-
Medición de presión arterial
La pregunta que habría que plantearse es ¿por qué si la PA es un parámetro que se monitoriza permanentemente durante el período intraoperatorio, se reportan casos de isquemia cerebral? Probablemente la respuesta es que uno de los factores determinantes ha sido la hipotensión mantenida sin diagnóstico, por error en la lectura la PAM. También o asociado a una mala o poco frecuente medición, por no tener presente que la irrigación cerebral es gobernada por la PAM y no por la PAS.
Una práctica ya no tan habitual, para no obstruir el flujo de la vía venosa y la lectura de la oximetría de pulso, era la tendencia de colocar el manguito neumático de presión arterial en la pantorrilla. Al sentar a un paciente anestesiado y tomar la PA en el brazo o en la pierna, se produce un gradiente hidrostático que produce una diferencia entre la presión existente en el cerebro y la obtenida más distalmente. A mayor distancia (en la línea vertical) entre el cerebro y el sitio donde está ubicado el manguito de presión, mayor será el gradiente y mayor la diferencia de presión obtenida (Figuras 1 y 2). En decúbito lateral esta diferencia no es importante y entre el tobillo y el brazo la diferencia probablemente no superará los 5-10 mm de Hg[17].
Para mantener una adecuada presión arterial media de perfusión cerebral en posición sentada, se aconseja hacer una corrección en el valor obtenido en cada medición de la PA. Considerando la distancia entre el cerebro y el sitio de medición. El gradiente entre el cerebro y el punto de medición genera una diferencia de 0,77 mmHg por cada 1 cm de diferencia (o 1 mm Hg por cada 1,25 cm)[18],[19],[20]. Si en PSP existe una distancia de 30-40 cm entre el conducto auditivo externo (CAE) y el punto medio del manguito de presión en el brazo, la diferencia de presión arterial media puede alcanzar 20-30 mmHg y si entre el CAE y la pantorrilla hay 60-70 cm, la diferencia puede llegar a ser de 45-55 mmHg. En otras palabras, para mantener una PAM cerebral dentro de evalores de autorregulación seguros de 60-70 mmHg es necesario conseguir una PAM braquial de 80-90 mmHg.
Sin embargo, no existe consenso entre los diferentes autores ya que existen dos teorías al respecto: la teoría del circuito cerrado o “sifón” y la del circuito abierto o “cascada de agua”. El circuito cerrado o “sifón” plantea la existencia de una columna constante de flujo tanto a nivel arterial como venoso y el efecto de la gravedad se compensa con el impacto sobre los 2 sistemas, lo que mantendría el flujo y la PAM sin variación, por lo que la corrección de la PA sería irrelevante. En cambio la teoría del “circuito abierto” o cascada de agua, que es la más aceptada, plantea que sí existe una diferencia según el gradiente hidrostático generado y la corrección de presión debe realizarse si la presión arterial se mide en un lugar distante del cerebro[16],[21].
A mayor ángulo de posición, tendremos mayor impacto hemodinámico y mayor gradiente hidrostático entre el cerebro y el sitio de medición de PA (Figura 1 y 2). Si el gradiente aumenta y no se hace corrección en la lectura de la PA se estará sobrevalorando la PPC y el riego de isquemia aumenta.
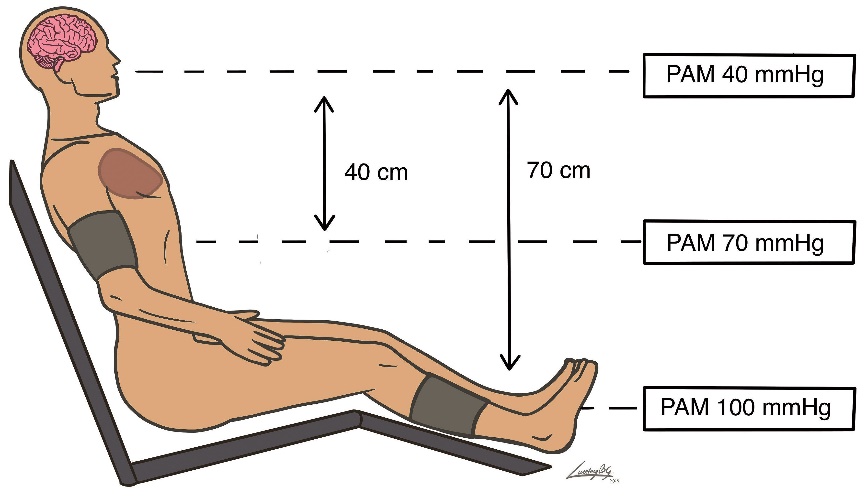
Figura 1. Paciente sentado en ángulo de 80º.
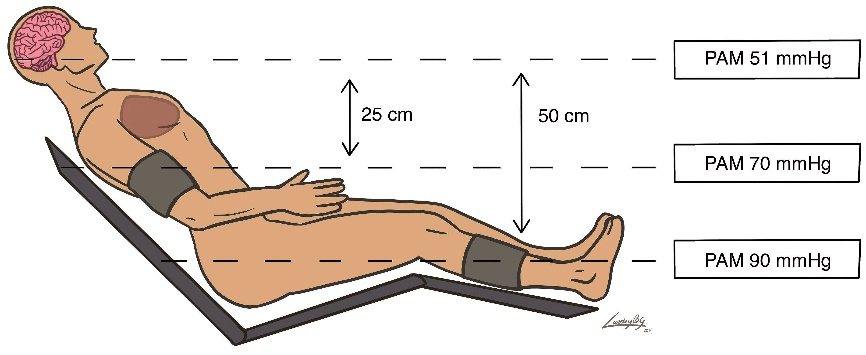
Figura 2. Paciente sentado en ángulo de 45º.
-
Medición de la perfusión cerebral
Durante la última década y posterior al reporte de los casos de isquemia cerebral en pacientes en PSP, se han publicado numerosos trabajos que han centrado el estudio en medir la disponibilidad de oxígeno al cerebro en relación con los cambios de posición[22]. La variable más frecuentemente evaluada es la Saturación Cerebral Regional de Oxígeno (ScO2), medida mediante métodos no invasivos como el uso del NIRS (Near Infra Red Spectroscopy) y/o también medición directa de saturación de oxígeno en el bulbo yugular.
El NIRS mide oxigenación cerebral regional a través de medición transcutánea. Los sensores son puestos en zonas vulnerables frente a los cambios de demanda y aporte de O2, como la corteza frontal y se define como cambio significativo, un caída mayor o igual al 20% del valor basal o menor a 55% como valor absoluto. Estos sensores determinan saturación cerebral gracias a la cantidad de luz que absorbe la hemoglobina en el cerebro y nos da información a cerca de la perfusión cerebral en esa área puntual, ya que el flujo cerebral no necesariamente se mantiene homogéneo en todo el cerebro. El aparato analiza y mide la relación entre los dos tipos de hemoglobina, realiza la substracción entre la señal superficial y profunda para obtener como resultado la saturación regional de oxígeno de hemoglobina en la corteza frontal. En el cerebro la relación entre sangre venosa y arterial es de 85:15, la ScO2 mide más bien la saturación cerebral venosa, reflejando también el balance entre aporte y demanda cerebral. Los valores obtenidos de ScO2 dependen de las variables que influencian el equilibrio entre la oferta y la demanda de oxígeno cerebral[23],[24].
Existe discusión si NIRS realmente es capaz de predecir eventos isquémico, ya que el valor calculado por el monitor asume una relación fija entre saturación arterial y venosa cerebral, valor que puede variar en PSP[25]. Se han reportado discordancias entre la medición de saturación de O2 cerebral medida en de bulbo yugular comparada con NIRS. Jeong H y cols describieron que NIRS fue concordante sólo en un 30% de los casos en que las mediciones de saturaciones venosas de bulbo fueron menores al 50%[26].
Los distintos trabajos realizados para medir cambios en PSP han demostrado resultados dispares, pero esto puede estar dado por la variabilidad de factores presentes: momento de mediciones, número de mediciones, magnitud del ángulo de la posición, tipo de anestesia, variabilidad de PAM, lugar de medición de PAM, número pequeño de pacientes, etc.
No obstante, por el momento la información disponible demuestra que hasta un 80% de la población en PSP bajo anestesia general y ventilación mecánica, puede evolucionar con caídas de saturación venosa cerebral mayor al 20%[22]-[26].
Murphy[27] comparó dos grupos de pacientes sometidos a CAH, 134 pacientes. Un grupo en decúbito lateral (DL) y otro en PSP (todos en ángulo de 80-90º, se eliminaron los pacientes en ángulos menores). Todos los pacientes recibieron anestesia general y midieron ScO2 con NIRS. El grupo PSP presentó un 80,3% de eventos de desaturación cerebral de O2(DcO2) comparado con un 0% en el grupo DL. La duración de los períodos de DcO2 varió de 3 segundos a 9 minutos. Ningún paciente evolucionó con signos de isquemia. Posteriormente este mismo autor[28] encontró un 56% de DcO2 en pacientes en PSP y de éstos el 68% coincidió con períodos de hipotensión. El 76% de los pacientes requirió fenilefrina para corregir la PAM.
Tange[29], no encontró diferencias en 30 pacientes en que midió ScO2 y en quienes la PAM se mantuvo sobre 60 mmHg. Se midió ScO2 en decúbito supino, en el paciente sentado en ángulo de 30º y posteriormente en 60º. Probablemente estos resultados se pueden explicar porque no hubo ángulos mayores a 60º y porque la medición de ScO2 no fue continua, durando 5 min en relación a cada cambio.
Moerman y cols.[30] encontraron una caída significativa de la ScO2, en el 80% de un grupo de 20 pacientes en PSP de ángulo de 60-70º. El 30% presentó, además, una caída menor del 50% de saturación. Hubo correlación con caída del CO2 telespirado.
Lee y cols.[31] midieron episodios de DcO2 en 27 pacientes bajo anestesia general más hipotensión controlada, manteniendo PAM de 60-65 mmHg medida a nivel del CAE. Encontraron que un 7,4% (2 pac) presentaron DcO2 en PSP, los 2 pacientes evolucionaron con PAM menores de 60 mmHg al momento de la DcO2, lo que se revirtió al elevar la PAM. El valor promedio de ScO2 en los pacientes anestesiados antes de sentarlos fue de 74% y en PSP fue de 67%. Al inducir hipotensión en PSP los valores de ScO2 se mantuvieron en un 66% y no hubo alteración en las pruebas neurocognitivas. La PAM sí presentó una caída importante al sentar a los pacientes y al inducir hipotensión. La baja incidencia de DcO2 se puede explicar por la definición de DcO2 que los autores platearon (caída mayor al 80% sobre valor basal) y además porque la PA fue rigurosamente medida a nivel del CAE.
Pant y cols. publicaron un metaanálisis que evaluó la utilidad del NIRS en CAH en PSP. Incluyeron 9 artículos, con un total de 340 pacientes. Encontraron una incidencia de 29% de DcO2 y establecieron una relación entre el número de eventos y el ángulo de PSP. A mayor ángulo mayor incidencia de eventos[6].
Laflam A. y cols.[32] evaluaron y compararon autorregulación cerebral a través de un índice que se calculaba al integrar DcO2 y PA medida por pletismografía. También midieron resultados congnitivos y biomarcadores. Al comparar un grupo en DL vs PSP, PSP presentó mayores eventos de DcO2 y caídas de PPC sobre límite inferior de autorregulación. No obstante, estos resultados no presentaron correlación con resultados cognitivos clínicos ni biomarcadores.
Algunos de los trabajos mencionados, también han tratado de correlacionar caída de la PAM y eventos de DcO2, pero no se ha podido establecer una relación lineal o establecer cuál magnitud de caída de PAM, impacte la DcO2. En cirugía cardíaca y monitorización con NIRS, sí se ha podido establecer que DcO2 mayores a 50 min se se asocian a deterioro cognitivo[15].
En relación al uso de vasoconstrictores y DcO2, se ha reportado mayor eventos DcO2 secundario a uso de vasocontrictores como fenilefrina o arginina vasopresina, comparado con manejo de volemización con cristaloides. Se plantea que estos fármacos pueden producir mayor DcO2 a expensas de vasoconstricción de vasos extracraneales o cambios en el flujo sanguíneo cerebral, además la fenilefrina es un vasoconstrictor que se ha asociado a caída del gasto cardíaco, situación que favorece la caída del flujo sanguíneo cerebral, a diferencia de efedrina que mejora el gasto cardiaco[21].
Actualmente, se considera que la monitorización con NIRS es una herramienta útil para pesquisar caídas de saturación de oxígeno cerebral y mayor riesgo de isquemia. Sin embargo, hay que tener presente que este monitor posee limitaciones, no considera todas las variables que pudiesen favorecer una isquemia cerebral y la correlación clínica con un daño neurológico no se ha establecido aun.
-
Impacto de la técnica anestésica sobre los resultados
También durante los últimos años, se han publicado trabajos que evalúan el impacto de las distintas técnicas anestésicas sobre los resultados, pero es difícil obtener datos “duros” en relación a una complicación tan poco frecuente y de etiología multifactorial.
En relación con la anestesia regional (AR) se ha tratado de demostrar su rol “protector” cuando se usa como técnica anestésica acompañado de sedación en ventilación espontánea. Lo anterior se ve reflejado en trabajos que demuestran un menor impacto hemodinámico sistémico y regional cerebral. Teóricamente habría una preservación de la autorregulación cerebral y una menor caída del retorno venoso al no estar presente el efecto de la VM y de altas concentraciones de drogas vasodilatadoras. Sin embargo, si el bloqueo de plexo interescalénico no logra dar una excelente calidad de anestesia o el paciente requiere de una sedación profunda, también pueden existir cambios hemodinámicos. La sedación además puede comprometer la ventilación, lo que puede sumarse a diversos grados de parálisis diafragmáticas secundaria al bloqueo interescalénico. Hay que tener presente que la literatura también reporta complicaciones propias del bloqueo de plexo interescalénico en el ámbito hemodinámico: hasta un 13-24% de la población puede evolucionar con hipotensión y bradicardia llegando incluso a la asistolía. Lo anterior se debería a la activación del reflejo de Bezold Jarisch que también se describe en pacientes bajo anestesia raquídea[33].
Aguirre y cols.[10] publicaron un trabajo en 90 pacientes, en que compararon la incidencia DcO2 mediante NIRS y su relación con cambios neurocognitivos en pacientes en PSP en 65º. Un grupo recibió AG y otro grupo bloqueo interescalénico más sedación con propofol y remifentanil (AR). En ambos grupos la PAM se mantuvo entre 100 y 80 mmHg (medidas a nivel del corazón), lo que se logró mediante indicación de drogas vasoactivas para subir o bajar dicho parámetro. La incidencia de DcO2 fue de 71% para AG comparado con un 2,2% para AR. Estos autores incluso encuentran un incremento del ScO2 que se describió al comparar el valor basal con el valor después de 5 min de PSP en el grupo AR. El perfil hemodinámico fue favorable para el grupo AR al igual que los resultados neurocognitivos. Se demostró un claro deterioro de las pruebas neurocognitivas en el grupo con AG. Los pacientes que evolucionaron con DcO2, mostraron un mayor deterioro de los resultados en comparación con aquellos que no presentaron DcO2. Contrariamente a este grupo, otro autor no encontró alteración de pruebas cognitivas en un grupo de 50 pacientes que recibieron AG con sevofluorano en PSP a pesar de un 18% de DcO2[34]. Así mismo, Koh y cols.[35] compararon AG con AR más sedación con propofol en 60 pacientes en PSP, sin hipotensión controlada y con un protocolo de tratamiento implementado para tratar DcO2. Encontraron una incidencia de 57% de episodios de DcO2 en el grupo con AG, en comparación con el 0% en el grupo con AR.
Yadeau y cols.[36] evaluaron el impacto de la AR más sedación con propofol, sobre la ScO2 en 99 pacientes en PSP e hipotensión controlada. Encontraron una incidencia de hipotensión de 99%, pero sólo un 10% presentó DcO2. Los autores explican que si bien hay impacto sobre la PAM, la autorregulación cerebral se mantendría y por eso la caída de ScO2 es menor que la reportada en pacientes bajo anestesia general. Sin embargo, esta cohorte corresponde a un grupo de pacientes menores de 50 años y el protocolo de hipotensión controlada no se estandarizó y los vasoconstrictores se utilizaron según el criterio del anestesiólogo presente. En la línea de evaluar el efecto de la AR, el mismo autor[35] analizó 4.169 casos de CAH en PSP bajo régimen de cirugía ambulatoria del Hospital for Special Surgery de New York (3.000 casos retrospectivos y 1.169 prospectivos). El 96% de los pacientes se operó con AR más sedación en ventilación espontánea, el 2,5% recibió anestesia regional más anestesia general y el 1,5% sólo con anestesia general. El 61% recibió drogas hipotensivas, siendo las más utilizadas metoprolol y/o labetalol o hidralazina para obtener cifras de presión más bajas para que el cirujano tuviese mejor visualización. La PA se midió en forma no invasiva en el brazo contralateral, definiendo hipotensión como presión sistólica menor de 90 mmHg, o MAP menor de 60 mmHg o caída de más del 30% del valor basal. El 47% de los pacientes presentó hipotensión y no hubo reporte de casos de stroke. Posteriormente, M. Rohrbaugh[37]no encontró eventos neurológicos en 15014 pacientes. Esta publicación reúne la experiencia de 11 años en CAH en PSP en pacientes bajo anestesia regional (bloqueo interescalénico), sedados con propofol y en ventilación espontánea. Los datos fueron obtenidos de la base de datos en que se registran todas las complicaciones asociadas a anestesia en los campus de la Universidad de Pittsburgh y desde la base de datos que registra las readmisiones no programadas.
En relación con la anestesia general Jeong H. y cols.[39] compararon dos técnicas diferentes de anestesia general en pacientes en PSP. Un grupo recibió anestesia general inhalatoria con sevofluorano y el otro grupo anestesia general endovenosa con propofol. El primer grupo presentó una menor caída de la PAM después de sentar al paciente y un mejor perfil en las mediciones de saturación de oxígeno en bulbo yugular (en decúbito y en PSP) comparado con el segundo grupo. La caída de saturación venosa en bulbo yugular (SO2vJ) fue de un 16% en grupo con sevofluorano comparado con un 71% en el grupo con propofol. Ningún paciente presentó DcO2 menores al 40% (valor crítico asociado a isquemia cerebral) en el grupo con sevofluorano, comparado con un 29% del grupo con propofol. De los pacientes que presentaron caída de la SO2vJ bajo 50%, un 27% de los pacientes presentó hipotensión, un 27% presentó caída de la ScO2 (NIRS) más hipotensión y un 7% sólo caída de la SrO2. El 40% de los pacientes con SO2vJ bajo 50%, no presentó ni hipotensión ni caída de la ScO2.
También se han comparado grupos evaluando el efecto del aumento del CO2 telespirado y su relación con incidencia de DcO2. Murphy y cols.[28] compararon un grupo control con CO2 de 30-32 mmHg contra otro grupo con CO2 de 40-42 mmHg. Describieron una incidencia de DcO2 de 56% y 9% respectivamente. Todos pacientes sentados en ángulo de 80 a 90º. Picton y cols.[40] compararon dos estrategias de ventilación mecánica y midieron su impacto sobre la ScO2, encontrando que el aumento de la Fi02 de 0,3 a 1 en el paciente en PSP produjo un incremento de la ScO2 en un 5% y al subir la capnometrías de 30 a 45 mmHg se produjo un incremento adicional de un 9% más. Este grupo no encontró diferencias entre las técnicas con desfluorano comparado propofol.
Otro factor que se ha medido y al cual se le ha encontrado un rol protector para prevenir caídas de la PAM y/o ScO2, es el uso rutinario de compresión neumática intermitente de ambas extremidades inferiores, esto contribuirían a mantener el gasto cardíaco, mejorando la precarga[21].
En suma, la AR más sedación en ventilación espontánea se asocia a menor incidencia de DcO2 en todos los trabajos publicados. De la misma forma la estrategia de mantener CO2 telespirado sobre 40 mmHg en pacientes bajo anestesia general se asocia a menor caída de la ScO2. Al comparar sevofluorano con propofol, el primero posee un mejor perfil y la mantención de FiO2 sobre 70% favorecería caídas menores de ScO2.
-
Conclusiones y sugerencias
La isquemia cerebral en pacientes de CAH en PSP es una complicación grave, devastadora poco frecuente y de etiología multifactorial. Los pacientes bajo efecto de AG que adoptan PSP poseen caída del gasto cardíaco, de la presión arterial y de la presión de perfusión cerebral. Si esta caída de presión se mantiene en el tiempo, estos pacientes poseen teóricamente mayor riesgo de hipoperfusión cerebral y daño isquémico. La decisión de sentar a un paciente debe considerar al anestesiólogo y al cirujano, conciliando una buena exposición quirúrgica con el menor impacto hemodinámico posible y menor riesgo de isquemia. La medición fidedigna de la PA es fundamental y se debe tener en mente que en PSP la PA medida distalmente no traduce en forma precisa la PPC. Especial cuidado se debe tener con pacientes con disminución conocida de la reserva cerebrovascular, pero no olvidando a los pacientes “sanos” que podrían tener también algún factor anatómico desconocido que predisponga a la isquemia. La AR tendría un rol protector y su menor impacto sobre la hemodinamia y sobre eventos de DcO2 podrían asociarse a mejores resultados. El NIRS es un monitor que nos sirve para pesquisar eventos de DcO2, pero su capacidad de predecir isquemia cerebral en PSP aún no está establecida.
A la luz de la evidencia disponible, se puede establecer y sugerir las siguientes estrategias:
1- La PSP en pacientes bajo AG genera cambios hemodinámicos que afectan la PPC. La PAM debería mantenerse sobre 70 mmHg y no deberían tolerarse caídas sobre el 20% del valor basal.
2- La magnitud del ángulo de la PSP es un factor importante al favorecer mayores cambios hemodinámicos. Se sugieren ángulos menores a 45º.
3- La medición de la PAM en PSP debe ser obtenida en la parte más cercana al cerebro. La PA NO debe medirse en las extremidades inferiores durante PSP.
4- Frente a pacientes con factores de riesgo de hipoperfusión cerebral lo ideal es medir PA en forma invasiva y poner transductor a la altura del CAE.
5- La AR es una buena alternativa anestésica ya que se asocia a menor porcentaje de DcO2, debe ser realizada cuando sea posible.
6- Bajo ventilación mecánica, el CO2 telespirado debería mantenerse sobre los 40 mmHg, ya que se asocia a menor incidencia de DcO2. La FiO2 debería mantenerse sobre 0,7.
7- Bajo AG, la ventilación espontánea es preferible a ventilación mecánica.
8- La monitorización con NIRS es útil al detectar DcO2, su rol en la prevención aun no se ha establecido.
9- En pacientes bajo AG y PSP, el sevofluorano sería mejor que el propofol.
10- Es aconsejable el uso rutinario de compresión neumática intermitente.
11- La cabeza debe ser posicionada con rigurosidad, evitando compresiones externas e hiperflexiones en el sentido lateral y anteroposterior.
Parte de este artículo fue publicado el año 2016.
Espinoza U. Ana, Bollini Carlos. Cirugía de hombro en posición en silla de playa: prevención de complicaciones isquémicas.
Referencias
1. Bhatti MT, Enneking FK. Visual loss and ophthalmoplegia after shoulder surgery. Anesth Analg. 2003 Mar;96(3):899–902. https://doi.org/10.1213/01.ANE.0000047272.31849.F9 PMID:12598282
2. Pohl A, Cullen DJ. Cerebral ischemia during shoulder surgery in the upright position: a case series. J Clin Anesth. 2005 Sep;17(6):463–9. https://doi.org/10.1016/j.jclinane.2004.09.012 PMID:16171668
3. Drummond JC, Lee RR, Howell JP Jr. Focal cerebral ischemia after surgery in the “beach chair” position: the role of a congenital variation of circle of Willis anatomy. Anesth Analg. 2012 Jun;114(6):1301–3. https://doi.org/10.1213/ANE.0b013e31823aca46 PMID:22052983
4. Drummond JC. A beach chair, comfortably positioned atop an iceberg. Anesth Analg. 2013 Jun;116(6):1204–6. https://doi.org/10.1213/ANE.0b013e318291826b PMID:23709074
5. Friedman DJ, Parnes NZ, Zimmer Z, Higgins LD, Warner JJ. Prevalence of cerebrovascular events during shoulder surgery and association with patient position. Orthopedics. 2009 Apr;32(4):256–64. PMID:19388618
6. Pant S, Bokor DJ, Low AK. Cerebral oxygenation using near-infrared spectroscopy in the beach-chair position during shoulder arthroscopy under general anesthesia. Arthroscopy. 2014 Nov;30(11):1520–7. https://doi.org/10.1016/j.arthro.2014.05.042 PMID:25108906
7. Ng JL, Chan MT, Gelb AW. Perioperative stroke in noncardiac, nonneurosurgical surgery. Anesthesiology. 2011 Oct;115(4):879–90. https://doi.org/10.1097/ALN.0b013e31822e9499 PMID:21862923
8. Skyhar MJ, Altchek DW, Warren RF, Wickiewicz TL, O’Brien SJ. Shoulder arthroscopy with the patient in the beach-chair position. Arthroscopy. 1988;4(4):256–9. https://doi.org/10.1016/S0749-8063(88)80040-9 PMID:3233114
9. Hindman BJ, Palecek JP, Posner KL, Traynelis VC, Lee LA, Sawin PD, et al. Cervical spinal cord, root, and bony spine injuries: a closed claims analysis. Anesthesiology. 2011 Apr;114(4):782–95. https://doi.org/10.1097/ALN.0b013e3182104859 PMID:21326090
10. Aguirre J, Borgeat A, Trachsel T, Cobo Del Prado I, De Andrés J, Bühler P. Cerebral oxygenation in patients undergoing shoulder surgery in beach chair position: comparing general to regional anesthesia and the impact on neurobehavioral outcome. Rev Esp Anestesiol Reanim. 2014 Feb;61(2):64–72. https://doi.org/10.1016/j.redar.2013.08.002 PMID:24119783
11. Cullen D, Kirby R. Beach chair position may decrease cerebral perfusion: catastrophic outcomes have occurred. APSF Newslett. 2007;22:25–7.
12. Marshall WK, Bedford RF, Miller ED. Cardiovascular responses in the seated position—impact of four anesthetic techniques. Anesth Analg. 1983 Jul;62(7):648–53. https://doi.org/10.1213/00000539-198307000-00005 PMID:6344698
13. Drummond JC. The lower limit of autoregulation: time to revise our thinking? Anesthesiology. 1997 Jun;86(6):1431–3. https://doi.org/10.1097/00000542-199706000-00034 PMID:9197320
14. Murphy GS, Szokol JW. Blood pressure management during beach chair position shoulder surgery: what do we know? Can J Anaesth. 2011 Nov;58(11):977–82. https://doi.org/10.1007/s12630-011-9573-8 PMID:21863353
15. Orebaugh S, Palmeri S, Lin C, YaDeau J. Daring discourse: is nerve block with sedation the safest anesthetic for beach chair position? Reg Anesth Pain Med. 2019 Jul;44(7):707–12. https://doi.org/10.1136/rapm-2018-100230 PMID:30928909
16. Lanier W. Cerebral Perfusion Cerebral Perfusion: err on the Side of Caution. APSF Newslett. 2009;24:1–4.
17. Choi JC, Lee JH, Lee YD, Kim SY, Chang SJ. Ankle-brachial blood pressure differences in the beach-chair position of the shoulder surgery. Korean J Anesthesiol. 2012 Dec;63(6):515–20. https://doi.org/10.4097/kjae.2012.63.6.515 PMID:23277812
18. Miller RD, Stoelting RK. Basics of Anesthesia. In: Drummond JC, Patel PM, editors. Cerebral physiology and the effects of anesthestics and techniques. 5th ed. New York (NY): Churchill Livingstone; 2000. p. 699.
19. Lee L, Caplan R. APSF workshop: cerebral perfusion experts share views on management of head-up cases. APSF Newslett. 2009–10;24:45–8.
20. Drummond J, Hargens A, Patel P. Hydrostatic gradient is important-blood pressure should be corrected. APSF Newslett. 2009;24:6.
21. Murphy GS, Greenberg SB, Szokol JW. Safety of Beach Chair Position Shoulder Surgery: A Review of the Current Literature. Anesth Analg. 2019 Jul;129(1):101–18. https://doi.org/10.1213/ANE.0000000000004133 PMID:30973381
22. Troianos C. Cerebral oximetry may provide helpful information. APSF Newslett. 2009;24:7–9.
23. Wahr JA, Tremper KK, Samra S, Delpy DT. Near-infrared spectroscopy: theory and applications. J Cardiothorac Vasc Anesth. 1996 Apr;10(3):406–18. https://doi.org/10.1016/S1053-0770(96)80107-8 PMID:8725427
24. Watzman HM, Kurth CD, Montenegro LM, Rome J, Steven JM, Nicolson SC. Arterial and venous contributions to near-infrared cerebral oximetry. Anesthesiology. 2000 Oct;93(4):947–53. https://doi.org/10.1097/00000542-200010000-00012 PMID:11020744
25. Meex I, Genbrugge C, De Deyne C, Jans F. Cerebral tissue oxygen saturation during arthroscopic shoulder surgery in the beach chair and lateral decubitus position. Acta Anaesthesiol Belg. 2015;66(1):11–7. PMID:26103737
26. Jeong H, Jeong S, Lim HJ, Lee J, Yoo KY. Cerebral oxygen saturation measured by near-infrared spectroscopy and jugular venous bulb oxygen saturation during arthroscopic shoulder surgery in beach chair position under sevoflurane-nitrous oxide or propofol-remifentanil anesthesia. Anesthesiology. 2012 May;116(5):1047–56. https://doi.org/10.1097/ALN.0b013e31825154d2 PMID:22421420
27. Murphy GS, Szokol JW, Marymont JH, Greenberg SB, Avram MJ, Vender JS, et al. Cerebral oxygen desaturation events assessed by near-infrared spectroscopy during shoulder arthroscopy in the beach chair and lateral decubitus positions. Anesth Analg. 2010 Aug;111(2):496–505. https://doi.org/10.1213/ANE.0b013e3181e33bd9 PMID:20508134
28. Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Shear TD, Vender JS, et al. Effect of ventilation on cerebral oxygenation in patients undergoing surgery in the beach chair position: a randomized controlled trial. Br J Anaesth. 2014 Oct;113(4):618–27. https://doi.org/10.1093/bja/aeu109 PMID:24860157
29. Tange K, Kinoshita H, Minonishi T, Hatakeyama N, Matsuda N, Yamazaki M, et al. Cerebral oxygenation in the beach chair position before and during general anesthesia. Minerva Anestesiol. 2010 Jul;76(7):485–90. PMID:20613688
30. Moerman AT, De Hert SG, Jacobs TF, De Wilde LF, Wouters PF. Cerebral oxygen desaturation during beach chair position. Eur J Anaesthesiol. 2012 Feb;29(2):82–7. https://doi.org/10.1097/EJA.0b013e328348ca18 PMID:21730865
31. Lee JH, Min KT, Chun YM, Kim EJ, Choi SH. Effects of beach-chair position and induced hypotension on cerebral oxygen saturation in patients undergoing arthroscopic shoulder surgery. Arthroscopy. 2011 Jul;27(7):889–94. https://doi.org/10.1016/j.arthro.2011.02.027 PMID:21620637
32. Laflam A, Joshi B, Brady K, Yenokyan G, Brown C, Everett A, et al. Shoulder surgery in the beach chair position is associated with diminished cerebral autoregulation but no differences in postoperative cognition or brain injury biomarker levels compared with supine positioning: the anesthesia patient safety foundation beach chair study. Anesth Analg. 2015 Jan;120(1):176–85. https://doi.org/10.1213/ANE.0000000000000455 PMID:25268397
33. Neal JM, Gerancher JC, Hebl JR, Ilfeld BM, McCartney CJ, Franco CD, et al. Upper extremity regional anesthesia: essentials of our current understanding, 2008. Reg Anesth Pain Med. 2009 Mar-Apr;34(2):134–70. https://doi.org/10.1097/AAP.0b013e31819624eb PMID:19282714
34. Salazar D, Sears BW, Aghdasi B, Only A, Francois A, Tonino P, et al. Cerebral desaturation events during shoulder arthroscopy in the beach chair position: patient risk factors and neurocognitive effects. J Shoulder Elbow Surg. 2013 Sep;22(9):1228–35. https://doi.org/10.1016/j.jse.2012.12.036 PMID:23415820
35. Koh JL, Levin SD, Chehab EL, Murphy GS. Neer Award 2012: cerebral oxygenation in the beach chair position: a prospective study on the effect of general anesthesia compared with regional anesthesia and sedation. J Shoulder Elbow Surg. 2013 Oct;22(10):1325–31. https://doi.org/10.1016/j.jse.2013.01.035 PMID:23571083
36. Yadeau JT, Liu SS, Bang H, Shaw PM, Wilfred SE, Shetty T, et al. Cerebral oximetry desaturation during shoulder surgery performed in a sitting position under regional anesthesia. Can J Anaesth. 2011 Nov;58(11):986–92. https://doi.org/10.1007/s12630-011-9574-7 PMID:21866430
37. Yadeau JT, Casciano M, Liu SS, Edmonds CR, Gordon M, Stanton J, et al. Stroke, regional anesthesia in the sitting position, and hypotension: a review of 4169 ambulatory surgery patients. Reg Anesth Pain Med. 2011 Sep-Oct;36(5):430–5. https://doi.org/10.1097/AAP.0b013e318228d54e PMID:21857267
38. Rohrbaugh M, Kentor ML, Orebaugh SL, Williams B. Outcomes of shoulder surgery in the sitting position with interscalene nerve block: a single-center series. Reg Anesth Pain Med. 2013 Jan-Feb;38(1):28–33. https://doi.org/10.1097/AAP.0b013e318277a2eb PMID:23222361
39. Jeong H, Jeong S, Lim HJ, Lee J, Yoo KY. Cerebral oxygen saturation measured by near-infrared spectroscopy and jugular venous bulb oxygen saturation during arthroscopic shoulder surgery in beach chair position under sevoflurane-nitrous oxide or propofol-remifentanil anesthesia. Anesthesiology. 2012 May;116(5):1047–56. https://doi.org/10.1097/ALN.0b013e31825154d2 PMID:22421420
40. Picton P, Dering A, Alexander A, Neff M, Miller BS, Shanks A, et al. Influence of Ventilation Strategies and Anesthetic Techniques on Regional Cerebral Oximetry in the Beach Chair Position: A Prospective Interventional Study with a Randomized Comparison of Two Anesthetics. Anesthesiology. 2015 Oct;123(4):765–74. https://doi.org/10.1097/ALN.0000000000000798 PMID:26244887

 ORCID
ORCID