Juan Carlos de la Cuadra-Fontaine MD. 1 , Ghislaine C. Echevarría MD. MS, 1 ,2 . Ximena P. Jara MD. 1 , Natalia L. de la Fuente MD. 1 , Valentina A. Puga MD. 1 , Pablo Miranda H. MD. 1
Recibido: 11-10-2019
Aceptado: 17-11-2019
©2020 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 49 Núm. 1 pp. 151-159|https://doi.org/10.25237/revchilanestv49n01.13
PDF|ePub|RIS
Effect of Intrathecal fentanyl on secondary hyperalgesia, in patients undergoing anterior cruciate ligament repair
Abstract
Background and Objectives: Fentanyl addition is a common practice when administering spinal anesthesia. Intrathecal fentanyl has been associated to increased postoperative pain and increase morphine consumption, but considered to be related to acute opioid tolerance. This prospective, randomized, blind study evaluates the effect of intrathecal fentanyl in the development of secondary hyperalgesia, measured with Von Frey filaments, in patients undergoing anterior cruciate ligament repair. Methods: 46 patients having anterior cruciate ligament repair, received intrathecal hyperbaric bupivacaine 13.5 mg with fentanyl 20 mcg or no fentanyl addition. Light touch pain threshold was measured with von Frey filaments before anesthesia, at 6 and 24 hours post anesthesia in the non-operated thigh and in the forearm. Visual analogue pain scores and morphine consumption were also measured at the same time. Results: Baseline thresholds to mechanical stimuli were similar in both groups. In the forearm, analysis showed a decreased threshold for the non-fentanyl group at 24 h p = 0.036. In the lower extremity, control and treatment group showed lower thresholds (secondary hyperalgesia) p = 0.002 but no difference between them p = 0.795. VAS score and morphine consumption did not differ among groups. Conclusions: Spinal fentanyl added to hyperbaric bupivacaine showed no evidence of an augmented state of hyperalgesia after ACL repair, neither by pain threshold modification nor clinical outcomes. On the contrary, at 24 h, fentanyl may have a protective effect at levels above the spinal block.
Resumen
Antecedentes y Objetivos: El uso de fentanilo es una práctica común en la administración de anestesia espinal. Su aplicación se ha asociado a un aumento del dolor post operatorio y a un aumento en el uso de morfina; por otro lado, se ha vinculado a una tolerancia aguda a opioides. El siguiente estudio prospectivo, randomizado y ciego, evalúa los efectos del fentanilo intratecal en la aparición de hiperalgesia secundaria, medida a través de filamentos Von Frey, en pacientes operados de ligamento cruzado anterior. Metodología: Se incluyeron a 46 pacientes operados de ligamento cruzado anterior (LCA) con una dosis intratecal de bupivacaína hiperbárica de 13,5 mg; con y sin la adición de fentanilo de 20 mcg. Se midió el umbral del dolor mecánico, a través de filamentos Von Frey, antes de la anestesia, a las 6 y 24 horas postanestesia en el muslo no operado y en el antebrazo. Al mismo tiempo, se midió la puntuación del dolor en la escala verbal numérica (EVN) y el consumo de morfina. Resultados: Los umbrales basales ante la estimulación mecánica resultaron similares en ambos grupos. En el antebrazo, el análisis mostró una disminución del umbral en el grupo de pacientes sin fentanilo, a las 24 h, p = 0,036 comparado con uso de fentanilo. En el muslo, el grupo control y tratamiento mostró umbrales más bajos (hiperalgesia secundaria) p = 0,002; no obstante, no se mostraron diferencias entre ellos. No se mostraron diferencias entre las puntuaciones de la EVN y el consumo de morfina en los dos grupos. Conclusión: No hay evidencia que la adición de fentanilo espinal, a la dosis de bupivacaína hiperbárica, haya contribuido a un aumento en la hiperalgesia tras la reparación del LCA, medido por la modificación del umbral del dolor, ni en los resultados clínicos. Al contrario a las 24 h fentanilo puede tener un efecto protector de la hiperalgesia secundaria sobre el nivel del bloqueo espinal.
-
Introducción
La adición de opioides a una solución de anestesia local, es de uso común cuando se administra anestesia espinal. Ha sido bien documentado el hecho de que la combinación de opioides espinal y anestésico local tiene un efecto analgésico sinérgico[1]-[4]. Una dosis alta de anestésico local intratecal puede producir un alto nivel de bloqueo motor y sensitivo, así como una hipotensión arterial[5]. En algunos procedimientos médicos[6], el uso de una dosis baja de anestésico local para la anestesia espinal demuestra ser poco confiable al otorgar una anestesia inadecuada. La adición de fentanilo resuelve este problema, dado que refuerza la anestesia y aumenta la duración del bloqueo sensitivo, al mismo tiempo que provee una anestesia adecuada para un procedimiento quirúrgico sin intensificar el bloqueo motor, ni prolongar la recuperación de la micción.
Se ha sugerido que, en los humanos, existe un efecto de hiperalgesia inducida por opioides (HIO). La HIO es ampliamente definida como un estado de sensibilización nociceptiva causada por la exposición a opioides, y se caracteriza por una respuesta paradójica en que los pacientes que reciben opioides para el tratamiento del dolor pueden tornarse incluso más sensibles al dolor[7]. Esto puede ocurrir tanto en el área donde se ha tratado el dolor, o bien puede ser una sensibilización al dolor más generalizada, que muchas veces presenta características de dolor neuropático, como hiperalgesia o alodinia[8]. Estudios en animales han demostrado esta asociación[9]. Sin embargo, los estudios en humanos voluntarios, que implican la administración a corto plazo de opioides, son los únicos que actualmente proveen evidencia directa de la existencia de HIO al aplicar pruebas de hiperalgesia secundaria y de dolor por estimulación en frío[10].
Existen estudios en pacientes quirúrgicos que reportan un aumento de dolor postoperatorio a pesar de haber recibido una dosis alta de opioide durante la operación y un aumento en el consumo de opioides tras la operación[11],[12]. Un estudio en mujeres operadas de cesárea y que recibieron anestesia espinal, reporta un aumento en el consumo de opioides postoperatorios, cuando éstas recibieron previamente una solución de opioide intratecal en vez de recibir una solución salina “placebo” antes de la operación[13]. Otro estudio sugiere que el uso de fentanilo intratecal para la anestesia espinal, en una cirugía de cesárea, puede inducir una tolerancia aguda a la morfina intratecal[14]. Sin embargo, dado que en dicho estudio no se registraron las diferencias en requerimientos postoperatorios de analgésicos, y, sumado a eso, la diferencia en las puntuaciones de dolor fue baja, la relevancia clínica de este estudio es incierto. En contraste, en otros estudios no se ha logrado encontrar un aumento del dolor o un consumo exagerado de opioides en pacientes que reciben una alta dosis sistémica de opioides comparado con una dosis baja durante la operación[15].
El objetivo de este estudio es evaluar el efecto del fentanilo intratecal en el desarrollo de hiperalgesia secundaria, medida a través de filamentos Von Frey, en pacientes operados de ligamento cruzado anterior (LCA)
-
Metodología
Tras obtener la aprobación del comité de ética institucional (Escuela de Medicina, Pontificia Universidad Católica de Chile) y la firma de un consentimiento informado por escrito, se estudió prospectivamente a 46 pacientes, ASA I – III, edades 18 – 65 años, con ruptura crónica (mayor de un mes) del ligamento cruzado anterior (LCA). Los pacientes estaban programados para una operación de LCA bajo anestesia espinal, tomando injerto del semitendinoso – gracillis.
Los criterios de exclusión incluyeron a pacientes con historial de uso crónico de opioides, dolor crónico certificado y manejado por especialistas, alergia a las drogas usadas en el estudio, obesidad (IMC > 30), uso de cualquier droga que actúa en el sistema nervioso central, retraso mental, previo conocimiento de enfermedad psiquiátrica y pacientes con aloinjerto o injerto de tendón patelar.
Previo a la llegada a pabellón, los pacientes fueron asignados de forma aleatoria, usando una tabla de números generados por computador, para recibir uno de los dos tratamientos durante el período intraoperatorio. El grupo control recibió 13,5 mg de bupivacaína hiperbárica intratecal de 0,75% (Hospira Inc. IL, USA); mientras que el grupo estudio (grupo fentanilo) recibió 13,5mg de bupivacaína hiperbárica de 0,75%, más 20 mcg de fentanilo (Hospira Inc. IL, USA). Previo a la administración de la anestesia se midió el umbral del dolor por estímulo mecánico en la superficie medial de la cara volar del antebrazo y 15 cm proximal al borde superior de la rótula en la extremidad inferior no operada. Para este propósito, se usaron sets de 20 monofilamentos Von Frey (VFMs) portátiles (Touch-Test® Sensory Evaluator, North Coast Medical Inc. CA, USA), calibrados para ejercer una fuerza creciente sobre la piel, desde 4 g (39.216 mN), hasta 300 g (2941.176 mN). Con los ojos de los pacientes cerrados, se administran VFMs en un ángulo de 90º contra la superficie de la piel, hasta que el filamento se flexiona, y se sostiene en el lugar durante 1,5 s. Se tomó un intervalo de 10 s entre cada prueba. El umbral del dolor, medido de forma mecánica, se definió como la menor fuerza percibida como dolorosa por el paciente. En todos los pacientes la vía venosa periférica fue instalada en el brazo contralateral al que se realiza la medición.
En pabellón se realizó una monitorización estándar (presión arterial no invasiva, ECG y oxímetro de pulso) y se instaló una vía venosa periférica, seguido de la administración de midazolam 2-3 mg i.v. Se administró oxígeno complementario vía máscara facial. Seguido de esto, el paciente fue ubicado en posición decúbito lateral con el lado a operar abajo, para recibir la anestesia espinal. La anestesia se administró con una aguja punta lápiz de 25G (Pecan B. Braun) en el espacio intervertebral ± L3-L4. Un anestesiólogo presente, no involucrado en el estudio, preparó la jeringa de acuerdo a la randomización. Todos los pacientes se mantuvieron en decúbito lateral por 5 minutos antes de volver a la posición supina. Ante la presencia de hipotensión (definida como una baja de un 20% respecto a la medida basal) se administró 250 mL de Ringer lactato, además de una dosis i.v. en bolo de efedrina de 4 mg (máximo 40 mg). La bradicardia (frecuencia cardíaca < 60) se trató con atropina i.v. de 0,3 mg cada 5 minutos hasta la recuperación (máximo 1 mg). La altura del bloqueo espinal se midió a través de estimulación con alfiler 30 minutos después de la administración de la anestesia espinal.
Tras la cirugía, todos los pacientes fueron llevados a la Unidad de Recuperación Post-Anestésica (URPA). El dolor dinámico y estático se midió usando la escala verbal numérica (EVN: 0 = sin dolor; 10 = dolor insoportable). Una enfermera, ciega a la asignación de grupos de los pacientes, evaluó las escalas de dolor al llegar a la URPA. La dosis de morfina intravenosa se ajustó en incrementos de 3mg cada 5 minutos hasta que las medidas de dolor dinámico y estático fueran menores a 5 y 4, respectivamente, o hasta alcanzar un máximo de 9 mg de morfina utilizada. En caso de que aquello ocurriera, se inicia una bomba para analgesia controlada por el paciente (ACP); en caso contrario, la bomba se instala cuando el paciente es dado de alta de la URPA. La bomba de ACP se configuró de la siguiente manera: sin infusión, bolo 1 mg de morfina por demanda, con un intervalo de 8 min. A todos los pacientes se les desconectó la bomba ACP 24 horas tras el término de la operación. La analgesia postoperatoria fue complementada, durante 24 horas, por una solución intravenosa de 90 mg de ketorolaco y paracetamol de 500 mg vía oral cada 6 horas.
El umbral del dolor se midió de forma mecánica a las 6 y 24 horas tras la administración de anestesia intratecal, en las mismas áreas y siguiendo los mismos procedimientos descritos anteriormente. Para evitar variaciones entre evaluadores, todas las medidas de dolor fueron tomadas únicamente por dos investigadores, previamente entrenados para medir el umbral del dolor con filamentos Von Frey. Así mismo, se tomaron las medidas del dolor estático y dinámico, consumo de morfina, presencia de náuseas, vómito, prurito, retención urinaria y frecuencia respiratoria. Ante la aparición de nauseas o vómitos, se administró ondansetrón i.v. de 4 mg (máximo 4 mg cada 8 horas); ante la aparición de prurito se administró clorfenamina de 5 mg (máximo 10 mg cada 12 horas); ante la aparición de retención urinaria, se llevó a cabo una cateterización urinaria para vaciar la vejiga. En caso de presentar sedación profunda (Escala de Sedación-Agitación – ESA) y/o frecuencia respiratoria < 10, se trató a los pacientes con naloxona intravenosa de 0,04 mg cada 5 minutos (hasta un máximo de 0,12 mg).
Tanto los pacientes como los investigadores que participaron en la evaluación postoperatoria, permanecieron ciegos a la asignación de los grupos durante todo el período de estudio.
-
Análisis estadístico
Basado en los hallazgos de Echeverría y colaboradores[16], se necesitó una muestra de 21 pacientes por grupo para detectar una diferencia mínima de un 20% en los umbrales del dolor postoperatorio entre ambos grupos, con una potencia de un 80% y un nivel a de 0,05. Dado que los filamentos Von Frey siguen una distribución log-normal[17] todos los cálculos y análisis estadísticos se desarrollaron después de la transformación logarítmica de los datos. Se reclutaron 23 pacientes por grupo, tomando en cuenta posibles deserciones.
Se testeó la normalidad usando el test de Shapiro-Wilk y un (Q-Q plots) gráfico de cuartiles. Se compararon los datos demográficos y los datos intraoperatorios continuos usando la prueba t de Student para datos no pareados o la prueba de la suma de rangos de Wilcoxon, según corresponda. Se usó el test de Pearson Chi-cuadrado y el test exacto de Fischer para inferencias de proporciones. Para comparar las medidas Von Frey (ajustadas al valor base), el consumo de morfina postoperatoria acumulada y la escala visual analógica en el tiempo, se utilizó un análisis de varianza para calcular las medidas repetidas con SAS Proc Mixed.
Los datos están expresados como media (Dosis Única) o como la media más análisis de re-muestreo con un intervalo de confianza del 95% (95% bCI, basado en 2.000 réplicas con reemplazo y ajuste de Bias (BCa)), a menos que haya sido indicado lo contrario. Se consideró como significativo, el valor p bilateral menor a 0,05. Los análisis se realizaron usando SAS 9.2 (SAS Institute Inc., Cary, NC, USA).
-
Resultados
Se reclutaron a un total de 46 pacientes en este estudio. Todos recibieron la intervención asignado a ellos. Se excluyó a dos pacientes del análisis: el primero, producto de un cambio en la técnica quirúrgica (cirugía del tendón rotuliano); y el segundo, producto de una falla en la bomba de ACP.
Figura 1. Ambos grupos muestran similitudes en cuanto a las características de los pacientes y los datos intraoperatorios (Tabla 1).
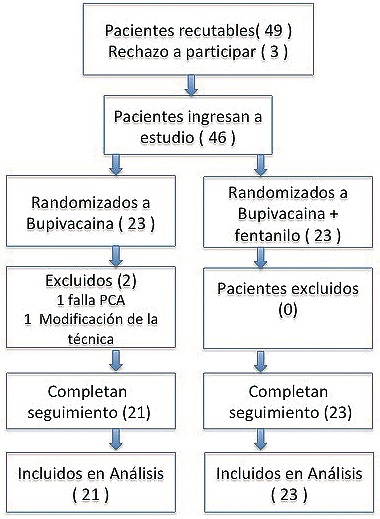
Figura 1.
| Tabla 1. Datos demográficos | ||||||
| Sexo
(masculino/ femenino) |
Edad
(prom ± ds) |
Peso (Kg)
(prom ± ds) |
ASA
(I/II) |
Espinal
Talla (Med, IQR) |
Cirugía tiempo
(min) (prom ± ds) |
|
|
Fentanilo |
20/3 | 29,3 ± 7,4 | 73,7 ± 10,1 | 20/3 | T5, T4-T8 | 125 ± 29 |
|
Control |
18/3 | 29,6 ± 9,4 | 78,3 ± 12,2 | 18/3 | T5 , T4-T8 | 137 ± 25 |
|
p |
NS | NS | NS | NS | NS | NS |
El umbral base del dolor, medido por estimulación mecánica fue similar en ambos grupos. En la extremidad inferior, los valores de la media fueron 169,4 g (95% bCI: 123,5, 208,4) para el grupo fentanilo; 184,4 g (95% bCI: 129,4, 227,7) para el grupo control, (valor de p = 0,560); y 165,4 g (95% bCI: 131, 212,7) y 193,2 g (95% bCI: 119,1, 212,2) en el antebrazo para el grupo fentanilo y para el grupo control respectivamente (valor de p = 0,510).
En la Figura 2 están representados los valores de la estimulación mecánica del dolor por tiempo, tanto en el antebrazo como en la extremidad baja.
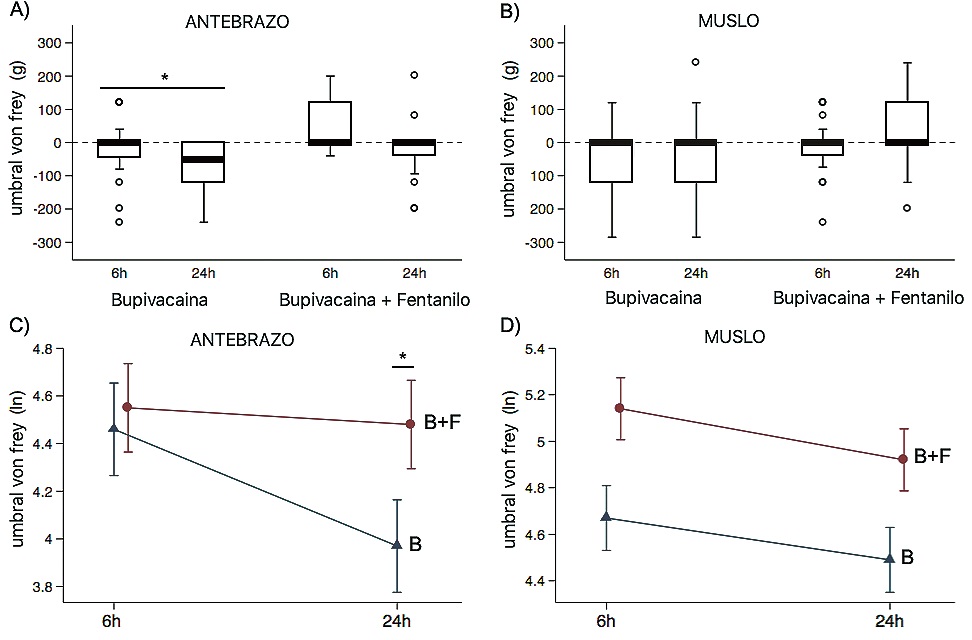
Figura 2.
– Antebrazo (panel A y C), análisis ajustado a valores de referencia. Basado en el análisis, la interacción grupo en función del tiempo fue estadísticamente significativa (valor p = 0,036), indicando que el efecto del Grupo fentanilo versus control no fue la misma en todas las medidas de Tiempo (medida de repetición). El análisis post hoc mostró que durante las primeras 6 horas postoperatorias, la diferencia no fue significativa, pero se tornó estadísticamente significativa a las 24 horas después de la operación.
– Extremidad Baja (Panel a la derecha B y D), análisis ajustado a valores de referencia. Basado en el análisis, la interacción grupo en función del tiempo no fue estadísticamente significativa (Valor p = 0,795). Dentro del efecto principal, el tiempo probó ser estadísticamente significativo (Valor p = 0,002), lo que sugiere que ambos grupos presentaron hiperalgesia, pero la magnitud del cambio (variación de la inclinación), no fue diferente entre ambos grupos.
No se presentaron diferencias en el consumo de morfina entre las 6 y 24 horas postoperatorias. Los grados de intensidad del dolor estática y mecánica fueron similares en ambos grupos, a las 6 y 24 horas postoperatorias (Tabla 2). Más pacientes en el grupo fentanilo presentaron prurito p = 0,055, pero no se presentaron diferencias entre nausea y vómito, retensión urinaria y frecuencia respiratoria.
| Tabla 2. Dolor y consumo de morfina | ||||
| 6 (h) | 24 (h) | p | ||
|
Dolor en Reposo (EVN 0- 10) |
Fentanilo mediana (p 25-p75) |
2 (1-4) | 2 (1-3) | NS |
|
Control Mediana (p 25-p75) |
2 (0-4) | 3 (1,4-25) | ||
|
Dolor dinámico (EVN 0- 10) |
Fentanilo Mediana (p 25-p75) |
4 (1-5,75) | 4 (3-5,75) | NS |
|
Control Mediana (p 25-p75) |
3 (0,75-6) | 5 (3,75-6,25) | ||
|
Consumo de morfina (mg) |
Fentanilo Promedio (p 25-p75) |
2,4 (0-4,75) | 13,2 (4,2-21,8) | NS |
|
Control Promedio (p 25-p75) |
1,5 (0-2,5) | 12,9 (4,25-23) | ||
-
Discusión
El resultado principal de este estudio es que, tras la reparación del LCA, existe un fenómeno normal de hiperalgesia generalizada. La adición de fentanilo a una solución de bupivacaína hiperbárica no mostró evidencia de un aumento de la hiperalgesia comparado con una solución de bupivacaína hiperbárica sola. Es más, en un área de la piel, por sobre el nivel máximo de anestesia espinal, se encontró evidencia de protección de hiperalgesia postoperatoria en pacientes que recibieron fentanilo espinal. Los cambios fisiológicos no se reflejaron en diferencias clínicas del umbral del dolor ni del consumo postoperatorio de opioides entre ambos grupos.
Este resultado difiere enormemente de dos estudios anteriores. Cooper et al [13], demostró que la adición de fentanilo a la anestesia espinal para cirugía de cesárea resultó en un mayor consumo de morfina a las 24 horas postoperatorias. Carvalho[14], encontró un aumento significativo del dolor postoperatorio, al aumentar las dosis de fentanilo. En ambos estudios, se hipotetizó que el mecanismo subyacente era una aguda resistencia a los opioides, inducida por fentanilo.
En la práctica clínica es muy difícil, sino imposible, determinar si las diferencias en intensidad del dolor o el uso anestésico de opioides postoperatorios se deben a una tolerancia aguda o a un efecto pro-algésico.
La tolerancia aguda se relaciona con un desplazamiento a la derecha en la sensibilidad del receptor a una droga, esto significa, que se necesitan dosis más grandes de la droga para producir cierta respuesta en el receptor. La hiperalgesia, por otro lado, ocurre cuando hay un giro hacia la izquierda en la intensidad de respuesta al dolor; lo que implica que se necesita un estímulo menor para producir la misma intensidad de dolor percibida por el paciente. Una prueba cuantitativa de la sensibilidad (PCS) del dolor antes y después del inicio de la terapia puede dilucidar este dilema[7],[18],[19a].
La prueba cuantitativa de la sensibilidad incluye varios métodos, por los cuales, con el uso de dispositivos controlados, se pueden medir los umbrales de la precepción sensitiva[19a],[19]. El filamento Von Frey, es un dispositivo PCS, que permite determinar un toque ligero estático. Cuando la punta de la fibra se presiona contra la piel en un ángulo recto, la fuerza de la aplicación aumenta en la medida de que el investigador continúa avanzando con la fibra hasta que se doble. No se produce más fuerza una vez que se dobla el filamento. Esto permite al investigador reproducir la misma fuerza con una sonda portátil. El set de filamentos Von Frey, otorga una escala logarítmica de la fuerza real aplicada. La detección del umbral del dolor de forma mecánica se realiza aumentando la intensidad del estímulo aplicado sobre la piel, hasta que el sujeto perciba la presión como dolorosa. Los filamentos Von Frey se han utilizado en estudios clínicos anteriores por estas mismas razones. Optamos por usar un dispositivo PCS como método objetivo para distinguir un mecanismo subyacente en caso de presentarse diferencias en los umbrales del dolor y uso de opiáceos entre los grupos. A pesar de que ambos grupos presentaron similitudes en las puntuaciones del dolor y el consumo acumulado de morfina, contrario a lo que se pensaba, el uso de fentanilo disminuyó la respuesta hiperalgésica en el grupo control, cuando se midió en el antebrazo.
Nuestro estudio se diferencia de los estudios de Coorper y Carvalho en muchos aspectos. La principal diferencia dice relación con los resultados inesperados relativos a la cantidad de opioide neuroaxial.
Hay evidencia que el opioide intratecal puede aumentar la analgesia desde una dosis subterapéutica de anestésico local[2],[6],[20]. La dosis mínima efectiva de fentanilo intratecal (aprox. 12,5 µg[5]), que, en combinación con una dosis baja de bupivacaína intratecal (5 mg), proveería las condiciones quirúrgicas adecuadas, con estabilidad hemodinámica y sin prolongar la recuperación. En general las dosis de fentanilo que han sido testeadas, varían entre 10 µg y 50 µg, y las dosis de bupivacaína, varían entre 5 mg a 20 mg[4]. Sin embargo, no hay variación en la duración de la analgesia entre las dosis de 10 µg y 40 µg de fentanilo[21].
En este estudio, se utilizó 20 mcg de fentanilo intratecal, dado que es nuestra práctica clínica habitual. Cooper utilizó 20 mcg de fentanilo intratecal, seguido a la brevedad de 50 mcg de fentanilo epidural. Carvalho utilizó dosis en aumento de fentanilo intratecal, sumado a una dosis fija de 200 mcg de morfina intratecal, mostrando un aumento significativo del dolor al aumentar la dosis de fentanilo. Los estudios que utilizan opioides endovenosos intraoperatorios han demostrado la relación entre el uso de altas dosis y la hiperalgesia postoperatoria. También el pacientes en uso oral crónico, la dosis más altas se asocian a alteración de umbrales sensitivos e HIO[22]. Por lo tanto, a pesar de que en este estudio se utilizó una dosis de fentanilo más alta de lo necesario, Cooper y Carvalho, agregaron a su dosis espinal, una dosis extra de fentanilo epidural o morfina intratecal; y, de acuerdo a la evidencia presente, esto último facilitaría la respuesta hiperalgésica. El caso clínico de Kalaydjian y col[23] es la única que conocemos de hiperalgesia intratecal por fentanilo y también está asociado a incremento de dosis sobre las habituales.
Otras diferencias evidentes son el tipo de cirugía y el género. En este caso, se estudió a un grupo de pacientes quirúrgicos ortopédicos, de los cuales el 86% eran hombres. Se podría sugerir, a partir de estos estudios, que los pacientes obstétricos y las mujeres pueden ser más susceptibles a la hiperalgesia. Un estudio sobre las diferencias de sexo y la analgesia o hiperalgesia causada por opioides, muestra que, en datos de estudios en animales, la hiperalgesia inducida por opioides, es mayor en roedores femeninos[24].
En nuestro estudio utilizamos ketorolaco intravenoso durante el período postoperatorio. Cooper utilizó una dosis rectal de diclofenaco, mientras de Carvalho no usó otro analgésico, más que morfina. Los inhibidores COX han demostrado atenuar la hiperalgesia en modelos animales[7]; sin embargo, el ketorolaco produjo un umbral del dolor más bajo luego de 5 días tras una cirugía de espalda[25].
Las dosis de bupivacaína espinal utilizadas en los estudios mencionados, son distintas entre sí. Cooper, que demostró un efecto hiperalgésico mayor, utilizó 10 mg; Carvalho, utilizó 12 mg; y en el presente estudio utilizamos 13,5 mg. Es posible que la bupivacaína influya, de forma protectora, sobre el efecto hiperagésico del fentanilo intratecal. En nuestros resultados, se mostró una mayor disminución en el umbral del dolor ante estimulación mecánica, en la pierna (nivel espinal) que en el antebrazo (sobre el nivel espinal).
En resumen, en una cirugía de reparación del ligamento cruzado, una dosis de 20 mcg de fentanilo agregados a una solución de bupivacaína hiperbárica no produjo un aumento de la hiperalgesia postoperatoria en comparación con el uso de bupivacaína sola. Esto puede estar relacionado principalmente a la dosis total de opioide neuraxial utilizado durante el período operatorio. Otros factores que pueden influir este resultado, comparado con trabajos con otras publicaciones son el género, el tipo de cirugía, y la dosis utilizada de ketorolaco o bupivacaína. Será necesario realizar futuros estudios que modifiquen estos factores.
Referencias
1. Tejwani GA, Rattan AK, McDonald JS. Role of spinal opioid receptors in the antinociceptive interactions between intrathecal morphine and bupivacaine. Anesth Analg. 1992 May;74(5):726–34. https://doi.org/10.1213/00000539-199205000-00018 PMID:1314527
2. Wang C, Chakrabarti MK, Whitwam JG. Specific enhancement by fentanyl of the effects of intrathecal bupivacaine on nociceptive afferent but not on sympathetic efferent pathways in dogs. Anesthesiology. 1993 Oct;79(4):766–73. https://doi.org/10.1097/00000542-199310000-00019 PMID:8214756
3. Akerman B, Arweström E, Post C. Local anesthetics potentiate spinal morphine antinociception. Anesth Analg. 1988 Oct;67(10):943–8. PMID:3421498
4. Pöpping DM, Elia N, Marret E, Wenk M, Tramèr MR. Opioids added to local anesthetics for single-shot intrathecal anesthesia in patients undergoing minor surgery: a meta-analysis of randomized trials. Pain. 2012 Apr;153(4):784–93. https://doi.org/10.1016/j.pain.2011.11.028 PMID:22230804
5. Goel S, Bhardwaj N, Grover VK. Intrathecal fentanyl added to intrathecal bupivacaine for day case surgery: a randomized study. Eur J Anaesthesiol. 2003 Apr;20(4):294–7. https://doi.org/10.1097/00003643-200304000-00004 PMID:12703834
6. Ben-David B, Solomon E, Levin H, Admoni H, Goldik Z. Intrathecal fentanyl with small-dose dilute bupivacaine: better anesthesia without prolonging recovery. Anesth Analg. 1997 Sep;85(3):560–5. https://doi.org/10.1213/00000539-199709000-00014 PMID:9296409
7. Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008 Jul-Aug;24(6):479–96. https://doi.org/10.1097/AJP.0b013e31816b2f43 PMID:18574358
8. Colvin LA, Fallon MT. Opioid-induced hyperalgesia: a clinical challenge. Br J Anaesth. 2010 Feb;104(2):125–7. https://doi.org/10.1093/bja/aep392 PMID:20086062
9. Célèrier E, Rivat C, Jun Y, Laulin JP, Larcher A, Reynier P, et al. Long-lasting hyperalgesia induced by fentanyl in rats: preventive effect of ketamine. Anesthesiology. 2000 Feb;92(2):465–72. https://doi.org/10.1097/00000542-200002000-00029 PMID:10691234
10. Fishbain DA, Cole B, Lewis JE, Gao J, Rosomoff RS. Do opioids induce hyperalgesia in humans? An evidence-based structured review. Pain Med. 2009 Jul-Aug;10(5):829–39. https://doi.org/10.1111/j.1526-4637.2009.00653.x PMID:19594845
11. Chia YY, Liu K, Wang JJ, Kuo MC, Ho ST. Intraoperative high dose fentanyl induces postoperative fentanyl tolerance. Can J Anaesth. 1999 Sep;46(9):872–7. https://doi.org/10.1007/BF03012978 PMID:10490157
12. Guignard B, Bossard AE, Coste C, Sessler DI, Lebrault C, Alfonsi P, et al. Acute opioid tolerance: intraoperative remifentanil increases postoperative pain and morphine requirement. Anesthesiology. 2000 Aug;93(2):409–17. https://doi.org/10.1097/00000542-200008000-00019 PMID:10910490
13. Cooper DW, Lindsay SL, Ryall DM, Kokri MS, Eldabe SS, Lear GA. Does intrathecal fentanyl produce acute cross-tolerance to i.v. morphine? Br J Anaesth. 1997 Mar;78(3):311–3. https://doi.org/10.1093/bja/78.3.311 PMID:9135312
14. Carvalho B, Drover DR, Ginosar Y, Cohen SE, Riley ET. Intrathecal fentanyl added to bupivacaine and morphine for cesarean delivery may induce a subtle acute opioid tolerance. Int J Obstet Anesth. 2012 Jan;21(1):29–34. https://doi.org/10.1016/j.ijoa.2011.09.002 PMID:22100823
15. Cortínez LI, Brandes V, Muñoz HR, Guerrero ME, Mur M. No clinical evidence of acute opioid tolerance after remifentanil-based anaesthesia. Br J Anaesth. 2001 Dec;87(6):866–9. https://doi.org/10.1093/bja/87.6.866 PMID:11878688
16. Echevarría G, Elgueta F, Fierro C, Bugedo D, Faba G, Iñiguez-Cuadra R, et al. Nitrous oxide (N(2)O) reduces postoperative opioid-induced hyperalgesia after remifentanil-propofol anaesthesia in humans. Br J Anaesth. 2011 Dec;107(6):959–65. https://doi.org/10.1093/bja/aer323 PMID:21965050
17. Rolke R, Magerl W, Campbell KA, Schalber C, Caspari S, Birklein F, et al. Quantitative sensory testing: a comprehensive protocol for clinical trials. Eur J Pain. 2006 Jan;10(1):77–88. https://doi.org/10.1016/j.ejpain.2005.02.003 PMID:16291301
18. Angst MS, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006 Mar;104(3):570–87. https://doi.org/10.1097/00000542-200603000-00025 PMID:16508405
19. Mao J. Clinical Diagnosis of Opioid-Induced Hyperalgesia. Reg Anesth Pain Med. 2015 Nov-Dec;40(6):663–4. https://doi.org/10.1097/AAP.0000000000000317 PMID:26488079
20. Hansson P, Backonja M, Bouhassira D. Usefulness and limitations of quantitative sensory testing: clinical and research application in neuropathic pain states. Pain. 2007 Jun;129(3):256–9. https://doi.org/10.1016/j.pain.2007.03.030 PMID:17451879
21. Penning JP, Yaksh TL. Interaction of intrathecal morphine with bupivacaine and lidocaine in the rat. Anesthesiology. 1992 Dec;77(6):1186–2000. https://doi.org/10.1097/00000542-199212000-00021 PMID:1466469
22. Seewal R, Shende D, Kashyap L, Mohan V. Effect of addition of various doses of fentanyl intrathecally to 0.5% hyperbaric bupivacaine on perioperative analgesia and subarachnoid-block characteristics in lower abdominal surgery: a dose-response study. Reg Anesth Pain Med. 2007 Jan-Feb;32(1):20–6. https://doi.org/10.1016/j.rapm.2006.09.007 PMID:17196488
23. Wasserman RA, Hassett AL, Harte SE, Goesling J, Malinoff HL, Berland DW, et al. Pressure Pain Sensitivity in Patients With Suspected Opioid-Induced Hyperalgesia. Reg Anesth Pain Med. 2015 Nov-Dec;40(6):687–93. https://doi.org/10.1097/AAP.0000000000000315 PMID:26469365
24. Kalaydjian A, Farah F, Cheng Y, Acquadro MA, Gerges FJ. Opioid Induced Hyperalgesia with Intrathecal Infusion of High-Dose Fentanyl. Pain Pract. 2019 Feb;19(2):222–3. https://doi.org/10.1111/papr.12726 PMID:30267637
25. Bodnar RJ, Kest B. Sex differences in opioid analgesia, hyperalgesia, tolerance and withdrawal: central mechanisms of action and roles of gonadal hormones. Horm Behav. 2010 Jun;58(1):72–81. https://doi.org/10.1016/j.yhbeh.2009.09.012 PMID:19786031
26. Wilder-Smith OH, Tassonyi E, Crul BJ, Arendt-Nielsen L. Quantitative sensory testing and human surgery: effects of analgesic management on postoperative neuroplasticity. Anesthesiology. 2003 May;98(5):1214–22. https://doi.org/10.1097/00000542-200305000-00025 PMID:12717144

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution