Alberto Fernández Delgado 2 , Roberto Palomino Romero 1 , David Valdelamar Rosenstand 2
Recibido: 21-02-2019
Aceptado: 12-08-2019
©2020 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 49 Núm. 2 pp. 284-288|https://doi.org/10.25237/revchilanestv49n02.15
PDF|ePub|RIS
Negative pressure acute pulmonary edema secondary to endotracheal tube obstruction
Abstract
Acute negative pressure pulmonary edema (EPPN) is a life-threatening clinical entity that requires immediate recognition and management by the anesthesiologist, avoiding potential complications during perioperative care. We present the case of a 19-year-old male patient who goes to the emergency department with a penetrating neck wound, which is why he is taken to emergency surgery. During anesthetic awakening there is obstruction of the endotracheal tube, presenting in the immediate postoperative period signs of respiratory distress and pink foamy sputum compatible with EPPN.
Resumen
El edema pulmonar agudo por presión negativa (EPPN), es una entidad clínica potencialmente mortal que requiere reconocimiento y manejo inmediato por parte del anestesiólogo, evitando potenciales complicaciones durante el cuidado perioperatorio. Presentamos el caso de un paciente masculino de 19 años de edad quien acude al servicio de urgencias con herida penetrante en cuello, razón por la cual es llevado a cirugía de emergencia. Durante el despertar anestésico se produce obstrucción del tubo endotraqueal, presentando en el postoperatorio inmediato signos de dificultad respiratoria y esputo espumoso rosado compatible con EPPN.
-
Introducción
El edema pulmonar agudo por presión negativa (EPPN), también llamado edema pulmonar postobstructivo, es una entidad de gran importancia para el anestesiólogo. En la práctica anestésica se ha reportado una incidencia de 0,05-0,1%, probablemente con mayor número de casos en la práctica diaria relacionados con la intubación endotraqueal y con laringoespamo, los cuales en su mayoría no son documentados[1 ]. El mecanismo propuesto plantea un incremento de la presión intrapleural y alveolar negativa durante el esfuerzo inspiratorio espontáneo en oposición a una vía aérea obstruida, con consecuente edema pulmonar y hemorragia alveolar.
El EPPN puede presentarse de manera inmediata o tardía, requiriendo el reconocimiento y manejo oportuno por parte del personal involucrado en el cuidado perioperatorio de los pacientes para evitar las potenciales complicaciones relacionadas[2 ]. Este evento inesperado durante el acto anestésico puede comprometer los desenlaces de pacientes sanos llevados a procedimientos quirúrgicos relativamente simples, lo que puede prolongar la estancia hospitalaria, la necesidad de ventilación mecánica y vigilancia en una Unidad de Cuidados Intensivos (UCI) con riesgo para la vida del paciente. El EPPN debe tenerse en cuenta al momento de evaluar pacientes con distress respiratorio agudo postoperatorio[3 ].
-
Presentación del caso
Paciente masculino de 19 años de edad sin antecedentes médicos o quirúrgicos de importancia, quien acude a urgencias por herida penetrante causada por objeto cortopunzante en zona II izquierda del cuello, con presencia de hematoma no expansivo. Posteriormente, presenta disfonía, por lo cual es llevado a cirugía para cervicotomía y exploración quirúrgica de urgencia. Al ingreso a quirófano, encontramos un adulto joven en buen estado general sin compromiso del estado de conciencia; se realiza monitoria anestésica básica, registrando TA: 105/72 mmHg, FC: 95 lpm FR: 16 rpm y SaO2: 99% al aire ambiente. Como técnica anestésica se realizó anestesia general balanceada previa inducción de secuencia rápida, con fentanilo 200 mcg, ketamina 140 mg, midazolam 2 mg y succinilcolina 100 mg vía endovenosa.
En la laringoscopia se evidencia un Cormack-Lehane grado 1, apertura glótica sin anomalías. Se realiza intubación con tubo endotraqueal (TET) número 7.5, presión controlada del balón neumotaponador, fijación del TET a 21 cm de la comisura oral derecha, sin presencia de trauma durante el procedimiento. La auscultación demostró una ventilación simétrica en ambos campos pulmonares, en ausencia de ruidos agregados. La onda de capnografía posterior a la intubación fue regular durante sus tres fases, demostrando valores adecuados. Se inicia ventilación mecánica en modo controlado por volumen, con un volumen corriente de 425 ml y frecuencia respiratoria de 12, además, se aplicó presión positiva al final de la espiración de 5 cm de H2O.
El mantenimiento anestésico se realizó mediante la administración de sevoflurano a una concentración alveolar mínima (MAC) de 0,5; se administró remifentanilo en infusión endovenosa titulada, iniciando a 0,25 mcg/kg/min. Durante el procedimiento quirúrgico mantuvo estabilidad hemodinámica, con manejo adecuado de las presiones de la vía aérea y acople a ventilación mecánica.
Entre los hallazgos quirúrgicos presentó laceración de la arteria carótida común izquierda de 1 cm, sin otras lesiones vasculares ni nerviosas. Se realizó rafia de la lesión vascular sin complicaciones con una pérdida sanguínea aproximada de 500 ml durante el intraoperatorio. Balance de fluidos positivo de 200 ml. El tiempo quirúrgico fue de 165 minutos.
Se aspiran secreciones y se inicia despertar anestésico. Al momento de recuperar conciencia y ventilación espontánea, el paciente se torna agitado y combativo, mordiendo el TET durante aproximadamente 35 segundos, realizando esfuerzos inspiratorios importantes. Posteriormente, se realizó extubación, con disminución de la agitación y sin deterioro del patrón respiratorio alcanzando un estado de recuperación postanestésica según la escala de Aldrete de 9/10, trasladándose a la Unidad de Cuidados Postanestésicos (UCPA) bajo monitoria continua y control de signos vitales. A los 12 minutos de encontrarse en recuperación, el paciente presenta dificultad respiratoria marcada de forma súbita, taquipnea, cianosis, disminución de la saturación arterial periférica de oxígeno (85%), taquicardia (124 latidos/minuto), tos con presencia de esputo espumoso y rosado asociados a crépitos en ambos campos pulmonares.
El paciente fue colocado en posición semisentada y se administró oxígeno a través de máscara facial de no reinhalación con un flujo de 12 l/min. A pesar de esto, el paciente no presentó mejoría clínica de la dificultad respiratoria, con posterior empeoramiento del patrón ventilatorio y malos índices de oxigenación, por lo cual se decidió realizar nueva inducción de secuencia rápida y reintubación; lo cual además permitía lograr permeabilidad de la vía aérea e instauración de ventilación mecánica con PEEP (presión positiva al final de la inspiración), el cual se ajustó a 6 cmH2O. Se obtuvo muestra para gasometría arterial la cual demostró pH: 7,29, PaO2: 184 mmHg, PaCO2: 55 mmHg, HCO3: 20 mEq/l, BE: -6 mmol/L, FiO2: 100%, PaFi: 184. Ante la sospecha de EPPN, se realiza radiografía de tórax con evidencia de infiltrado alveolar perihiliar bilateral y engrosamiento de líneas intersticiales con silueta cardiaca normal, lo cual confirmó la sospecha diagnóstica (Figura 1). Teniendo en cuenta esto, se decidió administrar diurético endovenoso tipo furosemida 20 mg y transferir a unidad de cuidados intensivos (UCI) para manejo y seguimiento.
En UCI se le suministró soporte ventilatorio mecánico con PEEP durante 6 horas, presentando estabilidad hemodinámica y mejoría del patrón ventilatorio. La gasometría arterial de control demostró pH: 7,38, PaO2: 210 mmHg, PaCO2: 37 mmHg, HCO3: 23 mEq/l, BE: -2 mmol/L, FiO2: 60%, PaFi: 350, saturación arterial de oxígeno: 98%. La radiografía de control a las 24 horas demostró reducción marcada de infiltrados alveolares en ambos campos pulmonares (Figura 2). Teniendo en cuenta la mejoría clínica e imagenológica, la presencia de índices oximétricos adecuados y prueba de respiración espontánea con presencia de patrón ventilatorio adecuados, se realiza extubación con buena tolerancia al destete ventilatorio. Al día siguiente se traslada a sala general para observación de patología quirúrgica, sin complicaciones respiratorias.
Basado en el contexto clínico y en la rápida recuperación del paciente, se estableció el diagnóstico de edema pulmonar agudo por presión negativa. El paciente fue dado de alta al quinto día postoperatorio sin secuelas.
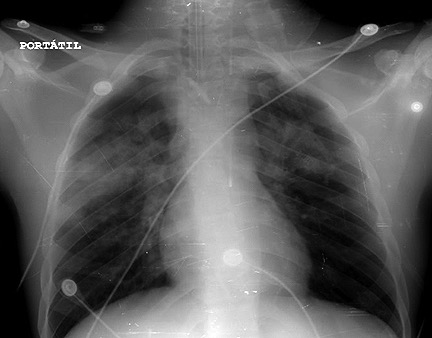
Figura 1. Radiografía anteroposterior de tórax con presencia de infiltrados perihiliares.
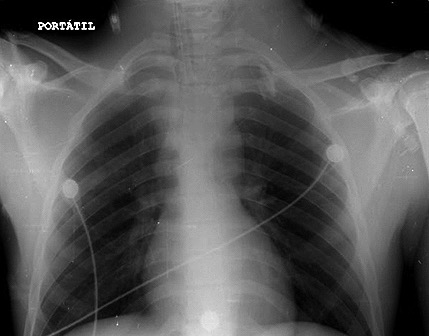
Figura 2. Control a las 24 horas con disminución marcada de los infiltrados.
-
Discusión
El EPPN es una entidad clínica infrecuente potencialmente grave con gran relevancia en anestesiología y cuidado intensivo. Es una forma de edema pulmonar no cardiogénico, el cual se da como resultado de altas presiones negativas intratorácicas en oposición a la obstrucción de la vía aérea superior[4 ]. Suele desarrollarse de manera rápida y en sujetos relativamente jóvenes y vigorosos, capaces de producir un gran esfuerzo inspiratorio. Los principales factores relacionados con EPPN son: sexo masculino, obesidad, SAOS, cirugía de vía respiratoria alta y cirugía de cabeza y cuello.
Dos subclases distintas de EPPN se han descrito en la literatura; el tipo I se relaciona con el esfuerzo inspiratorio frente a una obstrucción aguda de la vía aérea superior (laringoespasmo, epiglotitis, cuerpo extraño, obstrucción del tubo endotraqueal, parálisis postoperatoria de las cuerdas vocales), mientras el tipo II ocurre posterior a la liberación de la vía aérea críticamente obstruida de forma crónica (adenoidectomía, resección de tumor de vía aérea superior)[9]. El laringoespamo posterior al manejo anestésico es la causa más común en pacientes adultos; se cree que hasta un 50% de los casos de EPPN son debidos a la presencia de laringoespasmo durante el postoperatorio[10 ].
Existen al menos dos teorías que explican la patogénesis del EPPN: Desequilibrio hidrostático y estrés mecánico[5 ]. Al realizarse un esfuerzo inspiratorio aumentado por la presencia de una obstrucción en la vía aérea, se produce un aumento del retorno venoso desde las cavidades cardiacas derechas hacia las arterias pulmonares, se genera un incremento del volumen y de la presión capilar pulmonar, ocasionando rápidamente trasudación del contenido de los capilares pulmonares al intersticio, sobrepasando la capacidad del drenaje linfático que resulta incapaz de evitar el edema pulmonar. Se genera de esta forma una presión negativa intratorácica hasta de -50 a -100 cmH2O, siendo la presión durante la inspiración normal de -2 a -5 cmH2O[6 ].
La hipoxia del edema origina una lesión tisular pulmonar, la cual conlleva a liberación de endotelina-1 (ET-1), cofactor en la formación del edema, ocasionando un incremento en la filtración capilar. Además, se presenta disminución en la movilización de fluidos alveolares al inhibir el transporte activo de Na+ a través del epitelio alveolar lesionado, el cual se realiza en canales de Na+ apicales y en los canales basolaterales de Na+/K+ATPasa[7 ].
La presentación clínica de EPPN, puede ser variable, ya que no existe relación directa entre la severidad de los síntomas y el grado de obstrucción de la vía aérea. Habitualmente la presentación del cuadro clínico es súbita, caracterizada por intolerancia al decúbito, agitación, disnea, esfuerzo inspiratorio aumentado, tiraje intercostal y supraesternal, disociación toracoabdominal, hipoxemia, taquicardia y taquipnea. A la auscultación de campos pulmonares, existe la presencia de crepitantes bilaterales, además de la aparición de esputo espumoso y rosado[8 ]. Han sido reportados casos con presentaciones tardías de EPPN, los cuales han iniciado hasta 24 horas posteriores al evento desencadenante[12 ].
La radiografía de tórax es clave para el diagnóstico inicial y el seguimiento de los pacientes; los hallazgos radiológicos suelen estar presentes de forma temprana. Además, ayuda en la exclusión de otras causas de insuficiencia respiratoria aguda en el postoperatorio inmediato[15 ].
Para iniciar un manejo oportuno, es importante tener en cuenta las diferentes posibilidades de diagnóstico diferencial, las cuales, podrían presentarse inicialmente con signos y síntomas similares a los ya descritos. Entre estas entidades encontramos: Neumonitis aspirativa, embolismo pulmonar, anafilaxia, sobrecarga hídrica iatrogénica y edema pulmonar cardiogénico o neurogénico. Las entidades anteriormente mencionadas no son extrañas durante el perioperatorio, por lo cual no es infrecuente que exista confusión al inicio del cuadro clínico[1 ].
El tratamiento debe iniciarse de inmediato, siendo prioridad el alivio de la obstrucción de la vía aérea y la corrección de la hipoxemia, tal como lo fue en el caso clínico descrito. El tratamiento de soporte incluye la administración de oxígeno suplementario al 100% con presión positiva continua en la vía aérea (CPAP) o con PEEP; la adición de PEEP entre 5-10 cmH20 ha demostrado mejorar la oxigenación y la relación ventilación/perfusión, lo cual contribuye en gran manera a la rápida resolución del edema pulmonar[11].
El soporte ventilatorio no invasivo ha demostrado ser una alternativa eficaz a la intubación, previniendo o tratando una falla respiratoria aguda. Entre los objetivos del soporte ventilatorio no invasivo están incluidos la compensación de la función respiratoria afectada disminuyendo el trabajo respiratorio, optimizar el reclutamiento alveolar con mejoría del intercambio gaseoso y reducir la poscarga del ventrículo izquierdo optimizando el gasto cardiaco[9 ]. Sin embargo, a pesar de existir alternativas ventilatorias no invasivas, hasta un 34%-46% de los pacientes puede requerir ventilación mecánica controlada a través de intubación orotraqueal[14 ]. En el caso reportado, el manejo inicial requirió soporte ventilatorio invasivo ante la poca respuesta del distress respiratorio a la oxigenoterapia no invasiva con oxígeno al 100%.
El uso de diuréticos en el contexto de EPPN ha sido descrito, especialmente en aquellos pacientes que han recibido terapia hídrica agresiva durante el perioperatorio. El objetivo del manejo con diuréticos es lograr la disminución del volumen intravascular y favorecer la filtración intracapilar con la consecuente resolución del edema. Debe tenerse precaución en pacientes hipovolémicos por el riesgo de exacerbar hipoperfusión en el paciente quirúrgico. En revisiones de la literatura, se ha descrito la administración inicial de furosemida endovenosa 20 mg con óptimos resultados, lo cual se observó en el caso clínico expuesto[1 ].
El papel del anestesiólogo en la prevención del EPPN es clave, debido a que este debe reconocer los diferentes escenarios clínicos en los cuales puede ocurrir obstrucción de la vía área y de esta forma tomar las precauciones pertinentes. El plan de manejo anestésico debe incluir una adecuada profundidad anestésica durante la ventilación con máscara facial, así como asegurar que el paciente esté completamente despierto previo a la extubación; tener en consideración el manejo de la intubación mediante fibrobroncoscopia en aquellos pacientes con anormalidades en la vía aérea[13 ].
-
Conclusiones
El EPPN es una entidad con repercusión importante en la práctica anestésica. A pesar de contar con buen pronóstico y un manejo relativamente simple, representa un riesgo potencial con alta probabilidad de comprometer los desenlaces de los pacientes. El EPPN debe tenerse en cuenta al momento de evaluar pacientes con posibilidad de presentar obstrucción de la vía aérea superior, lo cual es el paso crucial para la prevención de esta entidad. La marcada disminución de la saturación de oxígeno, posterior a la extubación debe generar un alto índice de sospecha para EPPN, el cual debe estar presente para realizar un diagnóstico y tratamiento oportuno incidiendo significativamente en la morbimortalidad postoperatoria.
Referencias
1. Udeshi A, Cantie SM, Pierre E. Postobstructive pulmonary edema. J Crit Care. 2010 Sep;25(3):508.e1–5. https://doi.org/10.1016/j.jcrc.2009.12.014 PMID:20413250
2. Lang SA, Duncan PG, Shephard DA, Ha HC. Pulmonary oedema associated with airway obstruction. Can J Anaesth. 1990 Mar;37(2):210–8. https://doi.org/10.1007/BF03005472 PMID:2178789
3. Wanigasuriya R, Gunaratne A, Gunapala A. Negative pressure pulmonary edema may present as acute left ventricular failure: case report. Anaesth Pain Intensive Care. 2017;21(1)
4. Westreich R, Sampson I, Shaari CM, Lawson W. Negative-pressure pulmonary edema after routine septorhinoplasty: discussion of pathophysiology, treatment, and prevention. Arch Facial Plast Surg. 2006 Jan-Feb;8(1):8–15. https://doi.org/10.1001/archfaci.8.1.8 PMID:16415442
5. Fremont RD, Kallet RH, Matthay MA, Ware LB. Postobstructive pulmonary edema: a case for hydrostatic mechanisms. Chest. 2007 Jun;131(6):1742–6. https://doi.org/10.1378/chest.06-2934 PMID:17413051
6. Jacka MJ, Persaud SS. Negative-pressure pulmonary edema associated with saber-sheath trachea. Anesthesiology. 1999 Apr;90(4):1209–11. https://doi.org/10.1097/00000542-199904000-00038 PMID:10201696
7. Lemyze M, Mallat J. Understanding negative pressure pulmonary edema. Intensive Care Med. 2014 Aug;40(8):1140–3. https://doi.org/10.1007/s00134-014-3307-7 PMID:24797685
8. Deepika K, Kenaan CA, Barrocas AM, Fonseca JJ, Bikazi GB. Negative pressure pulmonary edema after acute upper airway obstruction. J Clin Anesth. 1997 Aug;9(5):403–8. https://doi.org/10.1016/S0952-8180(97)00070-6 PMID:9257208
9. Bhaskar B, Fraser JF. Negative pressure pulmonary edema revisited: pathophysiology and review of management. Saudi J Anaesth. 2011 Jul;5(3):308–13. https://doi.org/10.4103/1658-354X.84108 PMID:21957413
10. Goli AK, Goli SA, Byrd RP Jr, Roy TM. Spontaneous negative pressure changes: an unusual cause of noncardiogenic pulmonary edema. J Ky Med Assoc. 2003 Aug;101(8):317–20. PMID:14502951
11. Chuang YC, Wang CH, Lin YS. Negative pressure pulmonary edema: report of three cases and review of the literature. Eur Arch Otorhinolaryngol. 2007 Sep;264(9):1113–6. https://doi.org/10.1007/s00405-007-0379-9 PMID:17598119
12. McConkey PP. Postobstructive pulmonary oedema—a case series and review. Anaesth Intensive Care. 2000 Feb;28(1):72–6. https://doi.org/10.1177/0310057X0002800114 PMID:10701042
13. Lathan SR, Silverman ME, Thomas BL, Waters WC 4th. Postoperative pulmonary edema. South Med J. 1999 Mar;92(3):313–5. https://doi.org/10.1097/00007611-199903000-00011 PMID:10094274
14. Antonelli M, Conti G, Moro ML, Esquinas A, Gonzalez-Diaz G, Confalonieri M, et al. Predictors of failure of noninvasive positive pressure ventilation in patients with acute hypoxemic respiratory failure: a multi-center study. Intensive Care Med. 2001 Nov;27(11):1718–28. https://doi.org/10.1007/s00134-001-1114-4 PMID:11810114
15. Broccard AF, Liaudet L, Aubert JD, Schnyder P, Schaller MD. Negative pressure post-tracheal extubation alveolar hemorrhage. Anesth Analg. 2001 Jan;92(1):273–5. https://doi.org/10.1097/00000539-200101000-00055 PMID:11133644

 ORCID
ORCID
 Creative Commons Attribution
Creative Commons Attribution