Darío Fernando Ortega Vallejo 1 , Andrés Felipe Erazo Narvaez 2 , León Santiago Díez Chamorro 2 , Daniela Suárez Rodríguez 3 , Jamer Armando Campo Sánchez 4 , Laura Fernanda Ortega López 5 , Lucía Maribel Velasco Villarreal 6 , Karen Alejandra Rivera 7
Recibido: 28-05-2019
Aceptado: 23-06-2020
©2020 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 49 Núm. 4 pp. 493-503|https://doi.org/10.25237/revchilanestv49n04-05
PDF|ePub|RIS
Ultrasound for the assessment of gastric content: a systematic review
Abstract
Pneumonic aspiration of gastric contents is an important complication of anesthetic practice. : To determine the applicability of ultrasound for the assessment of the qualitative and quantitative characteristics of gastric contents. : A systematic review was carried out, based on a structured search of the literature published in the databases: Pubmed, EMBASE, SciELO, Cochrane Library, OVID and Google Scholar, from the foundation of these until December 2018 Boolean connectors were used to locate information from the terms: anesthesiology, ultrasonography, gastrointestinal Contents. The quality of the information was assessed using different tools according to each type of study. : We found 23 relevant studies for inclusion in the systematic review. The overall risk of bias was low. : Gastric ultrasound seems to correspond to a tool that is easy to perform at the patient’s bedside, but there is uncertainty about its applicability in uncontrolled settings, different from those applied in the studies described in this review. More research is needed with different populations and scenarios, in favor of establishing the behavior in these, of the variables that can be determined by ultrasound. The implications for clinical practice and long-term outcomes may have the measurements achieved by ultrasound are still uncertain.
Resumen
: La aspiración neumónica del contenido gástrico es una complicación importante de la práctica anestésica. : Determinar la aplicabilidad del ultrasonido para la valoración de las características cualitativas y cuantitativas del contenido gástrico. : Se realizó una revisión sistemática, a partir de una búsqueda estructurada de la literatura publicada en las bases de datos: Pubmed, EMBASE, SciELO, Cochrane Library, OVID y Google Scholar, desde la fundación de las mismas hasta diciembre de 2018. Se utilizaron conectores booleanos para localizar información a partir de los términos: anesthesiology, ultrasonography, gastrointestinal Contents. La calidad de la información fue valorada mediante diferentes herramientas de acuerdo a cada tipo de estudio. : Se encontraron 23 estudios pertinentes para su inclusión en la revisión sistemática. El riesgo global de sesgo fue bajo. El ultrasonido gástrico parece corresponder a una herramienta de fácil realización a la cabecera del paciente, pero existe incertidumbre sobre su aplicabilidad en contextos no controlados, diferentes a los aplicados en los estudios descritos en la presente revisión. Se necesita más investigación con distintas poblaciones y escenarios, en favor de establecer el comportamiento en estos, de las variables que pueden determinarse por ultrasonido. Las implicaciones que para la práctica clínica y desenlaces a largo plazo puedan tener las mediciones logradas mediante ecografía son aún inciertas.
-
Introducción
La aspiración de contenido gástrico representa hasta el 9% de todas las muertes asociadas a la anestesia[1], con una incidencia oscila entre 0,1 y 19%[2],[3]. Su prevención ocurre mediante directrices de ayuno, no siempre aplicadas en la práctica clínica[ 2 ]. Algunos estudios han propuesto al ultrasonido (US) como una alternativa para la valoración del contenido estomacal[1 ],[4]. El objetivo de la presente revisión sistemática es determinar la aplicabilidad del ultrasonido para la valoración de las características cualitativas y cuantitativas del contenido gástrico.
-
Materiales y Métodos
Se desarrolló una búsqueda de la literatura publicada en las bases de datos: Pubmed, EMBASE, SciELO, Cochrane Library, OVID y Google Scholar, desde su fundación hasta diciembre de 2018. Se utilizaron descriptores Booleanos para localizar información a partir de los términos: anesthesiology, ultrasonography y gastrointestinal Contents. Adicionalmente, se realizó una búsqueda abierta y se revisaron de forma manual las referencias de cada uno de los estudios encontrados, en favor de encontrar información adicional relevante.
-
Objetivo
Determinar la aplicabilidad del ultrasonido para la valoración de las características cualitativas y cuantitativas del contenido gástrico.
-
Criterios de inclusión y exclusión de los estudios
Se incluyeron estudios de casos y controles, estudios de cohorte y ensayos clínicos, realizados con pacientes mayores de 18 años de edad; se excluyeron estudios derivados de población pediátrica, mujeres gestantes y obesidad mórbida. También fueron excluidos del algoritmo de selección los comentarios, cartas al editor, editoriales, reportes de caso, series de caso, estudios descriptivos y artículos de revisión. Se excluyeron, además, manuscritos que no valoraban ninguno de los desenlaces considerados para la presente revisión, los cuales fueron los siguientes: a) factibilidad de realización del ultrasonido gástrico (USG) gástrico; b) clasificación cualitativa del contenido gástrico; c) determinación del área de sección transversal (AST) del antro gástrico y d) cuantificación del volumen del contenido gástrico (VCG).
Cada estudio fue valorado de forma independiente por dos coautores, su inclusión fue dependiente del consenso de los mismos y las decisiones dispares fueron resueltas por un tercer coautor. La calidad de los ensayos clínicos fue evaluada mediante la herramienta para la valoración del riesgo de sesgo Cochrane (HRSC)[5], mientras que los estudios de cohorte y de casos y controles fueron valorados a través de la escala Newcastle-Otawa (NO)[6].
-
Resultados
Mediante búsqueda estructurada original se encontraron 1.416 estudios. Fueron excluidos 1.393 resultados correspondientes a artículos duplicados, no relacionados con valoración del contenido gástrico por US en función de los desenlaces estudiados, cartas al editor, editoriales, artículos en idiomas diferentes al inglés o al español, así como artículos de revisión o estudios descriptivos. El algoritmo de selección de los estudios se presenta en la Figura 1.
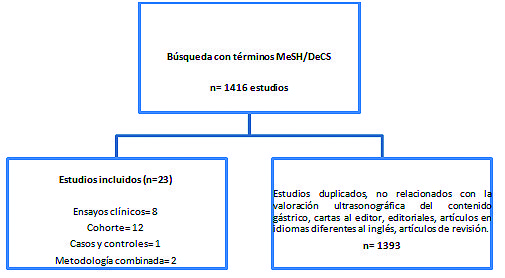
Figura 1. Flujograma de selección de los estudios.
-
Descripción preliminar de los estudios
Fujigaki et al[ 7 ]., llevaron a cabo un estudio prospectivo de cohorte en dos fases. En la fase 1 midieron el AST antral de 31 individuos sanos a las 1, 4 y después de 8 horas posteriores a la ingesta de 600-800 g de comida sólida. Encontraron que 27/31 pacientes (87%) con más de 8 horas de ayuno, tuvieron un AST < 8 cm2; mientras que 9/31 pacientes (29%) mostraron un AST < 8 cm2 a las 4 horas. En la fase 2, se midió el AST en ocho sujetos con más de 8 horas de ayuno, antes y cinco minutos después de la ingesta de 50 ml de leche. Ningún paciente tuvo más de 8 cm2 de AST en la medición previa, mientras que sólo uno tuvo valores de AST inferiores a 8 cm2 tras la ingesta de leche.
Hveem et al.[8], realizaron un estudio de cuatro fases con metodologías de estudio de cohorte y ensayo clínico, el cual incluyó 70 individuos programados para endoscopia digestiva superior, identificaron el AST de los mismos después de 8 horas de ayuno, encontrándose un valor promedio de 4,2 cm2, con un rango de 2-16 cm2 y un coeficiente de correlación (r) entre AST y volumen aspirado mediante endoscopia de 0,91, p < 0,001.
Jacoby et al[9 ], llevaron a cabo un ensayo clínico con 20 voluntarios sanos con más de 6 horas de ayuno, los cuales fueron aleatorizados en dos grupos definidos para ingerir alimentos sólidos o continuar en ayuno. El estómago fue identificado en 65% de las veces en el decúbito supino (DS) y 75% en el decúbito lateral derecho (DLD).
Perlas et al.[10], en 2009, realizaron un estudio en dos fases: la primera, realizada con 18 pacientes y con metodología de estudio de cohorte; estudió en cinco momentos diferentes, el AST a nivel del antro, el cuerpo y el fondo estomacal tanto en DS como en DLD, tras la ingesta de distintos volúmenes de líquidos claros o alimentos sólidos. Se encontró que el antro y el DLD resultaron más convenientes para el cálculo del AST en el caso de los líquidos claros. No obstante, la medición del contenido sólido, resultó más factible en DS. La segunda fase, con metodología de ensayo clínico, incluyó 36 sujetos con más de 8 horas de ayuno, los cuales fueron aleatorizados en dos ocasiones diferentes para ingerir distintos volúmenes de agua. Se midió el AST inmediatamente después de la ingesta y se generaron fórmulas matemáticas para predecir el VCG con base al AST, a saber: VCG (ml) = -372,54 + 282,49 x log [AST DLD]- 1,68 x peso y VCG (ml) = 1.199,99 372,54 + 483,09 x log [AST DS]- 5,84 x edad- 9,94 x peso.
Bouvet et al.[11 ], mediante un ensayo clínico, midieron el AST de 22 voluntarios en 3 momentos distintos, tras su aleatorización hacia uno de los siguientes grupos: permanecer en ayunas, 2 horas después de ingestión de líquidos y 2 horas después de ingestión de sólidos. Se informaron medianas de 2,6 cm2, 3,8 cm2 y 7 cm2 respectivamente para cada estado, concluyendo un valor de AST compatible con estómago de riesgo igual a 3,2 cm2 (VCG > 0,8 ml/kg), sensibilidad 85% y especificidad 93%.
Bouvet et al.[4 ], en un estudio prospectivo de cohorte, contrastaron el valor de área de sección transversal (AST) medida por ultrasonido con el contenido gástrico aspirado en pacientes electivos y emergentes llevados a anestesia general, a quienes se les había dado a ingerir 100 cc de agua. Se reportó un AST de 3,4 cm2 para el diagnóstico de estómago de riesgo (mayor a 0,8 ml/kg), según los investigadores; con un coeficiente de correlación de 0,72 entre el valor medido y el aspirado (p < 0,0001).
Perlas et al.[ 12 ], en un estudio de cohorte, valoraron cualitativamente el antro gástrico de 200 pacientes en los DLD y DS. Los pacientes fueron clasificados en tres categorías: grado 0, aquellos en los que no se visualizó contenido en ninguna de las dos visualizaciones, grado 1 a quienes se les visualizó contenido hipoecoico únicamente en el DLD y grado 2, los pacientes en quienes se visualizó el contenido en ambas posiciones. Un total de 86 pacientes (43%) fueron clasificados como grado 0, 107 (53,5%) como grado 1, 7 (3,5%) como grado 2; con un VCG predicho por AST de 0, 16 ± 36 mL y 180 ± 83 mL, respectivamente.
Koening et al.[13 ], en un estudio de cohorte, evaluaron la utilidad del ultrasonido para determinar la necesidad de vaciamiento estomacal por tubo orogástrico, en 80 pacientes con indicación de intubación orotraqueal de emergencia. En 19/80 (24%) pacientes se encontró contenido líquido y en 13/80 (16%) se decidió realizar vaciado gástrico, con control ecográfico que no mostró ocupación residual.
Cubillos et al.[14 ], en ensayo clínico, caracterizaron los hallazgos ecográficos del contenido gástrico en ayuno, a los 5 y a los 90 minutos después de la ingesta de líquido claro, líquidos no claros y alimentos sólidos. Se encontró hipoecogenicidad en el caso de los líquidos claros, disminución de la misma con la ingesta de líquidos no claros y aspecto de vidrio esmerilado tras la ingesta y una ecogenicidad intermedia a los 90 minutos.
Perlas et al.[15 ], en un ensayo clínico aleatorizado realizado a 108 voluntarios sanos programados para endoscopia digestiva superior, tras la ingesta de 0, 50, 100, 200, 300 y 400 ml de jugo de manzana, midieron el AST para calcular el VCG con base a su modelo matemático previo, para luego compararlo con el volumen aspirado mediante endoscopia. Se generó un nuevo modelo matemático: VCG (ml) = 27 + 14,6 x log [AST DLD]- 1,28 x edad, con un coeficiente de correlación de 0,731 entre las dos mediciones.
Kruisselbrink et al.[16 ], realizaron un ensayo clínico con 22 voluntarios sanos bajo directrices de ayuno, aleatorizados para la ingesta de 0, 100, 200, 300 o 400 ml de jugo de manzana. Se midió el AST mediante dos técnicas: convencional de doble diámetro y la técnica de libre trazado. Se encontró un coeficiente de correlación general de 0,96 entre ambas técnicas, con una buena fiabilidad inter e intraobservador para los diferentes volúmenes, con cualquiera de las dos alternativas de medición.
Alakkad et al.[ 1 ], en un estudio prospectivo de cohorte, valoraron las características del contenido gástrico en pacientes programados para procedimientos electivos quienes no cumplieron las directrices de ayuno. En este estudio se informó un cambio en el momento de la anestesia, en la técnica anestésica o en ambas, en el 71% de los pacientes, ocurriendo una menor incidencia de retrasos quirúrgicos.
Bisinotto et al.[17], en un ensayo clínico realizado con 30 individuos sanos bajo directrices de ayuno, aleatorizados en varias ocasiones en cuatro grupos: ayuno, ingestión de 250 ml de líquido claro, leche y alimento sólido, encontraron que el estómago vacío fue identificado en el 73,5% de los casos y el líquido claro se identificó como tal 81,2% de las veces. El líquido no claro fue considerado como sólido en 81,2% y el contenido sólido fue reportado de dicha manera en 93,7% de las veces.
Bouvet et al[18 ], en un estudio prospectivo de cohorte realizado con 440 pacientes quirúrgicos electivos o de urgencia, encontraron una prevalencia de estómago de riesgo (Grado 1 de Perlas con AST > 3,4 cm2) del 5% (IC 95%, 2-9%). La obesidad, la diabetes mellitus, la cirugía de emergencia y el consumo perioperatorio de opioides fueron factores de riesgo independientes para estómago lleno.
Chen et al.[19], realizaron un estudio de cohorte que incluyó 60 participantes con y sin insuficiencia renal, los cuales fueron evaluados mediante el sistema de tres grados de Perlas[12] a las 6 horas después de la ingesta de alimento sólido. Se encontró 16,7% de pacientes con grado 2 de Perlas en el grupo de insuficiencia renal.
Van de Putte et al.[20 ], en un estudio de cohorte retrospectiva realizado con 538 pacientes quirúrgicos bajo directrices de ayuno, estudiaron la incidencia de estómago de riesgo (VCG > 1,5 ml/kg), los cambios en el manejo anestésico y la incidencia de aspiración, entre otros desenlaces. Se informó que 32 pacientes (6,2%) tuvieron estómago de riesgo, en 9 (1,7%) se documentó contenido sólido y en 23 (4,5%) un VCG > 1,5 ml/kg. Asimismo, apenas 6 pacientes (1,1%) tuvieron algún factor de riesgo para retraso en el vaciamiento gástrico. El manejo anestésico fue cambiado en 9 pacientes (1,7%) y no se reportaron casos de aspiración.
Van de Putte et al.[21 ], en otro estudio de cohorte retrospectiva realizado con 37 pacientes programados para cirugía electiva quienes no cumplieron directrices de ayuno, evaluaron el impacto del US para determinar cambios en la estratificación del riesgo de aspiración, en el manejo anestésico inicialmente planteado (momento del procedimiento, cambio de la técnica anestésica) y en la incidencia de aspiración. La estratificación del riesgo y cambio en el manejo anestésico se documentó en el 64,9% de los casos. No se documentaron casos de aspiración.
Kruisselbrink et al.[22 ], realizaron un ensayo clínico crossover con 40 voluntarios sanos bajo directrices de ayuno, los cuales fueron aleatorizados hacia uno de tres grupos: continuar en ayuno o ingerir una cantidad estandarizada de alimento líquido o sólido. El proceso se repitió 24 horas después, para un total de 80 mediciones. Se determinó que el ultrasonido gástrico tiene una alta sensibilidad (S) y especificidad (E), para la identificación del estómago de riesgo (VCG > 1,5 ml/kg): S = 1 (IC 95%, 0,925-1,0) y E = 0,975 (IC 95% 0,95-1,0).
Mendes et al.[23], a través un ensayo clínico crossover que involucró 17 participantes, evaluaron la variación del VCG tras la ingesta de líquidos claros y alimento sólido, cada hora y durante 6 horas, mediante la aplicación del modelo matemático validado de Perlas[15], encontrando tiempos medios de vaciamiento (DE) de 2,5 ± 0,7 y 4,5 ± 0,9 h líquido y sólido, respectivamente (p < 0,001). Para el líquido, el estómago estaba completamente vacío en 59% y 100% de los sujetos después de 2 y 4 horas; mientras que se vació en 65% y 100% de los sujetos que ingirieron sólidos después de 4 y 7 horas, respectivamente.
Ohashi et al.[ 24 ], en un estudio de cohorte, estudiaron el VCG en 222 pacientes bajo directrices de ayuno, mediante la aplicación del modelo matemático validado de Perlas[15]. Se informó que 2,7% tuvieron estómago de riesgo (VCG > 1,5 ml/Kg). No se encontró asociación entre este hallazgo y el consumo de opioides, diabetes mellitus, obesidad o reflujo gastroesofágico.
Sabry et al.[25 ], en un estudio de casos y controles, estudiaron contenido gástrico de 50 pacientes bajo directrices de ayuno, 25 de ellos con diagnóstico de diabetes mellitus de larga data (> seis años) y 25 individuos sin el antecedente. Encontraron una mediana de AST de 13,8 [9,5-19,5] cm2 en el grupo de diabetes, en contraste con 8,8 [5,5-10,5] cm2 en el grupo control. Además, se estimó un VCG de 177 [96-275] mL vs 83 [50-109] mL, P < 0,001; en paciente diabéticos y no diabéticos, respectivamente.
Sharma et al.[26 ], en un estudio de cohorte, midieron el volumen del contenido gástrico en 100 pacientes con 6-16 horas de ayuno, a través del modelo matemático validado de Perlas[15]. En 1% y 6% de los pacientes con 6-10 horas de ayuno se encontró contenido sólido y líquido superior a 1,5 ml/kg, respectivamente. Asimismo, se informó 5% y 8%, con iguales características en individuos con más de 10 horas de ayuno. Los pacientes con diabetes mellitus (DM), insuficiencia renal crónica (IRC) y obesidad, tuvieron un incremento importante del AST.
Sharma S et al. (2018), en un estudio de cohorte, evaluaron la efectividad de las directrices de ayuno en 246 pacientes, llevados a procedimientos quirúrgicos electivos o emergentes, a través de la aplicación de un modelo matemático validado de Perlas[15 ]. Se encontró que 28% con estómago de riesgo, pero no se encontró relación entre dicho volumen y las horas de ayuno. Se estableció una relación lineal entre el VCG y el índice de masa corporal (IMC); y se estimó que los pacientes con IRC tienen 2,3 veces más probabilidad de tener estómago de riesgo (Tabla 1 ver Anexo 1).
|
Tabla 1. Calidad de los estudios incluidos |
||
|
Estudio |
Herramienta utilizada |
Riesgo global de sesgo |
|
Fujigaki[ 7 ] |
NOec |
Bajo |
|
Hveem[ 8 ] |
NOec-HCRS |
Intermedio |
|
Jacoby[ 9 ] |
HCRS |
Intermedio |
|
Perlas[ 10 ] |
HCRS |
Bajo |
|
Bouvet[ 4 ] |
HCRS |
Bajo |
|
Bouvet[ 11 ] |
NOec |
Bajo |
|
Perlas[ 12 ] |
NOec-HCRS |
Bajo |
|
Koenig[ 13 ] |
NOec |
Intermedio |
|
Cubillos[ 14 ] |
HCRS |
Bajo |
|
Perlas[ 15 ] |
HCRS |
Bajo |
|
Kruisselbrink[ 16 ] |
HCRS |
Bajo |
|
Alakkad[ 1 ] |
NOec |
Bajo |
|
Bisinotto[ 17 ] |
HCRS |
Bajo |
|
Bouvet[ 18 ] |
NOec |
Bajo |
|
Chen[ 19 ] |
NOec |
Bajo |
|
Van de Putte[ 20 ] |
NOec |
Bajo |
|
Van de Putte[ 21 ] |
NOec |
Bajo |
|
Kruisselbrink[ 22 ] |
HCRS |
Bajo |
|
Mendes[ 23 ] |
HCRS |
Bajo |
|
Ohashi[ 24 ] |
NOec |
Intermedio |
|
Sabry[ 25 ] |
NOcc |
Bajo |
|
Sharma[ 26 ] |
NOec |
Intermedio |
|
Sharma[ 27 ] |
NOec |
Intermedio |
|
HCRS: Herramienta Cochrane para la valoración del riesgo de sesgo de ensayos clínicos; NOcc: Escala Newcastle – Ottawa para la valoración de la calidad de estudios de casos y controles; NOec: Escala Newcastle – Ottawa para la valoración de la calidad de estudios de cohorte. |
||
-
Discusión
Mediante búsqueda sistemática se encontraron 23 estudios, incluyendo 8 ensayos clínicos, 10 estudios prospectivos de cohorte, 2 estudios de cohorte retrospectiva, 1 estudio de casos-controles y 2 estudios de dos etapas con metodología de ensayo clínico y estudio de cohorte. En todos los ensayos clínicos el riesgo de sesgo global fue bajo, al igual que en 8 estudios de cohorte y el estudio de casos y controles. Para los demás estudios el riesgo fue catalogado como intermedio y no se encontraron estudios con alto riesgo de sesgo.
-
Factibilidad y precisión
Kruisselbrink et al.[16 ], no encontraron diferencia entre la medición del AST a través de las técnicas de libre trazado o de doble diámetro, encontrando un coeficiente de correlación > 0,96, entre las mediciones realizadas con ambas técnicas. Entre tanto, Perlas et al. (2009), reportaron una mejor correlación entre el AST medida y volúmenes gástricos aspirados, cuando las mediciones se realizaron a nivel del antro gástrico; en el DLD para el caso del contenido líquido y en DS para sólidos.
Jacoby et al.[ 9 ], calcularon la posibilidad determinar el estado prandial US en 65% de las veces en el decúbito supino (DS) y 75% en el decúbito lateral derecho (DLD). Los examinadores de este estudio fueron personal en entrenamiento, con experiencia limitada, en comparación con los demás estudios que hacen parte de la presente revisión sistemática, en los cuales, las mediciones fueron realizadas por personal experto. No obstante, en un estudio de curva de aprendizaje, el número promedio de casos requeridos para alcanzar tasas de éxito del 90% y 95% en la determinación del tipo de contenido, se estimó en 24 y 33 valoraciones ecográficas, respectivamente[28].
Por otro lado, Hveem et al.[8 ], encontraron un coeficiente de correlación entre el AST medido y los volúmenes aspirados de 0,91 (p < 0,001) en pacientes en ayunas y de 0,74 (p < 0,001) en pacientes que ingirieron líquidos. Se encontraron, además, un coeficiente de variación intra-observador de 6% e inter-observador del 7,4%. Del mismo modo, en un estudio de Bouvet et al.[ 4 ], el AST antral aumentó proporcionalmente al volumen aspirado de contenido gástrico, con un coeficiente de correlación de 0,72 (P < 0,0001). Por su parte, Kruisselbrink et al.[22 ], encontró una sensibilidad y especificidad cercanas a 100%, con valores predictivos positivo y negativo superiores a 0,97, para la determinación del tipo de contenido gástrico.
-
¿Qué puede considerarse estómago de riesgo?
No existe consenso para definir el término. Perlas et al., consideran que este debe corresponder a un valor superior a 1,5 ml/kg de peso, ya que las secreciones gástricas basales de un adulto en ayuno pueden alcanzar dicho valor. En contraste, Bouvet, ha sugerido que dicho valor debe corresponder a 0,8 ml/kg, en consideración a resultados derivados de estudios con animales (monos Rhesus). En este mismo sentido, Engelhardt et al.[29 ], demostraron que la instalación de 0,4 a 0,6 ml/ kg de ácido clorhídrico directamente en las tráqueas de los monos causan cambios clínicos pero no la muerte; mientras que la dosis letal media (DL50) de ácido clorhídrico instilado en la tráquea de los monos es de 1,0 ml/kg. Con base en esto, Bouvet et al., han utilizado en sus trabajos un límite de 0,8 mL/kg, o aproximadamente 50 ml, como el umbral a partir del cual debería definirse el estómago de riesgo (también denominado estómago lleno). Los autores de la presente revisión se encuentran de acuerdo con la postura de Perlas, por lo que se considera un valor de 1,5 ml/kg como punto de corte, en especial en el paciente que no tiene factores predisponentes para el retraso en el vaciamiento gástrico.
-
Análisis cualitativo
Cubillos et al.[ 9 ], caracterizaron los hallazgos ecográficos del contenido gástrico en ayuno y tras la ingesta de contenido líquido o sólido. En términos cualitativos, Perlas et al.[ 12 ], categorizaron, con base a un análisis cualitativo, los pacientes que podrían estar en riesgo de aspiración. Según esto, un análisis ecográfico inicial permite valorar la presencia del contenido sólido o líquido, discriminándolo del estómago vacío. Cualquier cantidad de sólido identificado se considera de alto riesgo, mientras que la ausencia de contenido devela riesgo bajo. En un segundo paso se determina si el contenido líquido alcanza o no, un valor superior al que pueden llegar a tener las secreciones basales (1,5 ml/kg). Cuando el volumen es inferior, la visibilidad del contenido líquido sólo es posible en el DLD, debido al desplazamiento gravitacional del líquido; mientras que su apreciación tanto en DLD como en DS, representa un volumen que supera el umbral de riesgo (Figura 2).
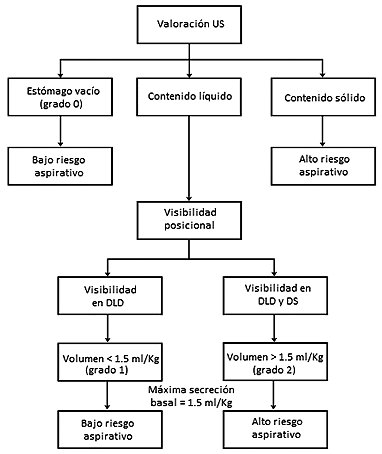
Los estudios de Perlas et al.[12],[15], han mostrado una adecuada correlación entre el sistema de tres grados y los volúmenes gástricos aspirados o predichos, siendo una alternativa útil para el cribado del estómago de riesgo.
-
Análisis cuantitativo
Los intentos por medir el contenido gástrico se han dirigido a la determinación del AST del antro gástrico y a la predicción de volúmenes mediante modelos logarítmicos con base a dicha medición. Matemáticamente, el AST puede calcularse mediante la aplicación de la fórmula de la elipse, mediante la ecuación: D1 x D2 x π/4; donde D1 representa el diámetro cefalocaudal y D2 el diámetro anteroposterior del antro medidos por ultrasonido.
Así las cosas, Bouvet et al.[4],[11], para un valor de 0,8 ml/kg, determinaron valores de AST entre 3,2 y 3,4 cm2, los cuales serían compatibles con estómago de riesgo. Por su parte, Perlas et al.[12], encontraron 3,5% de pacientes con clasificación grado 2 a pesar de las directrices de ayuno, en los cuales se halló una media de AST antral de 11,6 ± 3,2, por lo que al menos un paciente tuvo un AST mínima de 8,4 cm2, considerándose aún con estómago de riesgo. En contraste, el máximo valor de AST en 107/200 pacientes catalogados como grado 1 fue de 7 cm2[12].
Por otro lado, también Perlas et al.[10 ], intentaron establecer un modelo matemático en base a una regresión logística de 70 mediciones de AST antral en DLD y DS, realizadas en 36 sujetos, tras la ingesta de volúmenes controlados de agua. La ecuación es la siguiente: Volumen (ml) = -372,54 + 282,49 x log [AST DLD]- 1,68 x peso], útil para la predicción de volúmenes inferiores a 300 ml.
De forma similar, en un estudio subsecuente, Perlas et al. (2013), establecieron un nuevo modelo, igualmente, con base en la medición del AST en DLD, realizada en 108 voluntarios tras la ingesta de distintos volúmenes de jugo de manzana, que posteriormente fueron succionados. Mediante regresión se estimó la ecuación: Volumen (ml) = 27 + 14,6 x log [AST DLD (cm2)]- 1,28 x edad (años), útil para la predicción de volúmenes hasta de 500 ml.
Sin embargo, ambos modelos tienen limitaciones particulares, debido especialmente a que derivaron de individuos adultos sanos. De esta forma, no son aplicables a población pediátrica, embarazadas, sujetos con IMC > 40 kg/m2 ni a pacientes con patologías específicas que pudieran determinar un cambio en la función o anatomía del sistema gastrointestinal, por ejemplo, los pacientes con íleo. Asimismo, no son útiles para valores por encima de los previamente descritos, sobre los cuales, la capacidad de predicción de cada modelo disminuye. Además, son aplicables al contexto de la ingesta de alimento líquido, siempre y cuando la medición del AST se realice en DLD y entre contracciones peristálticas. De cualquier manera, estos modelos resultan de difícil aplicación en la práctica rutinaria a menos que se incorporen a herramientas tecnológicas que faciliten su uso.
Por otro lado, Fujigaki et al., encontraron un AST < de 8 cm2 después de 8 horas de ayuno tras la ingesta de una comida copiosa, pero la muestra sobre la que se realizó el estudio fue una cohorte de tan solo 8 pacientes, pudiendo generarse una importante variación interindividual a lo largo de las mediciones. En contraste, Hveem et al., encontraron un AST promedio tras 8 horas de ayuno de 4,2 cm2, con un rango que alcanzó los 16 cm2, no habiéndose establecido medidas de tendencia central que permitieran deducir conclusiones. Además, se trató de una muestra de 31 individuos, con las mismas consideraciones que el estudio anterior. En este sentido, es difícil establecer un AST aislado como punto de corte para estómago de riesgo (> 1,5 ml/kg). Si bien, de acuerdo a los estudios de Perlas[12],[15], pudiera asumirse que dicho límite se encuentra entre valores de AST que oscilan alrededor de 7 y 8,4 cm2, no existe un AST absoluta para un volumen predicho, sino que este parece variar en función de la edad[15].
-
Implicaciones para la práctica anestésica
Varios estudios, han encontrado que existe un porcentaje pequeño pero significativo de pacientes que mantiene el estómago de riesgo a partir de las directrices de ayuno[12],[15],[19],[20],[23]-[26]. En contraposición, Alakkad et al.[1], encontraron 24/38 pacientes con clasificaciones 0 y 1 de Perlas, a pesar de no haber seguido las orientaciones y Perlas et al.[12], encontraron 7/200 pacientes con clasificación grado 2 a pesar de las directrices de ayuno. Van de Putte et al.[20], reportaron 6,2% pacientes con estómago lleno, 1,7% de los cuales tuvieron contenido sólido, mientras que un 4,5% líquido claro > 1,5 ml/kg. Por su parte, Bouvet et al.[18 ] encontraron una media de estómago de riesgo del 5% (> 0,8 ml/kg), considerando factores predictivos independientes para tal condición: la cirugía de emergencia, el uso perioperatorio de morfina, la diabetes y la obesidad. Al respecto, el estudio de Chen et al.[19], encontró valores superiores de AST en pacientes con falla renal que en sujetos sin el antecedente, fenómeno similar al reportado por Sabry en pacientes diabéticos[25]. Por su parte Ohashi et al.[24 ], encontraron 2,7% de pacientes con estómago de riesgo, mientras que Sharma informó 6% de pacientes con contenido sólido y 16% con volúmenes superiores a 1,5 ml/kg, con y sin comorbilidades. A pesar de lo anterior, no se ha encontrado que la persistencia del estómago de riesgo aumente la incidencia de la aspiración neumónica, así como es posible que muchos pacientes carezcan del riesgo antes de lo recomendado por las directrices de ayuno[2 ].
Alakkad et al.[1] y Van de Putte[21] informaron un 71% y 64,9% de cambio en el manejo anestésico respectivamente, bien sea por modificación la técnica o del momento en que se brindó la anestesia, encontrándose una disminución en las tasas de cancelación y/o retraso de los procedimientos quirúrgicos, en pacientes que no cumplían con las directrices de ayuno. Por su parte, Koening S.[13 ] et al, identificaron la capacidad del US para determinar la necesidad de vaciamiento estomacal por tubo orogástrico, en 13/80 (16%) quienes requirieron intubación traqueal de emergencia.
-
Conclusiones
La literatura disponible sugiere que ultrasonido aplicable en la determinación de las características cualitativas y cuantitativas del contenido gástrico. Sin embargo, los estudios encontrados tienen limitaciones metodológicas importantes que dificultan su extensión a la población general.
Así las cosas, el ultrasonido puede ser útil, especialmente en aquellos casos en los que se no cumplen o se desconoce el tiempo de ayuno, aunque existe incertidumbre sobre su aplicabilidad en escenarios no controlados, diferentes a los aplicados en los estudios descritos en la presente revisión. Se necesita más investigación con distintas poblaciones y en distintos escenarios, en favor de establecer el comportamiento en estos, de las variables que pueden determinarse por ultrasonido. Las implicaciones que para la práctica clínica y desenlaces a largo plazo puedan tener las mediciones logradas mediante ecografía son aún inciertas, especialmente en términos del impacto sobre la incidencia de aspiración pulmonar con contenido gástrico.
Referencias
1. Alakkad H, Kruisselbrink R, Chin KJ, Niazi AU, Abbas S, Chan VW, et al. Point-of-care ultrasound defines gastric content and changes the anesthetic management of elective surgical patients who have not followed fasting instructions: a prospective case series. Can J Anaesth. 2015 Nov;62(11):1188–95. https://doi.org/10.1007/s12630-015-0449-1
2. American Society of Anesthesiologists. Practice Guidelines for Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration: Application to Healthy Patients Undergoing Elective Procedures: An Updated Report by the American Society of Anesthesiologists Task Force on Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration. Anesthesiology. 2017 Mar;126(3):376–93. https://doi.org/10.1097/ALN.0000000000001452 PMID:28045707
3. Kozlow JH, Berenholtz SM, Garrett E, Dorman T, Pronovost PJ. Epidemiology and impact of aspiration pneumonia in patients undergoing surgery in Maryland, 1999-2000. Crit Care Med. 2003 Jul;31(7):1930–7. https://doi.org/10.1097/01.CCM.0000069738.73602.5F PMID:12847385
4. Bouvet L, Mazoit JX, Chassard D, Allaouchiche B, Boselli E, Benhamou D. Clinical assessment of the ultrasonographic measurement of antral area for estimating preoperative gastric content and volume. Anesthesiology. 2011 May;114(5):1086–92. https://doi.org/10.1097/ALN.0b013e31820dee48 PMID:21364462
5. Jørgensen L, Paludan-Müller AS, Laursen DR, Savović J, Boutron I, Sterne JA, et al. Evaluation of the Cochrane tool for assessing risk of bias in randomized clinical trials: overview of published comments and analysis of user practice in Cochrane and non-Cochrane reviews. Syst Rev. 2016 May;5(1):80. https://doi.org/10.1186/s13643-016-0259-8 PMID:27160280
6. Bae J-M. A suggestion for quality assessment in systematic reviews of observational studies in nutritional epidemiology. Epidemiology and Health. Korean Society of Epidemiology; 2016 Apr 26;38:e2016014. http://dx.doi.org/10.4178/epih.e2016014
7. Fujigaki T, Fukusaki M, Nakamura H, Shibata O, Sumikawa K. Quantitative evaluation of gastric contents using ultrasound. J Clin Anesth. 1993 Nov-Dec;5(6):451–5. https://doi.org/10.1016/0952-8180(93)90059-N PMID:8123268
8. Hveem K, Hausken T, Berstad A. Ultrasonographic assessment of fasting liquid content in the human stomach. Scand J Gastroenterol. 1994;29(9):786-9. https://doi.org/10.3109/00365529409092511.
9. Jacoby J, Smith G, Eberhardt M, Heller M. Bedside ultrasound to determine prandial status. Am J Emerg Med. 2003 May;21(3):216–9. https://doi.org/10.1016/S0735-6757(02)42243-7 PMID:12811716
10. Perlas A, Chan VW, Lupu CM, Mitsakakis N, Hanbidge A. Ultrasound assessment of gastric content and volume. Anesthesiology. 2009 Jul;111(1):82–9. https://doi.org/10.1097/ALN.0b013e3181a97250 PMID:19512861
11. Bouvet L, Miquel A, Chassard D, Boselli E, Allaouchiche B, Benhamou D. Could a single standardized ultrasonographic measurement of antral area be of interest for assessing gastric contents? A preliminary report. Eur J Anaesthesiol. 2009 Dec;26(12):1015–9. https://doi.org/10.1097/EJA.0b013e32833161fd PMID:19707146
12. Perlas A, Davis L, Khan M, Mitsakakis N, Chan VW. Gastric sonography in the fasted surgical patient: a prospective descriptive study. Anesth Analg. 2011 Jul;113(1):93–7. https://doi.org/10.1213/ANE.0b013e31821b98c0 PMID:21596885
13. Koenig SJ, Lakticova V, Mayo PH. Utility of ultrasonography for detection of gastric fluid during urgent endotracheal intubation. Intensive Care Med. 2011 Apr;37(4):627–31. https://doi.org/10.1007/s00134-010-2125-9 PMID:21287147
14. Cubillos J, Tse C, Chan VW, Perlas A. Bedside ultrasound assessment of gastric content: an observational study. Can J Anaesth. 2012 Apr;59(4):416–23. https://doi.org/10.1007/s12630-011-9661-9 PMID:22215523
15. Perlas A, Mitsakakis N, Liu L, Cino M, Haldipur N, Davis L, et al. Validation of a mathematical model for ultrasound assessment of gastric volume by gastroscopic examination. Anesth Analg. 2013 Feb;116(2):357–63. https://doi.org/10.1213/ANE.0b013e318274fc19 PMID:23302981
16. Kruisselbrink R, Arzola C, Endersby R, Tse C, Chan V, Perlas A. Intra- and interrater reliability of ultrasound assessment of gastric volume. Anesthesiology. 2014 Jul;121(1):46–51. https://doi.org/10.1097/ALN.0000000000000193 PMID:24595113
17. Bisinotto FM, Pansani PL, Silveira LA, Naves AA, Peixoto AC, Lima HM, et al. Qualitative and quantitative ultrasound assessment of gastric content. Rev Assoc Med Bras (1992). 2017 Feb;63(2):134–41. https://doi.org/10.1590/1806-9282.63.02.134 PMID:28355374
18. Bouvet L, Desgranges FP, Aubergy C, Boselli E, Dupont G, Allaouchiche B, et al. Prevalence and factors predictive of full stomach in elective and emergency surgical patients: a prospective cohort study. Br J Anaesth. 2017 Mar;118(3):372–9. https://doi.org/10.1093/bja/aew462 PMID:28203726
19. Chen C, Liu L, Wang CY, Choi SW, Yuen VM. A pilot study of ultrasound evaluation of gastric emptying in patients with end-stage renal failure: a comparison with healthy controls. Anaesthesia. 2017 Jun;72(6):714–8. https://doi.org/10.1111/anae.13869 PMID:28332186
20. Van de Putte P, Vernieuwe L, Jerjir A, Verschueren L, Tacken M, Perlas A. When fasted is not empty: a retrospective cohort study of gastric content in fasted surgical patients. Br J Anaesth. 2017 Mar;118(3):363–71. https://doi.org/10.1093/bja/aew435 PMID:28203725
21. van de Putte P, van Hoonacker J, Perlas A. Gastric ultrasound to guide anesthetic management in elective surgical patients non-compliant with fasting instructions: a retrospective cohort study. Minerva Anestesiol. 2018 Jul;84(7):787–95. https://doi.org/10.23736/S0375-9393.17.12305-9 PMID:29152936
22. Kruisselbrink R, Gharapetian A, Chaparro LE, Ami N, Richler D, Chan VW, et al. Diagnostic Accuracy of Point-of-Care Gastric Ultrasound. Anesth Analg. 2019 Jan;128(1):89–95. https://doi.org/10.1213/ANE.0000000000003372 PMID:29624530
23. Carmona BM, Almeida CC, Vieira WB, Fascio MN, Carvalho LR, Vane LA, et al. [Ultrasound dynamics of gastric content volumes after the ingestion of coconut water or a meat sandwich. A randomized controlled crossover study in healthy volunteers]. Rev Bras Anestesiol. 2018 Nov – Dec;68(6):584–90. https://doi.org/10.1016/j.bjan.2018.06.008 PMID:30195629
24. Ohashi Y, Walker JC, Zhang F, Prindiville FE, Hanrahan JP, Mendelson R, et al. Preoperative gastric residual volumes in fasted patients measured by bedside ultrasound: a prospective observational study. Anaesth Intensive Care. 2018 Nov;46(6):608–13. https://doi.org/10.1177/0310057X1804600612 PMID:30447671
25. Sabry R, Hasanin A, Refaat S, Abdel Raouf S, Abdallah AS, Helmy N. Evaluation of gastric residual volume in fasting diabetic patients using gastric ultrasound. Acta Anaesthesiol Scand. 2019 May;63(5):615–9. https://doi.org/10.1111/aas.13315 PMID:30609007
26. Sharma G, Jacob R, Mahankali S, Ravindra MN. Preoperative assessment of gastric contents and volume using bedside ultrasound in adult patients: A prospective, observational, correlation study. Indian J Anaesth. 2018 Oct;62(10):753–8. https://doi.org/10.4103/ija.IJA_147_18 PMID:30443057
27. Sharma S, Deo AS, Raman P. Effectiveness of standard fasting guidelines as assessed by gastric ultrasound examination: A clinical audit. Indian J Anaesth. 2018 Oct;62(10):747–52. https://doi.org/10.4103/ija.IJA_54_18 PMID:30443056
28. Arzola C, Carvalho JC, Cubillos J, Ye XY, Perlas A. Anesthesiologists’ learning curves for bedside qualitative ultrasound assessment of gastric content: a cohort study. Can J Anaesth. 2013 Aug;60(8):771–9. https://doi.org/10.1007/s12630-013-9974-y PMID:23703533
29. Engelhardt T, Webster NR. Pulmonary aspiration of gastric contents in anaesthesia. Br J Anaesth. 1999 Sep;83(3):453–60. https://doi.org/10.1093/bja/83.3.453 PMID:10655918

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution