Samuel da Rosa Sousa 1 , Isadora Juliana Opolski 1 , Marcio Grande Carstens 2 , Paula Farías 2 , Guilherme Voltolini 1 , Renato Lorena Gomes 1 , Sarita Branco Ferreira 1
Recibido: 12-01-2020
Aceptado: 22-01-2020
©2020 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 49 Núm. 4 pp. 564-567|https://doi.org/10.25237/revchilanestv49n04-13
PDF|ePub|RIS
Sphenopalatine ganglion block, an option for treatment of post dural puncture headache
Abstract
Post-dural puncture headache is a complication of neuroaxial anesthesia. The initial approach consists of supportive treatment. In case of therapeutic failure, the epidural blood patch (PSE) is the treatment of choice. The case of a sphenopalatine ganglion block is presented for its management with good results.
Resumen
La cefalea postpunción dural es una complicación de la anestesia neuroaxial. El abordaje inicial consiste en tratamiento de soporte. En caso de falla terapéutica, el parche sanguíneo epidural (PSE) es el tratamiento de elección. Se presenta el caso de un bloqueo de ganglio esfenopalatino para su manejo con buenos resultados.
-
Introducción
La cefalea postpunción dural (CPPD) es una complicación de la anestesia neuroaxial. Su incidencia es multifactorial y presenta, como característica principal, dolor intenso y limitante, generalmente fronto-occipital, con empeoramiento en ortostasis. El abordaje inicial consiste en tratamiento de soporte. En caso de falla terapéutica, el parche sanguíneo epidural (PSE) es, aún hoy, considerado el tratamiento de elección. Debido a que tal técnica presenta riesgos significativos asociados, el bloqueo del ganglio esfenopalatino (BGEP), ampliamente difundido en situaciones de jaqueca, ha ganado notoriedad, ya que se configura como una alternativa no invasiva, segura y eficaz, que puede reducir los síntomas asociados y, de este modo, evitar la realización de PSE. Este trabajo tiene como objetivo debatir el BGEP como primera línea de tratamiento en la CPPD, así como conceptos fisiopatológicos que comprenden dicha técnica.
-
Caso clínico
AMSM, 43 años, sexo femenino, 63 kg, ASA P1, admitida en el centro quirúrgico para colecistectomía abierta. Se optó por el bloqueo epidural del neuroeje, en el cual se produjo una perforación inadvertida de la duramadre, con aguja de Tuohy, calibre 18. Luego de 48 horas, la paciente evolucionó con CPPD, holocraneal, intensidad 10 en la Escala de Clasificación Numérica 0-10, con empeoramiento al levantarse y alivio en decúbito, sin rigidez cervical o déficit focales. Inicialmente, se optó por un abordaje conservador. Se procedió a hidratación venosa, el empleo de hidrocortisona 200 mg/día, Ketoprofeno 200 mg/día y cafeína 500 mg/día, sin mejora de los síntomas. Se propuso, entonces, la realización del PSE, al cual la paciente se negó. Frente a la contraindicación absoluta al procedimiento que es la negación, se ofreció la posibilidad del BGEP. Con autorización de la paciente, se realizó el BGEP en ambiente monitoreado, posición supina, con una ligera extensión cervical y monitorización de los signos vitales. Paralelamente al suelo de la nariz, se introdujeron dos aplicadores, con punta de algodón embebidos en 4 ml de ropivacaína 1%, hasta la pared posterior de ambas fosas nasales, hasta sentir una resistencia (Figura 1). Luego de 5, 10 y 15 minutos, 1 ml del anestésico fue instilado por los cables de los aplicadores, los cuales permanecieron en la cavidad nasal durante 15 minutos. El alivio de los síntomas fue inmediato. La paciente permaneció monitoreada durante una hora y, posteriormente, fue trasladada a sala común. La mañana siguiente, fue dada de alta hospitalaria con cafeína (500 mg) 3 veces al día. Como seguimiento, se contactó a la paciente transcurridos cinco días y no relató dolor.
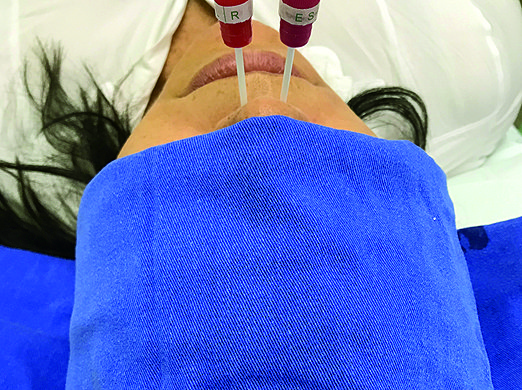
Figura 1. Se observa la forma de instalación del bloqueo esfenopalatino.
-
Discusión
La punción accidental de la duramadre es una complicación conocida durante la realización de anestesia neuroaxial. Frecuentemente, causa cefalea postural, con una incidencia de aproximadamente 60%, variando significativamente según el tamaño y tipo de aguja utilizada[1 ].
El dolor, generalmente, se manifiesta como intenso, frontal y occipital, que es exacerbado por el ortostatismo y aliviado en reposo. Eventualmente, otros síntomas, tales como náuseas, vómitos, rigidez de nuca y zumbido, pueden estar presentes y, en raras ocasiones, puede ocurrir la parálisis de los nervios craneales, como el oculomotor (III), troclear (IV) y abducens (VI)[3],[4].
Alrededor del 90% de los casos de CPPD suceden dentro de los primeros tres días de lo ocurrido. Generalmente, el diagnóstico de CPPD se realiza con base en la historia de una punción dural, asociado a datos clínicos. Sin embargo, frente a estos casos, deben considerarse otros diagnósticos, entre ellos, jaqueca, meningitis, hemorragia intracraneal, trombosis venosa central o tumor cerebral[1 ].
El abordaje de la CPPD siempre estuvo presente en la práctica de la anestesiología[5 ]. Los tratamientos están basados en su fisiopatología, tomando en consideración dos teorías principales que rigen la génesis de los síntomas. La primera se basa en el drenaje continuo de líquido cefalorraquídeo (LCR) a través del orificio generado por la aguja en la duramadre y que, a su vez, lleva a una pérdida de fluido del compartimento intracraneal, disminuyendo el efecto de amortiguación que el líquido cefalorraquídeo desempeña en el cerebro. Esto provoca una tracción de las meninges y, consecuentemente, dolor pronunciado en posición ortostática[6 ].
La segunda teoría propone que la pérdida de LCR genera hipotensión intracraneal. De acuerdo con el concepto de Monro-Kellie, el volumen intracraneal es igual al volumen encefálico más el volumen de sangre cerebral, sumado al volumen del LCR, y este volumen intracraneal debe permanecer inalterado. Siguiendo este concepto, la pérdida de LCR debido a la punción dural provoca que otros constituyentes intracraneales aumenten sus volúmenes, a fin de que la presión intracraneal y la presión de perfusión cerebral permanezcan constantes. Por ser el tejido cerebral un componente con poca capacidad de expansión aguda, es el volumen sanguíneo intracraneal el que aumenta agudamente, secundario a la vasodilatación, sugiriendo que la CPPD presentará alivio con restauración del volumen de LCR intracraneal, con el uso de vasoconstrictores cerebrales o también por bloqueo del mecanismo de vasodilatación, confiriendo, de este modo, alivio sintomático[1],[5],[6],[7].
La terapia de soporte con medicamentos sintomáticos es el abordaje inicial en pacientes con síntomas leves de CPPD, consistiendo en rehidratación, cafeína y antiinflamatorios no esteroides. En casos de falla o manifestaciones graves como, por ejemplo, alteraciones relacionadas con los pares de nervios craneales, el PSE se considera el tratamiento de elección, el cual es una técnica invasiva con potenciales complicaciones (meningitis, convulsiones, déficits motores y sensoriales, etc.) y limitaciones, que consiste en la inyección de sangre del propio paciente en el espacio epidural, con el fin de taponar el orificio de la duramadre y, así, impedir el derrame de líquido cefalorraquídeo. En contrapartida, el bloqueo del ganglio esfenopalatino (BGEP) ha sido usado desde hace mucho tiempo y de forma muy eficaz en el tratamiento de cefaleas de diferentes etiologías, siendo una alternativa actual, segura y de bajo riesgo para el tratamiento de la CPPD[8],[9].
Conceptualmente, el ganglio esfenopalatino se sitúa a aproximadamente 3 mm de la mucosa de la pared posterior de la cavidad nasal, a nivel del cornete medio. Recibe múltiples neuronas aferentes sensoriales y autonómicas, envía conexiones eferentes a la cavidad nasofaríngea y estructuras meníngeas, y desempeña un papel importante en la modulación neuronal[10],[11].
Sluder, en 1908, fue quien relató el primer BGEP con uso de cocaína tópica. En 2009, Cohen et al., relataron el abordaje del BGEP para la CPPD por medio de la introducción de un aplicador de punta de algodón embebido en lidocaína 4%[7 ],[12].
Por su parte, en 2015, Kent y Mehaffey relataron el uso del BGEP realizado con aplicadores de algodón embebidos en lidocaína 2%, en parturientas afectadas por CPPD. Todas las pacientes relataron alivio de los síntomas, sin necesidad de realizar el PSE[8 ]. Se cita también que, en 2017, Cardoso et al., realizaron un BGEP bilateral con levobupivacaína 0,5%, con resolución de los síntomas dentro de los 5 minutos luego de retirar los aplicadores de algodón[13 ].
Esta breve cronología demuestra que se han descrito varias técnicas de BGEP, siendo el abordaje transnasal la más simple y menos invasiva en el tratamiento de la CPPD, mostrándose eficaz para mejorar los síntomas al atenuar la vasodilatación cerebral inducida por la estimulación parasimpática transmitida por las neuronas que tienen sinapsis en el ganglio esfenopalatino, actuando de esta forma en el tono muscular del vaso meníngeo, reduciendo la vasodilatación exacerbada y actuando en la transmisión de la nocicepción por inhibición parasimpática, siendo este el mecanismo de acción de la técnica[1],[6],[14].
La descripción de la técnica transnasal consiste en colocar al paciente en posición supina, con una ligera extensión cervical. Luego, se introducen suavemente aplicadores con punta de algodón embebidos en 2 ml de anestésico local, bilateralmente, en paralelo al suelo de la nariz, hasta tocar la pared posterior. De forma seriada, se aplican pequeñas dosis de anestesia local sobre la varilla del aplicador y se verifica la ubicación correcta por medio de una leve presión o el giro de los aplicadores. El aplicador debe permanecer en la cavidad nasal durante 15 a 20 min, con algunos relatos de hasta 40 min. Es evidente que el BGEP por abordaje transnasal es una técnica no invasiva, simple, segura, con menor incomodidad para el paciente, de fácil aprendizaje, bajo costo, gran aplicabilidad en la práctica e inicio de acción rápido, factores que señalan que se trata de una alternativa segura al PSE[5],[7].
No existen relatos de complicaciones graves asociadas a esta técnica. Está contraindicado en casos de fractura de la base del cráneo o de infecciones locales/sistémicas[7 ],[15].
Se relataron episodios leves de epistaxis durante la introducción traumática del aplicador y parestesia nasofaríngea. La duración media del efecto analgésico, así como la droga de elección a ser utilizada, continúa mal definida. Estudios relatan el uso de lidocaína 4%, levobupivacaína 0,5%, ropivacaína de 0,75% a 1%, o también la combinación de drogas, todos con alta eficacia[16 ] En el caso relatado, el bloqueo se realizó con Ropivacaína 1%, y obtuvo alivio rápido y prolongado del dolor. De este modo, se sugiere que deben realizarse más estudios bien diseñados y con muestra significativa, a fin de elucidar mejor cuestiones aún no abordadas, hecho éste que no descalifica ni descarta el BGEP como terapia válida o de primera elección ante la CPPD.
Referencias
1. Turnbull DK, Shepherd DB. Post-dural puncture headache: pathogenesis, prevention and treatment. Br J Anaesth. 2003 Nov;91(5):718–29. https://doi.org/10.1093/bja/aeg231 PMID:14570796
2. Weir EC. The sharp end of the dural puncture. BMJ. 2000 Jan;320(7227):127–8. https://doi.org/10.1136/bmj.320.7227.127 PMID:10625287
3. Orbach-Zinger S, Ashwal E, Hazan L, Bracco D, Ioscovich A, Hiersch L, et al. Risk Factors for UnintendedDural Puncture in Obstetric Patients. Anesth Analg. 2016;123(4):972–6. https://doi.org/10.1213/ANE.0000000000001510 PMID:27537928
4. Kim YA, Yoon DM, Yoon KB. Epidural blood patch for the treatment of abducens nerve palsy due to spontaneous intracranial hypotension – A case report. Korean J Pain. 2012 Apr;25(2):112–5. https://doi.org/10.3344/kjp.2012.25.2.112 PMID:22514780
5. Cardoso JM, Sá M, Graça R, Reis H, Almeida L, Pinheiro C, et al. [Sphenopalatine ganglion block for postdural puncture headache in ambulatory setting]. Rev Bras Anestesiol. 2017 May – Jun;67(3):311–3. https://doi.org/10.1016/j.bjan.2017.02.003 PMID:28364968
6. Fleisher LA. Evidence-Based Practice of Anesthesiology. Saunders; 2013. 612 pp.
7. Cohen S, Levin D, Mellender S, Zhao R, Patel P, Grubb W, et al. Topical Sphenopalatine Ganglion Block Compared With Epidural Blood Patch for Postdural Puncture Headache Management in Postpartum Patients: A Retrospective Review. Reg Anesth Pain Med. 2018 Nov;43(8):880–4. https://doi.org/10.1097/AAP.0000000000000840 PMID:30063655
8. Kent S, Mehaffey G. Transnasal sphenopalatine ganglion block for the treatment of postdural puncture headache in obstetric patients. J Clin Anesth. 2016 Nov;34:194–6. https://doi.org/10.1016/j.jclinane.2016.04.009 PMID:27687372
9. Flaatten H, Rodt S, Rosland J, Vamnes J. Postoperative headache in young patients after spinal anaesthesia. Anaesthesia. 1987 Feb;42(2):202–5. https://doi.org/10.1111/j.1365-2044.1987.tb03001.x PMID:3826597
10. Nair AS, Rayani BK. Sphenopalatine ganglion block for relieving postdural puncture headache: technique and mechanism of action of block with a narrative review of efficacy. Korean J Pain. 2017 Apr;30(2):93–7. https://doi.org/10.3344/kjp.2017.30.2.93 PMID:28416992
11. Robbins MS, Robertson CE, Kaplan E, Ailani J, Charleston L 4th, Kuruvilla D, et al. The Sphenopalatine Ganglion: Anatomy, Pathophysiology, and Therapeutic Targeting in Headache. Headache. 2016 Feb;56(2):240–58. https://doi.org/10.1111/head.12729 PMID:26615983
12. Cohen S, Sakr A, Katyal S, Chopra D. Sphenopalatine ganglion block for postdural puncture headache. Anaesthesia. 2009 May;64(5):574–5. https://doi.org/10.1111/j.1365-2044.2009.05925.x PMID:19413836
13. Byrd H, Byrd W. Sphenopalatine Phenomena. Arch Intern Med (Chic). 1930 Dec;46(6):1026. https://doi.org/10.1001/archinte.1930.00140180127013.
14. Todorov L, Laurito CE, Schwartz DE. Postural headache in the presence of cerebral venous sinus thrombosis. Anesth Analg. 2005 Nov;101(5):1499–500. https://doi.org/10.1213/01.ANE.0000181003.37968.CB PMID:16244019
15. Nair AS, Rayani BK. Sphenopalatine ganglion block for relieving postdural puncture headache: technique and mechanism of action of block with a narrative review of efficacy. Korean J Pain. 2017 Apr;30(2):93–7. https://doi.org/10.3344/kjp.2017.30.2.93 PMID:28416992
16. Furtado I, Lima IF, Pedro S. Uso de ropivacaína em bloqueio do gânglio esfenopalatino via transnasal para cefaleia pós-punção dural em pacientes obstétricas – série de casos. Rev. Bras. Anestesiol.

 ORCID
ORCID
 Creative Commons Attribution
Creative Commons Attribution