Cecilia M. Acosta 1 , Andrés I. Acosta 2 , Gerardo Tusman 1
Recibido: 21-04-2020
Aceptado: 26-06-2020
©2020 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 49 Núm. 5 pp. 640-667|https://doi.org/10.25237/revchilanestv49n05-08
PDF|ePub|RIS
Lung ultrasound in critical care. Clinical application
Abstract
Lung ultrasound has had a great development in the critical patient management in the last decade. It is a safe, non-invasive and radiation-free tool that allows examining the patient at the bedside without the need for transfer. The last characteristic is particularly beneficial in patients with hypoxemia, hemodynamic instability and with high-risk of nosocomial contamination, as currently occurs in the pandemic caused by the outbreak of the new coronavirus 2019 disease (COVID-19). Lung ultrasound can be used to assess lung aeration in the patient under mechanical ventilation, evaluating the response to different strategies, personalizing lung recruitment maneuvers, and guiding the weaning process. This review describes the basic principles of lung ultrasound to obtain the images and interpret them. Lung ultrasound provides anesthesiologists, intensivists and respiratory therapists a safe and reliable tool for the diagnosis and follow-up of the main pulmonary diseases in the critical ill patient.
Resumen
El ultrasonido pulmonar ha tenido un gran desarrollo en el abordaje del paciente crítico en las últimas décadas. Constituye una herramienta segura, no invasiva y libre de radiación, que permite examinar al paciente sin necesidad de traslado. Esta última característica es particularmente beneficiosa en pacientes hipóxicos, inestables hemodinámicamente o con alto riesgo de contaminación nosocomial, como ocurre actualmente con la pandemia ocasionada por el brote de la enfermedad del nuevo coronavirus 2019 (COVID-19). El ultrasonido pulmonar puede ser usado, además, para evaluar y monitorizar la aireación pulmonar en el paciente en ventilación mecánica, personalizando maniobras de reclutamiento, testeando la respuesta a diferentes estrategias ventilatorias y monitorizando el proceso de weaning. Esta revisión describe los principios básicos del ultrasonido pulmonar para la obtención de imágenes y su interpretación. Proporcionando a médicos anestesiólogos, intensivistas y kinesiólogos respiratorios una herramienta segura y confiable para el diagnóstico y seguimiento de las principales patologías pulmonares en el paciente crítico.
-
Introducción
Numerosos estudios han evidenciado el gran potencial del ultrasonido pulmonar (USP) para el diagnóstico y monitorización de patologías pulmonares en diferentes áreas como salas de emergencia, cuidados intensivos y anestesiología[1]-[7]. Permite examinar el tórax obteniendo una imagen del pulmón de manera rápida, no invasiva, libre de radiación y sin necesidad de traslado al departamento de imágenes; disminuyendo así las complicaciones asociadas al traslado de pacientes críticos como desconexión del respirador, inestabilidad hemodinámica o relativas al riesgo de contaminación nosocomial, como ocurre actualmente con pacientes con fallo respiratorio agudo infectados por el nuevo coronavirus 2019 (COVID-19).
Posee una precisión diagnóstica superior a la auscultación y la radiografía de tórax para el diagnóstico de diferentes patologías pulmonares como neumotórax, derrame pleural, síndrome intersticial y consolidación alveolar en pacientes adultos y pediátricos[2],[7]. En los últimos años, la auscultación pulmonar está siendo reemplazada por la visualización del pulmón, considerando al USP como el “estetoscopio del nuevo milenio”[8]. Curiosamente, el USP al igual que la auscultación, se basa en la transmisión del sonido a través de las distintas estructuras del tórax.
El USP posee una curva de aprendizaje más corta que la ecocardiografía, tanto para obtener las imágenes como para interpretarlas; además, permite repetir sin riesgos el examen sonográfico, evaluando la evolución de las diferentes patologías. Sin embargo, es necesario un entrenamiento supervisado y riguroso antes de utilizar este método para evitar errores diagnósticos.
-
Exploración sonográfica del tórax
El USP permite no solo el diagnóstico sino también el seguimiento de diversas patologías pulmonares, así como también guiar procedimientos invasivos ( Tabla 1 ).
| Aplicación clínica del ultrasonido torácico |
| Control de correcta colocación del tubo endotraqueal |
| Diagnóstico y seguimiento de neumotórax |
| Diagnóstico y seguimiento de derrame pleural |
| Diagnóstico y seguimiento de edema agudo de pulmón |
| Diagnóstico y seguimiento de neumonías/bronconeumonías/atelectasias/contusión pulmonar |
| Diagnóstico y seguimiento de enfermedades intersticiales/fibrosis pulmonar |
| Diagnóstico y seguimiento del distrés respiratorio |
| Diagnóstico de tromboembolismo pulmonar |
| Control de reposición de fluidos/identificar patrón pulmonar tolerante a fluidos |
| Monitorización dinámica de la maniobra de reclutamiento y titulación de la PEEP |
| Evaluación de la función diafragmática |
| Guiar y monitorizar el proceso de weaning |
| Guía de procedimientos invasivos (toracocentesis, biopsia lesiones pleuro-pulmonares) |
| Diagnóstico y monitorización de neumonía por enfermedad por coronavirus-2019 (COVID-19) |
El examen puede realizarse con las sondas descritas en la Tabla 2, cuya selección dependerá de las características del paciente. Es decir, en el paciente pediátrico y neonato la sonda de elección es la lineal de alta frecuencia, debido a las dimensiones de la pared torácica del niño; mientras que para estudiar la gran mayoría de las patologías pulmonares en el adulto podemos utilizar una sonda convex, ya que permite obtener una imagen a gran profundidad. Sin embargo, según los hallazgos que encontremos en el examen inicial, podemos cambiar la sonda convex por una lineal para visualizar con mayor precisión alteraciones en la pleura y region subpleural.
| Tipos de sondas |
Frecuencia |
Profundidad |
Examen |
Lineal
 |
6 – 15 MHz |
6 cm |
De elección en pacientes pediátricos/neonatos
En el paciente adulto delgado es de elección para el diagnóstico de neumotórax Sonda de elección para diagnósticos de patología pleural y subpleural. Permiten visualizar con mayor resolución estructuras más superficiales: pared torácica, pleura y consolidaciones subpleurales |
Convex / microconvex
 |
|||
|
2 – 6 MHz |
30 cm |
De elección para el estudio sonográfico del pulmón en el paciente adulto. Permite obtener una imagen con mayor profundidad para evaluar grandes consolidaciones, derrame pleural, síndrome intersticial y a la vez es posible el diagnóstico de neumotórax | |
Sectorial
 |
1 – 5 MHz | 35 cm | Se utilizan para realizar ecocardiografía transtorácica
Permiten obtener una imagen a gran profundidad y estudiar el sindrome intersticial, los derrames pleurales y las consolidaciones. Debido a su campo proximal estrecho no es de elección para el diagnóstico de neumotórax |
Dentro de los modos de exploración de la pared torácica podemos mencionar los siguientes:
• Modo bidimensional: es el modo empleado con mayor frecuencia ya que permite la identificación de signos dinámicos.
• Modo M: consiste en el análisis de un punto, través del tiempo. Permite cuantificar el derrame pleural o evaluar la excursión diafragmática.
• Doppler color: permite el estudio de flujo sanguíneo en patología tromboembólica, identifica el shunt en atelectasias inducidas por anestesia[9]. A través el doppler espectral permite el diagnóstico diferencial de consolidaciones benignas (atelectasias, neumonías) y malignas[10].
-
Metodología para el estudio de patologías pulmonares
El examen sonográfico del pulmón debe ser realizado de una manera ordenada, con el paciente en decúbito supino. En el paciente adulto y pediátrico dividiremos el tórax en regiones: anterior, lateral y posterior, trazando las siguientes líneas: paraesternal, axilar anterior, axilar posterior y paravertebral; a su vez subdividiremos cada una de estas regiones en superior e inferior[3],[5]. En tanto, que en el neonato o lactante debido a las dimensiones de la caja torácica solo dividiremos áreas anteriores, laterales y posteriores ( Figura 1 ). De esta manera colocaremos en primer lugar la sonda en posición longitudinal con el notch hacia cefálico en cada una de estas seis regiones en cada hemitórax obteniendo una imagen en la cual las estructuras más cefálicas estarán a la izquierda de la pantalla. Posteriormente, rotaremos la sonda en posición oblicua, obteniendo de esta manera una imagen completa de la línea pleural y el parénquima pulmonar sin visualizar la sombra acústica de las costillas ( Figura 2 ).
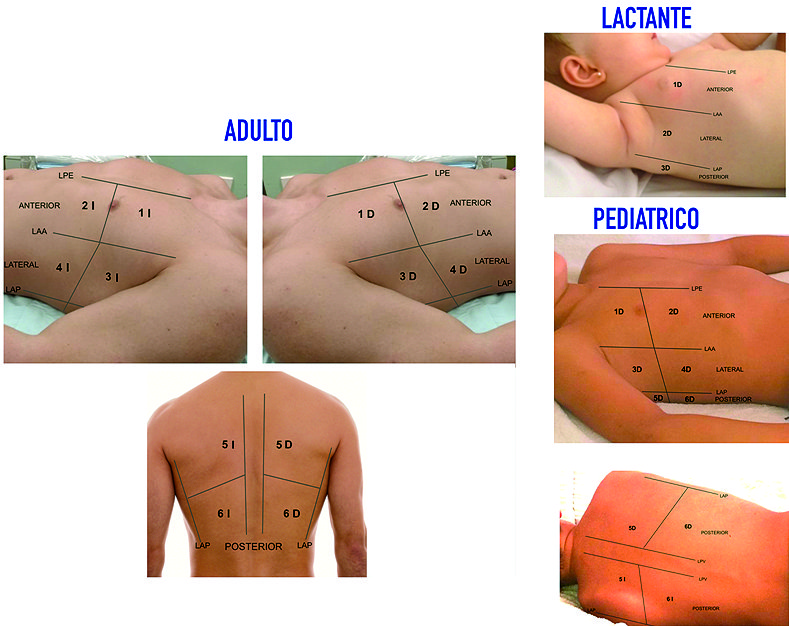
Figura 1. Patrón pulmonar normal en un paciente adulto con sonda convex 2-6 MHz. A: Modo B, corte longitudinal, de la región anterior del tórax, denominado “signo del murciélago”; B: Modo M evidencia el “signo de la playa”.
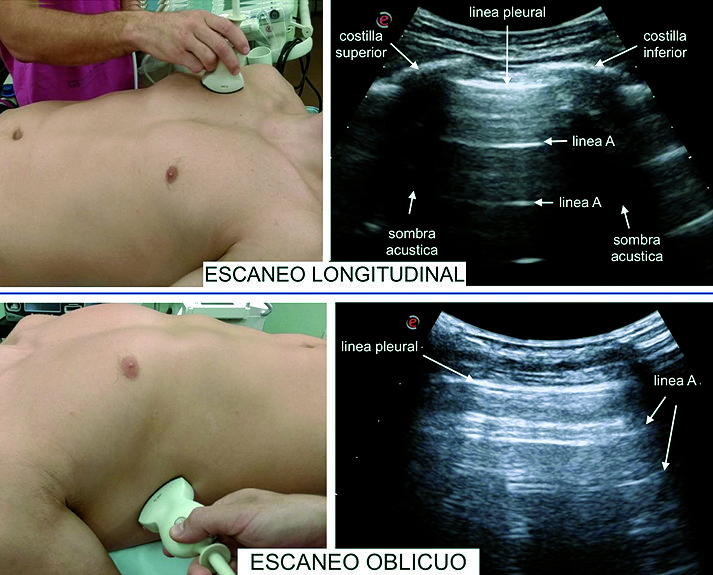
Figura 2. Patrón histológico que evidencia engrosamiento de los septos alveolares y su correlación sonográfica representada por artefactos verticales denominados líneas B.
Debemos tener en cuenta la posición en que se examina al paciente respecto al vector de la gravedad y al área de la pared torácica donde la sonda es posicionada. Siguiendo este principio, tanto el derrame pleural como las atelectasias por compresión se localizarán en las zonas más declives del pulmón. De modo opuesto, el neumotórax al igual que el síndrome intersticial se localizarán en zonas no dependientes del pulmón.
-
Principios básicos
Al colocar el transductor ecográfico sobre la pared torácica se obtienen imágenes que resultan de la interacción del haz ultrasónico con la pleura, el parénquima pulmonar y la interfase aire-líquido, generando artefactos horizontales y verticales de diferente ecogenicidad. La marcada diferencia en la impedancia acústica existente entre los tejidos blandos que conforman la caja torácica y el parénquima pulmonar normalmente aireado impide la formación de una imagen real y determina la aparición de artefactos, ocasionados por la reflexión de la pared torácica sobre la línea pleural. Las líneas A son los principales artefactos horizontales, caracterizados por ser líneas hiperecoicas, que se repiten y aparecen dispuestas a una distancia equidistante a la distancia existente entre la piel y la pleura. Esta repetición de las líneas A constituye un artefacto que está dado por la reverberación del sonido sobre la pleura. De esta manera, la pleura actúa como el “espejo del pulmón”[6].
Si posicionamos el transductor perpendicular a las costillas con el notch dirigido hacia cefálico podemos identificar dos líneas hiperecoicas que corresponden a las corticales de las costillas superior e inferior y sus sombras acústicas generadas por la ausencia del paso del ultrasonido (US) por debajo de las costillas, 0,5 cm por debajo de las imágenes costales una línea hiperecoica representa la pleura parietal y visceral. La imagen formada por estas estructuras fue denominada por Lichtenstein “signo del murciélago” (“bat sign”) y constituye uno de los signos sonográficos más importantes del USP[2] ( Figura 3A ).
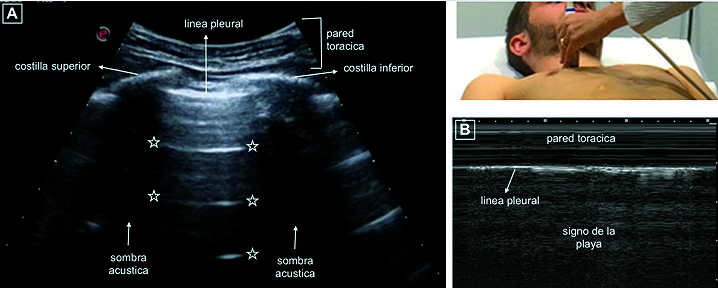
Figura 3. Segmentación del tórax para el estudio de patologías pulmonares dividiendo ambos hemitórax en seis regiones derechas e izquierdas. LPE: línea paraesternal. LAA: línea axilar anterior. LAP: línea axilar posterior.
En condiciones normales la línea pleural presenta un movimiento respiratorio observado en el modo bidimensional, denominado “deslizamiento pulmonar” (“lung sliding”), el cual constituye un signo dinámico generado por el deslizamiento de la pleura visceral sobre la pleura parietal durante el ciclo respiratorio[11],[12]. Si aplicamos el modo M, se distinguen dos zonas bien diferenciadas que configuran el “signo de la playa” (seashore sign): la parte superior corresponde a la pared torácica formada por líneas horizontales paralelas (el mar) y la parte inferior desde la pleura, de aspecto granulado como arena de playa[12] ( Figura 3B ).
Al disminuir el contenido de aire en el parénquima pulmonar e incrementarse la cantidad de fluidos o el depósito de células en los septos interlobulares y el intersticio aparecen artefactos verticales de reverberación llamados líneas B. Estos artefactos constituyen el signo sonográfico de la pérdida de aireación pulmonar, caracterizados por ser verticales y bien definidos, se originan en la línea pleural y se dirigen hasta el límite inferior de la imagen, borran las líneas A y poseen un movimiento sincrónico con el desplazamiento pleural. Se considera patológico cuando encontramos tres o más líneas B en un escaneo longitudinal[11] ( Figura 4 ).
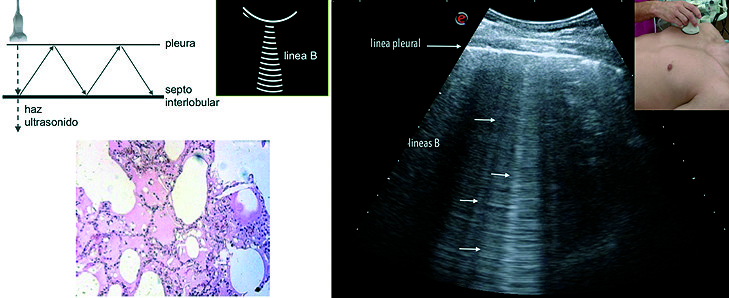
Figura 4. En la parte superior se observa la posición de la sonda en el escaneo longitudinal del tórax. Por debajo imagen obtenida con la sonda en posición oblicua, en la cual no se observan las sombras acústicas costales.
Otro tipo de líneas verticales son las líneas E (“E” por enfisema) que corresponden al enfisema subcutáneo. Estas líneas son causadas por la presencia de gas en el tejido subcutáneo por lo que, a diferencia de las líneas B, se observarán por arriba de la pleura.
Por el contrario, cuando la pérdida de la aireación en el espacio alveolar es completa (consolidación) desaparece la diferencia en la impedancia acústica entre ambos tejidos y por consiguiente, el fenómeno de reflexión especular, generándose una imagen real. El USP es altamente sensible a las variaciones en el contenido de aire y fluidos pulmonares actuando como un verdadero densitómetro del parénquima pulmonar[6]; puede detectar alteraciones en la aireación que causan colapso alveolar sin edema o inflamación pulmonar como ocurre en las atelectasias y el exceso en la fluidoterapia endovenosa.
A continuación, desarrollaremos los diferentes patrones pulmonares para el estudio de las principales enfermedades respiratorias en el paciente con fallo respiratorio agudo. Los signos sonográficos se encuentran resumidos en la Tabla 3.
-
Neumotórax
El método de referencia para su diagnóstico es la tomografía. El USP permite realizar el diagnóstico y evaluar su evolución de una manera rápida, a la cabecera del paciente y sin radiación; particularmente beneficioso en pacientes inestables en cuidados intensivos o cuando existe sospecha diagnóstica durante el intraoperatorio.
El USP es más sensible y a la vez permite un diagnóstico más rápido que la radiografía de tórax; si bien ambos métodos diagnósticos poseen elevada especificidad. La sensibilidad reportada por numerosos estudios para el USP es de 88,9%-92%[13]-[14], mientras que para la radiografía convencional es de 52%[14].
Dentro de las limitantes de esta técnica debemos mencionar la imposibilidad de reconocer un neumotórax en área mediastínica o posterior y cuando existe enfisema subcutáneo. En este último caso, el aire localizado en el tejido subcutáneo obstaculiza la visión hacia estructuras más profundas (reparos costales, línea pleural) y genera artefactos verticales ecogénicos denominados “líneas E”. En un paciente politraumatizado con fracturas costales la presencia de enfisema subcutáneo es un signo indirecto de neumotórax.
El examen debe comenzar con el paciente en posición supina, la sonda de elección es la lineal debido a que posee gran resolución en campos próximos, o la sonda convex que también permite visualizar la pleura en gran extensión. Colocaremos la sonda en posición longitudinal para reconocer fácilmente los reparos anatómicos “signo el murciélago” e identificar la línea pleural, posteriormente, podemos rotarla en posición oblicua para visualizar la línea pleural en toda su extensión. Debido al efecto gravitacional, el aire se localizará preferentemente en la región anterior del tórax, por dicho motivo nuestra exploración comenzará a nivel del 2° y 4° espacio intercostal entre las líneas paraesternal y medioclavicular; identificaremos los signos sonográficos de neumotórax, si existen dudas podemos comparar los hallazgos con el lado contralateral para facilitar la interpretación. Posteriormente, deslizaremos el transductor hacia la línea axilar y áreas más laterales para constatar la extensión del mismo ( Figura 5 ).
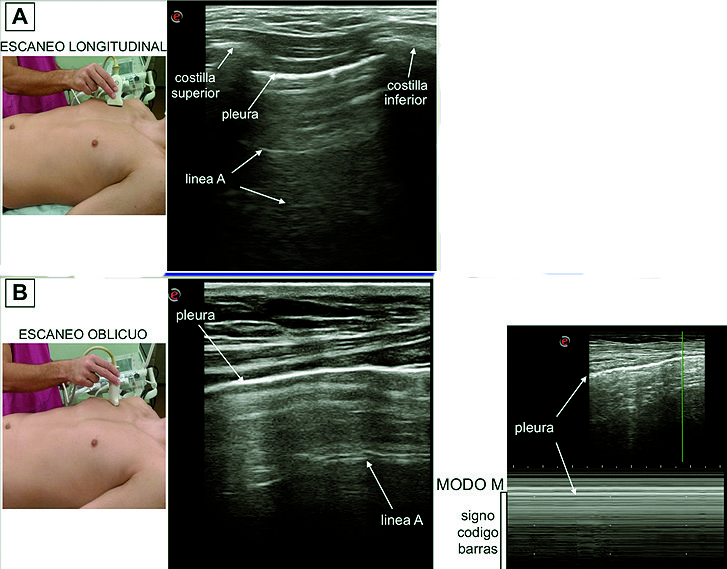
Figura 5. A: Modo B, escaneo longitudinal con sonda lineal HF 6-12 MHz: para reconocer reparos anatómico costales y línea pleural, visualización de líneas A generadas por la presencia de aire por debajo de la pleura parietal; B: Escaneo oblicuo, A la izquierda modo B, a la izquierda: signo del “código de barras”.
Para realizar el diagnóstico de esta entidad en un paciente hemodinámicamente estable, debemos seguir el algoritmo propuesto por el Consenso de Expertos reconociendo tres signos con valor predictivo negativos y un signo con valor predictivo positivo[11],[13] ( Figura 6 ).
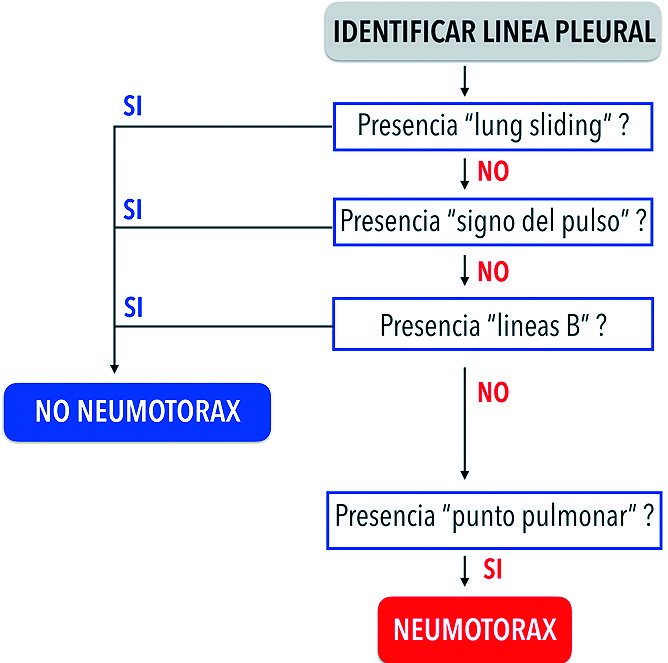
Figura 6. Algoritmo diagnóstico de neumotórax.
A continuación, describiremos los tres signos sonográficos con alto valor predictivo negativo:
• La presencia del lung sliding en áreas anteriores excluye el diagnóstico de neumotórax con un valor predictivo negativo de 100%[11]. El modo M permite objetivar el movimiento de la pleura, evidencia la ausencia del “signo de la playa” y la aparición del “signo del código de barras” llamado también signo de “la estratósfera”. Este signo es poco específico y no se encuentra dentro del algoritmo diagnóstico propuesto por el Consenso de Expertos[11]. La ausencia de lung sliding no es patognomónica de neumotórax, podemos observarla en un paciente en apnea, intubación selectiva, grandes consolidaciones pulmonar, pleurodesis, fibrosis pulmonar, síndrome de distrés respiratorio agudo (SDRA) y pacientes en ventilación mecánica con elevados niveles de presión positiva[13].
• La presencia del “signo de pulso pulmonar”[26] descarta el neumotórax. Se caracteriza por la ausencia de “lung sliding” y la presencia de un movimiento de la línea pleural sincrónico con la frecuencia cardiaca del paciente. Constituye el signo de la atelectasia completa, donde el pulmón atelectasiado transmite los latidos cardíacos ( Figura 7 ).
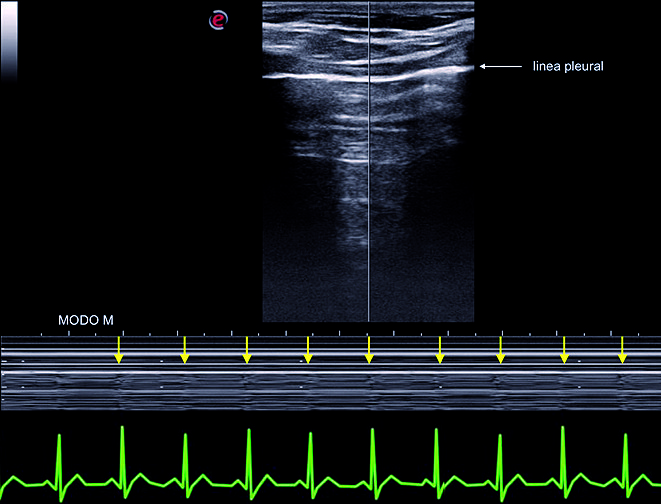
Figura 7. Escaneo longitudinal de la región anterior izquierda del tórax con sonda lineal HF 6-12 MHz en un paciente con intubación selectiva del bronquio derecho. En la parte superior imagen en modo B, en la inferior modo M evidencia un artefacto que se repite coincidente con la frecuencia cardíaca del paciente, evidenciando el “signo del pulso” pulmonar. Este artefacto se ve como una distorsión vertical en la imagen del modo M en cada latido.
• La presencia de una línea B descarta el diagnóstico de neumotórax con valor predictivo negativo de 100%.
El único signo con alto valor predictivo positivo:
• La presencia del “signo del punto pulmonar” es 100% específico de neumotórax. Representa la transición entre el aire contenido entre la pleura parietal y visceral del pulmón. Nos indica la extensión del neumotórax. Volpicelli y su grupo estudiaron el potencial del USP para cuantificar el tamaño del neumotórax, y encontraron que el “punto pulmonar” a nivel de la línea axilar media o posterior predijo un colapso pulmonar mayor al 15% cuantificado por tomografía, con una sensibilidad de 83,3% y especificidad de 82,4%; además, evidenciaron que el USP supera a la radiografía convencional para cuantificar el porcentaje de pulmón colapsado en neumotórax grandes utilizando tomografía volumétrica[15]. Oveland y col., reportó que el deslazamiento lateral del “punto pulmonar” es un indicador de progresión del neumotórax durante la ventilación invasiva, lo que destaca la utilidad para monitorizar el tamaño del neumotórax y decidir cuándo drenarlo[16].
Ante la sospecha de un neumotórax en un paciente inestable hemodinámicamente la ausencia de los tres primeros signos que hemos descripto con valor predictivo negativo en áreas anterior-inferior de alguno de los dos hemitórax permiten realizar un rápido diagnóstico y tratamiento sin necesidad de buscar el “signo del punto pulmonar”[13].
El USP posee gran importancia diagnóstica y terapéutica, ya que permite evidenciar o descartar un posible neumotórax, predecir el grado de colapso pulmonar y realizar el drenaje bajo guía ecográfica de una manera más segura. Además, es posible realizar un seguimiento de la evolución del neumotórax y verificar su resolución.
-
Derrame pleural
Debido a que es importante evaluar la extensión del derrame pleural, la exploración sonográfica del tórax debe realizarse con una sonda de baja frecuencia como la convex, microconvex o sectorial, las cuales permitirán obtener una imagen con la profundidad necesaria. El líquido se visualizará como una imagen anecoica entre la pleura parietal y visceral; su ecogenicidad va a diferir de acuerdo a las características del derrame, de tal manera que en el trasudado observaremos una imagen anecoica mientras que el exudado puede ser anecoico, o presentarse como una imagen difusamente ecogénica con ecos internos. Los derrames complejos o difusamente ecogénicos son siempre exudados y se corresponden habitualmente con hemotórax o empiemas, es posible observar la presencia de ecos internos y septos de fibrina en derrames tabicados.
El paciente debe examinarse en decúbito supino, colocaremos la sonda en el seno costo-diafragmático y observaremos el diafragma y por encima el derrame pleural y el pulmón. Lichtenstein propone en su protocolo BLUE un punto estandarizado para buscar el derrame llamado “punto postero-lateral síndrome pleural y/o alveolar” (PLAPS-point)[2],[12] ( Figura 8D ). Este punto se encuentra delimitado por dos líneas: una línea horizontal que se traza a nivel de la mamila y que se continúa, posteriormente, hasta la intersección con una línea vertical que corresponde a la línea axilar posterior; en este punto es posible detectar derrames pleurales pequeños y grandes y el 90% de las consolidaciones alveolares presentes en pacientes críticos[2].
Dentro de los signos sonográficos asociados al derrame pleural podemos mencionar:
• El “signo del sinusoide”, es un signo dinámico que posee una especificidad de 97% para el diagnóstico de derrame pleural. Utilizando el modo M observaremos un movimiento de aproximación y alejamiento de la pleura visceral hacia la pleura parietal durante el ciclo respiratorio[12]. Este movimiento se ve disminuido o ausente cuando se incrementa la densidad del líquido del derrame como ocurre en los exudados o derrames tabicados ( Figura 8A ).
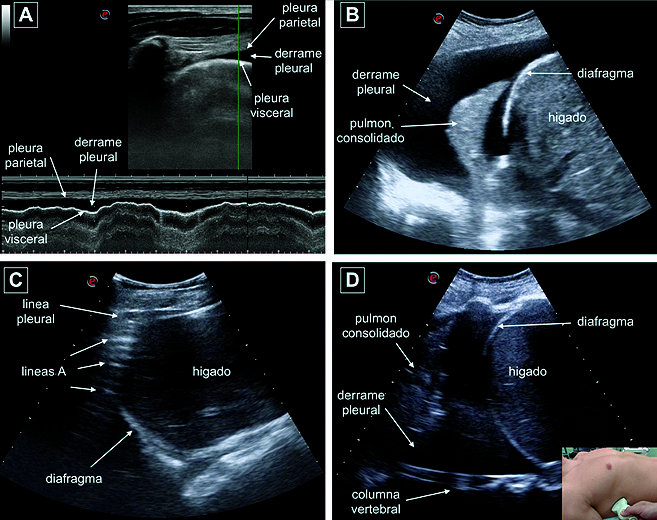
Figura 8. A: Modo M: “signo del sinusoide”; B: Derrame pleural, consolidación pulmonar “signo de la medusa”; C: Ausencia de derrame pleural evidenciado por el “signo de la cortina”; D: Derrame pleural severo, “signo del raqui desnudo”.
• El “signo de la medusa” (jellyfish sign), refleja el movimiento ondulante que presenta el pulmón consolidado rodeado por el derrame ( Figura 8B ).
• El “signo de la cortina”, se observa en el seno costo-diafragmático cuando existe ausencia de derrame. Durante cada inspiración los artefactos originados por el pulmón aireado impiden identificar el diafragma y órganos abdominales ( Figura 8C ).
• El “signo del raqui desnudo”, se observa a nivel del seno costo-diafragmático cuando existe derrame pleural. La presencia del líquido a nivel pleural permite la transmisión del ultrasonido hacia estructuras profundas identificando la columna vertebral ( Figura 8D ).
El USP no solo permite realizar el diagnóstico del derrame pleural identificando pequeñas cantidades de líquido (5-20 ml) con una sensibilidad de 92%-100% y una especificidad de 93-100%[7] sino también evaluar la naturaleza del mismo, estimar el volumen[17],[18] y definir el área donde realizar la toracocentesis de una manera más certera que la radiografía de tórax[19].
La cuantificación del derrame a través de la auscultación y la radiografía de tórax frecuentemente constituye un desafío. Un método simple utilizado en pacientes en ventilación mecánica consiste en medir en milímetros la distancia máxima entre la pleura parietal y visceral a nivel de la línea axilar posterior, con el paciente en posición supina y la cabecera a 15º. Esta distancia multiplicada por 20 nos predice el volumen del derrame en mililitros[17]. Mientras que, en pacientes en ventilación espontánea, es posible medir en decúbito supino la distancia máxima del derrame entre pleura parietal y visceral; el valor obtenido debe ser multiplicado por 48 y luego al resultado debemos restarle 840. Según este método una distancia de 20 mm se corresponde con un volumen aproximado de 400 ml, mientras que una distancia de 40 mm con un volumen de 1.000 ml[18].
Sin embargo, desde el punto de vista clínico es más relevante considerar la repercusión que genera el derrame en la mecánica respiratoria del paciente que el valor absoluto del volumen del derrame pleural. El diagnóstico de un derrame pleural severo durante el perioperatorio es de gran importancia en el paciente quirúrgico de alto riesgo, ya que la indicación de una toracocentesis previa a la inducción anestésica previene una situación crítica asociada a la interacción corazón-pulmón. Por otro lado, la persistencia del derrame pleural en el postoperatorio puede ocasionar insuficiencia respiratoria, aumento del trabajo respiratorio, fallo en el weaning, atelectasias, hipoxemia y complicaciones neumónicas por lo que es relevante monitorizar su resolución en el tiempo.
-
Síndrome intersticial
El incremento en la densidad del pulmón puede ser causado por un aumento de su peso como en el caso del incremento del agua pulmonar extravascular, depósito de colágeno, proteínas o sangre; o a pérdida en la aireación pulmonar como ocurre en las atelectasias. Las líneas B son extremadamente dinámicas, su aparición y resolución se asocian con cambios en la densidad pulmonar. Pueden estar presentes en 10% en pacientes sanos, y hasta en 37% en ancianos[20]. El USP no es capaz de distinguir cuál es la naturaleza del fluido que se acumula, si el tejido que prolifera es fibrótico o infiltrativo, o si el mecanismo que produce el paso de líquidos desde el vaso al intersticio es hidrostático o por aumento de la permeabilidad[11]. Por consiguiente, es fundamental a la hora de realizar un diagnóstico diferencial relacionar los diferentes hallazgos sonográficos con el contexto clínico del paciente y otros métodos diagnósticos.
Para el estudio del síndrome intersticial podemos utilizar una sonda convex o sectorial en pacientes adultos y una sonda lineal en neonatos y niños. La exploración sonográfica del tórax se realiza examinando 8 áreas propuestas por Volpicelli, delimitando regiones anteriores y laterales a través del trazado de las líneas paraesternal, axilar anterior y posterior, dichas regiones se subdividen en superior e inferior[1]-[11]. La identificación de menos de dos regiones positivas por hemitórax evidencian un patrón A, mientras que dos o más regiones positivas por cada hemitórax sugieren un patrón B[11].
El síndrome intersticial representa un gran número de entidades heterogéneas con compromiso del intersticio pulmonar y deterioro de la capacidad de intercambio gaseoso alvéolo-capilar, las cuales conducen en mayor o menor medida al fallo respiratorio severo. Tales condiciones pueden presentarse de manera aguda o crónica.
El síndrome intersticial se clasifica en focal o difuso según su presentación:
1. Síndrome intersticial focal se caracteriza por un patrón sonográfico de múltiples líneas B localizadas de una manera focal, podemos encontrarlo en las siguientes entidades: neumonía y neumonitis, atelectasias, contusión pulmonar, infarto pulmonar, enfermedad pleural y neoplasias.
2. El síndrome intersticial difuso representa una serie de entidades que se caracterizan por presentar un patrón sonográfico de líneas B en dos o más áreas en ambos hemitórax, puede estar presente en:
• Edema pulmonar cardiogénico: el US detecta el agua pulmonar extravascular. Las líneas B presentan una distribución homogénea, difusa en áreas anterolateral de ambos hemitórax, la línea pleural se observa bien definida y suele asociarse a derrame pleural. El número de líneas B se incrementa a medida que aumenta la severidad del edema pulmonar[21] ( Figura 9A ).
• Edema pulmonar no-cardiogénico: es causado por alteración en la permeabilidad; aparece en: injuria pulmonar aguda, SDRA y síndromes inflamatorios asociados a procesos infecciosos. Las líneas B presentan una distribución no homogénea, asociadas a anormalidades en la línea pleural, consolidaciones subpleurales anteriores y áreas pulmonares respetadas ( Figura 9B ).
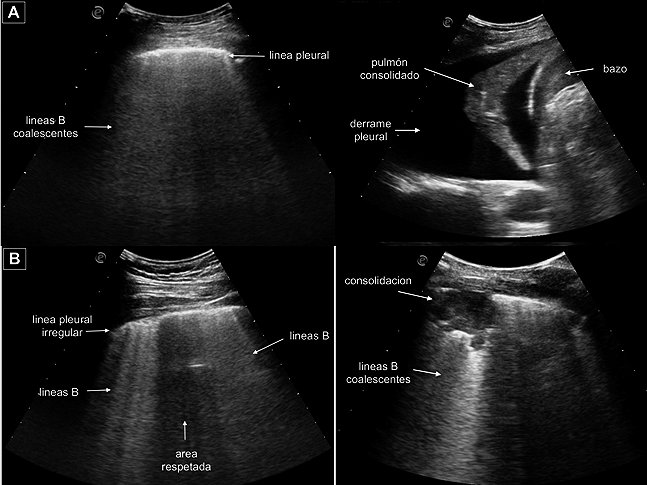
Figura 9. Cortes oblicuos obtenidos con sonda convex 2-6 MHz. A: Patrón característico de edema pulmonar cardiogénico: líneas B coalescentes, línea pleural regular. En seno costo-diafragmático derecho se observa derrame pleural asociado; B: Patrón sonográfico característico de SDRA: distribución no-homogénea de líneas B, asociado a áreas respetadas, línea pleural irregular. En áerea posterior se observa consolidación alveolar asociada a líneas B coalescentes.
• Neumonía intersticial o neumonitis viral, caracterizada por la presencia de líneas B de distribución focal o difusa y consolidaciones subpleurales de diferentes tamaños[22],[23].
• Enfermedades intersticiales difusas del parénquima pulmonar[9]. El hallazgo sonográfico de múltiples líneas B posee una elevada correlación con los signos de fibrosis evidenciados por tomografía computada[17]. Las líneas B presentan una distribución no homogénea, línea pleural irregular con pequeñas consolidaciones subpleurales; en estadios tempranos afecta preferentemente áreas posteriores y basales.
• Neumonía por COVID-19, posee signos sonográficos características de una neumonía viral. Se discutirá más adelante en este artículo.
-
Evidencia clínica y valor pronóstico de las líneas B en el paciente con insuficiencia cardíaca
Las líneas B poseen una sensibilidad de 94% y especificidad de 92% para el diagnóstico de disnea de origen cardiogénico en el departamento de emergencias[24]. Numerosos estudios han reportado una elevada correlación entre las líneas B y el agua pulmonar extravascular medidos por método de termodilución[25]-[29], presión de enclavamiento pulmonar, medidas con catéter de Swan-Ganz[24],[27], niveles de péptido natriurético[37] y hallazgos ecocardiográficos de insuficiencia cardíaca[29]. Existe una relación inversa entre el número de líneas B y los parámetros de función sistólica y diastólica del ventrículo izquierdo. La presencia de múltiples líneas B se asocia a disfunción sistólica y/o diastólica del ventrículo izquierdo y es altamente indicativo de congestión pulmonar de origen cardíaco[26]. Sin embargo, para cada grado de disfunción cardíaca, la respuesta del lecho vascular pulmonar puede ser variable. De esta manera, la presencia de múltiples líneas B en pacientes con presiones de llenado elevadas de ventrículo izquierdo son indicativas de fallo en la membrana alvéolo-capilar, lo cual conduce a redistribución del líquido dentro del parénquima pulmonar, manifestándose ecográficamente a través de las líneas B; mientras que la ausencia de las mismas es indicativo de congestión hemodinámica con una membrana alvéolo-capilar intacta. Un estudio multicéntrico prospectivo que incluyó pacientes de cuidados intensivos que requirieron monitorización invasiva; Volpicelli y su grupo reportaron que si bien las líneas B permiten predecir la congestión pulmonar indicada por el agua pulmonar extravascular medida por el método de termodilución transpulmonar, presentan una utilidad limitada para predecir congestión hemodinámica indicada por la presión de enclavamiento pulmonar, contrario a lo reportado en otros estudios[26].
La presencia de un patrón sonográfico con ausencia de líneas B en campos anteriores indica que el paciente puede “tolerar la administración de fluidos”, de esta manera el USP se posiciona como una herramienta útil para realizar una primera evaluación del estado hemodinámico en el paciente crítico. Por el contrario, el USP no permite predecir si el paciente es “respondedor a fluidos”, tal información puede ser obtenida a través de signos ecocardiográficos.
El estudio de las líneas B poseen un valor pronóstico relevante en el diagnóstico de pacientes con fallo cardíaco agudo[29],[32], síndrome coronario agudo[21],[31] e insuficiencia renal crónica en hemodiálisis[33].
En un estudio realizado en pacientes hospitalizados por insuficiencia cardiaca, Coiro y su grupo reportaron que la persistencia de líneas B al momento del alta hospitalaria es un factor predictor independiente de mortalidad a corto plazo y de rehospitalización por fallo cardiaco[32]. Sólo el 45% de la población estudiada presentó una fracción de eyección de ventrículo izquierdo inferior a 40%, lo que destaca la potencial utilidad de las líneas B en el manejo de pacientes con insuficiencia cardiaca y fracción de eyección preservada. Gargani y su grupo obtuvieron similares resultados reportando que la persistencia de congestión pulmonar, evidenciada por líneas B al momento del alta, predice la rehospitalización a los tres y seis meses[34]. Ambos estudios evidencian el valor predictivo independiente no solo pronóstico, sino también predictor de eventos, en tanto que la ausencia o la presencia de escasas líneas B identifica a pacientes con un riesgo extremadamente bajo de ser re hospitalizados por insuficiencia cardiaca.
El USP permite detectar en pacientes con pre-eclampsia severa la presencia de congestión pulmonar y aumento de las presiones de fin de diástole; por lo que el hallazgo de patrón B debería alentar la restricción hídrica[35].
El estudio de las líneas B a través de USP se encuentra incluido dentro de las recomendaciones de la Asociación Europea de Imagen Cardiovascular y la Asociación de Cuidados Cardiovascular Agudo para el diagnóstico diferencial del paciente con disnea aguda desde el año 2013[36]. Un artículo publicado recientemente por el Grupo de Estudio de Fallo Cardiaco Agudo de la Sociedad Europea de Cardiología y la Asociación de Cuidado Cardiovascular Agudo, destaca el rol de la ecocardiografía y USP en el manejo del paciente con insuficiencia cardíaca aguda y shock cardiogénico, ya que permiten una rápida evaluación del paciente crítico, mejora la agudeza diagnóstica, guía y monitoriza la respuesta a intervenciones y como hemos mencionado anteriormente aporta información pronóstica[37].
-
Consolidación alveolar
El USP posee una elevada sensibilidad (90% al 100%) para el diagnóstico de consolidaciones alveolares en el paciente crítico[2],[7]. Debemos recordar que por ser una técnica de superficie, solo es posible visualizarlas cuando las mismas están en contacto con la superficie pleural. Es mandatorio identificar el diafragma para certificar que la imagen de consolidación sea intra-torácica y evitar un diagnóstico erróneo.
En pacientes adultos la utilización de sondas de baja frecuencia convex o sectorial permiten una mejor visualización de la extensión de la consolidación; sin embargo, para el estudio de consolidaciones subpleurales la sonda lineal es de elección por la gran resolución que posee en campo proximal. En pacientes pediátricos y neonatos debido a las dimensiones del tórax utilizaremos una sonda lineal.
Cuando ocurre pérdida severa del aire alveolar o incremento en el contenido de fluidos, el ultrasonido puede ser fácilmente propagado, generando una imagen real con una elevada resolución similar a otras técnicas de imagen más avanzadas como la tomografía computada o resonancia magnética. El USP posee mayor certeza diagnóstica que la radiografía para el diagnóstico de consolidaciones[11].
La imagen sonográfica de la consolidación aparece como una región hipoecoica subpleural o una ecotextura homogénea similar al hígado[11]; con borde irregular en la mayoría de las consolidaciones, denominado “signo del margen fragmentado” (shred sign)[11],[12] ( Figura 10A, D ). El deslizamiento pleural se encuentra preservado en las consolidaciones pequeñas mientras que en las grandes está ausente, apareciendo el “signo del pulso”, generado por la transmisión del latido cardíaco sobre el parénquima pulmonar consolidado.
Dentro de los signos sonográficos que permiten realizar el diagnóstico diferencial de las diversas causas de la consolidación podemos mencionar: las características de los márgenes profundos de la consolidación, en forma de cuña, irregular o bordes romos, líneas B que se originan de las consolidaciones subpleurales, broncogramas aéreos y broncogramas fluidos y patrón vascular dentro de la consolidación ( Figura 10 ).
Podemos clasificar las consolidaciones según la etiología que le dio origen:
• Consolidaciones de origen inflamatorio: neumonía.
• Consolidaciones de origen mecánico: atelectasias obstructivas o compresivas.
• Consolidaciones de origen neoplásico: cáncer pulmonar, metástasis.
• Consolidaciones de origen vascular: infarto pulmonar ocasionado por un embolismo.
• Consolidaciones de origen traumático: contusión pulmonar.
-
Neumonía
El pulmón con una consolidación neumónica en un estadio precoz presenta un patrón, una ecotextura homogénea similar al hígado con bordes irregulares, dentados y borrosos ( Figura 10B, C, E ). A medida que va evolucionando en el tiempo el USP permite identificar diferentes patrones de aireación evidenciando o no la adecuada respuesta a la antibioticoterapia[38]. La presencia de “broncograma aéreo dinámico” prácticamente descarta la posibilidad de que la consolidación sea una atelectasia, con una especificidad de 94% y un valor predictivo positivo de 97% para el diagnóstico de neumonía vs atelectasia[39]. Los broncogramas aéreos se evidencian sonográficamente como estructuras tubulares hiperecoicas o lenticulares dependiendo si realiza una sección longitudinal o transversa del bronquio. En la neumonía los broncogramas aéreos dinámicos se observan como una imagen con realce hiperecoico coincidente con la inspiración, denotando el aire en el interior de los bronquios. En el caso de las atelectasias el gas que se encuentra en los bronquios no es reabsorbido completamente y se visualiza a través de la presencia de “broncogramas aéreos estáticos”, dicho signo posee una sensibilidad de 94% para el diagnóstico de atelectasias, pero una baja especificidad, ya que la neumonía puede mostrar este patrón en 40% de los casos[40]. Cuando existen grandes consolidaciones se observa el “signo del pulso”. Con doppler color es posible evidenciar la presencia de estructuras vasculares con patrón regular ramificado[10] ( Figura 10C ).
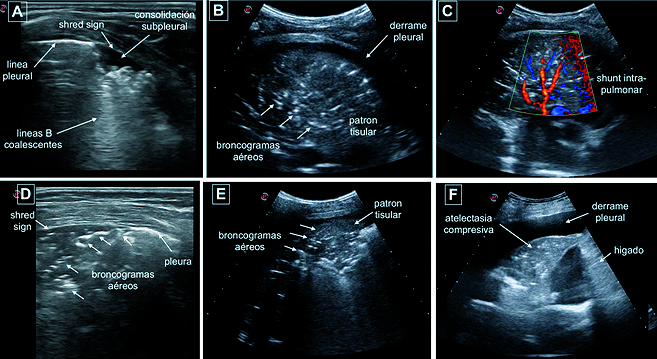
Figura 10. A: Imagen de atelectasia asociada a anestesia general en paciente pediátrico, obtenida con sonda lineal HF 6-12 MHz. Se observa consolidación subpleural, “shred sign” con broncogramas aéreos puntiformes y líneas B que nacen de dicha consolidación; B y C: Imagen obtenida con sonda convex 2-6 MHz: consolidación con “patrón tisular”, se observan broncogramas aéreos, pequeño derrame pleural y presencia de shunt intrapulmonar utilizando doppler color en paciente con neumonía bacteriana; D: Imagen de atelectasia asociada a anestesia general obtenida con sonda lineal HF 6-12 MHz. Se observa consolidación subpleural, “shred sign” con broncogramas aéreos laminares y puntiformes; E: Imagen obtenida con sonda convex 2-6 MHz: consolidación con “patrón tisular”, broncogramas aéreos con patrón arboriforme característico de neumonía bacteriana; F: Imagen obtenida con sonda convex 2-6 MHz: atelectasia pulmonar compresiva debido a derrame pleural severo.
El USP constituye una herramienta relevante para el diagnóstico y monitorización de la evolución de la neumonía; detecta, además, complicaciones asociadas como derrames paraneumónicos característicos de neumonías bacterianas, abscesos, enfisema, etc. La sensibilidad y especificidad del USP para el diagnóstico de neumonía adquirida de la comunidad (NAC) es de 93,4% y 97,7% respectivamente, según un estudio multicéntrico realizado por Reissig y su grupo[40]. El USP ha demostrado también ser una valiosa herramienta en el diagnóstico temprano de la neumonía asociada a respirador, según un estudio multicéntrico realizado por Mongodi y su grupo[41].
El examen sonográfico del pulmón en pacientes en cuidados intensivos demostró ser efectivo en reducir el número de radiografías de tórax, costos médicos y la exposición a radiación, sin afectar el resultado[42].
-
Atelectasias
Existen dos tipos de atelectasias de origen mecánico:
• Las atelectasias compresivas se asocian a grandes derrames pleurales. Cuando son extensas es posible evidenciar el signo del pulso[12]. Sonográficamente se visualiza el tejido pulmonar con forma de un gorro puntiagudo, flotando en el derrame, conocido como “signo de la medusa” cuya forma y movimiento se modifica con el ciclo respiratorio. Pueden evidenciarse broncogramas aéreos estáticos como artefactos hiperecoicos puntiformes o lineales, a diferencia de los broncogramas arboriformes y dinámicos característicos de las neumonías ( Figura 10F ).
• Las atelectasias obstructivas son producidas por obstrucción al flujo aéreo en bronquios centrales o periféricos. Pueden presentar broncogramas fluidos, descriptos como estructuras tubulares con un contenido hipoecoico o anecoico y en raras ocasiones broncogramas aéreos estáticos[37]. Con la utilización de doppler color se observa un patrón vascular regular paralelo a los bronquios[10] ( Figura 10B, C, E ).
-
Infarto pulmonar
El USP puede evidenciar consolidaciones subpleurales características de TEP con una sensibilidad de 74% y especificidad de 95% comparada con la angio-tomografía[43]. Dichas consolidaciones poseen una morfología triangular con base en la línea pleural y márgenes agudos. Si aplicamos doppler color a nivel de la consolidación identificaremos la ausencia característica de flujo sanguíneo. La precisión diagnóstica del US multiorgánico, que combina el USP, ecocardiografía y ecografía de venas, posee una sensibilidad y especificidad de 90% y 86,2% respectivamente, siendo superior que cada una de estas técnicas por separado[44].
-
Síndrome de distrés respiratorio agudo
El SDRA caracterizado por una injuria pulmonar aguda con una alteración en la aireación e incremento en la permeabilidad vascular y en el peso del parénquima pulmonar, constituye una entidad clínica que se presenta con hipoxemia, opacidades bilaterales detectadas con radiografía o tomografía de tórax y disminución de la complacencia pulmonar e incremento del espacio muerto alveolar. En la Tabla 4 se describen los principales patrones sonográficos que permiten realizar el diagnóstico diferencial entre SDRA y edema pulmonar de origen cardiogénico[45] ( Figura 9B ). El área donde los recursos son limitados, se ha propuesto una definición de SDRA utilizando USP, donde los hallazgos de infiltrados bilaterales observados en la radiografía de tórax son reemplazados por un patrón bilateral de líneas B y/o consolidaciones pulmonares[46], integrando siempre el cuadro clínico del paciente para optimizar la agudeza diagnóstica de esta herramienta.
En este escenario el USP permite no solo detectar el compromiso focal o difuso del parénquima pulmonar, sino también monitorizar la evolución de la enfermedad, repitiendo la exploración para evaluar la respuesta a las diferentes terapéuticas sin necesidad de traslados, evitando complicaciones relacionadas a la desconexión al respirador e inestabilidad hemodinámica.
Bouhemad y su grupo idearon un score para evaluar los cambios en la aireación pulmonar a través de diferentes patrones sonográficos analizando doce áreas pulmonares ( Figura 1 )[3],[38]. Dicho score ha mostrado una correlación estadísticamente significativa frente a los cambios de aireación pulmonar medidos con tomografía en pacientes con neumonía[38] y la tradicional curva presión/volumen en pacientes con SDRA e injuria pulmonar aguda[3].
El score de aireación se basa en la identificación de cuatro patrones sonográficos ( Figura 11 ):
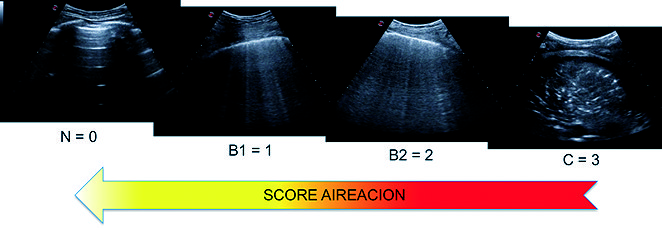
Figura 11. Imágenes obtenidas con sonda convex 2-6 MHz. Score de aireación. N: patrón aireación normal; B1: múltiples líneas B, pérdida moderada de la aireación; B2: líneas B confluentes, pérdida severa de la aireación; C: consolidación, pérdida total de la aireación.
• N: patrón normal con líneas A y deslizamiento pulmonar.
• B1: pérdida moderada de la aireación con múltiples líneas B.
• B2: pérdida severa de la aireación con líneas B coalescentes.
• C: pérdida completa de la aireación con consolidación pulmonar.
Soummer y su grupo utilizaron el score de aireación para evaluar el proceso de weaning. Examinaron las doce áreas utilizando los cuatro patrones sonográficos descriptos por Bouhemad y col., aplicando un score de 0 a 3 para cada área examinada, donde 0: equivale al patrón normal (N); 1: pérdida moderada de la aireación con múltiples líneas B (B1); 2: pérdida severa de la aireación con líneas B coalescentes (B2) y 3: patrón de consolidación alveolar (C), estableciendo finalmente un score de 0 a 36 ( Figura 11 ). Reportaron que un score de aireación < a 13 permite predecir una extubación exitosa, mientras que un score > a 17 al finalizar el test de respiración espontánea es predictivo de distrés postextubación[47].
Un reciente estudio multicéntrico realizado en pacientes ancianos con riesgo elevado de fallo en el weaning o extubación evidencia que el score de aireación realizado con USP en áreas antero-laterales y no la ecocardiografía, puede ayudar a predecir el resultado del weaning[48].
Este score de aireación utilizado en pacientes adultos también puede ser adaptado al paciente pediátrico. De esta manera es posible evaluar la eficacia de un tratamiento a través de la mejoría o deterioro del score de aireación pulmonar luego de aplicar una determinada estrategia ventilatoria o implementar alguna otra terapéutica determinada[49].
-
Neumonía por COVID-19
La neumonía viral ocasionada por el SARS-CoV-2 fue declarada pandemia por la Organización Mundial de la Salud (OMS) desde el 13 de marzo de 2020, se caracteriza por presentar un cuadro clínico inicial con fiebre, tos seca y disnea con un amplio espectro de severidad. Según datos publicados por la OMS, el 80% de los pacientes presentan síntomas leves, aproximadamente 14% requiere hospitalización presentando enfermedad severa y 5% son enfermos críticos[50]. Esta neumonía viral se caracteriza por una severa hipoxemia asociada frecuentemente a una complacencia respiratoria prácticamente normal en más de 50% de los casos, diferenciándose así del SDRA[51]. La presentación de esta enfermedad no es uniforme, algunos pacientes presentan una hipoxemia silente mientras que otros cuadros de hipoxemia severos con rápida progresión. Gattinoni y col., identifican dos tipos diferentes de fenotipos para un mejor manejo de estos pacientes: 1) el fenotipo L se caracteriza por presentar una elevada complacencia, baja relación V/Q, bajo peso pulmonar evidenciando edema intersticial modesto a nivel subpleural (áreas de vidrio esmerilado) en la tomografía de tórax y baja reclutabilidad; 2) el fenotipo H (20%-30% de la serie de casos) posee criterios de SDRA severo con hipoxemia, infiltrados bilaterales, disminución de la complacencia pulmonar, elevado shunt de derecha a izquierda, en el análisis cuantitativo realizado con tomografía muestra marcado incremento del peso pulmonar e incremento de la cantidad de tejido no aireado como en un SDRA severo, con elevada reclutabilidad[51].
Sin embargo, Bos y colaboradores, en un estudio retrospectivo en pacientes COVID-19, realizaron una tomografía de tórax posterior a la intubación endotraqueal y encontraron que la mayoría de los pacientes (63%) presentaron resultados discordantes, no pudiendo ser clasificado como fenotipo L o H[52]. Coincidentemente con estos hallazgos, un estudio prospectivo multicéntrico realizado en España, evidencia que el SDRA observado en el COVID-19 es de presentación muy heterogénea, con múltiples combinaciones de lesiones y de comportamiento clínico que obliga al médico tratante a personalizar el tratamiento ventilatorio[53].
El test diagnóstico de laboratorio se basa la reacción en cadena de la polimerasa con transcriptasa inversa, conocido como “RT-PCR”, el tiempo en obtenter el resultado es de 24 horas y posee una sensibilidad que oscila entre 60%-94%[54]. Dentro de los métodos de imágenes, la tomografía de tórax es el recomendado. Datos reportados en un estudio realizado por Fang y colaboradores indican que la tomogafía posee una sensibilidad de 98% comparado con la RT-PCR (71%) para el diagnóstico de infección por COVID-19[55]. En el contexto de una pandemia, no es factible realizar tomografía a todos los pacientes con hipoxemia que concurren al departamento de emergencia; por otro lado, el traslado al departamento de imágenes, de pacientes críticos en ventilación mecánica con hipoxemia severa puede ser riesgoso, además, de exponer a un número mayor de personal sanitario favoreciendo la aparición de infecciones nosocomiales.
Numerosas publicaciones destacan la elevada sensibilidad y especificidad del USP para el diagnóstico de patologías pulmonares intersticiales, las cuales se caracterizan por una afección periférica del parénquima pulmonar[1],[11]. De igual manera, en pacientes con SDRA[2],[7], el USP permite evidenciar cambios en la densidad de la superficie pulmonar detectados por la tomografía axial y que pueden permanecer ocultos en un porcentaje elevado de radiografías de tórax[7],[11],[12]. Estudios realizados tanto en pacientes adultos como pediátricos durante la pandemia ocasionada por el virus de influenza N1H1 en el 2009, destacan el beneficio de esta herramienta para el diagnóstico diferencial de la neumonía viral[22],[23].
La pandemia ocasionada por el brote de COVID-19 caracterizada por una rápida transmisión y elevada tasa de infección y mortalidad, exige planificar una estrategia de manejo en nuestros hospitales destinada a un cuidado óptimo de estos pacientes y a la vez implementar medidas para reducir la transmisión intrahospitalaria y el riesgo de exposición para los trabajadores de salud[56]. Según reportes de la OMS el personal médico representa 11% de los infectados, presentando variaciones importantes en algunos países[50].
En este contexto, el USP puede ser una herramienta segura para el diagnóstico y monitorización de los pacientes con COVID-19, reemplazando así el uso del estetoscopio[57] que posee en este escenario alto riesgo de contaminación, y complementando el uso de la radiografía y tomografía de tórax. Un único profesional puede realizar un examen clínico visualizando el pulmón, registrando a la vez imágenes y videos, sin necesidad de traslado del paciente al departamento de imágenes, disminuyendo así el riesgo de contaminación nosocomial.
Es posible utilizar sondas ecográficas inalámbricas y una tablet envueltas cada una de ellas por una cobertura de plástico para evitar la contaminación con otros pacientes[57],[69]. Sin embargo, podemos utilizar también los equipos ecográficos con que habitualmente trabajamos cubriéndolos con una funda de nylon, y descontaminándolos con solución alcohólica antes y después de examinar cada paciente.
El análisis de datos de imágenes tomográficas disponibles de pacientes con COVID-19 muestran lesiones bilaterales extensas, parcheadas y confluentes de áreas en vidrio esmerilados o un patrón mixto de consolidaciones y áreas en vidrio esmerilado con distribución periférica. Son frecuentes lesiones en forma de cuña con base pleural. Las consolidaciones de mayor dimensión presentan broncogramas aéreos. Los lóbulos más frecuentemente afectados son el lóbulo inferior derecho seguido por el lóbulo superior e inferior izquierdo. El compromiso de áreas posteriores está presente en el 67% de los casos[58],[59].
Si bien hasta el momento, son escasos los datos publicados[57],[60]-[72], el patrón sonográfico en pacientes con neumonía por COVID-19 evidencia un marcado compromiso intersticial en la periferia del pulmón donde el patrón sonográfico característico es la presencia de líneas B, asociado a línea pleural normal, irregular o fragmentada y consolidaciones subpleurales pequeñas con o sin broncogramas aéreos[61]-[67]. En unas publicaciones recientes Volpicelli y Gargani han descripto un artefacto denominado “light beam sign” o “signo del haz de luz”, el cual, si bien no es patognomónico, parece observarse en la gran mayoría de los pacientes con neumonía por COVID-19. Este artefacto vertical en forma de banda se caracteriza por ser luminoso, ancho, moverse rápidamente con el “lung sliding” y originarse típicamente en un área regular de la pleura asociado con áreas de patrón normal y líneas B[64]-[66]. Resultados preliminares de un estudio piloto que están realizando Volpicelli y su grupo (datos no publicados) evidencian que en una serie de 100 pacientes con sospecha de COVID-19, 48 de 49 pacientes con neumonía y enfermedad confirmada mostraron múltiples “light beam sign”, mientras que este artefacto no estuvo presente en ninguno de los 12 pacientes con diagnóstico negativo[65]. Dicho artefacto, puede detectarse a través de la tomografía computada, y se corresponde a una alteración temprana, típica del patrón en “vidrio esmerilado” de enfermedades agudas[64]-[66].
En la neumonía por COVID-19 las líneas B aparecen separadas, múltiples y coalescentes presentando una distribución multifocal en ambos campos pulmonares, en forma parcheada asociadas al artefacto típico “light beam sign”[64]-[66]. Algunos autores refieren que a medida que el cuadro clínico es más severo aparecen líneas B coalescentes y multifocales con áreas de pulmón blanco[60]-[70]. Dichas imágenes se correlacionan con áreas multifocales en vidrio esmerilado en la tomografía axial de alta resolución[60]-[67],[72] ( Figura 12 ). Aunque algunos mencionan que existe un engrosamiento de la pleura, este término no es correcto, ya que la imagen de la pleura es solo un artefacto, por lo que no es posible medirlo, lo que observamos en realidad es la aparición de una línea pleural irregular como ocurre en otras afecciones del intersticio pulmonar. La combinación de estos signos sonográficos y especialmente la distribución que presenta esta enfermedad en el parénquima pulmonar parece ser muy específica de esta neumonía viral[65]. La aparición de grandes consolidaciones lobares con broncogramas aéreos en bases pulmonares debe alertar sobre la posibilidad de una sobreinfección bacteriana[65],[66]. En los casos más severos la enfermedad progresa hacia la fibrosis pulmonar, mientras que aquellos pacientes que presentan una evolución favorable aparece un patrón de líneas A en la fase de recuperación[57]. La asociación con derrame pleural es poco frecuente[60]-[63],[65]. No existe hasta el momento una correlación entre el grado de afección pulmonar inicial y la evolución de la enfermedad. Heldeweg y colaboradores reportaron una fuerte correlación entre el USP y la tomografía computada (r = 0795). Encontraron, además, que los hallazgos de afección pulmonar severa, evidenciados con USP o tomografía, son predictores de una estadía prolongada en UCI, pero no de mortalidad[73].
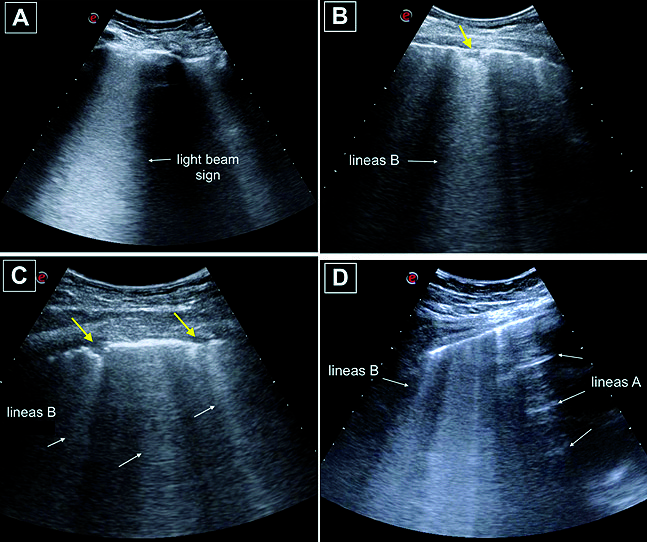
Figura 12. Imágenes características de neumonía por COVID-19. Imágenes obtenidas con sonda convex 2-6 MHz. Se observa “light beam sign”, líneas B con separadas o coalescentes, áreas de pulmón blanco asociadas a áreas respetadas con líneas A. Irregularidad en la línea pleural, consolidaciones subpleurales de diferentes tamaños señaladas con flechas amarillas.
Para realizar el examen sonográfico del pulmón sugerimos utilizar una sonda convex 2-6 MHz debido a que por su ancho permite examinar una área extensa del tórax del paciente adulto y a su vez gracias a su baja frecuencia posee una penetración adecuada para poder identificar las líneas B y los “light beam sign” características de la afección intersticial en esta enfermedad[65],[66]. En pacientes pediátricos debido al menor tamaño de la cavidad torácica, la sonda lineal es de elección, aunque según los reportes actuales esta población parece ser menos afectada. Es posible utilizar una sonda lineal 6-13 MHz para poder identificar con mayor resolución la irregularidad pleural y presencia de consolidaciones subpleurales.
A diferencia del estudio clásico del síndrome intersticial donde examinamos las 8 áreas de Volpicelli[1], según indica el Consenso de Expertos en USP[11]; en el contexto de esta pandemia, sin bien aún no existe nada protocolizado, deberíamos realizar un examen sonográfico de las 12 áreas ( Figura 1 ) descriptas previamente en este artículo, ya que el compromiso de la neumonía por COVID-19 suele ser difuso y afectar diferentes áreas pulmonares. Aconsejamos grabar videos de cada área y realizar un score de aireación como previamente explicamos[47] para poder cuantificar la extensión de la enfermedad y evaluar la respuesta a medidas terapéuticas o guiar estrategias de ventilación mecánica ( Figura 13 ).
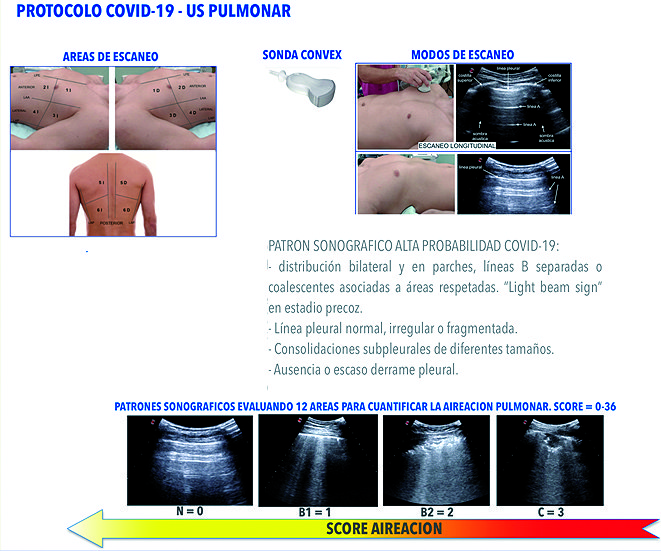
Figura 13. Protocolo de USP para pacientes con neumonía por COVID-19. Se muestran áreas de exploración, técnica de estudio y escala para la cuantificación de la afección pulmonar.
Con la sonda lineal 6-13 MHz es posible visualizar con mayor resolución los signos asociados a las líneas B como la irregularidad en la línea pleural y consolidaciones subpleurales. La utilización de doppler color en estas áreas de consolidaciones subpleurales permite evidenciar la ausencia de flujo sanguíneo probablemente debido a la fisiopatología de fenómenos microtrombóticos relacionada con el COVID-19; lo cual sería relevante para el diagnóstico diferencial con otras consolidaciones inflamatorias o atelectásicas que poseen patrón vascular y presentan buen pronóstico, a diferencia de este tipo de neumonía viral donde la rápida progresión posee elevada mortalidad[63]. Zotzmann y col., sugieren que en pacientes que presentan dímeros D elevados y consolidaciones subpleurales deberíamos estar alertas ante la posibilidad de que desarrollen embolismo pulmonar[71]. En este contexto, el ultrasonido point-of-care asociando al USP, la ecocardiografía y ecografía de venas profundas pueden indicar signos de embolismo pulmonar agudo en estos pacientes[44].
Sin duda, al ser el USP una técnica de superficie, juega un rol importante en el diagnóstico y seguimiento de los pacientes con esta nueva enfermedad, dicha herramienta debe siempre complementarse con la clínica del paciente, así como también con otros métodos diagnósticos.
En la Tabla 5 se sintetiza la aplicación del USP en diferentes escenarios. Son necesarios más estudios que permitan establecer la sensibilidad y especificidad del USP en el diagnóstico y manejo de la neumonía por COVID-19.
| Escenario clínico | Rol del USP | Beneficio del USP | Hallazgos clínicos | Principales hallazgos sonográficos |
| Guardia externa | – Triage de pacientes | – Mayor sensibilidad que la rx de tórax
– Elevada concordancia con TAC – Examen rápido, sin traslados. Disminución infecciones nosocomiales |
– Insuficiencia respiratoria aguda
– Tos, fiebre, anosmia, falla respiratoria aguda – Enfermedades previa o reagudización |
– Patrón altamente probable COVID+65: distribución bilateral y en parches, líneas B separadas o coalescentes asociadas a áreas respetadas. Light beam sign
– Línea pleural irregular – Consolidaciones subpleurales de diferentes tamaños – Ausencia o escaso derrame pleural |
| Internación | – Estratificación de riesgo
– Seguimiento y monitorización de la evolución – Evaluar respuesta a oxígeno-terapia |
– Examen rápido, sin traslados. Disminución de infecciones nosocomiales
– Posibilidad de repetir examen y grabar videos – Hallazgos sonográficos se anticipan al deterioro clínico |
Deterioro leve/moderado a severo: taquipnea, SpO2 < 93%, requerimiento de O2 suplementario | Mayor número de líneas B, coalescentes (áreas pulmón blanco)
– Mayor número de consolidaciones subpleurales de diferentes tamaño |
| UCI | – Monitorización de VNI, ARM y respuesta terapéutica
– Diagnóstico de complicaciones de ARM – Guiar weaning asociado a US diafragmático y ETT – Asociado a POCUS: diagnósticos rápidos y monitorización en inestabilidad hemodinámica |
– Examen a la cabecera del paciente. Disminución infecciones nosocomiales
– Posibilidad de repetir y grabar videos para evaluar estrategia terapéutica y ventilatoria – Guiar maniobras de reclutamiento, optimizar nivel de PEEP – Predecir respuesta al prono y reclutamiento postural – Predecir fallo del weaning |
– Agravamiento de la hipoxemia, necesidad de incremento en la FiO2
– Signos de SDRA, necesidad de VNI, ARM – Fallo multiorgánico |
– Incremento en la gravedad en el score de aireación: líneas B coalescentes, consolidaciones en campos anteriores. Disminución del “lung sliding” en áreas más afectadas
– Derrame pleural: moderado/severo: sospecha de fallo cardíaco descompensado – Aparición de grandes consolidaciones con broncogramas aéreos dinámicos y/o derrame pleural: sospecha de sobreinfección bacteriana – Consolidaciones subpleurales con ausencia de flujo con doppler color; dilatación/disfunción de VD, presencia de trombo en venas profundas: sospecha de TEP |
| Perioperatorio | – Cuantificación de la afección pulmonar en pacientes con elevada sospecha o COVID + (a/sintomáticos)
– Valoración de función diafragmática – Verificar posición del tubo endotraqueal – Valoración del estado hemodinámico asociado a POCUS |
– Decidir estrategia anestésica más adecuada
– Individualizar la estrategia de ARM, guiar maniobras de reclutamiento, optimizar nivel de PEEP – Predecir fallo de extubación – Diagnóstico rápido y seguimiento en inestabilidad hemodinámica o paro cardiorrespiratorio |
– Paciente COVID + asintomático o con hipoxemia moderada/severa
– Alta sospecha de COVID sin PCR |
– Patrón altamente probable COVID+: distribución bilateral y en parches, líneas B separadas o coalescentes asociadas a áreas respetadas, light beam sign, irregularidad pleural, consolidaciones subpleurales de diferentes tamaños
– Aparición de áreas de consolidación en zonas posteriores luego de inducción anestésica con imagen de reclutamiento tidal, indicativas de atelectasias – Presencia de “lung sliding” bilateral luego de intubación endotraqueal permite verificar su correcta posición – Neumotórax asociado a procedimientos invasivos o ARM – Derrame pleural extenso asociado a falla cardiaca o paraneumónico |
-
Ultrasonidopulmonar en la monitorización de la ventilación mecánica
El USP constituye una herramienta que permite guiar y monitorizar la ventilación mecánica, optimizando la estrategia ventilatoria e identificando qué pacientes podrían beneficiarse de una maniobra de reclutamiento alveolar[3]-[38]. También permite realizar el diagnóstico de complicaciones asociadas a la ventilación mecánica como neumotórax, atelectasias y neumonía asociada al respirador[74].
Las atelectasias constituyen un efecto negativo asociado a la ventilación mecánica en pacientes con pulmones sanos (anestesia) o enfermos (UCI)[75]. Dichas atelectasias no solo causan reducción en la complacencia pulmonar y alteran la relación ventilación/perfusión, sino también predisponen a la injuria pulmonar asociada al ventilador (IPAV), aun en pacientes con pulmones previamente sanos.
El USP presenta un rol clave en la monitorización del paciente en ventilación mecánica, ya que permite el diagnóstico certero de atelectasias inducidas por la anestesia general con una elevada sensibilidad y especificidad (87%-88% y 89%-92% respectivamente) tanto en pacientes pediátricos[5] como adultos[76],[77]. Sonográficamente, se caracterizan por la presencia de consolidaciones subpleurales, líneas B y broncogramas aéreos pequeños; el signo del pulso sólo se evidencia en 40% de los pacientes[5] ( Figura 10A, D ). A través de la utilización de doppler color es posible observar en las atelectasias el shunt intrapulmonar, causante de hipoxemia[9]. El USP no solo identifica qué pacientes presentan unidades alveolares reclutables, sino también permite el diagnóstico a la cabecera del paciente de reclutamiento tidal, uno de los mecanismos propuestos de IPAV. La elevada resolución de la imagen sonográfica permite detectar este fenómeno caracterizado por la apertura y cierre de los alvéolos durante el ciclo respiratorio[78] ( Figura 14 ). Otro de los mecanismos implicados en la IPAV es la sobredistensión pulmonar; sin embargo, el USP no permite valorar de manera precisa la sobredistención en pacientes ventilados. Por este motivo, deben utilizarse, además, otros métodos de monitorización basados en la mecánica respiratoria y transpulmonar.
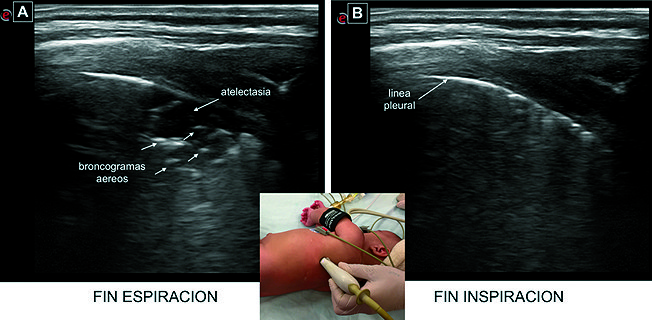
Figura 14. Imágenes obtenidas con sonda lineal 6-12 MHz en un paciente pediátrico bajo anestesia general, área posterior derecha. Se observa fenómeno de reclutamiento tidal: evidenciado por la diferencia en el grado de aireación durante la apertura (A: fin inspiración) y cierre (B: fin espiración) cíclico de los alvéolos durante el ciclo respiratorio.
Las maniobras de reclutamiento alveolar (MRA) tienen como objetivo restaurar el colapso pulmonar a través de un breve y controlado incremento en las presiones de vía aérea, y una selección óptima de PEEP para mantener el pulmón abierto[4]. El USP permite guiar y personalizar la estrategia de apertura pulmonar y el seteo de la PEEP óptima[4],[10], identificando no solo el punto de colapso y de apertura alveolar, sino también la repercusión hemodinámica durante tal maniobra[4] (Figura 15). A través del score de aireación es posible detectar de una manera simple la cantidad de parénquima pulmonar reclutado luego de aplicar una MRA, evaluando la respuesta a dicha terapéutica[3],[47]. El USP permite optimizar la interacción corazón-pulmón a través de la elección de una mejor estrategia ventilatoria, reduciendo el colapso pulmonar y mejorando la performance del ventrículo derecho[81].
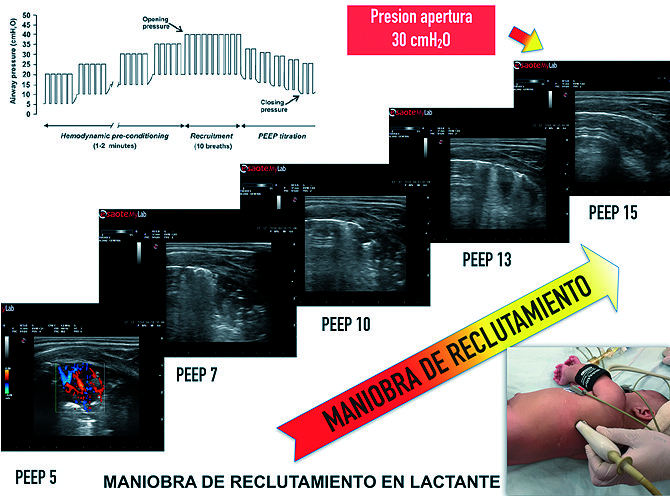
Figura 15. Paciente pediátrico bajo anestesia general, imágenes obtenidas con sonda lineal 6-12 MHz, corte oblicuo en áreas dependientes. Maniobra de reclutamiento guiada por US. Durante la fase de incremento escalonado en la presión de la vía áerea, el US detecta la presión plateau en la cual desaparece el colapso en aéreas dependientes “presión de apertura” marcada con un círculo.
Estudios prospectivos realizados en pacientes pediátricos reportaron el rol del USP en la monitorización para evaluar el beneficio de una determinada estrategia ventilatoria durante el intraoperatorio, tales como maniobra de reclutamiento alveolar[4],[49],[82] o reclutamiento postural[79],[80].
En pacientes con SDRA a través del USP es posible predecir qué pacientes pueden presentar una respuesta beneficiosa a maniobras de reclutamiento utilizando el decúbito prono. De esta manera, aquellos pacientes que presentan áreas posteriores de consolidación pulmonar con áreas de patrón pulmonar normal en regiones anteriores presentan una mejoría en la aireación pulmonar asociada a una mejoría clínica del paciente luego de aplicar esta estrategia[83],[84], a diferencia de aquellos con afección difusa de ambos campos pulmonares.
-
Conclusión
El USP es una herramienta segura, no invasiva y libre de radiación, que permite no solo un diagnóstico rápido, sino también el seguimiento de pacientes con diversas patologías respiratorias sin necesidad de traslado. Estas características destacan el gran potencial de este método diagnóstico para el manejo del paciente hipóxico en áreas de cuidados críticos y quirófano. El USP es una metodología simple que requiere contextualizar los hallazgos sonográficos con el cuadro clínico del paciente.
La combinación de USP con el ultrasonido “point-of-care” permiten un abordaje integral en el manejo del paciente crítico durante la práctica anestésica y la Unidad de Cuidados Intensivos. Probablemente, la presente pandemia generada por la infección del SARS-CoV-2 hará que el uso del USP se expanda y genere interés en adquirir un entrenamiento con esta valiosa herramienta.
Referencias
1. Volpicelli G, Mussa A, Garofalo G, et al. Bedside lung ultrasound in the assessment of alveolar-interstitial syndrome. Am J Emerg Med 2006; 24:689-96. https://doi.org/10.1016/j.ajem.2006.02.013
2. Lichtenstein D a, Mezière G: Relevance of lung ultrasound in the diagnosis of acute respiratory failure: the BLUE protocol. Chest 2008;134:117-25. https://doi.org/10.1378/chest.07-2800
3. Bouhemad B, Brisson H, Le-Guen M, et al. Bedside Ultrasound Assessment of Positive End-Expiratory Pressure-induced Lung Recruitment. Am J Respir Crit Care Med 2011;183:341-7. https://doi.org/10.1164/rccm.201003-0369OC
4. Tusman G, Acosta CM, et al. Ultrasonography for the assessment of lung recruitment maneuvers. Crit Ultrasound J 2016;8:8. https://doi.org/10.1186/s13089-016-0045-9
5. Acosta CM, Maidana G, Jacovitti D, et al. Accuracy of transthoracic lung ultrasound for diagnosing anesthesia-induced atelectasis in children. Anesthesiology 2014;120:1370-9. https://doi.org/10.1097/ALN.0000000000000231
6. Volpicelli G. Lung sonography. J Ultrasound Med 2013;32:165-71. https://doi.org/10.7863/jum.2013.32.1.165
7. Lichtenstein DA, Goldstein I, Mourgeon E, et al. Comparative diagnostic performances of auscultation, chest radiography and lung ultrasonography in ARDS. Anesthesiology 2004;100:9-15. https://doi.org/10.1097/00000542-200401000-00006
8. Copetti R. Is lung ultrasound the stethoscope of the new millennium? Definitely yes! Acta Med Acad 2016; 45: 80-81. https://doi.org/10.5644/ama2006-124.162
9. Acosta CM, Tusman G, et al. Doppler images of intra-pulmonary shunt within atelectasis in anesthetized children. Crit Ultrasound J 2016;8:19. https://doi.org/10.1186/s13089-016-0055-7
10. Görg C, Seifart U, Görg K, et al. Color doppler sonographic mapping of pulmonary lesions. J Ultrasound Med 2003; 22:1033-9. https://doi.org/10.7863/jum.2003.22.10.1033
11. Volpicelli G, Elbarbary M, Blaivas M, et al: Conference Reports and Expert Panel: International Liaison Committee on Lung Ultrasound (ICC-LUS) International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med 2012; 38:577-91. https://doi.org/10.1007/s00134-012-2513-4
12. Lichtenstein DA. Lung ultrasound in the critically ill. An Intensive Care 2014;4:1. https://doi.org/10.1186/2110-5820-4-1
13. Volpicelli G. Sonographic diagnosis of pneumothorax. Intensive Care Med 2011; 37:224-32. https://doi.org/10.1007/s00134-010-2079-y
14. Soldati G, Testa A, Sher S, et al. Occult traumatic pneumothorax: diagnostic accuracy of lung ultrasonography in the emergency department. Chest 2008;133:204-11. https://doi.org/10.1378/chest.07-1595
15. Volpicelli G, Boero E, Sverzellati N, et al. Semi-quantification of pneumothorax volume by lung ultrasound. Intensive Care Med 2014; 40:1460-7. https://doi.org/10.1007/s00134-014-3402-9
16. Oveland NP, Lossius HM, Wemmelund K, et al. Using thoracic ultrasonography to accurately assess pneumothorax progression during positive pressure ventilation: a comparison with CT scanning. Chest 2013;143:415-22. https://doi.org/10.1378/chest.12-1445
17. Balik M, Plasil P, Waldauf P, et al. Ultrasound estimation of volume of pleural fluid in mechanically ventilated patients. Intensive Care Med 2006, 32:318-21. https://doi.org/10.1007/s00134-005-0024-2
18. Eibenberger KL, Dock WI, Ammann ME, et al. Quantification of pleural effusions: sonography versus radiography. Radiology 1994;191(3): 681-4. https://doi.org/10.1148/radiology.191.3.8184046
19. Soldati G, Smargiassi A, Inchingolo R, et al. Ultrasound-guided pleural puncture in supine or recumbent lateral position – feasibility study. Multidisciplinary Respiratory Medicine 2013;8:18. https://doi.org/10.1186/2049-6958-8-18
20. Chiesa AM, Ciccarese F, Gardelli G, et al. Sonography of the normal lung: comparison between young and elderly subjects. J Clin Ultrasound 2014; 43:230-4. https://doi.org/10.1002/jcu.22225
21. Gargani L. Lung ultrasound: a new tool for the cardiologist. Cardiovasc Ultrasound 2011, 9:6. https://doi.org/10.1186/1476-7120-9-6
22. Tsung JW, Kessler DO, Shah VP. Prospective application of clinician-performed lung ultrasonography During the 2009 H1N1 influenza A pandemic: distinguishing viral from bacterial pneumonia. Crit Ultrasound J. 2012,4:16. https://doi.org/10.1186/2036-7902-4-16
23. Testa A, Soldati G, Copetti R, Giannuzzi R, Portale G, Gentiloni-Silveri N. Early recognition of the 2009 pandemic influenza A (H1N1) pneumonia by chest ultrasound. Crit Care 2012;16(1):R30. https://doi.org/10.1186/cc11201
24. Al Deeb M, Barbic S, Featherstone R, et al. Point-of-care ultrasonography for the diagnosis of acute cardiogenic pulmonary edema in patients presenting with acute dyspnea: a systematic review and meta-analysis. Acad Emerg Med 2014;21:843-52. https://doi.org/10.1111/acem.12435
25. Pivetta E, Goffi A, Lupia E, et al. SIMEU Group for Lung Ultrasound in the Emergency Department in Piedmont. Lung ultrasound-implemented diagnosis of acute decompensated heart failure in the ED: a SIMEU Multicenter Study. Chest 2015;148: 202-10.
26. Volpicelli G, Skurzak S, Boero E, et al. Lung Ultrasound Predicts Well Extravascular Lung Water but Is of Limited Usefulness in the Prediction of Wedge Pressure. Anesthesiology 2014;121:320-7. https://doi.org/10.1097/ALN.0000000000000300
27. Agricola E, Bove T, Oppizzi M, et al. “Ultrasound comet-tail images”: a marker of pulmonary edema: a comparative study with wedge pressure and extravascular lung water. Chest 2005, 127:1690-5. https://doi.org/10.1378/chest.127.5.1690
28. Gargani L, Frassi F, Soldati G, et al. Ultrasound lung comets for the differential diagnosis of acute cardiogenic dyspnea: a comparison with natriuretic peptides. Eur J Hear Fail 2008, 10:70-7. https://doi.org/10.1016/j.ejheart.2007.10.009
29. Frassi F, Gargani L, Tesorio P, et al. Prognostic value of extravascular lung water assessed with ultrasound lung comets by chest sonography in patients with dyspnea and/or chest pain. J Card Fail 2007;13:830-5. https://doi.org/10.1016/j.cardfail.2007.07.003
30. Platz E, Lewis EF, Uno H, et al. Detection and prognostic value of pulmonary congestion by lung ultrasound in ambulatory heart failure patients. Eur Heart J 2016; https://doi.org/10.1093/eurheartj/ehw745
31. Bedetti G, Gargani L, Sicari R, et al. Comparison of prognostic value of echocardiographic risk score with the Thrombolysis in Myocardial Infarction (TIMI) and Global Registry in Acute Coronary Events (GRACE) risk scores in acute coronary syndrome. Am J Cardiol 2010;106:1709-16. https://doi.org/10.1016/j.amjcard.2010.08.024
32. Coiro S, Rossignol P, Ambrosio G, et al. Prognostic value of residual pulmonary congestion at discharge assessed by lung ultrasound imaging in heart failure. Eur J Heart Fail 2015;17:1172-81. https://doi.org/10.1002/ejhf.344
33. Zoccali C, Torino C, Tripepi R, et al. Pulmonary congestion predicts cardiac events and mortality in ESRD. J Am Soc Nephrol 2013; 24:639-46. https://doi.org/10.1681/ASN.2012100990
34. Gargani L, Pang PS, Frassi F, et al. Persistent pulmonary congestion before discharge predicts rehospitalization in heart failure: a lung ultrasound study. Cardiovasc Ultrasound 2015;13:40. https://doi.org/10.1186/s12947-015-0033-4
35. Zieleskiewicz L, Contargyris C, Brun C, et al. Lung Ultrasound Predicts Interstitial Syndrome and Hemodynamic Profile in Parturients with Severe Preeclampsia. Anesthesiology 2014;120:906-14. https://doi.org/10.1097/ALN.0000000000000102
36. Neskovic AN, Hagendorff A, Lancellotti P, Guarracino F, et al. European Association of Cardiovascular Imaging. Emergency echocardiography: the European Association of Cardiovascular Imaging recommendations. Eur Heart J Cardiovasc Imaging. 2013;14:1-11. https://doi.org/10.1093/ehjci/jes193
37. Price S, Platz E, Cullen L, et al. Expert Consensus Document: Echocardiography and lung ultrasound for the assessment and management of acute heart failure. Nat Rev Cardiol. 2017;14:427-40. https://doi.org/10.1038/nrcardio.2017.56
38. Bouhemad B, Liu ZH, Arbelot C, et al. Ultrasound assessment of antibiotic-induced pulmonary reaeration in ventilator-associated pneumonia. Crit Care Med 2010;38:84-92. https://doi.org/10.1097/CCM.0b013e3181b08cdb
39. Lichtenstein D, Mezière G, Seitz J. The dynamic air bronchogram. A lung ultrasound sign of alveolar consolidation ruling out atelectasis. Chest 2009;135:1421-25. https://doi.org/10.1378/chest.08-2281
40. Reissig A, Copetti R, Mathis G, et al. Lung ultrasound in the diagnosis and follow-up of community-acquired pneumonia: a prospective, multicenter, diagnostic accuracy study. Chest 2012;142:965-72. https://doi.org/10.1378/chest.12-0364
41. Mongodi S, Via G, Girard M, et al. Lung Ultrasound for early diagnosis of ventilator-associated pneumonia. Chest 2016;149(4):969-80. https://doi.org/10.1016/j.chest.2015.12.012
42. Brogi E, Bignami E, Sidoti A, et al. Could the use of beside lung Ultrasound reduce the number of chest x-rays in the intensive care unit? Cardiovascular Ultrasound 2017;15:23 https://doi.org/10.1186/s12947-017-0113-8
43. Mathis G, Blank W, Reissig A, et al. Thoracic Ultrasound for diagnosing pulmonary embolism: a prospective multicenter study of 352 patients. Chest 2005;128:1.531-8. https://doi.org/10.1378/chest.128.3.1531
44. Nazerian P, Vanni S, Volpicelli G, et al. Accuracy of point-of-care multiorgan ultrasonography for the diagnosis of pulmonary embolism. Chest 2014;145(5):950-7. https://doi.org/10.1378/chest.13-1087
45. Copetti R, Soldati G, Copetti P. Chest sonography: a useful tool to differentiate acute cardiogenic pulmonary edema from acute respiratory distress syndrome. Cardiovascular Ultrasound 2008;6:16. https://doi.org/10.1186/1476-7120-6-16
46. Riviello ED, Kiviri W, Twagirumugabe T, Mueller A, Banner-Goodspeed VM, Officer L, et al. Hospital incidence and outcomes of the acute respiratory distress syndrome using the Kigali modification of the Berlin definition. Am J Respir Crit Care Med 2016;193:52-59. https://doi.org/10.1164/rccm.201503-0584OC
47. Soummer A, Perbet S, Brisson H, et al. Ultrasound assessment of lung aeration loss during a successful weaning trial predicts postextubation distress. Crit Care Med 2012;40:2064-72. https://doi.org/10.1097/CCM.0b013e31824e68ae
48. Bouhemad B, Mojoli F, Nowobilski N, Hussain A, et al. Use of combined cardiac and lung Ultrasound to predict weaning failure in elderly high-risk cradiac patients: a pilot study. Intensive Care Med 2020. https://doi.org/10.1007/s00134-020-05956-0
49. Acosta CM, Sara T, Carpinela M, Volpicelli G, et al. Lung recruitment prevents collapse during laparoscopy in children. A randomised controlled trial. Eur J Anesthesiol 2017; 34:1-8. https://doi.org/10.1097/EJA.0000000000000761
50. World Health Organisation. Coronavirus disease 2019 (COVID-19) situation report – 41; data as reported by national autorities. 1 March 2020.
51. Gattinoni L, Chiumello D, Caironi P, Busana M, Romitti F, Brazzi L, Camporota L. COVID-19 pneumonia: different respiratory treatment for different phenotipes? Intensive Care Med 2020. https://doi.org/10.1007/s00134-020-06033-2
52. Bos LDJ, Paulus F, Vlaar APJ, Beenen LFM, Schultz M. Subphenotyping ARDS in COVID-19 patients: Consequences for ventilator management. Annals ATS 2020; https://doi.org/10.1513/AnnalsATS.202004-376RL.
53. Ferrando C, Mellado-Artigas R, Gea A, Arruti E, Aldecoa C, et al. Características, evolución clínica y factores asociados a la mortalidad en UCI de los pacientes críticos infectados por SARS-CoV-2 en España: estudio prospectivo, de cohorte y multi-céntrico. Revista Española de Anestesiología y Reanimación 2020; https://doi.org/10.1016/j.redar.2020.07.003
54. Jin YH, Cai L, Cheng ZS, Cheng H, Deng T, Fan YP, et al. A rapid advice guideline for the diagnosis and treatment of 2019 novel coronavirus (2019-nCoV) infected pneumonia (standard version). Mil Med Res. 2020;6;7(1):4. https://doi.org/10.1186/s40779-020-0233-6.
55. Fang Y, Zhang H, Xie J, Lin M, Ying L, et al. Sensitivity of chest CT for COVID-19: Comparison to RT-PCR. https://doi.org/10.1148/radiol.2020200432.
56. Wong J, Goh QY, Tan Z et al. Preparing for a COVID-19 pandemic: a review of operating room outbreak response measures in a large tertiary hospital in Singapore. Can J Anesth 2020. https://doi.org/10.1007/s12630-020-01620-9
57. Buonsenso D, Pata D, Chiaretti A. COVID-19 outbreak: less stethoscope, more ultrasound. Lancet Resp Med 2020. https://doi.org/10.1016/S2213-2600(20)30120-X
58. Bernheim A et al. Chest CT finding in coronavirus disease-19 (COVID-19): Relationship to Duration of infection. Radiology. 2020; 200463. https://doi.org/10.1148/radiol.2020200463
59. Shi H, Han X, Jiang N, Cao Y, Alwalid O et al. Radiological finding from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis 2020. https://doi.org/10.1016/S1473-3099(20)30086-4
60. Soldati G, Smargiassi A, Inchingolo R et al. Is there a role for lung ultrasound during the COVID-19 pandemic? 2020. JUM https://doi.org/10.1002/jum.15284
61. Soldati G, Smargiassi A, Inchingolo R et al. Proposal for international standardization of the use of lung Ultrasound for COVID-19 patients; a simple, quantitative, reproducible method. 2020. JUM https://doi.org/10.1002/jum.15285
62. Peng Q, Wang X, Zhang L. Findings of lung ultrasonography of novel corona virus pneumonia during the 2019-2020 epidemic. Intensive Care Med 2020. https://doi.org/10.1007/s00134-020-05996-6
63. Huang Y, Wang S, Liu Y et al. A Preliminary Study on the Ultrasonic Manifestations of Peripulmonary Lesions of Non-Critical Novel Coronavirus Pneumonia (COVID-19). SSRN (2020). https://doi.org/10.2139/ssrn.3544750
64. Volpicelli G, Gargani L. Sonographic sign and patterns of COVID-19 pneumonia. The Ultrasound Journal 2020;12:22. https://doi.org/10.1186/s13089-020-00171-w
65. Volpicelli G, Lamorte A, Vilen T. What’s new in lung ultrasound during the COVID-19 pandemic. Intensive Care Med 2020. https://doi.org/10.1007/s00134-020-06048-9
66. Gargani L, Soliman-Aboumarie, Volpicelli G, Corradi F, Concetta Pastore M, Cameli M. Why, when, and how to use lung Ultrasound During the COVID-19 pandemic: enthusiasm and caution. Eur Heart J Cardiovasc Imaging 2020 https://doi.org/10.1093/ehjci/jeaa163
67. Smith MJ, Hayward SA, Innes SM, Miller A. Point-of-care lung ultrasound in patients with COVID-19 – a narrative review. Anaesthesia 2020. https://doi.org/10.1111/anae.15082
68. Poggiali E, Dacrema A, Bastoni D, et al. Can lung US help critical care clinicians in the early diagnosis of novel coronavirus (COVID-19) pneumonia? Radiology 2020. https://doi.org/10.1148/radiol.2020200847
69. Vetrugno L, Bove T, Orso D, et al. Our Italian experience of using lung ultrasound for identification, grading and serial follow-up of severity of lung involvement for management of patients with COVID-19. Echocardiography 2020. https://doi.org/10.1111/echo.14664
70. Buonsenso D, Piano A, Raffaelli F, et al. Point-of-care lung ultrasound findings in novel coronavirus disease 19 pnemoniae: a case report and potential applications during COVID-19 outbreak. European Review For Medical And Pharmacological Sciences 2020; 24: 2776-80.
71. Zotzmann V, Lang CN, Bamberg F, Bode C, Staudacher DL. Are subpleural consolidations indicators for segmental pulmonary embolism in COVID-19? Intensive Care Med 2020. https://doi.org/10.1007/s00134-020-06044-z
72. Duclos G, López A, Leone M, Zieleskiewicz. “No dose” lung ultrasound correlation with “low dose” CT scan for early diagnosis of SARS-COV-2 pneumonia. Intensive Care Med 2020. https://doi.org/10.1007/s00134-020-06058-7
73. Heldeweg M, López Matta JA, Haaksma ME, et al. Lung Ultrasound and computed tomography to monitor COVID-19 pneumonia in critically ill patients: a two-center prospectivecohort study. Research Square 2020 https://doi.org/10.21203/rs.3.rs-44726/v1
74. Monjoli F, Bouhemad B, Mongodi S, Lichtenstein D. Lung ultrasound for critical ill patients. Am J Respir Crit Care Med 2019;199:701-14. https://doi.org/10.1164/rccm.201802-0236CI
75. Gunnarsson L, Tokics L, Gustavsson H, et al. Influence of age on atelectasis formation and gas exchange impairment during general anaesthesia. Br J Anaesth 1991;66:423-32. https://doi.org/10.1093/bja/66.4.423
76. Monastesse A, Girard F, Massicotte N, et al. Lung ultrasonography for the assessment of perioperative atelectasis: a pilot feasibility study. Anesth Analg 2017;124:494-04. https://doi.org/10.1213/ANE.0000000000001603
77. Yu X, Zhenping Z, Zhao Y, et al. Performance of lung ultrasound in detecting peri-operative atelectasis after general anesthesia. Ultrasound Med Biol 2016;42:2775-84. https://doi.org/10.1016/j.ultrasmedbio.2016.06.010
78. Tusman G, Acosta CM, Nicola M, et al. Real-time images of tidal recruitment using lung ultrasound. Crit Ultrasound J 2015;7:19. https://doi.org/10.1186/s13089-015-0036-2
79. Tusman G, Acosta CM, Böhm SH, et al. Postural lung recruitment assessed by lung Ultrasound in mechanically ventilated children. Crit Utrasound J. 2017;9-22. https://doi.org/10.1186/s13089-017-0073-0
80. Acosta CM, Volpicelli G, Rudzik N, Venturin N, Gerez S, Ricci L, Natal M, Tusman G. Feasibility of postural lung recruitment maneuver in children: a randomized, controlled study. Ultrasound J 2020;12:34. https://doi.org/10.1186/s13089-020-00181-8
81. Longo S, Siri J, Acosta CM, et al. Lung recruitment improves right ventricular performance after cardiopulmonary bypass: a randomised controlled trial. Eur J Anaesthesiol 2017;34:66-74. https://doi.org/10.1097/EJA.0000000000000559
82. Song IK, Kim EH, Lee JH. Effects of an alveolar recruitment manoeuvre guided by lung ultrasound on anaesthesia-induced atelectasis in infants: a randomised, controlled trial. Anaesthesia. 2016. https://doi.org/10.1111/anae.13713.
83. Prat G, Guinard S, Bizien N, Nowak E, Tonnelier JM, Alavi Z, et al. Can lung ultrasonography predict prone positioning response in acute respiratory distress syndrome patients? J Crit Care 2016;32:36-41. https://doi.org/10.1016/j.jcrc.2015.12.015
84. Haddam M, Zieleskiewicz L, Perbet S, Baldovini A, Guervilly C, Arbelot C, et al.; CAR’Echo Collaborative Network; AzuRea Collaborative Network. Lung ultrasonography for assessment of oxygenation response to prone position ventilation in ARDS. Intensive Care Med 2016;42:1546-1556. https://doi.org/10.1007/s00134-016-4411-7

 ORCID
ORCID