Germán Soto 1 , Guillermina Harvey 1 , Ivo Glavinovich 1 , Victoria García 1 , Constanza Urchipia 1 , Nicolás Becher 1
Recibido: 03-12-2019
Aceptado: 23-01-2020
©2020 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 49 Núm. 5 pp. 675-682|https://doi.org/10.25237/revchilanestv49n05-10
PDF|ePub|RIS
Comparative effects of midazolam dexmedetomidina in patients with obstructive sleep apnea
Abstract
Objective: To compare the efficacy and safety of sedation with midazolam vs dexmedetomidine in patients with high probability of obstructive sleep apnea, to assess hemodynamic parameters, ventilation and depth of hypnosis. Methods: Patients scheduled to regional anesthesia and sedation participated in this randomly and double-blinded study. The MDZ Group (n = 29) midazolam 0.05 m g ∙ k g – 1 ; while the DEX Group (n = 29) dexmedetomidina 0.4 μ g ∙ k g – 1 ∙ h – 1 . Systolic and Diastolic Blood Presion (SBP and DBP), Heart Rate (HR), Respiratory Rate (RR) peripheral oxygen saturations (SpO2), and bispectral index (BIS) scores were recorded during surgery. Results: Patient demographics were similar in the two groups. There were no differences with respect to SBP and DBP. The DEX group decreased significantly HR 10’ (p = 0.001), 15’ (p = 0.002), 20’ (p = 0.004); the MDZ group decreased significantly RR (p < 0.0001), 10’ (p < 0.0001), 15’ (p = 0.001), 30’ (p = 0.001), 45’ (p = 0.0019), 60’ (p = 0.001), and SAT O2 5’ (p = 0.032), 10’ (p = 0.033), 15’ (p = 0.059), 30’ (p = 0.033), 45’ (p = 0.047), 60’ (p = 0.028) compare to DEX group. The MDZ group decreased significantly BIS 5’ (p < 0.0001), 10’ (p < 0.0001), 15’ (p = 0.001), 30’ (p < 0.001), 45’ (p = 0.003), 60’ (p = 0.038), compare to DEX group. Conclusion: The use of DEX for sedation in patients with high probability of obstructive sleep apnea provides better control over the depth of sedation, to compare with MDZ.
Resumen
Objetivo: Comparar efecto de sedación, midazolam versus dexmedetomidina, en funciones hemodinámicas, ventilación y profundidad de hipnosis, en pacientes STOP-Bang positivo bajo anestesia espinal. Materiales y Métodos: Estudio clínico prospectivo, doble ciego, aleatorizado, pacientes bajo bloqueo espinal y sedación. Grupo MDZ (n = 29): midazolam 0,05 m g ∙ k g – 1 ; Grupo DEX (n = 29): dexmedetomidina 0,4 μ g ∙ k g – 1 ∙ h – 1 . Se evaluaron parámetros hemodinámicos (TAS, TAD y FC), ventilatorios (FR, SAT O2, ETCO2), profundidad de hipnosis (BIS), en periodos basal, 5, 10, 15, 30, 45 y 60 minutos. Criterios de inclusión: pacientes ASA I y II, 18 y 60 años, STOP-Bang positivos (+3 criterios positivos), ambos sexos. Criterios de exclusión: contraindicación de bloqueo central, alergia conocida a las drogas, negativa del paciente. Análisis estadístico: datos cualitativos se expresan como nº (%), se utilizó Test Chi-cuadrado y Test de Fisher. Datos cuantitativos promedio (desvío estándar), Test t. Nivel de significación: 0,05. Resultados: Datos demográficos similares ambos grupos ( Tabla 1 ); el grupo DEX presentó menor FC 10’ (p = 0,001), 15’ (p = 0,002), 20’ (p = 0,004). El grupo MDZ disminuyó la FR 5’ (p < 0,0001), 10’ (p < 0,0001), 15’ (p = 0,001), 30’ (p = 0,001), 45’ (p = 0,0019), 60’ (p = 0,001), y SAT O2 5’ (p = 0,032), 10’ (p = 0,033), 15’ (p = 0,059), 30’ (p = 0,033), 45’ (p = 0,047), 60’ (p = 0,028) comparado con DEX. El grupo MDZ disminuyó valores BIS 5’ (p < 0,0001), 10’ (p < 0,0001), 15’ (p = 0,001), 30’ (p < 0,001), 45’ (p = 0,003), 60’ (p = 0,038), comparado con DEX. Conclusión: La sedación con dexmedetomidina en pacientes STOP Bang positivo bajo anestesia espinal, proporciona estabilidad hemodinámica, con mejor control de parámetros de ventilación y profundidad de hipnosis, en comparación con midazolam.
Introducción
La permeabilidad de la vía aérea, cuya función depende de la estructura, faríngea, es esencial en pacientes bajo sedación[1]. El síndrome de apnea obstructiva del sueño (SAOS) se manifiesta por la obstrucción parcial o total de la vía aérea superior, con episodios repetitivos de detención de la respiración, que se producen durante el sueño[2],[3]. El diagnóstico de SAOS se realiza mediante polisomnografía, que establece el número de anormalidades respiratorias por hora de sueño, y determina el grado y la severidad del síndrome[3],[4]. El SAOS se asocia con incremento perioperatorio de la morbimortalidad, debido a complicaciones por sedantes y opioides[5],[6]. Debido a su alta prevalencia en la población, protocolos internacionales recomiendan un cuestionario de detección precoz previo a la cirugía, denominado STOP-Bang, donde se busca la presencia de síntomas y signos relacionados con la enfermedad[7],[8]. Pacientes STOP-Bang positivos son considerados de alto riesgo de SAOS, sugiriéndose adecuada elección de drogas, control estricto de la ventilación y de la profundidad de hipnosis[9],[10]. Desde el punto de vista anestésico, midazolam y dexmedetomidina son ampliamente utilizadas para procedimientos quirúrgicos bajo sedación. Midazolam tiene efecto sedante, ansiolítico e hipnótico, sin embargo, sus efectos se asocian a relajación de la vía aérea y episodios obstructivos[11]. En contraposición, dexmedetomidina tiene efecto sedante y analgésico sin producir compromiso respiratorio[12]-[15]. Teniendo en cuenta lo anterior expuesto, se propone como hipótesis que la perfusión de dexmedetomidina provoca menor impacto en los parámetros hemodinámicos, de ventilación y profundidad de hipnosis en comparación con la administración de midazolam en una población de pacientes STOP-Bang positivo.
-
Pacientes y Métodos
El protocolo de investigación fue diseñado cumpliendo el código de ética de la Organización Mundial de la Salud (Declaración de Helsinki), siendo aprobado por el Comité de Ética e Investigación del Hospital Provincial de Rosario, y el Comité de Investigación y Docencia del Hospital Escuela Eva Perón.
Se realizó un estudio prospectivo, aleatorizado y comparativo en 60 pacientes STOP-Bang positivos bajo anestesia espinal, que recibieron sedación. El estudio se realizó en el Hospital Escuela Eva Perón, Granadero Baigorria, Provincia de Santa Fe, Argentina, entre los meses de enero de 2018 y diciembre de 2018.
Criterios de inclusión:
• Pacientes ASA I y II.
• Edad entre 18 y 60 años.
• Pacientes STOP-Bang positivos (3 o más criterios positivos).
• Ambos sexos.
Criterios de exclusión:
• Contraindicación de bloqueo central, absoluto o relativo.
• Intolerancia o alergia conocida a las drogas a utilizar o sus excipientes.
• Negativa del paciente.
Luego de obtener el consentimiento informado, los pacientes se asignaron aleatoriamente a uno de los siguientes grupos:
Grupo MDZ (Midazolam, Midazolam Gobbi®, Gobbi): IC de midazolam.
Grupo DEX (dexmedetomidina, Precedex®, Pfizer): IC de dexmedetomidina.
Se utilizó una secuencia de asignación aleatoria generada por una persona ajena al estudio, mediante el software R (R Core Team, R Foundation for Statiscal Computing, Vienna University of Economics and Business, Viena, Austria, www.r-project.org), sin imponer ninguna restricción en el esquema de aleatorización. Se efectuó con dos operadores, uno de ellos preparó las drogas según la aleatorización correspondiente, y el otro las administró y recolectó los datos sin conocer el contenido de la solución que estaba manipulando.
-
Manejo anestésico
Al ingreso de los pacientes a quirófano, se les colocó un catéter endovenoso periférico 20 G, y monitorización de rutina según normas FAAAAR[16], la cual consistió en el registro continuo de electrocardiograma, temperatura, presión arterial no invasiva, saturación de oxígeno de la hemoglobina (Dräger Infinity Vista XL MS 18986, USA.) y concentración final de espiración de CO2 (Dräger SCIO, Lübeck, Alemania). Se hidrató al paciente con solución fisiológica a razón de 10 ml/kg para compensar la pérdida nocturna de fluidos y luego se mantuvo una infusión continua de la misma solución a 5 ml.kg-1.h-1. Inmediatamente se administró oxígeno por una cánula nasal con línea de capnografía a un flujo de 2-3 lt/min, y se comenzó con la sedación según el respectivo grupo: grupo MDZ: midazolam 0,05 mg.kg-1; grupo DEX: dexmedetomidina 0,4 ug.kg-1.h-1. Ambas drogas fueron administradas en infusión continua durante 30 minutos, utilizando bomba Asena PK™ (Alaris Medical Systems, Basingstoke, UK). A continuación, los pacientes fueron posicionados en sedestación con las piernas apoyadas sobre un resalto a 40 centímetros por debajo del nivel de la camilla. Se realizó asepsia y antisepsia de la piel con alcohol iodado, colocación de campos estériles e infiltración de la piel con lidocaína 1% con aguja subcutánea, la anestesia raquídea se realizó utilizando aguja 27 G punta lápiz en los espacios intervertebrales L3-L4, administrando 3 ml de bupivacaína hiperbara 0,5% (15 mg) + 0,2 ml de fentanilo (20 ug).
-
Parámetros hemodinámicos
Se registraron tensión arterial sistólica (TAS), tensión arterial diastólica (TAD) y frecuencia cardíaca (FC) con esfigmomanómetro automático y ECG de monitor multiparamétrico. El registro de TAS, TAD y FC se realizó en los momentos basal, a los 5 min, 10 min, 15 min, 30 min y 60 min.
-
Parámetros de ventilación
Se registró la frecuencia respiratoria (FR) mediante impedancia toráxica, la concentración de CO2 al final de la expiración mediante capnometría (CO2) y el porcentaje saturación de oxígeno (% SAT O2) mediante oximetría. El registro de FR, CO2 y % SAT 02 se realizó en los momentos basal, a los 5 min, 10 min, 15 min, 30 min y 60 min.
-
Parámetros de hipnosis
Se registró índice biespectral (BIS) mediante monitor BIS (Medtronic, Inc., Boulder, CO, USA), previa colocación de sensor BIS autoadhesivo de cuatro electrodos en la región frontal y temporal izquierda de los pacientes, siguiendo normas del fabricante. El registro de BIS se realizó en los momentos basal, a los 5 min, 10 min, 15 min, 30 min y 60 min.
-
Registros de efectos adversos
Se definió como hipotensión arterial (TAS < 20% TAS basal), bradicardia (FC < de 50 latidos/min con hipotensión o FC < de 40 latidos/min), taquicardia (FC > 100 latidos/min) e hipoxemia (% SAT < 90%). Los episodios de hipotensión fueron corregidos con aumento de la infusión de solución fisiológica; de persistir durante más de 1 min, se administraron bolos IV de 5 mg efedrina, dosis que podría repetirse hasta 2 oportunidades. En caso de bradicardia se administró bolo IV 0,01 mg/kg de atropina, dosis que podría repetirse hasta 2 oportunidades.
Análisis estadístico
Para el cálculo del tamaño muestral de 30 pacientes por grupo se consideró un nivel de significación del 5% y una potencia del test (bilateral) igual a 95% para detectar una diferencia en la FR a los 10 minutos entre grupos, de 2 respiraciones por minuto. Se presenta el promedio acompañado del desvío estándar para describir las variables continuas. Para las variables categóricas se presentan las frecuencias junto con los porcentajes. En la comparación de las variables continuas se utilizó el Test t de comparación de medias luego de verificarse el supuesto de normalidad mediante el Test de Kolmogorov-Smirnov. En el análisis de las variables hemodinámicas se utilizó el Test U de Mann-Whitney. En lo que respecta a las variables categóricas se utilizó el Test Chi-cuadrado de independencia o el Test de Fisher para comparar las proporciones entre grupos, según correspondiera. Los resultados con una probabilidad asociada menor que 0,05 se consideraron estadísticamente significativos. Los análisis se realizaron con R Core Team (2019).
-
Resultados
Dos cirugías fueron suspendidas por razones de instrumental quirúrgico (una del grupo MDZ y otra del grupo DEX). Se evaluaron en total 58 pacientes. Los datos demográficos fueron similares en ambos grupos ( Tabla 1 ). En relación con parámetros hemodinámicos, no se halló diferencia significativa entre grupos respecto TAS y TAD. El grupo DEX presentó menor FC en los minutos 10, 15 y 20 (p = 0,001, p = 0,002 y p = 0,004). Respecto a parámetros de ventilación, el grupo MDZ disminuyó la FR 5’ (p < 0,0001), 10’ (p < 0,0001), 15’ (p = 0,001), 30’ (p = 0,001), 45’ (p = 0,0019), 60’ (p = 0,001) (Figura 1 ) y SAT O2 5’ (p = 0,032), 10’ (p = 0,033), 15’ (p = 0,059), 30’ (p = 0,033), 45’ (p = 0,047), 60’ (p = 0,028) (Figura 2 ) comparado con DEX. El grupo DEX menor ETCO2 10’ (p = 0,013) respecto a MDZ. Con relación a parámetros de hipnosis, en el grupo MDZ disminuyó índice BIS 5’ (p < 0,0001), 10’ (p < 0,0001), 15’ (p = 0,001), 30’ (p < 0,001), 45’ (p = 0,003), 60’ (p = 0,038), comparado con DEX (Figura 3 ). Fueron registrados 3 episodios de bradicardia que se revirtieron con atropina (1 paciente grupo MDZ y 2 pacientes grupo DEX). Se registraron 5 episodios de hipotensión que fueron tratados y revertidos con efedrina (4 pacientes grupo MDZ y 1 paciente grupo DEX). No se registraron episodios de hipoxemia.
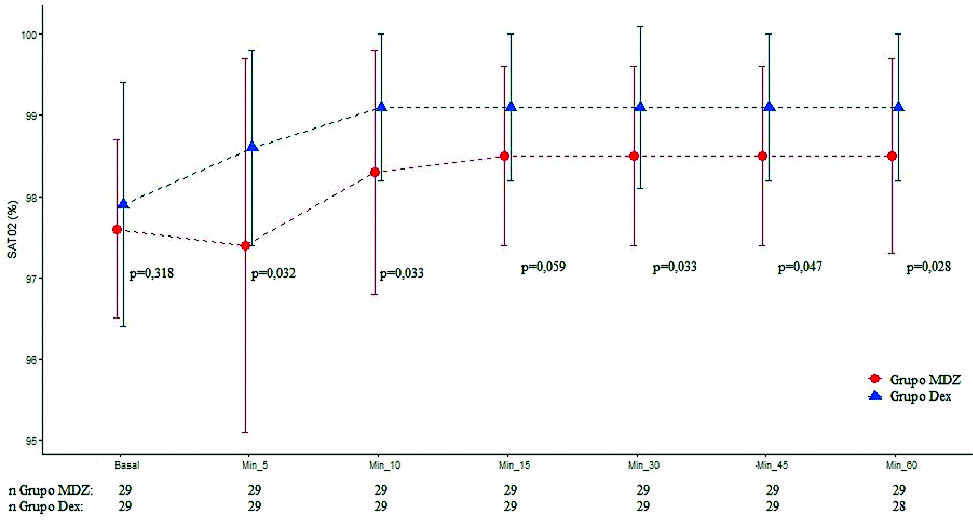
Figura 1. Valor de saturación de O2 en tiempos quirúrgicos según grupos. Los puntos representan los valores y las líneas del desvío estándar de los valores de la SAT O2 en cada uno de los momentos de evaluación según grupo.
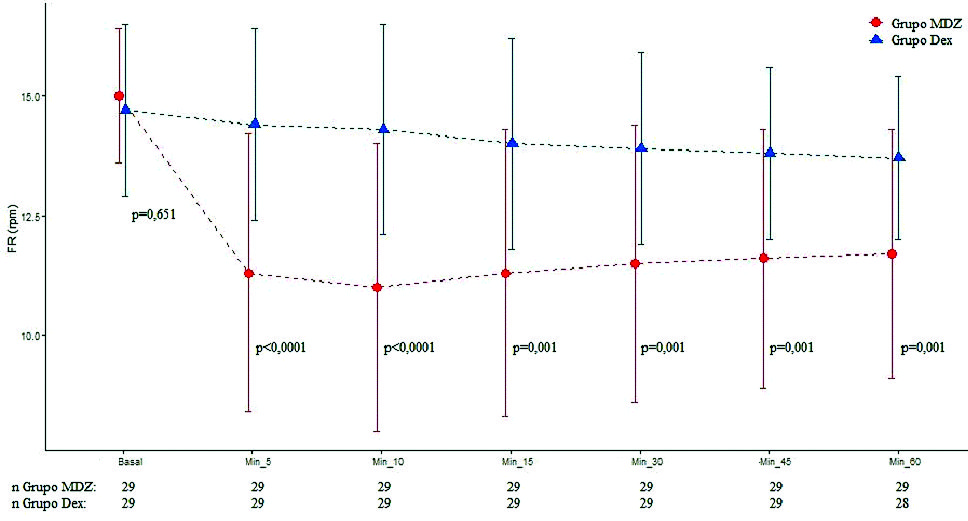
Figura 2. Valor de frecuencia respiratoria en tiempos quirúrgicos según grupos. Los puntos representan los valores y las líneas del desvío estándar de los valores de la SAT O2 en cada uno de los momentos de evaluación según grupo.
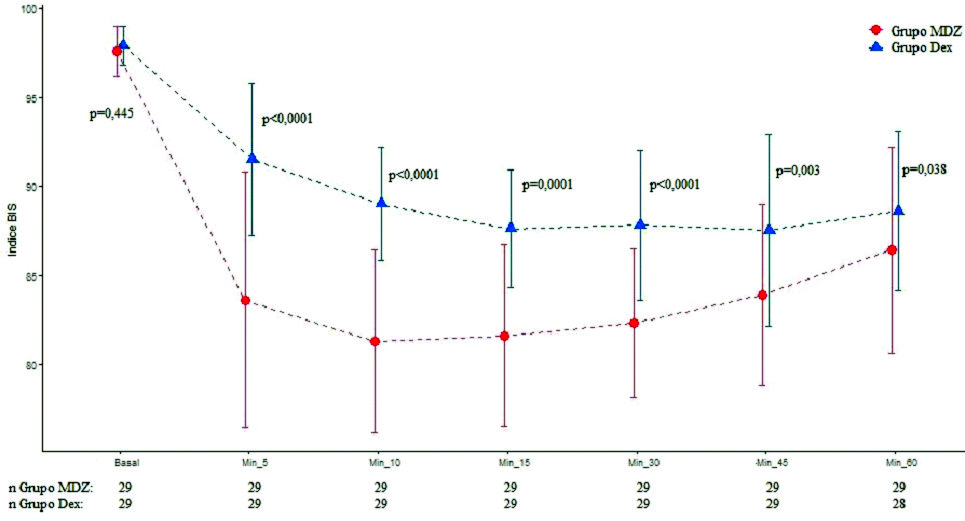
Figura 3. Valor de frecuencia índice BIS en tiempos quirúrgicos según grupos. Los puntos representan los valores y las líneas del desvío estándar de los valores de la SAT O2 en cada uno de los momentos de evaluación según grupo.
-
Discusión
Este estudio demuestra que la infusión de dexmedetomidina en pacientes STOP-Bang positivo, proporciona estabilidad hemodinámica, con mejor control de parámetros de ventilación y profundidad de hipnosis, en comparación con midazolam. Con relación a los parámetros cardiovasculares, no se hallaron diferencias entre grupos en cuanto a TAS o TAD. El grupo DEX presentó menor FC en comparación al grupo MDZ, sin compromiso clínico relevante. En concordancia con estos resultados, Silva-Jr et al.[17] hallaron mayor incidencia de bradicardia en grupo DEX en comparación con MDZ, aunque la diferencia no fue estadísticamente significativa. La dexmedetomidina tiene un efecto hemodinámico bifásico, primero hipertensión transitoria y luego hipotensión con bradicardia refleja, debido a la acción sobre receptores -2 periféricos y centrales[18]. En un estudio en pacientes críticos, Ickeringill et al.[19] encontraron que, evitando el bolo de carga de dexmedetomidina, disminuye las alteraciones tensión arterial y frecuencia cardíaca. En este estudio no se utilizó bolo de carga, evitando de esta manera fluctuaciones hemodinámicas.
Con respecto a los parámetros de ventilación, el grupo MDZ disminuyó significativamente FR y la SAT O2, en comparación con el grupo DEX. Coincidiendo con estos hallazgos, Eren et al.[20] describen mayor porcentaje de desaturación con midazolam comparado con dexmedetomidina. Las benzodiazepinas producen relajación de la musculatura de la vía aérea superior, reduciendo el espacio faríngeo, y aumentando la incidencia de hipoventilación, acción que se agrava con la administración de opioides[21]. En cambio, los agonistas 2, tendrían escasa implicancia en el control central de la respiración, manteniendo la curva de respuesta respiratoria al CO2[22]. Estos cambios observados en la ventilación son similares a los observados durante el sueño fisiológico, reflejados por un descenso del volumen corriente, con escaso cambio en la frecuencia respiratoria. La dexmedetomidina podría provocar colapso de la vía aérea, pero solo en dosis superiores a las utilizadas en esta investigación[23]. Con relación a valores de capnometría, se halló diferencia significativa entre grupos en un solo momento evaluado, sin trascendencia clínica. Actualmente, estándares internacionales, recomiendan utilización de capnógrafo de rutina para el monitoreo de sedaciones en ventilación espontánea[24],[25].
Respecto a la evaluación de la hipnosis, el grupo MDZ disminuyó significativamente el índice BIS, en comparación con el grupo DEX. En concordancia con estos hallazgos, estudios demuestran menores valores de sedación con midazolam en comparación con dexmedetomidina, evaluados por escalas de sedación de Ramsay[19] y RASS (Richmond Agitation-Sedation Scale)[16]. El midazolam en dosis de sedación, afecta la coordinación entre ventilación y el reflejo de deglución a través de la activación de vías gabaérgicas, comprometiendo la integridad de la vía aérea[21]. En contraste, los efectos sedantes de la dexmedetomidina resultan principalmente de la estimulación del parasimpático, y la inhibición del simpático en el locus cereleus del tronco encefálico[26]. Como resultado se produce un patrón de electroencefalograma conocido como espinas de sueño, similares a las producida en la etapa S2 del sueño NREM (Non-Rapid Eye Movement)[27]. Se especula que utilización de monitores de hipnosis, podrían evitar la profundización no deseada de la sedación, pudiendo estar indicado en pacientes con alto riesgo para SAOS[28]-[32].
Estos hallazgos tomados en conjunto, sugieren mayor margen de seguridad cuando se utiliza dexmedetomidina para sedación, en paciente STOP Bang positivo, siendo actualmente recomendados por protocolos internacionales[33],[34]. Pacientes con alto riesgo de SAOS, podrían beneficiarse con otros efectos descriptos para dexmedetomidina, como neuroprotección[35], atenuación del estrés y de la inflamación, mejorando los resultados postoperatorios.
-
Conclusión
La sedación con dexmedetomidina en pacientes STOP-Bang positivo, bajo anestesia espinal, proporciona estabilidad hemodinámica, con mejor control de parámetros respiratorios y profundidad de hipnosis, en comparación con midazolam.
Agradecimientos: A Juan Catá MD, Profesor Asociado MD Anderson Cancer Center, The University of Texas, Houston, USA, por sus valiosos aportes y revisión crítica del manuscrito.
Referencias
1. American Society of Anesthesiologists: Continuum of depth of sedation: Definition of general anesthesia and levels of sedation/ analgesia. Approved by ASA House of Delegates on October 13, 1999 and last amended on October 15, 2014. Available at: http://www.asahq.org/quality-and-practice-management/practice-guidance-resource-documents/continuum-of-depth-ofsedation- definition-of-general-anesthesia-and-levels-of-sedationanalgesia
2. Yegneswaran B, Chung F. The importance of screening for obstructive sleep apnea before surgery. Sleep Med 2009; 10:270-1. https://doi.org/10.1016/j.sleep.2008.02.009
3. Chung F, Memtsoudis S, Ramachandran S, Nagappa M, Opperer M, Cozowicz C, et al. Society of Anesthesia and Sleep Medicine Guidelines on Preoperative Screening and Assessment of Adult Patients With Obstructive Sleep Apnea. Anesth Analg 2016; 123:452-73. https://doi.org/10.1213/ANE.0000000000001416
4. den Herder C, Schmeck J, Appelboom DJ, de Vries N. Risks of general anaesthesia in people with obstructive sleep apnea. BMJ 2004; 329:955-9. https://doi.org/10.1136/bmj.329.7472.955
5. McEntire DM, Kirkpatrick DR, Kerfeld MJ, Hambsch ZJ, Reisbig MD, Agrawal DK, Youngblood CF. Effect of sedative-hypnotics, anesthetics and analgesics on sleep architecture in obstructive sleep apnea. Expert Rev Clin Pharmacol. 2014; 7, 6:787-806. https://doi.org/10.1586/17512433.2014.966815
6. Chung F, Hillman D, Lydic R. Sleep medicine and anesthesia: new horizon for anesthesiologists. Anesthesiol 2011; 114:1261-1262. https://doi.org/10.1097/ALN.0b013e318216e858
7. Chung F, Liao P, Farney R. Correlation between the STOP-Bang score and the severity of obstructive sleep apnea. Anesthesiol 2015; 122:1436-1437. https://doi.org/10.1097/ALN.0000000000000665
8. Chung F, Subramanyam R, Liao P, Sasaki E, Shapiro C, Sun Y. High STOP-Bang score indicates a high probability of obstructive sleep apnoea. Br J Anaesth. 2012; 108:768-775. https://doi.org/10.1093/bja/aes022
9. Gross JB, Bachenberg KL, Benumof JL, et al; American Society of Anesthesiologists Task Force on Perioperative Management. Practice guidelines for the perioperative management of patients with obstructive sleep apnea: a report by the American Society of Anesthesiologists Task Force on Perioperative Management of patients with obstructive sleep apnea. Anesthesiology. 2006; 104:1081-1093. https://doi.org/10.1097/00000542-200605000-00026
10. Gross JB, Apfelbaum JL, Caplan RA, et al. Practice guidelines for the perioperative management of patients with obstructive sleep apnea. An updated report by the American Society of Anesthesiologists Task Force on perioperative management of patients with obstructive sleep apnea. Anesthesiology. 2014; 120:268-286. https://doi.org/10.1097/ALN.0000000000000053
11. Ankichetty S, Wong J, Chung F. A systematic review of the effects of sedatives and anesthetics in patients with obstructive sleep apnea. J Anaesthesiol Clin Pharmacol. 2011;27: 447-458. https://doi.org/10.4103/0970-9185.86574
12. Scholz J, Tonner PH. a2-adrenoceptor agonists in anaesthesia: a new paradigm. Curr Opin Anesthesiol. 2000; 13: 437-42 https://doi.org/10.1097/00001503-200008000-00007
13. Vega Sepúlveda R. Experiencias prácticas con dexmedetomidina. En: Sepulveda P, editor. La anestesia intravenosa II. Chile, Santiago; 2006. p.115-125.
14. Vega Sepúlveda R. dexmedetomidina: rol actual y futuro en anestesia. En: Sepulveda P, editor. La anestesia intravenosa (o endoflevosa). Chile, Santiago; 2014. p. 177-190.
15. Ramsay MA, Luterman DL. Dexmedetomidine as total intravenous anesthesia agent. Anesthesiol 2004; 101: 787-90. https://doi.org/10.1097/00000542-200409000-00028
16. Silva-Jr JM, Katayama HT, Nogueira FAM, Moura TB, Alves TL, Oliveira BW. Comparison of dexmedetomidine and benzodiazepine for intraoperative sedation in elderly patients: a randomized clinical trial. Reg Anesth Pain Med. 2019; 44, 3:319-324. https://doi.org/10.1136/rapm-2018-100120
17. Afonso J, Reis F. Dexmedetomidina: rol actual en anestesia y cuidados Intensivos. Rev Bras Anestesiol 2012; 62: 1: 118-133. https://doi.org/10.1590/S0034-70942012000100015
18. Ickeringill M, Shehabi Y, Adamson H. Dexmedetomidine infusion without loading dose in surgical patients requiring mechanical ventilation: haemodynamic effects and efficacy. Anaesth Intensive Care 2004; 32:741-745. https://doi.g/10.1177/0310057X0403200602
19. Eren G, Cukurova Z, Demir G, Hergunsel O, Kozanhan B, Emir NS. Comparison of dexmedetomidine and three different doses of midazolam in preoperative sedation. J Anaesth Clin Pharmacol 2011; 27:367-72. https://doi.org/10.4103/0970-9185.83684
20. Hårdemark Cedborg A, Sundman E, Bodén K, Hedström H, Kuylenstierna R, et al. Effects of Morphine and Midazolam on Pharyngeal Function, Airway Protection, and Coordination of Breathing and Swallowing in Healthy Adults. Anesthesiol 2015; 122:1253-67. https://doi.org/10.1097/ALN.0000000000000657
21. Mahmoud M. Dexmedetomidine: The science and clinical aspects in adults and children 2017; 221-244. En: Absalom AR, Mason KP. Total Intravenous Anesthesia and Target Controlled Infusions. 2017, Cham, Switzerland. https://doi.org/10.1007/978-3-319-47609-4_13
22. Lodenius Å, Maddison KJ, Lawther BK, Scheinin M, Eriksson LI, Eastwood PR, Hillman DR, Fagerlund MJ, Walsh JH. Upper airway collapsibility during dexmedetomidine and propofol sedation in healthy volunteers. A nonblinded randomized crossover study. Anesthesiology 2019; 131:962-73. https://doi.org/10.1097/ALN.0000000000002883
23. Venkatesh S, Bhavani S. Capnometry in the spontaneously breathing patient. Anaesthesiol 2004; 17: 517-520. https://doi.org/10.1097/00001503-200412000-00013
24. Whitaker D, Benson J. Capnography standards for outside the operating room. Anaesthesiol 2016; 29:485-492. https://doi.org/10.1097/ACO.0000000000000355
25. Ebert T, Maze M. Dexmedetomidine: another arrow for the quiver. Anaesthesiol 2004; 17:517-520.
26. Huupponen E, Maksimow A, Lapinlampi P, Sarkela M, Saastamoinen A, Snapir A, et al. Electroencephalogram spindle activity during sedation and physiological sleep. Acta Anaesthesiol Scand 2008; 52: 289-294. https://doi.org/10.1111/j.1399-6576.2007.01537.x
27. Triltsch AE, Welte M, von Homeyer P. Bispectral index-guided sedation with dexmedetomidine in intensive care: a prospective, randomized, double blind, placebo-controlled phase II study. Crit Care Med 2002; 30:1007-1014. https://doi.org/10.1097/00003246-200205000-00009
28. Jo YY, Lee D, Jung WS, Cho NR, Kwak HJ. Comparison of intravenous dexmedetomidine and midazolam for bispectral index-guided sedation during spinal anesthesia. Med Sci Monit 2016; 22:3544-3551. https://doi.org/10.12659/MSM.896461
29. Sheahan CG, Mathews DM. Monitoring and delivery of sedation. Brit J Anaesth 2014; 113 (S2): ii37-ii47. https://doi.org/10.1093/bja/aeu378
30. Fahy B, Chau D. The Technology of processed electroencephalogram monitoring devices for assessment of depth of anesthesia. Anesth Analg 2018; 126:111-7. https://doi.org/10.1213/ANE.0000000000002331
31. Eagleman S, Drover D. Calculation of consciousness: electroencephalography analyses to determine anesthetic depth. Curr opin Anesthesiol 2018; 31, 4: 431-438. https://doi.org/10.1097/ACO.0000000000000618
32. American Society of Anesthesiologists. Practice Guidelines for Moderate Procedural Sedation and Analgesia. 2018. Anesthesiology 2018; 128:437-79. https://doi.org/10.1097/ALN.0000000000002043
33. Chung SA, Yuan H, Chung F. A systemic review of obstructive sleep apnea and its implications for anesthesiologists. Anesth Analg 2008; 107:1543-1563. https://doi.org/10.1213/ane.0b013e318187c83a
34. Ma D, Hossain M, Rajakumaraswamy N. Dexmedetomidine produces its neuroprotective effect via the alpha2A-adrenoceptor subtype. Eur J Pharmacol. 2004; 502:87-97. https://doi.org/10.1016/j.ejphar.2004.08.044
35. Wang K, Wu M, Xu J, Wu CH, ZhangB, Wang G, Ma D. Effects of dexmedetomidine on perioperative stress, inflammation, and immune function: systematic review and meta-analysis. Brit J Anaesth 2019; 123, 6: 777-794. https://doi.org/10.1016/j.bja.2019.07.027

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution