Antonia Arrate V. 1 , Gabriel Ramírez L. 1 , Claudia Jiménez E., M.D. 2 , Felipe Contreras G., M.D. 2 , Mauricio González L., M.D. 2 , Felipe Maldonado C., M.D., M.Sc. 2 .
Recibido: 12-08-2020
Aceptado: 24-10-2020
©2020 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 49 Núm. 6 pp. 824-835|https://doi.org/10.25237/revchilanestv49n06-08
PDF|ePub|RIS
Spinal fluid drainage catheter: uses, technique, and complications for the anesthesiologist
Abstract
Spinal drainage catheter installation is a procedure indicated essentially in the repair of aortic aneurysms and the neurosurgery setting. It is not always a simple procedure where dilemmas arise about the indication, technique, and complications. The following article reviews each of these topics.
Resumen
La instalación de un catéter de drenaje espinal es un procedimiento indicado principalmente en la reparación de aneurismas aórticos y en el escenario de neurocirugía. No siempre es un procedimiento fácil de realizar donde surgen dudas sobre indicación, técnica y eventuales complicaciones. En el siguiente artículo revisamos cada uno de estos temas.
-
Introducción
La instalación del catéter de drenaje espinal (CDE) es un procedimiento invasivo que permite el drenaje del líquido cefalorraquídeo (LCR), terapia que ha ganado popularidad y evidencia en distintos escenarios clínicos. En cardiocirugía su principal indicación y donde ha demostrado utilidad, es en la cirugía de reparación de aneurismas de la aorta torácica y toracoabdominal, donde se busca evitar la isquemia medular, una de sus complicaciones más temidas. En neurocirugía se ha utilizado para controlar la hipertensión intracraneal (HIC) refractaria, prevención de complicaciones secundarias a hemorragias subaracnoidea aneurismática (HSAa), manejo de fístulas del LCR, entre otros[ 1 ].
A pesar de estas aceptadas indicaciones, su instalación no es un procedimiento inocuo y se asocia a complicaciones, las que aumentan debido a falta de experiencia del operador y una inadecuada técnica de inserción.
El objetivo de esta revisión es entregar una visión general de la evidencia actual en torno a su uso, describir cómo hemos desarrollado la técnica de instalación en nuestro centro, su posterior configuración y detallar las complicaciones para el anestesiólogo.
-
Drenaje espinal en cirugía cardiovascular
La médula espinal es en extremo sensible a la isquemia, bastan solo minutos para producir un infarto medular con consecuencias devastadoras. Una de las complicaciones más catastróficas en el tratamiento de patologías de la aorta torácica y toracoabdominal es la isquemia medular, con una incidencia que varía dependiendo del abordaje quirúrgico. En cirugía abierta (cada vez menos frecuente) puede llegar hasta 20%, mientras que en cirugía endovascular el daño neurológico permanente puede ser 2%-14% y el daño temporal hasta 20%[2], produciendo desde paresia hasta paraplejia[3]. Lo que demuestra que la incidencia de isquemia medular no ha disminuido a pesar de técnicas más modernas de reparación endovascular.
Existen distintas estrategias perioperatorias para proteger la médula espinal en este tipo de cirugías: evitar episodios de hipotensión, sangrado y presión elevada de LCR durante el intra y en el postoperatorio, disminución del tiempo de pinzamiento aórtico, reimplantación selectiva de arterias intercostales, intervenciones farmacológicas, hipotermia epidural focalizada y el uso de CDE[2],[4],[5]. La disminución de la perfusión de la médula espinal persiste después de la operación, por lo que, se recomienda mantener
esta monitorización en el postoperatorio inmediato. El drenaje de LCR es el único método con evidencia dirigido a mitigar la isquemia medular. Un estudio aleatorizado demostró disminuir el riesgo de paraplejia desde 13% hasta 2,6%, y estudios posteriores confirmaron baja incidencia de paraplejia en ese grupo de pacientes[ 5 ],[6]. Actualmente, el CDE es indicación clase IB en las guías estadounidenses y una fuerte recomendación en pacientes de alto riesgo en las guías europeas[3],[5],[7],[8]. Una reciente revisión sistemática sobre recomendaciones del uso de drenaje de LCR durante la reparación del aneurisma aórtico endovascular muestra que los diferentes protocolos para drenaje de LCR incluyen más comúnmente el drenaje pasivo hasta lograr una presión objetivo intra y postoperatoria entre 8 y 12 mmHg. La incidencia de isquemia medular varió de 0% a 17% en pacientes con drenaje LCR y de 0% a 50% en aquellos sin drenaje LCR. Las tasas de complicaciones relacionadas con CDE oscilaron entre < 1% y 28%[ 9 ].
El uso de CDE se basa en el hecho de que la presión de perfusión de la médula espinal (PPME) está determinada por la diferencia entre la presión arterial espinal y la presión del LCR, cuando este último excede a la presión arterial espinal se alcanza una presión crítica de cierre que colapsa los vasos[10], por lo que, aumentando la presión arterial espinal o disminuyendo la presión del LCR se mejoraría la PPME[3],[5], punto crítico en el manejo de un CDE. Esto se ha convertido en un procedimiento habitual de manejo y cuidado perioperatorio en cirugías con riesgo de isquemia medular. Su utilización ha demostrado mayor utilidad cuando la monitorización y drenaje de LCR se asocia en el intraoperatorio al uso de potenciales evocados motores (Figura 1) y se prolonga el control de presión/drenaje de LCR hasta 48 h del postoperatorio. Sin embargo, es un procedimiento invasivo no exento de potenciales complicaciones[ 11 ],[12], de las cuales las más frecuentes son hematoma epidural/subdural y espinal, parálisis de nervio, catéteres retenidos, meningitis/infección y cefalea postpunción
-
Drenaje espinal en neurocirugía
Existen múltiples usos del CDE en el ámbito neuroquirúrgico, sin embargo, hay poca evidencia de alta calidad para muchos de ellos. Describimos a continuación algunos de sus usos.
Prevención y tratamiento de fugas de LCR
Las fugas de LCR secundarias a resección de tumores del SNC o cirugías de columna se asocian a múltiples complicaciones: infecciones; fístulas subaracnoideas-cutáneas; derivadas de la hipotensión intracraneal; déficits neurológicos por compresión o encarcelamiento de elementos neurales; falla de artrodesis vertebrales y siembra tumoral en resección de tumores malignos de columna[13].
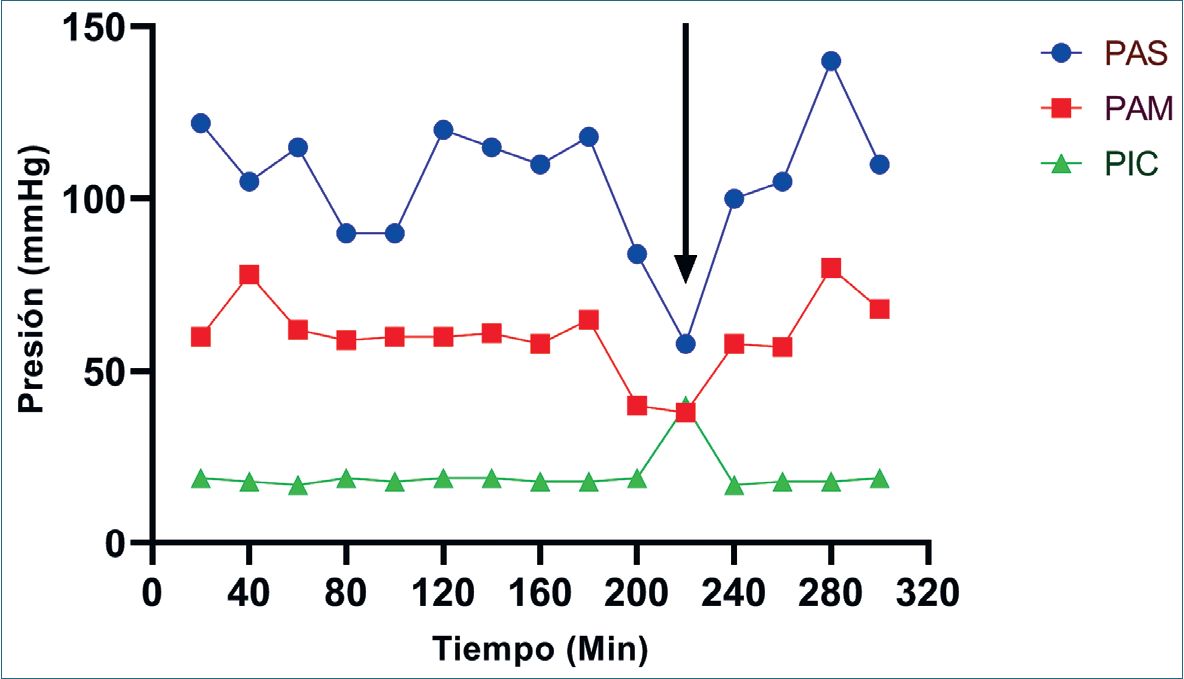
Figura 1. Caso clínico. En el gráfico presión tiempo se observa el comportamiento de la presión arterial sistólica (PAS), media (PAM) y la presión intracraneal (PIC). La flecha indica una disminución de la señal en potenciales evocados. A pesar del uso de drogas vasoactivas, sólo retirando 20 mL de líquido cefalorraquídeo por el drenaje espinal, se logra la normalización de los potenciales evocados.
Existen indicadores que permiten distinguir aquellas con menos probabilidades de sanar espontáneamente, como las fugas de LCR que se desarrollan días o semanas después del trauma quirúrgico, fugas masivas que se desarrollan inmediatamente posterior a la cirugía o fugas de LCR de presión normal[ 14 ]. La mayoría se resuelven con medidas conservadoras en 1-10 días[ 1 ],[14], pero en caso de que no tengan efecto o existan predictores de que la fuga no sanará espontáneamente, se deben tomar medidas más invasivas. Clásicamente, se utilizan distintos tipos de suturas para reparar el defecto en la duramadre e incluso parches de sangre o de fascia muscular, los que pueden ser utilizados inmediatamente si la fuga se detecta en el intraoperatorio. Sin embargo, si ésta se hace evidente en el postoperatorio, podría ser necesaria una reintervención, de incidencia relativamente baja, pero con gran morbimortalidad asociada[13]. Además, las suturas del defecto tienen una falla de 5%-9%[ 15 ].
En este contexto, surge el CDE como una opción tanto frente a una reintervención quirúrgica[ 1 ], como durante el intraoperatorio para prevención y en el periodo postquirúrgico como tratamiento de fugas de LCR. Su utilidad radica en la Ley de Poiseuille: la reducción del flujo de LCR a través del defecto dural abierto se puede enlentecer al disminuir la diferencia de presión del LCR entre el espacio intradural y el extradural a través de la derivación lumbar de LCR, permitiendo que la brecha dural sane[ 13 ],[16].
En presencia de HIC, simultáneamente se utilizan derivaciones ventrículo-peritoneales o lumbo-peri-toneales[ 13 ], sin embargo, la utilización de CDE de forma temporal por 5-7 días permite que el defecto de la duramadre sane, con una tasa de éxito de 85%- 94%[15]. Es importante considerar que el número de días y el volumen de LCR a drenar necesarios para lograr el cierre no están bien definidos ni estudiados. Ha sido descrito que drenar 120-360 ml/día por 3-5 días conferirá una tasa de éxito del 90%-92% en el tratamiento de fístulas de LCR[ 16 ], pero existe poca evidencia confiable al respecto.
Relajación cerebral intraoperatoria
Técnica utilizada en neurocirugía para lograr un mejor acceso a la lesión objetivo y reducir lesiones iatrogénicas secundarias a la retracción intraoperatoria. Existen varios métodos para lograr una adecuada relajación cerebral intraoperatoria: hiperventilación, agentes hiperosmóticos y el CDE intraoperatorio. Este último logra aumentar el espacio intracraneal al drenar LCR, de forma segura y sin interferir con el volumen sanguíneo circulante ni el equilibrio hidroelectrolítico[ 1 ]. Las complicaciones asociadas al uso de CDE son menores a 10% y ocurren generalmente por drenajes prolongados, desarrollándose en un lapso subagudo a crónico[ 17 ]. Algunas complicaciones graves, pero infrecuentes, son la hemorragia intracraneal y la herniación amigdalar cerebelosa aguda, que ocurren especialmente en pacientes con malformación asintomática de Chiari Tipo I[ 17 ],[18]. Actualmente, no existen estudios que comparen la eficacia de los agentes hiperosmóticos, como manitol y la solución salina hipertónica con el CDE.
Control de hipertensión intracraneal refractaria
El tratamiento de primera línea de la HIC secundaria a lesiones cerebrales traumáticas se basa en las recomendaciones de la Brain Trauma Foundation: medidas generales, sedantes, relajantes musculares, uso de soluciones osmóticas hiperosmolares, drenaje ventricular externo de LCR e hiperventilación leve. Si con estas medidas no se logra controlar la presión intracraneal (PIC) se pueden utilizar medidas de segunda línea: hipotermia moderada, hiperventilación con pCO2 < 30 mmHg, coma inducido por barbitúricos y craniectomía descompresiva. Sin embargo, algunas de estas medidas disminuyen el flujo sanguíneo cerebral, y por ende, la oxigenación, produciendo isquemia cerebral. Usualmente estos pacientes se encuentran inestables, resultando en un mal pronóstico y en el aumento de la morbimortalidad[ 19 ],[20].
Una contraindicación de la punción lumbar es la HIC, debido al riesgo de herniación transtentorial o amigdalina, por lo que durante muchos años se asumió esta misma indicación para el CDE. Sin embargo, en 1990 se comenzó a utilizar el CDE para tratamiento de HIC refractaria en pacientes pediátricos con resultados alentadores, evidenciando una disminución de la PIC sin ningún tipo de hernia cerebral[ 21 ].
Hemorragia subaracnoidea aneurismática
Una menor mortalidad por HSAa en la población, se acompaña de un aumento en la incidencia de complicaciones secundarias (vasoespasmo e isquemia cerebrales tardía), las que se producen entre 20%-50% de todos los pacientes sobrevivientes a HSAa[ 22 ]. Estas dependen principalmente del volumen, densidad y la persistencia de coágulos en el espacio subaracnoideo o cavidades ventriculares, donde los productos de descomposición de la hemoglobina estarían involucrados[ 23 ],[24].
Dentro de las múltiples técnicas para prevenir estas complicaciones, Macdonald y cois. y Hanggi y cois. [25],[ 26 ] proporcionan evidencia para el uso de CDE. Describen que el drenaje del LCR reducía la incidencia y las posibles consecuencias del vasoespasmo, con una tasa más baja de complicaciones en comparación a los otros métodos. Se ha observado que mediante un CDE se logra una eliminación más eficiente de los productos de descomposición de la hemogiobina dei LCR versus el uso de drenaje ventricular externo, con potenciales beneficios ciínicos[ 27 ].
Por otro iado, un metaanálisis que inciuyó estudios observacionales y ensayos aleatorios controlados (EAC)[ 23 ], determinó que el CDE es útil para prevenir infartos cerebrales vinculados a isquemia cerebral tardía y disminuye el riesgo de discapacidad grave. Sin embargo, el anáilsis de los 2 EAC de aita caildad no mostró diferencias en el RR en prevención de infartos, y no mejora el resuitado a los 6 meses post HSAa[ 28 ].
Si bien el uso de CDE no tuvo efecto estadísticamente significativo sobre el riesgo de mortaildad, esto no sería por la técnica en sí, ya que no aumenta el riesgo de resangrado[ 29 ],[30], sino que probabiemente por otros mecanismos aún no determinados.
Meningitis bacteriana y ventriculitis
Ei tratamiento actual para meningitis bacteriana y ventriculitis (MB/V) aguda grave, son antibióticos endovenosos precoz, sin embargo, de los pacientes que ingresan a Unidad de Cuidados Intensivos por esta patoiogía, la mortaiidad y morbilidad grave es entre 17,1%- 77,5%, siendo la causa más frecuente de muerte la HIC refractaria. El uso de CDE para disminuir la HIC y la presencia de citoquinas en el LCR, ha mostrado una reducción en la mortalidad de estos pacientes[ 31 ]. Las contraindicaciones en este contexto corresponden a la presencia de masas focales, como abscesos, coaguiopatías, infección en el sitio de punción y presencia de papliedema, siendo esta última una contraindicación no absoluta[ 1 ],[31]. También, se describe el uso de CDE para administrar antibióticos en el LCR como tratamiento de pacientes con MB/V posquirúrgica producidas por microorganismos muitirresistentes, con menor tasa de recaída infecciosa[ 32 ]. Sin embargo, aún se requiere evidencia de aita calidad.
Valor predictivo en hidrocefalia normotensiva
La hidrocefalia normotensiva (HNT) o crónica del adulto, es una causa de demencia potencialmente reversible. Descrita por Hakim y Adams en 1965 con la triada clínica de alteración aguda de la marcha, incontinencia urinaria y alteraciones cognitivas[ 33 ], se clasifica en primaria o idiopática y secundaria. En la HNT primaria existe presión normal de LCR y evidencia de ventriculomegalia en imágenes[34],[35],[36],[37]. Dado que el tratamiento es quirúrgico usando una derivación ventrículo-peritoneal, es fundamental realizar una adecuada selección y predicción de respuesta al tratamiento.
Generalmente, se realizan punciones lumbares repetidas para evaluar respuesta clínica. El uso de CDE ha demostrado ser un buen predictor de efectividad de la cirugía de derivación, alcanzando una sensibilidad de 50%-100%, especificidad de 80%-100%, valor predictivo positivo 80%-90% y un valor predictivo negativo de 36%-90%[34],[35],[36],[38],[39],[40], io que indica que aquellos pacientes con una prueba positiva serían candidatos idóneos para la cirugía.
-
Instalación del catéter de drenaje espinal
Para la instaiación dei CDE se deben considerer los elementos disponibles para ello. En muchas partes se sigue utilizando un equipo de catéter epidural a través de un trocar tuohy 16 o 18 Gauge, el que no está diseñado para drenaje de LCR, presentando una alta tasa de daño vascular y oclusión luego de instalado, haciendo que no sea aconsejable. Actualmente, existen equipos comerciales disponibles, en nuestro centro el kit “EDM Lumbar Drainage Kit with 120 mL Graduated Chamber” es el más usado. Este kit contiene una serie de insumos prediseñados para el drenaje de LCR. Sugerimos familiarizarse con cada parte del Kit previo a la instalación (Figura 2) y realizar el procedimiento con dos operadores bajo estrictas condiciones de esterilidad.
Para fines prácticos, describiremos el procedimiento en dos etapas:
1. Procedimiento de instalación del catéter.
2. Instalación y configuración del sistema de drenaje externo.
-
Procedimiento de instalación del catéter
Preparación: Cubrir una mesa de trabajo con paños estériles. Retirar insumos desde bandeja sellada del kit. Extender el equipamiento en mesa (Tabla 1). Sugerimos que las piezas pequeñas del equipo sean dejadas dentro de una bandeja estéril para evitar su caída accidental.
| Tabla 1. Equipamiento |
| Mesa de trabajo amplia |
| Ropa, paños y guantes estériles |
| Copela y torulero |
| Desinfectante (clorhexidina) |
| Jeringas de 5 y 10 ml |
| Lidocaína 2% 5 ml |
| Aguja #25 |
| Solución fisiológica 20 ml |
| Kit de drenaje lumbar para drenaje externo y monitoreo |
Inserción de guía metálica: Retirar la guía del envase, usar aguja roma (Figura 2) para cebar con solución fisiológica el catéter y así facilitar la inserción de la guía metálica. El insertar la guía le confiere al catéter la rigidez necesaria para ingresar por el trocar Tuohy y avanzar hasta el espacio subaracnoideo.
Punción: Primero posicionar al paciente, sugerimos puncionar en decúbito lateral para evitar un reflujo excesivo de LCR por trocar Tuohy durante el procedimiento. Se debe preparar la piel del paciente lavando con agua y jabón, luego secar para finalizar con el uso de desinfectante tipo clorhexidina. Manteniendo la esterilidad, se procede a elegir el espacio a puncionar (L3-L4 o el mejor espacio palpable hacia caudal). Luego de infiltrar con anestesia local, se punciona con el trocar 14G Tuohy que viene en el kit. Este sistema está diseñado para realizar una punción directa, sin embargo, sugerimos utilizar la técnica de baja resistencia, para así guiar la punción, buscar el espacio peridural y, luego cruzar controladamente la
duramadre. Para esto, avanzar el trocar hasta sentir el ligamento interespinoso, retirar el mandril del trocar y conectar la jeringa de baja resistencia previamente llenada con solución fisiológica, evitando la presencia de burbujas en su interior. Al cruzar la duramadre, existirá una salida de líquido hacia la jeringa de baja resistencia, que, al estar con solución fisiológica, se observará como una mezcla de líquidos y un sutil desplazamiento del émbolo hacia el exterior.
Introducción del catéter: Confirmar que el trocar Tuohy se encuentra dirigido con su bisel hacia cefálico. Un segundo operador estará esperando con el catéter en sus manos para introducirlo rápidamente cuando el primer operador desconecte la jeringa de baja resistencia del trocar Tuohy. En ese momento existirá salida de LCR, por lo que se debe minimizar el tiempo entre desconexión e introducción del catéter. A diferencia de un catéter peridural clásico, el CDE viene graduado con su primera marca a 11 cm de la punta, y luego una marca cada 5 cm. Sugerimos introducir el catéter profundo a unos 20-25 cm para evitar desplazamientos accidentales durante el retiro del trocar Tuohy. Es normal que el paciente pueda experimentar parestesias durante la introducción del catéter, signo de que éste ha entrado en contacto con alguna estructura nerviosa, por lo que en ese momento se debe detener la introducción, retirar 1 cm y evaluar la desaparición del síntoma (ventaja de realizar el procedimiento con paciente despierto). Sugerimos dejar el catéter entre 8-15 cm dentro del espacio subaracnoideo, para así evitar desplazamientos y asegurar una correcta recolección de LCR por las 4 filas de agujeros en su punta, siempre con la precaución de no generar parestesia ni síntomas neurológicos. Finalmente, en el extremo distal del catéter, revisar la salida de LCR llevando transitoriamente la punta distal bajo el nivel del paciente (sin contaminar) y observando la salida de gotas de LCR por gravedad. Introducir la pieza transparente liberadora de tensión (“strain relief”, Figura 2) y utilizar como tapa el conector luerlock que se inserta en el extremo distal del catéter, juntando posteriormente ambas piezas. Luego, conectar una llave de tres pasos estéril para usarla como sistema de revisión de permeabilidad del catéter a futuro.

Figura 2. Equipamiento de kit para drenaje espinal. Extraído de “Product-catalog” Medtronic.
Fijación: El kit cuenta con dos pestañas de fijación tipo abrazaderas que se adhieren a la piel mediante un punto de sutura. Tener precaución que el catéter no quede completamente doblado al salir de la piel, para evitar su obstrucción, se puede usar una pequeña gasa estéril bajo el catéter y evitar su angulación. Cubrir con apósitos tipo tegaderm para proteger el sitio de punción y el catéter. Mediante estos pasos, el catéter queda instalado y podría ser usado para el drenaje de LCR.
Dado que generalmente estos catéteres se indican tanto para uso en el quirófano como para drenaje de LCR en sala, procederemos a describir las dos técnicas de drenaje de LCR que usamos en nuestro centro.
-
Instalación y configuración del sistema de drenaje externo
Dependiendo del objetivo terapéutico y la patología subyacente del paciente, los catéteres pueden configurarse para que realicen extracción de LCR por presión o manteniendo un flujo continuo de líquido. En cirugía de aorta torácica, el objetivo es evitar un aumento de la presión de LCR perimedular, protegiendo de eventuales eventos isquémicos regionales que puedan relacionarse a edema. En este escenario, el nivel de presión objetivo se establece generalmente usando la altura del drenaje en relación al paciente. Así, dejando el nivel de drenaje a 10 cmH2O sobre el conducto auditivo externo (CAE), el líquido fluirá cuando la presión a nivel lumbar sobrepase los 10 cmH2O (7,36 mmHg). En neurocirugía en cambio, para tratar fístulas de LCR, se prefiere un flujo continuo de líquido que asegure una salida a nivel lumbar. En este caso, se realiza la conexión CDE a una bomba de infusión configurada para extracción de líquido, asegurando un flujo continuo por hora. En ambas situaciones, el sistema de drenaje debe cebarse con LCR del paciente o con solución salina estéril. La manipulación de cualquier zona del catéter en contacto con el contenido del lumen (llaves de tres pasos, cambios de bolsas de recolección, etc.) debe ser la mínima posible y siempre asegurar esterilidad.
Para la instalación a flujo sugerimos conectar mediante alargadores arteriales tipo macho-macho y macho-hembra al canal secundario de una bomba de infusión, lo que permitirá configurar la extracción del paciente y usar una bolsa reservorio en el extremo final de la “bajada” (Figura 2). Muchas bombas requieren que el canal primario de infusión esté en funcionamiento para que el canal secundario pueda aspirar. De ser así, sugerimos dejar en un mínimo el canal primario (0,1 mL/h) y el canal secundario a el objetivo terapéutico (Ej: 5 mL/h) esto permitirá que el recolector junte 5,1 mL por hora y pueda cuantificarse la extracción de LCR.
En caso de decidir una instalación con objetivo de presión, el sistema se conectará a un sistema de drenaje externo que consiste generalmente en un reservorio graduado plástico con el extremo distal del drenaje ubicado en la parte superior del reservorio. Este punto define la altura de referencia del sistema de drenaje en donde se hará “cero” con el paciente.
El “cero” o nivel de presión en relación al paciente, puede ser a nivel del CAE (hace referencia a la presión de LCR a nivel de polígono de Willis), a nivel axilar (en relación a las aurículas), a nivel medular donde se encuentra la zona de riesgo de isquemia medular o a nivel lumbar en el sitio de inserción. La decisión de “cero” se debe definir según el objetivo terapéutico: un cero a 10 cm sobre el nivel del CAE va a permitir el drenaje cuando en el polígono Willis la presión de LCR supere los 10 cmH2O, lo que puede no ser óptimo para proteger la presión a nivel medular (más aún si el paciente está sentado, por ser esta una columna hidrostática). La elección a nivel axilar o toracolumbar puede ser adecuada en el caso de sospecha de isquemia medular, pero puede generar un aumento de la salida de LCR generando fenómenos de hipotensión de LCR a nivel encefálico, con riesgo de hematoma subdural o sintomatología neurológica, lo que es mayor si se elige el nivel lumbar. Es siempre necesario considerar la patología y el estado clínico del paciente.
-
Precauciones
El extremo distal del CDE nunca debe quedar a caída libre o bajo el paciente, por el riesgo de drenar un exceso de LCR, disminución de la PIC, hematomas e incluso muerte. Siempre realizar un manejo en ambiente estéril estricto para disminuir el riesgo de contaminación y eventual meningitis. En su retiro, sugerimos el uso de un punto de sutura en la piel para evitar el desarrollo de fístula de LCR a nivel lumbar en el trayecto de inserción, lo cual debe ser monitorizado en los días posteriores al retiro
-
Complicaciones del CDE
El uso de CDE es un procedimiento no exento de complicaciones, se han descrito distintos tipos de eventos adversos, algunos de ellos asociados incluso a mortalidad[ 1 ],[41].
Las formas de clasificar las complicaciones asociadas del CDE son variadas entre un reporte y otro. Algunos autores las han dividido según su naturaleza (infecciosas, mecánicas, derivadas del drenaje de LCR propiamente tal, etc.), o según su gravedad (leves, moderadas y graves). Sin embargo, proponemos una clasificación basada en temporalidad del procedimiento, la cual se muestra en la Tabla 2, adjuntando algunos comentarios como los factores que pueden favorecerlas y aquellos que pueden contribuir a limitar su frecuencia de aparición[1],[5],[41].
| Tabla 2. Complicaciones | |||
| Tipo de complicación | Factores predisponentes | Recomendaciones para evitar su ocurrencia | Manejo de la complicación |
| 1. Derivadas de la Punción/inserción: | |||
| a) Daño medular o de raíz nerviosa | – Poca presencia de LCR al momento de la punción – Realización del procedimiento bajo anestesia general | – Operador experto
– Buena técnica – Paciente vigil, idealmente antes de la cirugía (antes de que se pierda LCR durante la cirugía, si es el caso) |
– Diagnóstico precoz
– Determinar pronóstico |
| b) Hematoma del canal neuroaxial | – Múltiples intentos
– Alteración de coagulación |
– Operador experto
– Chequear estado de la hemostasia |
– Diagnóstico precoz e imágenes
– Descompresión quirúrgica precoz (antes de 8 h) |
| c) Neumoencéfalo | – Técnica deficiente
– Uso de aire para técnica de pérdida de resistencia |
– Técnica pulcra, usando pérdida de resistencia con suero fisiológico | – Si sintomatología es grave (cefalea): oxigenoterapia con FiO2 alta; analgesia |
| d) Sección/fragmentación del catéter | – Mala técnica
– Manipulación excesiva |
– Operador entrenado | – Diagnóstico temprano por imágenes
– Extricación quirúrgica del fragmento |
| 2. Derivadas de la estadía del catéter y su funcionamiento: | |||
| a) Derivadas de la hipotensión licuoral (cefalea, parálisis de VI par, HIC) | – Tasa de extracción excesiva de LCR
– Pérdida excesiva de LCR durante la inserción |
– Manipulación del sistema de drenaje solo por aneste- siólogo en el postoperatorio – Limitar tasa de extracción de LCR a no más de 10-20 ml/h | – Vigilancia seriada y estrecha del funcionamiento del sistema de drenaje espinal – Neuroimagen para descartar HIC
– Punción lumbar y diagnóstico precoz |
| b) Meningitis | – Factores del paciente (diabetes e inmunodepresión) – Tiempo de estadía prolongado del CDE | – Limitar tiempo de cateterización
– Alto índice de sospecha de complicación |
-Antibióticos/retiro del catéter (si aún está presente) |
| c) Drenaje excesivo de LCR (enclavamiento) | – Falta de vigilancia
– Errores en la programación de la bomba de extracción |
– Manejo exclusivo del sistema de drenaje espinal por anestesiólogo | – Detener extracción de LCR
– Estabilización (ABC) |
| 3. Derivadas del retiro del catéter: | |||
| a) Desarrollo de fístula de LCR | – Historia de otras fístulas de LCR | – Punto de piel en sitio de inserción al retiro | – Cierre quirúrgico de fístula
– Parche de sangre |
| b) Sección fragmentación del catéter | – Instalación difícil (con presencia de poco LCR en postoperatorio, por ejemplo) – Mala técnica en el retiro – Tracción forzada | – Técnica cuidadosa en el retiro
– No traccionar en exceso si hay un stop en el retiro; esperar, probar tracción suave en distintos momentos o posiciones del paciente |
– Revisar meticulosamente el catéter que se retira: corroborar su integridad total
– Ante duda de posible fragmentación: neuroimagen: TC sin contraste: catéter es radiopaco – Extricación quirúrgica |
| c) Cefalea por hipotensión de LCR | – Sexo femenino
– Historia de otras fístulas de LCR – Varios intentos de punción |
– Técnica cuidadosa, minimizar el número de intentos | – Parche de sangre
– Manejo conservador (analgesia, reposo, tiempo) |
El drenaje espinal excesivo es la complicación más frecuente, siendo el mecanismo de daño más aceptado el desplazamiento descendente del contenido intracraneal debido al gradiente de presión entre los compartimientos intracraneal e intratecal, alterando la mecánica y produciendo hipotensión intracraneal. Esto se puede manifestar clínicamente con cefalea, parálisis de nervios craneales, alteración del estado mental, entre otros[ 1 ],[4],[10].
Las complicaciones más graves asociadas al CDE son la hemorragia intracerebral, subaracnoidea o sub-dural, en las que la mayoría de los pacientes cursa sin o con leve déficit neurológico, pero pueden presentar un desenlace fatal. Factores de riesgo independiente para el sangrado son drenaje de grandes volúmenes de LCR, atrofia cerebral, malformaciones arteriovenosas, aneurismas cerebrales y episodios previos de hematoma subdural[ 2 ],[4]. El hematoma neuroaxial es otra complicación grave, por lo que es relevante la sospecha a través de la detección precoz de déficit neurológico en las extremidades inferiores, que requiere tratamiento quirúrgico urgente para evitar daño permanente[ 4 ].
La presencia de sangre durante el drenaje espinal es un indicador sensible de hemorragia intracraneal, incluso sin llegar a presentar sintomatología neurológica, por lo que se debe considerar realizar con urgencia una imagen neuroaxial, detener el drenaje y optimizar los parámetros de coagulación sanguínea[1],[2],[4].
La meningitis bacteriana es una complicación la mayoría de las veces inevitable, su incidencia varía según los reportes y según la patología de base, correspondiendo al 1% en aquellos sometidos a cirugía cardiovascular[2],[4],[42] y a 40% en neurocirugía[1].
-
Sugerencias del equipo de trabajo
La instalación del CDE es un procedimiento cada vez más frecuente y exigido por el cirujano tratante. En manos de anestesiólogos acostumbrados a realizar punciones lumbares y trabajo en ambiente estéril, se puede considerar un procedimiento seguro. Sugerimos algunas precauciones como el manejo en completa esterilidad y una buena planificación de las referencias anatómicas para el drenaje (cero). Finalmente, una adecuada comunicación con el equipo médico y de enfermería tratantes evitará complicaciones en su manejo.
-
Referencias
1. Li G, Zhang Y, Zhao J, Han Z, Zhu X, Hou K. Some cool considerations of external lumbar drainage during its widespread application in neurosurgical practice: a long way to go. Chinese Neurosurgical Journal. 2016 Dec;2(1). Available from: http://cnjournal.biomedcentral.com/articles/10.1186/s41016-016-0033-8 https://doi.org/10.1186/s41016-016-0033-8.
2. Wortmann M, Böckler D, Geisbüsch P. Perioperative cerebrospinal fluid drainage for the prevention of spinal ischemia after endovascular aortic repair. Gefasschirurgie. 2017;22(2 Suppl 2):35–40. https://doi.org/10.1007/s00772-017-0261-z PMID:28944782
3. Khan SN, Stansby G. Cerebrospinal fluid drainage for thoracic and thoracoabdominal aortic aneurysm surgery. Cochrane Vascular Group, editor. Cochrane Database of Systematic Reviews. 2012 Oct 17; Available from: http://doi.wiley.com/10.1002/14651858.CD003635.pub3 https://doi.org/10.1002/14651858.CD003635.pub3.
4. Fedorow CA, Moon MC, Mutch WA, Grocott HP. Lumbar cerebrospinal fluid drainage for thoracoabdominal aortic surgery: rationale and practical considerations for management. Anesth Analg. 2010 Jul;111(1):46–58. https://doi.org/10.1213/ANE.0b013e3181ddddd6 PMID:20522706
5. Rong LQ, Kamel MK, Rahouma M, White RS, Lichtman AD, Pryor KO, et al. Cerebrospinal-fluid drain-related complications in patients undergoing open and endovascular repairs of thoracic and thoraco-abdominal aortic pathologies: a systematic review and meta-analysis. Br J Anaesth. 2018 May;120(5):904–13. https://doi.org/10.1016/j.bja.2017.12.045 PMID:29661408
6. Coselli JS, LeMaire SA, Köksoy C, Schmittling ZC, Curling PE. Cerebrospinal fluid drainage reduces paraplegia after thoracoabdominal aortic aneurysm repair: results of a randomized clinical trial. J Vasc Surg. 2002 Apr;35(4):631–9. https://doi.org/10.1067/mva.2002.122024 PMID:11932655
7. ESC Guidelines on the diagnosis and treatment of aortic diseases: document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2014 Nov;35(41):2873–926. https://doi.org/10.1093/eurheartj/ehu281 PMID:25173340
8. Writing Group Members. Hiratzka LF, Bakris GL, Beckman JA, Bersin RM, Carr VF, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM Guidelines for the Diagnosis and Management of Patients With Thoracic Aortic Disease: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons, and Society for Vascular Medicine. Circulation. 2010 Apr 6;121(13). Available from: https://www.ahajournals.org/doi/10.1161/CIR.0b013e3181d4739e
9. Malloy PC, Raghavan A, Elder T, Wright J, Wright CH, Burant C, et al. Cerebrospinal Fluid Drainage During Endovascular Aortic Aneurysm Repair: A Systematic Review of the Literature and Treatment Recommendations. Vasc Endovascular Surg. abril de 2020;54(3):205-13. https://doi.org/10.1177/1538574419896525.
10. Godet G, Bertrand M, Fléron MH, Goarin JP, Colson P, Cardon A, et al. Cerebrospinal fluid drainage and thoracic endovascular aneurysm repair. Asian Cardiovasc Thorac Ann. 2017 Nov;25(9):608–17. https://doi.org/10.1177/0218492317739472 PMID:29058970
11. González L. Mauricio, Portilla Mario, Müller Karen, Allamand Francisco. Utilidad del Catéter Espinal y Potenciales Evocados como técnicas de protección medular en Cirugía de la Aorta Toraco-abdominal. Rev Chil Anest. 2012;41:199–201.
12. Field M, Doolan J, Safar M, Kuduvalli M, Oo A, Mills K, et al.; Thoracic Aortic Aneurysm Service at Liverpool Heart and Chest Hospital. The safe use of spinal drains in thoracic aortic surgery. Interact Cardiovasc Thorac Surg. 2011 Dec;13(6):557–65. https://doi.org/10.1510/icvts.2011.272211 PMID:21795413
13. Barber SM, Fridley JS, Konakondla S, Nakhla J, Oyelese AA, Telfeian AE, et al. Cerebrospinal fluid leaks after spine tumor resection: avoidance, recognition and management. Ann Transl Med. mayo de 2019;7(10):217-217. https://doi.org/10.21037/atm.2019.01.04.
14. Kerr JT, Chu FWK, Bayles SW. Cerebrospinal Fluid Rhinorrhea: Diagnosis and Management. Otolaryngologic Clinics of North America. agosto de 2005;38(4):597-611.
15. Fang Z, Tian R, Jia Y-T, Xu T-T, Liu Y. Treatment of cerebrospinal fluid leak after spine surgery. Chinese Journal of Traumatology. abril de 2017;20(2):81-3. https://doi.org/10.1016/j.cjtee.2016.12.002.
16. Chaudhry S, Ishaque M. A Simple Lumbar Drainage System: Techniques in Orthopaedics. diciembre de 2012;27(4):265.
17. Sugrue PA, Hsieh PC, Getch CC, Batjer HH. Acute symptomatic cerebellar tonsillar herniation following intraoperative lumbar drainage. JNS. abril de 2009;110(4):800-3. https://doi.org/10.3171/2008.5.17568.
18. Zhao J, Li G, Zhang Y, Zhu X, Hou K. Sinking skin flap syndrome and paradoxical herniation secondary to lumbar drainage. Clinical Neurology and Neurosurgery. junio de 2015;133:6-10. https://doi.org/10.1016/j.clineuro.2015.03.010.
19. Murad A, Ghostine S, Colohan AR. Role of Controlled Lumbar CSF Drainage for ICP Control in Aneurysmal SAH. En: Feng H, Mao Y, Zhang JH, editores. Early Brain Injury or Cerebral Vasospasm. Vienna: Springer Vienna; 2011 [citado 6 de mayo de 2020]. p. 183-7. Disponible en: http://link.springer.com/10.1007/978-3-7091-0356-2_34 https://doi.org/10.1007/978-3-7091-0356-2_34.
20. Llompart-Pou JA, Abadal JM, Pérez-bárcena J, Molina M, Brell M, IbáÑEz J, et al. Long-Term Follow-up of Patients with Post-Traumatic Refractory High Intracranial Pressure Treated with Lumbar Drainage. Anaesthesia and Intensive Care. enero de 2011;39(1):79-83.
21. Tuettenberg J, Czabanka M, Horn P, Woitzik J, Barth M, Thomé C, et al. Clinical evaluation of the safety and efficacy of lumbar cerebrospinal fluid drainage for the treatment of refractory increased intracranial pressure. JNS. junio de 2009;110(6):1200-8. https://doi.org/10.3171/2008.10.JNS08293.
22. Muñoz-Sanchez MA, Murillo-Cabezas F, Egea-Guerrero JJ, Gascón-Castillo ML, Cancela P, Amaya-Villar R, et al. [Emergency transcranial doppler ultrasound: predictive value for the development of symptomatic vasospasm in spontaneous subarachnoid hemorrhage in patients in good neurological condition] [English Edition]. Med Intensiva. 2012 Dec;36(9):611–8. https://doi.org/10.1016/j.medine.2012.12.003 PMID:22425337
23. Claassen J, Bernardini GL, Kreiter K, Bates J, Du YE, Copeland D, et al. Effect of cisternal and ventricular blood on risk of delayed cerebral ischemia after subarachnoid hemorrhage: the Fisher scale revisited. Stroke. 2001 Sep;32(9):2012–20. https://doi.org/10.1161/hs0901.095677 PMID:11546890
24. Muñoz-Guillén NM, León-López R, Túnez-Fiñana I, Cano-Sánchez A. Del vasoespasmo a la lesión cerebral precoz: una nueva frontera en la investigación de la hemorragia subaracnoidea. Neurologia. 2013 Jun;28(5):309–16. https://doi.org/10.1016/j.nrl.2011.10.015 PMID:22264777
25. Macdonald RL. Lumbar drainage after subarachnoid hemorrhage: does it reduce vasospasm and delayed hydrocephalus? Neurocrit Care. 2007;7(1):1–2. https://doi.org/10.1007/s12028-007-0046-4 PMID:17657651
26. Hänggi D, Liersch J, Turowski B, Yong M, Steiger HJ. The effect of lumboventricular lavage and simultaneous low-frequency head-motion therapy after severe subarachnoid hemorrhage: results of a single center prospective Phase II trial. J Neurosurg. 2008 Jun;108(6):1192–9. https://doi.org/10.3171/JNS/2008/108/6/1192 PMID:18518727
27. Maeda Y, Shirao S, Yoneda H, Ishihara H, Shinoyama M, Oka F, et al. Comparison of lumbar drainage and external ventricular drainage for clearance of subarachnoid clots after Guglielmi detachable coil embolization for aneurysmal subarachnoid hemorrhage. Clin Neurol Neurosurg. 2013 Jul;115(7):965–70. https://doi.org/10.1016/j.clineuro.2012.10.001 PMID:23107165
28. Al-Tamimi YZ, Bhargava D, Feltbower RG, Hall G, Goddard AJP, Quinn AC, et al. Lumbar Drainage of Cerebrospinal Fluid After Aneurysmal Subarachnoid Hemorrhage: A Prospective, Randomized, Controlled Trial (LUMAS). Stroke. marzo de 2012;43(3):677-82.
29. Ochiai H, Yamakawa Y. Continuous lumbar drainage for the preoperative management of patients with aneurysmal subarachnoid hemorrhage. Neurol Med Chir (Tokyo). 2001 Dec;41(12):576–80. https://doi.org/10.2176/nmc.41.576 PMID:11803582
30. Ruijs ACJ, Dirven CMF, Algra A, Beijer I, Vandertop WP, Rinkel G. The risk of rebleeding after external lumbar drainage in patients with untreated ruptured cerebral aneurysms. Acta Neurochir (Wien). noviembre de 2005;147(11):1157-62. https://doi.org/10.1007/s00701-005-0584-5.
31. Abulhasan YB, Al-Jehani H, Valiquette M-A, McManus A, Dolan-Cake M, Ayoub O, et al. Lumbar Drainage for the Treatment of Severe Bacterial Meningitis. Neurocrit Care. octubre de 2013;19(2):199-205. https://doi.org/10.1007/s12028-013-9853-y.
32. Remeš F, Tomáš R, Jindrák V, Vaniš V, Šetlík M. Intraventricular and lumbar intrathecal administration of antibiotics in postneurosurgical patients with meningitis and/or ventriculitis in a serious clinical state. JNS. diciembre de 2013;119(6):1596-602
33. Hakim S, Adams RD. The special clinical problem of symptomatic hydrocephalus with normal cerebrospinal fluid pressure. Journal of the Neurological Sciences. julio de 1965;2(4):307-27. https://doi.org/10.1016/0022-510X(65)90016-X.
34. Chotai S, Medel R, Herial NA, Medhkour A. External lumbar drain: A pragmatic test for prediction of shunt outcomes in idiopathic normal pressure hydrocephalus. Surg Neurol Int. 2014 Jan;5(1):12. https://doi.org/10.4103/2152-7806.125860 PMID:24678428
35. Shprecher D, Schwalb J, Kurlan R. Normal pressure hydrocephalus: Diagnosis and treatment. Current Neurology and Neuroscience Reports. Springer Science and Business Media LLC; 2008 Sep;8(5):371–6. http://dx.doi.org/10.1007/s11910-008-0058-2
36. Marmarou A, Young HF, Aygok GA, Sawauchi S, Tsuji O, Yamamoto T, et al. Diagnosis and management of idiopathic normal-pressure hydrocephalus: a prospective study in 151 patients. J Neurosurg. 2005 Jun;102(6):987–97. https://doi.org/10.3171/jns.2005.102.6.0987 PMID:16028756
37. Halperin JJ, Kurlan R, Schwalb JM, Cusimano MD. Practice guideline: Idiopathic normal pressure hydrocephalus: Response to shunting and predictors of response. 2015;11.
38. Panagiotopoulos V, Konstantinou D, Kalogeropoulos A, Maraziotis T. The predictive value of external continuous lumbar drainage, with cerebrospinal fluid outflow controlled by medium pressure valve, in normal pressure hydrocephalus. Acta Neurochir (Wien). septiembre de 2005;147(9):953-8. https://doi.org/10.1007/s00701-005-0580-9.
39. Marmarou A, Bergsneider M, Klinge P, Relkin N, Black PMcL. The Value of Supplemental Prognostic Tests for the Preoperative Assessment of Idiopathic Normal-pressure Hydrocephalus. Neurosurgery. 1 de septiembre de 2005;57(suppl3):S2-17-S2-28. https://doi.org/10.1227/01.NEU.0000168184.01002.60.
40. Walchenbach R, Geiger E, Thomeer R, Vanneste J. The value of temporary external lumbar CSF drainage in predicting the outcome of shunting on normal pressure hydrocephalus. J Neurol Neurosurg Psychiatry. abril de 2002;72(4):503-6
41. Açıkbaş SC, Akyüz M, Kazan S, Tuncer R. Complications of Closed Continuous Lumbar Drainage of Cerebrospinal Fluid. Acta Neurochirurgica. 1 de mayo de 2002;144(5):475-80.
42. Estrera AL, Sheinbaum R, Miller CC, Azizzadeh A, Walkes J-C, Lee T-Y, et al. Cerebrospinal Fluid Drainage During Thoracic Aortic Repair: Safety and Current Management. The Annals of Thoracic Surgery. julio de 2009;88(1):9-15.

 ORCID
ORCID