Manuel Alberto Guerrero Gutiérrez 1 ,*, José Carlos Gasca Aldama 2 , Orlando Rubén Pérez Nieto 3 , Jesús Salvador Sánchez Díaz 4 , Luis Antonio Morgado Villaseñor 5 ,Fernando Jaziel López Pérez 6
Recibido: 12-04-2021
Aceptado: 15-05-2021
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 6 pp. 825-832|https://doi.org/10.25237/revchilanestv5004101050
PDF|ePub|RIS
Ultrasound evaluation of venous congestion
Abstract
In the last decade, ultrasound usage has had a great impact on the evaluation of intravenous fluid therapy in critically ill patients; however, positive fluid balances and fluid overload are frequent in the intensive care unit and are associated with a morbidity and mortality increase and with a wide range of adverse effects. The Venous Excess Ultrasound Score (VExUS) aims to assess venous congestion and veno-ventricular interaction, which can finally close the resuscitation cycle with the concept of “de-resuscitation.”
Resumen
El uso de ultrasonido ha tenido un gran impacto en la última década para evaluar la fluidoterapia intravenosa en pacientes críticos; sin embargo, los balances hídricos positivos y la sobrecarga de líquidos son una entidad frecuente en la unidad de cuidados intensivos y se asocian a un incremento en la morbimortalidad y a una amplia gama de efectos adversos. El sistema de clasificación de la congestión venosa por ultrasonido (VExUS, por sus siglas en inglés) tiene como objetivo evaluar la congestión venosa y la interacción veno-ventricular al cerrar el ciclo de reanimación con el concepto de “desreanimación”.
En los últimos años, la ecografía se ha convertido en una herramienta indispensable para la valoración y el moni- toreo de pacientes en estado crítico. En un principio se enfocaba en el diagnóstico del estado de choque con protocolos de gran utilidad que han mejorado la evaluación de la fluidoterapia. Una de las utilidades principales de la ecografía es la predicción de respuesta a la administración de volumen[1]. La base fisiológica de la administración de líquidos intravenosos
en pacientes con inestabilidad hemodinámica es el aumento del volumen de fin de diástole y del gasto cardíaco, lo que restablece la perfusión tisular[2]. Sin embargo, este efecto se observará en menos de 50% de los pacientes hemodinámicamente inestables, teniendo en cuenta que la administración de fluidos podría ser la peor herramienta para incrementar la precarga, sobre todo en contextos clínicos que no cursan con pérdida de volumen (choque séptico, choque cardiogénico), por lo que la administración de líquidos intravenosos en estos pacientes suele ser deletérea[3].
Últimamente, se ha descrito una relación entre la sobrecarga hídrica y el riesgo de presentar fallas orgánicas [4]-[6], así como de muerte[7],[8]. La administración agresiva de líquidos intravenosos podría lesionar la glucocálix, lo que causaría una disminución de su capacidad protectora para mantener el volumen sanguíneo en el espacio intravascular y de la respuesta adrenérgica a la vasoconstricción[9]. A su vez, esto favorecería el incremento de la permeabilidad vascular y la fuga de volumen al espacio intersticial. Del mismo modo, la sobrecarga hídrica altera el acoplamiento veno-ventricular y genera un aumento en la capacitancia venosa que se traduce en disminución de la precarga ventricular[10],[11]. El edema tisular aumenta el gradiente arteriovenoso de difusión para el oxígeno y sustratos metabólicos, así como la presión hidrostática intersticial que ocasiona una disminución del flujo sanguíneo capilar. Estos efectos son más relevantes en los órganos encapsulados como el riñón, hígado y bazo debido a una disminución en su distensibilidad[11]. De tal forma que, junto con la valoración del estado de volemia y de la respuesta al volumen intravascular, la evaluación de la sobrecarga hídrica y la congestión venosa deberían ser parte de la monitorización del estado de volemia del paciente y de la decisión de administrar o no líquidos intravenosos. La monitorización de la congestión venosa por ultrasonido (VExUS) debe tomar en cuenta que cada lecho vascular posee características propias en cuanto a cumplimiento normativo (modelo multicompartimental)[12]-[14].
La evaluación del sistema venoso, que contiene cerca de 75% del volumen sanguíneo, nos permitirá observar datos de congestión venosa a la cabecera del paciente, con el análisis de la morfología de las ondas venosas que sugieran que se ha alcanzado el límite de cumplimiento venoso. La evaluación se centra en la vena cava, la vena suprahepática, la vena porta y la vena renal[15]. La presencia de patrones anormales en el contexto de congestión puede asociarse a peores desenlaces en el paciente[16]-[19].
El sistema de clasificación de la congestión venosa por ultrasonido (VExUS, por sus siglas en inglés) tiene como objetivo evaluar la congestión venosa y la repercusión en la relación flujo-presión-volumen del sistema cardiovascular, para normar conductas terapéuticas, el uso de diuréticos y/o la ultrafiltración con máquinas extracorpóreas. Es vital entender los fundamentos fisiológicos de la hemodinámica para su correcta aplicación. Reddi y Carpenter propusieron “exceso venoso” para denominar el entendimiento del compartimiento venoso. De esta forma, se entiende por exceso venoso al volumen, no tanto estacionario, sino dinámico y equivale a la sangre venosa acumulada en la entrada del corazón (PVC)[20]. La evaluación ultrasonográfica de este volumen puede ser posible en tiempo real si se analiza el comportamiento del flujo en los distintos lechos vasculares sin olvidar la delicada interacción con la bomba cardíaca.
Esta metodología se debe utilizar en escenarios clínicos en donde se considera que el paciente ha alcanzado una reanimación adecuada o se encuentra con datos de sobrecarga hídrica[16]:
Reanimación y desreanimación : es imperativo saber guiar una reanimación sin causar más daño, por lo que el VExUS será un pilar fundamental para la desreanimación.
Estados congestivos: se trata de la congestión en entidades clínicas como falla cardíaca, síndrome hepatorrenal, síndrome cardiorrenal, etc.
Falla renal: una falsa creencia es que todas las lesiones o fallas renales responden a volumen; sin embargo, esta actitud lleva a un estado de congestión venosa diagnosticado por medio de ultrasonido denominado “renosarca”.
Prescripción de líquidos: se debe evaluar a todo paciente que se le administren líquidos para justificar con evidencia si en realidad los necesita y, en dicho caso, evitar caer en estados de congestión venosa.
La elevación patológica de la presión venosa central (PVC) es un factor importante para el desarrollo de daño orgánico congestivo[17]. En pacientes con insuficiencia cardíaca congestiva, el principal parámetro hemodinámico asociado al desarrollo de lesión renal aguda es el aumento en la PVC y no en el índice cardiaco (IC)[18], esto también es cierto en pacientes con sepsis[19]. De forma similar, la gravedad de la hepatopatía congestiva se correlaciona con la elevación de la presión auricular derecha (PAD) y no con el IC[20]. Sin embargo, no se debe tomar este incremento de la PVC como una contrapresión al flujo venoso[21], sino como un reflejo del desacoplamiento veno-ventricular y/o del aumento del exceso venoso, que a su vez repercuten en cada lecho vascular que, como ya se comentó anteriormente, tienen características propias.
El flujo de las venas hepáticas se observa como un espejo de lo que puede suceder en el compartimiento central (Figura 1). Un cambio en la capacitancia de los segmentos vasculares (hepático, portal, esplácnico, renal) altera la distribución de la volemia y, por lo tanto, de la perfusión orgánica; por ejemplo, la renosarca y la disminución en la presión de perfusión renal, una especia de tampón adeintracapsular[17]. El uso del ultrasonido permite interrogar de manera directa el flujo a nivel orgánico mediante Doppler[22]. Con el uso de esta herramienta, diversos grupos de investigadores han encontrado asociaciones entre alteraciones del flujo venoso a nivel orgánico y desenlaces importantes como lesión renal aguda[15], encefalopatía congestiva[23] y mortalidad[24].
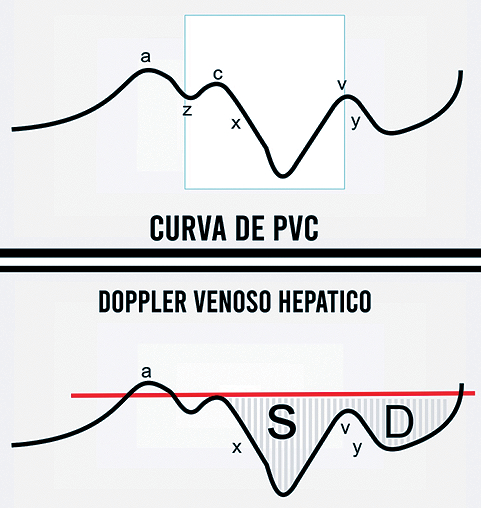 |
| Figura 1. Curva de PVC y USG Doppler de vena suprahepática dispuestas en espejo. Abreviaturas: PVC: presión venosa central; USG: ultrasonido. |
La valoración de la congestión venosa a nivel orgánico debe comenzar con la determinación de la congestión a nivel sistémico. Para esto, el análisis de la tolerancia a volumen por medio de la colapsabilidad de la vena cava inferior es de utilidad. Esta valoración debe realizarse en su eje corto con barrido cefalocaudal a 4 cm de la unión cavo-auricular para adquirir una impresión sobre el volumen de una estructura tridimensional[25]. Una vena cava con diámetro mayor a 2 cm y con colapsabilidad inspiratoria menor a 20% se considera el primer dato de congestión venosa[22].
Posterior a esto, la siguiente medición importante es el patrón de flujo en la vena porta. Por lo general, en el segmento vascular correspondiente a la vena porta se tiene alta compliancia vascular debido a las sinusoides hepáticas; no obstante, cuando el exceso venoso se incrementa de forma patológica, este puede llegar a afectar el patrón de flujo venoso[26]. Por lo tanto, el flujo portal normal es un flujo continuo mientras que, en pacientes con congestión venosa grave, el flujo portal se torna pulsátil[15]. Un índice de pulsatilidad mayor a 30% se considera congestión moderada, mientras que cuando es mayor a 50% se considera grave. De igual manera, la valoración del flujo venoso intrarrenal permite distinguir patrones de flujo asociados a la congestión. El flujo renal continuo se considera normal; conforme aumenta la congestión venosa, el flujo se torna pulsátil, bifásico y monofásico en orden de gravedad[24]. La combinación de estas alteraciones permite no solo una estimación del exceso venoso y el desacoplamiento de la interacción entre vasculatura y corazón, sino también de su repercusión a órganos diana[22].
En nuestra opinión, la presencia de congestión venosa es un argumento poderoso en contra de la administración de soluciones intravenosas, las cuales exacerban el daño orgánico congestivo, independientemente de la presencia de predictores dinámicos de respuesta a volumen. Aunque también existen excepciones que pueden modificar los patrones de flujo y no necesariamente tienen que ver con la congestión sistémica, éstas reflejan la repercusión de las patologías que involucran las cavidades cardíacas y los ejes neuro-hormonales que los regulan mediante el efecto que pueden tener sobre los patrones de flujo en la vasculatura periférica y central (taponamiento cardíaco, pericarditis constrictiva, neumotórax a tensión, hipertensión pulmonar, insuficiencia tricúspidea) y ninguna decisión debe tomarse con un parámetro de forma individual. Cabe señalar que en pacientes con grados más avanzados de congestión venosa (pulsatilidad portal > 50%), el uso de diuréticos puede incluso mejorar la función orgánica.
De esta forma, es fundamental que el diagnóstico de la congestión venosa no se limite a determinar su presencia y gravedad, sino que debe alentar a encontrar la causa subyacente (sobrecarga de volumen, insuficiencia cardíaca congestiva, falla ventricular derecha, hipertensión pulmonar aguda, pericarditis constrictiva, taponamiento cardíaco, etc.). Esta respuesta nos debe llevar a integrar el acoplamiento veno-ventricular y el exceso venoso como ejes rectores de esta nueva metodología en la evaluación hemodinámica. La Figura 2 muestra un ejemplo de un paciente no congestivo y de uno con congestión venosa grave.
La valoración de la congestión venosa a nivel orgánico debe comenzar por la determinación de congestión a nivel sistémico; para esto se evalúa el diámetro de la vena cava inferior como primer paso. A continuación, se presenta una descripción de la metodología de manera práctica.
Se valorarán los siguientes vasos:
1. Vena cava inferior.
2. Vena suprahepática.
3. Vena porta.
4. Vena renal.
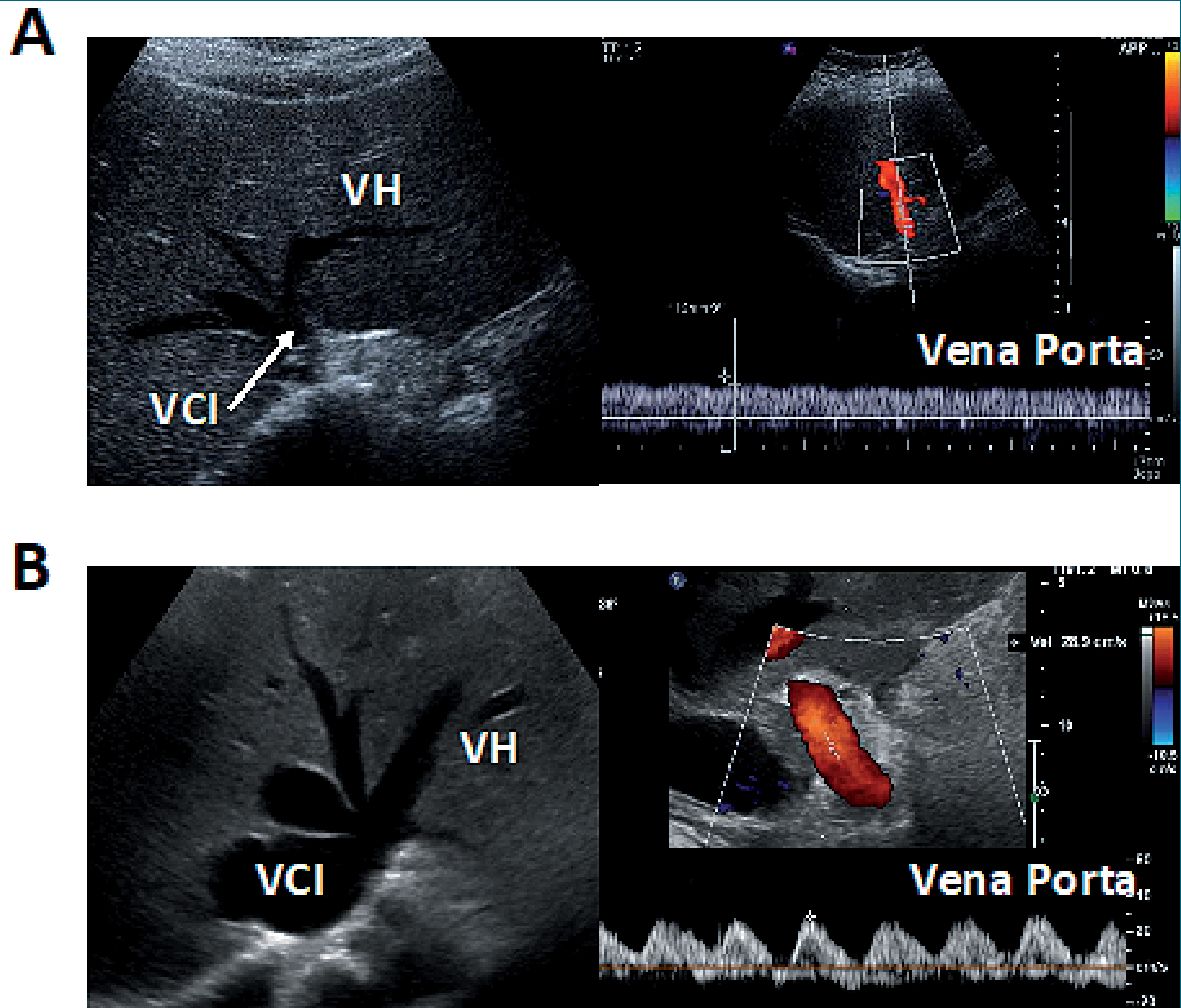 |
| Figura 2. USG de venas hepáticas: A) A la izquierda se observa la VCI en eje corto a nivel del origen de las venas hepáticas con un diámetro de 9 mm; a la derecha se observa la imagen de USG Doppler pulsado de la vena porta que muestra la mínima pulsatilidad (flujo continuo), característicos de un paciente sin congestión venosa; B) A la izquierda se visualiza la VCI en eje corto a nivel del origen de las venas hepáticas con diámetro de 34 mm y dilatación de las venas suprahepáticas; a la derecha se observa la imagen de USG Doppler pulsado de la vena porta mostrando pulsatilidad de 100% [(Vmáx – Vmín/Vmáx) x 100] característicos de un paciente con congestión venosa severa. Foto cortesía de Eduardo Argaiz. Abreviaturas: USG: ultrasonido; VCI: vena cava inferior. |
1. Utilizar un transductor sectorial de 2,5-5 MHz.
2. Colocar el transductor sectorial en el área subxifoidea, con la marca apuntando a las 3 h y realizar un giro en dirección de las 12h o hasta observar la desembocadura de la vena cava en la aurícula derecha, lo que ocurra primero. De ser necesario, se puede considerar el semifowler.
3. Con base en esta imagen, realizar mediciones en modo 2D para obtener el diámetro mayor (inspiración) y menor (espiración), llevando de inmediato el caudal a la desembocadura de la vena suprahepática (Figura 3). Si la vena cava inferior presenta un diámetro máximo de 20 mm, proceder a revisar el resto de los flujos venosos. Es fundamental tomar en cuenta las situaciones clínicas que pueden asociarse al incremento del diámetro de la VCI (presión intrabdominal, falla del ventrículo derecho, HAP, PEEP)[23].
Se tomarán en cuenta los siguientes valores:
Grado 0: < 5 mm de diámetro con variación en la respiración.
Grado 1: 5-9 mm con variación en la respiración.
Grado 2: 10-19 mm con variación en la respiración.
Grado 3: > 20 mm con variación en la respiración.
Grado 4: > 20 mm con mínima o nula variación en la respiración.
1. Utilizar un transductor sectorial de 1 a 5 MHz, en modo abdominal.
2. En continuidad con la ventana de la vena cava, ubicar la vena suprahepática usando el Doppler color, ubicar el flujo y observar su morfología usando el Doppler pulsado.
Alternativa 2 (transhepática):
1. Colocar el transductor sectorial en la zona hepática, a la
altura de la línea media axilar, con la muesca hacia las 6 h y 12 h.
2. Sobre la estructura hepática, buscar el árbol hepático venoso y colocar el Doppler color. Ajustar la escala de intensidad (a mayor número de filtro, menor “ruido” en imágenes; sin embargo, la cantidad de flujo será menor).
3. Colocar el Doppler pulsado sobre el vaso a examinar.
4. Presionar nuevamente el botón del Doppler pulsado para obtener la imagen del flujo hepático. Identificar las ondas S y las ondas D (Figuras 4 y 5).
1. Utilizar un transductor sectorial de 1-5 MHz.
2. Trabajar sobre la misma imagen obtenida para Doppler de la vena suprahepática (vista transhepática) y se debe buscar la vena porta con el transductor a las 12 h en comparación con las 3 h. Una vez centrada la vena porta, ubicar el flujo con el Doppler color y medirlo con el Doppler pulsado.
3. Obtener la imagen de la vena porta (Figura 6), sobre la cual se obtendrá y se medirá el flujo máximo y mínimo. Aplicar el despeje de la fórmula de pulsatilidad.
 |
| Figura 3. Patrones visuales de la VCI según su congestión venosa. A; grado 1: VCI 5-9 mm con variación en la respiración; B; grado 2: VCI: 10-19 mm con variación en la respiración; C; grado 3: > 20 mm con variación en la respiración; D; grado 4: >20 mm con mínima o nula variación en la respiración. Abreviaturas: VCI: vena cava inferior. |

Figura 4. Características de las ondas en las venas suprahepáticas con la morfología audioespectral.
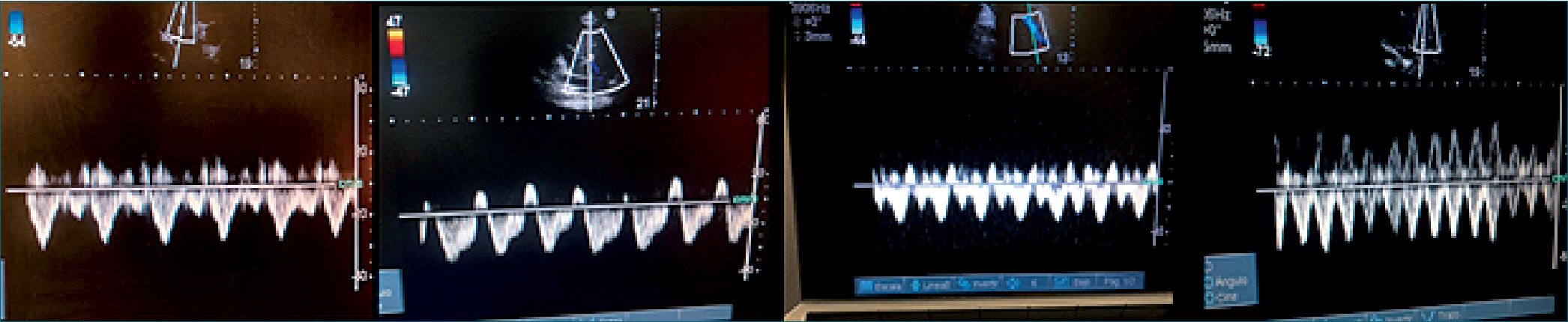 |
| Figura 5. Características de la onda pulsátil de la VH por USG Doppler según el grado de congestión venosa: grado 0: normal S > D, grado 1: S < D; S anterógrada, grado 2: S plana, invertida o bifásica. Abreviaturas: VH: vena hepática; USG: ultrasonido. |
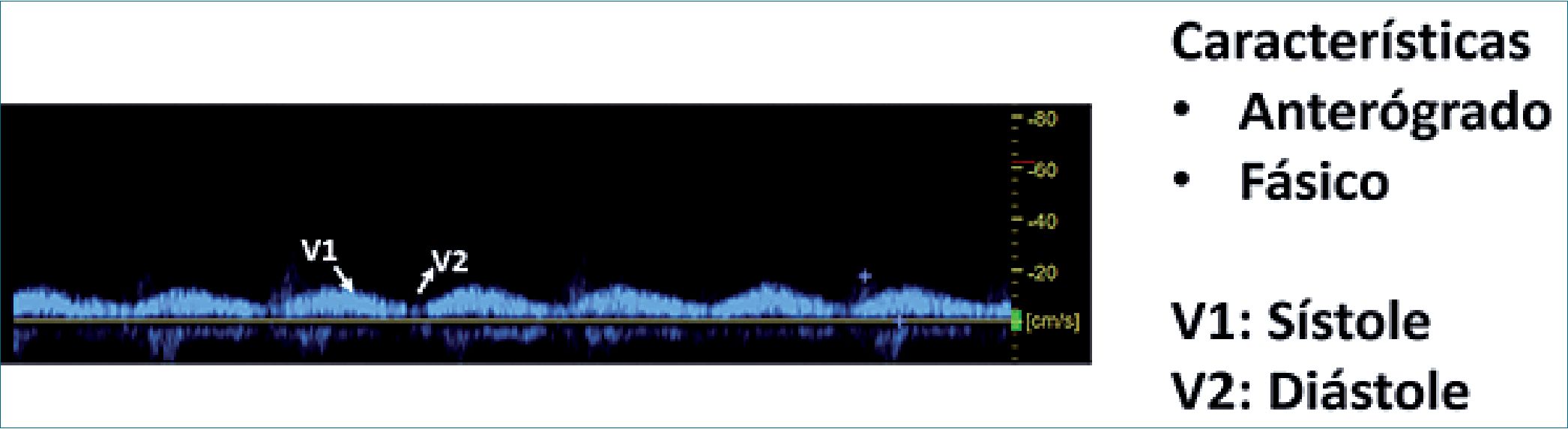 |
| Figura 6. Características de la onda sistólica y diastólica de USG de la vena porta en condiciones normales (sin sobrecarga venosa). |
El intervalo de velocidad normal de la vena porta va de los 16 a 40 cm; < 13 es un predictor de trombosis portal. Si se acompaña de nódulos y la velocidad es igual o menor a 12 cm, esto es sugestivo de cirrosis[24],[25].
• Grado 0: < 0,3 IP.
• Grado 1: 0,3-0,49 IP.
• Grado 2: 0,5-1 IP.
1. Utilizar un transductor convexo en modo abdominal.
2. Colocar el transductor a las 6 h, en la línea axilar posterior a la altura del borde inferior de la parrilla costal derecha. Realizar la búsqueda con deslizamientos caudales para ubicar la altura del riñón y movimientos rostrales para el grosor del riñón, con el objetivo de obtener la mejor ventana.
3. Una vez que se ha localizado el riñón, localizar los vasos interlobares por medio del Doppler color. Una vez ubicado el flujo vascular, medir su velocidad con Doppler pulsado con el transductor a las 12 h contra 3 h, con base en la mejor ventana.
4. Obtener la siguiente imagen sobre la cual se procederá a realizar mediciones (parte superior arteria renal (índice de resistencias renales), parte inferior (Doppler venoso renal)) (Figura 7).
Grado 0 = continuo, monofásico y pulsátil.
Grado 1 = discontinuo y flujo bifásico.
Grado 2 = discontinuo y monofásico (solo diástole).
Índice de resistencia arteria renal: A (pico sistólico) – B (velocidad telediastólica)/A
IRR = < 0,7 normal
Recientemente, se ha estudiado el flujo venoso renal[27]-[30], tomando como sustento fisiopatológico las interconexiones renales y cardíacas por las cuales la disfunción aguda o crónica en uno de los dos órganos influye en el otro. La evidencia sustenta que las alteraciones en el patrón de flujo venoso renal tienen relación con los incrementos de presión de aurícula derecha. Pues si bien se trata de dos segmentos vasculares distintos, ambos reflejan congestión y repercuten de manera considerable en los resultados clínicos. La evaluación de los flujos renales no solo debe centrarse en el lado venoso, sino también en el análisis de las velocidades de flujo en las arterias interlobares y/o arcuatas. En estas también pueden manifestarse alteraciones como consecuencia de la congestión (renosarca); en cambio, las alteraciones en el índice resistivo renal no son exclusivas del riñón[31]-[33] (Figura 8).
Con base en las mediciones previas, se realiza una escala integrada por 4 grados de congestión venosa (Tabla 1, Figura 9)[34].
Al ser una metodología de reciente aparición, queda por definir cuál es la prevalencia real de la congestión venosa y si es una herramienta que pueda aplicarse en otros escenarios, por ejemplo: síndrome de permeabilidad global aumentado (SPGA), pacientes con quemaduras, endoteliopatía inducida por choque (SHINE), que son situaciones clínicas caracterizadas por un incremento de la permeabilidad endotelial y el alto índice de fuga capilar, donde el volumen sanguíneo se distribuye en el espacio intersticial[35],[36].
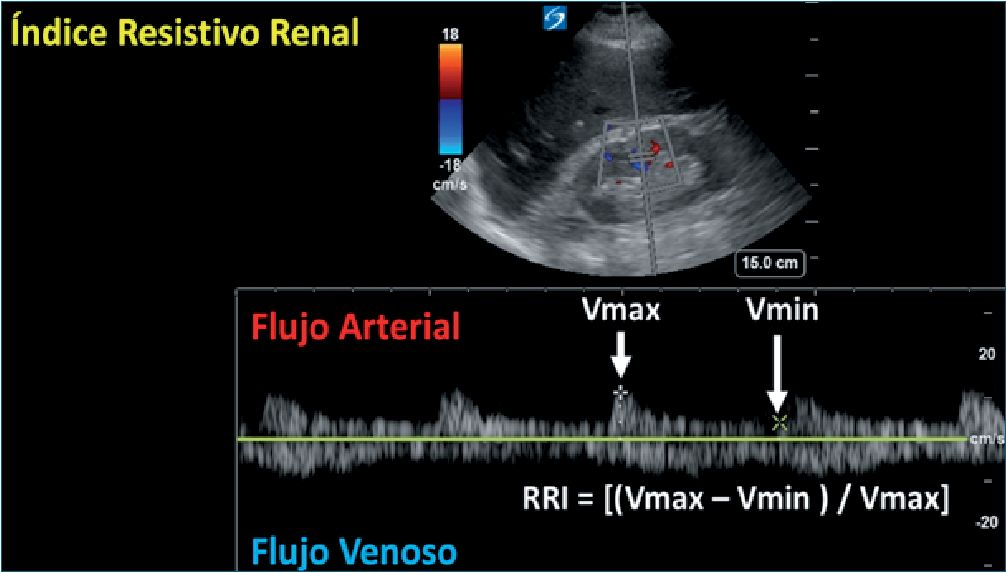 |
| Figura 7. Imagen por USG del flujo sanguíneo renal. Arriba se observa un USG con transductor convexo en proyección hepatorrenal donde se sitúa el USG Doppler donde se observa el flujo arterial y la fórmula del IRR (por debajo se observa el flujo venoso). Abreviaturas: USG: ultrasonido; IRR: índice resistivo renal. |
Tabla 1. Interpretación del sistema VExUS
| Mediciones | Interpretación | |
| Grado 0 | VCI < 20mm (grado < 3)
VH, VP y VR grado 0 |
Sin congestión |
| Grado 1 | VCI grado 4
VH, VP y VR grado 0 |
Congestión leve |
| Grado 2 | VCI grado 4
VH, VP y VR grado 1 |
Congestión moderada |
| Grado 3 | VCI grado 4
VH, VP y VR grado 2 |
Congestión severa |
Abreviaturas: VCI: vena cava inferior; VH: vena hepática; VP: vena porta; VR: vena renal.
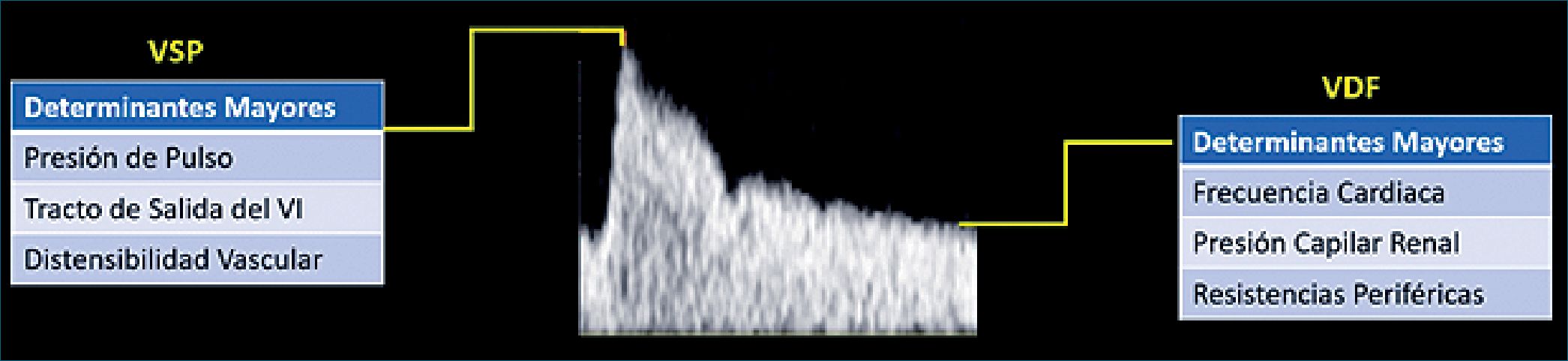 |
| Figura 8. USG Doppler de flujo de arteria renal y factores determinantes del IRR, es decir VSP y VDF. Abreviaturas: USG: ultrasonido; IRR: índice resistivo renal, VSP: velocidad sistólica pico, VDF: velocidad diastólica final. |
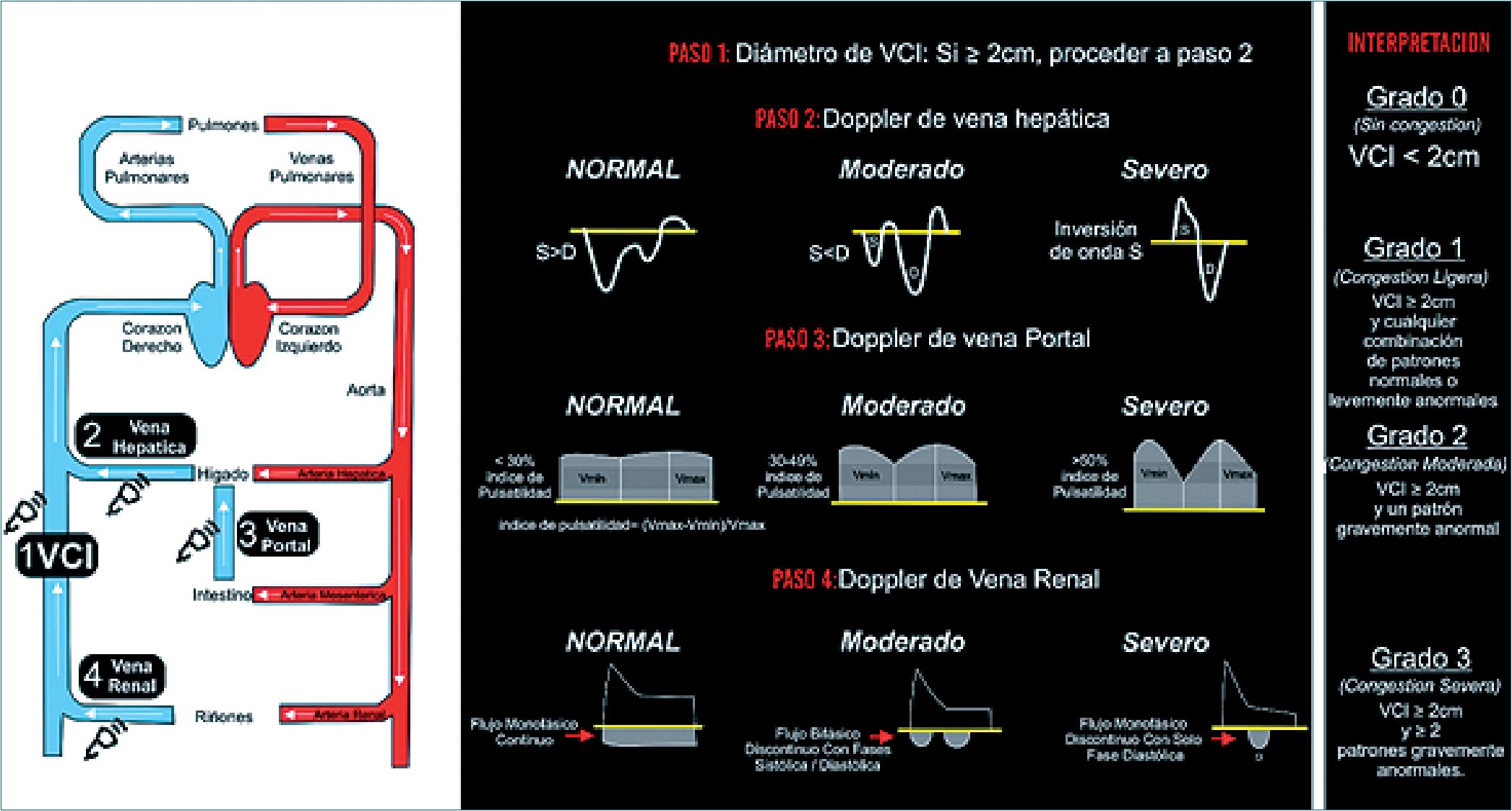 |
| Figura 9. Escala VExUS. Tomada con permiso de Vi DinhPocus 101 and Pocus 101.com Abreviatura: VExUS: sistema de clasificación de la congestión venosa por ultrasonido. |
Esta metodología es una herramienta clave no solo en el escenario de la falla cardíaca o la sobrecarga hídrica secundaria a insuficiencia renal (síndromes cardiorrenales), sino también se puede y debe transpolar a escenarios críticos donde las interrogantes sobre el estado de la volemia son parte de la rutina de trabajo[37]-[39]. Es prometedor tener a la cabecera del enfermo mediciones objetivas que nos ayuden a tomar decisiones como el uso de diuréticos, ultrafiltración, etc. Un diagnóstico ultrasonográfico temprano y mucho más preciso que la exploración física puede orientarnos en la toma de decisiones e implementación de estrategias de tratamiento de forma oportuna, minimizando los daños que conlleva la fluidoterapia excesiva.
La evaluación del sistema venoso a la cabecera del paciente es importante para diagnosticar y evaluar la sobrecarga de líquidos en pacientes graves. El VExUs es una estrategia que nos permite determinar el grado de congestión venosa y guiar la desreanimación.
Conflictos de interés: Todos los autores declaran no tener conflictos de interés.
Referencias
1. Levitov, A., Frankel, H. L., Blaivas, M., Kirkpatrick, A. W., Su, E., Evans, D., … & McLaughlin, M. (2016). Guidelines for the appropriate use of bedside general and cardiac ultrasonography in the evaluation of critically ill patients-part II: cardiac ultrasonography. Critical care medicine, 44(6), 1206-1227. https://doi.org/10.1097/CCM.0000000000001847
2. Vincent, J. L. (2019). Fluid management in the critically ill. Kidney international, 96(1), 52-57. https://doi.org/10.1016/j.kint.2018.11.047
3. Marik, P. E., Monnet, X., &Teboul, J. L. (2011). Hemodynamic parameters to guide fluid therapy. Annals of intensive care, 1(1), 1. https://doi.org/10.1186/2110-5820-1-1
4. Zhang, J., Crichton, S., Dixon, A., Seylanova, N., Peng, Z. Y., & Ostermann, M. (2019). Cumulative fluid accumulation is associated with the development of acute kidney injury and non-recovery of renal function: a retrospective analysis. Critical Care, 23(1), 392. https://doi.org/10.1186/s13054-019-2673-5
5. Wang, N., Jiang, L., Zhu, B., Wen, Y., & Xi, X. M. (2015). Fluid balance and mortality in critically ill patients with acute kidney injury: a multicenter prospective epidemiological study. Critical Care, 19(1), 371. https://doi.org/10.1186/s13054-015-1085-4
6. Jaffee, W., Hodgins, S., & McGee, W. T. (2018). Tissue edema, fluid balance, and patient outcomes in severe sepsis: an organ system review. Journal of Intensive Care Medicine, 33(9), 502-509. https://doi.org/10.1177/0885066617742832
7. Sakr, Y., RubattoBirri, P. N., Kotfis, K., Nanchal, R., Shah, B., Kluge, S., … & Vincent, J. L. (2017). Higher fluid balance increases the risk of death from sepsis: results from a large international audit. Critical care medicine, 45(3), 386-394. https://doi.org/10.1097/CCM.0000000000002189
8. Acheampong, A., & Vincent, J. L. (2015). A positive fluid balance is an independent prognostic factor in patients with sepsis. Critical care, 19(1), 251. https://doi.org/10.1186/s13054-015-0970-1
9. Milford, E. M., & Reade, M. C. (2019). Resuscitation fluid choices to preserve the endothelial glycocalyx. Critical Care, 23(1), 1-11. https://doi.org/10.1186/s13054-019-2369-x
10. Tyberg JV. Venous modulation of ventricular preload. Am. Heart J. 123: 1098-1104, 1992. https://doi.org/10.1016/0002-8703(92)90736-F
11. Tyberg JV. How changes in venous capacitance modulate cardiac output. Pflügers Arch 445: 10 -17, 2002. https://doi.org/10.1007/s00424-002-0922-x
12. Brengelmann GL. Venous return and the physical connection between distribution of segmental pressures and volumes. Am J Physiol Heart Circ Physiol 2019; 317:H939-H953 https://doi.org/10.1152/ajpheart.00381.2019
13. Dalmau R. Venous return: a fresh start. Am J Physiol Heart Circ Physiol. 2019 Nov 1;317(5):H1102-H1104. https://doi.org/10.1152/ajpheart.00575.2019
14. Brengelmann GL. A critical analysis of the view that right atrial pressure determines venous return. J Appl Physiol94: 849-859, 2003. https://doi.org/10.1152/japplphysiol.00868.2002
15. O’Connor, M. E., &Prowle, J. R. (2015). Fluid overload. Critical care clinics, 31(4), 803-821. https://doi.org/10.1016/j.ccc.2015.06.013
16. Beaubien-Souligny W, Bouchard J, Desjardins G, Lamarche Y, Liszkowski M, Robillard P, Denault A (2017). Extracardiac signs of fluid overload in the critically ill cardiac patient: a focused evaluation using bedside ultrasound. Can J Cardiol 33:88-100 https://doi.org/10.1016/j.cjca.2016.08.012
17. Iida N, Seo Y, Sai S, Machino-Ohtsuka T, Yamamoto M, Ishizu T, Kawakami Y, Aonuma K (2016) Clinical implications of intrarenal hemodynamic evaluation by Doppler ultrasonography in heart failure. JACC Heart Fail 4:674-682. https://doi.org/10.1016/j.jchf.2016.03.016
18. Ikeda Y, Ishii S, Yazaki M, Fujita T, Iida Y, Kaida T, Nabeta T, Nakatani E, Maekawa E, Yanagisawa T, Koitabashi T, Inomata T, Ako J (2018) Portal congestion and intestinal edema in hospitalized patients with heart failure. Heart Vessels 33:740-751 https://doi.org/10.1007/s00380-018-1117-5
19. Reddi BA, Carpenter RH. Venous excess: a new approach to cardiovascular control and its teaching. J Appl Physiol98: 356-364, 2005. https://doi.org/10.1152/japplphysiol.00535.2004
20. Eljaiek R, Cavayas YA, Rodrigue E, Desjardins G, Lamarche Y, Toupin F, Denault AY, Beaubien-Souligny W (2019) High postoperative portal venous flow pulsatility indicates right ventricular dysfunction and predicts complications in cardiac surgery patients. Br J Anaesth 122:206-214. https://doi.org/10.1016/j.bja.2018.09.028
21. Beaubien-Souligny, W. et al. Alterations in Portal Vein Flow and Intrarenal Venous Flow Are Associated with Acute Kidney Injury After Cardiac Surgery: A Prospective Observational Cohort Study. J Am Heart Assoc7, e009961 (2018). https://doi.org/10.1161/JAHA.118.009961
22. Rola, Philippe (2019). Bedside ultrasound: a primer for clinical integration, 2nd edition. The critical skill press.
23. Via G, Tavazzi G, Price S. Ten situations where inferior vena cava ultrasound may fail to accurately predict fluid responsiveness: a physiologically based point of view. Intensive Care Med. 2016 Jul;42(7):1164-7. https://doi.org/10.1007/s00134-016-4357-9
24. Stine JG, Wang J, Shah PM, Argo CK, Intagliata N, Uflacker A, Caldwell SH, Northup PG. Decreased portal vein velocity is predictive of the development of portal vein thrombosis: A matched case-control study. Liver Int. 2018 Jan;38(1):94-101. https://doi.org/10.1111/liv.13500
25. Gaiani S, Gramantieri L, Venturoli N, Piscaglia F, Siringo S, D’Errico A, Zironi G, Grigioni W, Bolondi L. What is the criterion for differentiating chronic hepatitis from compensated cirrhosis? A prospective study comparing ultrasonography and percutaneous liver biopsy. J Hepatol. 1997 Dec;27(6):979-85 https://doi.org/10.1016/S0168-8278(97)80140-7
26. Rosenkranz, S., Howard, L. S., Gomberg-Maitland, M. &Hoeper, M. M. Systemic Consequences of Pulmonary Hypertension and Right-Sided Heart Failure. Circulation 141, 678-693 (2020). https://doi.org/10.1161/CIRCULATIONAHA.116.022362
27. Mullens, W. et al. Importance of venous congestion for worsening of renal function in advanced decompensated heart failure. J. Am. Coll. Cardiol.53, 589-596 (2009). https://doi.org/10.1016/j.jacc.2008.05.068
28. Legrand, M. et al. Association between systemic hemodynamics and septic acute kidney injury in critically ill patients: a retrospective observational study. Crit Care17, R278 (2013). https://doi.org/10.1186/cc13133
30. Tang, W. H. W. & Kitai, T. Intrarenal Venous Flow: A Window into the Congestive Kidney Failure Phenotype of Heart Failure? JACC Heart Fail4, 683-686 (2016). https://doi.org/10.1016/j.jchf.2016.05.009
31. Lida, N. et al. Clinical Implications of Intrarenal Hemodynamic Evaluation by Doppler Ultrasonography in Heart Failure. JACC Heart Fail4, 674-682 (2016). https://doi.org/10.1016/j.jchf.2016.03.016
32. Yoshihisa, A., Watanabe, K., Sato, Y. et al. Intrarenal Doppler ultrasonography reflects hemodynamics and predicts prognosis in patients with heart failure. Sci Rep 10, 22257 (2020).
33. Di Nicolò P, Granata A. Renal Resistive Index: not only kidney. Clin Exp Nephrol. 2017 Jun;21(3):359-36634. Beaubien-Souligny, W. et al. Quantifying systemic congestion with Point-Of-Care ultrasound: development of the venous excess ultrasound grading system. Ultrasound J12, (2020). https://doi.org/10.1186/s13089-020-00163-w
35. Duchesne JC, Kaplan LJ, Balogh ZJ, Malbrain ML. Role of permissive hypotension, hypertonic resuscitation and the global increased permeability syndrome in patients with severe hemorrhage: adjuncts to damage control resuscitation to prevent intra-abdominal hypertension. Anaesthesiol Intensive Ther. 2015;47(2):143-55. https://doi.org/10.5603/AIT.a2014.0052
36. Johansson PI, Stensballe J, Ostrowski SR. Shock induced endotheliopathy (SHINE) in acute critical illness – a unifying pathophysiologic. Crit Care. 2017;21(1):25. https://doi.org/10.1186/s13054-017-1605-5
37. Verbrugge, F. H., Guazzi, M., Testani, J. M., & Borlaug, B. A. (2020). Altered Hemodynamics and End-Organ Damage in Heart Failure. Circulation, 142(10), 998-1012. https://doi.org/10.1161/CIRCULATIONAHA.119.045409
38. ErwanDonal, Elena Galli, Elise Paven, Leyla Elif Sade, Haemodynamic evaluation: a key tool for heart failure management. Ultrasounds forever! European Journal of Heart Failure. (2020). https://doi.org/10.1002/ejhf.2055
39. Pellicori P, Platz E, Dauw J, Ter Maaten JM, Martens P, Pivetta E, Cleland JGF, McMurray JJV, Mullens W, Solomon SD, Zannad F, Gargani L, Girerd N. Ultrasound imaging of congestion in heart failure: examinations beyond the heart. Eur J Heart Fail. 2020 Oct 29. https://doi.org/10.1002/ejhf.2032

 ORCID
ORCID