Ricardo Bustamante Bozzo 1 , Héctor Javier Lacassie Quiroga 2
Recibido: 12-11-2020
Aceptado: 14-11-2020
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 1 pp. 171-195|https://doi.org/10.25237/revchilanestv50n01-11
PDF|ePub|RIS
Pregnant patient in emergency
Abstract
Laparoscopic apendicectomy posterior fossa surgery in the sitting position in a pregnant patient with cerebellopontine angle meningioma. A review is made of those anatomical and physiological changes that occur during pregnancy, that may affect anesthesia administration. Emphasis is made in upper airway, respiratory function, cardiovascular and gastrointestinal systems. Pharmacokinetic and pharmacodynamic changes that are relevant to the administration of general and regional anesthesia are described. The most suitable time for surgery is discussed and is concluded that elective surgery must not be performed during pregnancy and it should be postponed until after delivery. In some cases, immediately after, such as tubal sterilization, and others, after normalization of physiological parameters. A remark is made regarding teratogenicity: Although there is a well-known effect of anesthetic drugs on cell formation, mitosis and DNA synthesis (which participate in cell differentiation and organogenesis), any significant change in function or morphology of a child, secondary to a prenatal treatments (such as, anesthetic management) may eventually affect the outcome. Finally, recommendations are made regarding the anesthetic techniques of choice. There is not a single optimal technique for all cases but becomes clear that maintaining maternal oxygenation and uteroplacental flow are the key. Whichever technique is chosen, it is paramount to avoid hypoxemia and acidosis, maintaining normocarbia and normothermia, treating hypotension aggressively; however, in general when a regional technique is feasible, its use is preferable.
Resumen
La apendicectomía laparoscópica es la cirugía más frecuente durante el embarazo. El Colegio Americano de Obstetras y Ginecólogos (ACOG), sugiere que es importante contactar a un obstetra antes de realizar la cirugía. Se hace una revisión de los cambios anatómicos y fisiológicos que ocurren durante el embarazo más relacionados con la administración de anestesia, especialmente en la vía aérea superior, en la función respiratoria, en el sistema cardiovascular y a nivel gastrointestinal. Se describen los cambios farmacológicos, farmacocinéticos y farmacodinámicos implicados con la administración de anestesia general y regional. Se discute el momento más adecuado para la realización de una cirugía: una cirugía electiva no debe realizarse durante el embarazo, sino que debe postergarse hasta después del parto; algunas inmediatamente después, como la esterilización tubaria y otras, después que los parámetros fisiológicos hayan vuelto a la normalidad. Se hace una referencia a la teratogenocidad, que no solo es el efecto de las drogas usadas en anestesia que pudieran afectar la formación celular, mitosis y síntesis de ADN, que participan en la diferenciación celular y la organogénesis, sino a cualquier cambio significativo en la función o morfología de un niño, secundario a algún tratamiento prenatal (en este caso, el manejo anestésico). Finalmente, se recomienda una técnica anestésica: no existe una única técnica óptima en la medida de que se mantenga la oxigenación materna y el flujo uteroplacentario. Cualquiera sea la técnica elegida, lo importante es evitar la hipoxemia y la acidosis, mantener la normocarbia y la normotermia, y tratar de manera agresiva la hipotensión arterial; sin embargo, en términos generales, cuando es posible, se prefiere una técnica regional.
En Estados Unidos alrededor de 1% (entre 0,75% y 2%) de las embarazadas necesita someterse a algún tipo de cirugía no obstétrica durante su embarazo[1]. Cerca de 75.000 mujeres embarazadas se operan en ese país cada año y 1,2% de mujeres en edad reproductiva tienen la prueba de embarazo positivo al ingresar a una cirugía ambulatoria electiva[2].
Las intervenciones no obstétricas más frecuentes en la embarazada son: apendicectomía (1:1.500 embarazos), colecistectomía (1:1.600), extirpación de quistes ováricos complicados, trauma y cirugía oncológica de mama[3].
Con el advenimiento de la cirugía laparoscópica, muchas de estas intervenciones pueden realizarse por esta vía, por lo que su manejo será tratado como un tema aparte. Algunas intervenciones son misceláneas como aneurismas intracraneales, valvulopatías, feocromocitomas y pueden generalmente postergarse hasta después del parto. Otras, como la cirugía oncológica, debe realizarse en el momento más oportuno y finalmente una cirugía que no es tan inhabitual, el cerclaje uterino, se hace en la mitad del embarazo.
En el Hospital de Urgencias Asistencia Pública, la apendicectomía es la cirugía más frecuente, presentándose, además, algunas pacientes fracturadas y por lo menos una politraumatizada grave al año. Por tratarse de un servicio de urgencias alejado de su hospital base, en tales casos es necesario hacer una buena coordinación del equipo quirúrgico, obstétrico y anestésico (y eventualmente neonatológico). Aunque el Colegio Americano de Obstetras y Ginecólogos (ACOG) no tiene recomendaciones basadas en la evidencia, sugiere que es importante contactar a un obstetra antes de realizar la cirugía, porque ellos son los que están técnicamente más capacitados para manejar los aspectos fisiológicos y anatómicos que pueden afectar el bienestar materno-fetal durante el intraoperatorio y determinar individualmente la necesidad de monitorización fetal, de tocólisis o de resolución del embarazo. Esto no siempre puede realizarse en forma preoperatoria en la urgencia, pero sí se realiza rutinariamente interconsulta en el postoperatorio. Es así como cada caso amerita un enfoque de equipo, para la óptima seguridad de la madre y el feto[4].
La cirugía puede ser necesaria durante cualquier etapa del embarazo, dependiendo de la urgencia de la indicación. En una serie de 5.405 casos, 42% se hizo durante el primer trimestre del embarazo, 35% durante el segundo trimestre y 23% durante el tercero[5]. Habitualmente, la cirugía se realiza solo y únicamente cuando es absolutamente necesaria para la salud de la madre, el feto o ambos.
En el manejo anestésico de una paciente embarazada deben considerarse como objetivos el bienestar de la madre y el feto, para lo que hay que hacer un balance de los requerimientos de ambos pacientes. Con el fin de obtener este propósito, es importante considerar algunos elementos teóricos que describiremos en este capítulo: cambios fisiológicos, anatómicos y farmacológicos que ocurren durante el embarazo, el momento más adecuado para realizar la cirugía, el tipo de anestesia más recomendado y el conocimiento de los fármacos proscritos o potencialmente peligrosos. Se debe tener en cuenta también algunos elementos prácticos: garantizar permanentemente una adecuada perfusión uteroplacentaria y prevenir el aborto o parto prematuros[6]. Algunas situaciones especiales, de baja incidencia serán tratadas en forma independiente.
-
Cambios fisiológicos y anatómicos: sus implicancias anestésicas
Durante el embarazo ocurren adaptaciones que son conocidas y que constituyen la base del manejo anestésico. Las más precoces están relacionadas especialmente con cambios hormonales, mientras que las más tardías se asocian a los efectos mecánicos derivados del aumento del tamaño del útero, al aumento de las demandas metabólicas por parte del feto y a la baja resistencia de la circulación placentaria. Se recordarán las más importantes a tener en cuenta para la administración de la anestesia.
-
Vía aérea superior
Cerca del final del embarazo, pero también desde mediados del segundo trimestre, los cambios hormonales producen un incremento del líquido extracelular (edema) e ingurgitación vascular (fragilidad capilar) de los tejidos orofaríngeos, que contribuyen a una reducción del tamaño de la abertura glótica y a un aumento del sangrado al contacto con la hoja del laringoscopio, la introducción de catéteres oro o nasofaríngeos y de sondas nasogástricas. El edema puede ser especialmente intenso en pacientes con preeclampsia, en pacientes por largo rato en posición de Trendelemburg o por el uso de tocolíticos.
Estos cambios pueden dificultar tanto la ventilación espontánea, produciendo dificultad de la ventilación por las vías nasales, así como durante la ventilación asistida cuando la paciente está inconsciente durante la inducción de la anestesia general o por cualquier otro compromiso de consciencia. Así también, la dificultad de la intubación traqueal puede aumentar por el engrosamiento del cuello, así como por el aumento de tamaño de las mamas. Esto se facilita con el uso de laringoscopio de mango corto y haciendo un movimiento de giro para evitar su contacto, o bien, utilizando la posición en rampa.
En 1.500 mujeres embarazadas sometidas a cesárea con anestesia general, se encontró que el riesgo de vía aérea difícil en pacientes con clasificación Mallampati clase III y IV fue 7,5 y 11,3 veces mayor que en aquellas con Mallampati clase I[7]. Tanto así que los autores concluyeron que la clasificación de Mallampati, tan poco útil en forma aislada en las pacientes no embarazadas, es mucho más predictiva de vía aérea difícil en las embarazadas. Al realizar un estudio fotográfico de la vía aérea superior desde la boca en 242 mujeres embarazadas se encontró que, entre las 12 y 38 semanas de edad gestacional, la incidencia del Mallampati clase IV aumentó en 44%, lo que se correlaciona con el aumento de peso materno[8].
Ha habido gran discusión sobre la mayor incidencia de intubación traqueal fracasada durante la inducción anestésica de las pacientes embarazadas. Aunque no todas las pacientes son difíciles de intubar, varias auditorías han evaluado la tasa de intubación fallida, existiendo cierta preocupación en relación con que, por realizarse menos anestesias generales en este tipo de pacientes, su incidencia aumenta. Cualquiera sea la causa (la disminución de las destrezas o un verdadero aumento de incidencia), la imposibilidad de intubar la tráquea es en la actualidad la causa más común de mortalidad materna relacionada con la anestesia en este grupo[9].
Para disminuir el riesgo de vía aérea fracasada, se recomienda un mayor uso de la anestesia regional, un mejor uso de entrenamiento clínico con simulación, el uso de algoritmos de vía aérea bien establecidos y adaptados para cada institución, uso de dispositivos de vía aérea avanzados y personal experimentado inmediatamente disponible[10]. Es también recomendable el uso de tubos endotraqueales de menos calibre (6,0-6,5 mm de diámetro interno) que los utilizados en la población general. Durante la extubación traqueal, el edema adicional de la vía aérea superior puede ocasionar obstrucción en el período de recuperación.
-
Cambios de la función respiratoria
El organismo de la mujer embarazada debe adaptarse a los requerimientos metabólicos cada vez mayores, al aumento del volumen del útero grávido y a los propios cambios cardiovasculares.
El diafragma se desplaza hacia cefálico con el aumento de la edad gestacional, lo que se acompaña de un aumento del diámetro anteroposterior y transversal de la caja torácica; esta compensación produce como resultado una disminución poco significativa de la capacidad pulmonar total. A partir del quinto mes de gestación se produce una disminución de la capacidad residual funcional (CRF) de 20%-30%, así como la de sus componentes: el volumen de reserva espiratorio (15%-20%) y el volumen residual (20%25%). Concomitantemente se produce un aumento del volumen de reserva inspiratorio. La capacidad vital no se modifica durante el embarazo.
La disminución de la CRF no produce grandes problemas en el embarazo normal, aunque puede tener implicancias durante la inducción de la anestesia general. Sin embargo, en aquellas pacientes con patologías como obesidad, tabaquismo o escoliosis, puede producirse un aumento del volumen de cierre y a medida que progresa el embarazo, puede ocasionar hipoxemia. El decúbito dorsal y la posición de Trendelemburg exacerban esta relación anormal entre volumen de cierre y CRF.
El incremento en los niveles de progesterona aumenta la ventilación minuto desde el comienzo del embarazo hasta llegar a 50% al término de la gestación, donde 35%-50% es en base al volumen corriente, con sólo un pequeño aumento de la frecuencia respiratoria. El espacio muerto alveolar aumenta proporcionalmente, al extremo de que la proporción de éste con el volumen corriente no se modifica. Tras la disminución de la progesterona después del parto, los cambios de volúmenes y capacidades se normalizan al cabo de tres semanas, aunque la normalización total no ocurre hasta 6 a 8 semanas posparto (Tabla 1).
El consumo basal de oxígeno también comienza a aumentar precozmente en el embarazo, llegando a 20% sobre el basal al término, aumentando concomitantemente la producción de CO2. Sin embargo, el aumento de la ventilación alveolar produce una sobrecompensación, reduciendo la PCO2 a niveles de alrededor de 28-32 mmHg y aumentando la PaO2 a alrededor de 100-106 mmHg en la fase inicial. Más avanzado el embarazo, la PaO2 vuelve a la normalidad o baja, por el cierre de las vías respiratorias más pequeñas en presencia de un volumen corriente normal y del cortocircuito intrapulmonar. La oxigenación mejora significativamente con el cambio de posición supina a lateral. La disminución de la PCO2 no modifica el pH arterial, debido a un aumento de la excreción renal de bicarbonato (Tabla 2).
Estos cambios de la función respiratoria tienen implicancias anestésicas. La disminución de la CRF y el aumento de la ventilación alveolar disminuyen los tiempos de inducción y salida de la anestesia inhalatoria al intensificar la captación y eliminación de los agentes inhalatorios. Por otra parte, la disminución de la CRF en conjunto con el aumento del metabolismo, disminuye la reserva de oxígeno durante el período de apnea previo a la intubación traqueal y predispone al desarrollo de hipoxemia. La obesidad materna, la preeclamsia o ambas, pueden acentuar el riesgo de hipoxemia asociada con la inducción y la salida de la anestesia general.
-
Cambios cardiovasculares
Los cambios más significativos que ocurren en el sistema cardiovascular durante el embarazo consisten en: aumento del volumen sanguíneo con las alteraciones hematológicas que ello implica, aumento del gasto cardíaco, disminución de la resistencia vascular y el riesgo de desarrollo de hipotensión arterial supina como resultado de la compresión vascular abdominal por el crecimiento del útero grávido.
Como producto de la mayor actividad de las hormonas mineralocorticoides durante la gestación se produce retención de sodio y agua, lo que da como resultado un aumento del volumen plasmático y del volumen sanguíneo total, de modo que al final del embarazo se alcanza un aumento de 40% a 50% y de 25% a 40% respectivamente. A pesar del aumento del volumen plasmático, la presión venosa central y la presión de capilar pulmonar no se modifican durante el embarazo, gracias al aumento en el tamaño del miocardio, que permite acomodar los nuevos niveles de volemia sin afectar las presiones de llenado.
La masa eritrocitaria aumenta sólo 20%, lo que explica la disminución de la hemoglobina a 11-12 g/100 ml y el valor del hematocrito a 35%. El aumento del volumen plasmático y la anemia relativa secundaria, alcanza niveles estables entre las 32 y 34 semanas de embarazo. Por otra parte, aumenta la cantidad de algunos factores procoagulantes, especialmente el fibrinógeno que se duplica y disminuye el número de plaquetas por efecto dilucional y mayor consumo. Los cambios en la coagulación alcanzan su máximo en el momento del parto. Otra modificación sérica importante relacionada con la administración de anestesia es la disminución de la actividad de la colinesterasa sérica en 20% al término de la gestación, aunque esta disminución no produciría aumento de la duración clínica de la succinilcolina (Tabla 3).
| Tabla 1. modificaciones de volúmenes y capacidades | ||
| Variable | Cambios | modificación |
| Ventilación minuto | ↑ | 45%-50% |
| Volumen corriente | ↑ | 35%-50% |
| Frecuencia respiratoria | ↑ | 0%-15% |
| Capacidad pulmonar total | ↓ | 0%-5% |
| Capacidad vital | Sin cambios | – |
| Capacidad inspiratoria | ↑ | 5%-15% |
| Volumen de reserva inspiratorio | ↑ | 0%-5% |
| Volumen corriente | ↑ | 40%-45% |
| Capacidad residual funcional | ↓ | 20% |
| Volumen de reserva espiratorio | ↓ | 20%-25% |
| Volumen residual | ↓ | 15%-20% |
| Tabla 2. modificaciones del consumo de oxígeno | ||
| Variable | Cambios | modificación |
| A término | ↑ | 20% sobre preembarazo |
| Parto (primera etapa) | ↑ | 40% sobre preparto |
| Parto (segunda etapa) | ↑ | 75% sobre preparto |
| Tabla 3. modificaciones hematológicas y séricas durante el embarazo | ||
| Variable | Cambios | modificación |
| Volumen plasmático | ↑ | 40-50% |
| Volumen sanguíneo total | ↑ | 25-40% |
| Hemoglobina | ↓ | 1-3 g/100 ml |
| Fibrinógeno | ↑ | 100% |
| Actividad de colinesterasa | ↓ | 20-30% |
El aumento del volumen de eyección de 20% a 25% y de la frecuencia cardíaca en 15% a 25% produce un aumento del débito cardíaco de 35% al final del primer trimestre, llegando a 40%-50% a las 28 semanas de embarazo. Durante el parto aumenta aún más el débito cardíaco, fluctuando con cada contracción (autotransfusión), pero el mayor aumento ocurre inmediatamente después del parto (3a etapa del trabajo de parto), donde puede llegar a ser 80% a 100% superior al de antes del inicio del parto. Esto puede constituir un gran riesgo para las pacientes cardiópatas, especialmente aquellas con estenosis valvulares fijas o hipertensión pulmonar. A las 24 h, el débito cardíaco regresa a los valores previos al parto y después de 2 semanas va disminuyendo hasta llegar entre 12 a 24 semanas a los valores previos al embarazo.
A pesar del aumento del débito cardíaco, la presión arterial se reduce en un embarazo normal, debido a una disminución de 20% de la resistencia vascular sistémica. La resistencia vascular pulmonar también baja en 35%. Tanto la presión arterial sistólica, diastólica como media se reducen entre 5% a 20% hasta la vigésima semana de gestación, aumentando gradualmente a partir de ese momento hasta llegar a los valores previos al embarazo. La presión venosa femoral aumenta 15% por efecto de compresión del útero grávido (Tabla 4).
A pesar de lo significativo de estas modificaciones, un motivo de preocupación para el anestesiólogo durante y después del segundo trimestre es la compresión aorto-cava[11]. El llamado síndrome de hipotensión en decúbito dorsal o síndrome de hipotensión supina ocurre en alrededor de 10% de las mujeres a término, porque en esta posición se produce disminu ción del calibre de la aorta y prácticamente oclusión de la vena cava inferior (Figura 1). El retorno de la sangre desde las extremidades inferiores se hace por las venas epidurales, ácigos y vertebral, que resultan congestionadas. Esto produce una brusca disminución de la precarga, del gasto cardíaco y de la presión arterial. El síndrome incluye taquicardia e hipotensión arterial, náuseas y vómitos, diaforesis, trastornos psicológicos y hasta presíncope o síncope. Los síntomas son más pronunciados en el tercer trimestre y se alivian con el decúbito lateral. La compresión de los vasos ilíacos puede exacerbar el éxtasis venoso y producir edema de las extremidades inferiores y aumentar el riesgo ya elevado de trombosis venosa profunda.
La anestesia neuroaxial predispone a la madre a la aparición del síndrome de hipotensión supina, por lo que es preciso evitar esta posición cuando se realizan estas técnicas con fines analgésicos durante el trabajo de parto o con fines anestésicos en cualquier intervención quirúrgica. Esto se logra mediante el giro de la paciente hacia la izquierda, lo que previene la hipotensión arterial y mantiene el flujo uteroplacentario. Existen cuñas de 10 a 15 cm como planos inclinados para poner en la cadera derecha o dispositivos especiales para desplazar el útero hacia la izquierda. En situaciones de urgencia esto puede ser reemplazado por una bolsa de suero o el puño de un operador.
Recientemente se ha visto en estudios con resonancia nuclear magnética que el decúbito dorsal no compromete el flujo aórtico, aunque sí el lumen de la vena cava inferior con inclinaciones < 15° (Figura 2)[12].
| Tabla 4. modificaciones cardiovasculares durante el embarazo | ||
| Variable | Cambios | modificación |
| Débito cardíaco | ↑ | 40-50% |
| Volumen de eyección | ↑ | 25-30% |
| Frecuencia cardíaca | ↑ | 15-25% |
| Resistencia vascular sistémica | ↓ | 20% |
| Resistencia vascular pulmonar | ↓ | 35% |
| Presión venosa central | Sin cambios | – |
| Presión capilar pulmonar | Sin cambios | – |
| Presión venosa femoral | ↑ | 15% |
Sobre la utilidad del uso de lateralización uterina en operación cesárea, se ha demostrado que no hace diferencias en cuanto a desenlaces fetales (puntaje de apgar ni gases arteriales fetales), sin embargo, no utilizar cuña aumenta los requerimientos de fenilefrina (para mantener normotensión arterial) y disminuye el débito cardiaco materno[13]. Es decir, clínicamente, pareciera poco importante su utilización, sin embargo, al observar desenlaces más finos, pudiera ser de ayuda. Por otra parte, el uso de cuña es una rutina ganada entre el personal obstétrico, por lo que es mejor seguir usándola, ya que en 10% de los casos se va a requerir y en ciertas condiciones obstétricas pudiese ser de gran utilidad. Por otra parte, en pacientes obstétricas con colapso cardiovascular, el desplazamiento uterino en 30° es mandatario para obtener mejores posibilidades de retorno de la circulación espontánea[14].
-
Cambios gastrointestinales
A medida que aumenta el tamaño del útero grávido, el estómago y el píloro se desplazan hacia cefálico, lo que produce a su vez un desplazamiento de la porción inferior del esófago hacia la cavidad intratorácica. La regurgitación de contenido gástrico depende de la gradiente entre la presión intragástrica y la del esfínter esofágico inferior (presión de barrera). Durante el embarazo, el esfínter esofágico inferior puede deformarse y ser insuficiente por efecto del útero grávido, mientras que la progesterona puede disminuir aún más su tonicidad. La producción de gastrina por parte de la placenta, también estimulada por la progesterona, aumenta la secreción de hidrogeniones en el jugo gástrico, haciendo que su contenido sea más ácido. El vaciamiento gástrico no está significativamente enlentecido durante el embarazo, pero sí durante el parto, potenciado por el dolor, la ansiedad y el uso de opioides.
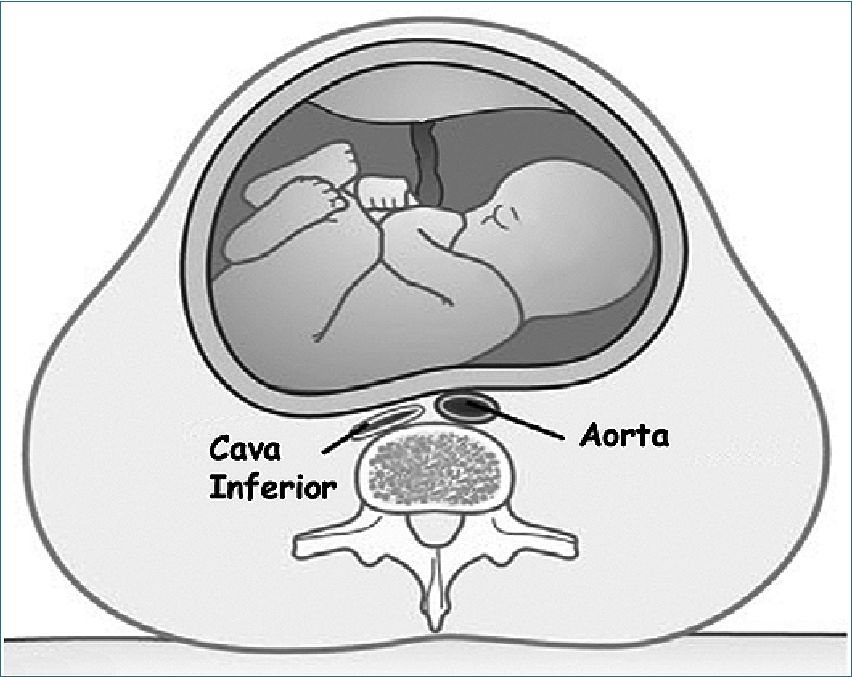
Figura 1. Corte a nivel de L5 en decúbito dorsal. Los grandes vasos, especialmente la vena cava inferior, son comprimidos por el útero grávido dando origen al síndrome de hipotensión supina.
Estos cambios anatómicos aumentan la frecuencia de esofagitis (pirosis) y regurgitación a lo largo del embarazo, así como el riesgo de aspiración de contenido gástrico y neumonitis ácida durante la inducción de anestesia general, especialmente en obesas. Las náuseas y los vómitos afectan hasta a 50% de las mujeres durante el embarazo, principalmente en el primer trimestre[15]. Se estima que ocurre neumonitis por aspiración en 0,1% de las cesáreas realizadas con anestesia general, donde las dificultades en la ventilación que ocurren durante el embarazo contribuyen a dicho riesgo[16]. Una mujer embarazada debe ser considerada con estómago lleno virtual, aunque esté en ayuno. Para la protección de la vía respiratoria materna y para reducir la exposición del feto a los diferentes medicamentos usados durante la anestesia general, se prefiere la anestesia regional cuando sea posible.
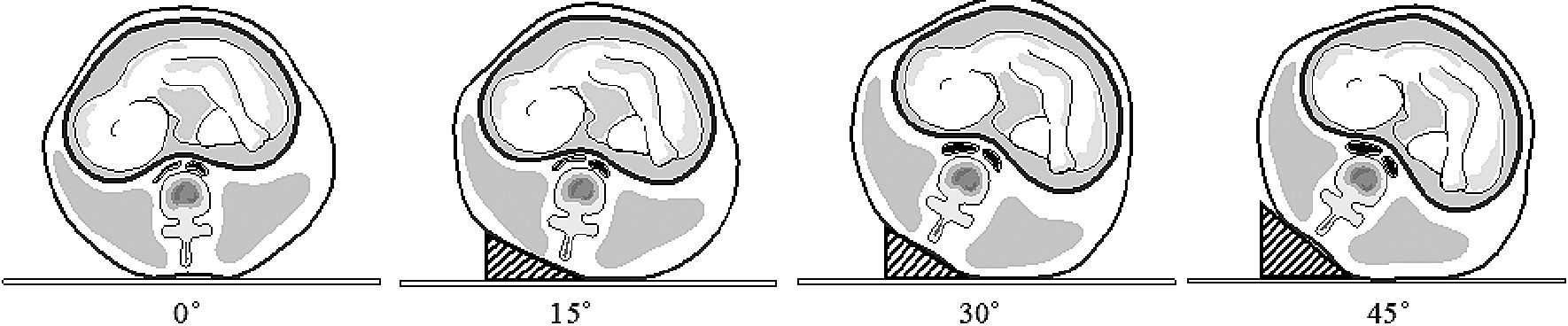
Figura 2. Efecto de la lateralización uterina en pacientes con embarazo a término, no anestesiadas. Se observa que la luz de la aorta no se compromete en ninguna inclinación, mientras que la cava inferior se hace patente desde inclinaciones de 30° o superior. (Adaptación de estudio de Higuchi et al. citado en el texto).
Las recomendaciones clínicas de muchos países anglosajones, como Estados Unidos, Canadá y el Reino Unido sugieren el uso de un antiácido no particulado previo a la inducción de la anestesia para neutralizar el pH gástrico. La incidencia de aspiración en tales circunstancias es tan baja que, en muchos otros países, incluyendo Latinoamérica y Chile no es una práctica habitual. La inducción debe hacerse en secuencia rápida y presión sobre el cartílago cricoides (maniobra de Sellick) antes de la intubación endotraqueal (otra maniobra que debe hacerse más por cumplir protocolos que por evidencia médica). Un agente procinético gástrico como la metoclopramida (10 mg en bolo administrados 15 min antes de la inducción de la anestesia), puede disminuir el volumen de contenido gástrico, aunque la administración de opioides reduce su eficacia. Los antagonistas H2 revierten la acidez gástrica solo una hora después de su administración; su asociación con antiácidos es más eficiente que no administrar nada o sólo antiácidos[17].
-
Cambios farmacológicos e implicancias anestésicas
En relación con la anestesia general, entre las 8 y 22 semanas de gestación disminuye la concentración alveolar mínima (CAM) de los agentes inhalatorios entre 32% y 40%, probablemente, debido al aumento de las concentraciones de progesterona y al incremento en la liberación de endorfinas[18]. Sin embargo, Ueyama et al., no encontraron diferencias en las mediciones electroencefalográficas de pacientes embarazadas de término anestesiadas con sevoflurano comparadas con no embarazadas, por lo que la modificación de la CAM pudiera no tener un buen correlato con profundidad hipnótica y a la vez representar una posible explicación de porqué las embarazadas tienen más riesgo de awareness que la población general[19].
Por otra parte, el volumen de distribución aumen tado por efecto del aumento del volumen sanguíneo total produce una disminución de la concentración de proteínas séricas por efecto dilucional, que ocasiona un aumento de las fracciones libres de los fármacos que se unen a ellas. Esto puede ocasionar diferentes efectos clínicos: por ejemplo, puede causar un aumento de la toxicidad sistémica de los anestésicos locales que tienen una elevada unión a proteínas.
Con relación a la anestesia neuroaxial, con la misma masa de anestésico local se obtiene un nivel superior de bloqueo en la mujer en el segundo y tercer trimestre de embarazo en relación con la no embarazada, debido a que la ingurgitación de las venas peridurales comprime el saco dural, disminuye el volumen intrarraquídeo y puede aumentar la difusión cefálica de los anestésicos locales[20].
Finalmente, con relación a la anestesia de nervios periféricos, se ha demostrado que el embarazo aumenta la sensibilidad del nervio mediano al bloqueo con lidocaína. En una preparación in vitro se ha demostrado una mayor susceptibilidad al bloqueo, que pudiera estar relacionada con la progesterona u otros mediadores hormonales[21].
La farmacocinética y la farmacodinamia alteradas durante el embarazo hace que los fármacos utilizados en anestesia deban ser cuidadosamente administrados, aunque, las alteraciones de fármacos individuales son heterogéneas. Lo que ocurre con los bloqueadores neuromusculares es un ejemplo de la complejidad de estos cambios[22]. Los niveles de colinesterasa plasmática están disminuidos en 25% desde el comienzo de la gestación hasta una semana después del parto, sin embargo, el bloqueo neuromuscular prolongado con succinilcolina es infrecuente, porque el mayor volumen de distribución compensa el impacto de la disminución de la hidrólisis del fármaco[23]. El vecuronio en una dosis estándar de 0,2 mg/kg tiene un tiempo de inicio más rápido y una mayor duración de acción en la embarazada. El tiempo de inicio de una dosis de 0,6 mg/kg de rocuronio no se modifica, pero también produce una mayor duración de acción en comparación con las pacientes no embarazadas. Los bloqueadores neuromusculares cuya eliminación es independiente del hígado y riñón también sufren alteraciones farmacocinéticas: por ejemplo, el cisatracurio, que se metaboliza por eliminación de Hoffman, tiene un tiempo de inicio y una duración de acción significativamente más cortos en la embarazada[24].
-
Momento más adecuado para la cirugía
Una cirugía electiva no debe realizarse durante el embarazo, sino que debe postergarse hasta después del parto. Algunas inmediatamente después, como la esterilización tubaria y otras, después que los parámetros fisiológicos hayan vuelto a la normalidad.
Debe evitarse la cirugía en todo lo posible durante el primer trimestre del embarazo ya que es un período fundamental de la organogénesis (desde día 13 al 60), donde se podrían producir alteraciones estructurales[25]. Luego de este período, se presentan las anormalidades funcionales, según las particularidades del caso. El crecimiento y desarrollo se producen durante el segundo y el tercer trimestre.
El segundo trimestre se considera el más adecuado para realizar una cirugía que pudo postergarse desde el primer trimestre, por varias razones:
– La incidencia de aborto baja a 5,6% en el segundo trimestre del embarazo, en comparación con 12% a 15% durante el primer trimestre.
– La incidencia de parto prematuro es menor en el segundo trimestre que en el tercero, aunque no es un período completamente libre de riesgos. La prevención y tratamiento del parto prematuro es el problema más difícil de superar en el perioperatorio y constituye la causa más común de muerte fetal. Probablemente su causa no está influenciada por el manejo anestésico, sino por la patología subyacente o el propio acto quirúrgico. La mayoría de los estudios demuestran que las mujeres que se han sometido a una cirugía durante el embarazo, incluso en el segundo trimestre, dan a luz antes que aquellas que no lo han hecho y sus hijos son más pequeños[26].
– En teoría, el riesgo de teratogénesis es más bajo a partir del segundo trimestre.
Obviamente que, si se trata de una cirugía de urgencia, especialmente emergencias de tipo abdominal, trauma, algunas lesiones neoplásicas, neuroquirúrgicas y cardíacas, deben realizarse sin importar el momento del embarazo y pensando en la seguridad de la madre. Las cirugías pueden ser propias del embarazo o no relacionadas con éste (Tabla 5).
Con fines prácticos, la cirugía no obstétrica durante el embarazo puede clasificarse en 3 grupos[27]: Cirugía electiva: cuando puede ser aplazada hasta seis semanas después del parto.
– Cirugía de urgencia: aquellos casos en que, sin poner en riesgo a la madre, se puede diferir hasta el segundo trimestre.
– Cirugía de emergencia: aquella que no puede postergarse porque aumenta la morbimortalidad materna y debe realizarse independientemente de la edad gestacional. El objetivo principal es favorecer la vida de la madre.
-
Teratogenicidad
La teratogenicidad se refiere no solo al efecto de las drogas usadas en anestesia que pudieran afectar la formación celular, mitosis y síntesis de ADN, que participan en la diferenciación celular y la organogénesis, sino a cualquier cambio significativo en la función o morfología de un niño, secundario a algún tratamiento prenatal (en este caso, el manejo anestésico). De este modo, la hipotensión arterial materna, la hipoxemia, los trastornos en el metabolismo de los hidratos de carbono y la hipertermia también han demostrado ser teratogénicos.
Cualquier agente puede ser teratogénico en animales si se produce una exposición suficientemente prolongada en una etapa de desarrollo sensible y en la dosis adecuada. Una pequeña dosis de un medicamento dado puede ser catastrófica para el embrión temprano, pero una gran dosis del mismo fármaco puede no tener efecto en un feto en una etapa avanzada de desarrollo. La mayoría de las anomalías estructurales de causa iatrogénica ocurren ante una exposición al fármaco durante el período de organogénesis (días 13-60), en tanto que las anomalías funcionales, durante el embarazo tardío.
| Tabla 5. Causas más habituales de cirugía no obstétrica durante el embarazo | |
| Cirugías relacionadas con el embarazo | Cirugías no relacionadas con el embarazo |
| Cerclaje | Abdomen agudo |
| Laparotomía pélvica de emergencia | Trauma |
| Cirugía neonatal | Cirugía oncológica
Cirugía neuroquirúrgica Cirugía cardíaca |
Después de años de estudios experimentales en modelos animales y estudios observacionales en seres humanos, no se ha demostrado que los fármacos anestésicos sean claramente peligrosos para el feto. La respuesta definitiva se ha visto obstaculizada por la imposibilidad ética de realizar ensayos aleatorios en mujeres embarazadas y a que ningún modelo animal es exactamente igual a la gestación humana. Por otra parte, constituye un problema para médicos y pacientes el hecho de que las nuevas drogas rara vez se prueban para determinar su seguridad durante el embarazo antes o después de su comercialización. No hay información adecuada para determinar si los beneficios superan los riesgos teratogénicos para 91% de los medicamentos introducidos en los últimos 20 años[28].
El Catálogo de Shepherd, que enumera los agentes o factores probadamente teratogénicos en humanos, no incluye agentes anestésicos ni fármacos utilizados de forma rutinaria durante la administración de anestesia[29]. Algunas moléculas altamente polarizadas como los bloqueadores neuromusculares, no atraviesan la barrera hematoencefálica en concentraciones clínicamente suficientes. El óxido nitroso afecta la síntesis de ADN y tiene efectos teratogénicos en animales. En seres humanos, sin embargo, en los años 70 se estableció una dudosa relación entre el personal femenino que trabaja en los pabellones quirúrgicos y en el entorno dental, con pérdida del embarazo y defectos de nacimiento, aunque se estableció un vínculo más convincente con la reducción de la fertilidad. En tiempos actuales, con las medidas utilizadas para eliminación de gases anestésicos ambientales, que pueden reducir la exposición al óxido nitroso en más de 90%, varios estudios realizados en este sentido no han demostrado esta asociación con resultados adversos[30]. Desde el punto de vista teórico, el óxido nitroso bloquea directamente la reacción de transmetilación mediante la cual se sintetiza la metionina a partir de la homocisteína y el metiltetrahidrofolato, oxidando la vitamina B12, cofactor de la enzima metionina sintetasa, responsable de la formación de las vainas de mielina, entre otros efectos. Sin embargo, desde el punto de vista clínico, la evidencia actual no apoya la suspensión del uso de óxido nitroso en la práctica clínica, ni por su posible efecto sobre el personal médico ni sobre una paciente embarazada[31].
También ha habido una preocupación por la posible asociación entre los benzodiacepínicos (específicamente diazepam) y defectos craneofaciales, como el paladar hendido o cardiopatías congénitas; sin embargo, estudios más recientes han refutado esa posible relación[32]. De este modo, en ocasiones puede ser apropiado proporcionar una ansiolisis preoperatoria juiciosa, de manera de evitar aumentos en los niveles de catecolaminas circulantes, que deterioran la perfusión uteroplacentaria.
-
Manejo anestésico
Como se ha dicho, los agentes anestésicos como: inductores, agentes inhalatorios e intravenosos, bloqueadores neuromusculares, anestésicos locales, benzodiacepinas y opioides, usados bajo condiciones clínicas normales, han demostrado ser seguros y no teratogénicos. Por eso, en la medida de que se mantenga la oxigenación materna y el flujo uteroplacentario, no existe una técnica anestesia óptima que pueda ser recomendada sobre otra. Cualquiera sea la técnica elegida, lo importante es evitar la hipoxemia y la acidosis, mantener la normocarbia y la normotermia, y tratar de manera agresiva la hipotensión arterial. Sin embargo, en términos generales, cuando es posible, se prefiere una técnica regional debido a la consideración de la vía aérea materna (riesgo de dificultad de intubación traqueal y aspiración de contenido gástrico) y la limitación de la exposición fetal a cualquier fármaco potencialmente nocivo[33]. La incidencia de falla en la intubación traqueal en la población obstétrica es de 1 entre cada 300 pacientes, 8 veces más frecuente que en la población quirúrgica general[34].
Frente a la elección de la técnica anestésica deben considerarse el tipo y la duración de la cirugía, el trimestre del embarazo y las pérdidas sanguíneas, con el fin de tomar la decisión más adecuada. Si el feto está muerto o no es viable, deben seguirse los mismos principios que en la paciente no embarazada. Si se desconoce el momento de la muerte fetal o si se ha producido como consecuencia de un trauma uterino o sepsis, debe corregirse una eventual coagulopatía antes de la anestesia y de la cirugía.
El manejo anestésico debe buscar los siguientes objetivos:
– Optimizar y mantener la fisiología materna normal.
– Optimizar y mantener el flujo uteroplacentario y la entrega de oxígeno al feto.
– Evitar el efecto de drogas que pudieran dañar al feto.
– Evitar la estimulación del miometrio.
– Evitar el despertar durante la anestesia general. Usar anestesia regional, si es posible.
-
Evaluación
En la evaluación preanestésica es necesario determinar la edad gestacional, explicar los riesgos materno-fetales a la familia y valorar las diferentes opciones anestésicas según el tipo y duración de la cirugía, el trimestre del embarazo y las pérdidas sanguíneas, con el fin de tomar la mejor decisión. Es conveniente contactarse con el obstetra de la paciente o hacer una interconsulta con el fin de obtener su opinión sobre la necesidad de monitorización de latidos cardiofetales (LCF) o realizar tocólisis. Después de las 24 semanas de gestación hay que verificar la disponibilidad de una unidad neonatal en caso de que ocurriera parto prematuro o cesárea de emergencia.
La premedicación con una dosis única oral o endovenosa de benzodiacepínicos puede prevenir el deterioro de la circulación uteroplacentaria si la paciente demuestra signos de ansiedad, sin embargo, la tranquilidad que brinda el contacto previo con el anestesiólogo puede evitar su uso. A partir de las 16 semanas de gestación debe hacerse profilaxis con antagonistas de los receptores H2 y antiácidos no particulados.
-
Monitorización
El objetivo de la monitorización es vigilar una adecuada oxigenación, mantener normocarbia y euglicemia. La monitorización es la habitual, incluyendo electrocardioscopía (ECG), presión arterial no invasiva, oximetría de pulso y capnografía. En situaciones que se prevé pérdidas sanguíneas importantes se debe medir la presión arterial directa. El uso de catéter venoso central o catéter de arteria pulmonar es de muy baja ocurrencia y su utilización dependerá de las características específicas de cada paciente y la patología que motiva la cirugía.
Hay que recordar que la paciente embarazada tiene la paCO2 reducida en 10 mmHg durante el embarazo, debido al aumento de la ventilación minuto. La glucosa en sangre debe controlarse durante los procedimientos largos para evitar la hipoglicemia. Los mínimos cuidados sugeridos por la ACOG son: monitorización básica para la madre, sumada a la de LCF pre y postoperatorios (y opcionalmente durante la cirugía).
Asimismo, las recomendaciones actuales de la ACOG sugieren que la decisión de realizar monitorización fetal debe ser tomada caso a caso y, de ser usada, debe basarse en la edad gestacional, el tipo de cirugía y la disponibilidad del instrumento. De este modo, cada paciente requiere una aproximación de anestesiólogos, obstetras y cirujanos, para garantizar la óptima seguridad de la madre y el feto[35].
Independientemente de esta recomendación, el monitoreo de la frecuencia cardíaca fetal es factible a partir de las 18-22 semanas. Sin embargo, es a partir de las 24-26 semanas, cuando se asume viabilidad fetal, cuando puede ser determinante en inducir a tomar determinaciones clínicas durante la cirugía, aunque no haya evidencia que demuestre que usando esta monitorización mejore el resultado final en el feto. Desde entonces, se puede detectar sin dificultad la variabilidad de la frecuencia cardíaca. Puede ser difícil de obtener en las pacientes con sobrepeso o en la cirugía abdominal, cuando el instrumento invade el campo quirúrgico.
La pérdida de la variabilidad de la frecuencia cardíaca fetal no es necesariamente un indicador de sufrimiento fetal, sino simplemente el efecto de los agentes anestésicos y sedantes sobre el sistema autónomo fetal, la hipotermia o los periodos de sueño fetal. Por el contrario, la disminución de la frecuencia cardiaca (latidos cardiofetales menor a 80/min) es más preocupante y puede ser un indicador de hipoxemia, asfixia y acidosis fetal, pero también puede estar relacionada con hipotermia y acidosis respiratoria materna o con la administración de fármacos, agentes anestésicos o ambos, que tienden a disminuir la frecuencia cardíaca[36]. Las desaceleraciones pueden hacer tomar decisiones precozmente: aumentar la oxigenación materna, aumentar la ventilación, subir la presión arterial (con fluidos o vasopresores adecuados), aumentar el desplazamiento uterino, cambiar la posición de separadores quirúrgicos o iniciar tocólisis. El monitoreo intraoperatorio de LCF requiere una interpretación hábil y un obstetra con un plan de acción en caso de diagnóstico de sufrimiento fetal. La manipulación uterina debe minimizarse para evitar el parto prematuro.
-
Inducción de la anestesia
La posición de la paciente debe asegurar una inclinación lateral izquierda para facilitar el desplazamiento uterino. Los cambios de posición materna pueden producir efectos hemodinámicos significativos y deben llevarse a cabo lentamente, especialmente las posiciones de Trendelemburg y Fowler. Desde la semana 19 en adelante las pacientes ya presentan riesgo de desarrollar el síndrome de hipotensión supina, lo que compromete el flujo sanguíneo uteroplacentario. Esto es exacerbado por un bloqueo neuroaxial, en que los mecanismos compensatorios están disminuidos o suprimidos.
La preoxigenación debe ser cuidadosa antes de comenzar una anestesia general, ventilando durante 5 min con O2 100%, para asegurar una meticulosa desnitrogenación pulmonar. En emergencias con inducción de secuencia rápida, esto se puede reemplazar realizando 5 inhalaciones a capacidad vital con O2 100%. Puesto que los requerimientos de oxígeno maternos aumentan y la CRF disminuye, la desaturación arterial puede ocurrir en muy poco tiempo. Aunque la intubación endotraqueal es perentoria, en caso de fracasar, se ha usado exitosamente máscaras laríngeas en las mujeres embarazadas, con la paciente en posición de Fowler y mantención de la maniobra de Sellick[37]. La intubación nasal debe evitarse durante el embarazo debido a la mayor vascularización de las mucosas.
Cualquier hipnótico es seguro para la inducción de la anestesia, con excepción de la ketamina, que aumenta la tonicidad uterina tanto en modelos experimentales como en mujeres embarazadas, especialmente durante los primeros meses de la gestación, por lo que está contraindicada[38]. Esto puede dificultar la inducción de las pacientes politraumatizadas en shock hipovolémico, donde la ketamina, que es el agente de elección, debe ser reemplazado por etomidato. Las dosis de hipnóticos endovenosos son más bajas que en las pacientes no embarazadas, probablemente por los cambios hormonales, sin embargo, no se recomiendan modificarlas[39].
La relajación muscular en la inducción en secuencia rápida debe hacerse con succinilcolina. La succinilcolina no penetra la barrera placentaria a menos que se empleen dosis superiores a 300-500 mg. El rocuronio debe usarse en dosis de 1,2 mg/kg, cuando está contraindicada la succinilcolina o cuando se trata de una cirugía prolongada, pues en esas dosis se transforma en un bloqueador de larga duración. Además, si el feto debe sacarse utilizando esas dosis, debe tenerse en cuenta que la relación feto/materna de rocuronio es 0,16, por lo que el recién nacido pudiese mostrar efectos de la droga.
-
Mantención de la anestesia
La mantención de la anestesia puede hacerse en forma endovenosa o inhalatoria. La limitación de la anestesia endovenosa total es la hipovolemia u otras situaciones en que el propofol no permite la mantención de presiones arteriales compatibles con una adecuada perfusión uteroplacentaria.
Los agentes inhalatorios pueden ser usados sin excepción, manteniéndolos a concentraciones por debajo de 2 CAM para prevenir su efecto deletéreo sobre el débito cardíaco materno. Como contraparte, la relajación uterina es proporcional a la concentración de halogenados, lo que es beneficioso, pues aumenta el flujo sanguíneo uterino. Como se señaló, el embarazo está asociado con requerimientos anestésicos más bajos, cuyo mecanismo es desconocido, aunque posiblemente mediado por hormonas. La CAM para los anestésicos inhalatorios se reduce en 30% precozmente, entre las 8-12 semanas de gestación. A pesar de todas las disquisiciones teóricas que se han hecho sobre los posibles efectos nocivos del óxido nitroso, no hay evidencia en la actualidad para que no pueda ser usado discrecionalmente por los anestesiólogos para disminuir las concentraciones de halogenados; sin embargo, su uso es cada vez menor en toda circunstancia, más por razones ambientales que médicas.
Más importante que la elección de los agentes inhalatorios o endovenosos que se van a utilizar en la mantención de la anestesia general, es importante una profundidad adecuada, pues una anestesia superficial se asocia a un aumento de catecolaminas circulantes, que producen un deterioro de la perfusión uteroplacentaria y, por ende, del bienestar fetal.
La mantención del bloqueo neuromuscular puede hacerse con cualquier relajante muscular; en su mayoría son moléculas estructuralmente grandes (sales de amonio cuaternario) y altamente polarizadas, por lo que cruzan escasamente la barrera placentaria y sus cocientes feto/maternos son mínimos. Debe privilegiarse aquellos que producen menos liberación de histamina, para mantener la presión arterial materna más estable. Los cambios farmacocinéticos son tan individuales e impredecibles que se recomienda el uso de monitorización intraoperatoria de la relajación muscular, especialmente para no sobredosificar los bloqueadores neuromusculares, porque los anticolinesterásicos deben administrarse lentamente y con precaución, para prevenir el aumento de los niveles de acetilcolina, que pueden inducir aumento de la contractilidad uterina. No hay estudios de seguridad de sugammadex durante el embarazo, por lo que el laboratorio que produce la droga recomienda solo su uso en casos de urgencia vital (no poder ventilar-no poder intubar)[40].
La ventilación debe mantenerse tratando de preservar los niveles de ETCO2 dentro de los límites que se observan normalmente en el embarazo; existe una relación lineal entra la PaCO2 materna y fetal. La hipercarbia materna limita la gradiente de difusión de CO2 desde la sangre fetal a la materna y puede producir acidosis fetal. Existe una buena correlación entre la ETCO2 y la PaCO2, por lo que la capnografía es una buena forma para guiar la ventilación. La ventilación a presión positiva y el uso de PEEP deben tener en cuenta los cambios hemodinámicos que pudieran comprometer la perfusión placentaria.
Es durante la mantención de la anestesia donde ocurren las situaciones que pueden traducirse en deterioro fetal y parto prematuro. Es necesario garantizar en todo momento una adecuada presión de perfusión uterina, que es directamente proporcional a la presión arterial media materna. La compresión aorto-cava puede comenzar a partir de la semana 16 de gestación y el desplazamiento uterino debe ser permanentemente mantenido. Además, de la mantención permanente del desplazamiento uterino, la administración de fluidos, la posición de Trendelemburg, la elevación de las piernas, el uso de medias o compresión venosa (o su combinación), son las medidas preventivas más importantes del síndrome de hipotensión supina.
Si es necesario usar fármacos, los agentes vasoactivos a adrenérgicos que reducen el flujo uteroplacentario como la adrenalina y la dopamina, no son los ideales para el tratamiento de la hipotensión arterial intraoperatoria, puesto que, aunque la presión sanguínea materna puede aumentar, el flujo sanguíneo uterino puede permanecer deprimido. La efedrina es el agente de elección, pero cuando ésta es ineficaz o hay contraindicación de usarla (estenosis de válvulas cardíacas o tratamiento con b agonistas), se han usado pequeñas dosis de fenilefrina en forma segura en varios estudios y reportes, siendo el agente de segunda elección.
El riesgo de parto prematuro es mayor en casos de cirugía abdominal baja, con una incidencia de 14%16%, que se incrementa a 22% en cirugía de urgencia[41]. La monitorización intraoperatoria de LCF es muchas veces impracticable en situaciones de urgencia o en cirugía abdominal. Su uso no ha demostrado mejores resultados en los parámetros fetales. Lo más probable es que no haya disponibilidad de personal con experiencia en interpretar la variación de latidos, y una mala interpretación del monitor fetal podría dar lugar a un parto prematuro innecesario[42].
El uso de tocolíticos en forma profiláctica en los grupos de mayor riesgo debe ser conversado con el equipo obstétrico y puede ser considerado en procedimientos como el cerclaje y la cirugía fetal in utero(ver abajo). Su uso indiscriminado es controversial porque no ha disminuido la incidencia de parto prematuro y no está exento de riesgo. La indometacina (oral o rectal) no tiene interferencias con la anestesia; la infusión de sulfato de magnesio potencia el efecto de los bloqueadores neuromusculares y atenúa la capacidad de respuesta vascular, lo que dificulta el tratamiento de la hipotensión arterial en situaciones de hipovolemia; los estimulantes b2 adrenérgicos (fenoterol, terbutalina) producen taquicardia, hipotensión arterial y arritmias particularmente en pacientes anestesiadas.
Su uso postoperatorio en cambio, al ser detectada actividad uterina, ha disminuido el porcentaje de nacimientos prematuros. Probablemente la monitorización tocográfica durante las primeras horas o días después de la operación (dependiendo de la cirugía y/o la presencia de actividad uterina) y el tratamiento oportuno al aparecer contracciones son las medidas más racionales.
En las cirugías que se deben realizar durante el tercer trimestre de la gestación, a menudo se recomienda realizar una cesárea antes de la cirugía mayor. En tales casos, cuando es posible, la cirugía debe retrasarse 48 h para realizar maduración pulmonar fetal con esteroides y luego realizar la cesárea con anestesia regional y convertirla a anestesia general para la cirugía definitiva. En la anestesia posterior al parto, si es inhalatoria, debe considerarse la precaución de usar hasta 0,5 CAM de halogenados e iniciar infusión de oxitócicos para minimizar el riesgo de inercia uterina[43].
La extubación traqueal debe hacerse con criterios más estrictos, con la paciente lo más despierta posible y ojalá en decúbito lateral, previa aspiración cuidadosa del contenido gástrico y la faringe.
-
Posoperatorio
El manejo posoperatorio debe estar enfocado en el riesgo de parto prematuro, la prevención de la enfermedad tromboembólica y el manejo del dolor.
La monitorización del período intraoperatorio debe continuarse en la sala de recuperación como en todos los pacientes, pero con un énfasis especial en: la posición (decúbito lateral o desplazamiento uterino hacia la izquierda), evitar hipoxemia, mantener normocarbia, controlar la temperatura y ser cuidadosamente agresivos en el tratamiento de la hipotensión arterial.
Además, debe hacerse monitoreo de la frecuencia cardíaca fetal y de la actividad uterina si no se hizo durante la operación, de modo de evitar el parto prematuro en forma precoz y activa. No existe evidencia sobre el tiempo en que se debe mantener este control. En un hospital general, el monitoreo especializado puede requerir la recuperación en la sala de recuperación postanestésica de la unidad de obstetricia o unidad de tratamiento intensivo.
Se debe proporcionar una buena analgesia posoperatoria, teniendo en cuenta que la analgesia disminuye la variabilidad de la frecuencia cardíaca fetal, por lo que se deben usar técnicas regionales cuando sea posible, ya que tienen menos interacciones con el feto y presentan menores efectos adversos para la madre. El dolor posquirúrgico es un desencadenante de actividad uterina, sin embargo, su control puede enmascararla y retardar su tratamiento. Los estudios de teratogenicidad en animales de experimentación de varios analgésicos son contradictorios. Se ha observado un aumento de anomalías fetales con morfina, meperidina, metadona y otros[44] y, por otra parte, no se ha asociado a ningún efecto teratogénico la administración crónica de morfina[45], fentanilo, sufentanilo y alfentanilo[46]. No hay evidencia de teratogenicidad de opioides en humanos; la exposición a corto plazo de narcóticos se considera segura, aunque crucen la barrera placentaria y se continúe con el embarazo después de la cirugía.
Los antiinflamatorios no esteroidales (AINES) se evitan por lo general el último trimestre del embarazo, porque pueden ocasionar oligohidramnios y el cierre prematuro del ducto arterioso, con hipertensión primaria neonatal debido a la inhibición de la prostaglandina sintetasa[47]. Sin embargo, no se ha encontrado este efecto cuando se usa indometacina en el tratamiento del parto prematuro, por lo que se cree que este riesgo se ha exagerado[48]. Tanto el cierre prematuro del ducto arterioso como el oligohidramnios son reversibles. Se recomienda evitar el uso de AINES, especialmente de ibuprofeno, por más de 48 h en pacientes que cursan el tercer trimestre de embarazo[49].
Entre las adaptaciones fisiológicas del embarazo, se produce un estado de hipercoagulabilidad. Aumentan casi todos los procoagulantes, incluyendo los factores VII, VIII, IX, X y XII y especialmente el fibrinógeno (factor I). Se produce, además, trombocitopenia por hemodilución. Estos hechos, incrementados aún más por la estasis venosa posoperatoria, son responsables de que las pacientes embarazadas tengan un riesgo cinco veces mayor de enfermedad tromboembólica (ETE)[50]. La compresión venosa con medias elásticas y la compresión neumática intermitente deben iniciarse antes de la inducción de la anestesia, pues mejoran el retorno venoso y protegen del tromboembolismo.
También es importante la movilización precoz (otra razón para el manejo agresivo del dolor postoperatorio). Con relación al uso de profilaxis farmacológica, no hay estudios prospectivos aleatorios en pacientes embarazadas sometidas a cirugía no obstétrica que traten este aspecto, por lo que es necesario adaptarse a situaciones de mayor riesgo de ETE en situaciones no obstétricas; la relación riesgo/beneficio dependerá de las posibilidades de sangrado. Aunque existe un acuerdo general en que la hospitalización o la razón de la hospitalización, coloca a una mujer embarazada en mayor riesgo de ETE, no hay datos que demuestren qué método de tromboprofilaxis debe usarse o si algún método es eficaz para prevenir la ETE en embarazadas hospitalizadas[51]. Debe considerarse iniciar la tromboprofilaxis desde el ingreso hospitalario en embarazadas con complicaciones médicas o quirúrgicas, con lesiones ortopédicas o que tienen más factores de riesgo para ETE (Tabla 6)[52].
La ACOG[53] y el Royal College of Obstetricians and Gynecoalogists (RCOG)[54] han desarrollado recomendaciones para la atención de mujeres con factores de riesgo agregado de ETE en momentos específicos del embarazo, y después del parto vaginal o por cesárea, usando un sistema de puntuación. Los factores de riesgo agregado pueden ser preexistentes (historia de enfermedad tromboembólica o trombofilia) o surgir durante el embarazo (ingreso hospitalario o necesidad de cirugía). Se consideran de riesgo intermedio la comorbilidad médica y un procedimiento quirúrgico. El uso de heparinas de bajo peso molecular tiene varias ventajas sobre la heparina no fraccionada (a no ser en el tercer trimestre, que necesite ser revertida) (Tabla 7)[55]. La tromboprofilaxis farmacológica no es inocua y debe analizarse con el equipo quirúrgico y obstétrico el momento de inicio y la duración de la terapia.
-
Anestesia neuroaxial
No hay estudios que demuestren la evidencia de un efecto beneficioso sobre el resultado del embarazo de la anestesia regional comparada con anestesia general. Sin embargo, el mayor riesgo de hipoxemia materna y fetal ante dificultades en la intubación traqueal o riesgo de aspiración de contenido gástrico, hacen que la anestesia regional se elija por sobre la anestesia general cada vez que sea posible. Además, la anestesia regional tiene la ventaja de minimizar la exposición fetal a fármacos, especialmente en el primer trimestre del embarazo, se asocia a menores pérdidas sanguíneas y disminuye la variabilidad de LCF en el monitoreo fetal continuo.
Aunque la evidencia no lo demuestre, los riesgos para la madre y el feto son teóricamente menores, en la medida que la anestesia regional sirva para el procedimiento quirúrgico. Con un bloqueo de plexo supraclavicular se puede reducir ortopédica o quirúrgicamente una fractura de antebrazo o con una anestesia espinal puede realizarse una osteosíntesis de fémur, una apendicectomía abierta o un quiste ovárico complicado. Pero en cirugía laparoscópica o de abdomen superior, resulta impracticable. El desarrollo de la técnica combinada (espinal-peridural), ha proporcionado una nueva alternativa terapéutica, al combinar calidad anestésica con mínimas dosis y máxima flexibilidad, con el tiempo que brinda una técnica peridural continua.
Durante la anestesia regional debe hacerse la misma monitorización y tomarse las mismas precauciones que las descritas para la anestesia general. El mayor riesgo de la anestesia regional es la hipotensión arterial que resulta del bloqueo simpático, especialmente después de una anestesia neuroaxial, potenciada por la compresión aorto-cava, que reduce el flujo sanguíneo uterino y, por ende, la perfusión fetal. Lo más importante es la prevención de la hipotensión arterial materna antes del bloqueo con un adecuado aporte de volumen y un efectivo desplazamiento uterino. La mantención de la presión arterial es crítica. En caso necesario, debe administrarse vasopresores.
| Tabla 7. Dosis tromboprofilácticas sugeridas en el pre y posnatal por el Royal College of Obstetricians and Gynaecologists de heparinas de bajo peso molecular | |||
| Peso (kg) | Enoxaparina | Dalteparina | Tinzaparina (75 u/kg/ día) |
| < 50 | 20 mg diarios | 2.500 u diarias | 3.500 u diarias |
| 50-90 | 40 mg diarios | 5.000 u diarias | 4.500 u diarias |
| 91-130 | 60 mg diarios* | 7.500 u diarias | 7.000 u diarias* |
| 131-170 | 80 mg diarios* | 10.000 u diarias | 9.000 u diarias* |
| > 170 | 0,6 mg/kg/diarios* | 75 u/kg/día | 75 u/kg/día* |
| Dosis altas para mujeres entre 50-90 | 40 mg c/12 h | 5.000 u c/12 h | 4.500 u c/12 h |
| Tabla 6. Evaluación del riesgo de tromboembolismo en pacientes que van a ser sometidas a operación cesárea |
| Bajo riesgo: deambulación precoz |
| Parto por cesárea para un embarazo sin complicaciones, sin otros factores de riesgo |
| Riesgo moderado: heparinas de bajo peso molecular o medias elásticas |
| – Edad: mayor de 35 años
– Obesidad: índice de masa corporal mayor de 30 – Paridad: mayor de 3 – Venas varicosas gruesas – Infección en curso – Preeclampsia – Inmovilidad por más de 4 días antes de la operación – Enfermedad grave en curso – Cesárea de urgencia durante el trabajo de parto |
| Riesgo alto: heparinas de bajo peso molecular y medias elásticas |
| – Presencia de más de dos factores de riesgo moderado
– Cesárea con histerectomía – Antecedentes de trombosis venosa profunda o trombofilia conocida |
Tradicionalmente el vasopresor de elección en la hipotensión arterial por bloqueo simpático en la paciente embarazada ha sido la efedrina, debido a sus propiedades estimulantes predominantemente sobre los receptores beta y su falta de efectos sobre la circulación uteroplacentaria. Sin embargo, investigaciones más actuales han demostrado que es más importante el tratamiento efectivo de la hipotensión arterial materna que la elección teóricamente más adecuada del agente. Es así como la fenilefrina, un vasopresor alfa estimulante, previamente contraindicada, se considera actualmente una alternativa válida.
La dosificación de los anestésicos locales debe ser ajustada. En el caso de la anestesia neuroaxial deben disminuirse las dosis en alrededor de un tercio respecto a la que se usaría en una paciente no embarazada. Aunque el mecanismo no se conoce con exactitud, la disminución del tamaño del canal raquídeo por la ingurgitación venosa y el aumento en el contenido adiposo epidural, asociado a una mayor sensibilidad neuronal a los anestésicos locales son las causas más probables.
La anestesia regional, en tanto se mantenga la estabilidad hemodinámica, aporta además un excelente control del dolor posoperatorio, especialmente con el uso de catéteres. Esto permite una reducción de la sedación de la madre con el uso de analgésicos narcóticos, de modo que la paciente puede sentir las contracciones en caso de parto prematuro y se puede efectuar una movilización precoz, reduciendo el riesgo de enfermedad tromboembólica.
Si es necesario el uso de anestesia general o convertir una anestesia regional, es importante que sea realizada por un anestesiólogo debidamente capacitado y, en lo posible, con experiencia en la administración de anestesia general a pacientes embarazadas.
-
Situaciones especiales
Con los avances de la cirugía y de la anestesiología, se están realizando procedimientos cada vez más complicados durante el embarazo. Existe una serie de situaciones muy específicas que son de reciente incorporación, como la cirugía laparoscópica o bien, de muy baja frecuencia, como el trauma y la necesidad de realizar una cirugía cardíaca o neuroquirúrgica. Aunque se aplican los mismos principios básicos de la anestesia en pacientes embarazadas, algunos tienen características especiales que justifican una discusión adicional.
-
Trauma
El trauma es una de las principales causas de muerte materna. Alrededor de 6% a 7% de las pacientes embarazadas se presentan al hospital como consecuencia de un trauma, de diversa gravedad[56]. En Estados Unidos la primera causa de trauma durante el embarazo son los accidentes automovilísticos (64%). El resto son caídas (19%), heridas penetrantes por arma de fuego o arma cortopunzante, trauma cerrado (10%) y quemaduras (1%). En Chile no hay estadísticas ni publicaciones al respecto.
Puede acompañarse de muerte fetal, que ocurre por hipovolemia o shock hipovolémico materno, desprendimiento de placenta o muerte materna. Se debe realizar una ecografía al llegar la paciente al box recuperador para determinar la viabilidad fetal e iniciar en ese momento el monitoreo de LCF. Los procedimientos diagnósticos son los mismos, con protección radiológica para el feto cuando sea posible. La exposición a radiación debe tenerse presente, pero no está contraindicada, tratando de mantener niveles de exposición menores de 5 rad. Por ejemplo, una tomografía axial computarizada de cráneo expone a menos de 1 rad y no representa mayor riesgo para el feto[57]. El examen radiográfico de rutina después de un traumatismo (columna cervical, tórax y pelvis con protección) produce una exposición insignificante al feto[58]. El ultrasonido y la resonancia nuclear magnética no utilizan radiaciones ionizantes.
La reanimación cardiopulmonar en mujeres embarazadas debe hacerse bajo los estándares de Advanced Cardiac Life Suport (ACLS), considerando los cambios fisiológicos del embarazo: debe haber una especial preocupación por desplazar el útero o inclinación lateral hacia la izquierda, para prevenir la compresión aorto-cava y mejorar la perfusión materna. Debe tenerse altamente presente un parto por cesárea perimortem en aquellas madres en que no ha habido retorno a la circulación espontánea después de cuatro minutos de reanimación de buena calidad[59]. Una descripción completa se hace en el capítulo “Anestesia para Emergencias en Obstetricia”.
Si el feto no es viable (< 24 semanas) o está muerto, el tratamiento debe enfocarse en la condición de la madre, que en tal caso tolerará el parto inducido posteriormente, mucho mejor que un parto por cesárea en el momento de la emergencia. Sólo debe indicarse una cesárea de emergencia en caso de: Una madre estable con un feto viable en peligro. Rotura uterina traumática.
– Si el útero grávido interfiere con las reparaciones intraabdominales de la madre.
– Una madre que no puede ser salvada con un feto que sea viable.
En los accidentes automovilísticos el traumatismo encéfalocraneano (TEC) es la principal causa de muerte materna. 20% de ellos son traumas mayores y se acompañan de fractura de cráneo, contusión cerebral, hemorragia intracerebral, fractura de vértebras cervicales, compromiso toracoabdominal con daño visceral o genitourinario y fracturas pélvicas. 17% se trata de traumas menores con laceraciones profundas de cara, tórax y abdomen, fracturas de huesos largos, fracturas faciales y 63% presentan lesiones superficiales leves.
Los efectos directos del trauma cerrado abdominal con frecuencia producen hematoma retroperitoneal con el riesgo de hemorragia pelviana. Las fuerzas generadas en el trauma cerrado grave producen desprendimiento de placenta normo inserta y ruptura uterina, con una frecuencia de 0,6% de los traumas en embarazadas y una mortalidad de 50%[60]. Se manifiesta por aumento del tono uterino, contracciones o metrorragia, aún después de las 48 h del trauma. El grado de sangrado vaginal no tiene una correlación directa con el grado de desprendimiento placentario.
-
Cirugía laparoscópica
En un comienzo existió preocupación con relación al efecto sobre el bienestar fetal durante la cirugía laparoscópica, especialmente por estudios en modelos animales que sugerían la posibilidad de traumatismo uterino y fetal directo con la aguja de Verres, la generación de acidosis fetal por absorción de CO2 y la disminución de la perfusión utreroplacentaria por la disminución del gasto cardíaco materno y el aumento de la presión intraabdominal[61],[62]. Sin embargo, la experiencia en clínica en seres humanos ha sido favorable, por lo que la cirugía laparoscópica se ha convertido en las últimas décadas en un procedimiento de elección en el embarazo en patologías que por lo demás, están entre las más frecuentes: apendicectomías, colecistectomías, quistectomías ováricas complicadas, biopsias hepáticas, etc. La laparoscopía ha demostrado ser una técnica quirúrgica segura con relación a la hemodinamia materna y al bienestar fetal, siempre que se tengan en cuenta las modificaciones anestésicas y quirúrgicas adecuadas. Produce menos dolor posoperatorio disminuyendo los requerimientos de analgésicos y los eventos tromboembólicos, acorta el período de hospitalización, permite una rápida movilización e integración de la paciente a sus actividades.
La apendicitis es la afección no ginecológica más común que requiere cirugía durante el embarazo. Se estima que la apendicitis afecta a 1 en 1.500 embarazos[63]. Su diagnóstico es a veces tardío y no siempre los cirujanos usan la técnica laparoscópica. La colecistitis es la segunda indicación más común de cirugía no obstétrica en el embarazo, pero es el procedimiento laparoscópico más frecuente, pues el útero grávido no interfiere en la visión del campo operatorio[64],[65]. De hecho, la primera cirugía laparoscópica realizada en una embarazada fue una colecistectomía en 1991[66].
Un estudio multicéntrico canadiense demostró que cuando hay peritonitis apendicular, la tasa de partos prematuros es cuatro veces mayor y la de cesáreas casi se duplicó con relación a la apendicitis sola[67]. Los datos no consignan si la apendicectomía se hizo por laparotomía o laparoscopía.
Debido al aumento de la presión intraabdominal secundaria a la insuflación de gas, se recomienda presiones intraabdominales entre 8 y 12 mm Hg. La absorción de CO2 que podría traducirse en acidosis fetal, se previene con la monitorización del CO2 espirado y una adecuada ventilación, manteniendo una ETCO2 entre 30-35 mm Hg, con un período de insuflación lo más corto posible[68]. Tanto la hipercarbia como la hiperventilación excesiva pueden ser perjudiciales para el feto, por lo que el objetivo debe ser mantener la normocarbia. En pacientes sin antecedentes de patología pulmonar no es necesaria la toma de gases arteriales, pues la correlación entre ETCO2 y PaCO2 es buena, existiendo diferencias de sólo 3 a 5 mmHg, que no tienen mayor significación clínica; no ocurre acidosis respiratoria cuando la ETCO2 se mantiene en 32 mmHg durante el neumoperitoneo[69].
Se ha demostrado que el comportamiento hemodinámico de las pacientes embarazadas es similar al de la población no obstétrica; se espera una respuesta compensatoria de taquicardia e hipertensión al establecer el neumoperitoneo, la que se normaliza en los primeros 15 min luego de la insuflación. No existe compromiso del flujo úteroplacentario, siempre que el neumoperitoneo no supere los 20 mmHg[70]. Los cambios que produce el neumoperitoneo en la mujer embarazada se resumen en la Tabla 8. Algunos son acentuados por la posición de Trendelenburg y otros por la posición de Fowler.
Otras consideraciones técnicas que deben tenerse en cuenta durante la cirugía son: vaciar la vejiga con sonda vesical y descomprimir el estómago con sonda nasogástrica, incluir protección fetal con plomo durante las colangiografías, uso de medias de compresión neumática, rotación de la mesa permanentemente hacia la izquierda y colocación bajo visión directa del trócar umbilical, punción guiada por ecografía o uso de punciones alternativas según la altura uterina[72]. Los cambios graduales y limitados de posición ayudan a la fisiología materna a compensar mejor las variaciones hemodinámicas. La Sociedad Americana de Cirujanos Gastroenterológicos (SAGES) hizo una serie de recomendaciones con relación a la cirugía laparoscópica durante el embarazo que se resumen en la Tabla 9[73].
Una revisión canadiense sugiere que la incidencia de anomalías congénitas fetales es menos de 2 de 400 laparoscopias en el embarazo y es poco probable que la causa sea la laparoscopia[74]. De este modo, aunque los riesgos fetales pudieran ser discutibles, los beneficios maternos de una cirugía mínimamente invasiva son similares a los de las pacientes no embarazadas.
-
Neurocirugía
La incidencia de hemorragia intracraneal por rotura de aneurismas o malformaciones arteriovenosas es mayor en la embarazada que en la no embarazada debido a los cambios cardiovasculares hiperdinámicos y a los casos de hipertensión arterial propia del embarazo (preeclampsia)[75]. No existe una clara correlación entre embarazo y aumento de riesgo de rotura vascular, pero el aumento del débito cardíaco, del volumen sanguíneo y el reblandecimiento del tejido conectivo vascular debido a los cambios hormonales pudieran predisponer a tales eventos. Otras patologías tienen las mismas posibilidades de presentación que en la población no gestante, pero a veces necesitan resolución quirúrgica como: lesiones tumorales, derivaciones de líquido cefalorraquídeo y trauma.
Los tumores pueden volverse sintomáticos o agravarse y requerir ser intervenidos antes del término del embarazo. Los meningiomas tienen receptores de esteroides y pueden aumentar de tamaño durante el embarazo secundariamente a la retención de líquido intracelular y al aumento de la vascularización tumoral. También son necesarios en algunas oportunidades los pinzamientos de aneurismas o reparación de malformaciones arteriovenosas, que pueden resolverse por vía intravascular, menos invasiva. Se ha descrito pinzamientos de aneurismas rotos realizados con éxito, evitando la craneotomía, y con un resultado positivo para el feto realizando una adecuada protección radiológica fetal[76].
| Tabla 8. Cambios inducidos por el neumoperitoneo que determinan cambios en el manejo anestésico. Algunos se acentúan con la posición de Trendelemburg1 y otros con la posición de Fowler2 (modificado de O’Rourke N et al.)[71] | |
| Cambios respiratorios | Efecto |
| • Distensibilidad de la pared torácica | Disminuye 40% |
| • Capacidad residual funcional | Disminuye1 |
| • Presión de la vía aérea | Aumenta 40%-70%1 |
| • PaO2 | Estable |
| • CO2 entregado a los pulmones | Aumenta 30% |
| • Gradiente PaCO2-ETCO2 | Estable (3-5 mmHg) |
| Cambios cardiovasculares | Efecto |
| • Débito cardíaco | Disminuye 30%-50%1 |
| • Presión arterial | Aumenta2 |
| • Presión venosa central | Aumenta2 |
| • Resistencia vascular sistémica | Aumenta2 |
| Cambios gastrointestinales | Efecto |
| • Náuseas y vómitos posoperatorios | Aumenta 40%-60% |
| Tabla 9. Recomendaciones de la Sociedad Americana de Cirujanos Gastroenterológicos Americanos (SAGES) con relación a la cirugía laparoscópica en mujeres embarazadas. LCF: latidos cardiofetales |
| Factores importantes en la cirugía laparoscópica en la embarazada
• Realizar desviación uterina a partir del segundo trimestre • Usar tromboprofilaxis mecánica y/o farmacológica • Usar una técnica abierta para entrar al abdomen • Monitorizar capnografía materna manteniendo niveles de 32-35 mmHg • Mantener presión de neumoperitoneo baja entre 10 y 15 mmHg • Minimizar el tiempo operatorio para disminuir el riesgo de hipercarbia • Como alternativa usar sistema de tracción peritoneal sin gas (“Laparolift”) • Limitar las inclinaciones del Trendelemburg y Fowler • Hacer lentamente los cambios de posición • Monitorizar LCF y actividad uterina cuando sea posible en el pre y posoperatorio |
El manejo anestésico requiere un control hemodinámico que puede hacer necesario el uso de hipotensión arterial controlada, hipotermia, hiperventilación (PaCO2 entre 25-30 mmHg) y estimulación de la diuresis para reducir el edema cerebral, que son especialmente perjudiciales para el bienestar fetal. La hipocarbia y la alcalosis materna pueden causar sufrimiento fetal y deben abordarse mediante el manejo de los parámetros del ventilador. En términos generales se ha usado con éxito una gran variedad de enfoques anestésicos en este tipo de pacientes.
La hipotensión arterial controlada puede inducirse con anestésicos volátiles en dosis altas, nitroprusiato de sodio o nitroglicerina. Cada técnica conlleva sus propios peligros potenciales, además de la reducción del flujo sanguíneo uteroplacentario. La reducción de la presión arterial sistólica a 25%-30% de la basal o una presión arterial media de 70 mmHg generalmente conducen a una reducción del flujo sanguíneo uteroplacentario. La hipotensión arterial inducida se usa con menos frecuencia cuando se usan clips vasculares proximales a la lesión, por lo que esta técnica podría considerarse en el contexto del embarazo para evitar la necesidad de hipotensión arterial controlada. Cuando se considera necesaria, se debe utilizar monitorización de la frecuencia cardíaca fetal y limitar el período de hipotensión arterial.
Todos los fármacos utilizados en hipotensión arterial controlada atraviesan la barrera placentaria y pueden inducir hipotensión arterial en el feto[77]:
– El isoflurano y sevoflurano tienen la ventaja de ser hipnóticos e hipotensores en concentraciones clínicas, en las que reducen la actividad metabólica y potencialmente brindan precondicionamiento. Su manejo, sin embargo, es más difícil, pues las variaciones de presión arterial son más lentas que con el uso de fármacos endovenosos. Se usan solos o combinados con agentes coadyuvantes para limitar la taquicardia y la hipertensión arterial de rebote.
– El nitroprusiato de sodio se metaboliza en cianuro y tiocianato y su acumulación en el feto produce toxicidad y muerte fetal en pacientes tratadas durante períodos largos. Si es necesario usarlo debe hacerse por cortos períodos y suspenderse si la velocidad de infusión debe llegar a 0,5 mg/kg/ hora, si se produce acidosis metabólica materna o se produce un efecto de taquifilaxis al agente.
– La nitroglicerina no se ha asociado a efectos deletéreos fetales y puede usarse juntamente con nitroprusiato para disminuir sus requerimientos. Se metaboliza a nitritos, que en forma experimental han producido metahemoglobinemia.
La hipotermia moderada puede usarse ocasionalmente en este tipo de cirugías para disminuir los requerimientos metabólicos del cerebro y reducir el flujo sanguíneo cerebral. El objetivo es una temperatura de 30 °C, lo que modifica también la temperatura fetal y ocasiona bradicardia, que se recupera con el recalentamiento[78].
La hiperventilación es una técnica usada habitualmente en neuroanestesia para reducir el flujo sanguíneo cerebral. Durante el embarazo, el aumento fisiológico de la ventilación reduce la PaCO2 a cifras de 30 a 32 mmHg. Los efectos clínicos de estas cifras normales en la embarazada sobre el flujo sanguíneo uteroplacentario son discutibles, pero una hiperventilación extrema, menor de 25 mmHg, puede causar vasoconstricción de las arterias uterinas y un desplazamiento hacia la izquierda de la curva de disociación de la hemoglobina materna; de hecho, se ha demostrado que la hiperventilación profiláctica en pacientes neuroquirúrgicas a niveles menores de 25 mmHg tiene un impacto negativo en el resultado final[79], pero los potenciales efectos adversos sobre el feto de la disminución de la transferencia de oxígeno hacia la placenta y la vasoconstricción de los vasos umbilicales, no deberían ser un problema para un feto sano, en que se ha hecho a la madre una hiperventilación moderada de entre 25 y 30 mmHg. La monitorización de los LCF puede ayudar al ajuste de la ventilación materna para no alcanzar niveles que puedan causar problemas en la condición fetal.
La reducción del edema cerebral suele manejarse con agentes osmóticos o diuréticos que actúan a nivel del asa de Henle, tanto en el intra como en el postoperatorio, que pueden producir trastornos en el medio fetal. El manitol administrado a la madre se acumula lentamente en el feto ocasionando hiperosmolaridad que se traducen en una serie de alteraciones fisiológicas, como: reducción de la producción de líquido pulmonar fetal, disminución del flujo sanguíneo renal y aumento de la concentración plasmática fetal de sodio[80]. Aunque en modelos animales se produce cierto grado de deshidratación fetal, en diferentes reportes en mujeres embarazadas en que se ha usado manitol en dosis entre 0,25-0,5 g·kg-1 en caso necesario, la administración ha sido segura y sin efectos adversos para el feto[81]. Los diuréticos que actúan a nivel del asa, como la furosemida, son una alternativa, pero también deben usarse con precaución y solo en caso necesario. Una diuresis agresiva puede reducir la perfusión uterina si el gasto cardíaco materno se ve afectado. Varios autores han informado resultados fetales exitosos después de neurocirugía en pacientes embarazadas con el uso de medidas sencillas como
la lidocaína y bajas dosis de manitol para controlar la presión intracraneal, acompañada, cuando sea posible, de monitoreo ecocardiográfico fetal[82].
-
Cardiocirugía
La prevalencia de enfermedades cardiacas durante el embarazo es de 1%-4%. Se ha reportado cirugía exitosa para la madre y el feto de valvulopatías, bypass coronarios, mixomas auriculares y disección aórtica. Las indicaciones más frecuentes de cirugía durante la gestación son la estenosis mitral reumática, estenosis aórtica congénita, disfunción de prótesis biológica, trombosis de válvula mecánica (a pesar de una anticoagulación adecuada) y la endocarditis.
El aumento fisiológico de 30% a 50% del volumen sanguíneo y el gasto cardíaco es máximo a las 28-30 semanas, constituyendo un momento común para la descompensación cardíaca en embarazadas con lesiones valvulares estenóticas o hipertensión pulmonar; estos valores se mantienen hasta el parto, cuando se pueden observar alteraciones aún mayores. Las valvulopatías mitrales y aórticas obstructivas graves durante el embarazo debe tratarse preferiblemente en forma percutánea con balón, en lugar de una intervención quirúrgica abierta, pues esta técnica no invasiva se asocia con una reducción significativa de la mortalidad fetal y neonatal[83]. Otro período de alto riesgo ocurre inmediatamente después del parto, en que la liberación de la compresión aorto-cava y la autotransfusión de la sangre uteroplacentaria aumentan el gasto cardíaco al máximo.
En pacientes cercanas al término del embarazo, la cesárea combinada con el reemplazo valvular se ha realizado con éxito. No se debe postergar la cirugía, si está indicada por razones maternas. En este contexto, la mortalidad materna no es diferente a la de la mujer no embarazada, estando relacionada con la gravedad de la patología cardíaca y no con el embarazo propiamente tal[84]. El problema es la mortalidad fetal, pero ha ido disminuyendo con el avance de la tecnología. El uso de monitorización fetal, normotermia y normocarbia, puede disminuir la tasa de mortalidad fetal. Una serie reporta que la mortalidad fetal con hipotermia es de 4% y con bypass cardiopulmonar normotérmico es de 0%[85]. Cambios en la PCO2 también pueden afectar el flujo sanguíneo uteroplacentario; específicamente, la hipocapnia causa vasoconstricción uteroplacentaria y la hipercapnia aumenta el flujo sanguíneo uteroplacentario, pero se asocia con acidosis fetal y función cardíaca reducida.
La circulación extracorpórea produce deterioro en muchos niveles: alteraciones de la coagulación con activación del complemento, liberación de mediadores vasoactivos (renina y catecolaminas), embolia gaseosa y de partículas, hipotermia, hipotensión arterial por flujo inadecuado de la bomba y flujo no pulsátil. Las presiones y flujos óptimos durante el bypass son desconocidos, pero los estudios en animales indican que los flujos y las presiones más altas pueden ser beneficiosos durante el embarazo para mantener el flujo sanguíneo uterino y la oxigenación fetal. Ocurre comúnmente bradicardia fetal al inicio del bypass, regresando luego lentamente a niveles normales bajos, con poca variabilidad latido a latido. Se recomienda un flujo de bomba > 2,5 litros min-1 m-2, una presión de perfusión > 70 mmHg y normotermia durante la circulación extracorpórea para mantener un flujo uteroplacentario aceptable[86].
La clasificación del estado funcional según la escala de la New York Heart Association (NYHA) para evaluar la insuficiencia cardíaca, a pesar de sus limitaciones, puede ser usada como parámetro para predecir como evolucionará la paciente durante el embarazo[87]. A medida que las demandas cardiovasculares aumentan durante la gestación, la clase funcional puede deteriorarse: 44% de las embarazadas con enfermedad cardiaca desarrollan edema pulmonar o progresan a una clase funcional IV durante el tercer trimestre del embarazo. Se considera que las mujeres que se encuentran en clase funcional I y II no tendrán mayor dificultad durante el embarazo en tanto aquellas en clase funcional III están en riego de presentar mayores complicaciones.
Parece ser que el resultado fetal puede optimizarse antes de que la paciente llegue a la clase IV de la escala de la NYHA mediante el uso de circulación extracorpórea normotérmica, de alto flujo y alta presión. Se debe mantener a la paciente en hiperoxia y con un nivel de hematocrito mayor de 25%[88]. Mejor aún, un hematocrito > 28% optimiza la capacidad de transporte de oxígeno y es beneficioso para el feto[89].
-
Cirugía intrauterina y EXIT (Ex utero Intrapartum Treatment)
El procedimiento de EXIT (Ex utero intrapartum treatment) fue inicialmente desarrollado para revertir la oclusión traqueal temporal que se realizaba antenatalmente en pacientes con diagnóstico de hernia diafragmática congénita grave. Actualmente, esta operación está indicada en lesiones fetales que causen potencialmente obstrucción de vía aérea inmediatamente posparto. Al mantener la circulación uteroplacentaria, la vía aérea fetal puede ser evaluada y asegurada previo al parto, mediante intubación, broncoscopía o traqueotomía.
Entre la variedad de situaciones en las cuales este procedimiento está indicado, se incluye: todo tipo de malformaciones obstructivas de la vía aérea fetal, tanto extrínsecas (teratoma y linfangioma) como intrínsecas (atresia laríngea y obstrucción congénita de vía aérea alta) y, más recientemente, lesiones intratorácicas como hidrotórax congénito y derrame pleural. Las indicaciones más frecuentes corresponden a la obstrucción de la vía aérea fetal habitualmente causada por un tumor cervical diagnosticado prenatalmente.
-
Procedimiento
El manejo anestésico debe tener los siguientes objetivos: a) alcanzar un estado de hipotonía uterina con el fin de mantener la circulación úteroplacentaria; b) preservar el volumen uterino para prevenir el desprendimiento placentario; c) mantener la presión arterial materna en rangos normales y d) alcanzar un nivel de anestesia fetal sin depresión cardíaca.
Este procedimiento requiere de un equipo de trabajo sincronizado constituido por múltiples especialidades: anestesiología, neonatología, otorrinolaringología infantil, cirugía infantil y obstetricia.
La evaluación preoperatoria debe incluir a la madre y el feto. Con respecto a la evaluación fetal, el diagnóstico prenatal es fundamental para una adecuada programación del parto en aquellos fetos con malformaciones que potencialmente comprometen la vía aérea y que pueden ser manejados mediante EXIT. Entre los procedimientos diagnósticos se encuentra la ecografía y la resonancia nuclear magnética fetal. En cuanto al diagnóstico ecográfico es importante precisar, además de las características anatómicas fetales (asociación con otras malformaciones), evaluación de líquido amniótico, ubicación placentaria y estimación de peso fetal. El uso de la resonancia nuclear magnética fetal aporta valiosa información sobre la malformación en estudio, como, por ejemplo características, ubicación, vascularización y volumen tumoral y compromiso de otras estructuras. Es importante considerar como en cualquier interrupción, la edad gestacional y la eventual necesidad de corticoides para maduración pulmonar. Dentro de la evaluación materna, se deben considerar factores de riesgo de inercia uterina (polihidroamnios, uso de tocolíticos, etc.). Es importante la clasificación sanguínea ABO-Rh y la reserva de unidades de glóbulos rojos previo al procedimiento.
El intraoperatorio incluye fundamentalmente 3 aspectos: la anestesia materna y fetal, la técnica quirúrgica y el manejo de la vía aérea fetal, todos a cargo de los diferentes equipos de especialistas.
-
Anestesia materna y fetal
Antes de iniciar la anestesia, se puede instalar un catéter epidural para ser usado en la última parte de la cirugía y como analgesia posoperatoria.
La técnica anestésica a utilizar puede incluir tanto a la madre como al feto. Este último requiere de analgesia para el procedimiento EXIT, ya que sus vías nociceptivas están desarrolladas desde las 20 semanas. Por otra parte, la anestesia puede proporcionar las condiciones uterinas óptimas para el procedimiento, ya que los gases halogenados son los más potentes tocolíticos existentes. La técnica en breve incluye: anestesia general sobre la base de un gas halogenado en dosis sobre 1 CAM y uso de opiáceos sistémicos maternos, idealmente de alta potencia y corta duración, como es el caso del remifentanil. Esta droga atraviesa la placenta en aproximadamente 70%-80% del nivel plasmático materno[90], lográndose analgesia fetal efectiva, cuyo efecto desaparece a los pocos minutos del nacimiento (o pinzamiento del cordón umbilical). Como droga de refuerzo para la tocólisis se utiliza nitroglicerina en infusión continua. Esta técnica tiene el riesgo de hipotensión arterial materna, por lo que es necesario el uso de alguna droga vasoactiva para su prevención y eventual tratamiento. Es recomendable la monitorización de presión arterial invasiva, uso de capnografía con analizador de gases espirados, oximetría de pulso, electrocardioscopía continua y medición de temperatura central.
En relación a la técnica quirúrgica, la decisión de entrar al abdomen a través de una incisión transversa o media se basa en la localización de la placenta, el sitio predispuesto de la histerotomía y la indicación para la realización de EXIT. La incisión de elección más frecuentemente es la transversa baja, excepto en aquellos casos en los cuales la ubicación placentaria anterior baja requiera una aproximación por el fondo uterino o la pared posterior. En este caso, se procederá a realizar una laparotomía media infraumbilical. En algunos centros la determinación de la ubicación placentaria se realiza mediante ultrasonido intraoperatorio, previo a realizar la histerotomía.
En los casos de polihidramnios grave la extracción de líquido debe ser la suficiente para permitir una adecuada manipulación fetal, pero no excesiva como para producir un desprendimiento de placenta.
Luego de la histerotomía, se extrae la cabeza, hombros y extremidad superior derecha fetal, dejando el resto de cuerpo y cordón umbilical dentro del útero para mantener temperatura, evitar vasoconstricción de vasos umbilicales y mantener constante el volumen uterino. Se puede administrar atropina 20 ug/kg y fentanilo 10 ug/kg intramuscular en extremidad superior de feto.
La hemodinamia fetal se monitoriza a través de oximetría de pulso ubicada en la mano fetal (midiendo frecuencia cardíaca fetal y PaO2 con un oxímetro estéril). En aquellos casos en que se anticipe un procedimiento quirúrgico extenso, debe instalarse una vía venosa en la extremidad superior del feto para la administración de fluidos, sangre o medicamentos.
La intubación orotraqueal del feto se realiza en primera instancia mediante laringoscopía directa; si no es posible, se procede a broncoscopía rígida. Cuando la intubación endotraqueal es imposible debido a una distorsión de la vía aérea se realiza una vía aérea quirúrgica. Una vez que la vía aérea está esta blecida y asegurada, el feto es ventilado con presión positiva, confirmando ventilación exitosa por auscultación, movimientos torácicos y eventual capnografía. Se extrae el feto y se secciona el cordón umbilical. Posterior a la extracción del recién nacido, se suspende la infusión de nitroglicerina, para iniciar la administración de uterotónicos (oxitocina o carbetocin y metilergonovina). Se procede al alumbramiento, revisión instrumental e histerorrafia con técnica habitual, constatando la adecuada retracción uterina. En este momento se puede activar el catéter epidural instalado al inicio del proceso.
El EXIT es un procedimiento no exento de complicaciones que requiere el manejo coordinado entre los diferentes especialistas. No constituye un procedimiento de rutina, sin embargo, la amplia gama de indicaciones actuales y el perfeccionamiento de las técnicas de diagnóstico antenatal que permiten detectarlas, hacen que su utilización sea cada vez más frecuente.
Referencias
1. Stewart MK, Terhune KP, Managment of pregnant patients undergoing general surgical procedures. Surg Cim North Am 2015; 95: 429-42. https://doi.org/10.1016/j.suc.2014.10.007
2. Manley S, de Kelaita G. Preoperative pregnancy testing in ambulatory surgery. Incidence and impact of positive results. Anesthesiology 1995; 83: 690-3. https://doi.org/10.1097/00000542-199510000-00007
3. Ravindra GL, Madamangalam AS, Seetharamaiah S. Anaesthesia for non-obstetric surgery in obstetric patients. Indian J Anaesth. 2018; 62: 710-6. https://doi.org/10.4103/ija.IJA_463_18
4. ACOG Commitee Opinion. Nonobstetric Surgery in Pregnancy. 2003; 102: 431. https://doi.org/10.1016/S0029-7844(03)00750-6
5. Mazze RI, Källén B. Reproductive outcome after anesthesia and operation during pregnancy: a registry study of 5405 cases. Am J Obstet Gynecol 1989; 161: 1178-85. https://doi.org/10.1016/0002-9378(89)90659-5
6. van De Velde M, De Buck F. Anesthesia for non-obstetric surgery in the pregnant patient. Minerva Anestesiol 2007; 73: 235-40.
7. Rocke DA, Murray WB, Rout CC, Gouws E. Relative risk analysis of factors associated with difficult intubation in obstetric anesthesia. Anesthesiology 1992; 77: 67-73. https://doi.org/10.1097/00000542-199207000-00010
8. Pilkington S, Carli F, Dakin MJ et al. Increase in Mallampati score during pregnancy. Br J Anaesth 1995; 74: 638-42. https://doi.org/10.1093/bja/74.6.638
9. Hawkins JL, Chang J, Palmer SK et al. Anesthesia-related maternal mortality in the United States: 1979-2002. Obstet Gynecol 2011; 117: 69-74. https://doi.org/10.1097/AOG.0b013e31820093a9
10. Cheek TG, Baird E. Anesthesia for nonobstetric surgery: maternal and fetal considerations. Clin Obstet Gynecol 2009; 52: 535-45. https://doi.org/10.1097/GRF.0b013e3181c11f60
11. Kinsella SM, Lohmann G. Supine hypotensive syndrome. Obstet Gynecol 1994; 83: 774-88.
12. Higuchi H, Takagi S, Zhang K et al. Effect of Lateral Tilt Angle on the Volume of the Abdominal Aorta and Inferior Vena Cava in Pregnant and Nonpregnant Women Determined by Magnetic Resonance Imaging. 2015; 122:286-93. https://doi.org/10.1097/ALN.0000000000000553
13. Lee AJ, Landau R, Mattingly J et al. Left lateral table tilt for elective cesarean delivery under spinal anesthesia has no effect on neonatal acid-base status: A randomized controlled trial. Anesthesiology 2017; 127: 241-9. https://doi.org/10.1097/ALN.0000000000001737
14. Cardiac arrest associated with pregnancy. Circulation. 2005 Dec 1; 112 (24 SUPPL.): IV-150-IV-153. https://doi.org/10.1161/CIRCULATIONAHA.105.166570
15. Broussard CN, Richter JE. Nausea and vomiting of pregnancy. Gastroenterol Clin North Am 1998; 27: 123-51. https://doi.org/10.1016/S0889-8553(05)70350-2
16. McDonnell MJ, Peach NJ, Clavis OM. Difficult and failed intubation in obstetric anaesthesia: an observational study of airway management and complications associated with general anaesthesia for caesarean section. Int J Obstet Anaesth 2008; 17: 292-7. https://doi.org/10.1016/j.ijoa.2008.01.017
17. Paranjothy S, Griffiths JD, Broughton HK et al. Interventions at caesarean section for reducing the risk of aspiration pneumonitis, Cochrane Database Syst Rev 2010; 1: CD004943. https://doi.org/10.1002/14651858.CD004943.pub3
18. Yin T, Chan MT. Decreased minimal alveolar concentration of isoflurane in pregnant humans. Anestesiology 1994; 81: 829-32. https://doi.org/10.1097/00000542-199410000-00009
19. Ueyama H, Hagihira S, Takashina M et al. Pregnancy does not enhance volatile anesthetic sensitivity on the Brain: An electroencephalographic analysis study. Anesthesiology. 2010; 113: 577-84. https://doi.org/10.1097/ALN.0b013e3181e4f508
20. Hirabayashi Y, Shumizu R, Saitoh K et al. Spread of subarachnoid hyperbaric amethocaine in pregnant women. Br J Anaesth 1995; 74: 384-6. https://doi.org/10.1093/bja/74.4.384
21. Butterworth JF IV, Walker FO, Lizak SZ. Pregnancy increases median nerve susceptibility of lidocaine. Anesthesiology 1990; 72: 962-5. https://doi.org/10.1097/00000542-199006000-00002
22. Mhuireachtaigh RN, O’Gorman DA. Anesthesia in pregnant patients for nonobstetric surgery. J Clin Anesth 2006: 18: 60-6. https://doi.org/10.1016/j.jclinane.2004.11.009
23. Leighton BL, Cheek TG, Gross JB. Succinylcholine pharmacodynamics in peripartum patients. Anesthesiology 1986; 64: 202-5. https://doi.org/10.1097/00000542-198602000-00012
24. Pan P, Moore C. Comparison of cisatracurium-induced neuromuscular blockade between immediate postpartum and nonpregnant patients. J Clin Anesth 2001; 13: 112-7. https://doi.org/10.1016/S0952-8180(01)00226-4
25. Tuchmann-Duplessis H. The teratogenic risk. Am J Ind Med 1983; 4: 245-58. https://doi.org/10.1002/ajim.4700040119
26. Reedy MB, Källén B, Kuehl TJ. Laparoscopy during pregnancy: a study of five fetal outcome parameters with use of the Swedish Health Registry. Am J Obstet Gynecol 1997; 177: 673-9. https://doi.org/10.1016/S0002-9378(97)70163-7
27. Socha García NI, Gómez Morant JC, Holguín González R. Cirugía no obstétrica durante el embarazo. Rev Col Anest 2011; 39: 360-73. https://doi.org/10.5554/rca.v39i3.51
28. Lo WY, Friedman JM. Teratogenicity of recently introduced medications in human pregnancy. Obstet Gynecol 2002; 100: 465-73. https://doi.org/10.1016/S0029-7844(02)02122-1
29. Dean, John. Catalog of Teratogenic Agents: 10th edition. Thomas H Shepard. Baltimore. Journal of Medical Genetics – J Med Genet 2002; 39: 454-454. https://doi.org/10.1136/jmg.39.6.454
30. Jones HE, Balster RL. Inhalant abuse in pregnancy. Obstet Gynecol Clin North Am 1998; 25: 153-67. https://doi.org/10.1016/S0889-8545(05)70363-6
31. Visser BC, Glasgow RE, Mulvihill KK, Mulvihill SJ. Safety and timing of nonobstetric abdominal surgery in pregnancy. Dig Surg 2001; 18: 409-17. https://doi.org/10.1159/000050183
32. McElhatton PR. The effects of benzodiazepine use during pregnancy and lactation. Reprod Toxicol 1994; 8: 461-75. https://doi.org/10.1016/0890-6238(94)90029-9
33. Reitman E, Flood P. Anaesthetic considerations for non-obstetric surgery during pregnancy. Br J Anaesth 2011;107(Supl 1): i72-8. https://doi.org/10.1093/bja/aer343
34. Russell R. Failed intubation in obstetrics: a self-fulfilling prophecy. Int J Obstet Anesth. 2006; 16: 1-3. https://doi.org/10.1016/j.ijoa.2006.10.002
35. ACOG committee opinion on Obstetric Practice. Nonobstetric surgery in pregnancy. Number 474. Obstet Gynecol. 2011; 117(2 Pt): 420-1. https://doi.org/10.1097/AOG.0b013e31820eede9
36. Kuczkowski KM. Nonobstetric surgery during pregnancy: what are the risks of anesthesia? Obstet Gynecol Surv 2004; 59: 52-6. https://doi.org/10.1097/01.OGX.0000103191.73078.5F
37. Han TH, Brimacombe J, Lee EJ, Yang HS. The laryngeal mask airway is effective (and probably safe) in selected healthy parturients for elective Cesarean section: a prospective study of 1067 cases. Can J Anaesth 2001; 48: 1117-21. https://doi.org/10.1007/BF03020379
38. Craft Jr JB, Coaldrake LA, Yonekura ML et al. Ketamine, catecholamines, and uterine tone in pregnant ewes. Am J Obstet Gynecol 1983; 146; 429-34. https://doi.org/10.1016/0002-9378(83)90823-2
39. Ansari J, Carvalho B, Shafer SL, Flood P. Pharmacokinetics and Pharmacodynamics of Drugs Commonly Used in Pregnancy and Parturition. Anesth Analg 2016 ;122: 786-804. https://doi.org/10.1213/ANE.0000000000001143
40. Varela N, Lobato F. Sugammadex and pregnancy, is it safe? J Clin Anesth. 2015; 27: 183-4. https://doi.org/10.1016/j.jclinane.2014.11.015
41. Levison G. Anesthesia for surgery during pregnancy. En Schneider & Levinson. Anesthesia for obstetrics. Baltimore. William y Wilkins, 249-66.
42. Oats JN, Vasey DP, Waldron BA. Effects of ketamine on the pregnant uterus. Br J Anaesth 1979; 51: 1163-6. https://doi.org/10.1093/bja/51.12.1163
43. Walton NKD, Melachuri VK. Anesthesia for non-obstetric surgery during pregnancy. Continuing Education in Anaesthesia, Critical Care & Pain. 2006; 6: 83-5. https://doi.org/10.1093/bjaceaccp/mkl008
44. Geber WF, Schramm LC. Congenital malformations of the central nervous system produced by narcotic analgesics in the hamster. Am J Obstet Gynecol 1975; 123: 705-13. https://doi.org/10.1016/0002-9378(75)90492-5
45. Zagon IS, McLaughlin PJ. Effects of chronic morphine administration on pregnant rats and their offspring. Pharmacology 1977; 15: 302-10. https://doi.org/10.1159/000136703
46. Fujinaga M, Stevenson JB, Mazze RJ. Reproductive and teratogenic effects of fentanyl in Sprague-Dawley rats. Teratology 1986; 34:51-7. https://doi.org/10.1002/tera.1420340107
47. Ostensen M, Ramsey-Goldman R. Treatment of inflammatory rheumatic disorders in pregnancy: what are the safest treatment options? Drug Safety 1998; 19: 389-410. https://doi.org/10.2165/00002018-199819050-00006
48. Niebyl JR, Witter FR. Neonatal outcome after indomethacin treatment for preterm labor. Am J Obstet Gynecol 1986; 155: 747-9. https://doi.org/10.1016/S0002-9378(86)80012-6
49. Upadya M, Saneesh PJ. Anaesthesia for non-obstetric surgery during pregnancy. Indian J Anaesth 2016; 60: 234-41. https://doi.org/10.4103/0019-5049.179445
50. Toglia MR, Weg JG. Venous thromboembolism during pregnancy. N Engl J Med 1996; 335: 108-14. https://doi.org/10.1056/NEJM199607113350207
51. Kolettis D, MD, Craigo S. Thromboprophylaxis in Pregnancy. Obstet Gynecol Clin N Am 2018; 45: 389-402. https://doi.org/10.1016/j.ogc.2018.01.007
52. Marik PE, Plante LA. Venous thromboembolic disease and pregnancy. N Engl J Med. 2008; 359: 2025-33. https://doi.org/10.1056/NEJMra0707993
53. The American Congress of Obstetricians and Gynecologists (ACOG) Committee on Practice Bulletins-Obstetrics. Practice bulletin no. 123: thromboembolism in pregnancy. Obstet Gynecol 2011; 118: 718-29. https://doi.org/10.1097/AOG.0b013e3182310c4c
54. Thrombosis and embolism during pregnancy and the puerperium, reducing the risk. Green-top guideline no. 37a. London: The Royal College of Obstetricians and Gynaecologists (RCOG); 2015.
55. Thromboprophylaxis during pregnancy, labour and after vaginal delivery. Guideline no. 37a. London: Royal College of Obstetricians and Gynaecologists, 2004. En: https://www.rcog.org.uk/globalassets/documents/guidelines/gtg-37a.pdf
56. Hill CC, Pickinpaugh J. Trauma and surgical emergencies in the obstetric patient. Surg Clin North Am. 2008; 88: 421-40. https://doi.org/10.1016/j.suc.2007.12.006
57. ACOG Committee on Obstetric Practice. Guidelines for diagnostic imaging during pregnancy. Obstet Gynecol 2004; 104: 647-51. https://doi.org/10.1097/00006250-200409000-00053
58. Coleman MT, Trianfo VA, Rund DA. Non-obstetric emergencies in pregnancy: Trauma and surgical conditions. Am J Obstet Gynecol 1997; 177: 497-502. https://doi.org/10.1016/S0002-9378(97)70135-2
59. Jeejeebhoy FM, Zelop CM, Lipman S et al. Cardiac arrest in pregnancy: A scientific statement from the American Heart Association. Circulation. 2015; 132: 1747-3. https://doi.org/10.1161/CIR.0000000000000300
60. Florina R. Anesthesia for nonobstetric surgery in the pregnant patient. Datta S (ed). Textbook of Obstetric Anesthesia. Philadelphia 2000. Churchill Livingtone, 289-298.
61. Cruz AM, Southerland LC, Duke T et al. Intraabdominal carbon dioxide insufflation in the pregnant ewe. Uterine blood flow, intraamniotic pressure, and cardiopulmonary effects. Anesthesiology 1996; 85: 1395-402. https://doi.org/10.1097/00000542-199612000-00021
62. Reedy MB, Galan HL, Bean-Lijewski JD et al. Maternal and fetal effects of laparoscopic insufflation in the gravid baboon. J Am Assoc Gynecol Laparosc 1995; 2: 399-406. https://doi.org/10.1016/S1074-3804(05)80060-X
63. Kilpatrick CC, Monga M. Approach to the acute abdomen in pregnancy. Obstet Gynecol Clin North Am. 2007; 34: 389-402. https://doi.org/10.1016/j.ogc.2007.06.002
64. Andreoli M, Servakov M, Meyers P. Laparoscopic surgery during pregnancy. J Am Assoc Gynecol Laparosc 1999; 6: 229-33. https://doi.org/10.1016/S1074-3804(99)80110-8
65. Cosenza CA, Saffari B, Jabbour N et al. Surgical management of biliary gallstone disease during pregnancy. Am J Surg 1999; 178: 545-8. https://doi.org/10.1016/S0002-9610(99)00217-2
66. Chohan L, Kilpatrick CC. Laparoscopy in Pregnancy A Literature Review. Clin Obstet Gynecol 2009; 52: 557-69. https://doi.org/10.1097/GRF.0b013e3181bea92e
67. Abbasi N, Patenaude V, Abenhaim HA. Evaluation of obstetrical and fetal outcomes in pregnancies complicated by acute appendicitis. Arch Gynecol Obstet. 2014; 290: 661-7. https://doi.org/10.1007/s00404-014-3276-7
68. Bhavani-Shankar K, Steinbrook RA, Mushlin PS, Freiberger D. Transcutanous PCO2 Monitorig during laparoscopic cholecistectomy in pregnancy. Can J Anaesth 1998: 45: 164-9. https://doi.org/10.1007/BF03013257
69. Bhavani-Shankar K, Steinbrook RA. Arterial to end- tidal carbon dioxide pressure difference during lap- aroscopic surgery in pregnancy. Anesthesiology 2000; 93: 370-3. https://doi.org/10.1097/00000542-200008000-00014
70. Steinbrook RA, Bhavani-Shankar K. Hemodynamics during laparoscopic surgery in pregnancy. Anesth Analg. 2001; 93: 1570-1. https://doi.org/10.1097/00000539-200112000-00051
71. O’Rourke N, Kodali BS. Laparoscopic surgery during pregnancy. Curr Opin Anaesthesiol 2006;19: 254-9. https://doi.org/10.1097/01.aco.0000192817.30612.b3
72. Fatum M, Rojansky N. Laparoscopy surgery during pregnancy. Obstet Gynecol Surv 2001; 56: 50-9. https://doi.org/10.1097/00006254-200101000-00025
73. Guidelines for laparoscopic surgery during pregnancy. Society of American Gastrointestinal Endoscopic Surgeons (SAGES). Surg Endosc 1998; 12: 189-90. https://doi.org/10.1007/s004649900629
74. Bisharah M, Tulandi T. Laparoscopic Surgery in Pregnancy. Clin Obstet Gynecol. 2003; 46: 92-97. Volume 46, Number 1, 92-97. https://doi.org/10.1097/00003081-200303000-00012
75. Bateman BT, Schumacher HC, Bushnell CD et al. Intracerebral hemorrhage in pregnancy: Frequency, risk factors, and outcome. Neurology 2006; 67: 424-9. https://doi.org/10.1212/01.wnl.0000228277.84760.a2
76. Piotin M, de Souza Filho CB, Kothimbakam R, Moret J. Endovascular treatment of acutely ruptured intracranial aneurysms in pregnancy. Am J Obstet Gynecol. 2001;185:1261-2. https://doi.org/10.1067/mob.2001.115861
77. Nuevo FR. Anesthesia for nonobstetric surgery in the pregnant patient. In: Birnbach D, Gatt SP, Datta S, eds. Textbook of Obstetric Anesthesia. New York: Churchill Livingstone, 2000; 289 – 98
78. Aboud E, Neales K. The effect of maternal hypothermia on the fetal heart rate. Int J Gynaecol Obstet 1999; 66: 163-4. https://doi.org/10.1016/S0020-7292(99)00058-2
79. Newell DW, Weber JP, Watson R et al. Effect of transient moderate hyperventilation on dynamic cerebral autoregulation after severe head injury. Neurosurgery 1996; 39: 35-44. https://doi.org/10.1097/00006123-199607000-00008
80. Lumbers ER, Stevens AD. Changes in fetal renal function in response to infusions of hyperosmotic solutions of mannitol to the ewe. J Physiol 1983; 343: 439-6. https://doi.org/10.1113/jphysiol.1983.sp014902
81. Bharti N, Kashyap L, Mohan VK. Anesthetic management of a parturient with cerebellopontine-angle meningioma. Int J Obstet Anesth 2002; 11: 219-21. https://doi.org/10.1054/ijoa.2001.0941
82. Giannini A, Bricchi M. Posterior fossa surgery in the sitting position in a pregnant patient with cerebellopontine angle meningioma. Br J Anaesth 1999; 82: 941-4. https://doi.org/10.1093/bja/82.6.941
83. de Souza JA, Martinez EE Jr, Ambrose J, et al. Percutaneous balloon mitral valvuloplasty in comparison with open mitral valve commissurotomy for mitral stenosis during pregnancy. J Am Coll Cardiol 2001; 37: 900-3. https://doi.org/10.1016/S0735-1097(00)01184-0
84. Khandelwal M, Rasanen J, Ludormirski A et al. Evaluation of fetal and uterine hemodynamics during maternal cardiopulmonary by pass. Obstet Gynecol 1996; 88:6 67-71. https://doi.org/10.1016/0029-7844(96)00129-9
85. Pomini F, Mercogliano D, Cavalletti C et al. Cardio-pulmonary bypass in pregnancy. Ann Thorac Surg 1996; 61: 259-68. https://doi.org/10.1016/0003-4975(95)00818-7
86. Iscan ZH, Mavioglu L, Vural KM et al. Cardiac surgery during pregnancy. J Heart Valve Dis 2006; 15: 686-90.
87. Rostagno C, Galanti G, Comeglio M et al. Comparison of different methods of functional evaluation in patients with chronic heart failure. Eur J Heart Fail. 2000; 2: 273-80. https://doi.org/10.1016/S1388-9842(00)00091-X
88. Parry AJ, Westaby S. Cardiopulmonary bypass during pregnancy. Ann Thorac Surg 1996; 61: 1865-9. https://doi.org/10.1016/0003-4975(96)00150-6
89. Iscan ZH, Mavioglu L, Vural KM et al. Cardiac surgery during pregnancy. J Heart Valve Dis. 2006; 15: 686-90.
90. Ngan Kee WD, Khaw KS, Ma KC et al. Maternal and neonatal effects of remifentanil at induction of general anesthesia for cesarean delivery: a randomized, double-blind, controlled trial. Anesthesiology 2006; 104: 14-20. https://doi.org/10.1097/00000542-200601000-00004

 ORCID
ORCID