Jesús Hernán Tovar Cardozo MD. 1 ,3,*, Jorman Harvey Tejada Perdomo MD. 2 ,3.4 , Giovani Lastra González MD. 3 ,5 , Valentina Gutiérrez Perdomo 6
Recibido: 24-02-2022
Aceptado: 02-05-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 5 pp. 593-597|https://doi.org/10.25237/revchilanestv5106071058
PDF|ePub|RIS
Difficult airway If algorithm doesn’t work?
Abstract
Subglottic stenosis is a congenital and/or acquired pathology, which can be secondary to prolonged endotracheal intubation and tracheotomy. It is associated with hypoperfusion of the epithelium related to the cuff pressure of the endotracheal tube and/ or the tracheostomy cannula. Grade III-IV stenosis represents urgent and/or emergent airways, which must be managed by expert anesthesiologists who are extensively trained in techniques and algorithms. We report a case of a woman with multiple pre- dictors of difficult airway, obesity and mechanical ventilation due to tracheotomy; with subsequent grade III subglottic stenosis managed with tracheal dilation; who presented a new symptomatic episode, a non-dilatable stenosis of 2 mm and an indication for emergency tracheal reconstruction.
Resumen
Las estenosis subglótica es una patología congénita y/o adquirida, que puede ser secundaria a intubación endotraqueal prolongada y necesidad de traqueostomía. Está asociada a una hipoperfusión del epitelio relacionado con la presión de cuff del tubo endotraqueal y/o de la cánula de traqueostomía. Las estenosis grado III-IV, representan vías aéreas urgentes y/o emergentes, que deben manejarse por anestesiólogos expertos y ampliamente entrenados en las técnicas y los algoritmos. Reportamos el caso de una mujer con múltiples predictores de vía aérea difícil, antecedente obesidad y de ventilación mecánica por traqueotomía; con posterior estenosis subglótica grado III manejada con dilatación traqueal; que presenta nuevo episodio sintomático, una estenosis no dilatable de 2 mm e indicación de reconstrucción traqueal de emergencia.
-
Introducción
La estenosis subglótica y la traqueal son una complicación frecuente de la intubación prolongada y las traqueosto- mías, comúnmente asociada a la obesidad, la posición del neumotaponador del tubo endotraqueal y/o la cánula de tra- queostomía; y la presión del cuff. Se ha convertido en una patología frecuente con el advenimiento de las técnicas de traqueos- tomía, y la intubación prolongada, debido a requerimiento de ventilación mecánica; y cuya incidencia que se ha elevado en los últimos 2 años como consecuencia directa de la pandemia por SARS-CoV-2. El manejo está determinado según el porcentaje de compromiso del lumen: conservador (< 50%), endoscópico y/o quirúrgico (> 50%)[1]-[5]; con un abordaje anestésico y de manejo de la vía aérea que ponen a prueba el conocimiento y las destrezas de los anestesiólogos más expertos; convirtiendo el entrenamiento en simulación y la revisión académica de los casos; en parte esencial de la formación más allá del posgrado.
El caso que se presenta a continuación, con intención académica y científica, desde un ángulo retrospectivo, en una paciente cuyo contexto clínico se aleja de los algoritmos; realizando hincapié en el paso a paso, los principales problemas en el manejo y las posibles opciones sugeridas.
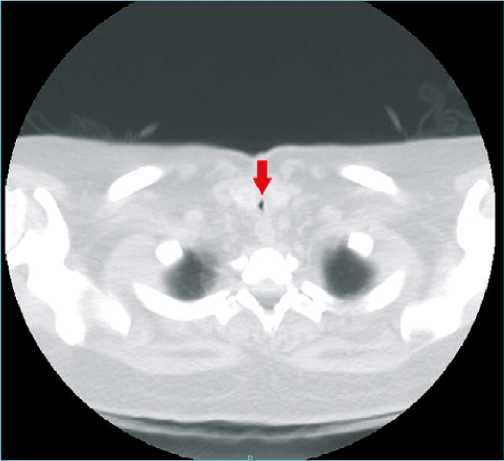
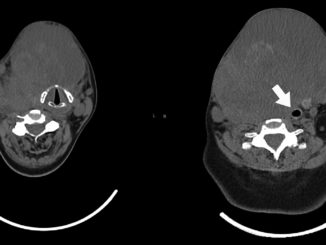
Figura 1a. Tac de cuello en corte transversal que demuestra la estenosis subglótica.
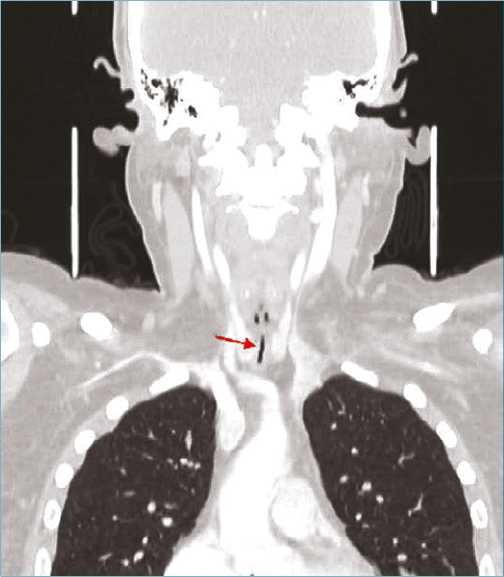
Figura 1b. Tac de cuello en corte transversal que demuestra la estenosis subglótica.
-
Reporte del caso
Mujer de 44 años de edad (peso 100 kg, talla 160 cm, IMC 39,1 kg/m2) quien en junio de 2021 presentó insuficiencia respiratoria secundario a neumonía grave por SARS-CoV2 con requerimiento de ventilación mecánica prolongada y traqueos- tomía percutánea; en el mes de julio, con cuadro de estenosis subglótica grado III a 5 cm de las cuerdas vocales, posterior a decanulación de traqueostomía, y precisa dilatación (tráquea de 7 mm posdilatación). En ese momento la paciente fue egresada con manejo ambulatorio, asintomática y oximetría de 99% con FiO2 al 0,21.
En el mes de octubre, la paciente reingresa por disnea súbita, estridor laríngeo, tos seca, y desaturación que mejora con oxígeno suplementario por ventury al 40%, antígeno para CO- VID-19 negativo y tomografía computada de cuello que evidencia estenosis traqueal de 2 mm en el diámetro mínimo (Figuras 1a y 1b) con traqueostomía cerrada.
Se realiza valoración prioritaria por cirugía general y anestesiología, para dilatación traqueal neumática. Valoración anestésica: ASA III, clase funcional previa NYHA II, índice de Lee 1 punto; y predictores de vía aérea difícil: obesidad grado II, diámetro del cuello mayor a 40 cm, distancia tiromentoniana menor a 6 cm, distancia mentoesternal menor a 10 cm, distancia mentohioidea menor a 3 cm, Mallampati II y, movilidad cervical Bellhouse Dore grado III. En la historia clínica no hay datos sobre dificultades para intubar y/o ventilar la paciente durante el proceso de intubación y/o la traqueostomía, y tampoco en la dilatación realizada posterior a la decanulación.
Se pasa al quirófano y, previa monitoría no invasiva, se inicia preoxigenación con cánula nasal sumado a máscara facial de máquina de anestesia a 6 l/min y oxígeno al 100%, durante 10 minutos. Se procede a inducción anestésica: lidocaína 1 mg/ kg Pr, fentanil 1 mcg/kgPr, ketamina 0,5 mg/kgPr, propofol 1 mg/kgPr, y succinilcolina 1 mg/kgPi. Introducción de la orofaríngea y nasofaríngea; y ventilación con máscara facial y circuito de anestesia difícil (pese a presión de 60 cm H2O). Posteriormente, con oxigenación apneica, se procede a primer intento de laringoscopia directa encontrando Cormack grado IV. Neumólogo realiza fibrobroncoscopia; sin embargo, la estenosis no es dilatable. Se realizan 3 intentos posteriores de videolaringoscopia fallida. La paciente presentó desaturación por lo cual se activa protocolo de emergencia ante estado de no ventilación y no intubación, un segundo anestesiólogo inicia ventilación con máscara facial a 2 manos con recuperación de oximetría a 90%; mientras la paciente recupera su ventilación espontánea manteniendo anestésico inhalado con CAM 2, se intenta de colocación de máscara laríngea clásica de rescate, la cual es fallida (ausencia de onda de capnografía, y no mejora la saturación de oxígeno).
En contexto de vía área difícil de emergencia (no intubación, y no ventilación), se decide retorno a la ventilación espontánea. El neumólogo procede a nueva fibrobroncoscopia, mientras el anestesiólogo más experto realiza videolaringoscopia, colocando tubo traqueal N° 5 guiado insinuado sobre la glotis y fijado a 3 puntos. Se da aporte de oxígeno por TOT al 100%, y llamado a cirujano general para eFONA, quien por antecedente (fragilidad de los tejidos cicatrizados y desconocimiento de la extensión del área comprometida), determinan mayor riesgo de complicaciones (incluida la necesidad de una traqueostomía por vía intratorácica y mayor probabilidad de muerte), e indica valoración por cirugía de tórax, quien decide llevar a cabo una reconstrucción traqueal. Anestesiólogos consideran manejo con anestesia local sumado a una anestesia total endovenosa, y mantenimiento de respiración espontánea.
Procedimiento quirúrgico sin complicaciones. Se encontró estenosis traqueal secundario a granuloma (que funcionaba como válvula) a 3 cm de las cuerdas vocales, con longitud de 3,5 cm y compromiso del 95% de la luz (Figura 2).
En el control posoperatorio al mes, tenía persistencia de disfonía leve y remisión completa de los demás síntomas.
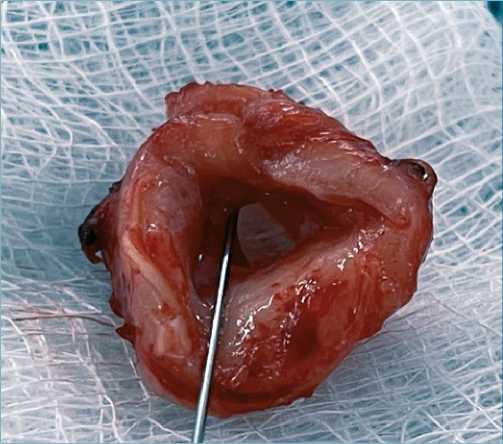
Figura 2. Pieza quirúrgica donde se observa la estenosis traqueal por granuloma.
-
Discusión
Desde el año 1960, el uso y avance en las técnicas de traqueostomía ha traído ventajas clínicas sobre el manejo y aseguramiento de la vía aérea, especialmente en pacientes con dependencia prolongada de ventilación mecánica[1]; sin embargo, ha traído a su vez un aumento significativo del estrechamiento subglótico y traqueal iatrogénico, clasificado en grados de acuerdo al porcentaje de compromiso del lumen por Myer- Cotton[2],[3]. La subglotis con frecuencia tiene mayor riesgo por ser la zona más estrecha. En un adulto, la medida vertical del estacio se encuentra entre 9,3 mm (± 9), y el ancho de 12,3 mm (± 4)[4]. Otro factor, asociado a la presencia de estenosis, es la presión ejercida por el manguito o cuff que conlleva a hipoperfusión del epitelio, necrosis, ulceración y cicatrización fibrosa (granulosa); es por ello que se recomienda que dicha presión no debe superar los 20-30 cm H2O[5].
La incidencia de estenosis traqueal posterior a traqueostomía se encuentra entre el 0,6%-21% de los casos y la presentación más frecuente es la concéntrica. En relación al número de pacientes con traqueostomías realizadas en la población, el número de pacientes con dicha complicación resultaba en una patología infrecuente pero prevalente; en los últimos dos años la pandemia por el SARS-CoV-2 ha elevado la incidencia exponencialmente; en tanto, el principal problema de la infección es la neumonía grave que conlleva a insuficiencia respiratoria, y esto a su vez la necesidad de ventilación mecánica prolongada, y aumento los casos de pacientes portadores de traqueostomía[5]-[7].
Las estenosis Cotton-Myer grado I-II, pueden ser manejadas de forma conservadora, mientras que las estenosis grado III-IV precisan de intervención médica. La primera opción es la dilatación endoscópica con balón, recomendada en los primeros 30 días posextubación o decanulación de traqueostomía debido a la suavidad del tejido. El procedimiento requiere uso de fibrobroncoscopio, laringoscopia directa y anestesia general, con evaluación hasta los bronquios principales y realización insuflación de un balón endoscópico durante 2 minutos, y repitiendo el procedimiento si el paciente tolera adecuadamente y no presenta alteración en la saturación de oxígeno[8]. Debido a que en la historia clínica no había reporte de vía aérea difícil en los procedimientos realizados, se definió por realizar la nueva dilatación bajo inducción anestésica total. El procedimiento reduce en 80% el riesgo de intervención quirúrgica; a pesar de ello, está descrito que las lesiones complejas suelen tener recurrencia y repetición de procedimiento sumado a una extensión del área comprometida, por lo cual la cirugía (reconstrucción laringotraqueal) es la única opción, demostrado un mayor éxito, por encima de los procedimientos endoscópicos y la laringoplastia[7],[9],[10]. En nuestro paciente, pese a la realización de dicha dilatación con mejoría sintomática y del lumen, progresa en unos meses a un cuadro de mayor severidad, y en un segundo intento, siguiendo las recomendaciones se lleva a nueva dilatación bajo anestesia general que resulta fallida.
Mientras para el cirujano la prioridad se encuentra en la resección del segmento estenótico y la reconstrucción, que permitirá a mediano plazo la permeabilidad de flujo aéreo; para el anestesiólogo el reto inminente es el mantenimiento de la ventilación y la oxigenación durante el procedimiento. En un metaanálisis se evaluó el mejor enfoque de abordaje de la vía aérea en cirugía traqueal por estenosis; la mayor parte de los trabajos enfatizaban en el uso de una técnica anestésica única (primando las técnicas locorregionales, y en segundo lugar la ventilación por dispositivo supraglótico bajo sedación, y el ECMO); no obstante, presentaban una eficacia relativa, por lo que se define que la mejor técnica es la que va dirigida, específicamente, al contexto del paciente[11],[12]. Para nosotros, la principal limitación es la ausencia de disponibilidad de dispositivos y/o técnicas de mayor eficacia para este tipo de pacientes (videolaringoscopio de hoja hiperangulada, varias máscaras laríngeas de segunda generación, ECMO y los estiletes como el FROVA o el Aintree).
En nuestro paciente, la anestesia general para el procedimiento laríngeo representaba un alto riesgo, no solo por la permeabilidad al flujo de aire, sino por el aumento de las presiones por resistencia de la vía aérea y el efecto de válvula dado por el granuloma. Ante un intento fallido de intubación con paciente despierto, bien con fibrobroncoscopio y videolaringoscopia (máximo 3+1 intentos), la DAS 2020 propone los accesos quirúrgicos (cricotirotomia o traqueostomía)[13]. Para los canadienses (2021) y la ASA (2022), se debe optar por dispositivos de rescate la máscara laríngea de segunda generación; y los accesos de cuello asociado a un introductor bajo inducción anestésica completa; aplazar la cirugía sino es urgente; e incluso el uso de ECMO, si todo lo demás falla[14],[15]. Para nuestra paciente era indispensable una cirugía en la vía aérea, ya se había realizado una traqueostomía, y por la altura del granuloma y su extensión, la cricotirotomía resultaba ser un procedimiento inviable; y el ECMO (procedimiento de elección ante una “vía aérea imposible”) no está disponible[14].
En el escenario de regresar a nuestra paciente a ventilación espontánea, descrita como opción por los canadienses, debido a su patología y estado al ingreso de la institución, era el riesgo inminente de falla ventilatoria. Ante esto, nos vimos involucrados en un camino sin aparente salida, y los algoritmos con sus recomendaciones, resultaron insuficientes. Aún así, en ese momento, concluimos que la elección de menor riesgo era el mantenimiento de la respiración espontánea, acoplado a técnicas de anestesia local y sedación; o una anestesia endovenosa titulada sin uso de relajación neuromuscular, con un TOT insinuado en la glotis y oxígeno al 100%; un desvío de las recomendaciones de la DAS para intubación despierto[13].
Una opción para el aporte suplementario de oxígeno, descrita brevemente en la literatura, es el uso no convencional del catéter Aintree o el FROVA combinado con máscara laríngea de segunda generación. Ambos, poseen un agujero en la punta distal y un conector proximal de 15 mm que permite el aporte de oxígeno (en tamaño de 5-15 French), combinado con una máscara laríngea de segunda generación que le otorgaría estabilidad y menor riesgo de trauma al momento introducir- lo[16],[17]. Aún así, el uso de introductores tiene como principal complicación la creación de una falsa ruta debido a trauma, un riesgo aumentado por la fragilidad del tejido del granuloma y que puede conducir a: neumotórax a tensión, ruptura esofagica y enfisema del cuello; lo que complicaría el estado del paciente[18].
-
Conclusión
El manejo de la vía aérea es sin lugar a dudas la piedra angular en la medicina y la anestesia; los algoritmos de abordaje ofrecen una serie de opciones de acuerdo a la eficacia y efectividad de las técnicas y los dispositivos evaluada en la literatura que ayuda a la disminución de riesgos y de fallas; a pesar de ello, podemos y debemos contar con un pequeño porcentaje de pacientes cuyas patologías y contextos clínicos van más allá de los algoritmos; y en los que la experiencia, el trabajo en equipo, y el conocimiento sobre las técnicas de manejo, se convierten en temas esenciales; sin dejar de un lado la imaginación científica que promueve y debe comenzar a priorizar el uso combinado de técnicas como puente entre los abordajes convencionales y los accesos quirúrgicos de emergencia (que en ocasiones no son una opción).
Agradecimientos. Se agradece al paciente, al Hospital Universitario Hernando Moncaleano y a la Universidad Surcolombiana.
Fuente de financiamiento: Se declara que no existe patrocinio de ninguna entidad.
Declaración conflicto de interés: Los autores no tienen conflictos de interés para reportar, son independientes a instituciones financiadoras y de apoyo.
Referencias
1. Heffner JE. Tracheotomy application and timing. Clin Chest Med. 2003 Sep;24(3):389–98. https://doi.org/10.1016/S0272-5231(03)00044-3 PMID:14535212
2. Myer CM 3rd, O’Connor DM, Cotton RT. Proposed grading system for subglottic stenosis based on endotracheal tube sizes. Ann Otol Rhinol Laryngol. 1994 Apr;103(4 Pt 1):319–23. https://doi.org/10.1177/000348949410300410 PMID:8154776
3. James P, Parmar S, Hussain K, Praveen P. Tracheal Stenosis after Tracheostomy. Br J Oral Maxillofac Surg. 2021 Jan;59(1):82–5. https://doi.org/10.1016/j.bjoms.2020.08.036 PMID:33160732
4. Bennett JD, Guha SC, Sankar AB. Cricothyrotomy: the anatomical basis. J R Coll Surg Edinb. 1996 Feb;41(1):57–60. PMID:8930047
5. Allgood S, Peters J, Benson A, Maragos C, McIltrot K, Slater T, et al. Acquired laryngeal and subglottic stenosis following COVID-19-Preparing for the coming deluge. J Clin Nurs. 2021 Aug;jocn.15992. ; Advance online publication. https://doi.org/10.1111/jocn.15992 PMID:34369020
6. Andrews MJ, Pearson FG. Incidence and pathogenesis of tracheal injury following cuffed tube tracheostomy with assisted ventilation: analysis of a two-year prospective study. Ann Surg. 1971 Feb;173(2):249–63. https://doi.org/10.1097/00000658-197102000-00012 PMID:5541484
7. D’Andrilli A, Venuta F, Rendina EA. Subglottic tracheal stenosis. J Thorac Dis. 2016 Mar;8 Suppl 2:S140–7. https://doi.org/10.3978/j.issn.2072-1439.2016.02.03 PMID:26981264
8. Marston AP, White DR. Subglottic Stenosis. Clin Perinatol. 2018 Dec;45(4):787–804. https://doi.org/10.1016/j.clp.2018.07.013 PMID:30396418
9. Hautefort C, Teissier N, Viala P, Van Den Abbeele T. Balloon dilation laryngoplasty for subglottic stenosis in children: eight years’ experience. Arch Otolaryngol Head Neck Surg. 2012 Mar;138(3):235–40. https://doi.org/10.1001/archoto.2011.1439 PMID:22351854
10. Yamamoto K, Kojima F, Tomiyama K, Nakamura T, Hayashino Y. Meta-analysis of therapeutic procedures for acquired subglottic stenosis in adults. Ann Thorac Surg. 2011 Jun;91(6):1747–53. https://doi.org/10.1016/j.athoracsur.2011.02.071 PMID:21619972
11. Schieren M, Böhmer A, Dusse F, Koryllos A, Wappler F, Defosse J. New Approaches to Airway Management in Tracheal Resections-A Systematic Review and Meta-analysis. J Cardiothorac Vasc Anesth. 2017 Aug;31(4):1351–8. https://doi.org/10.1053/j.jvca.2017.03.020 PMID:28800992
12. Liu X, Jiang R, Xiao J, Lu T, Gan J, Cheng J, et al. Anesthesia airway management for tracheal resection and reconstruction: a single-center case series. Ann Palliat Med. 2021 Mar;10(3):3354–63. https://doi.org/10.21037/apm-21-431 PMID:33849120
13. Ahmad I, El-Boghdadly K, Bhagrath R, et al. Anaesthesia. Difficult Airway Society guidelines for awake tracheal intubation (ATI) in adults. 2020;75:509–528.
14. Law, J. A., Duggan, L. V., Asselin, M., Baker, P., Crosby, E., Downey, A., Hung, O. R., Kovacs, G., Lemay, F., Noppens, R., Parotto, M., Preston, R., Sowers, N., Sparrow, K., Turkstra, T. P., Wong, D. T., Jones, P. M., & Canadian Airway Focus Group (2021). Canadian Airway Focus Group updated consensus-based recommendations for management of the difficult airway: part 2. Planning and implementing safe management of the patient with an anticipated difficult airway. Mise à jour des Lignes directrices consensuelles pour la prise en charge des voies aériennes difficiles du Canadian Airway Focus Group : 2ème partie. Planification et mise en œuvre d’une prise en charge sécuritaire du patient présentant des voies respiratoires difficiles anticipées. Canadian journal of anaesthesia = Journal canadien d’anesthesie, 68(9), 1405–1436. https://doi.org/10.1007/s12630-021-02008-z.
15. Jeffrey L. Apfelbaum, Carin A. Hagberg, Richard T. Connis, Basem B. Abdelmalak, Madhulika Agarkar, Richard P. Dutton, John E. Fiadjoe, Robert Greif, P. Allan Klock, David Mercier, Sheila N. Myatra, Ellen P. O’Sullivan, William H. Rosenblatt, Massimiliano Sorbello, Avery Tung; 2022 American Society of Anesthesiologists Practice Guidelines for Management of the Difficult Airway. Anesthesiology. 2022;136:31–81.
16. Cook TM, Seller C, Gupta K, Thornton M, O’Sullivan E. Non-conventional uses of the Aintree Intubating Catheter in management of the difficult airway. Anaesthesia. 2007 Feb;62(2):169–74. https://doi.org/10.1111/j.1365-2044.2006.04909.x PMID:17223810
17. Karnik PP, Dave NM, Ganguly A. Frova saved the day!! Indian J Anaesth. 2020 Sep;64(9):809–10. https://doi.org/10.4103/ija.IJA_521_20 PMID:33162580
18. Duggan LV, Law JA, Murphy MF. Brief review: Supplementing oxygen through an airway exchange catheter: efficacy, complications, and recommendations. Can J Anaesth. 2011 Jun;58(6):560–8. https://doi.org/10.1007/s12630-011-9488-4 PMID:21465321

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution