Antonio Bauk1, Matías Ontivero2,*, Santiago Sánchez2
Recibido: 11-07-2022
Aceptado: 21-07-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 6 pp. 773-778|https://doi.org/10.25237/revchilanestv5106101615
PDF|ePub|RIS
Case report: Anesthetic management in pregnant univentricular heart
Abstract
Incidence in women seeking for pregnancy with complex congenital heart disease is in continuous growth, that’s why nowadays cardiac diseases are the main cause of maternity death in developed countries. The univentricular heart is a poor prognostic, low incidence complex congenital cyanogenic heart disease, in which pulmonary and systemic venous return blend in unsepted unique ventricle, resulting in hypoxemic mixture. The severity of this entity depends on the Qp/Qs ratio, which represents the ratio between the pulmonary and systemic circulation. It’s of paramount importance that pregnant women with complex cardiac disease receive proper multiple disciplinary attention in order to complete a uneventful pregnancy. In this opportunity we present the anesthestic management of a 36 weeks pregnant women with uncorrected left univentricular heart associated with great vessels transposition, pulmonary stenosis and unbalanced atrioventricular channel.
Resumen
La incidencia de mujeres con cardiopatía congénita compleja en búsqueda de embarazo está en vías de ascenso[], de modo que la enfermedad cardíaca es ahora la principal causa de mortalidad materna en los países desarrollados. El corazón univentricular representa una patología de baja incidencia, pero mal pronóstico, que se caracteriza por ser una cardiopatía compleja cianógena en la que el retorno venoso sistémico y pulmonar se mezclan en el ventrículo único, por lo tanto, son siempre hipoxémicos y el grado de hipoxemia depende del ratio entre Qp/Qs (cociente entre la circulación pulmonar y la sistémica)[]. Resulta fundamental que las mujeres embarazadas con cardiopatía congénita sean atendidas por equipos multidisciplinarios que tengan experiencia y conocimientos en el manejo de tales condiciones para minimizar los riesgos y optimizar los resultados. Presentamos un caso clínico de manejo anestésico en gestante con diagnóstico de canal auriculoventricular disbalanceado, corazón univentricular izquierdo, transposición de grandes vasos y estenosis pulmonar.
-
Introducción
La cardiopatía congénita tiene una incidencia cercana a 0,6% de los nacidos vivos, excluyendo la válvula aortica bicúspide, que se produce aproximadamente en 2% en todo el mundo[3].
Si una madre tiene una cardiopatía congénita, la incidencia de transmisión es alta (6,7%). Por otro lado, las malformaciones complejas tienen una incidencia de aproximadamente 2,5 a 3 por 1.000 nacidos vivos con una variación significativa dependiendo del tipo de malformación en cuestión[4].
En los Estados Unidos, actualmente, hay más adultos con cardiopatías congénitas que bebés y niños, y se realizan aproximadamente 20.000 operaciones correctivas por año[5]. El número de mujeres que llegan a la edad fértil ha aumentado proporcionalmente. Sin embargo, las secuelas posoperatorias son la regla y en la mayoría de los casos, requieren atención médica a largo plazo y muy posiblemente de por vida. Esta población relativamente nueva y creciente de mujeres se enfrenta a la carga hemodinámica del embarazo superpuesta a la de su cardiopatía congénita.
Es así, que cerca del 1% de los embarazos se complican por enfermedad cardiovascular materna. En el Reino Unido, la enfermedad cardíaca es la causa más frecuente de muerte materna y las malformaciones congénitas son responsables de aproximadamente el 80% de las enfermedades cardíacas en mujeres embarazadas[6].
El corazón univentricular (UV) corresponde aproximadamente al 1% de todas las cardiopatías congénitas. Este término es muchas veces malentendido debido a que su significado literal no coincide con el significado real que tiene en la práctica clínica. Además, en gran medida, dicha confusión existente en torno a este término se debe al hecho de que este se aplica en 3 escenarios distintos con un significado diferente en cada uno de ellos:
Corazón univentricular
En el año 2012, el International Nomenclature Committee for Pediatric and Congenital Heart Disease propuso una definición genérica, exhaustiva y clínicamente útil[7]:
«Un espectro de malformaciones cardiovasculares congénitas en las que la masa ventricular no puede ser dividida de manera que tengamos una bomba ventricular para la circulación sistémica y otra para la circulación pulmonar. Esto podría ser debido a que tal división quirúrgica no sea anatómicamente factible o que no sea aconsejable».
En otras palabras, un corazón «univentricular» es un corazón con una malformación congénita «no corregible», en el sentido de conseguir una fisiología cardiocirculatoria normal, por cualquier razón, incluso en la presencia de 2 ventrículos de tamaño normal.
Fisiología univentricular
Hace referencia a aquella situación fisiológica en la que se cumplen 2 condiciones[8]:
1. Mezcla completa de los retornos venosos sistémico y pulmonar, con independencia de en qué parte del corazón se produzca.
2. La masa ventricular eyecta este retorno venoso, completamente mezclado, hacia ambas circulaciones (sistémica y pulmonar) al mismo tiempo (en paralelo). De hecho, esta circunstancia también se denomina «circulación en paralelo».
Se caracteriza, además, por sobrecarga de volumen resultado de la suma del gasto cardiaco pulmonar y sistémico; por ser una situación hipoxémica (la saturación pulmonar es similar que en la aorta) y la distribución del flujo sistémico y pulmonar depende de la relación entre las resistencias vasculares de ambos circuitos.
La fisiología univentricular, efectivamente, es el tipo de fisiología que encontramos en el contexto de los corazones uni- ventriculares no intervenidos quirúrgicamente, pero no necesariamente en los que sí han sido intervenidos.
Protocolo o camino univentricular
No tiene un significado anatómico ni fisiológico, sino qui- rúrgico-estratégico. Se refiere a una serie de procedimientos,
de tipo paliativo, que se ofrecen a un paciente con un corazón univentricular (no corregible), generalmente con el objetivo de alcanzar una circulación de Fontan, pasando previamente por procedimientos como Blaclock Taussing shunt y cirugía de Glenn.
Nos centraremos en el corazón univentricular propiamente dicho, del cual existen diferentes formas, a saber:
• Corazón derecho hipoplásico (atresia tricuspidea o atresia pulmonar con septum integro).
• Doble entrada de VU.
• Corazón izquierdo hipoplásico.
La forma más frecuente de corazón UV es la doble entrada de ventrículo morfológicamente izquierdo[9]. Desde el punto de vista embriológico, la fisiopatogenia consiste en un stop en la tabicación interventricular produciéndose la mayoría de las veces una doble entrada de ventrículo izquierdo quedando un ventrículo derecho rudimentario.
En esta malformación, de baja incidencia, pero mal pronóstico el grado de hipoxemia depende del ratio entre la circulación pulmonar y circulación sistémica (ratio Qp/Qs), tal es así que cuando la resistencia vascular sistémica disminuye, el paciente tenderá a la hipoxemia, ya que la sangre buscará desplazarse hacia el lecho sistémico; al contrario, cuando la resistencia vascular pulmonar disminuye, el paciente saturará mejor a expensas de la disminución del flujo sanguíneo hacia la circulación sistémica.
La longevidad de estos pacientes depende de la morfología del ventrículo único; la ausencia o presencia y grado de estenosis pulmonar o estenosis subaórtica; la resistencia vascular pulmonar en pacientes sin estenosis pulmonar; y la morfología y función de la válvula o válvulas que custodian la unión auri- culoventricular. La supervivencia hasta la edad adulta temprana no es rara, pero excepcionalmente llegan a la quinta década, sin embargo, como en este caso, se han reportado embarazos exitosos en mujeres con esta patología[9].
Las mujeres con enfermedad cardiovascular a veces experimentan complicaciones gestacionales significativas a pesar de la atención obstétrica y cardíaca moderna. Los investigadores del grupo CARPREG (siglas en inglés que hacen referencia a “enfermedades cardíacas en el embarazo”) desarrollaron un sistema de puntuación para mujeres con enfermedades cardíacas (score CARPREG) capaz de predecir eventos cardíacos tales como: edema pulmonar, arritmias, accidente cerebrovas- cular, paro cardíaco o muerte. El score en cuestión consiste en la presencia/ausencia de cuatro signos/síntomas: 1) disnea clase funcional III o IV de la New York Heart Association o presencia de cianosis; 2) eventos cardíacos previos; 3) obstrucción mitral o aórtica; y 4) fracción de eyección del ventrículo izquierdo < 40%. La validez de este score fue demostrada por Silversides et al.[10] en 2001, donde objetivó que los pacientes con la presencia de uno de los síntomas del score tuvieron tasas de eventos cardíacos del 27% frente al 75% en pacientes con puntuaciones de dos o más puntos. Cuando la puntuación era cero, la tasa de eventos era del 5%. Otra escala utilizada pertenece a la Clasificación Modificada de Enfermedades Cardiovasculares en el Embarazo de la Organización Mundial de la Salud[11]. Esta herramienta útil para el anestesiólogo, clasifica las lesiones cardíacas maternas según su “tasa de riesgo de un evento cardiovascular durante el embarazo” que va desde lesiones del grupo I (por ej defectos del tabique auricular o ventricular reparados simples, prolapso leve de la válvula mitral o latidos ectópicos auriculares o ventriculares aislados; tasa de eventos del 2,5% al 5%) a lesiones del grupo IV (por ej., hipertensión arterial pulmonar, disfunción ventricular sistémica grave, estenosis aórtica sintomática grave, dilatación aórtica grave; tasa de eventos del 40% al 100%).
Perlof et al.[9], realizaron una revisión de la literatura sobre los resultados del embarazo en mujeres con cardiopatía con- génita donde se obtuvieron los siguientes resultados: de 2.491 embarazos, la incidencia de complicaciones cardíacas en mujeres con cardiopatías congénitas fue del 11%. Las pacientes con cardiopatía congénita compleja y cardiopatía cianótica paliada o no operada tenían un alto riesgo de padecer insuficiencia cardiaca (4,8%). Las arritmias significativas (4,5%) generalmente eran supraventriculares. Se asoció además a 15% de abortos espontáneos y 5% de abortos electivos. No hubo aumento en la prevalencia de complicaciones obstétricas, pero hubo altas tasas de partos prematuros y de bajo peso al nacer, especialmente entre los casos de cardiopatías congénitas más complejos[12].
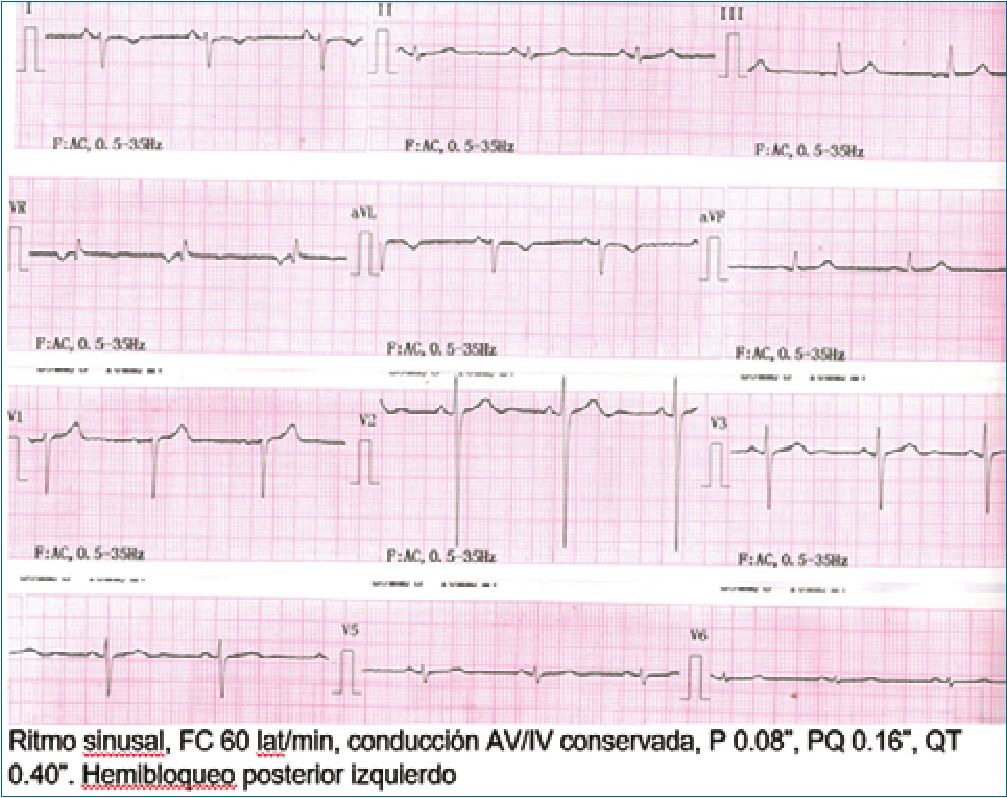
Figura 1. Electrocardiograma preoperatorio.
-
Caso clínico
-
Preoperatorio
Paciente de 29 años, 78 kg, 1,60 mts; primigesta cursando 36 semanas de gestación, con antecedente de hipotiroidismo gestacional; derivada desde el Hospital de San Martín de los Andes Dr. Ramón Carrillo hacia el Hospital Dr. Eduardo Castro Rendón de Neuquén, Argentina, para control de embarazo de alto riesgo en contexto de paciente con diagnóstico de cardiopatía congénita tipo ventrículo único izquierdo, transposición de grandes vasos con estenosis de arteria pulmonar y canal auriculo ventricular desbalanceado con predominio izquierdo, sin cirugía correctiva. Presenta un score CARPREG 1 y se clasifica como clase 3 de la clasificación modificada de riesgo de la OMS. Se constituye (Cuadro 1) un equipo multidisciplinario entre los servicios de Obstetricia, Anestesiología, Cardiología y Terapia Intensiva para tomar conocimiento del caso y valorar la terminación del embarazo en forma oportuna (ver estudios complementarios en el anexo correspondiente).
-
Intraoperatorio
Al ingreso a quirófano, la paciente se encuentra estable hemodinámicamente, lúcida, orientada en tiempo y espacio. Se realiza anamnesis y examen físico pre anestésico inmediato, en el cual se destaca: acropaquía y cianosis en mucosas, soplo holosistólico 3/6 en foco aórtico; asociado a una disnea CF III según NYHA. Se explica técnica anestésica a implementar, ventajas y desventajas. Comprende y acepta mediante firma de consentimiento informado.
Los signos vitales al ingreso son: TA: 125/81, FC: 86, ritmo sinusal, sat PO2 73% aire ambiente. Se decide medición continua de actividad eléctrica cardiaca a través de cardiosco- pio convencional, SatPO2 y presión arterial invasiva mediante canalización de arteria radial derecha. Se coloca un segundo acceso venoso periférico en miembro superior (16G). Se aporta oxígeno por cánula nasal a 3 lt/min, con lo cual la saturación es optimizada a 93%.
Se procede a realizar anestesia epidural continua mediante la colocación de catéter epidural 20G. Se inyecta por el mismo 15 ml de lidocaína al 1,5% con epinefrina 2 mcg/ml sin objetivar complicaciones ni alteraciones hemodinámicas. Finalizado el acto, se coloca a la paciente en decúbito supino con el útero desplazado hacia la izquierda para minimizar la compresión aorto-cava por el útero gestante[13].
Se comienza con infusión endovenosa de fenilefrina a dosis de 0,1-0,3 pg/kg/min según requerimientos para mantener la hemodinamia estable y se procede a realizar cesárea y ligadura tubaria bilateral sin complicaciones. Posterior al nacimiento del bebé, se infunde por vía intravenosa una dosis de 5 UI de oxi- tocina seguido de goteo lento de 15 UI más, según protocolo institucional. Durante la cirugía, la paciente recibió 1000 ml de ringer lactato, siendo la pérdida sanguínea de aproximadamente 300 ml y la diuresis de 200 ml.
No se registraron inconvenientes o imprevistos durante la misma, ya sea desde el punto de vista anestésico como por parte del equipo quirúrgico. Las puntuaciones de Apgar del bebé fueron 6 al minuto y 8 a los 5 minutos y su peso: 1.410 g.
-
Posoperatorio
La madre fue trasladada a unidad coronaria en donde cursó las primeras 24 h posoperatorias sin complicaciones, para luego pasar a sala general. El bebé fue enviado a la Unidad de Cuidados Intensivos Neonatales por las primeras 24 h. Luego de cuatro días de internación posoperatoria, la paciente es dada de alta.
-
Discusión
Dados los riesgos de complicaciones cardiovasculares siempre que sea posible, se deberá optar por la anestesia neuroaxial para la cesárea en mujeres con antecedentes de cardiopatías congénitas complejas[14].
| Tabla 1. Laboratorio preoperatorio | |
| Laboratorio preoperatorio | |
| HEMATOLOGÍA | |
| Hemograma | |
| Clasificacion modificada de riesgo de la OMS | |
| Hematocrito | 62% |
| Concentración de hemoglobina | 20,0 g/dl |
| Recuento Glóbulos Blancos | 7.900/mm3 |
| Fórmula leucocitana | |
| Mielocitos | 0% |
| Metamielocitos | 0% |
| Neutrofllos cayados | 0% |
| Neutrofilos segmentados | 48% |
| Eosinofllos | 2% |
| Basofilos | 0% |
| Linfocitos | 48% |
| Monocitos | 2 % |
| Recuento de plaquetas | 236.000/mm3 |
| Eritrosedlmentación | 1 mm/h |
| QUIMICA CLÍNICA | |
| Glucemia | 0,77 g/l |
| Uremia | 0,22 g/l |
| Colesterol total | 1,57 g/l |
| Colesterol HDL | 0,41 g/l |
| Colesterol LDL | 0,95 g/l |
| Triglicéridos | 1,05 g/l |
| Hepatograma | |
| Transaminasa glutámico oxal | 28 U/L |
| Acética | |
| Transaminasa glutámico pirúvica | 27 U/L |
| Fosfatasa alcalina | 173 U/L |
| Bilirrubina en sangre | |
| Bilirrubina total | 3,01 mg/dl |
| Bilirrubina directa | 0,52 mg/dl |
| Bilirrubina indirecta | 2,49 mg/dl |
Debido a que los cambios hemodinámicos de una anestesia espinal son más rápidos y pronunciados que para una anestesia epidural, se preferirá esta última como primera opción en dichas cirugías. No obstante, las mujeres con lesiones de clase I o II de la clasificación modificada de riesgo cardiovascular de la Organización Mundial de la Salud de enfermedad cardiovascular en el embarazo, suelen tolerar una dosis intratecal típica de anestesia local para cesárea[15]. Sin embargo, pacientes con graduaciones de clase III o IV, pueden beneficiarse de una sim- patectomía de inicio más gradual[16]. Es así que, se han des- cripto múltiples variantes de la anestesia neuroaxial para este tipo de pacientes sometidas a cirugía de cesárea, a saber[17]:
• Técnica epidural convencional con dosis titulada de anestésicos locales.
• Técnica epidural espinal combinadas dentro de las cuales se han publicados alternativas como:
– Anestesia epidural con punción dural[15].
– Anestesia espinal epidural combinada solo con opioides in- tratecales y anestésico local epidural (es decir, sin anestésico local a nivel subdural).
– Anestesia espinal y epidural combinada con opioide y dosis bajas de anestésicos locales (bupivacaina 2,5 a 5 mg) intratecales, seguido de una lenta titulación epidural de lidocaí- na al 2%[14]-[17].
Muchos anestesiólogos prefieren esta última opción en pacientes con enfermedades cardíacas ya que teóricamente combina la mayor confiabilidad de bloqueo, simetría y consistencia de la anestesia intratecal con la simpatectomía de inicio gradual de la anestesia epidural[18].
Para el seguimiento intraoperatorio diversos autores recomiendan el monitoreo básico ASA y se puede utilizar además el monitoreo intraarterial de la presión sanguínea si el anestesió- logo lo considera, sobre todo para la titulación en tiempo real de las drogas vasoactivas. Debe realizarse un control frecuente cada 2 a 5 minutos de la presión arterial, oximetría de pulso con alarmas audibles y electrocardiografía que alerte la presencia de arritmias. El monitoreo de presión venosa central y presión de arteria pulmonar se reserva para pacientes con descompensación cardiopulmonar o insuficiencia ventricular derecha que requieren titulación de vasopresores y vasodilatadores pulmonares[19].
Por otro lado, las indicaciones de anestesia general incluyen descompensación cardiopulmonar, anticoagulación, trom- bocitopenia y rechazo materno de la anestesia neuroaxial. Si bien se describe el uso exitoso de anestesia general en esta población de pacientes, algunos autores consideran que su uso debe limitarse a contraindicaciones de la anestesia neuroaxial y emergencias obstétricas, evitando así mayores alteraciones de la fisiopatología cardiovascular[20]. En mujeres con riesgo de insuficiencia cardíaca, existe un riesgo teórico de descompensación de su función ventricular inmediatamente después de la cesárea ya que la descompresión aortocava y la involución uterina en el momento del nacimiento pueden aumentar de forma aguda la precarga. Algunos expertos opinan que, si una mujer con enfermedad cardíaca es disneica o hipoxémica antes del parto por cesárea, sería prudente considerar la anestesia general en búsqueda de anticiparse a una posible descompensación inmediatamente después del nacimiento[21].

Cuadro 1. Informe ecocardiográfico.
Teniendo en cuenta la fisiopatología de esta enfermedad, el estadio clínico de nuestra paciente, los recursos con los que contamos y nuestra experiencia, decidimos realizar una anestesia epidural para esta cirugía y de esta forma beneficiar a la paciente de la gradualidad de la instauración del bloqueo simpático, lo cual se traduce en una disminución de la resistencia vascular sistémica pausada y una atenuación de su repercusión en la saturación del paciente y su hemodinamia. La anestesia general no fue considerada como primera opción debido a que la embarazada tiene un mayor riesgo de aspiración de contenido gástrico, una vía aérea con cambios en su anatomía que dificultan la intubación y un riesgoso pasaje transplacentario de drogas; sin mencionar las potenciales repercusiones hemodiná- micas de esta técnica[21].
Al monitoreo hemodinámico básico sugerido por la sociedad americana de anestesiología (ASA) le sumamos el monitoreo intraarterial continuo de la presión arterial, ya que consideramos muy importante modificar lo menos posible el modelo hemodinámico propio de esta paciente, y de verse alterado, corregirlo de manera precoz titulando la fenilefrina.
-
Conclusión
Tal como se ha expuesto con anterioridad, la incidencia de pacientes adultos con cardiopatías congénitas complejas corregidas y no corregidas, ha ido incrementándose en los últimos años. Debido a esto, la calidad de la atención proporcionada por los cardiólogos pediátricos desde el nacimiento hasta la madurez debe combinarse con una atención de igual calidad para pacientes adultos por parte de otras especialidades y la anestesiología no es una excepción a esto. En tanto y en cuanto, estos pacientes puedan experimentar una vida adulta plena no es de extrañar que los mismos ingresen a quirófano con patología de urgencia quirúrgica en forma concomitante, lo cual supone un desafío para el personal médico actuante.
El éxito de las intervenciones en dichos pacientes está supeditada a una constante actualización por parte del anestesiólo- go como así también de la capacidad de un abordaje multidis- ciplinario de la patología en cuestión entre los integrantes del equipo quirúrgico.
El aporte científico respecto a estos casos , constituye una herramienta fundamental en el desarrollo de habilidades teóricas y prácticas para una anestesia segura y de calidad.
| Tabla 2 Clasificación modificada de riesgo de la Organiza ción Mundial de la Salud |
| Clase I
Riesgo muy bajo |
| Seguimiento por Cardiología durante la gestación de una o dos visitas
Incluye: estenosis pulmonar, ductus arterioso persistente y prolapso mitral leves, lesiones simples corregidas con éxito (defecto atrial o ventricular, ductus persistente, drenaje venoso anómalo), latidos atriales o ventriculares ectópicos, aislados |
| Clase II
Riesgo moderado |
| Seguimiento cada trimestre
Incluye: defecto septal o atrial no reparado, tetralogía de Fallot corregida y la mayoría de arritmias |
| Clase II-III
Incluye: compromiso ventricular leve, miocardiopatía hipertrófica, enfermedad valvular nativa no considerada clase I o IV, síndrome de Marfan sin dilatación aórtica, aorta < 45 mm en enfermedad aórtica asociada con aorta bicúspide, coartación aórtica corregida |
| Clase III
Riesgo alto |
| Se recomienda seguimiento por Cardiología y Obstetricia una o dos veces al mes
Incluye: prótesis valvulares mecánicas, ventrículo derecho sistémico, circulación de Fontan, enfermedad cardíaca cianótica no reparada, enfermedad cardíaca compleja no reparada, dilatación aórtica (40-45 mm) en síndrome de Marfan, dilatación aórtica (45-50 mm) en enfermedad aórtica asociada con aorta bicúspide |
| Clase IV |
| Pacientes que tienen contraindicado el embarazo, pero si están embarazadas y deciden continuar con la gestación necesitan evaluación una o dos veces al mes Incluye: hipertensión arterial pulmonar de cualquier causa, disfunción ventricular izquierda severa (fracción de expulsión < 30%, clase funcional lll-IV), miocardiopatía periparto con cualquier compromiso residual de la función ventricular, estenosis mitral severa, estenosis aórtica severa sintomática, síndrome de Marfan con aorta dilatada (> 45 mm), dilatación aórtica (> 50 mm) en enfermedad aórtica asociada con aorta bicúspide, coartación aórtica nativa |
Referencias
1. Cauldwell M, Gatzoulis M, Steer P. Congenital heart disease and pregnancy: A contemporary approach to counselling, pre-pregnancy investigations and the impact of pregnancy on heart function. Obstet Med. 2017 Jun;10(2):53–7. https://doi.org/10.1177/1753495X16687905 PMID:28680462
2. Marín Rodríguez C, Sánchez Alegre ML, Lancharro Zapata Á, Alarcón Rodríguez J. Alarcón Rodríguez J. Cuantificación de la circulación pulmonar y sistémica: Qp/Qs. Qué es, cómo se calcula y para qué sirve. Lo que el radiólogo debe saber. Radiología (Madr). 2015 Sep;57(5):369–79. https://doi.org/10.1016/j.rx.2015.04.001 PMID:26070521
3. Nieminen HP, Jokinen EV, Sairanen HI. Late results of pediatric cardiac surgery in finland: a population-based study with 96% follow-up. ACC Curr J Rev. 2002 Jan;11(1):86–7. https://doi.org/10.1016/S1062-1458(01)00598-0.
4. Thorne S, Deanfield J. Long-term outlook in treated congenital heart disease. Arch Dis Child. 1996 Jul;75(1):6–8. https://doi.org/10.1136/adc.75.1.6 PMID:8813863
5. Creanga AA, Syverson C, Seed K, Callaghan WM. Pregnancy-Related Mortality in the United States, 2011-2013. Obstet Gynecol. 2017 Aug;130(2):366–73. https://doi.org/10.1097/AOG.0000000000002114 PMID:28697109
6. Uebing A, Steer PJ, Yentis SM, Gatzoulis MA. Pregnancy and congenital heart disease [Internet]. BMJ. 2006 Feb;332(7538):401–6. https://doi.org/10.1136/bmj.38756.482882.DE PMID:16484266
7. Vanpraagh R, Ongley PA, Swan HJ. Anatomic types of single or common ventricle in man. Am J Cardiol. 1964 Mar;13(3):367–86. https://doi.org/10.1016/0002-9149(64)90453-9 PMID:14128647
8. De Leval MR. Comprehensive Surgical Management of Congenital Heart Disease. J R Soc Med. 2004 Jul;97(8):407–8. https://doi.org/10.1177/014107680409700819.
9. Joseph K, Child John S, Jamil A. congenital heart disease in adults. 2009;
10. Silversides CK, Grewal J, Mason J, Sermer M, Kiess M, Rychel V, et al. Pregnancy Outcomes in Women With Heart Disease: the CARPREG II Study [Internet]. J Am Coll Cardiol. 2018 May;71(21):2419–30. [cited 2021 Dec 28] Available from: https://www.sciencedirect.com/science/article/pii/S0735109718342682#:~:text=The%20CARPREG%20risk%20score%20consists https://doi.org/10.1016/j.jacc.2018.02.076 PMID:29793631
11. Creanga AA, Syverson C, Seed K, Callaghan WM. Pregnancy-Related Mortality in the United States, 2011-2013. Obstet Gynecol. 2017 Aug;130(2):366–73. https://doi.org/10.1097/AOG.0000000000002114 PMID:28697109
12. Ertekin E, van Hagen IM, Salam AM, Ruys TP, Johnson MR, Popelova J, et al. Ventricular tachyarrhythmia during pregnancy in women with heart disease: Data from the ROPAC, a registry from the European Society of Cardiology. Int J Cardiol. 2016 Oct;220:131–6. https://doi.org/10.1016/j.ijcard.2016.06.061 PMID:27376569
13. Cambios anatómicos y fisiológicos del embarazo: sus implicancias anestesiológicas [Internet]. www.anestesia.org.ar . [cited 2022 Apr 1]. Available from: https://www.anestesia.org.ar/search/articulos_completos/1/1/188/c.php#:~:text=s%C3%ADndrome%20supino%2Dhipotensivo.%20o%20compresi%C3%B3n
14. Arendt KW, Muehlschlegel JD, Tsen LC. Cardiovascular alterations in the parturient undergoing cesarean delivery with neuraxial anesthesia. Expert Rev Obstet Gynecol. 2012 Jan;7(1):59–75. https://doi.org/10.1586/eog.11.79.
15. Chau A, Bibbo C, Huang CC, Elterman KG, Cappiello EC, Robinson JN, et al. Dural Puncture Epidural Technique Improves Labor Analgesia Quality With Fewer Side Effects Compared With Epidural and Combined Spinal Epidural Techniques: A Randomized Clinical Trial [Internet]. Anesth Analg. 2017 Feb;124(2):560–9. Available from: https://journals.lww.com/anesthesia-analgesia/FullText/2017/02000/Dural_Puncture_Epidural_Technique_Improves_Labor.30.aspx https://doi.org/10.1213/ANE.0000000000001798 PMID:28067707
16. Arendt KW, Muehlschlegel JD, Tsen LC. Cardiovascular alterations in the parturient undergoing cesarean delivery with neuraxial anesthesia. Expert Rev Obstet Gynecol. 2012 Jan;7(1):59–75. https://doi.org/10.1586/eog.11.79.
17. Hamlyn EL, Douglass CA, Plaat F, Crowhurst JA, Stocks GM. Low-dose sequential combined spinal-epidural: an anaesthetic technique for caesarean section in patients with significant cardiac disease. Int J Obstet Anesth. 2005 Oct;14(4):355–61. https://doi.org/10.1016/j.ijoa.2005.01.001 PMID:16139497
18. Arendt KW, Lindley KJ. Obstetric anesthesia management of the patient with cardiac disease [Internet]. Int J Obstet Anesth. 2019 Feb;37:73–85. [cited 2021 Oct 14] Available from: https://www.obstetanesthesia.com/article/S0959-289X(18)30086-4/fulltext https://doi.org/10.1016/j.ijoa.2018.09.011 PMID:30415799
19. American Society of Anesthesiologists. Committee on Standards and Practice Parameters (CSPP):Standards for Basic Anesthetic Monitoring.Available at: https://www.asahq.org/standards-and-guidelines/standards-for-basic-anesthetic-monitoring. Accessed March 2, 2021.
20. Lu SF, Joseph KM, Banayan JM. Anesthetic considerations for Fontan circulation and pregnancy. Int Anesthesiol Clin. 2021 Jul;59(3):52–9. https://doi.org/10.1097/AIA.0000000000000329 PMID:34029248
21. Meng ML, Arendt KW. Obstetric Anesthesia and Heart Disease: Practical Clinical Considerations. Anesthesiology. 2021 Jul;135(1):164–83. https://doi.org/10.1097/ALN.0000000000003833 PMID:34046669

 ORCID
ORCID