Diego Gutiérrez Martínez M.D.1,*, Alberto Gutiérrez Martínez M.D.1, Verónica Guilló Moreno M.D.1, Itxaso Galán González M.D.2, Inocencia Fornet Ruiz PhD.3, Javier García Fernández PhD.4
Recibido: 12-09-2022
Aceptado: 14-10-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 6 pp. 779-782|https://doi.org/10.25237/revchilanestv5107101211
PDF|ePub|RIS
Anaesthetic management for caesarean section of a parturient with tethered cord syndrome. Case report.
Abstract
Tethered cord syndrome is a congenital spinal dysraphism characterized by the presence of an abnormally descended conus medullaris. Neura- xial anesthesia is not recommended in these cases due to the high risk of direct spinal cord damage. We present the case of a 40-year-old woman with tethered cord syndrome of infectious aetiology due to fetal toxoplasmosis, scheduled for elective caesarean under general anesthesia. Neura- xial regional anesthesia should be avoided in patients with tethered cord syndrome. In special situations it could be performed after an exhaustive magnetic resonance study.
Resumen
El síndrome de médula anclada es un disrafismo espinal congenito caracterizado por la presencia de un cono medular anormalmente descendido. La anestesia neuroaxial se desaconseja en estos casos debido al alto riesgo de daño medular directo. Presentamos el caso de una mujer de 40 años programada para cesárea electiva con un síndrome de médula anclada de etiología infecciosa por una toxoplasmosis fetal mediante anestesia general. Se recomienda evitar la anestesia regional neuroaxial en pacientes con síndrome de médula anclada. En situaciones especiales podría utilizarse tras un estudio exhaustivo de resonancia magnética.
-
Introducción
El síndrome de médula anclada (SMA) es una malformación congénita de la región caudal que se caracteriza por la ausencia de ascenso del cono medular por encima de la vértebra lumbar L2 debido a su fijación a las estructuras vertebrales. Su incidencia estimada es de 0,25 casos cada 1.000 nacimientos[1]. La tensión mecánica a la que se somete la médula espinal debido a este fenómeno puede producir síntomas neu- rológicos, musculoesqueléticos, urológicos o gastrointestinales.
Las causas con las que se relaciona el SMA son disrafismos espinales, traumas, infecciones o neoplasias. Dentro de los dis- rafismos espinales los más frecuentes son la infiltración grasa del filum terminale, lipomielomeningocele, mielomeningocele, mielocistocele, meningocele, malformaciones del cordón hendido, seno dérmico, malformaciones anorrectales y tumores in- traespinales. Estos eventos provocan una serie de adherencias entre la médula espinal y las estructuras adyacentes impidiendo su normal ascenso durante el crecimiento que se produce entre los dos y tres meses de vida[2],[3].
Debido al descenso del cono medular, se desaconseja el uso de anestesia neuroaxial por riesgo de daño medular directo[4].
-
Caso clínico
Presentamos el caso de una mujer de 40 años (76 kg, 162 cm) programada para cesárea electiva. La paciente padece un síndrome de médula anclada producido por la presencia de un lipoma sacro debido un fallo de desarrollo del tubo neural.
Este disrafismo espinal que presenta la paciente fue ocasionado por una toxoplasmosis durante el desarrollo fetal. La cirugía de resección del lipoma sacro se realizó a los dos meses de vida siendo incompleta. La paciente actualmente presenta vejiga neurógena y escoliosis severa.
Dados los antecedentes médicos de la paciente, durante el primer trimestre se realizó una resonancia magnética, con el objetivo de planificar la cesárea, que evidenció una hidrocefalia leve a correlacionar con su clínica neurológica. Además, se describió un fallo de fusión de los elementos posteriores del sacro con dilatación del saco raquídeo y cono medular anclado a la altura de las vertebras L5 y S1 (Figura 1).
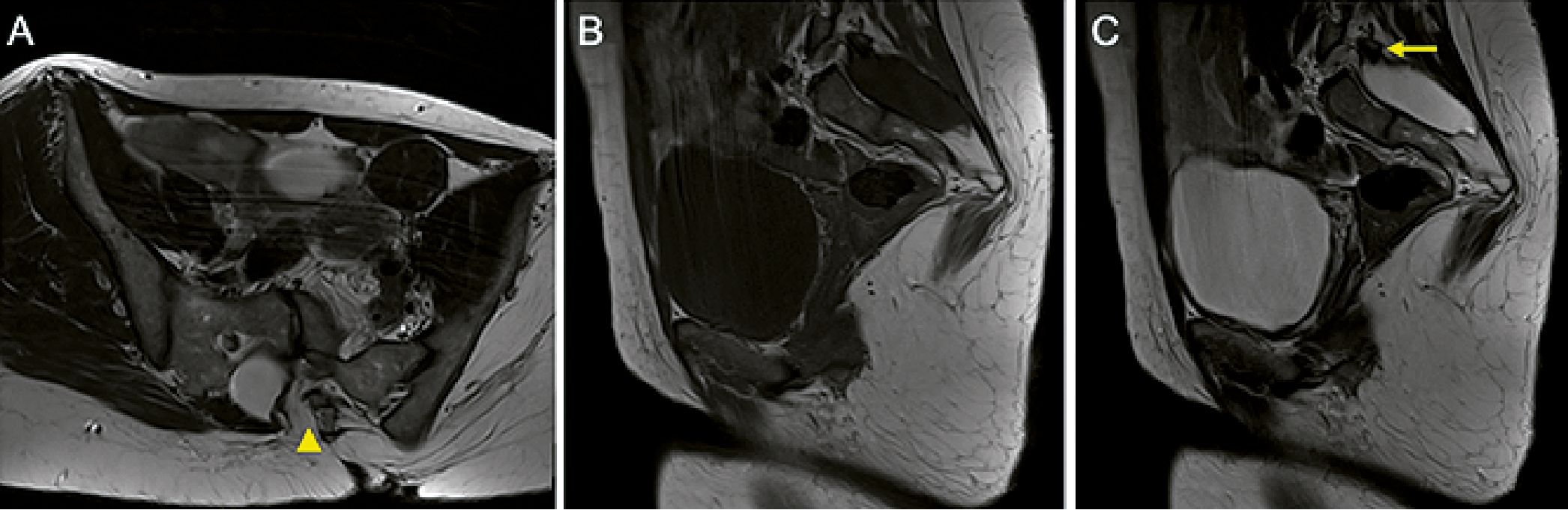
Figura 1. Cambios posquirúrgicos en columna lumbar en relación con antecedente de resección de lipoma del filum terminale. A. RM axial T2 que muestra defecto de fusión de los elementos posteriores de sacro y L5 (punta de flecha); B y C. RM sagitales T1 y T2 que evidencian dilatación del saco raquídeo en región lumbosacra y cono medular anclado a la altura de L5-S1 (flecha), desplazado posteriormente.
El servicio de neurología recomendó cesárea electiva para evitar el probable empeoramiento neurológico.
En la evaluación preoperatoria, debido al alto riesgo de daño medular, se descartó la anestesia regional neuroaxial y se decidió anestesia general como estrategia de elección. En la exploración física se evaluó la vía aérea con buenos predictores de intubación (apertura bucal mayor de 4 cm, test de Mallampati I y distancia tiromentoniana mayor de 6,5 cm). En la inspección de la columna lumbar se encontró una cicatriz en línea media a nivel lumbasacro.
Una vez preparado el campo quirúrgico y todo el personal médico, se procedió a la inducción de secuencia rápida con Propofol 2 mg/kg, succinilcolina 1 mg/kg e intubación orotraqueal con un tubo del número 7 sin incidentes. Recién nacido vivo, Apgar 9-10. La paciente fue extubada sin incidencias y trasladada a la sala de recuperación posanestésica junto al neonato. No se presentaron síntomas neurológicos de nueva aparición tras la intervención quirúrgica.
-
Discusión
Los lipomas lumbosacros y lipomielomeningoceles se originan por una anormalidad en la diferenciación regresiva de la masa celular caudal. Los lipomas lumbosacros producen una infiltración grasa del filum terminale impidiendo su correcto ascenso. El tejido adiposo se extiende desde los elementos neurales dentro del canal espinal a través de un defecto de los elementos posteriores de las vértebras, para unirse a la grasa subcutánea a través de la fascia lumbosacra. En cambio en los lipomielomeningoceles se añade una salida de los elementos neurales fuera del canal espinal[5]. Los casos registrados de médula espinal anclada se deben a lipoma espinal (72%), filum terminal tenso (12%), diastemetomielia (8%) y mielome- ningocele (8%). A pesar de intervenirse quirúrgicamente de estos hallazgos descritos, entre 8%-30% persiste el síndrome de médula anclada[1].
La paciente experimentó una toxoplasmosis fetal que provocó un problema de diferenciación del cono medular originando un lipoma sacro. Con el objetivo de evitar un síndrome de médula anclada fue operada para extraer el lipoma sacro y favorecer el ascenso correcto de la médula. La cirugía fue muy laboriosa siendo imposible la eliminación completa del lipoma lumbosacro. En la RMN pélvica preoperatoria se observaba un cono medular anclado a nivel de L5-S1.
El diagnóstico precoz tras el nacimiento es difícil dado que pueden no presentar ninguna clínica. La presencia de angio- mas, lipomas subcutáneos, fositas pilonidales malformaciones urogenitales o anorrectales frecuentemente indican la existencia de problemas en la formación del tubo neural[6],[7]. Debe valorarse realizar las pruebas sensitivas y motoras necesarias. Las extremidades inferiores deben de ser estudiadas minuciosamente en búsqueda de deformidades ortopédicas como disme- tría o escoliosis. El SMA también está relacionado con anomalías de los reflejos tendinosos profundos y del tono muscular[5].
El desarrollo osteomuscular se acompaña frecuentemente de dolores significativos en región lumbosacra, perineal y extremidades inferiores. A menudo también se asocia a déficits sensoriales que no siguen una distribución segmentaria. En este caso la paciente presentaba una escoliosis grave, dismetría de miembros inferiores y alteraciones en el control de los esfínteres. En cambio, no mostraba lesiones cutáneas a nivel lumbar ni presencia de lipomas subcutáneos.
Asimismo, el diagnóstico de SMA puede tener lugar en la edad adulta, desencadenado de manera espontánea o debido a un trauma[2]. Los síntomas más comunes son el déficit neu- rológico sensitivo-motor progresivo y bilateral en miembros inferiores, disminución de reflejos rotuliano y aquíleo, dolores en columna lumbar y miembros inferiores, y trastornos urológicos como vejiga neurógena o incontinencia de esfínteres[8].
Tanto el embarazo como el esfuerzo del parto pueden empeorar la clínica neurológica aumentando la tensión a la que se somete la médula espinal, que ya está tensa, alterando la microcirculación y el metabolismo celular[5]. La paciente manifestó un empeoramiento neurológico durante la gestación con parestesias de miembros inferiores. Por ello se decidió la cesárea como técnica de extracción fetal.
La resonancia magnética es la modalidad radiográfica de elección para evaluar el SMA (Figura 1). En ella se muestra el nivel del cono medular, visualizando la causa del anclaje y proporcionando detalles para la posible planificación quirúrgica. Un cono medular localizado a nivel de la vértebra lumbar L2 se considera dentro de la normalidad[9].
El tratamiento consiste en desanclar la médula espinal quirúrgicamente sin generar más daño. En el caso de los lipomas lumbosacros el objetivo es reducir la masa grasa para disminuir la compresión nerviosa, liberar el cordón terminal y cerrar la duramadre. Es imposible extraer completamente los lipomas sin producir daño neural. El momento de la cirugía es decisivo ya que si se interviene de manera precoz se puede favorecer la retracción del cono medular y mejorar el pronóstico neurológico[5].
La técnica anestésica de elección para la cesárea electiva en ausencia de contraindicaciones es la anestesia neuroaxial[10]. Su ventaja frente a la anestesia general es la capacidad de lograr una anestesia más efectiva sin necesidad de fármacos intravenosos, confiriendo mayor estabilidad hemodinámica y menores efectos secundarios en el feto. En el caso del SMA pueden existir tabiques fibróticos fusionados a estructuras epi- durales por lo que se dificulta la difusión del anestésico local tanto intradural como epidural, impidiendo alcanzar el nivel de analgesia deseado[11].
En estos casos no existe suficiente evidencia científica para recomendar un abordaje anestésico determinado. La resonancia magnética antes del parto puede ayudarnos a decidir, de manera que solo utilizaremos anestesia neuroaxial en casos seleccionados. No se recomienda la introducción de la aguja a través de lesiones o cicatrices. La anestesia intradural se puede utilizar cuando el cono medular no esté descendido ya que supone un riesgo alto de lesión medular directa con la aguja. En general, se debería evitar el uso de anestesia espinal en pacientes con diagnóstico de disrafia espinal cerrada[7],[12].
Los catéteres epidurales deben colocarse en un nivel anatómicamente normal con un ligamento amarillo intacto. Sin embargo, la analgesia puede ser incompleta si el espacio epidural ha sido alterado por una cirugía correctiva. No se pueden dar recomendaciones con respecto al bloqueo paravertebral, infusión continua intradural, opioides epidurales o catéteres epidurales por debajo de la lesión, ya que la experiencia clínica de estas técnicas es limitada[4].
La anestesia general se ha utilizado en pacientes con disra- fismo espinal de forma exitosa y sin incidencias[13]. La succinil- colina puede desencadenar hiperpotasemia en pacientes con miopatía o neuropatía, pero se ha utilizado con seguridad en numerosos casos de mielomeningocele fuera del embarazo[14]. En casos de cifoescoliosis severa, los volúmenes pulmonares reducidos se asocian con desaturaciones rápidas y la longitud traqueal corta predispone a la intubación selectiva del bronquio derecho[15].
Por todo ello, se realiza una anestesia general con el objetivo de evitar un efecto anestésico impredecible o un potencial daño medular durante la técnica neuroaxial.
-
Conclusiones
La anestesia neuroaxial podría utilizarse en casos seleccionados y tras un estudio exhaustivo de resonancia magnética. Síntomas tales como dolor de espalda, vejiga neurógena o alteraciones sensitivo-motoras, asociados a lesiones cutáneas lumbares suponen una alta sospecha de disrafismo oculto.
Se recomienda evitar la anestesia neuroaxial en pacientes diagnosticados de síndrome de médula anclada.
La anestesia general es la técnica de elección en cesárea electiva en estos pacientes.
Conflicto de intereses: Los autores declaran no tener conflictos de interés.
Este artículo no ha requerido ninguna financiación.
Referencias
1. Bhimani AD, Selner AN, Patel JB, Hobbs JG, Esfahani DR, Behbahani M, et al. Pediatric tethered cord release: an epidemiological and postoperative complication analysis. J Spine Surg. 2019 Sep;5(3):337–50. https://doi.org/10.21037/jss.2019.09.02 PMID:31663045
2. Pang D, Wilberger JE Jr. Tethered cord syndrome in adults. J Neurosurg. 1982 Jul;57(1):32–47. https://doi.org/10.3171/jns.1982.57.1.0032 PMID:7086498
3. Hoffman HJ, Taecholarn C, Hendrick EB, Humphreys RP. Management of lipomyelomeningoceles. J Neurosurg. 1985 Jan;62(1):1–8.. https://doi.org/10.3171/jns.1985.62.1.0001 PMID:3964839
4. Murphy CJ, Stanley E, Kavanagh E, Lenane PE, McCaul CL. Spinal dysraphisms in the parturient: implications for perioperative anaesthetic care and labour analgesia. Int J Obstet Anesth. 2015 Aug;24(3):252–63. https://doi.org/10.1016/j.ijoa.2015.04.002 PMID:26072279
5. Lew SM, Kothbauer KF. Tethered cord syndrome: an updated review. Pediatr Neurosurg. 2007;43(3):236–48. https://doi.org/10.1159/000098836 PMID:17409793
6. Kim J, Shin S, Lee H, Kil HK. Tethered spinal cord syndrome detected during ultrasound for caudal block in a child with single urological anomaly. Korean J Anesthesiol. 2013 Jun;64(6):552–3. https://doi.org/10.4097/kjae.2013.64.6.552 PMID:23814660
7. Kim YY, Song JW, Lim JH, Kim YS, Kwon YE, Lee JH. Nerve injury in an undiagnosed adult tethered cord syndrome patients following spinal anesthesia: A case report. Anesth Pain Med. 2015;10(3):171–4. https://doi.org/10.17085/apm.2015.10.3.171.
8. Giddens JL, Radomski SB, Hirshberg ED, Hassouna M, Fehlings M. Urodynamic findings in adults with the tethered cord syndrome. J Urol. 1999 Apr;161(4):1249–54. https://doi.org/10.1016/S0022-5347(01)61648-3 PMID:10081879
9. Pinto FC, Fontes RB, Leonhardt MC, Amodio DT, Porro FF, Machado J. Anatomic study of the filum terminale and its correlations with the tethered cord syndrome. Neurosurgery. 2002 Sep;51(3):725–9. https://doi.org/10.1097/00006123-200209000-00019 PMID:12188951
10. Morgan M. Anaesthetic contribution to maternal mortality. Br J Anaesth. 1987 Jul;59(7):842–55. https://doi.org/10.1093/bja/59.7.842 PMID:3304375
11. Scher EA, Ayad S. Complicated Neuraxial Anesthesia in a Patient With Tethered Spinal Cord. Cureus. 2021 Oct;13(10):e18705. https://doi.org/10.7759/cureus.18705 PMID:34790461
12. Liu JJ, Guan Z, Gao Z, Xiang L, Zhao F, Huang SL. Complications after spinal anesthesia in adult tethered cord syndrome. Medicine (Baltimore). 2016 Jul;95(29):e4289. https://doi.org/10.1097/MD.0000000000004289 PMID:27442670
13. Arata M, Grover S, Dunne K, Bryan D. Pregnancy outcome and complications in women with spina bifida. J Reprod Med. 2000 Sep;45(9):743–8. PMID:11027084
14. Dierdorf SF, McNiece WL, Rao CC, Wolfe TM, Means LJ. Failure of succinylcholine to alter plasma potassium in children with myelomeningocoele. Anesthesiology. 1986 Feb;64(2):272–3. https://doi.org/10.1097/00000542-198602000-00027 PMID:3946815
15. Alderson JD. Adult spina bifida. Anaesthesia. 2000 Jul;55(7):697–8. https://doi.org/10.1046/j.1365-2044.2000.01557-6.x PMID:10919433

 ORCID
ORCID