Eddisson Quispe Pilco1,*, Marjorie Calderón Lozano1, Estrella Garro Medrano2, Jorge Solsol Figueroa2, Virginia Albornoz Salas2
Recibido: 22-11-2022
Aceptado: 26-12-2022
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 4 pp. 415-418|https://doi.org/10.25237/revchilanestv52n04-15
PDF|ePub|RIS
Case report: Anesthesia for cesarean section in a patient with Proteus syndrome
Abstract
In pregnant women diagnosed with Proteus Syndrome, anesthetic management in cesarean delivery becomes a real challenge for the anesthesiologist, who must be prepared to approach a difficult airway or neuraxial access, due to the anatomical changes due to the presence of tumors or facial asymmetry, kyphoscoliosis and anatomical deformations produced by hamartomas on the thoracic and lumbar surfaces. Also, consider the importance of antithrombotic prophylaxis due to the high risk of deep vein thrombosis and pulmonary thromboembolism in this type of patient. To describe the anesthetic management by spinal technique of a pregnant woman with Proteus Syndrome. We present the case of a 34-week pregnant woman with Proteus syndrome undergoing cesarean section under spinal anesthesia. In addition, a literature review was carried out in this regard. Spinal anesthesia was an effective and safe technique in this patient, providing adequate sensory and motor blockade for cesarean section, without major hemodynamic changes, allowing rapid recovery and adequate postoperative pain control.
Resumen
En gestantes con diagnóstico de síndrome de Proteo, el manejo anestésico en parto por cesárea se convierte en un verdadero desafío para el anestesiólogo, quien debe estar preparado para el abordaje de una vía aérea o acceso neuroaxial difícil, por los cambios anatómicos debido a la presencia de tumores o asimetría facial, cifoescoliosis y las deformaciones anatómicas producidas por los hamartomas en la superficie torácica y lumbar. Además, considerar la importancia de la profilaxis antitrombótica por el alto riesgo de trombosis venosa profunda y tromboembolia pulmonar en este tipo de pacientes. Describir el manejo anestésico mediante técnica raquídea de una gestante con síndrome de Proteo. Presentamos el caso de una gestante de 34 semanas con síndrome de Proteo sometida a cesárea bajo anestesia raquídea. Además, se realizó revisión de literatura al respecto. La anestesia raquídea fue una técnica efectiva y segura en esta paciente, proporcionando un bloqueo sensitivo y motor adecuado para la cesárea, sin grandes cambios hemodinámicos, permitiendo una rápida recuperación y adecuado control del dolor posoperatorio.
-
Introducción
El síndrome de Proteo (SP) es una rara enfermedad genética que involucra al gen AKT1 siendo una mutación en mosaico[1], su incidencia aproximada es de 1: 1.000.000 de recién nacidos[1],[2], no muestra predilección por ningún sexo o raza[3]; se encuentra dentro del grupo de las enfermedades genéticas proliferativas, se diagnóstica generalmente en los primeros años de vida y puede ser muy difícil debido a sus múltiples formas de presentación[3].
El SP tiene gran variabilidad de presentación clínica, la principal es la proliferación de hamartomas en todo el cuerpo especialmente en tejidos conectivos y óseos ocasionando graves deformaciones y crecimiento asimétrico corporal[2], con presencia de tumoraciones en todo el sistema nervioso central (SNC), malformaciones arteriovenosas y a nivel de piel: nevos epidérmicos, nevos melanocíticos pigmentarios y lipomas[3]. Existe mayor riesgo de trombosis venosa profunda (TVP) y trom- boembolia pulmonar (TEP)[1],[2].
La mayoría de los conocimientos del SP derivan de los escasos casos clínicos reportados[1],[3]. Debido a su elevada morbimortalidad es muy difícil que estas pacientes lleguen a la edad adulta, siendo la gestación un evento muy inusual y de alto riesgo por los cambios fisiológicos que genera el embarazo principalmente en los sistemas respiratorio, cardiovascular y de coagulación[3].
El manejo anestésico del parto debe individualizarse dependiendo de los órganos y sistemas comprometidos, en caso de cesárea se debe decidir entre la anestesia general versus anestesia neuroaxial; sin embargo, debe corroborarse si la paciente está recibiendo tratamiento antitrombótico como heparina de bajo peso molecular que contraindicaría la anestesia neuroaxial en una cesárea de emergencia[2].
En caso de anestesia general, considerar vía aérea difícil por los cambios anatómicos en la vía aérea, debido a tumoraciones y asimetría facial que puede requerir el uso de videolaringoscopio y/o fibrobroncoscopia, los cambios propios del embarazo como edema de vía aérea, desplazamiento de estructuras respiratorias, rápida tendencia a la desaturación, aumento de los factores de coagulación y un estado de congestión venosa en miembros inferiores por compresión de la cava inferior, que aumenta más las probabilidades de TVP o TEP[1]. La anestesia neuroaxial puede ser de difícil acceso por la cifoescoliosis y las deformaciones anatómicas producidas por los hamartomas en la superficie torácica y lumbar[1].
Por lo anteriormente descrito y las pocas recomendaciones en la literatura sobre la conducta anestésica en gestantes con SP, presentamos el siguiente caso clínico.
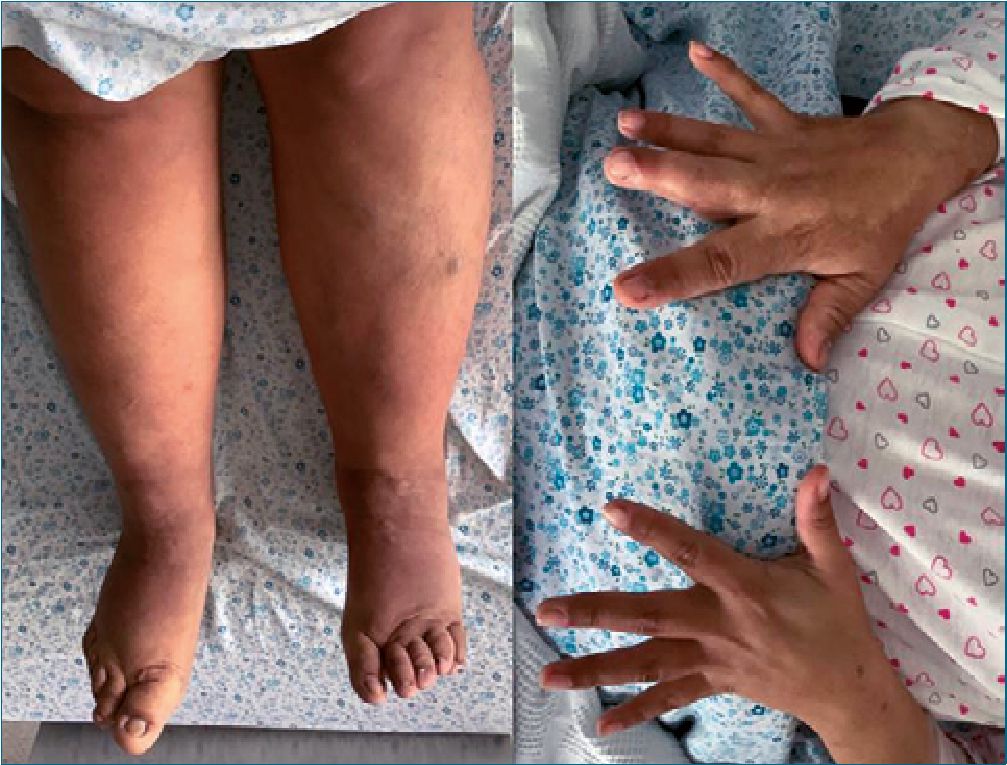
Figura 1. Crecimiento asimétrico de miembros superiores e inferiores con predominio derecho, evidenciándose macrodactilia en mano y pie derecho.
-
Descripción de caso
Segundigesta de 25 años con embarazo de 34 semanas y diagnóstico de síndrome de Proteo desde los 10 años, fue programada para cesárea de emergencia categoría 1, según clasificación de Lucas y col; con los diagnósticos de estado fetal no tranquilizador, feto en presentación podálica, retardo del crecimiento intrauterino (RCIU) severo y cesárea anterior.
Refirió antecedente de TVP en miembros inferiores a los 11 años y agenesia renal derecha; como antecedentes quirúrgicos tuvo múltiples cirugías ortopédicas en dedos de mano derecha por macrodactilia con anestesia general y una cesárea por preeclampsia con signos de severidad en su primer embarazo a los 18 años, donde recibió anestesia neuroaxial. La paciente no presentaba otros antecedentes personales ni familiares de importancia, realizaba sus actividades diarias con completa independencia. No consumo de alcohol, tabaco, drogas, ni alergias a medicamentos.
Al examen físico se evidenció asimetría facial con mayor crecimiento del lado derecho e hipertrofia parotídea derecha; en evaluación de vía aérea: apertura bucal > 3 cm, Mallampati modificado grado 3, distancia tiromentoniana > 6 cm; a nivel cardiovascular: latidos cardíacos rítmicos, no soplos; riesgo cardiológico grado 2 (score de Goldman); en la evaluación neumológica: murmullo vesicular se auscultaba bien en ambos campos pulmonares. Asimismo, se observó asimetría e hipertrofia en extremidades superiores e inferiores a predominio derecho con presencia de macrodactilia en mano y pie (Figura 1), ambas piernas mostraron signos de insuficiencia venosa; en la zona to- racolumbar presentaba múltiples tumoraciones adiposas y una marcada cifoescoliosis, dificultando la palpación de las apófisis espinosas vertebrales (Figura 2).
La fuerza muscular estaba conservada en extremidades y no presentaba ningún problema a la deambulación, no signos de focalización neurológica, orientada en tiempo, espacio y persona; refirió no tolerar mucho el decúbito dorsal por la presencia de tumoraciones. Se registró: presión arterial 164/99 mmHg, frecuencia cardíaca 82 latidos/minuto, frecuencia respiratoria 14 por minuto, SpO2:99% (Fio2 21%). En exámenes de laboratorio: grupo y factor B+, hemoglobina de 12 g/dl, tiempo de protrombina 10,2 segundos, tiempo de tromboplastina 30,3 segundos, recuento de plaquetas 187.000/mm3, fibrinógeno 424 mg/dl, glicemia 134 mg/dl, creatinina sérica 0,7 mg/dl y proteinuria negativa. La paciente fue clasificada como ASA 3.
Considerando que la paciente no había recibido profilaxis antitrombótica y la cirugía era de emergencia por el compromiso fetal, se optó por una anestesia raquídea, previo consentimiento firmado, explicando los riesgos y beneficios. Antes de iniciar la anestesia, se administró metoclopramida 10 mg EV, ranitidina 50 mg EV y dexametasona 8 mg EV, se verificó vendaje de miembros inferiores. Se realizó monitorización ASA básica, preparándose equipos y fármacos para probabilidad de anestesia general y vía aérea difícil en caso de no poder colocar la anestesia raquídea o de presentarse eventos adversos intraoperatorios.
Se procedió a colocar a la paciente en posición de estiramiento de isquiotibiales (Hamstring Strech), previa asepsia y antisepsia ubicó el espacio interespinoso lumbar más accesible y con menor superposición de tumoraciones, eligiendo el espacio L3-L4, con aguja raquídea Whitacre N.° 27, se accedió a espacio espinal al primer intento a 6 cm de profundidad de la piel (Figura 2), al confirmarse flujo de líquido cefalorraquídeo se administró bupivacaina hiperbárica 10 mg más morfina 100 mcg; se posicionó a la paciente en decúbito supino con late- ralización uterina de 15°, alcanzando un bloqueo sensorial a nivel de T4, no se observó variaciones de la frecuencia cardíaca y la presión arterial a los 10 minutos, quedando estabilizada en 120/70 mmHg, no se utilizó vasopresores.
El nacimiento fue a los 17 minutos del inicio de la anestesia con un recién nacido prematuro de sexo masculino, peso de 1.730 g, talla de 42,5 cm, edad por Capurro 34 semanas y AP- GAR 5-8 al minuto y 5 minutos. La cesárea duró 45 minutos, se registró sangrado intraoperatorio de 500 ml; no se reportaron eventos adversos ni complicaciones intraoperatorias; para la analgesia posoperatoria se administró paracetamol 1 g EV para complementar la morfina espinal; permaneció 3 h en recuperación sin presentar complicaciones, y el alta hospitalaria fue al tercer día postoperatorio, sin presentar eventualidades.
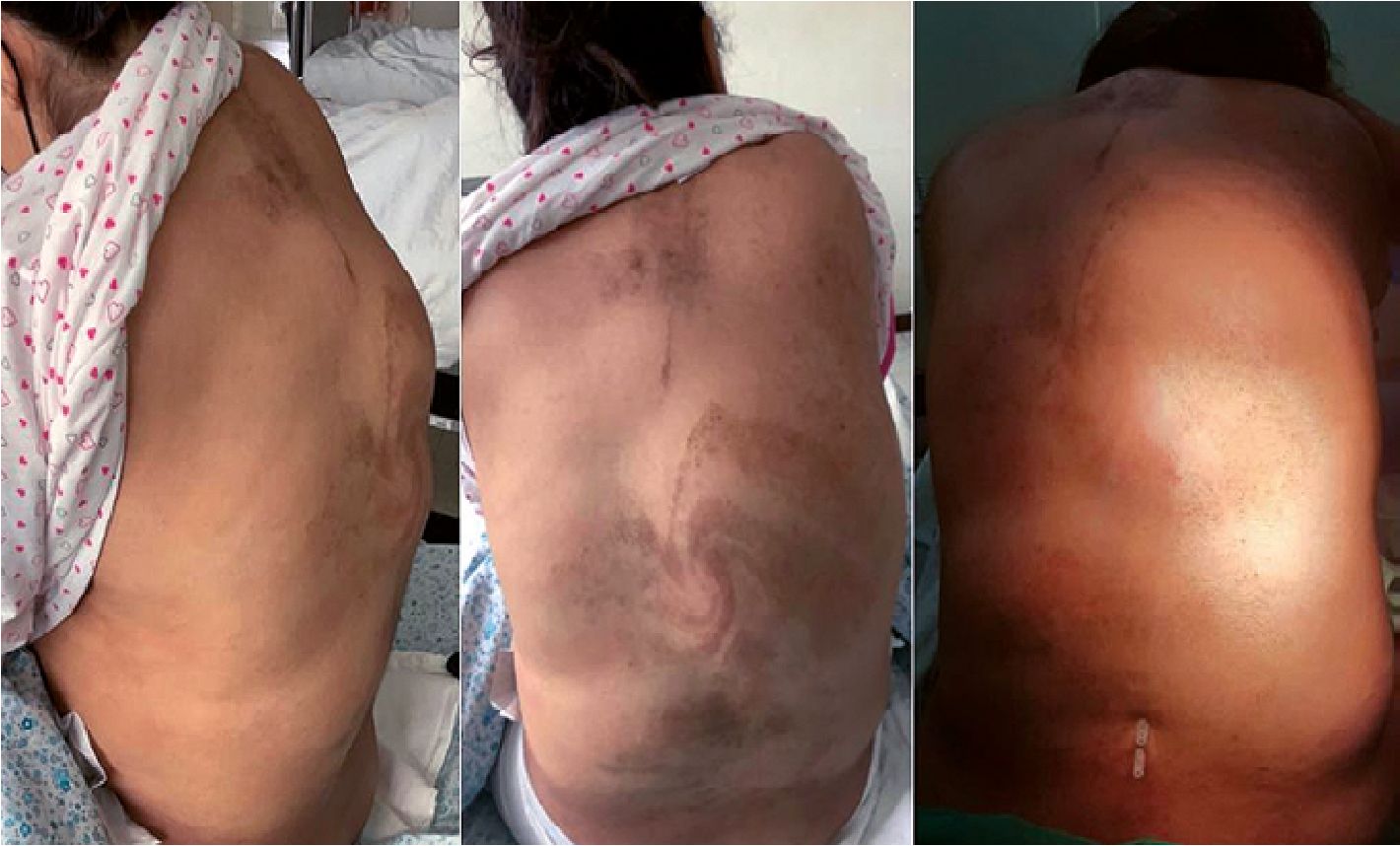
Figura 2. De izquierda a derecha. Primero, vista lateral con cifosis toracolumbar y tu- moraciones. Segundo, vista posterior evidenciándose la cifoescoliosis toracolumbar, nevos melanocíticos pigmentarios y tumoraciones a predominio derecho. Tercero, abordaje con aguja espinal en zona lumbar L3-L4, nótese que el acceso se realizó alejado de la línea media debido a escoliosis lumbar.
-
Discusión
Las gestantes con SP son casos muy raros y de difícil manejo anestésico por las múltiples formas de presentación clínica y la dificultad en el manejo de vía aérea, acceso neuroaxial y alta probabilidad de eventos tromboembólicos[2].
Se debe considerar una evaluación antenatal por un equipo multidisciplinario, para anticipar y prepararse para las posibles complicaciones del perioperatorio. En el caso del manejo anestesiológico, se debe disponer de imágenes de cabeza, cuello, tórax y columna vertebral por las múltiples malformaciones anatómicas, tumores de tejidos blandos y óseos que distorsionan la anatomía y dificultan tanto la intubación como el abordaje neuroaxial[2]. El problema con la paciente obstétrica es que estos exámenes están restringidos para evitar daño fetal por radiación, solo la resonancia magnética y la ecografía son seguras en último trimestre de la gestación; sin embargo, en nuestro caso la paciente entró para una cirugía de emergencia, y no disponía de exámenes de imágenes.
Con relación al manejo de la vía aérea, es importante tener un plan para abordarla, pues el SP tiene reportes de dificultad para la ventilación por la asimetría facial, tumoraciones, macrocefalia con hiperostosis craneal, hiperplasia gingival, macroglosia, epiglotis alargada, anomalías cervicales (escoliosis y torticolis fija), subóptima posición por la cifoescoliosis severa[2]. En nuestro caso, la paciente presentaba varias de las características anteriormente mencionadas, por lo cual se tenía el equipo de vía aérea difícil preparado ante cualquier eventualidad.
El abordaje del neuroeje también se considera un reto para el anestesiólogo, pues en el SP la asimetría de los cuerpos vertebrales y la cifoescoliosis es frecuente. El compromiso neurológico debido a la infiltración del canal raquideo por masas angiolipomatosas, estenosis por hipertrofia vertebral o hipertensión endocraneana por tumoraciones del SNC puede estar presente y contraindicaría el bloqueo neuroaxial. El ultrasonido es especialmente útil en estas pacientes pues permite realizar la técnica de una forma segura, evitando las complicaciones neurovasculares[6].
La paciente no presentaba signos de focalización o de compresión radicular, por este motivo se eligió la anestesia raquídea añadido al compromiso fetal que requería una anestesia de rápida acción, baja toxicidad y mínimo daño traumático en tejidos. Considerando la cifoescoliosis toraco-lumbar y que los tumores cubrían gran parte de la zona vertebral lumbar, se eligió la posición de estiramiento de isquiotibiales (Hamstring Strech), en lugar del decúbito lateral que frecuentemente se prefiere en la paciente obstétrica, porque permitía identificar mejor las referencias anatómicas.
Otro punto importante para considerar es la tromboprofilaxis perioperatoria, que es fundamental para evitar TVP y TEP[1],[7], pues la principal causa de muerte prematura es la TEP y la insuficiencia respiratoria aguda; siendo la mortalidad estimada de 25% antes de los 20 años[8].
Se ha descrito el uso de heparina de bajo peso molecular como la enoxaparina en el último trimestre de la gestación y en caso de una cesárea electiva se debería suspender por lo menos 12 h antes de la cirugía[1] y reiniciarla en el posoperatorio. En el caso descrito aún no se había iniciado tromboprofilaxis, esto facilitó la administración de anestesia neuroaxial, pues de haberse iniciado no se hubiese podido administrarse por el riesgo de hematomas raquídeo o epidural con grave compromiso neurológico.
Con relación al riesgo de sangrado intraoperatorio, se debe estar preparado para la administración de hemoderivados, debido al incremento de sangrado quirúrgico por las malformaciones vasculares subyacentes[1]; los fármacos antifibrinolíticos como el ácido tranexámico deben ser usados con precaución, pues teóricamente aumentan el riesgo de tromboembolismo que es común en este síndrome. Se menciona cierta predisposición de asociación del SP con las enfermedades hipertensivas del embarazo[3], como se vio en este caso, pero debido a la escasez de reportes aún no se puede establecer esta relación.
-
Conclusión
La anestesia raquídea fue una técnica efectiva y segura en esta paciente, proporciono un bloqueo sensitivo y motor adecuado para la cesárea, sin grandes cambios hemodinámicos, permitiendo a la paciente una rápida recuperación y adecuado control del dolor posoperatorio.
El manejo anestésico en gestantes con SP debe ser individualizado; el anestesiólogo debe estar preparado para el manejo de una vía aérea difícil y abordaje neuroaxial poco accesible;
la tromboprofilaxis y la deambulación precoz posoperatoria son esenciales para evitar complicaciones tromboembólicas; ante la presencia de hemorragias obstétricas valorar bien el riesgo beneficio del uso del ácido tranexámico.
Financiamiento: Los autores no recibieron patrocinio para realizar este artículo.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Referencias
1. Ranaei-Zamani N, Kaler MK, Khan R. Proteus syndrome in pregnancy: A case report. Obstet Med. 2021 Dec;14(4):253–6. https://doi.org/10.1177/1753495X20970791 PMID:34880940
2. Sethi D. Proteus syndrome: what the anesthetist should know. J Clin Anesth. 2015 Aug;27(5):419–22. https://doi.org/10.1016/j.jclinane.2015.03.038 PMID:25921368
3. Peña- Vega CJ, Ortiz-Jarillo J, Zavala-Barrios B. Síndrome de Proteus y embarazo. Reporte de un caso. Ginecol Obstet Mex. 2021; 89 (2): 151-159. https://doi.org/10.24245/gom.v89i2.4307
4. Alevizou A, Florou P, Batistaki C, Kostopanagiotou G. Anaesthesia and orphan diseases: airway management in Proteus disease. Eur J Anaesthesiol. 2017 Mar;34(3):180–1. https://doi.org/10.1097/EJA.0000000000000574 PMID:28141736
5. Hong JM, Lee HJ, Kim ES, Kim HK, Jeon S, Kim HJ. Bronchoscopic concerns in Proteus syndrome: a case report. Korean J Anesthesiol. 2016 Oct;69(5):523–6. https://doi.org/10.4097/kjae.2016.69.5.523 PMID:27703636
6. Kingwill AC, Lamacraft G. Ultrasound-guided neural blockade in Proteus syndrome. Southern African Journal of Anaesthesia and Analgesia. 2015;21(6):21–3. https://doi.org/10.1080/22201181.2015.1101993.
7. Keppler-Noreuil KM, Lozier J, Oden N, Taneja A, Burton-Akright J, Sapp JC, et al. Thrombosis risk factors in PIK3CA-related overgrowth spectrum and Proteus syndrome. Am J Med Genet C Semin Med Genet. 2019 Dec;181(4):571–81. https://doi.org/10.1002/ajmg.c.31735 PMID:31490637
8. Sapp JC, Hu L, Zhao J, Gruber A, Schwartz B, Ferrari D, et al. Quantifying survival in patients with Proteus syndrome. Genet Med. 2017 Dec;19(12):1376–9. https://doi.org/10.1038/gim.2017.65 PMID:28661492

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution