Julián Aliste1,2,3, Gonzalo Rivera3, Hans Erpel1,4,5
Recibido: 30-11-2022
Aceptado: 12-12-2022
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 2 pp. 142-151|https://doi.org/10.25237/revchilanestv5220121530
PDF|ePub|RIS
Abstract
Cesarean section is the most frequent surgery in the world and postoperative pain is commonly reported as moderate to severe. Thus, timely multimodal analgesia, based on systemic agents and neuraxial hydrophilic opioids, is the current recommended standard. The role of peripheral nerve blocks has accumulated some evidence on this subject. The most published blocks are the transverse abdominis muscle plane blocks, the quadratus lumborum muscle plane blocks, and the most recently described, the erector spinae muscle plane block. More classic blocks, such as thoracic paravertebral or ilioinguinal-iliohypogastric nerve blocks, have limited evidence in comparison. To date, peripheral blocks neither replace nor add to the analgesic role of neuraxial opioids in cesarean surgery. However, there is room to investigate these blocks in specific scenarios. For instance, studies looking for the benefits of more lasting blocks, their role as rescue alternatives for cases still in pain after a standardized treatment, and their pertinence in patients with a high risk of severe pain becoming a chronic entity are granted. Regardless of the technique, but especially in fascial plane injections, the vulnerability to local anesthetics’ systemic toxicity should be considered. Therefore, operators must follow the current guidelines for preventing and treating this complication.
Resumen
La cesárea es la cirugía más frecuente en el mundo y el dolor posoperatorio en esta cirugía es comúnmente reportado con intensidad moderada a severa. Una analgesia oportuna basada en multimodalidad de agentes sistémicos y opioides hidrofílicos neuroaxiales es el estándar recomendado actual. El rol de los bloqueos regionales periféricos ha acumulado cierta evidencia hasta la fecha. Los bloqueos con más evidencia publicada son el del plano del músculo transverso abdominal, luego aquellos en relación al músculo cuadrado lumbar y por último, el más recientemente descrito del plano de los músculos erectores de la columna. Bloqueos más clásicos como el paravertebral torácico o de los nervios ilioinguinal- iliohipogástrico poseen evidencia limitada en comparación. A la fecha, ningún bloqueo regional periférico ha demostrado poder reemplazar el rol analgésico de los opioides neuroaxiales en esta cirugía, sin embargo, aún existen ventanas abiertas para investigar ciertas alternativas en escenarios puntuales, como con bloqueos que aseguren mayor duración, rescate de dolor severo posoperatorio, pacientes con mayor riesgo de dolor severo o de su cronificación. Independiente del escenario en que estos bloqueos se utilicen no se debe olvidar que es una población de particular vulnerabilidad a desarrollar cuadros de toxicidad sistémica por anestésicos locales y por lo tanto se deben considerar las medidas de prevención y tratamiento actualmente recomendadas.
-
Introducción
La cesárea es la cirugía más frecuente en el mundo. En general, el dolor posoperatorio en esta cirugía es comúnmente reportado con intensidad moderada a severa, pudiendo así retrasar el retorno a la actividad habitual e incluso persistir y cronificarse[1]. Se ha descrito que el dolor severo puede estar presente en al menos una de cada 10 pacientes[2]. Más aún, el dolor severo podría estar presente entre 20% a 100% de las primeras 24 h posquirúrgicas. Adicionalmente, se ha reportado un tiempo medio (y rango intercuartílico) hasta la resolución del dolor y recuperación funcional de 21[14]-[27] y 27[19]-[40] días respectivamente[2]. De esta manera la indicación de una analgesia oportuna y adecuada adquiere una gran relevancia, y en la actualidad, similar a otras cirugías, es un pilar en protocolos específicos a procedimientos[3] y guías de recuperación acelerada posoperatoria[4]. Así, la evidencia sugiere que en contexto de una cirugía cesárea, en adelante “cesárea”, bajo anestesia neuroaxial, junto con una adecuada multimodalidad analgésica sistémica, el uso de opioides hidrofílicos neuroaxiales (OHNA), como morfina, es parte del manejo estándar[3]. Sin embargo, en escenarios clínicos donde estas drogas no puedan ser administrados por estas vías, existiría espacio para el uso de bloqueos regionales periféricos (BRP)[3]. En este artículo revisaremos los conceptos relevantes para la planificación y ejecución de estas técnicas regionales periféricas y su evidencia en el perioperatorio de cesárea.
-
Inervación relevante para una cesárea
En la actualidad, la mayoría de los partos por cesárea se realizan con una incisión horizontal (p. ej., Pfannenstiel o Joen-Cohen), que involucra los dermatomas T11 a T12. No obstante, durante la cirugía, la separación y retracción de los planos más profundos de la pared puede involucrar dermatomas hasta cuatro niveles más altos[5]. Además, el trabajo en la cavidad peritoneal intraabdominal y pélvica, demandará un bloqueo visceral más alto, el cual se aseguraría con bloqueo sensitivo a nivel dermatómico T4. Las fibras aferentes viscerales que conducen sensaciones dolorosas desde las vísceras situadas por encima de la línea de dolor de la pelvis siguen a las fibras simpáticas de forma retrógrada y ascienden a través de los plexos hipogástricos/aórticos, los nervios esplácnicos abdomino-pélvicos, los troncos simpáticos lumbares y los ramos comunicantes blancos, hasta alcanzar los cuerpos celulares en los ganglios sensitivos de nervios espinales torácicos inferiores y lumbares superiores[6]. Esta asociación física lleva a una común, pero errónea suposición de que el sistema nervioso simpático media el dolor visceral. Sin embargo, el aferente sensorial visceral y las neuronas simpáticas son funcionalmente distintas y separadas. Las neuronas simpáticas son puramente eferentes y no tienen ningún papel en señalización sensorial o nociceptiva visceral. Esta convergencia viscerosomática sería responsable del fenómeno de dolor referido[7]. Las fibras aferentes que conducen impulsos dolorosos desde vísceras o porciones de vísceras situadas por debajo de la línea de dolor de la pelvis siguen retrógradamente a las fibras parasimpáticas a través de los plexos pélvico e hipogástrico inferior y de los nervios esplácnicos pélvicos hasta alcanzar los cuerpos celulares en los ganglios sensitivos espinales de S2-S4[6]. Así, el bloqueo distal debiera ser idealmente tan bajo como S4 para asegurar un óptimo confort intraoperatorio.
-
Origen del dolor poscesárea
El dolor poscesárea consiste en una mezcla del originado desde la herida incisional y desde la contracción uterina[8]. Ambos orígenes diferirían tanto en los mecanismos fisiopatológicos como en sus respuestas farmacológicas. El estímulo nociceptor de la incisión es mediado por fibras C y fibras ligeramente mielinizadas A, pudiendo ser mantenido por sensibilización periférica y central. El dolor de la contracción-retracción uterina (entuertos), un tipo de dolor visceral, aparentemente gatillado por prostaglandinas, se transmite por fibras C exclusivamente[9].
Los bloqueos paraespinales como tales, podrían potencialmente bloquear el dolor somático y visceral, pero ningún efecto analgésico visceral puede ser atribuido a BRP más distales y esto último podría, más bien, estar mediado por un efecto sistémico del anestésico local (AL)[9].
Una adecuada analgesia regional periférica posoperatoria requiere la cobertura de los ramos ventrales y comunicantes de las últimas raíces torácicas y primeras lumbares, idealmente sin producir bloqueo motor de las extremidades inferiores que pueda dificultar la funcionalidad posoperatoria.
-
Bloqueos regionales periféricos en cesárea
Tomando en cuenta los estándares establecidos a la fecha para una óptima analgesia postoperatoria en cesárea, un bloqueo periférico debe cumplir algunos requisitos para ser incorporado de rutina en protocolos analgésicos. Más allá de lo básico en términos de seguridad y cobertura de región dolorosa involucrada (bilateralmente) y en el contexto de una analgesia multimodal sistémica completa, dicho bloqueo debe ser analgésicamente no-inferior a OHNA, e idealmente mejor en términos de efectos adversos. A la fecha, ningún bloqueo regional ha demostrado esto, y por lo tanto, no reemplazarían el rol de OHNA en cesárea.
Otro aspecto que podría cumplir un BRP en estas pacientes sería optimizar la analgesia dada por una multimodalidad sistémica más OHNA, sin embargo tampoco se ha demostrado este efecto.
Una tercera opción para BRP en este escenario, es cuando el uso de OHNA, ya sea por una preferencia local o franca contraindicación, no pueden ser utilizados. En este ámbito algunas técnicas poseen más evidencia que otras e incluso existen estudios comparando diferentes bloqueos.
Un cuarto, aunque más rebuscado y muy poco frecuente escenario, podría ser conducir una cesárea exclusivamente bajo bloqueos regionales en el contexto de un elevado e intolerable riesgo al utilizar anestesia neuroaxial o general.
-
¿Qué sabemos de los bloqueos periféricos en cirugías de tronco?
Los bloqueos de la pared abdominal dependen de la difusión del anestésico local dentro de los planos músculofasciales para anestesiar múltiples pequeños nervios o plexos, en lugar de apuntar a estructuras nerviosas específicas[10].
La pared abdominal anterolateral se extiende desde las líneas axilares posteriores. Los límites superiores son el margen costal de la séptima y décima costilla, y el proceso xifoides del esternón. Los límites inferiores están en las crestas ilíacas, ligamento inguinal, y sínfisis pubiana. La pared abdominal está constituida por capas de tejidos desde afuera hacia dentro que incluye piel, tejido subcutáneo, músculos abdominales y las aponeurosis asociadas, fascia transversalis, grasa extraperito- neal y peritoneo parietal[10].
Comprender la estructura de la pared abdominal posterior es esencial para algunos bloqueos. La fascia toracolumbar (FTL) es una estructura tubular compleja de aponeurosis combinadas y capas fasciales que recubren los músculos profundos de la espalda y, como su nombre indica, se extiende desde la región lumbar al tórax. Esta fascia se divide en 3 capas (aunque para algunos autores solo en dos): las capas posterior y media encierran los músculos erectores de la columna (MEC), y las capas media y anterior encierran el músculo cuadrado lumbar (MCL), músculo que se extiende entre la doceava costilla y la cresta ilíaca. Medial y anterior al MCL se encuentra el músculo psoas mayor. Las capas posterior y media de la FTL se fusionan hacia lateral para unirse con las aponeurosis del músculo oblicuo interno (MOI) y del musculo transverso abdominal (MTA)[10].
La pared abdominal anterior está inervada por los nervios toracoabdominales y los nervios ilioinguinal (NII) e iliohipogástrico (NIH). Los nervios toracoabdominales se originan en las ramas anteriores de los 7 nervios espinales torácicos inferiores (T6-T12) y son la continuación de los respectivos nervios intercostales. Cada uno de ellos emite una rama cutánea lateral en la línea axilar media, que se superficializa para entrar en los tejidos subcutáneos a lo largo de la línea axilar anterior e inerva la pared abdominal lateral. Las ramos anteriores emergen del margen costal y viajan en el plano del MTA[10], Donde forman un plexo altamente interconectado. Las ramas cutáneas anteriores terminales entran en la vaina del recto por su margen lateral y profundo. Una vez más, los nervios se ramifican y se comunican para formar un plexo en la vaina, antes de superficializarse y entrar en el tejido subcutáneo de la pared abdominal anterior.
Los bloqueos de la pared abdominal son, por lo tanto, una opción adecuada en pacientes obstétricas. Sin embargo, la mayoría de estos sólo serían efectivos contra el dolor incisional somático y no contra el dolor uterino visceral profundo, lo cual constituye un factor a considerar en caso de indicarse como rescate en dolor posoperatorio, debiendo considerar el carácter del dolor descrito[10]. Los rangos de extensión que alcanza un AL inyectado en un plano fascial puede variar hasta seis veces entre pacientes en estudios con resonancia nuclear, dependiendo de factores técnicos y anatómicos individuales. Así, mientras más cerca se inyecte de las fibras que se desea bloquear, debieran obtenerse mejores resultados. No obstante, algunos resultados clínicos sugieren que pueden existir efectos lejanos a sitios iniciales de inyección, habiéndose ya demostrado cierto grado de extensión a planos cercanos o difusión por gradiente entre tejidos (ki jin chin). Sin embargo, estos hallazgos aún no explican los efectos analgésicos obtenidos en algunos estudios, cobrando valor para algunos el posible efecto sistémico del AL inyectado a nivel interfascial. A la fecha de hoy se desconoce si los peak plasmáticos y concentraciones logradas en el tiempo, luego de un bloqueo de tronco, consiguen los efectos analgésicos sistémicos conseguidos con infusiones de lidocaina.
-
Morfina neuroaxial, el estándar actual de la analgesia regional postoperatoria en cesárea
La morfina intratecal (MIT) se describió por primera vez para la analgesia obstétrica a principios de la década de 1980 y siendo ampliamente utilizada para la analgesia en cesárea debido a su prolongado efecto analgésico, aunque con efectos secundarios como náuseas, vómitos, prurito, sedación y depresión respiratoria que, al igual que la analgesia, varían según la dosis utilizada[11]. Un metaanálisis reciente mostró que en cirugía abdominal la morfina intratecal disminuyó el consumo equivalente de morfina endovenosa a las 24 y 48 h en 18 mg y 25 mg, respectivamente[12]. El nivel de dolor en reposo y esfuerzo se redujo en el grupo de opioides intratecales después de 24 h, extendiéndose el beneficio durante el esfuerzo después de 48 h. Además, se evidenció diferencias intraoperatorias y en el tiempo a la primera demanda analgésica. Cuando se excluyeron estudios con dosis atípicamente altas, no se detectó un mayor riesgo de náuseas o sedación, pero sí de prurito[12]. Otro metaanálisis, enfocado en uso de MIT en cesárea, muestra que dosis altas (100-250 mcg) prolongan 4,5 h la analgesia después del parto por cesárea en comparación con dosis más bajas (50100 mcg) pero con un mayor riesgo de prurito y vómitos[11]. Por otra parte, la complicación más temida de los opioides neuroaxiales es la depresión respiratoria tardía. En una revisión sistemática se estimó que la incidencia de depresión respiratoria clínicamente significativa con dosis habituales de morfina neuroaxial osciló entre 1,63 por 10.000 y 1,08 por 10.000[13].
La Sociedad de Anestesia Obstétrica y Perinatología recomienda que con dosis bajas de MIT (0,05 a 0,15 mg) o morfina epidural (1 mg a 3 mg) en parturientas sanas de bajo riesgo, es razonable monitorear la frecuencia respiratoria y nivel de sedación cada 2 h durante 12 h después de la cirugía[14]. Un estudio recientemente publicado, con protocolo de analgesia multimodal, comparando analgesia posoperatoria entre hidromorfona (75 mcg) y morfina (150 mcg) intratecal demostró que con ambos opioides se logran áreas bajo la curva de dolor en reposo, dinámico y máximo en 36 h posoperatorias de 1,8-1,5, 3,7-3,8, y 4,5-4,5, respectivamente. El consumo opioide de rescate, en equivalentes a morfina oral (aproximadamente un tercio de potencia de morfina endovenosa) en 24 h fue de 30 mg y 22 mg en cada grupo, respectivamente. MIT se asoció a 23% de náuseas significativas y 13% de prurito, sin evidencia de depresión respiratoria, y sin diferencia con hidromorfona[15]. De esta manera podríamos utilizar estos resultados para entender lo que necesitamos conseguir con un bloqueo que pretenda reemplazar la MIT, o lo que debe superar la adición de un bloqueo a un protocolo que ya la incluya.
-
Bloqueos regionales periféricos para cesárea
-
Bloqueo paravertebral (BPV)
El BPV cubre la inervación de la pared abdominal otorgada por los nervios toracoabdominales inferiores (T6-T12) pero no siempre es suficiente para la incisión de Pfannenstiel la cual puede requerir una adecuada cobertura de L1[16]. La técnica del BPV original, guiado por reparos anatómicos, es relativamente estándar pudiendo ejecutarse en dosis única o en infusión continua, uni o bilateralmente y con punción uni o multinivel. En general, bloqueos multinivel logran mayor consistencia abarcando mayor extensión de niveles con bloqueo dermatómico[17]. En una cesárea con incisión Pfannensteil, lo ideal sería utilizar un BPV bilateral T12-L1, lo cual bloquearía el dolor originado desde la incisión parietal, y dependiendo de la extensión cráneo caudal (T10-L2) en ramos comunicantes de la cadena simpática, pudiera permitir analgesia en dolor visceral. La duración analgésica está descrita entre 9-12 h, sin embargo, a diferencia de lo ocurrido en otros bloqueos, este aspecto no se ha estudiado debidamente con el uso de coadyuvantes que prolonguen el efecto del AL[18].
A la fecha no existen ensayos clínicos comparando este bloqueo con opioides intratecales u otros bloqueos regionales en cesárea que permitan mayor análisis de su utilidad[19].
-
Bloqueos del plano del músculo transverso del abdomen (TAPB)
Desde la descripción de Rafi en 2001, el TAPB se ha convertido en uno de los bloqueos de tronco más comúnmente realizados para proporcionar analgesia posoperatoria en cirugía abdominal abierta y laparoscópica[20]. El TAPB es una técnica que permite el bloqueo de los nervios toracoabdominales en su recorrido por este plano miofascial y que, dependiendo de la técnica utilizada, puede cubrir desde T6 a L1. No obstante, con las técnicas lateral y posterior, lo habitual es una cobertura sólo más consistente a nivel infraumbilical. En la técnica lateral guiada por ultrasonido, el transductor se coloca perpendicular a la línea medioaxilar entre el margen costal y la cresta ilíaca para identificar la tres capas de músculos (de superficial a profundo): músculo oblicuo externo (MOE), MOI y MTA. Usando un abordaje en plano con el ultrasonido, la punta de la aguja y la inyección se ejecuta en la línea medioaxilar (Figura 1). Sin embargo, en cesárea, el abordaje lateral anestesiaría menos dermatomas, resultando en menor calidad analgésica comparado con el abordaje posterior (actualmente, conocido como bloqueo cuadrado lumbar lateral)[20]. Se debe saber que la calidad de las imágenes ultrasonográficas del plano fascial entre el MOI y el MTA para TAPB en embarazadas puede diferir de las no embarazadas y también cambiarían posterior a la cesárea[16]. La gran desventaja de TAPB es que no proporciona analgesia visceral y, en comparación con otros bloqueos troncales, resultaría en una concentración sérica máxima de AL 50% más rápida[20]. Curiosamente, muchos casos de toxicidad sistémica por AL se han originado en ensayos realizados en cesárea. En esta población, el cálculo de la dosis del AL debería basarse idealmente en la masa magra en lugar de la real. La epinefrina (hasta 5 pg/ml) ha demostrado disminuir en 35% la concentración plasmática máxima junto con retrasarla. En términos de volumen, desde 15 mL se lograría mejor extensión cefalocaudal del AL en el TAP[20]. Por otro lado, según un metaanálisis, dosis mayores a 50 mg de bupivacaina por lado, no determinarían ventajas analgésicas[21].
Un metaanálisis que incluyó 1.094 pacientes randomizadas a TAPB mostró una disminución media del consumo de morfina endovenosa en cesárea de 9 mg y 12 mg comparado con placebo y con ausencia de intervención, respectivamente. Además, reportó una disminución de dolor estático a 24 h posoperatorias de menos de un punto en escala de dolor al comparar contra placebo[19]. Una revisión reciente remarca el hecho de que el abordaje posterior sería mejor opción. Además, indica que la menor duración del efecto del TAPB en comparación con OHNA sería una factor a considerar al analizar los estudios comparativos. En esta línea, aún no existe suficiente evidencia valorando el efecto de coadyuvantes que prolonguen el bloqueo o con el uso de catéteres[22]. Sin embargo, un estudio que comparó OHNA más TAPB con bupivacaina versus bupivacaina de depósito liposomal, mostró un beneficio analgésico en este último grupo a 72 h. A futuro, el rol del rescate con TAPB en pacientes con dolor incisional agudo, persistente o crónico merece mayor estudio después de la publicación de reportes favorables en esta línea.
-
Bloqueo del cuadrado lumbar (BCL)
El BCL inicialmente se describió como un TAPB posterior, inyectando en relación a la aponeurosis del MTA, lateral al MCL[23]. Esto permitiría bloquear consistentemente los nervios iliohipogástrico (IH), ilioinguinal (II) y subcostal, antes de la emergencia de sus ramos cutáneos laterales[23]. Además, se ha descrito el potencial de difusión del AL hacia el espacio paravertebral torácico, con posible rol analgésico visceral pero con evidencia aún controversial.
Actualmente, se describen cuatro tipos de BCL según el punto de inyección respecto al músculo (Figura 1). El BCL lateral o BCL 1, con inyección profunda a la aponeurosis del MTA, lateral al MCL. El BCL posterior o BCL 2, con una inyección profunda entre el músculo erector de la columna (MEC) y el MCL. El BCL transmuscular o anterior, o también conocido como BCL 3, inyectando posterior al músculo psoas mayor. Por último, el BCL intramuscular o BCL 4, donde el anestésico se inyecta directamente en el espesor muscular[24]. En los abordajes lateral y posterior, el bloqueo se extendería a los dermatomas T7 a L1, el anterior abarcaría T10 a L4, y la técnica intramuscular cubriría T7 a T12[15]. No obstante, la cobertura dermatómica del BCL es inconstante. Además, la ultrasonografía de los planos tisulares en pacientes no embarazadas y embarazadas, y entre estas últimas, pre y poscesárea también puede variar considerablemente.
Como probablemente la extensión paravertebral torácica es esencial para la eficacia del BCL anterior, se han generado varias modificaciones para potenciarla. Así, el abordaje transmuscular que se realizó originalmente a nivel del proceso transverso L3-L4, ahora se recomienda en una ubicación más medial y craneal buscando difusión torácica. Se han descrito también las aproximaciones paramediana transversa oblicua y subcostal. A pesar de estas variantes técnicas, a la fecha la evidencia es aún débil en demostrar consistentemente logren su cometido.
Sin duda, pareciera que lo más relevante en estos bloqueos sería asegurar la difusión del anestésico entre el epimisio del MCL y la fascia transversalis[7]. Sin embargo, no hay estudios de este abordaje en cesárea, lo cual es técnicamente difícil dado que una sonolocalización precisa de estas estructuras en general es complejo.
Una revisión reciente que incorporó diferentes tipos de BCL, principalmente el posterior, y sin poder realizar análisis de subgrupos, demostró que en ausencia de OHNA, este bloqueo disminuye el consumo opioide a 24 y 48 h, en 14 mg y 20 mg respectivamente. En presencia de OHNA no habría beneficio demostrado a la fecha más allá de las 6 h posoperatorias[22]. El único estudio que comparó abordajes, mostró cierta superioridad de la versión transmuscular respecto a la posterior, en términos de dolor posoperatorio[24]. Vale la pena señalar que la mayoría de los estudios hasta la fecha se han visto limitados por la ausencia de una analgesia multimodal estandarizada postoperatoria.
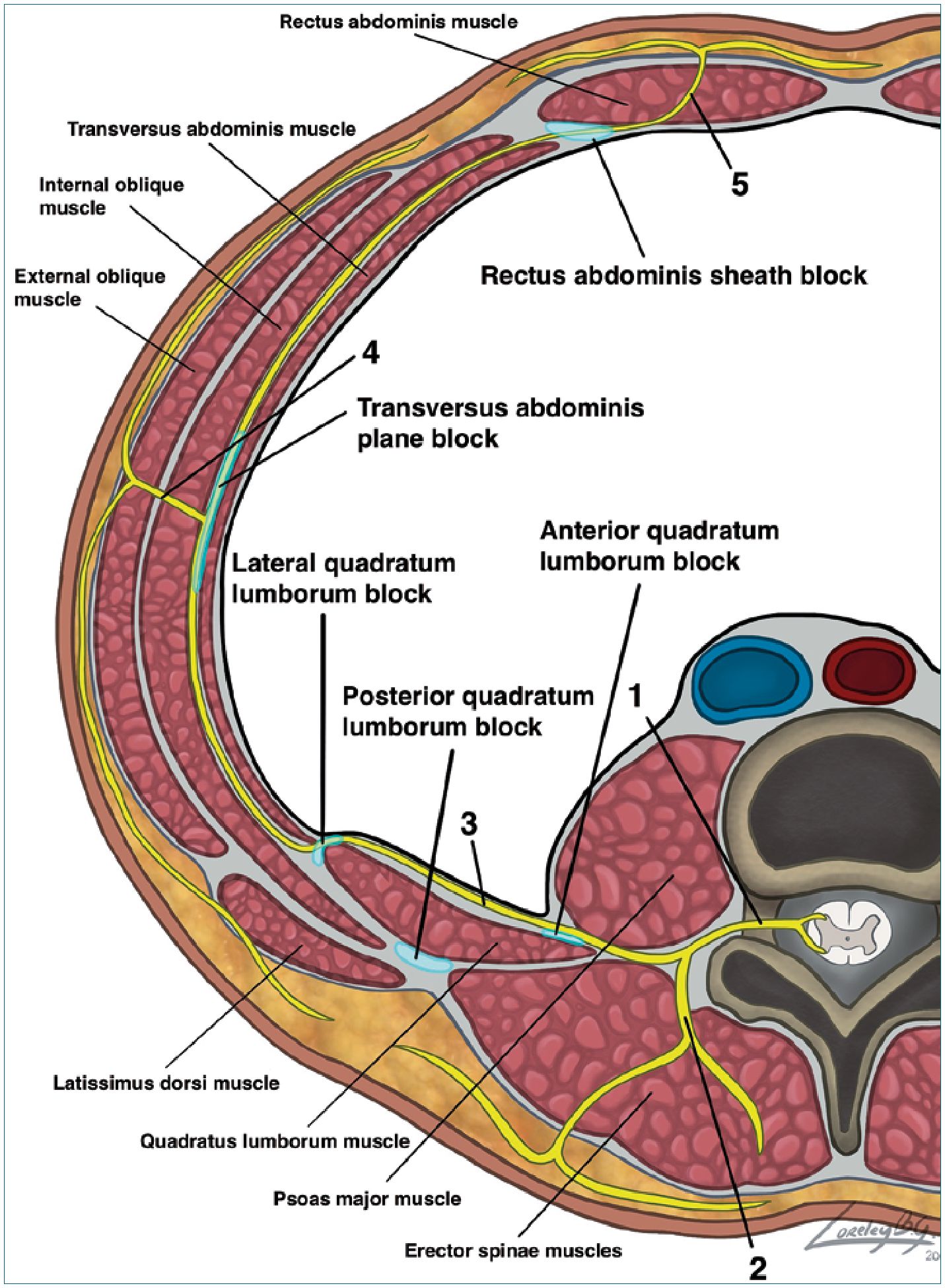
Figura 1. Esquema de planos musculares de la pared abdominal posterior y antero lateral con los puntos de depósito de anestésico local para los bloqueos TAPB, BCL 1-2-3 y bloqueo de la vaina del recto.
-
Bloqueo Ilioinguinal-iliohipogástrico
Los nervios II e IH perforan el MTA, superior y medial a la espina ilíaca anterosuperior (EIAS). El nervio IH proporciona inervación sensorial a la piel sobre la región inguinal y el nervio II entra en el canal inguinal y proporciona inervación sensorial a la piel del escroto o los labios mayores y la parte media del muslo. La rama ventral perfora el músculo oblicuo interno proporcionando inervación a los músculos oblicuos interno y externo, luego perfora los músculos oblicuos externos y proporciona inervación sensorial de la región suprapúbica. Los nervios II e IH pueden originarse entre T12 a L3 en 35% de los casos[15]. En la versión guiada por ultrasonido de este bloqueo, el transductor se coloca en la línea entre el EIAS y el ombligo; el anestésico local se deposita entre los planos del MTA y del MOI.
A la fecha, los estudios publicados analizando este bloqueo en cesárea son en su mayoría sin guía de ultrasonido, con elevado riesgo de sesgo al carecer de registro prospectivo y, con protocolos y resultados difíciles de comparar[22]. Similarmente a los bloqueos previamente descritos, habría más claridad de beneficios en ausencia de OHNA.
-
Bloqueo del plano erector espinal (ESPB)
En este bloqueo, se deposita el anestésico local entre la fascia de los músculos erectores de la columna (MEC) y las apófisis transversas de las vértebras torácicas o lumbares, lo que produce una difusión variable en este y otros planos (cefalocaudal, medial-lateral y antero-posterior), con bloqueo más constante en los ramos dorsales de los nervios segmentarios próximos a la inyección, y más variable en los ramos ventrales, esto último aparentemente asociado a la densidad de las barreras a anatómicas. Estas barreras anatómicas serían más permeables a nivel torácico alto y cervical, y prácticamente impermeables a nivel lumbar, impidiendo así la difusión del AL hacia los ramos ventrales a este nivel[25].
A la fecha, se han publicado seis ensayos clínicos evaluando ESPB en cesárea. De estos, tres poseen problemas serios con su registro público y por lo tanto, también en el riesgo de sesgo en sus resultados[26],[27],[28]. En todos los estudios, el ESPB fue a nivel de T9 y en ninguno se asoció un esquema analgésico multimodal[26],[27],[28],[29],[30],[31]. Un estudio de 140 pacientes que lo comparó con MIT no mostró diferencias en dolor a 8 h e incluso resultó en menor consumo de analgesia de rescate, aunque clínicamente poco relevante[26]. Dos estudios lo compararon contra nada en ausencia de MIT demostrando beneficios estadísticamente significativos aunque con cuestionable superioridad clínica[28],[31]. ESPB podría ser superior a las versiones lateral y posterior del TAPB[27],[29], pero al compararlo con BCL anterior las diferencias encontradas en términos de duración y calidad analgésica, como en requerimientos de rescate, podrían ser descrita como marginales[30].
-
Coadyuvantes y moléculas de liberación prolongada
Los coadyuvantes más utilizados actualmente para potenciar el efecto analgésico de AL en bloqueos periféricos son dexametasona y dexmedetomidina[32],[33]. Aún no existe certeza de como consiguen este efecto, pero se sabe que puede lograrse adicionándolos por vía intravenosa o mezclado con los AL, aunque pareciera que su inyección perineural reportaría algunas horas de mayor duración analgésica[34],[35]. Dexametasona perineural sería superior a dexmedetomidina[36] y la mezcla de ambos superaría el efecto de dexametasona sola[18]. Esta evidencia deriva de estudios en plexo braquial, siendo la originada en bloqueos de tronco más difícil de interpretar dado que, como se revisó anteriormente, en general tanto el bloqueo motor y sensitivo son de difícil evaluación en el tronco y, por otro lado, en las cirugías toracoabdominales el dolor no sólo se origina a nivel parietal. En cesárea existen estudios que han comparado el uso de estos coadyuvantes en bloqueos y reportan cierto beneficio, sin embargo, a la fecha no se han publicado ensayos que comparen bloqueos con coadyuvantes en contexto de uso de MIT[37],[38],[39],[40].
A pesar de una gran expectación inicial con la aparición de bupivacaína liposomal (BL) para el bloqueo de nervios periféricos, a la fecha, ésta no ha logrado demostrar superioridad consistente sobre bupivacaína o bupivacaína con dexametasona en bloqueos periféricos que permiten fácilmente objetivar bloqueo motor, sensitivo y analgesia[41],[42],[43]. En cesárea, BL ha sido utilizada en bloqueos TAP en investigando su adición a MIT, contra MIT más bloqueo y sin MIT. Así, BL ha mostrado aportar en la analgesia posoperatoria al utilizarse en conjunto con MIT y un protocolo analgésico multimodal[44]. Sin embargo, al comparar MIT más un TAPB con BL contra sólo un TAPB con BL, esta última opción fue inferior[45]. Un estudio comparó un grupo con MIT contra TAPB con BL y contra MIT más TAPB con BL en términos de consumo opioide de rescate. A las 24 h TAPB con BL fue inferior a MIT y MIT más TAPB con BL. Esta inferioridad desapareció a las 48 – 72 h. Destaca, no obstante, que luego de las 24 h los grupos con BL no superaron al grupo de MIT tomando en cuenta la supuesta duración de 72 h de este compuesto. Vale la pena mencionar que en estos tres estudios los autores poseen conflictos de interés asociados a la empresa que comercializa BL, hecho que ha sido expuesto en estudios que no han encontrado diferencias clínicamente relevantes en favor del componente una vez que han sido excluidos los trabajos con conflictos de interés[46],[47].
-
Toxicidad por anestésicos locales
Los niveles plasmáticos reducidos de glicoproteína ácida al en el embarazo favorecen una mayores concentraciones de anestésico local libre con peaks más altos luego de un bloqueo regional. Esto pueden predisponer a la toxicidad sistémica del anestésico local. Como se describió previamente, un porcentaje importante de los casos informados de toxicidad son en esta población, existiendo reportes con bloqueos regionales periféricos. En esta línea, es esencial que ante la ejecución de bloqueos regionales se tomen las medidas de prevención y manejo de esta situación según las recomendaciones vigentes[48].
-
Dolor crónico postquirúrgico en cesárea
El desarrollo de dolor crónico postquirúrgico (DCPQ), es decir, que permanece por más de 3 meses luego de la cirugía, constituye una complicación no infrecuente en cirugía general. Conceptualmente, corresponde a un dolor que se extiende más allá del tiempo de cicatrizado del tejido normal y que no se explica por patologías o complicaciones quirúrgicas[49]. La prevalencia de DCPQ varía según la naturaleza del insulto quirúrgico, el tiempo transcurrido desde la cirugía, pero también de acuerdo con los criterios utilizados para la clasificación de los pacientes. Altas prevalencias se reportan en estudios que incluyen cualquier reporte de dolor independiente de la intensidad. No obstante, cifras de prevalencias más bajas son típicamente observadas cuando otros criterios distintos a solo dolor (ej., discapacidad) son incluidos en la clasificación[50].
La prevalencia reportada de DCPQ en cirugía general va desde el 5% a más del 50% en población adulta, dependiendo del tipo de cirugía[5l]. En operación cesárea, la prevalencia DCPQ es relativamente baja y se situaría en los rangos entre el l% y el l8% de las pacientes[52], sin embargo, dado que la cirugía es muy frecuente, estas cifras podrían representar importantes consecuencias en consideraciones de salud pública.
El mecanismo por el cual el DCPQ puede desarrollarse luego de una cesárea, no ha sido estudiado específicamente, sin embargo, al igual que en otras situaciones quirúrgicas los factores involucrados pueden ser de características biológicas, psicológicas y genéticas interactuando en un momento dado[53]. Luego de la fase aguda, la progresión del dolor hacia la cronicidad se presume que se relaciona con daño de nervios periféricos, los cuales son seccionados o elongados debido a la manipulación quirúrgica, con ello se descargan señales repetidas de impulsos que estimulan vías glutamatérgicas que sensibilizan las vías nociceptivas en el sistema nervioso central. Estos efectos se asocian a la producción de neurotoxinas, activación de respuesta inflamatoria neuroinmune, activación de macrófagos y eventualmente modificación de expresión de genes que afectan la función de conexiones a nivel de médula espinal[54]. Clínicamente, el DCPQ puede tener características inflamatorias y neuropáticas. Usualmente, los signos inflamatorios (ej, enrojecimiento, hinchazón) disminuyen en pocas semanas y responden satisfactoriamente a medicación regular. No obstante, el componente neuropático puede hacerse predominante y persistir por largos períodos, siendo comúnmente refractario a analgésicos comunes[55]. El dolor neuropático, usualmente es continuo, como una sensación de quemadura superficial, puede incluir sensación de anestesia en la piel y también puede expresarse como dolor eléctrico o punzante en crisis breves de variada intensidad. El signo cardinal está constituido por la alodinia (dolor ante estímulos no dolorosos), la cual puede ser evidenciada incluso por tacto leve.
Es evidente que sólo una reducida fracción de las pacientes desarrollan DCPQ luego de una cesárea. No es claro cómo ni cuáles pacientes evolucionarán hacia la cronicidad. En este sentido, la literatura disponible ha delineado algunos factores de riesgo asociados a la ocurrencia de DCPQ en cesárea. La evidencia suele ser escasa, imprecisa y derivada de estudios se seguimientos (algunos prospectivos, pero la mayoría retrospectivos), por lo que la extrapolación debe realizarse con cautela.
-
Factores de riesgo para el desarrollo de DCPQ en cesárea
Se han descrito varios factores de riesgo para la ocurrencia de DCPQ en cirugía general, siendo varios de ellos también encontrados jugando un papel en la persistencia de dolor luego de la cesárea. La experiencia del operador, incluida su formación como médico o como asistente clínico (realiza la cirugía con capacitación sin ser médico como sucede en varios países africanos) no ha logrado impactar en la incidencia de DCPQ en ambientes subdesarrollados[56]. Similar a otras situaciones quirúrgicas, la evolución con dolor severo (EVA mayor o igual a 5) durante los primeros 7 días posteriores a la cesárea ha mostrado de manera consistente ser el factor de riesgo (RR 1,1 – 2,7) más relevante para presentar dolor a los 3 meses en estudios prospectivos[57],[58],[59]. Así es como el dolor agudo posoperatorio se transforma en el predictor más robusto de dolor crónico en tal periodo: “…el dolor predice dolor”[53]. Asimismo, los factores de riesgo del ámbito psicológico han sido asociados a aumentos en la incidencia de DCPQ luego de cesáreas. La presencia de depresión en el embarazo o en el período posparto, así como altos niveles de ansiedad preoperatorios aumentan significativamente la posibilidad de cronificación del dolor, no sólo en operación cesárea, sino que también posterior a otras cirugías[52],[60],[57]. Si bien no existen datos dirigidos en cesárea de que los síndromes de estrés postraumáticos, personalidades introvertidas o catastrofistas, constituyan factores de riesgo de DCPQ como en otros escenarios quirúrgicos[61], la información disponible permite sugerir cierta relación entre el efecto del ambiente sicológico durante el período perioperatorio y la ocurrencia de persistencia de dolor en el período posoperatorio. Por lo anterior, el adecuado manejo de los factores psicológicos o siquiátricos durante y posterior al embarazo podrían ser relevantes a la hora de tratar disminuir complicaciones como dolor o discapacidad crónica.
Diversos otros factores han sido adicionalmente asociados a la ocurrencia de DCPQ en cesárea entre los cuales se encuentran el hábito tabáquico en el embarazo, el eventual efecto analgésico protector de la oxitocina y algunos polimorfismos de genes asociados a la respuesta a analgésicos sistémicos, sin embargo, los resultados no han sido concluyentes y se requiere más información como para precisar el papel de estos factores en la práctica clínica[62].
-
Estrategias de prevención de DCPQ en operación cesárea
La cesárea es una cirugía que está fuertemente estandarizada en sus etapas y manejo en todo el mundo. Ya se ha hecho mención que el manejo de los factores psicológicos podría contribuir a un mejor resultado en términos de reducción de la persistencia de dolor posterior al procedimiento. Las técnicas regionales de anestesia y analgesia, fundamentalmente las técnicas neuroaxiales son usadas en más del 90% de las cesáreas actualmente y aunque estas técnicas han demostrado disminuir el riesgo de DCPQ en otros escenarios quirúrgicos (ej, epidurales torácicos en toracotomía o cirugía de cáncer de mama)[63], este hecho no ha sido evidenciado claramente en cesárea. No obstante aquello, el uso de técnicas neuroaxiales es altamente recomendado por su eficiencia, seguridad para el binomio madre-hijo y adecuado control de dolor en el período agudo. Generalmente, estas técnicas son suplementadas con combinaciones de opioides y antiinflamatorios no esteroidales, los cuales se continúan comúnmente por un período variable de tiempo. El uso de clonidina por vía neuraxial, si bien ha demostrado eficacia en disminuir el uso de opioides luego de cesárea, así como disminuir el área de hiperalgesia perincisional 48 h poscirugía, sin embargo, no ha demostrado impactar en la reducción del DCPQ a los 6-12 meses[64],[65]. El uso de gabapentinoides orales (ej, gabapentina, pregabalina), así como ketamina endovenosa o intramuscular en el período perioperatorio también ha sido estudiado con la finalidad de determinar su posible uso como protector del desarrollo de DCPQ en cesárea, no obstante, no han sido demostrados efectos distintos al uso de placebo en períodos tan variables como 1, 6, 12 meses ni tampoco a los 3 años[66],[67].
-
Conclusiones
En resumen, una vez entendida la inervación asociada a una cirugía y a sus focos principales de dolor posoperatorio, es posible pensar de manera más adecuada una anestesia o analgesia basada en bloqueos regionales periféricos. A la fecha ningún bloqueo periférico posee evidencia suficiente para ser recomendado para anestesia quirúrgica en cesárea, siendo lo más cercano lo reportado con BPVT asociado a sedación con dexmedetomidina. Afortunadamente, situaciones con total contraindicación de anestesia neuroaxial y general son extremadamente infrecuentes. Al referirse exclusivamente a analgesia posoperatoria, los bloqueos regionales hasta la fecha investigados no se han transformado en una alternativa que supere o aporte al uso de OHNA. Sin embargo, en situaciones donde esta última no se desee o no se pueda utilizar, serían una buena alternativa para optimizar un protocolo de analgesia multimodal. Dentro de los bloqueos más estudiados encontramos el TAPB, que daría una buena cobertura a la región incisional suprapúbica, aunque el BCL podría ser superior en la cobertura de dicha región por la inyección más posterior del AL con un bloqueo más completo de los nervios subcostal, II e IH. La evidencia con ESPB es aún limitada como para recomendarlo fuera de protocolos de investigación y, lamentablemente, la evidencia existente con bloqueo de los nervios II e IH difiere de los estándares actuales en anestesia regional periférica como para pronunciarse al respecto. Desde un punto de vista anatómico y potencial de bloqueo, el BPVT sería el con mejor posibilidad de cobertura de las regiones originadoras de dolor posoperatoria, tanto parietal como visceral, sin embargo, la evidencia con este bloqueo en cesárea es al menos escasa. Pareciera que BRP que aseguren mayor duración pudieran desempeñarse mejor, no obstante, es necesario conducir estudios bien deseñados que evalúen coadyuvantes, bloqueos continuos o anestésicos de depósito en pacientes con protocolos analgésicos multimodales, es decir, con al menos dos fármacos analgésicos que posean vías de acción complementarias y administradas basalmente por horario. Estos debieran compararse, solos y o asociados a OHNA, contra estos últimos. Los desenlaces a estudiar debieran ser consumo opioides y dolor pasivo/dinámico durante las primeras 24 h, e idealmente posterior a estas. Además, siempre es útil determinar el perfil de efectos adversos asociados. Así, quizás un BRP nunca permita eliminar completamente los OHNA, pero poder disminuir la dosis de estos últimos se ha asociado a menos efectos adversos. Esto podría ser de especial relevancia en poblaciones de riesgo particulares. Por último, teniendo en consideración el rol que puede tener la presencia de dolor severo en el posoperatorio inmediato en el desarrollo de DCPQ, los BRP representan una interesante herramienta para asociar en pacientes de riesgo o como rescate en aquellos que a pesar de las medidas estándar presentan rangos de dolor severos posoperatorios.
Referencias
1. Veef E, Van de Velde M. Post-cesarean section analgesia. Baillieres Best Pract Res Clin Anaesthesiol. 2022 May;36(1):83–8. https://doi.org/10.1016/j.bpa.2022.02.006.
2. Lavand’homme P. Postoperative cesarean pain: real but is it preventable? Curr Opin Anaesthesiol. 2018 Jun;31(3):262–7. https://doi.org/10.1097/ACO.0000000000000585.
3. Roofthooft E, Joshi GP, Rawal N, Van de Velde M, Joshi GP, Pogatzki-Zahn E, et al. PROSPECT Working Group* of the European Society of Regional Anaesthesia and Pain Therapy and supported by the Obstetric Anaesthetists’ Association. PROSPECT guideline for elective caesarean section: updated systematic review and procedure-specific postoperative pain management recommendations. Anaesthesia. 2021 May;76(5):665–80. https://doi.org/10.1111/anae.15339.
4. O’Carroll J, Carvalho B, Sultan P. Enhancing recovery after cesarean delivery – A narrative review. Baillieres Best Pract Res Clin Anaesthesiol. 2022 May;36(1):89–105. https://doi.org/10.1016/j.bpa.2022.01.001.
5. Nathan N, Wong CA. Spinal, Epidural, and Caudal Anesthesia: Anatomy, Physiology, and Technique. Chapter 12, David Chesnut, Chestnut’s Obstetric Anesthesia – Principles and Practice. 6th Edition, Elsevier Health, 2019, p 238-270.
6. Dailey AF, Agur AMR. Pelvis and perineum, chapter 6. Moore -Anatomy with clinical orientation. 9th Edition, Wolters Kluwer.
7. Chin KJ, Versyck B, Elsharkawy H, Rojas Gomez MF, Sala-Blanch X, Reina MA. Anatomical basis of fascial plane blocks. Reg Anesth Pain Med. 2021 Jul;46(7):581–99. https://doi.org/10.1136/rapm-2021-102506.
8. Arroyo-Fernández FJ, Calderón Seoane JE, Torres Morera LM. Strategies of analgesic treatment after cesarean delivery. Current state and new alternatives. Rev Esp Anestesiol Reanim (Engl Ed). 2020 Mar;67(3):167–75. https://doi.org/10.1016/j.redare.2019.11.002.
9. Hsu HW, Cheng YJ, Chen LK, Wang YP, Lin CJ, Lee CN, et al. Differential analgesic effect of tenoxicam on the wound pain and uterine cramping pain after cesarean section. Clin J Pain. 2003 Jan-Feb;19(1):55–8. https://doi.org/10.1097/00002508-200301000-00007.
10. Chin KJ, McDonnell JG, Carvalho B, Sharkey A, Pawa A, Gadsden J. Essentials of Our Current Understanding: Abdominal Wall Blocks. Reg Anesth Pain Med. 2017 Mar/Apr;42(2):133–83. https://doi.org/10.1097/AAP.0000000000000545.
11. Sultan P, Halpern SH, Pushpanathan E, Patel S, Carvalho B. The Effect of Intrathecal Morphine Dose on Outcomes After ElectiveCesarean Delivery: A Meta-Analysis. Anesth Analg. 2016 Jul;123(1):154–64. https://doi.org/10.1213/ANE.0000000000001255.
12. Koning MV, Klimek M, Rijs K, Stolker RJ, Heesen MA. Intrathecal hydrophilic opioids for abdominal surgery: a meta-analysis, meta-regression, and trial sequential analysis. Br J Anaesth. 2020 Sep;125(3):358–72. https://doi.org/10.1016/j.bja.2020.05.061.
13. Sharawi N, Carvalho B, Habib A, Blake L, Mhyre J, Sultan P. A systematic review evaluating neuraxial morphine and diamorphine-associated respiratory depression after cesarean delivery. Anesth Analg 2018; 127: 1385e95 https://doi.org/10.1213/ANE.0000000000003636.
14. Bauchat JR, Weiniger CF, Sultan P, Habib AS, Ando K, Kowalczyk JJ, et al. Society for Obstetric Anesthesia and Perinatology Consensus Statement: Monitoring Recommendations for Prevention and Detection of Respiratory Depression Associated With Administration of Neuraxial Morphine for Cesarean Delivery Analgesia. Anesth Analg. 2019 Aug;129(2):458–74. https://doi.org/10.1213/ANE.0000000000004195.
15. Sharpe EE, Molitor RJ, Arendt KW, Torbenson VE, Olsen DA, Johnson RL, et al. Intrathecal Morphine versus Intrathecal Hydromorphone for Analgesia after Cesarean Delivery: A Randomized Clinical Trial. Anesthesiology. 2020 Jun;132(6):1382–91. https://doi.org/10.1097/ALN.0000000000003283.
16. Mitchell KD, Smith CT, Mechling C, Wessel CB, Orebaugh S, Lim G. A review of peripheral nerve blocks for cesarean delivery analgesia. Reg Anesth Pain Med. 2019 Oct;•••:rapm-2019-100752. https://doi.org/10.1136/rapm-2019-100752.
17. Aliste J, Baeza F. Bloqueo Paravertebral Torácico. Rev Chil Anest. 2011;40:263–71.
18. Aliste J, Layera S, Bravo D, Aguilera G, Erpel H, García A, et al. Randomized comparison between perineural dexamethasone and combined perineural dexamethasone-dexmedetomidine for ultrasound-guided infraclavicular block. Reg Anesth Pain Med. 2022 Jun;47(9):rapm-2022-103760. https://doi.org/10.1136/rapm-2022-103760.
19. Singh NP, Monks D, Makkar JK, Palanisamy A, Sultan P, Singh PM. Efficacy of regional blocks or local anaesthetic infiltration for analgesia after caesarean delivery: a network meta-analysis of randomised controlled trials. Anaesthesia. 2022;77(4):463–74. https://doi.org/10.1111/anae.15645.
20. Tran DQ, Bravo D, Leurcharusmee P, Neal JM. Transversus Abdominis Plane Block: A Narrative Review. Anesthesiology. 2019 Nov;131(5):1166–90. https://doi.org/10.1097/ALN.0000000000002842.
21. Ng SC, Habib AS, Sodha S, Carvalho B, Sultan P. High-dose versus low-dose local anaesthetic for transversus abdominis plane block post-Caesarean delivery analgesia: a meta-analysis. Br J Anaesth. 2018 Feb;120(2):252–63. https://doi.org/10.1016/j.bja.2017.11.084.
22. Sultan P, Sultan E, Carvalho B. Regional anaesthesia for labour, operative vaginal delivery and caesarean delivery: a narrative review. Anaesthesia. 2021 Jan;76(S1 Suppl 1):136–47. https://doi.org/10.1111/anae.15233.
23. Layera S, Bravo D, Aliste J. Bloqueos de tronco. Truncal blocks. Rev Chil Anest. 2020;49(1):65–78. https://doi.org/10.25237/revchilanestv49n01.06.
24. Kang W, Lu D, Yang X, Zhou Z, Chen X, Chen K, et al. Postoperative analgesic effects of various quadratus lumborum blockapproaches following cesarean section: a randomized controlled trial. J Pain Res. 2019 Jul;12:2305–12. https://doi.org/10.2147/JPR.S202772.
25. Harbell MW, Seamans DP, Koyyalamudi V, Kraus MB, Craner RC, Langley NR. Evaluating the extent of lumbar erector spinae plane block: an anatomical study. Reg Anesth Pain Med. 2020 Aug;45(8):640–4. https://doi.org/10.1136/rapm-2020-101523.
26. Hamed MA, Yassin HM, Botros JM, Abdelhady MA. Analgesic Efficacy of Erector Spinae Plane Block Compared with Intrathecal Morphine After Elective Cesarean Section: A Prospective Randomized Controlled Study. J Pain Res. 2020 Mar;13:597–604. https://doi.org/10.2147/JPR.S242568.
27. Malawat A, Verma K, Jethava D, Jethava DD. Erector spinae plane block and transversus abdominis plane block for postoperative analgesia in cesarean section: A prospective randomized comparative study. J Anaesthesiol Clin Pharmacol. 2020 Apr-Jun;36(2):201–6. https://doi.org/10.4103/joacp.JOACP_116_19.
28. Aygun H, Ozturk NK, Ugur M, Aydin Y, Celik GI, Thomas DT, et al. Evaluation of ultrasound-guided bilateral low thoracic erector spinae planeblock for postoperative analgesia in cesarean delivery patients: a prospective, randomized, controlled clinical trial. Braz J Anesthesiol. 2022 Jul-Aug;72(4):444–9. https://doi.org/10.1016/j.bjane.2021.07.032.
29. Boules ML, Goda AS, Abdelhady MA, Abu El-Nour Abd El-Azeem SA, Hamed MA. Comparison of Analgesic Effect Between Erector Spinae Plane Block and Transversus Abdominis Plane Block After Elective Cesarean Section: A Prospective Randomized Single-Blind Controlled Study. J Pain Res. 2020 May;13:1073–80. https://doi.org/10.2147/JPR.S253343.
30. Bakshi A, Srivastawa S, Jadon A, Mohsin K, Sinha N, Chakraborty S. Comparison of the analgesic efficacy of ultrasound-guided transmuscular quadratus lumborum block versus thoracic erector spinae block for postoperative analgesia in caesarean section parturients under spinal anaesthesia-A randomised study. Indian J Anaesth. 2022 Jun;66 Suppl 4:S213–9. https://doi.org/10.4103/ija.ija_88_22.
31. Hu J, Chen Q, Xu Q, Song Y, Wei K, Lei XF. Analgesic effect of ultrasound-guided erector spinae plane block (espb) in general anesthesia for cesarean section: a randomized controlled trial. BMC Anesthesiol. 2022 Aug;22(1):244. https://doi.org/10.1186/s12871-022-01781-8.
32. Xuan C, Yan W, Wang D, Li C, Ma H, Mueller A, et al. The Facilitatory Effects of Adjuvant Pharmaceutics to Prolong the Duration of Local Anesthetic for Peripheral Nerve Block: A Systematic Review and Network Meta-analysis. Anesth Analg. 2021 Sep;133(3):620–9. https://doi.org/10.1213/ANE.0000000000005640.
33. Sehmbi H, Brull R, Ceballos KR, Shah UJ, Martin J, Tobias A, et al. Perineural and intravenous dexamethasone and dexmedetomidine: network meta-analysis of adjunctive effects on supraclavicular brachial plexus block. Anaesthesia. 2021 Jul;76(7):974–90. https://doi.org/10.1111/anae.15288.
34. Heesen M, Klimek M, Imberger G, Hoeks SE, Rossaint R, Straube S. Co-administration of dexamethasone with peripheral nerve block: intravenous vs perineural application: systematic review, meta-analysis, meta-regression and trial-sequential analysis. Br J Anaesth. 2018 Feb;120(2):212–27. https://doi.org/10.1016/j.bja.2017.11.062.
35. Hussain N, Brummett CM, Brull R, Alghothani Y, Moran K, Sawyer T, et al. Efficacy of perineural versus intravenous dexmedetomidine as a peripheral nerve block adjunct: a systematic review. Reg Anesth Pain Med. 2021 Aug;46(8):704–12. https://doi.org/10.1136/rapm-2020-102353.
36. Aliste J, Layera S, Bravo D, Fernández D, Jara Á, García A, et al. Randomized comparison between perineural dexamethasone and dexmedetomidine for ultrasound-guided infraclavicular block. Reg Anesth Pain Med. 2019 Jul;44(10):rapm-2019-100680. https://doi.org/10.1136/rapm-2019-100680.
37. Aga A, Abrar M, Ashebir Z, Seifu A, Zewdu D, Teshome D. The use of perineural dexamethasone and transverse abdominal plane blockfor postoperative analgesia in cesarean section operations under spinal anesthesia: an observational study. BMC Anesthesiol. 2021 Nov;21(1):292. https://doi.org/10.1186/s12871-021-01513-4.
38. Singla N, Garg K, Jain R, Malhotra A, Singh MR, Grewal A. Analgesic efficacy of dexamethasone versus dexmedetomidine as an adjuvant to ropivacaine in ultrasound-guided transversus abdominis plane block for post-operative pain relief in caesarean section: A prospective randomised controlled study. Indian J Anaesth. 2021 Sep;65(15 Suppl 3):S121–6. https://doi.org/10.4103/ija.IJA_228_21.
39. Gupta A, Gupta A, Yadav N. Effect of dexamethasone as an adjuvant to ropivacaine on duration and quality of analgesia in ultrasound-guided transversus abdominis plane block in patients undergoing lower segment cesarean section – A prospective, randomised, single-blinded study. Indian J Anaesth. 2019 Jun;63(6):469–74. https://doi.org/10.4103/ija.IJA_773_18.
40. Akkaya A, Yildiz I, Tekelioglu UY, Demirhan A, Bayir H, Ozlu T, et al. Dexamethasone added to levobupivacaine in ultrasound-guided tranversus abdominis plain block increased the duration of postoperative analgesia after caesarean section: a randomized, double blind, controlled trial. Eur Rev Med Pharmacol Sci. 2014;18(5):717–22.
41. Flaherty JM, Berg AA, Harrison A, Braman J, Pearson JM, Matelich B, et al. Comparing liposomal bupivacaine plus bupivacaine to bupivacaine alone in interscalene blocks for rotator cuff repair surgery: a randomized clinical trial. Reg Anesth Pain Med. 2022 May;47(5):309–12. https://doi.org/10.1136/rapm-2021-103349.
42. Sandhu HK, Miller CC 3rd, Tanaka A, Estrera AL, Charlton-Ouw KM. Effectiveness of Standard Local Anesthetic Bupivacaine and Liposomal Bupivacaine for Postoperative Pain Control in Patients Undergoing Truncal Incisions: A Randomized Clinical Trial. JAMA Netw Open. 2021 Mar;4(3):e210753. https://doi.org/10.1001/jamanetworkopen.2021.0753.
43. Kim DH, Liu J, Beathe JC, Lin Y, Wetmore DS, Kim SJ, et al. Interscalene Brachial Plexus Block with Liposomal Bupivacaine versus Standard Bupivacaine with Perineural Dexamethasone: A Noninferiority Trial. Anesthesiology. 2022 Mar;136(3):434–47. https://doi.org/10.1097/ALN.0000000000004111.
44. Nedeljkovic SS, Kett A, Vallejo MC, Horn JL, Carvalho B, Bao X, et al. Transversus Abdominis Plane Block With Liposomal Bupivacaine for Pain After Cesarean Delivery in a Multicenter, Randomized, Double-Blind, Controlled Trial. Anesth Analg. 2020 Dec;131(6):1830–9. https://doi.org/10.1213/ANE.0000000000005075.
45. Hutchins JL, Renfro L, Orza F, Honl C, Navare S, Berg AA. The addition of intrathecal morphine to a transversus abdominis plane block with liposome bupivacaine provides more effective analgesia than transversus abdominis plane block with liposome bupivacaine alone: a retrospective study. Local Reg Anesth. 2019 Feb;12:7–13. https://doi.org/10.2147/LRA.S190225.
46. Hussain N, Brull R, Sheehy B, Essandoh MK, Stahl DL, Weaver TE, Abdallah FW. Perineural Liposomal Bupivacaine Is Not Superior to Nonliposomal Bupivacaine for Peripheral Nerve Block Analgesia. Anesthesiology. 2021 Feb 1;134(2):147-164. : 33372953. https://doi.org/10.1097/ALN.0000000000003651.
47. Dinges HC, Wiesmann T, Otremba B, Wulf H, Eberhart LH, Schubert AK. The analgesic efficacy of liposomal bupivacaine compared with bupivacainehydrochloride for the prevention of postoperative pain: a systematic review and meta-analysis with trial sequential analysis. Reg Anesth Pain Med. 2021 Jun;46(6):490–8. https://doi.org/10.1136/rapm-2020-102427.
48. Neal JM, Barrington MJ, Fettiplace MR, Gitman M, Memtsoudis SG, Mörwald EE, et al. The Third American Society of Regional Anesthesia and Pain Medicine Practice Advisory on Local Anesthetic Systemic Toxicity: executive Summary 2017. Reg Anesth Pain Med. 2018 Feb;43(2):113–23. https://doi.org/10.1097/AAP.0000000000000720.
49. International Association for the Study of Pain (IASP) Subcommittee on Taxonomy. Classification of chronic pain. Descriptions of chronic pain syndromes and definitions of pain terms. Pain. 1986;24(Suppl):S1–S226).
50. Pagé GM, Stinson J, Campbell F, Isaac, Katz J. Identification of pain-related psychological risk factors for the development and maintenance of pediatric chronic postsurgical pain. J Pain Res. 2013;6:167–80. https://doi.org/10.2147/JPR.S40846.
51. Althaus A, Hinrichs-Rocker A, Chapman R, Becker OA, Lefering R, Simanski C, et al. Development of a risk index for the prediction of chronic post-surgical pain. Eur J Pain. 2012;16(6):901–10. https://doi.org/10.1002/j.1532-2149.2011.00090.x.
52. Jin J, Peng L, Chen Q, Zhang D, Ren Li, Qin P, Min Su. Prevalence and risk factors for chronic pain following cesarean section: a prospective study. BMC Anesthesiology 2016, 16: 99, 1-11. : 27756207. https://doi.org/10.1186/s12871-016-0270-6.
53. Katz J, Seltzer Z. Transition from acute to chronic postsurgical pain: risk factors and protective factors. Expert Rev Neurother 2009;9:723–744. : 19402781. https://doi.org/10.1586/ern.09.20.
54. Ferrari LF, Bogen O, Chu C et al. Peripheral administration inhibitors reverses increased hyperalgesia in a model of chronic pain in the rat. J Pain 201314:731–738. https://doi.org/10.1016/j.jpain.2013.01.779.. PMID: 23664545.
55. Fletcher D. Epidemiology of chronic postsurgical pain. In: Mick G, Guastella V, editors. Chronic postsurgical pain. Paris: Springer; 2013. pp. 13–20.
56. Husby AE, van Duinen AJ, Aune I. Caesarean birth experiences. A qualitative study from Sierra Leone. Sex Reprod Healthc. 2019;21:87–94. https://doi.org/10.1016/j.srhc.2019.06.003.
57. Borges NC, de Deus JM, Guimarães RA, Conde DM, Bachion MM, de Moura LA, et al. The incidence of chronic pain following Cesarean section and associated risk factors: A cohort of women followed up for three months. PLoS ONE 2020;15(9): e0238634. https://doi.org/10.1371/journal.pone.0238634.. 2020.
58. Nikolajsen L, Sorensen HC, Jensen TS, Kehlet H. Chronic pain following Caesarean section. Acta Anaesthesiol Scand 2004; 48: 111e6. : 14674981. https://doi.org/10.1111/j.1399-6576.2004.00271.x.
59. Sng BL, Sia AT, Quek K, Woo D, Lim Y. Incidence and risk factors for chronic pain after Caesarean section under spinal anaesthesia. Anaesth Intensive Care 2009; 37: 748e52, Komatsu R, Ando K, Flood PD. Factors associated with persistent pain after childbirth: a narrative review. Br J Anaesth. 2020;124(3):e117–30. https://doi.org/10.1177/0310057X0903700513.
60. Hinrichs-Rocker A, Schulz K, Järvinen I, Lefering R, Simanski C, Neugebauer EA. Psychosocial predictors and correlates for chronic post-surgical pain (CPSP) – a systematic review. Eur J Pain. 2009;13(7):719–30. https://doi.org/10.1016/j.ejpain.2008.07.015.
61. Van de Ven T, John Hsia HL. Causes and prevention of chronic postsurgical pain. Curr Opin Crit Care. 2012;18(4):366–71. https://doi.org/10.1097/MCC.0b013e3283557a7f.
62. Komatsu R, Ando K, Flood PD. Factors associated with persistent pain after childbirth: a narrative review. Br J Anaesth. 2020;124(3):e117–30. https://doi.org/10.1016/j.bja.2019.12.037.
63. Andreae MH, Andreae DA. Regional anaesthesia to prevent chronic pain after surgery: a Cochrane systematic review and meta-analysis. Br J Anaesth. 2013;111(5):711–20. https://doi.org/10.1093/bja/aet213.
64. Bollag L, Richebe P, Siaulys M, Ortner CM, Gofeld M, Landau R. Effect of transversus abdominis plane block Persistent pain after childbirth with and without clonidine on post-cesarean delivery wound hyperalgesia and pain. Reg Anesth Pain Med 2012; 37: 508e14. https://doi.org/10.1097/AAP.0b013e318259ce35.
65. Lavand’homme PM, Roelants F, Waterloos H, Collet V, De Kock MF. An evaluation of the postoperative antihyperalgesic and analgesic effects of intrathecal clonidine administered during elective Cesarean delivery. Anesth Analg 2008; 107: 948e55. https://doi.org/10.1213/ane.0b013e31817f1595.
66. Short J, Downey K, Bernstein P, Shah V, Carvalho JC. A single preoperative dose of gabapentin does not improve postcesarean delivery pain management: a randomized, double-blind, placebo-controlled dose finding trial. Anesth Analg 2012; 115: 1336e42. https://doi.org/10.1213/ANE.0b013e31826ac3b9.
67. Suppa E, Valente A, Catarci S, Zanfini BA, Draisci G. A study of low-dose S-ketamine infusion as “preventive” pain treatment for cesarean section with spinal anesthesia: benefits and side effects. Minerva Anestesiol 2012; 78: 774e81.

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution