Fabiola Señoret R.1,*, María Carolina Cabrera Sch.2, Fernando Aranda G.3, Claudio Gutiérrez V.4
Recibido: 05-09-2021
Aceptado: 21-09-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 2 pp. 203-212|https://doi.org/10.25237/revchilanestv5108021500
PDF|ePub|RIS
Ultrasound as a complement in the management of the airway
Abstract
Objective: To analyze the usefulness of ultrasound (US) as a complement to airway management. An overview of how to obtain a real-time airway ultrasound at the bedside is reviewed and the support for its use is checked against the evidence. Materials and Methods: The search was carried out in Pubmed and Medline, yielding 722 articles of interest with different levels of evidence. The literature search was limited to studies conducted in humans, published in English and Spanish between August 2011 and August 2021.35 articles were included in this review. Discussion: The usefulness of ultrasound in the evaluation and management of the airway is analyzed: predictors of difficult airway; cervical airway access; confirmation of tracheal intubation; calculation of endotracheal tube (ETT) size and depth. Conclusions: Airway ultrasound could be a useful tool for anesthesiologists, emergency physicians and intensivists, which could help improve patient care and safety. However, more research is needed to validate its use.
Resumen
Objetivo: Analizar la utilidad del ultrasonido (US) como complemento al manejo de la vía aérea. Se revisa una descripción general de cómo obtener una ecografía de la vía aérea en tiempo real a la cabecera del paciente y se coteja el respaldo de su utilización con la evidencia. Materiales y Métodos: La búsqueda se realizó en Pubmed y Medline, arrojando 722 artículos de interés con distinto nivel de evidencia. La búsqueda bibliográfica se limitó a estudios realizados en humanos, publicados en inglés y español entre agosto de 2011 y agosto de 2021. Se incluyeron 35 artículos en esta revisión. Discusión: Se analiza la utilidad del ultrasonido en la evaluación y manejo de la vía aérea: predictores de vía aérea difícil (VAD); acceso cervical de la vía aérea; confirmación de intubación traqueal; cálculo de tamaño de tubo endotraqueal (TET) y profundidad de éste. Conclusiones: El ultrasonido en la vía aérea podría ser una herramienta útil para anestesiólogos, emergenciólogos e intensivistas, que podrían ayudar a mejorar la atención y la seguridad del paciente. Sin embargo, se necesitan más investigaciones para validar su uso.
El manejo de la vía aérea es parte fundamental para una práctica segura de la anestesia. Los eventos respiratorios son la principal causa de morbimortalidad en anestesiología. Entre estos; la intubación imposible, dificultad en la ventilación e intubación esofágica no detectada, son las complicaciones más frecuentes. El 25% de los eventos respiratorios derivan en muerte o daño neurológico persistente[1].
Con el avance de la tecnología, la miniaturización de los equipos de ultrasonido, se ha facilitado su acceso. Hoy su uso es simple, no invasivo, portable, en tiempo real, relativamente barato y realizable a la cabecera del paciente. Este método diagnóstico por imágenes se ha convertido en una importante herramienta clínica que aumenta la seguridad del periodo pe- rioperatorio. Se ha descrito su uso guiando accesos vasculares, bloqueos nerviosos, evaluación del estado hemodinámico y últimamente en el manejo de la vía aérea.
El objetivo de esta revisión es analizar la utilidad del ultrasonido como complemento en la evaluación y manejo de la vía aérea, específicamente anatomía de la vía aérea superior, incluyendo laringe, cuerdas vocales y tráquea, predictores larin- goscopía difícil, acceso cervical de la vía aérea de emergencia y electivo, confirmación de intubación traqueal, cálculo de tamaño de tubo endotraqueal y profundidad de éste.
Se realizó una búsqueda en Pubmed y Medline con las siguientes palabras: ultrasound (US) operating room, ultrasono- graphy, upper airway, anatomy airway, difficult airway, vocal cords, cricothyroid membrane, cricothyroidotomy, tracheos- tomy and tube tracheostomy.
Se incluyeron reportes de casos y series, estudios prospectivos y retrospectivos, revisiones sistemáticas y metanálisis, guías clínicas y otras revisiones narrativas. La búsqueda bibliográfica se limitó a estudios realizados en humanos, publicados en idiomas inglés y español, desde agosto de 2011 a agosto de 2021.
La búsqueda arrojó 722 artículos (Pubmed 380 y Medline 342). Los autores con formación en la valoración crítica de la literatura revisaron todos los títulos y resumen de los artículos, se excluyeron 404 (152 repetidos y 252 no pertinentes), quedando 318 artículos de interés. Estos fueron analizados in extenso, incluyéndose finalmente 35 en esta revisión (Figura 1).
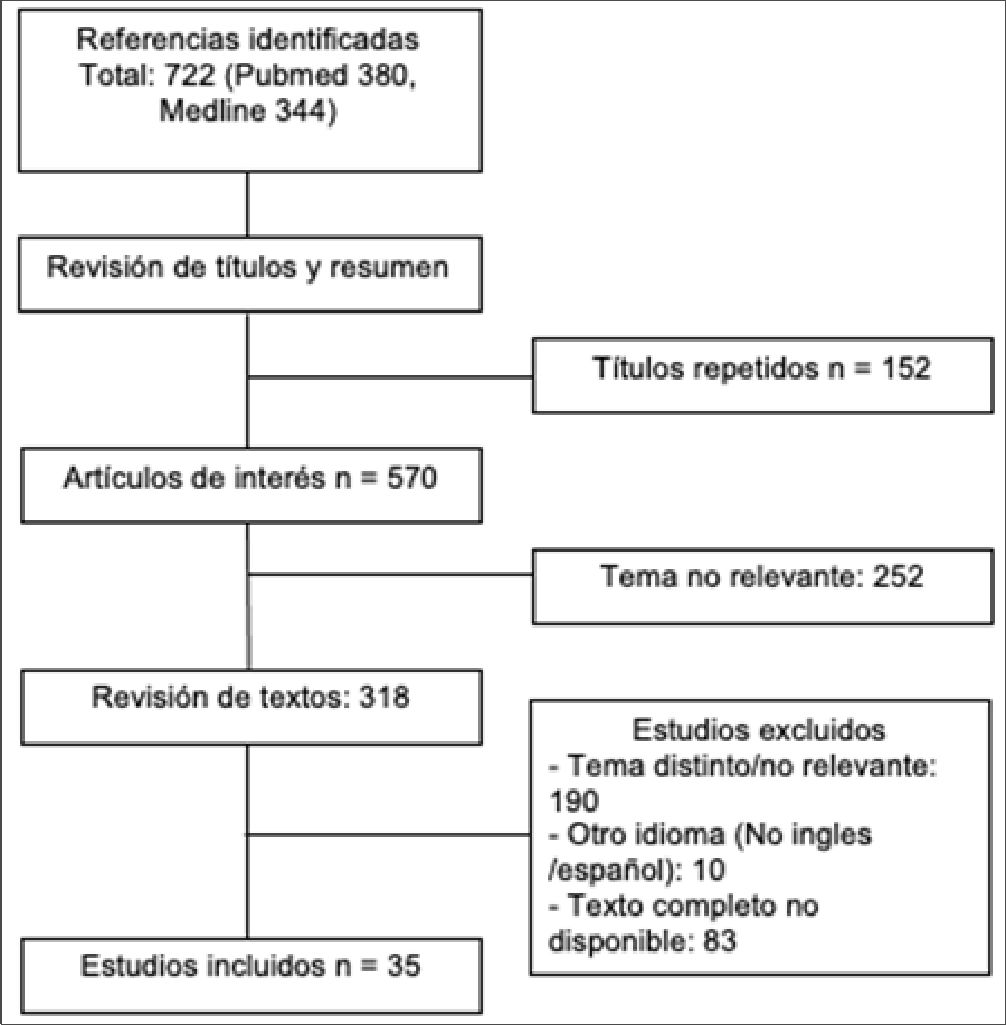
Figura 1. Método de búsqueda.
Figura 2. Eje vertical.
-
Ultrasonido
El ultrasonido es un método diagnóstico no invasivo que genera imágenes a través de ondas sonoras que tienen frecuencias mayores al umbral audible, es decir, a una frecuencia superior a 20.000 ciclos por segundo (20 kHz); permitiendo así diferenciar estructuras anatómicas, por la capacidad que tienen los tejidos de reflejar las ondas de ultrasonido; capacidad que está determinada por la densidad e impedancia acústica de cada tejido, principalmente. El aire es un mal conductor de las ondas de ultrasonido, lo que dificulta la evaluación de estructu-
ras llenas de aire como las vías respiratorias. Los artefactos de ultrasonido como sombras acústicas o reverberaciones ayudan a identificar la vía aérea. Las frecuencias que utilizan los aparatos en clínica son de 1 a 12 MHz (1 MHz = 106 Hz).
Las sondas ecográficas de alta frecuencia (7 – 12 MHz) tienen una menor profundidad y mayor precisión para diferenciar dos puntos entre sí, por lo que es la más adecuada para evaluar estructuras superficiales (dentro de 0-5 cm por debajo de la superficie de la piel).
Figura 3. Eje horizontal.
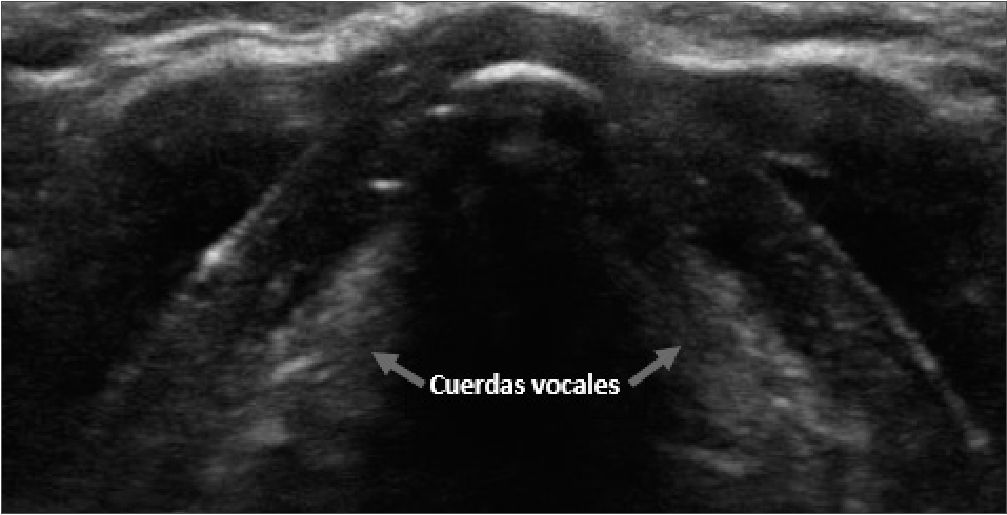
Figura 4. Cuerdas vocales, plano transversal.
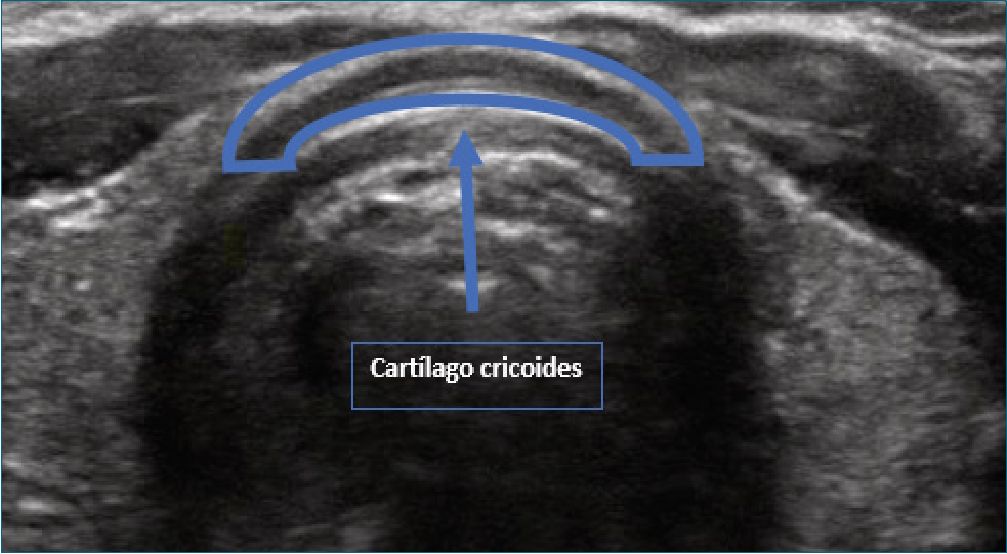
Figura 5. Cartílago cricoides, eje transversal.
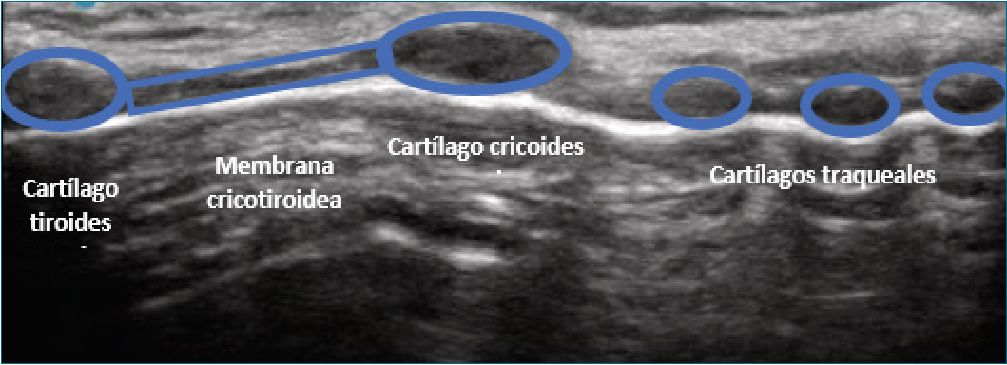
Figura 6. Eje vertical de cartílago cricoides y tiroides.
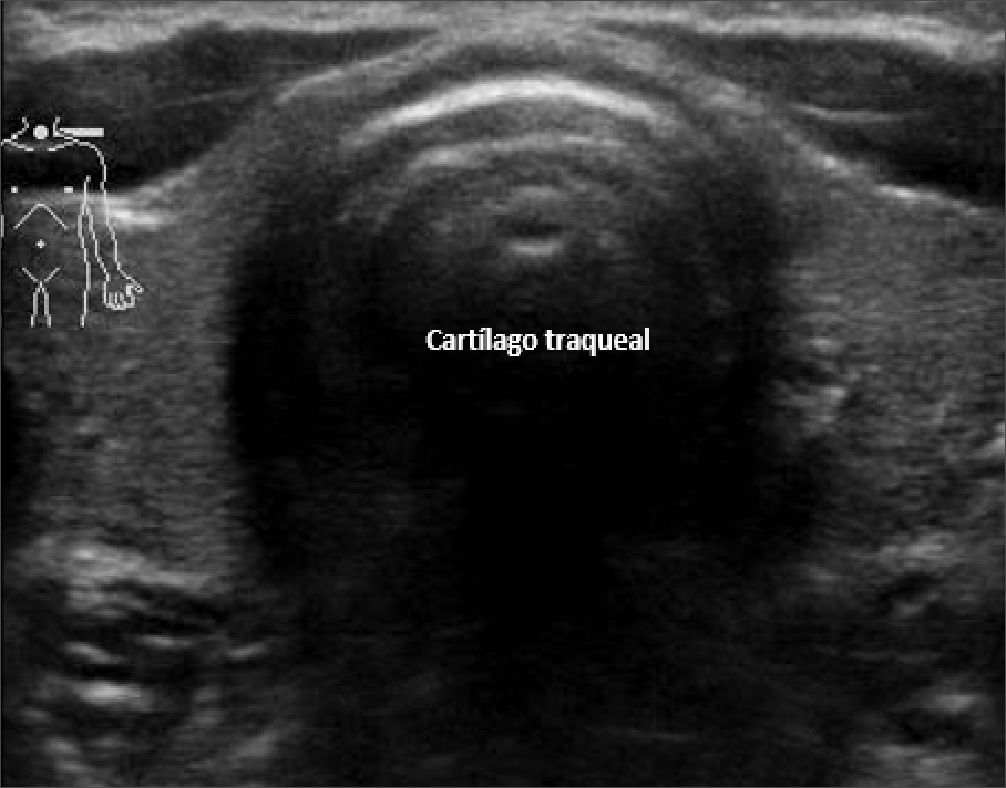
Figura 7. Cartílago traqueal en eje transversal.
El ultrasonido permite identificar la sonoanatomía de la vía aérea superior, como cuerdas vocales, cartílago tiroides, epiglotis, cartílago cricoides, membrana cricotiroidea (MC), cartílagos traqueales y esófago[2].
Se describen dos planos, el plano longitudinal o vertical (Figura 2) y el plano transversal u horizontal (Figura 3) en relación al eje corporal.
Las cuerdas vocales se observan mejor en el plano transversal a través del cartílago tiroides (Figura 4). Su evaluación cobra relevancia clínica en el diagnóstico del estridor laríngeo postex- tubación. Los ligamentos vocales se observan como imágenes hiperecogénicas que delimitan las cuerdas vocales, en posición de abducción y aducción.
El cartílago cricoides, en el plano transversal, se observa como una estructura hipoecoica ovalada (Figura 5), mientras en el plano longitudinal se ve como un bulto o joroba (Figura 6).
El cartílago traqueal en el plano transversal se ve como una “U” invertida (Figura 7) y en el plano longitudinal se ve como una “cadena de cuentas” (Figura 8).
El esófago se visualiza en un plano transversal a nivel del primer y segundo cartílago traqueal, posterior al lóbulo tiroideo izquierdo (Figura 9). Se puede ver un movimiento peristáltico dentro de la luz esofágica mediante la deglución.
La ecografía forma parte de las herramientas que permiten estudiar y manejar la vía aérea de los pacientes, principalmente
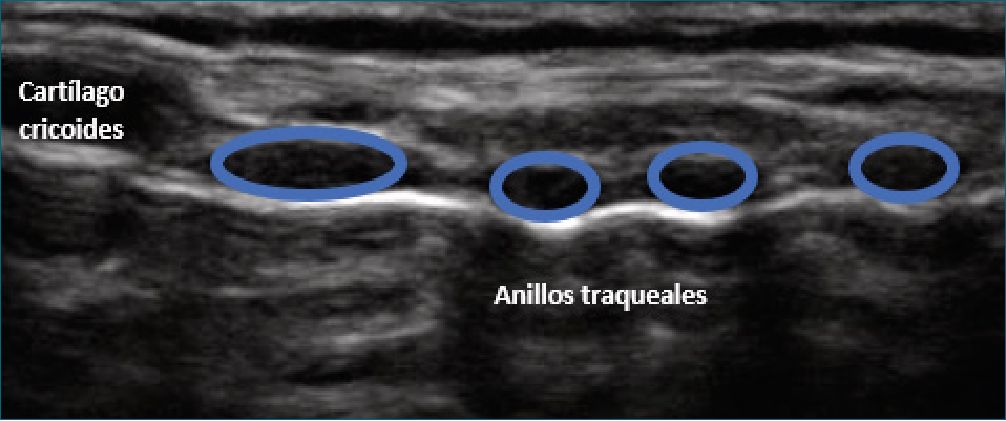
Figura 8. Anillos traqueales en eje longitudinal. “Collar de cuentas”.
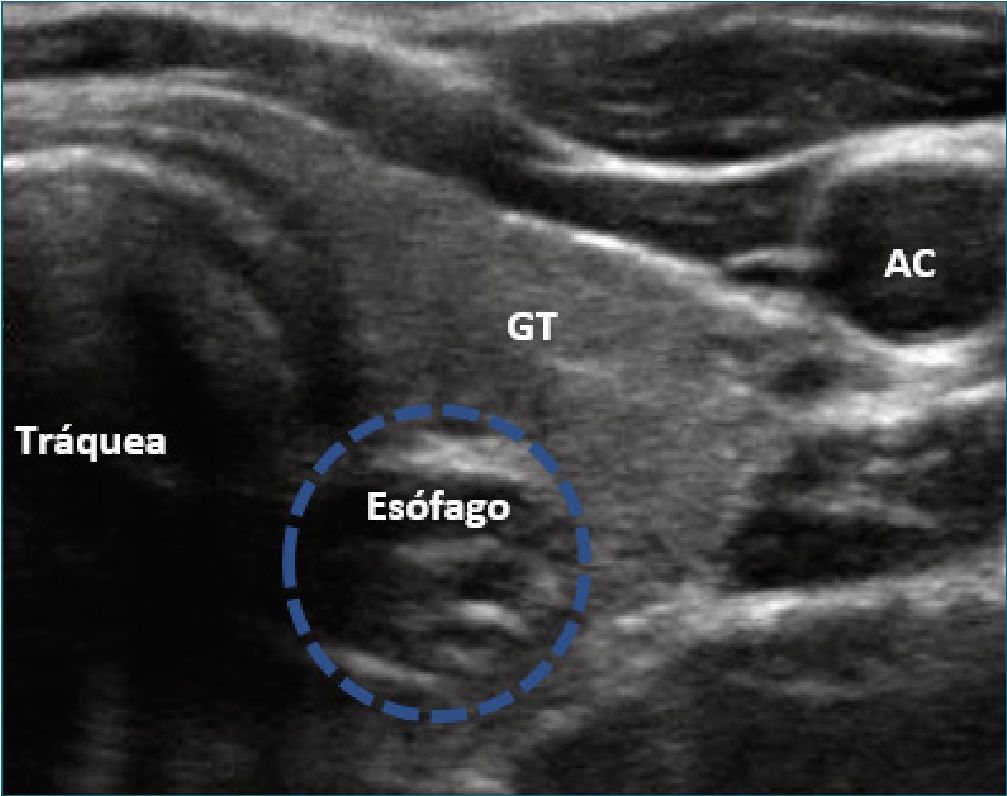
Figura 9. Esófago. GT: glándula tiroides. AC: arteria carótida.
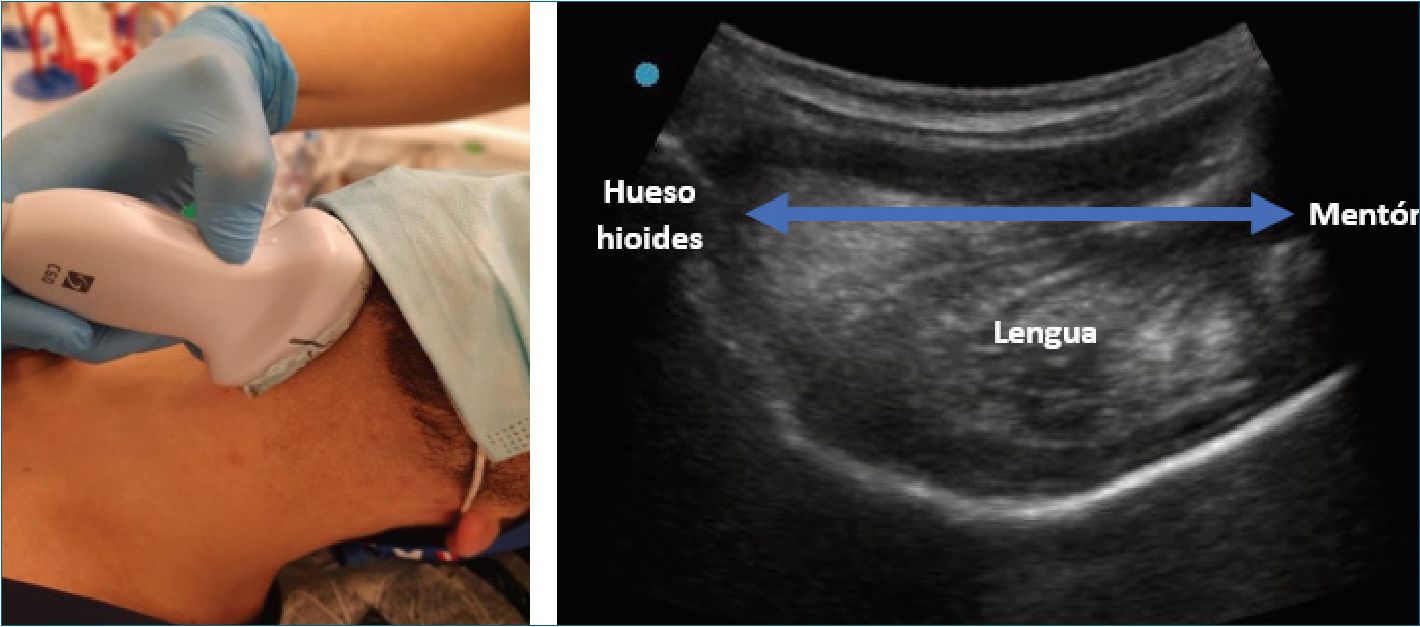
Figura 10. Distancia hiomental.
a través de la descripción de predictores de laringoscopía difí- cil[3],[4],[5],[6],[7],[8],[9],[10],[11],[12],[13] y de la guía al acceso cervical a la vía aére [14],[15].
-
Predictores laringoscopía difícil
En la literatura se han descrito múltiples predictores de laringoscopía difícil evaluados a través del ultrasonido, con el objetivo de mejorar el manejo de la vía aérea. Dentro de éstos, podemos destacar los enunciados en la Tabla 1.
-
Guía para el acceso cervical a la vía aérea
La ecografía de la vía aérea puede permitirnos realizar una cricotiroidotomía o traqueostomía, a través de la localización de la membrana cricotiroidea y cartílagos traqueales, respectivamente.
En el manejo de la vía aérea es imprescindible tener una evaluación preoperatoria detallada con objeto de tener indicios de una posible VAD. En caso de sospecharla, se puede dejar marcada la MC, para posteriormente realizar una cricotiroido- tomía con rapidez y precisión. Por otra parte, si bien en una situación de emergencia, el tiempo es de suma importancia, el estudio NAP 4[1] nos muestra que en al menos 18 de 58 pacientes en los que se intentó una vía aérea quirúrgica después de una intubación fallida, aún era posible ventilar con mascarilla facial o con un dispositivo supraglótico, por lo tanto, en tales pacientes habrá tiempo suficiente para realizar una ecografía.
La colocación del operador y del ecógrafo van a depender de la posición del paciente. En general, en pacientes sentados el operador se ubica detrás de éste y el ecógrafo enfrente de am-
bos; en cambio, en pacientes en decúbito supino el operador se posiciona a la cabecera del paciente y el ecógrafo a nivel del codo derecho del mismo.
Para esto se han descrito varias técnicas, sin embargo, en la presente revisión se describirán dos de ellas.
-
a. Técnica transversal (Figura 11)[14]
i. El transductor se coloca transversalmente a nivel cervical alto, desplazándolo distalmente hasta identificar el cartílago tiroides como una estructura triangular hiperecoica (Figura 4).
ii. A continuación, el transductor se mueve caudalmente hasta que se identifica la membrana cricotiroidea; ésta se reconoce como una línea blanca hiperecoica resultante del eco del interfaz aire-mucosa en el interior de la membrana, a menudo asociado a líneas hiperecoicas paralelas (Figura 14).
iii Luego, el transductor se mueve más caudalmente hasta que se identifica el cartílago cricoides como una estructura ane- coica en forma de “C” (Figura 5).
iv Finalmente, el transductor se mueve ligeramente en dirección cefálica hasta que se identifica el centro de la membrana cricotiroidea. Al identificar las formas muy características de los cartílagos tiroides y cricoides, se pueden identificar
Tabla 1
| Predictor | Protocolo | Evidencia |
| Distancia hiomental en posición neutra (Figura 10) | Paciente en decúbito supino con cabeza y cuello en posición neutra sin almohada utilizando ecógrafo con transductor curvilíneo se mide la distancia desde el borde anterior del hueso hioides hasta el borde posterior del mentón | Andruszkiewicz et al., encontró que los pacientes con distancias hiomentales más cortas en posición neutra [3,99 ± 0,56 cm] estaban significativamente asociados con una laringoscopía difícil [3]. Aunque Petrisor y Wojtczak et al no obtuvieron resultados estadísticamente significativos para este mismo parámetro[4],[5]. No obstante, el efecto general de esta medición en una revisión sistemática fue significativo (p < 0,0001)[6]. |
| Distancia hiomental en posición extendida (Figura 10) | Paciente en decúbito supino con cabeza y cuello en posición extendida sin almohada utilizando ecógrafo con transductor curvilíneo, se mide la distancia desde el borde anterior del hueso hioides hasta el borde posterior del mentón | Los pacientes con laringoscopía difícil tenían una disminución significativa en la posición extendida, de 4,28 ± 0,64 cm y 5,26 ± 0,58 cm, en comparación con los pacientes con laringoscopía fácil[3],[6]. Petrisor en el año 2018, estableció que valores iguales o inferiores a 5,50 cm (Sensibilidad: 100%, Especificidad: 71,4%), predecían una laringoscopía difícil[4]. El efecto general de esta medición en la revisión sistemática fue estadísticamente significativo (p = 0,0002)[6] |
| Distancia piel – hueso hioides (Figura 11) | Paciente en decúbito supino con cabeza y cuello en posición neutra sin almohada, utilizando ecógrafo con transductor lineal en eje corto y con una inclinación entre 30-45° en dirección cefálica, se realiza la medición de la distancia entre el hueso hioides y la piel | En un estudio del 2014 que evaluó diversos parámetros ecográficos de laringoscopía difícil se concluyó que una distancia superior a 1,28 cm predice una laringoscopía difícil con una sensibilidad y especificidad de 85,7%, y 85,1% respectivamente. Los pacientes con una laringoscopía difícil tenían una distancia piel – hueso hioides significativamente mayor 1,51 ± 0,27 cm en comparación con laringoscopía fácil[7]. Los resultados del estudio Indio del año 2016, no fueron estadísticamente significativos® |
| Distancia piel – epiglotis (Figura 12) | Paciente en decúbito supino con cabeza y cuello en posición neutra sin almohada utilizando ecógrafo con transductor lineal ubicado en la línea media entre el hueso hioides y el cartílago tiroides a nivel de la membrana tirohioidea con grados variables de angulación cefálica y caudal. La epiglotis se observa como una estructura discretamente móvil. Se procede a realizar la medición de la distancia entre la epiglotis y la piel | Los pacientes con laringoscopía difícil presentaron medidas medias superiores a 2,8 cm, (Sensibilidad: 100%, especificidad: 66,2%) [9], 2,54 cm (Sensibilidad: 82%, especificidad: 91%) [10], e igual o superior a 2,75 cm (Sensibilidad: 64,7%, especificidad: 77,1%)[11]. |
| Distancia piel – cuerdas vocales (Figura13) | Paciente en decúbito supino con cabeza y cuello en posición neutra sin almohada utilizando ecógrafo con transductor lineal en eje corto, a nivel de las cuerdas vocales se procede a realizar la medición de la distancia entre la comisura anterior de las cuerdas vocales y la piel | Ezri et al, en el año 2014 informó que los pacientes con laringoscopía difícil presentaban una distancia significativamente mayor de la piel a las cuerdas vocales (2,80 ± 0,27 cm en comparación con la laringoscopía fácil, 1,75 ± 0,18 cm)[12]
Komatsu et al, en el año 2017 evidenció una pequeña distancia de discriminación entre pacientes con laringoscopía fácil y difícil (2,04 ± 0,3 y 2,23 ± 0,38 cm, respectivamente) [13] Los estudios mostraron diferencias significativas. Es una de las medidas más imprecisas, pudiendo ser explicado por la complejidad de la técnica ecográfica |
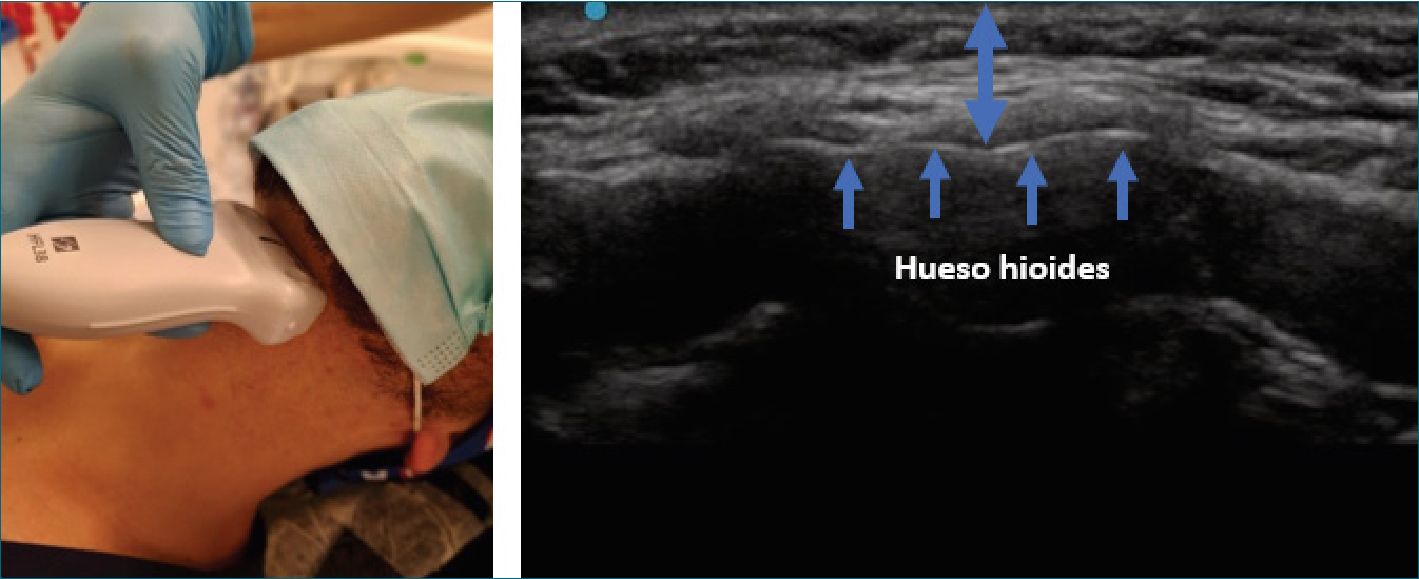
Figura 11. Distancia piel-hueso hioides.
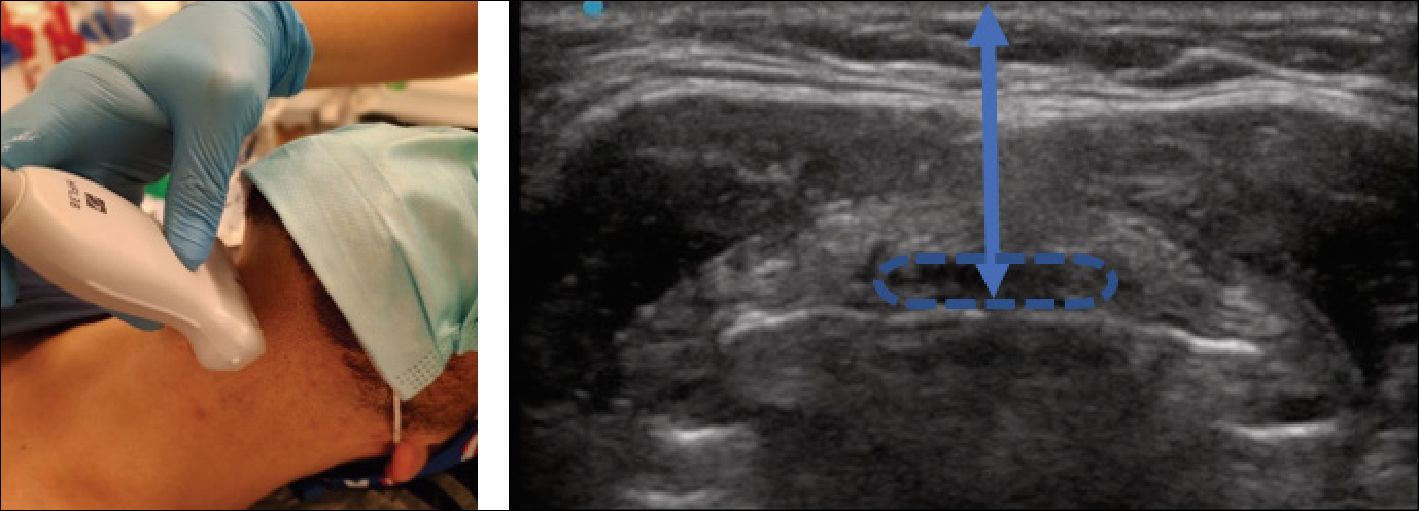
Figura 12. Distancia piel-epiglotis. Línea punteada: epiglotis.
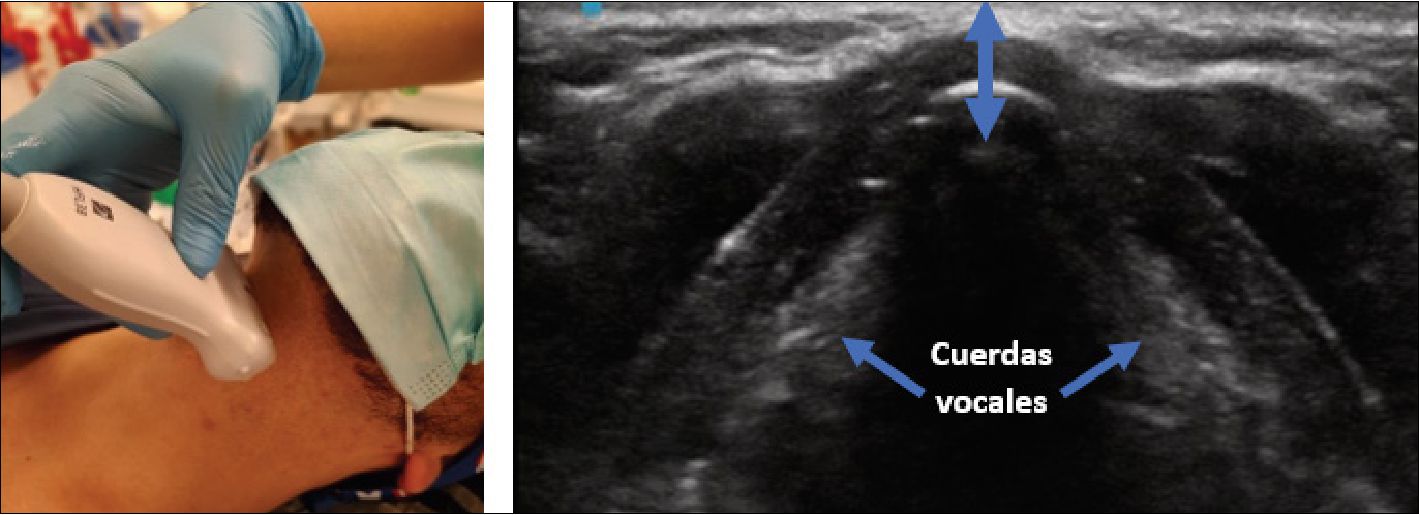
Figura 13. Distancia piel-cuerdas vocales.
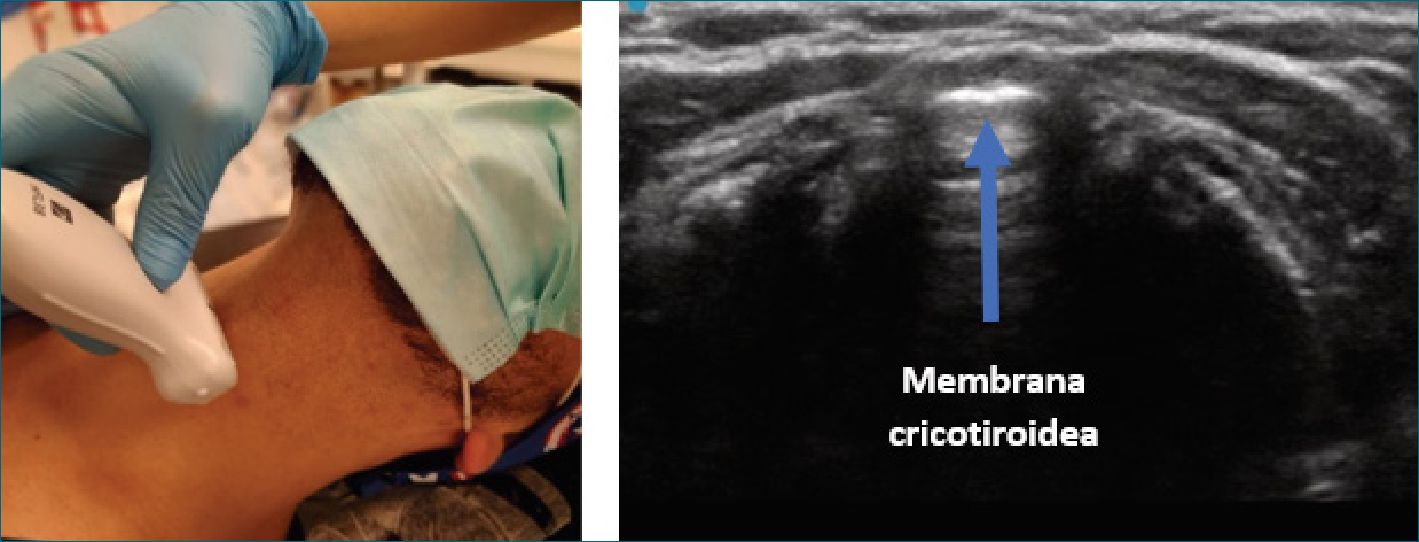
Figura 14. Membrana cricotiroidea en corte transversal.
los bordes cefálicos y caudal de la membrana cricotiroidea. La ubicación de la membrana cricotiroidea se puede marcar en la piel tanto transversal como sagitalmente con un lápiz marcador (Figura 15).
-
b.- Técnica longitudinal[14]
i. Se coloca el transductor transversalmente en la parte anterior del cuello del paciente, cefálico a la escotadura su- praesternal para ver la tráquea, la cual se visualiza como
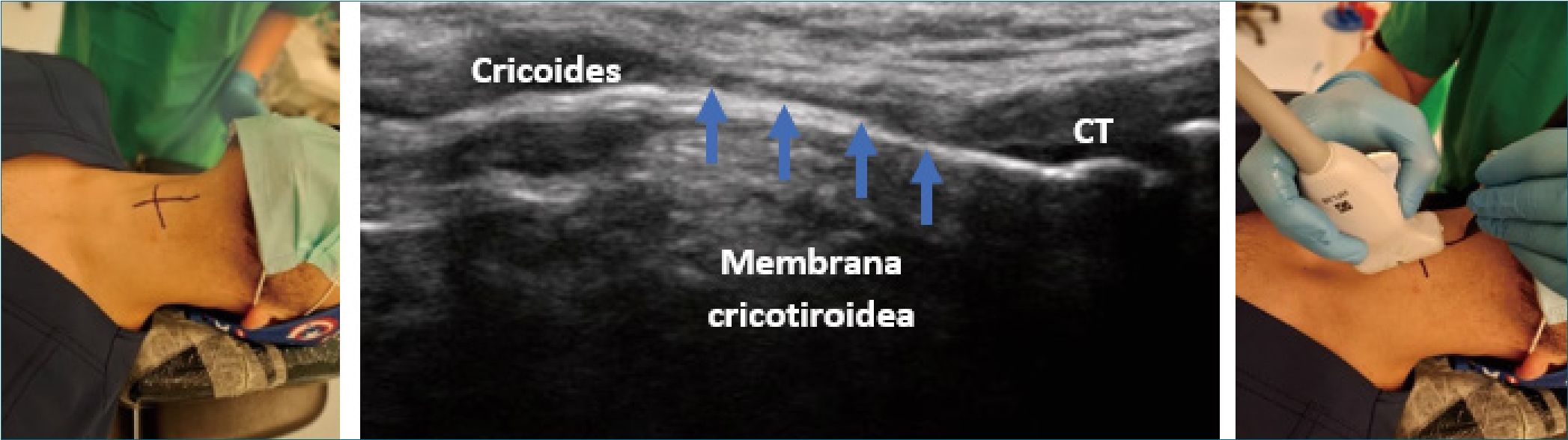
Figura 15. Marcación de la membrana cricotiroidea en eje longitudinal. CT: cartílago tiroides.
una estructura anecoica en forma de herradura con una línea hiperecoica posterior (Figura 7).
ii. El transductor se desliza hacia el lado derecho del paciente, de modo que el borde izquierdo del transductor se coloca sobre la línea media de la tráquea, y la imagen de ultrasonido del anillo traqueal se trunca a la mitad en la pantalla.
iii. El extremo izquierdo del transductor se mantiene en la línea media de la tráquea, mientras que su extremo derecho se gira 90 grados en el plano sagital, lo que da como resultado una exploración longitudinal de la línea media de la tráquea (Figura 2). Se verán varios anillos oscuros (hipoecoicos) antes de la línea hiperecoica, similar a un “collar de cuentas” (Figura 8). Los anillos hipoecoicos oscuros corresponden a la parte anterior de los anillos traqueales.
iv. El transductor se mantiene longitudinalmente en la línea media y se desliza en dirección cefálica hasta que el cartílago cricoides aparece a la vista (como una “perla” oscura más grande, más alargada y colocada anteriormente en comparación con los anillos traqueales). Más en sentido cefálico, también se puede ver la parte distal del cartílago tiroides (Figura 6).
v. Mientras todavía se sostiene el transductor de US con la mano dominante, la mano contraria se usa para deslizar una aguja (como marcador, por su capacidad para proyectar una sombra en la imagen de ultrasonido) entre el transductor y la piel del paciente hasta que la aguja se ve como una sombra a medio camino entre el borde caudal del cartílago tiroides y el borde cefálico del cartílago cricoides.
vi. Ahora se quita el transductor; la aguja marca el centro de la MC en el plano transversal, la que también se puede marcar en la piel con un rotulador (Figura 15).
La traqueotomía percutánea por dilatación (TPD) es un procedimiento cada vez más utilizado en la unidad de cuidados intensivos (UCI). Por lo general, se puede realizar con guía bron- coscópica, sin embargo, en el último tiempo, el US ha surgido como una herramienta útil para la TPD, mejorando potencialmente su tasa de éxito y reduciendo las complicaciones relacionadas con el procedimiento.
En 2020, se realizó una revisión sistemática de ensayos clínicos aleatorizados comparando una TPD guiada por eco
grafía, una guiada por broncoscopía y otra guiada por puntos de referencia anatómicos. A modo general, la TPD guiada por ecografía parece ser segura y comparable a la TPD guiada por broncoscopía con respecto a las complicaciones mayores y menores (RR: 0,48; [IC] 95%: 0,13-1,71, I2 = 0%). Por otro lado, las complicaciones menores se disminuían a cerca de la mitad en comparación con la TPD guiada por puntos de referencia anatómicos (RR: 0,55; IC 95%: 0,31-0,98, I2 = 0%)[15].
La confirmación de la intubación traqueal es crucial en el manejo de la vía aérea, ya que la intubación esofágica inadvertida es una complicación potencialmente peligrosa, que puede resultar en una morbilidad y mortalidad significativas, más aún si ésta es tardía. Actualmente, la capnografía se considera el estándar de oro en la confirmación de la intubación traqueal, a pesar de tener ciertas limitaciones. El US es una nueva herramienta con algunas ventajas definitivas sobre la capnografía, permite una vista en tiempo real y se puede realizar rápidamente; además, es independiente del flujo sanguíneo pulmonar y no requiere ventilación pulmonar. Varios estudios han demostrado que la ecografía permite determinar con precisión la confirmación de la intubación traqueal[16],[17],[18],[19],[20],[21].
El examen se realiza colocando una sonda lineal o curva en la membrana cricotiroidea o justo por encima de la escotadura supraesternal, en plano transversal o longitudinal. Puede realizarse simultáneamente con la intubación o inmediatamente después. En la vista transversal de la MC, se identifica la inserción traqueal del tubo por el “signo de tormenta de nieve”, “signo de bala” o aleteo detrás del cartílago tiroides. Una vez realizada, la intubación traqueal se identifica por una interfaz aire-mucosa con sombreado posterior, “cola de cometa”. En caso de intubación esofágica se observan dos interfaces aire- mucosa con sombreado posterior, conocido como “doble tráquea”.
En una revisión sistemática, evaluaron la utilidad de la ecografía de cabecera para la verificación de la colocación del TET en los servicios de urgencias y las UCI pediátricas. Los autores identificaron nueve estudios (uno con ecografía de cuello o tráquea y cinco con visualización directa de la punta del tubo endotraqueal, entre otros). El número de intubaciones evaluadas mediante ecografía de cuello y tráquea y visualización de la
punta del TET fueron 81 y 165, respectivamente. Para una correcta intubación la sensibilidad y la especificidad con la ecografía de cuello o tráquea fueron del 92%-100% y del 83%-100% para la visualización de la punta del TET [22]. En otra revisión sistemática publicada el año 2015, se analizaron once estudios y 969 intubaciones, obteniendo una sensibilidad y especificidad de la ecografía transtraqueal de 0,98 (IC del 95%: 0,97 a 0,99) y 0,98 (IC del 95%: 0,95 a 0,99), respectivamente[23]. Además de lo anterior, varios estudios han demostrado que la ecografía traqueal en tiempo real es un método preciso para identificar la posición del TET durante la reanimación cardiopulmonar, eliminando la necesidad de interrumpir la compresión toráci- ca[24],[25],[26],[27]. Especial utilidad podría tener durante la pandemia por COVID-19, considerando el alto riesgo de exposición de los proveedores con la confirmación de intubación traqueal por métodos habituales[28].
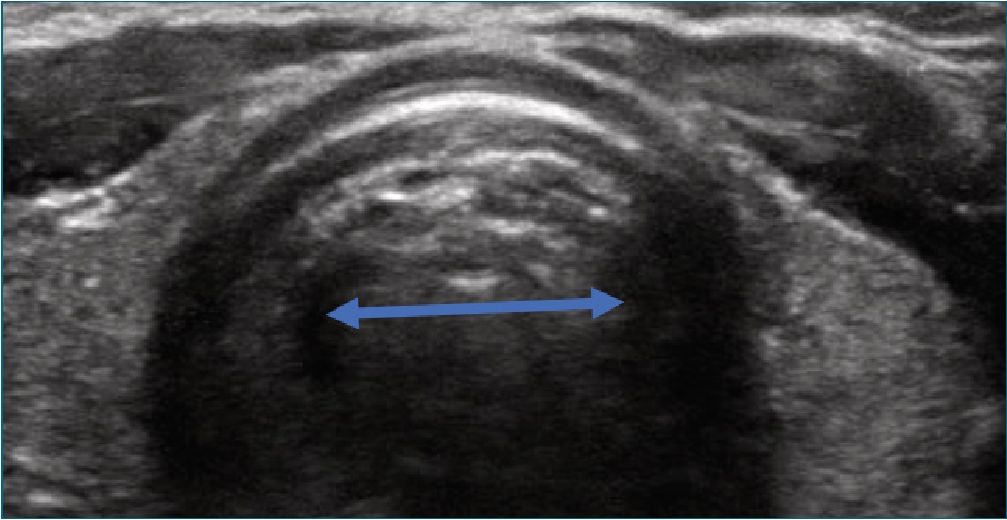
Figura 16. Cálculo de tamaño del TET. Medición de la columna de aire a nivel cricoideo.
La vía aérea pediátrica es especialmente desafiante para el anestesiólogo por sus particularidades, como tamaño pequeño, anatomía variable, flexibilidad y colapsabilidad. Es así que el cálculo de tamaño del TET cobra gran relevancia, un TET muy grande podría llevar a un traumatismo de la vía aérea y/o isquemia traqueal, mientras que uno muy pequeño genera riesgo de fuga durante la ventilación y aspiración pulmonar. Por otra parte, la colocación del TET requiere una profundidad adecuada de éste, evitando así una intubación monobronquial o extubacio- nes incidentales.
El ultrasonido ha demostrado ser confiable en determinar el tamaño del TET a través de la medición del diámetro de la vía aérea a nivel del cricoides en el área subglótica (Figura 16) [29],[30], con ventajas sobre otras técnicas de imagen -TAC y RNM- por requerir de entrenamiento mínimo y no requerir de inmovilidad total ni sedación[29].
Singh S. et al., en su estudio en población pediátrica en un estudio de 100 niños de ambos sexos, entre 12 y 60 meses de edad, sometidos a diversas cirugías electivas bajo anestesia general que requerían intubación endotraqueal, se comparó la medición subglótica bajo ecografía con los valores del tamaño del TET calculados por diversas fórmulas basadas en edad, talla, peso y diámetro del dedo meñique derecho e izquierdo[31]. Se realizó la correlación de tamaño de TET por diferentes modalidades y se obtuvo el coeficiente de correlación de Pearson. Se obtuvo una correlación moderada del mejor ajuste del TET con el tamaño del TET por fórmula basada en la edad (r = 0,743), en la talla (r = 0,683), en el dedo meñique derecho (r = 0,587), en el dedo meñique izquierdo (r = 0,587) y fórmula multiva- riante (r = 0,741). Mientras que con ecografía hubo una fuerte correlación (r = 0,943). Cabe destacar que Hao, en su estudio que incluyó a 50 pacientes pediátricos sometidos a cirugía de escoliosis concluyó que en pacientes con flexión cervical lateral se requiere un TET más pequeño que el tamaño predicho por la ecografía[32].
En el mismo sentido, Sutagatti et al., concluyó que la estimación ecográfica del diámetro subglótico es útil para la selección óptima del tamaño del TET pediátrico con manguito y sin manguito en comparación con fórmulas basadas en índices físicos (p < 0,05)[33].
Respecto a la profundidad del TET, Zavtseva et al., en un
estudio recientemente publicado, compararon el US en una vista paraesternal alta, midiendo la distancia del bisel del TET hasta la arteria pulmonar derecha a nivel de la carina con radiografía tórax. Concluyendo que el US es un método seguro, efectivo y no invasivo para confirmar la ubicación de la punta del TET, aunque no hay datos suficientes para sugerir que US sea el método definitivo o superior para confirmar la ubicación de la punta del TET[30]. Por último, en un estudio observacional prospectivo, que incluyó a 75 pacientes pediátricos de 2 meses a 18 años que requirieron intubación endotraqueal durante cateterismos cardíacos que no eran de emergencia, demostraron que la visualización ecográfica del manguito del TET inflado con solución salina en la escotadura supraesternal se correspondía con la profundidad correcta en la radiografía de tórax con precisión (IC del 95%, 86%-98%)[34].
Finamente, Dong et al., estudió la viabilidad y precisión de la medición de la profundidad del TET con US en 67 pacientes adultos en una UCI, evaluando la distancia entre el margen superior del manguito y el margen superior del arco aórtico. Concluyeron que la ecografía de cabecera proporciona un método novedoso y conveniente para medir la profundidad de TET en pacientes adultos de UCI (r = 0.844, p < 0,001)[35].
El ultrasonido de la vía aérea es una herramienta útil para anestesiólogos, emergenciólogos e intensivistas. Predecir la la- ringoscopía difícil, guiar el acceso cervical de la vía aérea de emergencia y electiva, calcular el tamaño de TET y determinar la profundidad de éste, son algunos de los usos que podrían ayudar a mejorar la atención y la seguridad del paciente. Sin embargo, se necesitan más investigaciones para validar su uso.
Fuente de financiamiento: Los autores declaran no tener fuente de financiamiento.
Conflicto de interés: Los autores declaran no tener conflicto de interés.
Referencias
1. Katz JA, Avram MJ. 4th national audit project of the royal college of anaesthetists and the difficult airway society: Major complications of airway management in the United Kingdom: Report and findings: Major complications of airway management in the United Kingdom report and findings. Anesthesiology. 2012;116(2):496–496. https://doi.org/10.1097/ALN.0b013e31823cf122.
2. You-Ten KE, Siddiqui N, Teoh WH, Kristensen MS. Point-of-care ultrasound (POCUS) of the upper airway. Can J Anaesth. 2018 Apr;65(4):473–84. https://doi.org/10.1007/s12630-018-1064-8 PMID:29349733
3. Andruszkiewicz P, Wojtczak J, Sobczyk D, Stach O, Kowalik I. Effectiveness and validity of sonographic upper airway evaluation to predict difficult laryngoscopy. J Ultrasound Med. 2016 Oct;35(10):2243–52. https://doi.org/10.7863/ultra.15.11098 PMID:27582532
4. Petrisor C, Szabo R, Constantinescu C, Prie A, Hagau N. Ultrasound-based assessment of hyomental distances in neutral, ramped, and maximum hyperextended positions, and derived ratios, for the prediction of difficult airway in the obese population: a pilot diagnostic accuracy study. Anaesthesiol Intensive Ther. 2018;50(2):110–6. https://doi.org/10.5603/AIT.2018.0017 PMID:29953573
5. Wojtczak JA. Submandibular sonography: assessment of hyomental distances and ratio, tongue size, and floor of the mouth musculature using portable sonography. J Ultrasound Med. 2012 Apr;31(4):523–8. https://doi.org/10.7863/jum.2012.31.4.523 PMID:22441908
6. Gomes SH, Simões AM, Nunes AM, Pereira MV, Teoh WH, Costa PS, et al. Useful ultrasonographic parameters to predict difficult laryngoscopy and difficult tracheal intubation-A systematic review and meta-analysis. Front Med (Lausanne). 2021 May;8:671658. https://doi.org/10.3389/fmed.2021.671658 PMID:34124099
7. Wu J, Dong J, Ding Y, Zheng J. Role of anterior neck soft tissue quantifications by ultrasound in predicting difficult laryngoscopy. Med Sci Monit. 2014 Nov;20:2343–50. https://doi.org/10.12659/MSM.891037 PMID:25403231
8. Reddy PB, Punetha P, Chalam KS. Ultrasonography – A viable tool for airway assessment. Indian J Anaesth. 2016 Nov;60(11):807–13. https://doi.org/10.4103/0019-5049.193660 PMID:27942053
9. Adhikari S, Zeger W, Schmier C, Crum T, Craven A, Frrokaj I, et al. Pilot study to determine the utility of point-of-care ultrasound in the assessment of difficult laryngoscopy. Acad Emerg Med. 2011 Jul;18(7):754–8. https://doi.org/10.1111/j.1553-2712.2011.01099.x PMID:21707828
10. Falcetta S, Cavallo S, Gabbanelli V, Pelaia P, Sorbello M, Zdravkovic I, et al. Evaluation of two neck ultrasound measurements as predictors of difficult direct laryngoscopy: A prospective observational study. Eur J Anaesthesiol. 2018 Aug;35(8):605–12. https://doi.org/10.1097/EJA.0000000000000832 PMID:29889671
11. Pinto J, Cordeiro L, Pereira C, Gama R, Fernandes HL, Assunção J. Predicting difficult laryngoscopy using ultrasound measurement of distance from skin to epiglottis. J Crit Care. 2016 Jun;33:26–31. https://doi.org/10.1016/j.jcrc.2016.01.029 PMID:26948251
12. Ezri T, Gewürtz G, Sessler DI, Medalion B, Szmuk P, Hagberg C, et al. Prediction of difficult laryngoscopy in obese patients by ultrasound quantification of anterior neck soft tissue. Anaesthesia. 2003 Nov;58(11):1111–4. https://doi.org/10.1046/j.1365-2044.2003.03412.x PMID:14616599
13. Komatsu R, Sengupta P, Wadhwa A, Akça O, Sessler DI, Ezri T, et al. Ultrasound quantification of anterior soft tissue thickness fails to predict difficult laryngoscopy in obese patients. Anaesth Intensive Care. 2007 Feb;35(1):32–7. https://doi.org/10.1177/0310057X0703500104 PMID:17323663
14. Kristensen MS, Teoh WH, Rudolph SS. Ultrasonographic identification of the cricothyroid membrane: best evidence, techniques, and clinical impact. Br J Anaesth. 2016 Sep;117 Suppl 1:i39–48. https://doi.org/10.1093/bja/aew176 PMID:27432055
15. Gobatto AL, Besen BA, Cestari M, Pelosi P, Malbouisson LM. Ultrasound-guided percutaneous dilational tracheostomy: A systematic review of randomized controlled trials and meta-analysis. J Intensive Care Med. 2020 May;35(5):445–52. https://doi.org/10.1177/0885066618755334 PMID:29409380
16. Das SK, Choupoo NS, Haldar R, Lahkar A. Transtracheal ultrasound for verification of endotracheal tube placement: a systematic review and meta-analysis. Can J Anaesth. 2015 Apr;62(4):413–23. https://doi.org/10.1007/s12630-014-0301-z PMID:25537734
17. Lin MJ, Gurley K, Hoffmann B. Bedside ultrasound for tracheal tube verification in pediatric emergency department and ICU patients: A systematic review. Pediatr Crit Care Med. 2016 Oct;17(10):e469–76. https://doi.org/10.1097/PCC.0000000000000907 PMID:27487913
18. Pfeiffer P, Bache S, Isbye DL, Rudolph SS, Rovsing L, Børglum J. Verification of endotracheal intubation in obese patients – temporal comparison of ultrasound vs. auscultation and capnography. Acta Anaesthesiol Scand. 2012 May;56(5):571–6. https://doi.org/10.1111/j.1399-6576.2011.02630.x PMID:22260400
19. Abbasi S, Farsi D, Zare MA, Hajimohammadi M, Rezai M, Hafezimoghadam P. Direct ultrasound methods: a confirmatory technique for proper endotracheal intubation in the emergency department. Eur J Emerg Med. 2015 Feb;22(1):10–6. https://doi.org/10.1097/MEJ.0000000000000108 PMID:24441884
20. Arya R, Schrift D, Choe C, Al-Jaghbeer M. Real-time tracheal ultrasound for the confirmation of endotracheal intubations in the intensive care unit: An observational study: Real-time ultrasound for endotracheal intubation. J Ultrasound Med. 2019 Feb;38(2):491–7. https://doi.org/10.1002/jum.14723 PMID:30058190
21. Zamani HM, Sharifi MD, Rajabi H y cols. Screening Characteristics of Bedside Ultrasonography in Confirming Endotracheal Tube Placement; a Diagnostic Accuracy Study. Emerg Tehran. 2017;2017;5(1): e19.
22. Lin MJ, Gurley K, Hoffmann B. Bedside ultrasound for tracheal tube verification in pediatric emergency department and ICU patients: A systematic review. Pediatr Crit Care Med. 2016 Oct;17(10):e469–76. https://doi.org/10.1097/PCC.0000000000000907 PMID:27487913
23. Das SK, Choupoo NS, Haldar R, Lahkar A. Transtracheal ultrasound for verification of endotracheal tube placement: a systematic review and meta-analysis. Can J Anaesth. 2015 Apr;62(4):413–23. https://doi.org/10.1007/s12630-014-0301-z PMID:25537734
24. Sahu AK, Bhoi S, Aggarwal P, Mathew R, Nayer J, T AV, et al. Endotracheal tube placement confirmation by ultrasonography: A systematic review and meta-analysis of more than 2500 patients. J Emerg Med. 2020 Aug;59(2):254–64. https://doi.org/10.1016/j.jemermed.2020.04.040 PMID:32553512
25. Chou HC, Chong KM, Sim SS, Ma MH, Liu SH, Chen NC, et al. Real-time tracheal ultrasonography for confirmation of endotracheal tube placement during cardiopulmonary resuscitation. Resuscitation. 2013 Dec;84(12):1708–12. https://doi.org/10.1016/j.resuscitation.2013.06.018 PMID:23851048
26. Lalande É, Fournier F. BET 2: transtracheal ultrasound to confirm tracheal intubation in cardiopulmonary arrest. Emerg Med J. 2014 Dec;31(12):1026–1026. https://doi.org/10.1136/emermed-2014-204339.2 PMID:25411398
27. Sağlam C, Unlüer EE, Karagöz A. Confirmation of endotracheal tube position during resuscitation by bedside ultrasonography. Am J Emerg Med. 2013 Jan;31(1):248–50. https://doi.org/10.1016/j.ajem.2012.08.002 PMID:22981624
28. Gottlieb M, Alerhand S, Long B. Point-of-care ultrasound for intubation confirmation of COVID-19 patients. West J Emerg Med [Internet]. 2020;21(5). Disponible en: https://doi.org/10.5811/westjem.2020.7.48657..
29. Gunjan A, Ankesh, Faseehullah MA. Is ultrasonography a better method of endotracheal tube size estimation in pediatric age group than the conventional physical indices-based formulae? Anesth Essays Res. 2020 Oct-Dec;14(4):561–5. PMID:34349320
30. Zaytseva A, Kurepa D, Ahn S, Weinberger B. Determination of optimal endotracheal tube tip depth from the gum in neonates by X-ray and ultrasound. J Matern Fetal Neonatal Med. 2020 Jun;33(12):2075–80. https://doi.org/10.1080/14767058.2018.1538350 PMID:30332898
31. Singh S, Jindal P, Ramakrishnan P, Raghuvanshi S. Prediction of endotracheal tube size in children by predicting subglottic diameter using ultrasonographic measurement versus traditional formulas. Saudi J Anaesth. 2019 Apr-Jun;13(2):93–9. PMID:31007653
32. Hao J, Zhang J, Dong B, Luo Z. The accuracy of ultrasound to predict endotracheal tube size for pediatric patients with congenital scoliosis. BMC Anesthesiol. 2020 Jul;20(1):183. https://doi.org/10.1186/s12871-020-01106-7 PMID:32736523
33. Sutagatti JG, Raja R, Kurdi MS. Ultrasonographic estimation of Endotracheal Tube size in paediatric patients and its comparison with physical indices based formulae: A prospective study. J Clin Diagn Res. 2017 May;11(5):UC05–08. https://doi.org/10.7860/JCDR/2017/25905.9838 PMID:28658880
34. Uya A, Gautam NK, Rafique MB, Pawelek O, Patnana SR, Gupta-Malhotra M, et al. Point-of-care ultrasound in sternal notch confirms depth of endotracheal tube in children. Pediatr Crit Care Med. 2020 Jul;21(7):e393–8. https://doi.org/10.1097/PCC.0000000000002311 PMID:32168296
35. Dong F, Zhu C, Xu H, Wang J, Zhu Y, Fan Q, et al. Measuring Endotracheal Tube Depth by Bedside Ultrasound in Adult Patients in an Intensive Care Unit: A Pilot Study. Ultrasound Med Biol. 2017 Jun;43(6):1163–70. https://doi.org/10.1016/j.ultrasmedbio.2017.01.018 PMID:28318890

 ORCID
ORCID


 Creative Commons Attribution
Creative Commons Attribution