Karina Rosas-Sánchez M.D. 1 ,*, Damián Gutiérrez-Zárate M.D. 1 , Ricardo Martínez-Zubieta M.D. 2 , Pablo Álvarez-Maldonado M.D. 3 , Enrique Monares-Zepeda M.D. 4
Recibido: 03-04-2021
Aceptado: 06-06-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 2 pp. 234-244|https://doi.org/10.25237/revchilanestv5110021259
PDF|ePub|RIS
Acute respiratory failure: 50 years ago, today and 50 years from now. A narrative review
Abstract
The management of acute respiratory failure may require, among other measures, airway control, mechanical ventilation, and hemodynamic stabilization. About 60% of critically ill patients will require some type of respiratory support. For these reasons, an understanding of respiratory pathophysiology is important. The aim of this review is to establish an up-to-date of the concepts and fundamentals for acute respiratory failure.
Resumen
El manejo de la falla respiratoria aguda puede requerir, entre otras medidas, control de la vía aérea, ventilación mecánica y estabilización hemodinámica. Alrededor del 60% de los pacientes graves requerirán de algún tipo de soporte respiratorio. Por estas razones es importante el entendimiento de la fisiopatología respiratoria. El objetivo de esta revisión es establecer conceptos y fundamentos actualizados sobre la falla respiratoria aguda.
-
Introducción. Hace 50 años sabíamos
El organismo necesita de energía para mantener la función celular y efectuar procesos metabólicos, requiriendo para esto de adecuadas cantidades de oxígeno (O2). En reposo el consumo de oxígeno tisular (VO2) normal oscila entre 4-5 ml/kg/min, pero en el caso de pacientes graves con una alta demanda metabólica se puede incrementar hasta diez veces su valor. También la producción de dióxido de carbono (CO2) pue
de verse modificada en la enfermedad grave por incrementos en la demanda metabólica. La función primordial del sistema respiratorio es mantener un equilibrio en el intercambio de estos gases. Este equilibrio con frecuencia se ve alterado en el paciente grave[1]-[3].
La falla respiratoria aguda se define como la incapacidad del aparato respiratorio para mantener un correcto intercambio gaseoso, sea sin oxigenar adecuadamente la sangre, o permitiendo la acumulación de CO2, o ambas. No existe una definición
absoluta de los niveles de presión arterial de O2 (PaO2) y presión arterial de CO2 (PaCO2) que indiquen la presencia de falla respiratoria, aunque una PaO2 inferior a 60 mmHg y una PaCO2 superior a 50 mmHg son los criterios clásicamente descritos. En la práctica clínica el umbral de referencia utilizado depende de la situación clínica, edad y altitud[4].
Otros términos utilizados en este contexto y frecuentemente mal empleados son: hipoxemia, la cual se define como una PaO2 inferior a 80 mm Hg a nivel del mar respirando al aire ambiente; mientras que la hipoxia es la disminución de la PO2 tisular; y cuando afecta el metabolismo oxidativo celular se conoce como disoxia. El término de falla ventilatoria se refiere a una reducción patológica de la ventilación alveolar con incapacidad de mantener un nivel de PaCO2 óptimo[5].
-
Tipos de falla respiratoria
En la mayor parte de la literatura se destaca principalmente dos tipos de falla respiratoria aguda (tipo I y tipo II), sin embargo, de acuerdo con el proceso fisiopatológico y etiología se reconocen 4 tipos[6]:
• Tipo 1. Se caracteriza por hipoxemia severa. Es el tipo más común en pacientes críticos.
• Tipo 2. Se presenta con incremento de la PCO2 debido a hipoventilación alveolar. Puede o no acompañarse de hipoxemia.
• Tipo 3. La falla respiratoria que ocurre en el periodo perio- peratorio.
• Tipo 4. Ocurre en el estado de choque y resuelve cuando este corrige, mientras no exista algún otro tipo de falla respiratoria sobreimpuesta.
-
Evaluación del intercambio gaseoso
La evaluación de la función respiratoria es indispensable en la atención del paciente crítico durante todas las etapas del tratamiento. Aunque existe una serie de pruebas que son consideradas útiles nos enfocaremos en la evaluación e interpretación de los gases arteriales (Tabla 1).
Presión alveolar de O2 (PAO2)
Se fundamenta en la ecuación del gas alveolar, la cual menciona que a nivel del mar la presión total de los gases (oxigeno, dióxido de carbono, nitrógeno y vapor de agua) es de 760 mmHg (presión atmosférica o barométrica).
Por tanto: PAO2 = PIO2 – (PACO2 / RQ).
PIO2 = presión inspirada de oxígeno.
PACO2 = presión alveolar de CO2.
RQ = cociente respiratorio.
Valor normal a nivel del mar es de 100 mmHg.
La PIO2 normal a nivel del mar y respirando al aire ambiente es de 150 mmHg. Se calcula con la presión barométrica (Pb) menos la presión de vapor de agua (PH2O) por la FiO2. La Pb varía en forma considerable dependiendo de la altitud y debe tomarse en cuenta si no nos encontramos a nivel del mar. La PH2O generada a nivel de las vías respiratorias es un valor constante de 47 mmHg.
| Tabla 1. Evaluación de la función respiratoria en el paciente crítico |
| Oxigenación: |
| Presión arterial de oxígeno (PaO2) |
| Fracción inspirada de oxígeno (FiO2) |
| Relación PaO2/FiO2 |
| Contenido arterial de oxígeno (CaO2) |
| Índice de oxigenación (IO) |
| Gradiente alveolo arterial de oxígeno (PA-aO2) |
| Cortocircuitos derecha-izquierda (Qs/Qt) |
| Saturación arterial de O2 (SaO2) |
| Ventilación: |
| Presión arterial de dióxido de carbono (PaCO2) |
| pH |
| Volumen de espacio muerto (Vd/Vt) |
| Producción de dióxido de carbono (VCO2) |
| CO2 al final de la espiración (EtCO2) |
| Mecánica ventilatoria: |
| Volumen tidal (Vt) |
| Volumen minuto (VE) |
| Distensibilidad |
| Auto-PEEP |
| Capacidad vital |
| Capacidad residual funcional (CRF) |
| Fuerza inspiratoria |
| Resistencia |
| Hemodinamia: |
| Gasto cardiaco |
| Presión venosa central (PVC) |
| Saturación venosa central (SvO2) |
| Presión arterial pulmonar (PAP) |
| Presión de oclusión de la arteria pulmonar (POAP) |
| Agua extravascular pulmonar (AEP) |
| Otros: |
| Radiografía de tórax |
| Ultrasonido pulmonar |
| Tomografía de tórax |
| Cultivos y tinción gram de secreción bronquial |
| Broncoscopía |
La PACO2 se reemplaza por la PaCO2, debido a que la cantidad de CO2 en el aire ambiente es despreciable y la facilidad con que difunde en la barrera alveolo-capilar.
El RQ es la relación entre el CO2 producido y el O2 consumido. Normalmente es de 0.8 (VCO2 200 ml/min / VO2 250 ml/ min), pero depende de la tasa metabólica y del tipo de nutriente metabolizado.
Gradiente alveolo-arterial de O2 (PA-a O2)
Es la diferencia de PO2 entre el gas alveolar y el arterial (PAO2 – PaO2); es una forma indirecta de medir anormalidades en la relación ventilación-perfusión (V/Q). El valor normal es de 5-15 mmHg, y representa un cortocircuito fisiológico (1-3%).
Es un buen marcador para identificar patologías pulmonares con alteración del intercambio gaseoso, y un valor normal más hipercapnia es característico de causas extrapulmonares de falla respiratoria.
Sin embargo, el valor se altera por diversos factores. Presenta comportamientos inestables con aumentos de la PAO2, y por cada 10% de incremento en la FiO2 el PA-a O2 se aumenta 5-7 mmHg. Este efecto es presumiblemente causado por pérdida en la vasoconstricción hipóxica regional. Con la edad se aumenta este gradiente, por lo que se han propuesto corregir el factor edad (PA-aO2 x 0,21 x edad en años). En los pacientes con ventilación mecánica y presión positiva se infraestima el valor, y se recomienda sumar el valor de la presión media de la vía aérea a la Pb[7]-[9].
Cociente arterio-alveolar de O2 (Ra/AO2 )
Es un índice de función pulmonar y eficiencia del intercambio gaseoso. A diferencia del PA-a O2, el Ra/AO2 es más estable a los cambios en la FiO2. Poco utilizado en la actualidad. Valor normal es mayor a 0,75[10].
Relación PaO2/FiO2
Es usado para estimar indirectamente la cantidad de cortocircuitos[11]. Frecuentemente utilizado para estadificar el grado de hipoxemia y predecir mortalidad en los pacientes con síndrome de distrés respiratorio agudo (SDRA). El valor normal en pacientes sin ventilación mecánica es mayor a 500 a nivel del mar y en pacientes con ventilación mecánica varia de 300-500. Debido a las variaciones tanto de la FiO2 y la SaO2 se recomienda especificar el valor de FiO2 con el cual se hizo la medición[12].
Índice de oxigenación (IO)
Desarrollado inicialmente para calcular la severidad de la falla respiratoria en neonatos, incorpora la severidad del cortocircuito que contribuye a la hipoxemia arterial y la reducción de la distensibilidad pulmonar que se observa en los pacientes con edema alveolar en una sola variable (IO = [FiO2 x presión media de la vía aérea x 100]/ PaO2). En adultos ha demostrado ser un buen predictor de mortalidad. Un valor mayor a 15 establece una falla respiratoria severa y aumento de la mortali- dad[13],[14].
Fracción de cortocircuitos intrapulmonares (Qs/Qt)
Define el porcentaje de sangre total que pasa por el pulmón sin interactuar con gas alveolar. Asume al pulmón como un sistema de dos compartimientos: uno en donde el alveolo esta normalmente ventilado y perfundido, y otro que es perfundido y no ventilado. Es derivado de la relación entre el contenido arterial de O2 (CaO2), sangre venosa mixta (CvO2), y sangre capilar pulmonar (CcO2).
Qs/Qt = (CcO2 — CaO2) / (CcO2 – CvO2)
El problema con esta fórmula es la imposibilidad para medir el CcO2 directamente. Por lo tanto, es recomendado que el cálculo sea con oxígeno al 100%, para producir una saturación de la sangre capilar pulmonar al 100%. La Qs/Qt normalmente no debe exceder el 5% del gasto cardiaco[7].
Espacio muerto (Vd/Vt)
El cálculo está basado en la diferencia entre la presión de CO2 exhalado (PECO2) y la PaCO2. En un pulmón sano el CO2 arterial se equilibra rápidamente con el alveolar, existiendo una diferencia normal de 2-5 mmHg. Cuando hay incremento del Vd/Vt el PECO2 disminuye en comparación con la PaCO2. Este principio se basa en la ecuación de Bohr[7]:
Vd/Vt = (PaCO2 – PECO2) / PaCO2
Falla Respiratoria tipo 1: Hipoxémica
-
Fisiopatología de la Hipoxemia
Hipoxemia se refiere a una baja presión parcial de oxígeno a nivel arterial y, por ende, un bajo contenido de oxígeno. Existen varios factores involucrados en su desarrollo.
El primero es el contenido de oxígeno en el are inspirado y a nivel del mar la presión parcial de oxígeno en de 150 mmHg, la cual desciende progresivamente con incrementos en la altitud, hasta alcanzar el nadir en 43 mmHg (cumbre del monte Everest).
La ventilación alveolar es el siguiente paso en la oxigenación arterial. En una persona con ventilación en reposo, con una PIO2 de 150 mmHg y una ventilación alveolar de 5 l/min (cerca de lo normal), se puede alcanzar una PAO2 de 100 mmHg, lo que confiere la presión necesaria para saturar completamente la hemoglobina (Hb). Ya que el O2 es poco soluble en el plasma, así que, una vez que la Hb se sature completamente, la ventilación alveolar solo agrega pequeñas cantidades de O2 a la sangre. Esto contrasta con el comportamiento del CO2, este continúa descendiendo tanto en la sangre como a nivel alveolar con incrementos en la ventilación alveolar[2].
Hacer coincidir el flujo sanguíneo y el gas alveolar es el siguiente paso. En personas sin patologías respiratorias, la musculatura lisa de la vía aérea se asegura que la V/Q sea cercana a 1:1 en todas las unidades alveolo-capilares. Independientemente del cociente V/Q el siguiente paso para lograr la oxigenación arterial es la difusión del oxígeno a través de la membrana alveolo-capilar hasta llegar al plasma y de ahí alojarse en el citoplasma de los eritrocitos, donde se enlazara con la molécula de Hb. La difusión y la unión a la Hb es un proceso tiempo-dependiente que generalmente ocurre en 250 mseg. El tiempo de tránsito normal de un eritrocito en el capilar alveolar es de aproximadamente 500-750 mseg, tiempo apropiado para completar la transferencia de O2. El último determinante del contenido de oxígeno arterial es la cantidad de Hb y su capacidad para enlazar moléculas de O2. En condiciones normales la Hb se satura al 100% con PaO2 entre 60-70 mmHg, como se ejemplifica en la Figura 1 representado en la curva de disociación de la Hb[5].
-
Mecanismos de hipoxemia
Es importante considerar que la hipoxemia puede deberse a la coexistencia de más de dos mecanismos diferentes, por lo que, clasificarlos de forma independiente solo se realiza con fines didácticos (Tabla 2). Tomando esto en cuenta, podemos decir que los mecanismos de hipoxemia son:
1. Disminución de la presión inspirada de oxígeno.
2. Hipoventilación alveolar.
3. Alteraciones en la difusión.
4. Alteraciones en el V/Q.
5. Presencia de cortocircuitos intrapulmonares (Shunt).
Disminución de la presión inspirada de oxígeno
Con forme la altitud aumenta se observa un descenso en la presión barométrica condicionando de igual forma un descenso en PIO2, componente fundamental de la ecuación de la PAO2. A medida que la PIO2 disminuye se ponen en marcha mecanismos compensatorios para restaurar la oxigenación, de los cuales, el más rápido es un aumento de la ventilación minuto que, al disminuir la PACO2, aumenta la PAO2 y por ende la PaO2. Esta respuesta requiere de la integridad de los quimiorreceptores ca- rotideos y la bomba ventilatoria.

Figura 1. Curva de disociación de la hemoglobina. La curva de disociación de la hemoglobina ejemplifica la relación entre la saturación de oxígeno y la presión parcial de oxígeno. El desplazamiento de la curva a la derecha facilita la liberación de oxígeno a nivel de los capilares periféricos y la captación en los capilares pulmonares. El desplazamiento a la izquierda tiene un efecto opuesto. La P50 representa el valor de la presión parcial de oxígeno a la cual se satura la hemoglobina en un 50%, el valor normal es de 27 mm Hg, y mediante este valor se puede identificar los desplazamientos de la curva. El efecto Haldane ocurre a nivel de los capilares pulmonares donde la presión parcial de oxígeno es alta y desplaza el dióxido de carbono. El efecto Bohr, por el contrario, cuando la concentración de dióxido de carbono es alta, como en los capilares periféricos, esté se uno a la hemoglobina y pierde afinidad por el oxígeno. O2, oxígeno; CO2, dióxido de carbono; DPG, 2,3-difosfoglicerato; Temp, temperatura; PO2, presión parcial de oxígeno.
Hipoventilación alveolar
La ventilación alveolar (VA) es el volumen de aire que alcanza los alvéolos en un minuto y participa en el intercambio de gases, mientras que la ventilación de espacio muerto (VD) es la parte de la ventilación minuto (VE) que no participa en el
intercambio de gases. La disminución de la VA se acompaña de un aumento directo de la PACO2 y secundariamente una disminución de la PAO2, que será el responsable final de la hipoxe- mia. En general cuando existen estas alteraciones el PA-aO2 es normal.
La variable que se utiliza para hablar de hipoventilación es la PaCO2 y de abordará con más profundidad más adelante. Cuando aparece hipoxemia en el contexto de hipoventilación alveolar es un estado tardío y con deterioro clínico significati- vo[15].
Alteraciones en la difusión
Se define como la alteración del paso de O2 desde el alveolo al capilar pulmonar. Generalmente, es como consecuencia de inflamación o fibrosis de la membrana alveolo-capilar. Se sabe que el intercambio gaseoso se rige por la Ley de Fick, que describe que el paso de gases será directamente proporcional al área de la membrana y a la diferencia de presión de los gases en ambos lados de la membrana, e inversamente proporcional al grosor de esta.
Es así como en enfermedades pulmonares en las que hay destrucción de los capilares pulmonares, la capacidad de difusión se ve alterada significativamente. Esto se observa en pacientes con enfermedad pulmonar intersticial y más frecuente cuando se enfrentan a un estresor que necesite aumentar su capacidad de difusión como el ejercicio. La hipoxemia provocada por trastornos de la difusión se puede revertir con aumento de la FiO2[16].
Alteración en la ventilación perfusión V/Q
Se denomina así, al disbalance entre el flujo sanguíneo y la ventilación, lo que causa que la composición del gas alveolar varíe de región a región. En un adulto joven la relación V/Q en reposo puede variar de 0,6 a 3 con una media de 0,8 a 1. La alteración en la V/Q es la causa más común de hipoxemia[17].
La relación V/Q en cada alveolo determina las PAO2 y PACO2, y, por lo tanto, la PaO2 y PaCO2 del capilar. Las unidades con baja V/Q (alveolos no ventilados, pero perfundidos) presentan baja PaO2 y alta PaCO2 y las unidades con alta V/Q (alveolos ventilados, pero no perfundidos) tienen valores opuestos. Estas diferencias se observan en las zonas descritas por West, modificadas posteriormente por Hughes[18].
El desequilibrio de la relación V/Q provoca el desarrollo de los siguientes 2 patrones:
1. Áreas perfundidas, pero mal ventiladas (V/Q < 1): La situación más extrema es el cortocircuito intrapulmonar y se caracteriza porque la administración de oxígeno suplemen-
Tabla 2. Características de la falla respiratoria hipoxémica

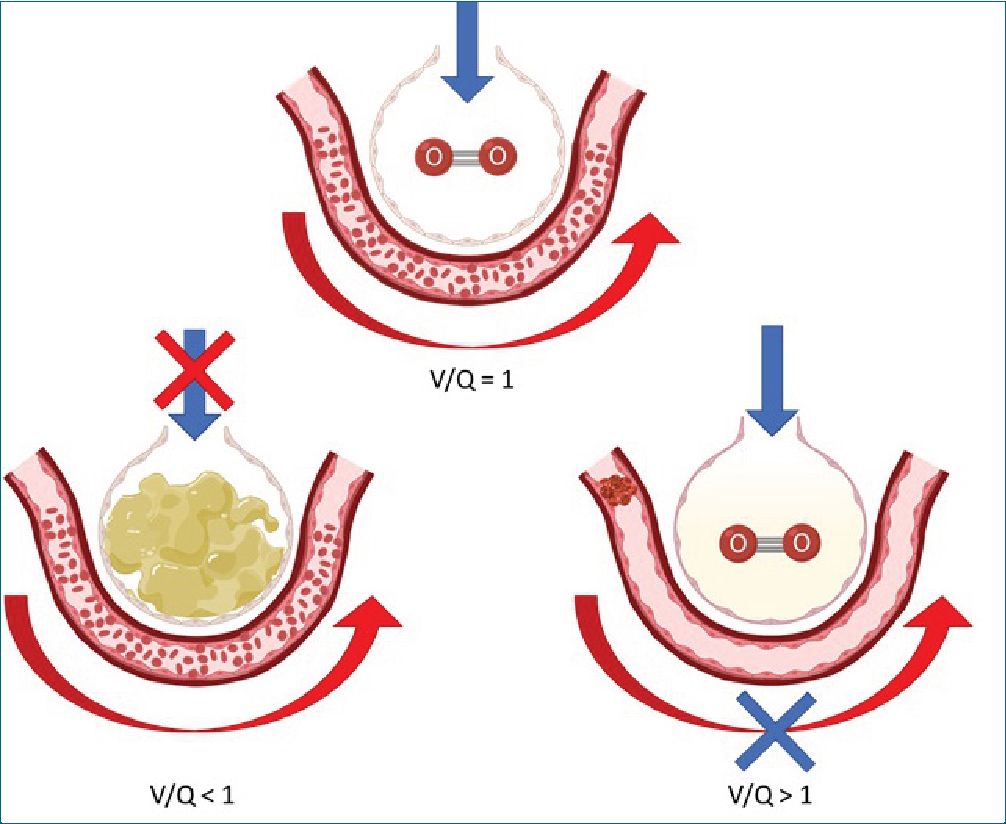
Figura 2. Desequilibrio entre la ventilación y perfusión (V/Q).
tario al 100% no eleva los valores de PaO2. La hipoxemia en enfermedad pulmonar obstructiva crónica (EPOC) exacerbada es explicada primariamente por un V/Q bajo, que se ha atribuido a las alteraciones en la vía aérea de conducción, y puede ser amplificado en presencia de neumonía, atelectasias o aumento del consumo de oxígeno probable por aumento en el trabajo de los músculos respiratorios[19]. El SDRA se caracteriza por pérdida de unidades grandes alveolares y cuando el cortocircuito excede el 50% del gasto cardiaco se observa hipoxemia. Estos pacientes se ven beneficiados con maniobras que permiten reclutar alveolos y secundariamente mejorar la oxigenación, como ocurre con incrementos en la PEEP y la posición prono[20],[21].
2. Áreas ventiladas, pero mal perfundidas (V/Q > 1) (Figura 2): Es lo que se conoce como espacio muerto. Si el aumento del espacio muerto es leve o moderado, la ventilación malgastada puede compensarse aumentado la VE, de manera que la cantidad de aire que llega a los alveolos bien per- fundidos continúa siendo normal. El embolismo pulmonar resulta en regiones de V/Q alto, y la redistribución del flujo a otras regiones pulmonares las transforma regiones con V/Q bajo, causando hipoxemia y un incremento en la PA-aO2. Sin embargo, la razón de la hipoxemia es principalmente incrementos en el V/Q. La hipoxemia puede empeorar con falla circulatoria o por cortocircuitos intracardiacos derecha- izquierda, ambos provocados por hipertensión pulmonar aguda[22],[23].
Cortocircuito intrapulmonar
Es el paso de sangre al sistema arterial sin pasar por áreas pulmonares ventiladas para realizar la hematosis. La mezcla de sangre venosa oxigenada es el mecanismo más potente de hi- poxemia. Si bien el cortocircuito es un grado extremo de alteraciones V/Q, dadas las afecciones que lo provocan y su respuesta nula a las FiO2 altas se considera como un mecanismo particular. Ocurre en enfermedades pulmonares con grandes conexiones arterio-venosas como cirrosis y teleangiectasia hemorrágica hereditaria. Es el mecanismo de hipoxemia en el SDRA, neumonía grave y atelectasias[7].
El efecto de grados crecientes de cortocircuitos sobre la PaCO2 es tardío, ya que como se ha mencionado, disminuciones pequeñas de PaO2 estimulan la respuesta de los quimiorre- ceptores y provocan aumento de la VE, controlando los niveles de PaCO2. PaO2/FiO2 es un estimador aproximado de la fracción de cortocircuito. Sí PaO2/FiO2 es < 200, el cortocircuito es más de 20%, mientras que una PaO2/FiO2 > 200 indica que el cortocircuito es menor del 20%[11].
También conocida como falla ventilatoria, se define con una PaCO2 > 45 mm Hg. Una elevación rápida de la PaCO2 lleva a una caída del pH arterial como consecuencia de una relación alterada entre HCO3 –/PaCO2. La acidosis respiratoria (pH < 7,35 e hipercapnia) es la característica en la falla respiratoria aguda hipercápnica[5].
-
Fisiopatología de la hipercapnia
El CO2 es el producto final del metabolismo aeróbico. Es producido casi en su mayoría por la mitocondria, donde se encuentra la PCO2 más alta; a partir de aquí y por gradientes de presión es transportado por la sangre hasta los pulmones. En los capilares pulmonares la PCO2 es mayor que la presión alveolar y difunde hacia el alveolo hasta equilibrarse. Entonces se identifican los determinantes de la PaCO2 con la relación entre la tasa de VCO2 y la tasa de ventilación alveolar (VA):
PaCO2 = k x (VCO2/VA)
La VA es la proporción del volumen minuto (VE) que no es ventilación de Vd/Vt:
PaCO2 = k x [VCO2/VE(1 – Vd/Vt)]
De esta forma se reconocen las tres mayores fuentes de hipercapnia: incremento en la producción de CO2 (VCO2), hi- poventilación (1/VE), e incremento en el espacio muerto (Vd/Vt) [24].
Hipoventilación
La hipoventilación produce hipoxemia como hipercapnia, pero el aumento del CO2 es característico y es el primer signo; en compañía de hipoxia se trata de un evento tardío. Esta se refiere principalmente a una alteración en la bomba respiratoria en cualquiera de sus compontes. Aquí es importante hacer distinción de fatiga y debilidad musculares. La fatiga es la inhabilidad de los músculos respiratorios para continuar generando suficiente presión para mantener la VA y ocurre cuando no se cumplen las demandas energéticas, mientras que debilidad es una reducción de la fuerza que no es reversible al reposo[25]. Existen múltiples causas de hipoventilación, las cuales se describen en la Figura 3.
Incremento del espacio muerto
Las anormalidades del V/Q no tienen como característica la hipercapnia a menos que sea un proceso tardío. Sin embargo, la hipercapnia si aparece con aumento del espacio muerto
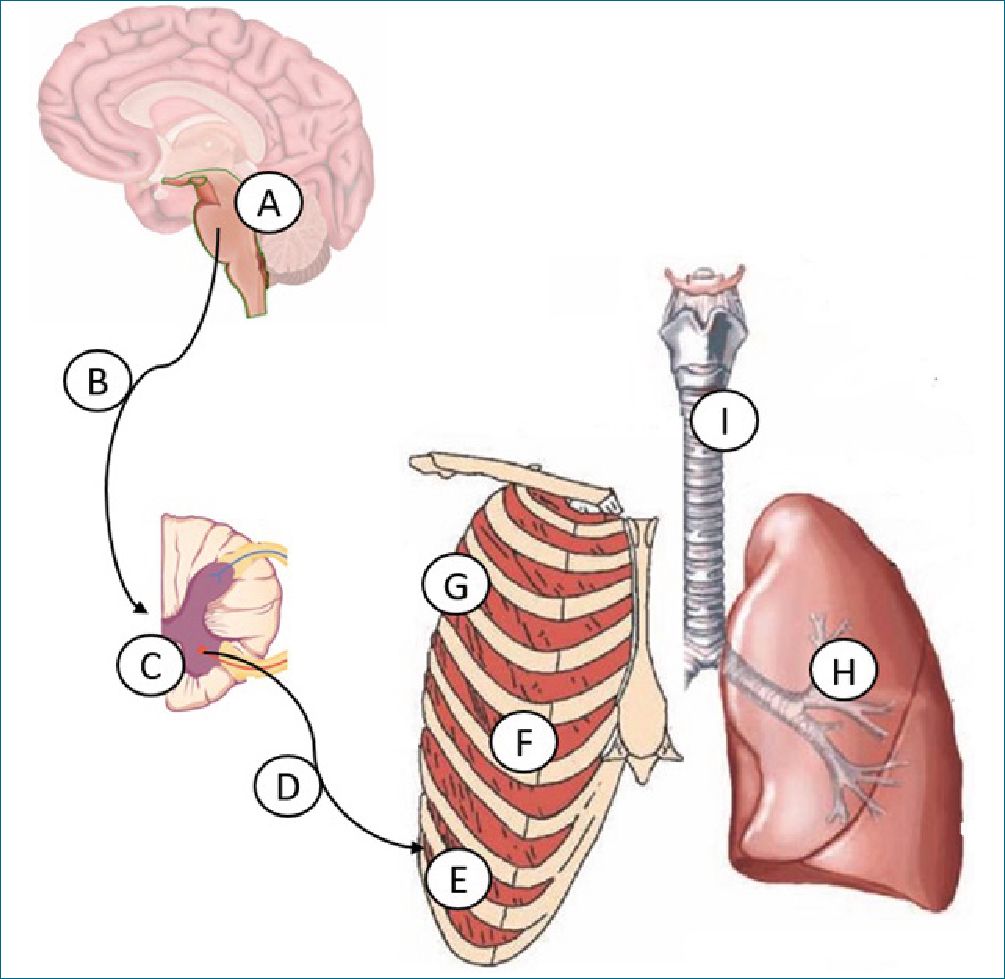
Figura 3. Descripción anatómica de las causas de hipoventilación.
A. Centro respiratorio. Este puede estar deprimido por hipoxia o niveles altos de PCO2. La pérdida de la sensibilidad a CO2 se observa en pacientes con EPOC y falla ventilatoria crónica. Medicamentos como opioides, barbitúricos y benzodiacepinas causan depresión del centro respiratorio e hipoventilación.
B. Motoneurona superior. La afección más frecuente es por trauma. Lesiones por arriba de C3-C4 pueden afectar al nervio frénico y resultar en apnea. Sin embargo, lesiones más bajas afecta a nivel de músculos intercostales conservando la función del diafragma.
C. Médula espinal. La patología típica es la poliomielitis con parálisis de todos los músculos respiratorios. Actualmente una patología rara.
D. Motoneurona inferior. El síndrome de Guillain-Barré, una polineuritis idiopática, comúnmente cursa con falla ventilatoria. La polineuropatía del enfermo crítico es frecuente de los pacientes en la UCI, causa identificable de hipoventilación y falla en el destete de la ventilación mecánica.
E. Unión neuromuscular. La miastenia gravis es la causa más común de falla ventilatoria por afección a este nivel. Otras causas incluyen al botulismo, bloqueadores neuromusculares e intoxicación organofosforados.
F. Músculos respiratorios. La eficiencia de los músculos respiratorios principalmente el diafragma puede verse disminuida en pacientes por afecciones abdominales y aumento de la presión intraabdominal, así como en etapas tardías de problemas respiratorios agudos, en pacientes con ventilación mecánica prolongada con atrofia diafragmática y pacientes con pobre reserva pulmonar.
G. Pérdida de la integridad de la pared torácica. Fracturas costales múltiples, tórax inestable y neumotórax a tensión, causando dolor y como característica una respiración rápida y superficial.
H. Aumento de la resistencia de las vías aéreas pequeñas. Es la causa más común de falla ventilatoria. Se observa en los pacientes con agudización del asma y con EPOC agudizado quienes presentan broncoespasmo o aumento de las secreciones y la pobre reserva pulmonar condiciona el aumento del CO2.
I. Obstrucción de la vía aérea superior. Las causas son diversas, desde tumores, cuerpo extraño, sangrado e infecciones de la vía aérea superior. Generalmente la falla ventilatoria es un evento tardío de la evolución de la patología.
(enfisema avanzado, con destrucción de la interface alveolo-arterial), la PaCO2 usualmente empieza a incrementar cuando la ventilación de espacio muerto es más del 50% de la ventilación total (Vd/Vt > 0,5)[26].
En patologías agudas donde existe broncoconstricción severa e hiperinsuflación dinámica, se caracterizan por un aumento en el espacio muerto, aunque otros contribuyentes como la fatiga muscular pueden ser más predominantes en la falla respiratoria[27]. En agudización de la EPOC se debe mantener el mecanismo compensador de la vasoconstricción hipóxica para así mantener el flujo sanguíneo pulmonar hacia áreas del pulmón bien ventiladas y no perpetuar la hipercapnia, por lo que la recomendación es mantener una hipoxemia leve (saturación entre 88%-92%) y también conservar el impulso respiratorio a través de la hipoxemia[28],[29]. La medición del espacio muerto ha cobrado importancia clínica en el SDRA, demostrándose que pacientes con Vd/Vt mayor al 50% tienen riesgo alto de muerte que se incrementa por cada incremento adicional de 10%. Aunque no se ha demostrado en forma consistente que un PEEP alto sea el causante, si lo es para un volumen tidal (Vt) mayor a 10 ml/kg, lo que soporta utilizar 6-8 ml/kg[30],[31]. Durante una prueba de ventilación espontánea puede haber fatiga diafrag- mática con disminución del Vt y clínicamente una respiración rápida y superficial con consecuente incremento del Vd/Vt[32].
Incremento en la producción de CO2
Obedece a un metabolismo oxidativo, pero se puede generar a partir de ácidos extracelulares de iones hidrogeno que se combinan con iones bicarbonato resultando la producción final de CO2. Cualquiera que sea la fuente, el incremento en la producción es acompañada con incremento en la VE, así manteniendo la PaCO2 constante. Por lo tanto, en condiciones normales no hay hipercapnia, a menos que la capacidad de excreción del CO2 se encuentre alterada. Como en patologías pulmonares crónicas que se someten a un evento de estrés con imposibilidad para eliminar el CO2 a la misma tasa que se produce. Existe la preocupación que en el paciente con falla respiratoria se debe administrar una terapia nutricional baja en carbohidratos para reducir la producción de CO2, sin embargo, esta estrategia no ha demostrado ser superior y actualmente no está recomendada[33],[34].
-
Falla respiratoria tipo 3: Perioperatoria
El mecanismo fisiopatológico primario es la formación de atelectasias en el perioperatorio. En general, anormalidades en la cavidad abdominal reduce la capacidad funcional residual en estos pacientes, llevando a colapso progresivo en zonas dependientes del pulmón. Se produce una falla respiratoria tipo 1, tipo 2, o ambas.
Los factores de riesgo principales son: cirugías torácicas con ventilación de un solo pulmón, cirugía abdominal, cirugías de más de 3 horas, balance de líquidos positivo durante la cirugía, obesidad, tabaquismo y patologías pulmonares previas[35].
Los esfuerzos están enfocados en las medidas preventivas como: ventilación en semifowler, control del dolor, cuidar el balance de líquido, un manejo ventilatorio con medidas de protección pulmonar, titulación de PEEP, incentivar el uso de ventilación no invasiva en forma temprana en el postoperatorio, y el uso juicioso de oxígeno[36].
El estado de choque se caracteriza por baja perfusión tisular y aumento del consumo de oxígeno. La hipoxemia es multi- factorial. Se describen alteraciones en la V/Q por un bajo flujo capilar pulmonar incrementando el Vd/Vt[37]. Frecuentemente, estos pacientes presentan taquipnea, dificultad respiratoria y requieren de soporte ventilatorio para estabilizar el intercambio gaseoso, disminuir la demanda ventilatoria y limitar el gasto cardiaco destinado al trabajo de los músculos respiratorios. Una vez corregido el estado de hipoperfusión se puede liberar fácilmente del soporte ventilatorio[38],[39].
-
Estrategias terapéuticas. Hoy
Evidentemente la falla respiratoria aguda tiene diferentes causas, por lo que establecer un algoritmo de manejo universal puede ser infructuoso y al contrario, consideramos que la terapéutica debe ir enfocada en la causa más allá del síntoma. Sin embargo, con referencia en la mejor evidencia posible hasta ahora podemos establecer lineamientos generales de los cuales el clínico puede partir para tomar las mejores decisiones al enfrentarse a pacientes en falla respiratoria aguda.
Considerando la fisiopatología de la falla respiratoria aguda podemos tener 3 posibles escenarios clínicos:
1. Falla respiratoria hipoxémica (tipo 1).
2. Falla respiratoria hipercápnica (tipo 2).
3. Falla respiratoria de componente mixto.
La administración de oxígeno suplementario a través de cánulas nasales o mascarillas simples o con reservorio (oxígeno- terapia convencional), se ha establecido como el primer paso en la atención de un paciente con falla respiratoria aguda. El reto inicia con el paciente que no le es suficiente la oxígenote- rapia convencional y desde el abordaje inicial presenta disnea de moderada a severa (con signos de aumento del trabajo respiratorio, uso de músculos accesorios o movimiento abdominal paradójico, y taquipnea mayor a 30 rpm) y/o con deterioro rápido y progresivo. Razón por la cual el clínico deberá contar con medidas de soporte respiratorio no invasivo e invasivo (Figura 4).
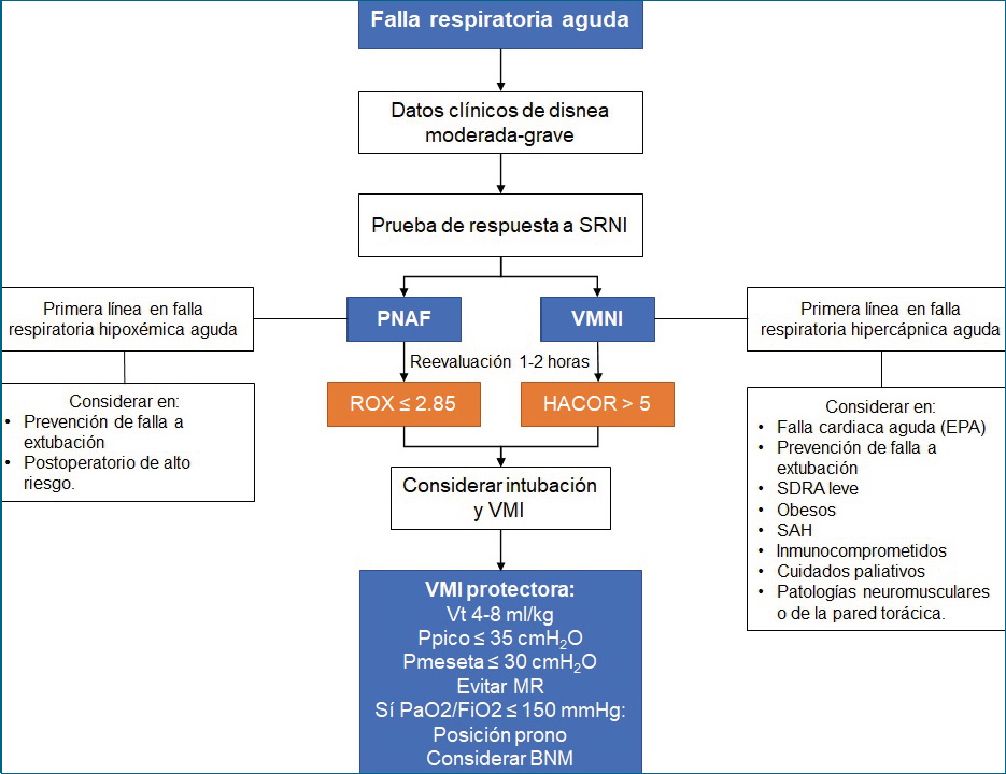
Figura 4. Propuesta de algoritmo de decisiones iniciales para el paciente en falla respiratoria aguda. EPA, edema pulmonar agudo; SAH, síndrome de apnea-hipoapnea del sueño; MR, maniobras de reclutamiento; BNM, bloqueadores neuromusculares.
-
Soporte respiratorio no invasivo
El rol del soporte respiratorio no invasivo (SRNI) históricamente ha sido evitar la intubación y por tanto la ventilación mecánica invasiva (VMI). La controversia actual estriba en la posibilidad de retrasar innecesariamente la intubación la cual se asocia a aumento en la morbilidad y mortalidad comparado con aquellos pacientes que se intubaron “tempranamente”[40],[41]. En teoría mantener al paciente respirando en forma espontánea con un impulso respiratorio alto incrementa el estrés en el tejido pulmonar y aumenta la fuga capilar causando lesión pulmonar auto-inducida (P-SILI), lo que podría explicar gran parte de los estragos de retrasar en forma innecesaria la intubación[42],[43].
Desde otra perspectiva el SRNI puede evitar la intubación en 50%-60% de los casos. Es por esta razón que un abordaje idóneo es hacer una prueba de respuesta al SRNI a la par de un monitoreo continuo estrecho. El monitoreo tendrá el objetivo de buscar variables que se han asociado a falla del SRNI: índices, oxigenación, trabajo respiratorio, uso de vasopresores y puntajes de severidad. Con el fin de evitar lo más posible retrasar la intubación.
Puntas nasales de alto flujo (PNAF)
Se trata de un dispositivo que comparado con la oxigenote- rapia convencional tiene ventajas de controlar el flujo, temperatura, humedad y la FiO2 administrada. Se puede administrar entre 20-60 l/min de flujo, con FiO2 hasta del 100%, y temperatura de 37°C. Debe tenerse en cuenta que la base de la terapia con PNAF es el flujo, ya que en teoría permite beneficios fisiológicos: 1) incremento de la presión de la vía aérea; 2) incremento del volumen pulmonar al final de la espiración (EELV); lo que podría contribuir a una mejoría en la oxigenación (independiente de las concentraciones de FiO2), disminución del trabajo respiratorio y un menor espacio muerto fisiológico[44].
La mejor evidencia de las PNAF es en falla respiratoria aguda hipoxémica, donde ha demostrado disminución del riesgo de intubación apenas superando a la oxigenoterapia convencional sin un impacto en la mortalidad[45]. Otras indicaciones son: prevención de falla a la extubación y en el posoperatorio en pacientes de alto riesgo como obesos y/o cirugía cardiotorácica. En falla respiratoria aguda hipercápnica tiene escasa evidencia y futuros ensayos clínicos exploran la utilidad en acidosis respiratoria leve a moderada[46].
El monitoreo de las PNAF se realiza con el índice de ROX, el cual se define como razón entre SPO2/FiO2 sobre la frecuencia respiratoria. Este índice se ha validado como un predictor de éxito o falla al dispositivo en pacientes con falla respiratoria aguda. Un índice de ROX por debajo de 2,85, 3,47 y 3,85 a las 2, 6 y 12 h respectivamente, tiene un riesgo alto de falla al dispositivo, siendo necesario aumentar el nivel de monitori- zación e intervención terapéutica. Posiblemente, la parte más importante del índice de ROX sea la evolución temporal de este índice y su cambio respecto a las intervenciones terapéuticas realizadas.
Ventilación mecánica no invasiva (VMNI)
La falla respiratoria aguda hipercápnica es clásicamente considerada la indicación para la VMNI. La aplicación de VMNI tiene ventajas fisiológicas importantes. Con presión positiva continua de la vía aérea (CPAP) se incrementa la capacidad funcional residual (CFR), con disminución del cortocircuito intrapulmonar, disminuyendo el trabajo respiratorio al disminuir la elastancia del sistema, además de disminuir la precarga y postcarga cardiaca. La ventilación a presión positiva en 2 niveles difiere de la CPAP en proveer asistencia inspiratoria mediante la presión soporte (PS) o presión positiva inspiratoria de la vía aérea (IPAP) y así restar trabajo respiratorio a los músculos de la respiración, incremento del volumen corriente, descenso de la frecuencia respiratoria y mejoría del intercambio gaseoso. Todo esto tiene como resultado una mejoría en la oxigenación, disminución del trabajo respiratorio y menor necesidad de intubación[48].
La evidencia más fuerte de la VMNI es como intervención de primera línea en EPOC exacerbado tanto en acidosis respiratoria leve (pH 7,30-7,35) como en casos más severos (pH < 7,30) [49]. Otras patologías con indicación para uso de VMNI es: edema pulmonar aguda cardiogénico, complicaciones pulmonares en obesos, síndrome de apnea-hipoventilación, prevención de falla a la extubación en pacientes de alto riesgo, inmunocom- prometidos, cuidados paliativos y patologías neuromusculares o de la pared torácica. En falla respiratoria aguda hipoxémica es controvertido su uso estando reservado para casos leves de SDRA[50].
La elección del tipo de interfase podría determinar la tolerancia y el éxito del dispositivo. El helmet es la interfase de elección y con mejor evidencia, pero tiene la desventaja de dis- ponibilidad[51].
Contraindicaciones para usar la VMNI son:
• Incapacidad para tolerar la máscara debido al disconfort y/o dolor.
• Incapacidad de proteger la vía aérea por tos y/o deglución deficiente (riesgo broncoaspiración).
• Inestabilidad hemodinámica.
• Inestabilidad electrocardiográfica con evidencia de isquemia o de arritmias ventriculares.
• Glasgow menor de 10 o incapacidad del paciente para cooperar con el equipo de médicos, enfermería e inhalotera- peutas y/o interactuar con los dispositivos.
• Hemorragia digestiva alta activa.
• Cirugía facial reciente.
• Trauma facial reciente.
• Deformidad facial.
• Cirugía reciente de esófago o estómago.
El monitoreo para evaluar el éxito o fallo a la VMNI serán parámetros como oxigenación (PaO2/FiO2) y valorar la severidad de la enfermedad (SAPS II, SOFA, APACHE II). En un análisis post hoc del estudio FLORALI se encontró que un Vt > 9 mL/kg de peso predicho en la primera hora se asoció a necesidad de intubación[52]. Un puntaje HACOR > 5 puntos después 1-2 h y a las 24 h se asocia a falla al dispositivo[53],[54].
-
Ventilación mecánica invasiva
Los objetivos de la ventilación serán encaminados en minimizar el daño pulmonar inducido por el ventilador (VILI), así
como reducir y distribuir el estrés pulmonar y vascular. La ventilación protectora se basa en Vt bajo de 4-8 ml/kg de peso predicho y mantener presiones de la vía aérea en niveles seguros (Presión pico < 35 cmH2O, presión meseta < 30 cmH2O)[55]. Titular la PEEP por oxigenación como se recomienda en el SDRA clásico (Tabla PEEP-FiO2) probablemente sea la mejor evidencia hasta ahora para programar la PEEP inicial. Evitar las estrategias de reclutamiento alveolar agudas ya que se ha asociado a incremento en la mortalidad en pacientes con SDRA[55]. Utilizar posición prona en PaO2/FiO2 < 150 mmHg por más de 16 h, redistribuye el flujo sanguíneo pulmonar y es la forma más segura de reclutamiento pulmonar para abrir áreas de colapso en las zonas dependientes[56]. El clínico deberá individualizar las estrategias de ventilación de acuerdo con la condición del paciente procurando en lo posible la ventilación protectora.
-
Consideraciones hemodinámicas
Observaremos alteraciones hemodinámicas tanto por la patología aguda asociada a la falla respiratoria aguda, así como resultado de la ventilación mecánica. Presiones altas de la vía aérea causaran inestabilidad hemodinámica si en forma adversa disminuye el retorno venoso por incremento en la impedancia en un ventrículo derecho sensible a los cambios de la poscarga. Por tanto, monitoreo estrecho de la función ventricular derecha es obligada. Medir la presión arterial invasiva y en conjunto con ecocardiografía nos proporcionara información de la función de precarga y postcarga del ventrículo derecho[57]. La escala diseñada por el grupo de trabajo del Dr Vieillard Baron puede ser útil para determinar el riesgo de disfunción del ventrículo derecho secundario a ventilación mecánica (Tabla 3)[58]. Una de las estrategias más importantes es el manejo de líquidos. El estudio FACTT en pacientes con SDRA demostró beneficios de un protocolo conservador de líquidos una vez que el estado de choque este resuelto. Este se asoció en forma significativa a incremento en los días libres de ventilador, pero sin demostrar reducción en la mortalidad[59].
El futuro del estudio y tratamiento de la falla respiratoria aguda apunta a terapias cada vez menos invasivas con la vía aérea del paciente, quizá terapias extracorpóreas como la remoción de CO2, pero menos invasivas desde el punto de vista vascular[60]. Otro punto importante serán las tecnologías de inteligencia artificial y los sistemas automatizados para la detección de pacientes en riesgo[61]; la ventilación mecánica con
| Tabla 3. Escala pronóstica de Cor Pulmonale en SDRA | |
| Parámetro | Puntos |
| Neumonía como causa de SDRA | 1 |
| Meseta – PEEP > 18 cmH2O | 1 |
| PaO2/FiO2 < 150 | 1 |
| PaCO2 > 48 mmHg | 1 |
| Total | 0 – 4 |
Más de 2 puntos es alto riesgo de COR pulmonale secundario a la ventilación mecánica.
programas que titulen la terapéutica sin necesidad de intervenciones humanas, con sistemas mucho más avanzados que las modalidades ya disponibles como la ventilación asistida propor- cional[62] o el ASV[63]. El monitoreo continuo también menos invasivo e inhalambrico[64] que permita tanto la movilidad del paciente como la telemedicina. El futuro es impredecible pero dos cosas son inamovibles: 1) La fisiología establecida hace 50 años para el estudio de la insuficiencia respiratoria, y 2) La necesidad del contacto humano como parte indispensable de la atención del paciente.
-
Conclusiones
La falla respiratoria aguda es una condición frecuente en el paciente grave. Se requiere de un entendimiento adecuado de las causas que la provocan y los mecanismos detrás de los distintos tipos de falla. Ya sea hipoxémica, hipercapnia, perioperatoria o secundaria a hipoperfusión, la falla respiratoria aguda requiere de un abordaje racional basado en la fisiopatología para obtener los mejores resultados de las intervenciones. Esto fue cierto hace 50 años, es cierto hoy y será cierto dentro de 50 años.
Conflicto de interés: Los autores declaran no tener conflicto de interés.
Referencias
1. Munrray JF. Gas Exchange and oxygen transport. Munrray FJ, The normal lung. 2nd ed. Philadelphia: WB Saunders; 1986. pp. 183–210.
2. West JB. Respiratory physiology. The essentials. 9th ed. Philadelphia: Lippincott Williams & Wilkins; 2011.
3. MacIntyre NR. Tissue hypoxia: implications for the respiratory clinician. Respir Care. 2014 Oct;59(10):1590–6. https://doi.org/10.4187/respcare.03357 PMID:25161296
4. Campbell EJ. Respiratory failure. BMJ. 1965 Jun;1(5448):1451–60. https://doi.org/10.1136/bmj.1.5448.1451 PMID:14288081
5. West JB. Pulmonary pathophysiology. The essentials. 8th ed. Philadelphia: Lippincott Williams & Wilkins; 2012.
6. Hall J, Schmidt G, Kress J. Principals of Critical Care. 4th ed. New York: Mc Graw Hill; 2015.
7. Wagner PD. The physiological basis of pulmonary gas exchange: implications for clinical interpretation of arterial blood gases. Eur Respir J. 2015 Jan;45(1):227–43. https://doi.org/10.1183/09031936.00039214 PMID:25323225
8. Pontoppidan H, Geffin B, Lowenstein E. Acute respiratory failure in the adult. 2. N Engl J Med. 1972 Oct;287(15):743–52. https://doi.org/10.1056/NEJM197210122871505 PMID:4626853
9. Raine JM, Bishop JM. A-a difference in O2 tension and physiological dead space in normal man. J Appl Physiol. 1963 Mar;18(2):284–8. https://doi.org/10.1152/jappl.1963.18.2.284 PMID:13990512
10. Gilbert R, Keighley JF. The arterial-alveolar oxygen tension ratio. An index of gas exchange applicable to varying inspired oxygen concentrations. Am Rev Respir Dis. 1974 Jan;109(1):142–5. https://doi.org/10.1164/rccm.201705-0956LE PMID:4809154
11. Covelli HD, Nessan VJ, Tuttle WK 3rd. Oxygen derived variables in acute respiratory failure. Crit Care Med. 1983 Aug;11(8):646–9. https://doi.org/10.1097/00003246-198308000-00012 PMID:6409506
12. Karbing DS, Kjaergaard S, Smith BW, Espersen K, Allerød C, Andreassen S, et al. Variation in the PaO2/FiO2 ratio with FiO2: mathematical and experimental description, and clinical relevance. Crit Care. 2007;11(6):R118. https://doi.org/10.1186/cc6174 PMID:17988390
13. Dechert RE, Park PK, Bartlett RH. Evaluation of the oxygenation index in adult respiratory failure. J Trauma Acute Care Surg. 2014 Feb;76(2):469–73. https://doi.org/10.1097/TA.0b013e3182ab0d27 PMID:24458052
14. Go L, Budinger GR, Kwasny M, et al. Failure to Improve the Oxygenation Index is a Useful predictor of Therapy Failure in ARDS Clinical Trails. Crit Care Med. 2016;44(1):40–4. https://doi.org/10.1097/CCM.0000000000001295 PMID:26427588
15. Roussos C, Koutsoukou A. Respiratory failure. Eur Respir J 2033;22(47):3-14. https://doi.org/10.1183/09031936.03.00038503.
16. Agustí AG, Roca J, Gea J, Wagner PD, Xaubet A, Rodriguez-Roisin R. Mechanisms of gas-exchange impairment in idiopathic pulmonary fibrosis. Am Rev Respir Dis. 1991 Feb;143(2):219–25. https://doi.org/10.1164/ajrccm/143.2.219 PMID:1990931
17. Belda JF, Soro M, Ferrando C. Pathophysiology of respiratory failure. Trends Anaesth Crit Care. 2013;3(5):265–9. https://doi.org/10.1016/j.tacc.2013.05.003.
18. Petersson J, Glenny RW. Gas exchange and ventilation-perfusion relationships in the lung. Eur Respir J. 2014 Oct;44(4):1023–41. https://doi.org/10.1183/09031936.00037014 PMID:25063240
19. Barberà JA, Roca J, Ferrer A, Félez MA, Díaz O, Roger N, et al. Mechanisms of worsening gas exchange during acute exacerbations of chronic obstructive pulmonary disease. Eur Respir J. 1997 Jun;10(6):1285–91. https://doi.org/10.1183/09031936.97.10061285 PMID:9192930
20. Dantzker DR, Brook CJ, Dehart P, Lynch JP, Weg JG. Ventilation-perfusion distributions in the adult respiratory distress syndrome. Am Rev Respir Dis. 1979 Nov;120(5):1039–52. PMID:389116
21. Guérin C, Reignier J, Richard JC, Beuret P, Gacouin A, Boulain T, et al. Prone positioning in the acute respiratory distress syndrome. N Engl J Med. 2013 Sep;369(10):980–1. https://doi.org/10.1056/NEJMoa1214103 PMID:24004127
22. Santolicandro WA, Prediletto R, Fornai E, et al. Pulmonary embolization causes hipoxemia and hypocapnia in pulmonary embolism. Am J Respir Crit Care Med. 2005;152:336–47. https://doi.org/10.1164/ajrccm.152.1.7599843 PMID:7599843
23. Altemeier WA, Robertson HT, McKinney S, Glenny RW. Pulmonary embolization causes hypoxemia by redistributing regional blood flow without changing ventilation. J Appl Physiol. 1998 Dec;85(6):2337–43. https://doi.org/10.1152/jappl.1998.85.6.2337 PMID:9843561
24. Lumb A. Nunn’s Applied Respiratory Physiology. 8th ed. Italy: Elsevier; 2016.
25. Roussos C, Macklem PT. The respiratory muscles. N Engl J Med. 1982 Sep;307(13):786–97. https://doi.org/10.1056/NEJM198209233071304 PMID:7050712
26. Robertson HT. Dead space: the physiology of wasted ventilation. Eur Respir J. 2015 Jun;45(6):1704–16. https://doi.org/10.1183/09031936.00137614 PMID:25395032
27. Ballester E, Reyes A, Roca J, Guitart R, Wagner PD, Rodriguez-Roisin R. Ventilation-perfusion mismatching in acute severe asthma: effects of salbutamol and 100% oxygen. Thorax. 1989 Apr;44(4):258–67. https://doi.org/10.1136/thx.44.4.258 PMID:2763227
28. Aaronson PI, Robertson TP, Knock GA, Becker S, Lewis TH, Snetkov V, et al. Hypoxic pulmonary vasoconstriction: mechanisms and controversies. J Physiol. 2006 Jan;570(Pt 1):53–8. https://doi.org/10.1113/jphysiol.2005.098855 PMID:16254010
29. Wedzicha JA, Miravitlles M, Hurst JR, Calverley PM, Albert RK, Anzueto A, et al. Management of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J. 2017 Mar;49(3):1600791. https://doi.org/10.1183/13993003.00791-2016 PMID:28298398
30. Nuckton TJ, Alonso JA, Kallet RH, Daniel BM, Pittet JF, Eisner MD, et al. Pulmonary dead-space fraction as a risk factor for death in the acute respiratory distress syndrome. N Engl J Med. 2002 Apr;346(17):1281–6. https://doi.org/10.1056/NEJMoa012835 PMID:11973365
31. Siddiki H, Kojicic M, Li G, Yilmaz M, Thompson TB, Hubmayr RD, et al. Bedside quantification of dead-space fraction using routine clinical data in patients with acute lung injury: secondary analysis of two prospective trials. Crit Care. 2010;14(4):R141. https://doi.org/10.1186/cc9206 PMID:20670411
32. Brochard L, Harf A, Lorino H, Lemaire F. Inspiratory pressure support prevents diaphragmatic fatigue during weaning from mechanical ventilation. Am Rev Respir Dis. 1989 Feb;139(2):513–21. https://doi.org/10.1164/ajrccm/139.2.513 PMID:2643905
33. al-Saady NM, Blackmore CM, Bennett ED. High fat, low carbohydrate, enteral feeding lowers PaCO2 and reduces the period of ventilation in artificially ventilated patients. Intensive Care Med. 1989;15(5):290–5. https://doi.org/10.1007/BF00263863 PMID:2504796
34. Taylor BE, McClave SA, Martindale RG, Warren MM, Johnson DR, Braunschweig C, et al.; Society of Critical Care Medicine; American Society of Parenteral and Enteral Nutrition. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). Crit Care Med. 2016 Feb;44(2):390–438. https://doi.org/10.1097/CCM.0000000000001525 PMID:26771786
35. Tusman G, Böhm SH, Warner DO, Sprung J. Atelectasis and perioperative pulmonary complications in high-risk patients. Curr Opin Anaesthesiol. 2012 Feb;25(1):1–10. https://doi.org/10.1097/ACO.0b013e32834dd1eb PMID:22113182
36. Fernandez-Bustamante A, Hashimoto S, Serpa Neto A, Moine P, Vidal Melo MF, Repine JE; Fernandez-Bustamante. Hashimoto S, Neto AS, Moire Pierre, Vidal MF, Repine JE. Perioperative lung protective ventilation in obese patients. BMC Anesthesiol. 2015;15(1):56. https://doi.org/10.1186/s12871-015-0032-x.
37. McLaughlin JS. Physiologic consideration of hypoxemia in shock and trauma. Ann Surg. 1971 May;173(5):667–79. https://doi.org/10.1097/00000658-197105000-00006 PMID:5091574
38. Bonanno FG. Clinical pathology of the shock syndromes. J Emerg Trauma Shock. 2011 Apr;4(2):233–43. https://doi.org/10.4103/0974-2700.82211 PMID:21769211
39. MacIntyre NR. Supporting oxygenation in acute respiratory failure. Respir Care. 2013 Jan;58(1):142–50. https://doi.org/10.4187/respcare.02087 PMID:23271824
40. Rello J, Pérez M, Roca O, Poulakou G, Souto J, Laborda C, et al.; CRIPS investigators. High-flow nasal therapy in adults with severe acute respiratory infection: a cohort study in patients with 2009 influenza A/H1N1v. J Crit Care. 2012 Oct;27(5):434–9. https://doi.org/10.1016/j.jcrc.2012.04.006 PMID:22762937
41. Bellani G, Laffey JG, Pham T, Madotto F, Fan E, Brochard L, et al.; LUNG SAFE Investigators; ESICM Trials Group. Noninvasive ventilation of patients with acute respiratory distress syndrome. insights from the LUNG SAFE study. Am J Respir Crit Care Med. 2017 Jan;195(1):67–77. https://doi.org/10.1164/rccm.201606-1306OC PMID:27753501
42. Brochard L, Slutsky A, Pesenti A. Mechanical ventilation to minimize progression of lung injury in acute respiratory failure. Am J Respir Crit Care Med. 2017 Feb;195(4):438–42. https://doi.org/10.1164/rccm.201605-1081CP PMID:27626833
43. Spinelli E, Mauri T, Beitler JR, Pesenti A, Brodie D. Respiratory drive in the acute respiratory distress syndrome: pathophysiology, monitoring, and therapeutic interventions. Intensive Care Med. 2020 Apr;46(4):606–18. https://doi.org/10.1007/s00134-020-05942-6 PMID:32016537
44. Ricard JD, Roca O, Lemiale V, Corley A, Braunlich J, Jones P, et al. Use of nasal high flow oxygen during acute respiratory failure. Intensive Care Med. 2020 Dec;46(12):2238–47. https://doi.org/10.1007/s00134-020-06228-7 PMID:32901374
45. Rochwerg B, Granton D, Wang DX, Helviz Y, Einav S, Frat JP, et al. High flow nasal cannula compared with conventional oxygen therapy for acute hypoxemic respiratory failure: a systematic review and meta-analysis. Intensive Care Med. 2019 May;45(5):563–72. https://doi.org/10.1007/s00134-019-05590-5 PMID:30888444
46. Cortegiani A, Longhini F, Carlucci A, Scala R, Groff P, Bruni A, et al. High-flow nasal therapy versus noninvasive ventilation in COPD patients with mild-to-moderate hypercapnic acute respiratory failure: study protocol for a noninferiority randomized clinical trial. Trials. 2019 Jul;20(1):450. https://doi.org/10.1186/s13063-019-3514-1 PMID:31331372
47. Roca O, Caralt B, Messika J, Samper M, Sztrymf B, Hernández G, et al. An index combining respiratory rate and oxygenation to predict outcome of nasal high-flow therapy. Am J Respir Crit Care Med. 2019 Jun;199(11):1368–76. https://doi.org/10.1164/rccm.201803-0589OC PMID:30576221
48. Comellini V, Pacilli AM, Nava S. Benefits of non-invasive ventilation in acute hypercapnic respiratory failure. Respirology. 2019 Apr;24(4):308–17. https://doi.org/10.1111/resp.13469 PMID:30636373
49. Osadnik CR, Tee VS, Carson-Chahhoud KV, Picot J, Wedzicha JA, Smith BJ. Non-invasive ventilation for the management of acute hypercapnic respiratory failure due to exacerbation of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Jul;7(7):CD004104. https://doi.org/10.1002/14651858.CD004104.pub4 PMID:28702957
50. Piraino T. Noninvasive Respiratory Support in Acute Hypoxemic Respiratory Failure. Respir Care. 2019 Jun;64(6):638–46. https://doi.org/10.4187/respcare.06735 PMID:31110033
51. Patel BK, Wolfe KS, Pohlman AS, Hall JB, Kress JP. Effect of Noninvasive Ventilation Delivered by Helmet vs Face Mask on the Rate of Endotracheal Intubation in Patients With Acute Respiratory Distress Syndrome: A Randomized Clinical Trial. JAMA. 2016 Jun;315(22):2435–41. https://doi.org/10.1001/jama.2016.6338 PMID:27179847
52. Frat JP, Ragot S, Coudroy R, Constantin JM, Girault C, Prat G, et al.; REVA network. Predictors of Intubation in Patients With Acute Hypoxemic Respiratory Failure Treated With a Noninvasive Oxygenation Strategy. Crit Care Med. 2018 Feb;46(2):208–15. https://doi.org/10.1097/CCM.0000000000002818 PMID:29099420
53. Innocenti F, Giordano L, Gualtieri S, Gandini A, Taurino L, Nesa M, et al. Prediction of Mortality With the Use of Noninvasive Ventilation for Acute Respiratory Failure. Respir Care. 2020 Dec;65(12):1847–56. https://doi.org/10.4187/respcare.07464 PMID:32843508
54. Duan J, Wang S, Liu P, Han X, Tian Y, Gao F, et al. Early prediction of noninvasive ventilation failure in COPD patients: derivation, internal validation, and external validation of a simple risk score. Ann Intensive Care. 2019 Sep;9(1):108. https://doi.org/10.1186/s13613-019-0585-9 PMID:31565779
55. Fan E, Del Sorbo L, Goligher EC, Hodgson CL, Munshi L, Walkey AJ, et al.; American Thoracic Society, European Society of Intensive Care Medicine, and Society of Critical Care Medicine. An official american thoracic society/european society of intensive care medicine/society of critical care medicine clinical practice guideline: mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 2017 May;195(9):1253–63. https://doi.org/10.1164/rccm.201703-0548ST PMID:28459336
56. Guérin C, Reignier J, Richard JC, Beuret P, Gacouin A, Boulain T, et al.; PROSEVA Study Group. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med. 2013 Jun;368(23):2159–68. https://doi.org/10.1056/NEJMoa1214103 PMID:23688302
57. Wiedemann HP, Wheeler AP, Bernard GR, Thompson BT, Hayden D, deBoisblanc B, et al.; National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network. Comparison of two fluid-management strategies in acute lung injury. N Engl J Med. 2006 Jun;354(24):2564–75. https://doi.org/10.1056/NEJMoa062200 PMID:16714767
58. Mekontso Dessap A, Boissier F, Charron C, Bégot E, Repessé X, Legras A, et al. Acute cor pulmonale during protective ventilation for acute respiratory distress syndrome: prevalence, predictors, and clinical impact. Intensive Care Med. 2016 May;42(5):862–70. https://doi.org/10.1007/s00134-015-4141-2 PMID:26650055
59. Vieillard-Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, et al. Experts’ opinion on management of hemodynamics in ARDS patients: focus on the effects of mechanical ventilation. Intensive Care Med. 2016 May;42(5):739–49. https://doi.org/10.1007/s00134-016-4326-3 PMID:27038480
60. May AG, Orizondo RA, Frankowski BJ, Ye SH, Kocyildirim E, Wagner WR, et al. In vivo testing of the low-flow CO2 removal application of a compact, platform respiratory device. Intensive Care Med Exp. 2020 Aug;8(1):45. https://doi.org/10.1186/s40635-020-00329-9 PMID:32804310
61. Ebrahimian S, Homayounieh F, Rockenbach MA, Putha P, Raj T, Dayan I, et al. Artificial intelligence matches subjective severity assessment of pneumonia for prediction of patient outcome and need for mechanical ventilation: a cohort study. Sci Rep. 2021 Jan;11(1):858. https://doi.org/10.1038/s41598-020-79470-0 PMID:33441578
62. Jonkman AH, Rauseo M, Carteaux G, Telias I, Sklar MC, Heunks L, et al. Proportional modes of ventilation: technology to assist physiology. Intensive Care Med. 2020 Dec;46(12):2301–13. https://doi.org/10.1007/s00134-020-06206-z PMID:32780167
63. Titus A, Sanghavi D. Adaptive Support Ventilation. StatPearls. Treasure Island (FL): StatPearls Publishing; January 29, 2021.
64. Michard F. Hemodynamic monitoring in the era of digital health. Ann Intensive Care. 2016 Dec;6(1):15. https://doi.org/10.1186/s13613-016-0119-7 PMID:26885656

 ORCID
ORCID