Manuel Enrique Rodríguez García M.D.1,*, Annalee Díaz Bustabad2, Aylen Ala Murillo3, Osvaldo Vargas Alonso3
Recibido: 23-06-2021
Aceptado: 22-12-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 4 pp. 375-384|https://doi.org/10.25237/revchilanestv5110051140
PDF|ePub|RIS
Systematic review and meta-analysis on the efficacy of vasoactive drugs in hemorrhagic shock in animals
Abstract
The objective of this review was to evalúate the efficacy of the use of vasoactive drugs in the initial resuscitation of hemorrhagic shock in animals. The search was developed using the databases: Cochrane Central Register of Controlled Trials, PUBMED, MEDLINE, EMBASE, the database was also included: Clinical Trial.gov; no date restriction of publication or language. We included randomized controlled clinical trials in animals that compared the use of vasoactive drugs with any other resuscitation strategy for hemorrhagic shock. The analysis was developed using of review manager version 5.4, with the random effects model and the Mantel Haenszel method for dichotomous data. Statistical heterogeneity was evaluated with the statisgraph I. The strength of evidence was assessed for each outcome according to the statements of the working group for the classification of the quality of the evidence (GRADE). 18 trials (n = 533 participant) were included in this meta-analysis. Compared with control, vasopressors were associated with lower relative risk of mortality during initial resuscitation from hae- morrhagic shock, with an overall risk estimate of 0.53 (0.39, 0.71) 95% confidence interval. There is evidence of the efficacy of vasopressors in resuscitation hemorrhagic shock in animals, this is of moderate to low quality; Therefore, it is necessary to develop and implement randomized clinical trials that allow an evaluation of the efficacy and safety of these drugs in humans for their use systematically in patients with hemorrhagic shock.
Resumen
El objetivo de esta revisión fue evaluar la eficacia del uso de drogas vasoactivas en la resucitación inicial del hemorrágico en animales. La búsqueda fue desarrollada usando las bases de datos: Cochrane Central Register of Controlled Trials, PUBMED, MEDLINE, EMBASE, fue incluida además la base de datos: Clinical Trial.gov; sin restricción por fecha de publicación o idioma. Se incluyeron ensayos clínicos controlados y aleatorizados en animales que compararon el uso de drogas vasoactivas con cualquier otra estrategia de resucitación del hemorrágico. El análisis fue desarrollado con el uso de review manager versión 5.4, con el modelo de efectos aleatorios y el método de Mantel Haenszel para datos dicotómicos. Heterogeneidad estadística fue evaluada con el estadígrafo I. La fuerza de la evidencia fue evaluada para cada resultado acorde a las declaraciones del grupo de trabajo para la clasificación de la calidad de la evidencia (GRADE). 18 ensayos (n = 533 participante) fueron incluidos en este metaanálisis. Comparado con el control, los vasopresores fueron asociados con menor riesgo relativo de mortalidad durante la reanimación inicial del hemorrágico, con una estimación global del riesgo de 0,53 (0,39, 0,71) intervalo de confianza de 95%. Existe evidencia de la eficacia de los vasopresores en la reanimación inicial del hemorrágico en animales, esta es de calidad moderada a baja; por lo que, es necesario desarrollar e implementar ensayos clínicos aleatorizados que permitan una evaluación de la eficacia y seguridad de estas drogas en humanos para su uso de manera sistemática en pacientes con hemorrágico.
-
Introducción
El shock hipovolémico es una condición clínica que amenaza la vida por una inadecuada perfusión y oxigenación tisular debido a una disminución en el volumen vascular circulante de sangre[1].
El shock es la mayor causa de morbilidad y mortalidad reportada en aproximadamente un tercio de los enfermos críticos adultos[2].
La incidencia anual del shock hipovolémico en los Estados Unidos es de aproximadamente 1,5 millones y el número de muertes total debido a shock hemorrágico es de 61.000[1]. Investigadores de la Organización Mundial de la Salud (WHO) reportaron que cerca de 5,8 millones de personal morían por trauma cada año[3] y este número se espera se incremente a 8 millones en los próximos años[4]. Cerca de 2 millones de estas muertes son por trauma y el resto es por hemorragia obstétrica, ruptura de aneurisma aórtico, o hemorragia gastroesofágica[5].
En Cuba, según el anuario estadístico de salud en su último reporte murieron por accidentes 11.280 personas en el 2019[6].
El tratamiento de shock hemorrágico requiere inmediato y apropiada resucitación para preservar la perfusión tisular mientras se espera por el control de la hemorragia[7],[8]. La resucitación con volumen y el control quirúrgico temprano son las dos medidas más importantes para salvar a los pacientes en shock hemorrágico[9].
En las recomendaciones internacionales que pautan la resucitación del paciente en shock hemorrágico se ha asociado recientemente y cada vez con mayor frecuencia la indicación del uso de vasopresores como medida salvadora y ahora es una práctica casi rutinaria cuando los pacientes no han tenido una adecuada respuesta a la resucitación habitual con fluidos y he- moderivados[4],[10],[11].
La indicación de vasopresores como medida salvadora ante este tipo de situación clínica en la que los pacientes no han tenido una adecuada respuesta a la resucitación habitual con fluidos y hemoderivados se ha fundamentado en las siguientes ideas: “en presencia de hipotensión que amenaza la vida; recomendamos la administración de vasopresores en adición a los fluidos para mantener los objetivos de presión arterial”[4],[10],[11].
Sin embargo, los datos científicos que apoyan el uso de drogas vasoactivas en dicha situación clínica son divergentes; en la era de los protocolos de transfusión masiva los vasopresores son comúnmente utilizados en pacientes con traumas exangui- nantes y su uso está asociado a un riesgo más alto de mortalidad, por lo que, el uso de vasopresores es percibido como
un marcador de inadecuada resucitación, especialmente en sangramiento activo y shock hemorrágico con un incremento independiente de la mortalidad de hasta 80%[12]-[14].
Las ideas anteriores expresan que, la recomendación de estas drogas en la resucitación inicial (resucitación intensiva a partir de producida la hemorragia aguda y durante las etapas previas a coaptar dicha hemorragia) de los pacientes en shock hemorrágico constituye un agnosticismo clínico más que una nueva evidencia científica.
Las recomendaciones del uso de los vasopresores en el shock hemorrágico fueron realizadas a partir de interpretación de los resultados de ensayos clínicos realizados en anima- les[11],[15],[16] o estudios que evalúan diagnósticos que singularizan la resucitación inicial del shock hipovolémico como es el trauma craneal severo asociado[17]; además, hay sustento en recomendaciones realizadas para entidades clínicas que no guardan relación desde el punto de vista etiológico y fisiopato- lógico con el shock hemorrágico como lo es la sepsis y el shock séptico[18]
La idea anterior alcanza su máxima importancia si se tiene presente lo limitada que resulta la evidencia científica actual de estudios en humanos que apoyen el uso de drogas vasoactivas en esta condición clínica.
Esta revisión sistemática y metaanálisis de ensayos clínicos controlados y aleatorizados se realizó para evaluar la evidencia disponible sobre la eficacia del uso de drogas vasoactivas en la resucitación inicial del shock hemorrágico en animales.
Lo cual debe mostrar el camino para orientar las investigaciones futuras que permitan una evaluación científica profunda de la utilidad de estas drogas en los pacientes que sufren estado de shock hipovolémico.
-
Material y Método
-
Diseño del estudio
Esta revisión sistemática y metaanálisis se realizó siguiendo las recomendaciones del Manual Cochrane para revisiones sistemáticas y metaanálisis, y los resultados se informaron de acuerdo con los elementos de informes preferidos para revisiones sistemáticas y metaanálisis (PRISMA)[19].
-
Estrategia de búsqueda
La estrategia de búsqueda se desarrolló utilizando las bases de datos: Cochrane Central Register of Controlled Trials, PUB-MED, MEDLINE, EMBASE, también se realizaron en la base de datos Clinical Trial.gov, la estrategia de búsqueda se desarrolló con un especialista en información y se validó de acuerdo con las guías de peer review of electronic search (PRESS)[20].
-
Criterios de elegibilidad de los estudios
Se incluyeron los ensayos clínicos controlados aleatorios que compararon drogas vasoactivas con cualquier otra estrategia de reanimación del shock hemorrágico. Se consideraron los ensayos realizados en animales de experimentación que evaluaron uso de drogas vasoactivas como estrategia de reanimación del shock hemorrágico comparado con las estrategias de reanimación habitual (fluidoterapia y hemoderivados). No se realizó ninguna restricción por idioma o tipo de publicación. Se excluyeron los ensayos cuando los resultados no median la supervivencia a la reanimación inicial del shock y cuando la causa de shock no era el resultado de perdida aguda de sangre.
-
Medidas de resultados
El resultado primario fue la supervivencia ante el shock he- morrágico durante las medidas de reanimación inicial (definida esta como las acciones desarrolladas para mantener la supervivencia desde que se produce la hemorragia aguda hasta que es coaptada la misma).
-
Selección de estudios y extracción de datos
Dos revisores AD y AA evaluaron de forma independiente los títulos de ensayos seleccionados resúmenes y publicaciones completas para determinar su elegibilidad y extrajeron los datos mediante un formulario de extracción de datos estandarizado y piloto, los desacuerdos fueron resueltos por un tercer revisor OV. Se estableció contacto con los autores cuando faltaba información para extraer. Se eliminaron las citas duplicadas.
Para cada ensayo, la extracción de datos incluyó: características del estudio, año, tamaño de muestra, duración del estudio. Información del procedimiento de exanguinación, tipo de animal de experimentación.
-
Evaluación del riesgo de sesgo
El riesgo de sesgo de los ensayos incluidos se evaluó mediante la herramienta Cochrane de riesgo de sesgo;(21) dos revisores (MR y AD) evaluaron de forma independiente el riesgo de sesgo para cada ensayo incluido y se consultó a un tercer revisor (AA) en caso de desacuerdo. La calidad metodológica general de cada ensayo se informó utilizando la peor puntuación obtenida en los siete dominios.
-
Síntesis de datos y análisis estadístico
Se consideró la supervivencia a la reanimación del shock hemorrágico durante el período de observación de los estudios según estrategia de reanimación empleada.
Los análisis se realizaron con review manager versión 5.4. Se utilizaron modelos de efectos aleatorios y el método Mantel Haenszel para datos dicotómicos. La heterogeneidad estadísti
ca se evaluó con la estadística I2, se consideró que una I2 superior al 50% representaba una heterogeneidad sustancial[19].
-
Fuerza de la evidencia y análisis secuencial de ensayos
La solidez de la evidencia se evaluó para cada resultado de acuerdo con la declaración del grupo de trabajo Grades of Re- commendation, Assesment Development and Evaluation (GRADE) utilizando la herramienta de desarrollo de guías GRADEpro (Mc Master University 2015, desarrollada por evidence prime, inc., Canadá)[22]. El enfoque GRADE implicó calificar la calidad de la evidencia en un continuo de alta, moderada, baja o muy baja; para cada resultado basado en un enfoque estructurado. Esta clasificación se realizó por duplicado de forma independiente por dos revisores (MR y AD).
Para limitar un posible error de tipo I e informar la investigación futura, se realizó un análisis secuencial de ensayos sobre el resultado primario utilizando el software TSA versión 0.9.5.10 Beta (Copenhagen Trial Unit, Center for Clinical Intervention Research, Denmark, 2011)[23],[24]. Los datos disponibles se utilizaron para calcular el tamaño de la información requerida and the O’Brien-Fleming a-spending boundaries function para calcular la puntuación Z acumulativa. Todos los cálculos se basaron en 5% de alfa y 90% de potencia con una prueba de dos colas.
-
Resultados
-
Identificación y selección de estudios
Se identificaron 282 estudios durante las búsquedas en las bases de datos de los cuales quedaron 197 después de remover los duplicados, 41 de estos fueron evaluados y 15 fueron excluidos. Veintiseis estudios fueron evaluados completamente para su elección, 8 estudios fueron excluidos acorde con los criterios de exclusión expresados y 18 estudios (n = 533 participantes) fueron incluidos en el metaanálisis (Figura 1).
-
Características de los ensayos
De los 18 ensayos incluidos en esta revisión sistemática y me- taanálisis, la mayoría se escribieron en inglés[15],[16],[25]-[37], mientras que tres se escribieron en chino[38]-[40]. Las fuentes de financiación no fueron mencionadas en 83,33% de los ensayos (15 ensayos; 424 participantes), en el 11,11% de los ensayos (2 ensayos; 90 participantes), la fuente de financiación fue la Sociedad Francesa de Anestesiología y the Scientific Re- search Foundation of Medical Science and Public Health of the People’s Liberation Army and National Natural Science Funds for Distinguished Young Scholars, y Aguettant Laboratories (Lyon, France) en Europa, financió 5,56% de los ensayos (1 ensayo; 19 participantes).
En este metaanálisis de 18 ensayos el 38,89% (7 ensayos; 293 participantes) se realizaron en ratas; el shock hemorrágico incontrolado fue producido por: lesión del parénquima esplé- nico y uno por sección de la arteria esplénica, la sustracción sanguínea de la vena femoral, exanguinación a través de la arteria femoral y lesión hepática. El 61,11% (11 ensayos; 240 participantes) se realizaron en cerdos; el shock hemorrágico se produjo por: lesión hepática, exanguinación rápida a través de catéter arterial, contusión pulmonar bilateral, incisión a través del mesenterio, craneotomía, hemorragia torácica e incisión mesentérica.
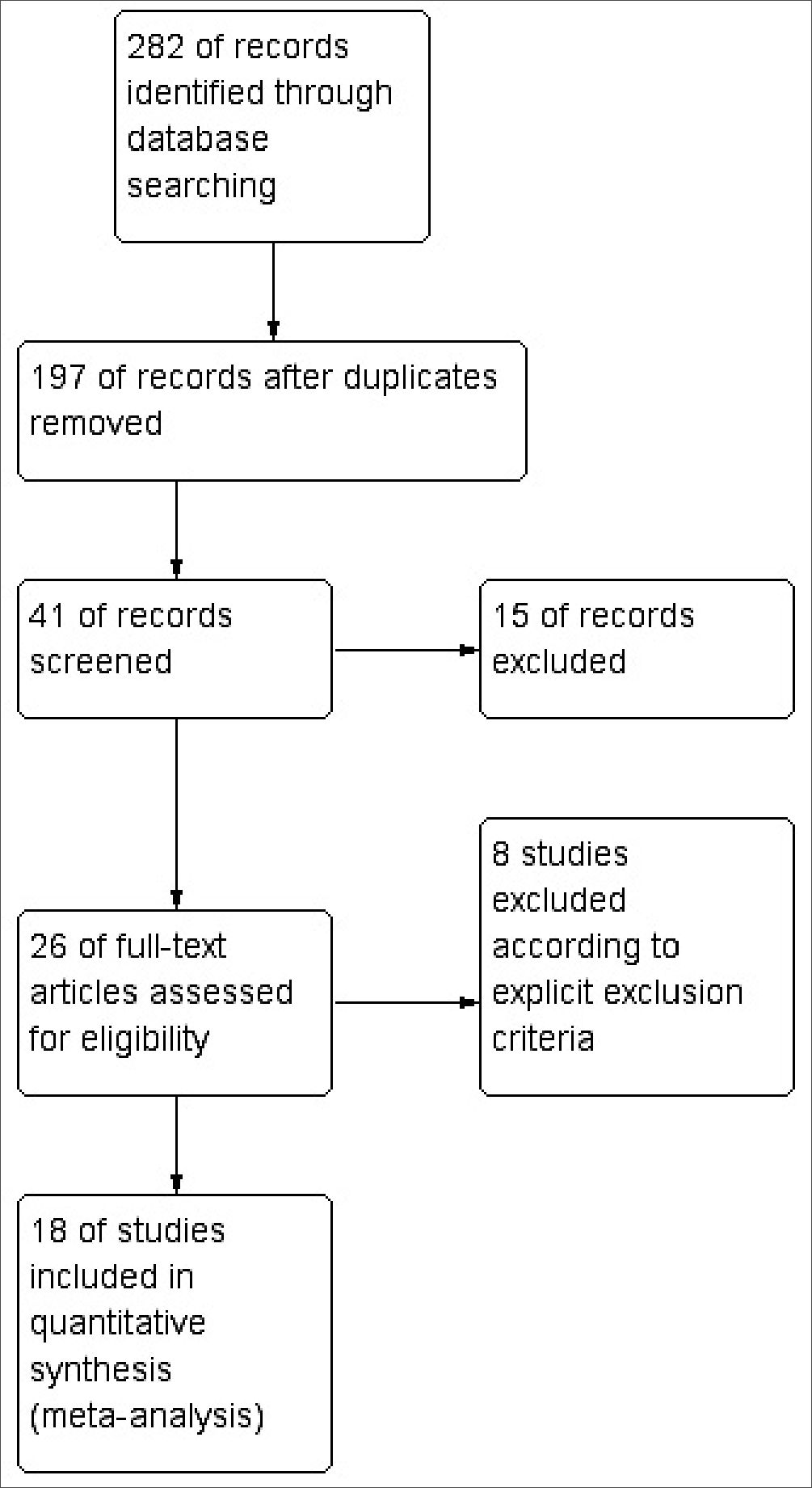
Figura 1. El diagrama de flujo de la revisión sistemática.
De todos los ensayos elegibles el 38,89% (7 ensayos; 296 participantes) evaluó noradrenalina, el 72,22% (13 ensayos; 380 participantes) evaluó vasopresina, el 5,56% (1 ensayo; 21 participantes) evaluó terlipresina, el 16,66% (3 ensayos; 80 participantes) evaluó epinefrina.
Los rangos de dosis fueron noradrenalina 2-10 mcg/kg bolo inicial seguido de 2-500 mcg/kg/h infusión continua (7 ensayos; 296 participantes), vasopresina 0,08-0,4 U/kg bolo inicial seguido de 0,04-0,08 U/kg/minutos (13 ensayos; 380 participantes), terlipresina 50 mcg/kg bolo (1 ensayo; 21 participantes), epin- efrina 5 mcg/kg/min infusión continua (3 ensayos; 80 participantes).
-
Evaluación del riesgo de sesgo
El riesgo general de sesgo fue bajo para el 50,00% de los ensayos (n = 9 of 18), incierto para 38,89% (n = 7 of 18) y elevado para el 11,11% (n = 2 of 18) de los ensayos incluidos en el metaanálisis (Figura 2).
-
Resultado primario
El riesgo relativo de mortalidad durante la reanimación inicial del shock hemorrágico fue menor con el uso de drogas vasoactivas comparado con las estrategias de reanimación habitual con una estimación global del riesgo de 0,53 (0,39, 0,71) intervalo de confianza de 95%, pero es importante señalar que para 66,67% de los ensayos (12 ensayos; 354 participantes) no hubo diferencias significativas en la supervivencia entre el uso de drogas vasoactivas y las medidas de reanimación habitual con fluidoterapia y hemoderivados para 95% de confianza. No hubo una heterogeneidad estadística significativa entre los ensayos con un x2 = 23,22; I2= 31% (Figura 3).
-
Resultado secundario
En este metaanalisis no es posible realizar una evaluación de los efectos adversos del uso de drogas vasoactivas durante la reanimación inicial de shock hemorrágico pues todos los animales fueron sacrificados (después de la reanimación) luego del período de observación diseñado para cada estudio.
-
El sesgo de publicación
El análisis visual sugirió un posible sesgo de publicación en el informe de algunos resultados.
-
Análisis secuencial de ensayos para la evaluación de la supervivencia
El análisis secuencial de ensayos para la eficacia de drogas vasoactivas en la resucitación inicial del shock hemorrágico evaluó que el tamaño de esta revisión con metaanálisis fue mayor que el requerido, sugiriendo que futuras investigaciones en animales no eran necesarias (Figura 4). Lo cual fue sugerido por la curva-Z cruzando los linderos secuenciales de prueba antes del tamaño requerido de información.
-
Calidad de la evidencia
La calidad de las pruebas para el resultado primario, supervivencia a la reanimación con el uso de drogas vasoactivas fue muy baja para norepinefrina, epinefrina, terlipresina y moderadas para vasopresina. Las calificaciones GRADE para todos los resultados se presentan en la (Tabla 1).
-
Discusión
En este metaanálisis, realizado a partir de ensayos clínicos aleatorizados en animales, se encontró un riesgo relativo global de evento adverso fatal de 0,53 (0,39, 0,71), lo cual indica que el uso de vasopresores constituye un factor protector ante un
378
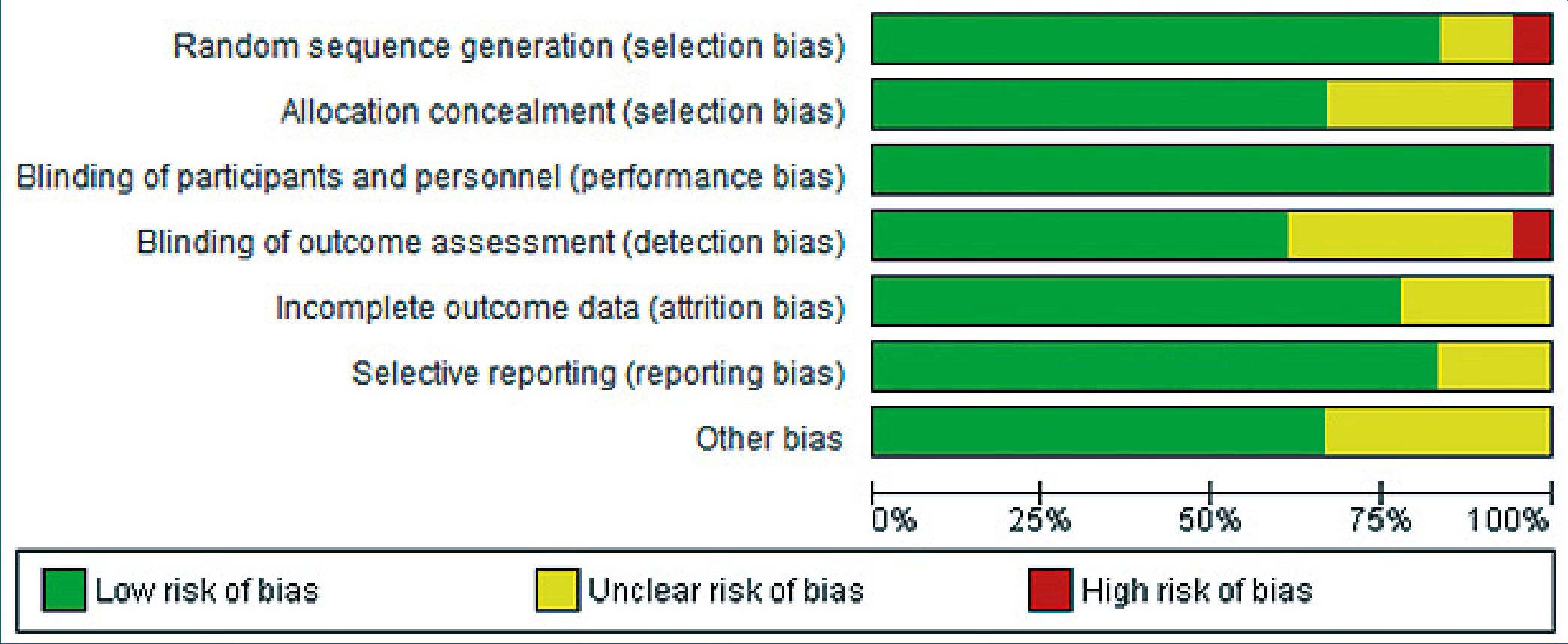
Figura 2. Riesgo de sesgo: juicio de autores acerca de cada riesgo presentado como los porcentajes a través de todos los estudios incluidos.
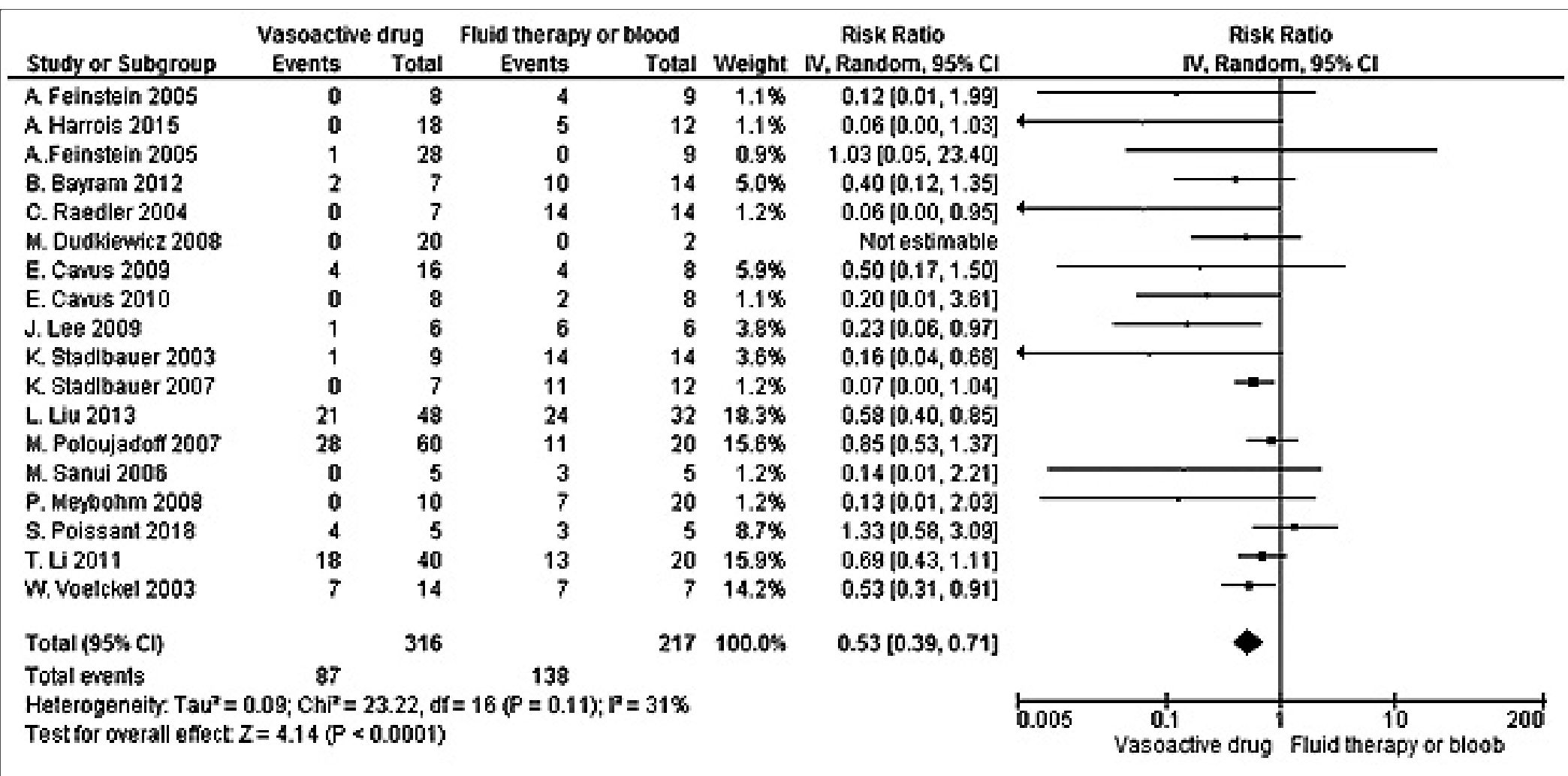
Figura 3. Eficacia de las drogas vasoactivas versus fluidos o hemoderivados en la resucitación inicial del shock hemorrágico.
evento fatal durante la reanimación inicial del shock hemorrá- gico, se podría afirmar que el uso de los mismos en esta condición clínica parece proteger en 39% y hasta en 71% de un desenlace adverso según estos estudios, aunque las calidad de la evidencia es moderada para vasopresina y muy baja calidad para noradrenalina, terlipresina y epinefrina.
El análisis secuencial de ensayos para la eficacia de drogas vasoactivas en la resucitación inicial del shock hemorrágico evaluó que el tamaño de esta revisión con metaanálisis fue mayor que el requerido, sugiriendo que futuras investigaciones en animales no eran necesarias. Lo cual fue sugerido por la curva-Z cruzando los linderos secuenciales de prueba antes del tamaño
requerido de información.
Lo anterior no es congruente con las recomendaciones de Wiggers, colaboradores y otros que, en 1950, habían llegado a la conclusión de que la vasoconstricción simpática aceleraba la transición a un shock irreversible después de una hemorra- gia[41],[42].
En este sentido existen evidencias de que la noradrenalina podría aumentar las variables hemodinámicas, pero no prolongar la supervivencia; en un estudio realizado por Tao Li y colaboradores evaluó la respuesta a la reanimación inicial con vasopresores versus el uso de estrategias habituales de fluido- terapia y hemoderivados en ratas, observando que infusión de
379
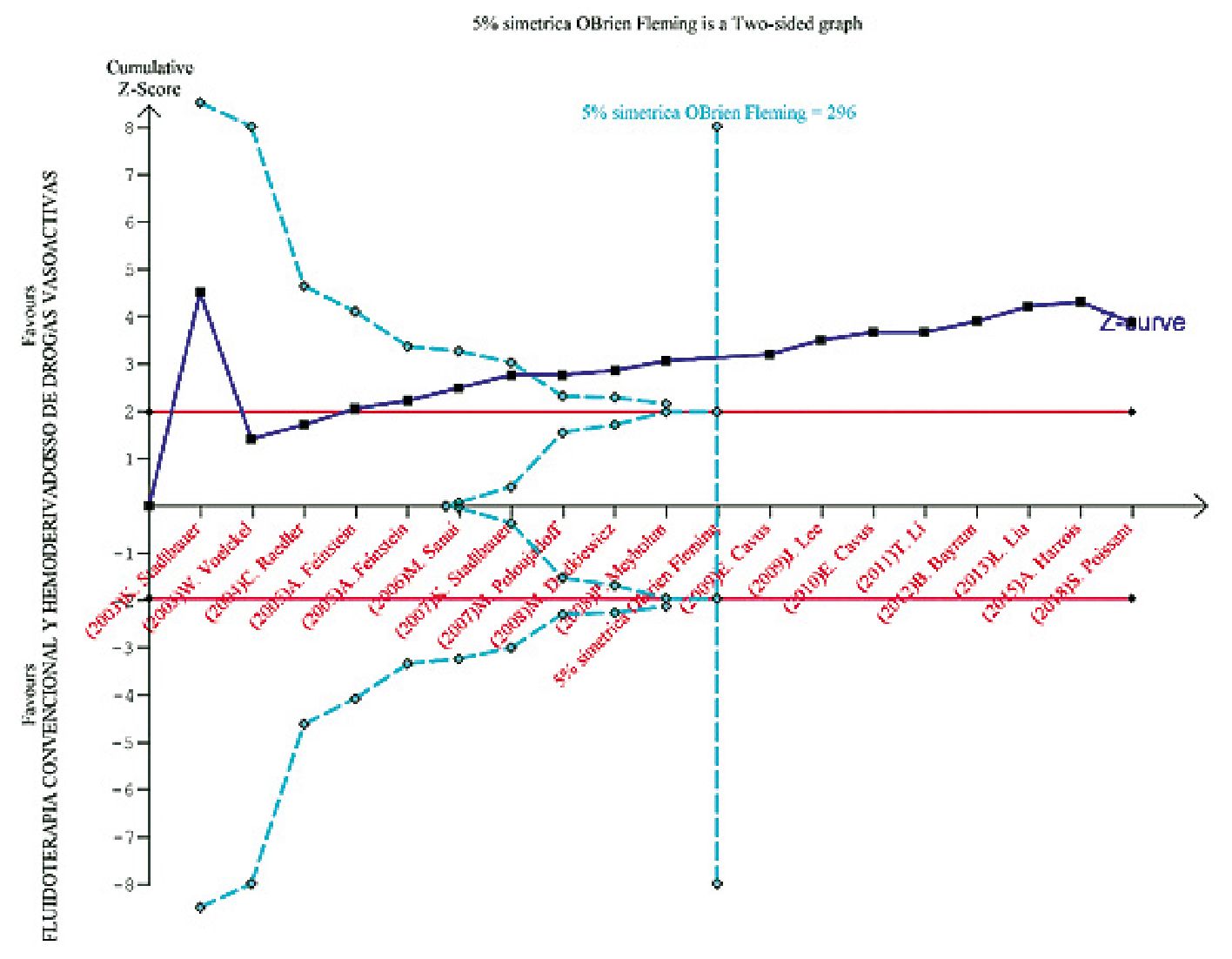
Figura 4. Análisis secuencial de ensayos para la evaluación de la supervivencia.
noradrenalina sola incrementaba la presión arterial media y presión sistólica del ventrículo izquierdo pero no se incrementó el tiempo de supervivencia en ratas en shock comparado con el grupo que recibió fluidos (P > 0,05)[38].
De ahí que la administración de noradrenalina es controvertida durante la reanimación por choque hemorrágico para estabilizar el nivel de Presión Arterial Media (PAM) porque podría haber efectos deletéreos sobre la circulación local[16].
Como resultado, la administración de noradrenalina sin corrección de la hipovolemia puede aumentar la vasoconstricción arteriolar en los estadios iniciales y disminuir el flujo sanguíneo de la microcirculación con la consiguiente aparición de hipoxia tisular[16].
Ello nos invita a reflexionar sobre el concepto de no equiparar incrementos de la tensión arterial con un incremento concomitante en el gasto cardiaco y en la perfusión tisular[43]; que son los objetivos en los que debe enfocarse la reanimación.
La noradrenalina, además, representa un agonista adre- nérgico cuyo efecto es: incremento de las resistencias vascular sistémica, pero es posible que no restablezca el tono vascular en estados de choque vasopléjicos (resistentes a las catecolami- nas); lo cual puede contribuir de manera directa con un incremento de la mortalidad[44].
Lo anterior puede ser explicado pues después de un traumatismo o shock severo, incluido el shock hemorrágico, la reactividad vascular a los vasoconstrictores y vasodilatadores se reduce en gran medida[45].
La reactividad vascular reducida puede estar relacionada con el trastorno funcional de los canales de K+ y Ca2+ en las células del músculo liso vascular (CMLV), o la hiperpolarización de las membranas celulares[46],[47]; lo que explica que cuando se administran altas dosis de vasopresores durante la reanimación del shock hipovolémico después de una respuesta inicial efímera (incremento de tensión arterial), le sucede una respuesta
menos efectiva que obliga a incrementar dosis de vasopresores para lograr resultados anteriores.
A partir de la idea anterior se evidencia que las catecolami- nas a menudo pierden potencia con un tratamiento prolonga- do[11],[33].
Además, el efecto agonista betaadrenérgico de los vaso- presores puede aumentar el consumo de oxígeno del miocardio[44],[48]; lo que se traduce en la aparición de arritmias graves que pueden incrementar la mortalidad.
Una evaluación especial merece la vasopresina pues esta no interactúa con los receptores adrenérgicos, sino con los receptores V1 vasculares. Por lo tanto, se ha encontrado que media la vasoconstricción periférica en la fase irreversible del shock hemorrágico que no responde al reemplazo de volumen y a las catecolaminas adrenérgicas[44],[48], lo que resulta en un flujo sanguíneo de órganos vitales mejorado, incluido el suministro de sangre a las coronarias y beneficio de supervivencia[31].
Existen evidencias de que vasopresina mejoró la presión arterial en cerdos durante la hipotensión casi fatal después de una lesión hepática penetrante no así la epinefrina[32].
En este metaanálisis es válido destacar que para 66,67% de los ensayos (12 ensayos; 354 participantes) incluidos con 95% de confianza no hubo diferencias significativas en la supervivencia entre el uso de vasopresores y las medidas de reanimación habitual con líquidos y hemoderivados.
Dichos hallazgos han sido corroborados en humanos con el uso de vasopresina; pues, un ensayo aleatorizado doble ciego, evaluó la seguridad y la eficacia de la adición de vasopresina al líquido de reanimación durante el tratamiento del shock hemo- rrágico; en el que los sujetos eran adultos hipotensos que habían sufrido una lesión traumática aguda. Los sujetos recibieron líquido solo (grupo de control) o líquido más vasopresina (grupo experimental), primero como un bolo (4 UI) y luego como una infusión intravenosa de 200 ml/h (vasopresina 2,4 UI/h) durante 5 h. Las tasas de eventos adversos, disfunción orgánica y mortalidad a los 30 días fueron similares en ambos grupos de estudio[49].
Tabla 1. Resumen de los resultados
[Drogas vasoactivas] comparado con [medidas de reanimación habitual con líquidos y hemoderivados] para [shock hemorragico]
Paciente o población: [shock hemorragico]
Configuración:
Intervención: [Drogas vasoactivas]
Comparación: [medidas de reanimacion habitual con líquidos y hemoderivados]
Efectos absolutos anticipados* (95% CI)
| Desenlaces | Riesgo con [medidas de reanimación habitual con líquidos y hemoderivados] | Riesgo con [Drogas vasoactivas] | Efecto relativo (95% CI) | n de participantes (Estudios) | Certainty of the evidence (GRADE) | Comentarios |
| Norepinefrina (NEP) evaluado con: influencia en la mortalidad durante la reanimación inicial del shock hemorrágico | 671 por 1.000 | 396 por 1.000 (382 a 409) | RR 0,59 (0,57 a 0,61) | 210
(6 Experimentos controlados aleatorios [ECAs]) |
□□□□
MUY BAJA a,b,c,d,e |
Cuando se emplearon dosis altas de norepinefrina (500 mcg )todos los animales murieron, algunos estudios reconocen mayor mortalidad posterior al período de observación diseñado y antes de sacrificar los animales en le grupo experimental |
| Epinefrina (EPI) evaluado con: influencia en la mortalidad durante la reanimación inicial del shock hemorrágico | 389 por 1.000 | 257 por 1.000 (179 a 362) | RR 0,66 (0,46 a 0,93) | 49
(3 Experimentos controlados aleatorios [ECAs]) |
□□□□
MUY BAJA f,g,h |
en algunos estudios se reporta necesidad de uso creciente de epinefrina para mantener los mismos efectos, en los grupos experimentales de algunos estudios la resistencia sistémica fue similar a los grupos control y variables como la presión de perfusión cerebral llego a ser mayor en grupo donde no se necesitó vasopresor |
| Terlipresina (TER) evaluado con: influencia en la mortalidad durante la reanimación inicial del shock hemorrágico | 714 por 1.000 | 286 por 1.000 (136 a 607) | RR 0,40 (0,19 a 0,85) | 21
(1 ECA (experimento controlado aleatorizado) |
□□□□
MUY BAJA i,j,k,l |
Fue necesario reducir el tiempo de observación pues la mayoría de las ratas habían muerto antes de cumplido el tiempo diseñado |
| Vasopresina (VAS) evaluado con: influencia en la mortalidad durante la reanimación inicial del shock hemorrágico | 827 por 1.000 | 215 por 1.000 (190 a 248) | RR 0,26 (0,23 a 0,30) | 165
(9 Experimentos controlados aleatorios [ECAs]) |
□□□□
MODERADO m,n |
La mejor calidad de evidencia se obtuvo para vasopresina, con ausencia de eventos en algunos de los estudios analizados |
El riesgo en el grupo de intervención (y su intervalo de confianza del 95%) se basa en el riesgo asumido en el grupo de comparación y en el efecto relativo de la intervención (y su intervalo de confianza del 95%)
CI: Intervalo de confianza; RR: Razón de riesgo
GRADE Working Group grades of evidence
High certainty: We are very confident that the true effect lies close to that of the estimate of the effect
Moderate certainty: We are moderately confident in the effect estimate: The true effect is likely to be close to the estimate of the effect, but there is a possibility that it is substantially different
Low certainty: Our confidence in the effect estimate is limited: The true effect may be substantially different from the estimate of the effect
Very low certainty: We have very little confidence in the effect estimate: The true effect is likely to be substantially different from the estimate of effect
Explicaciones
a. Método aleatorización no especificado de algunos estudios
b. No se realizo cegamiento
c. Muestra pequeña de algunos estudios
d. Tiempo de observación muy cortos en algunos estudios
e. Algunos de los estudios no llegaron al final del período de observacion diseñado porque muchos de los animales del grupo control murieron antes de cumplirse el mismo f. Método de aleatorizacion no especificado en algunos estudios
g. Tiempo de observación corto en algunos estudios
h. Muestra pequeña
i. No se precisa el método de aleatorización
j. Fue necesario reducir tiempo de observación de el estudio pues la mayoría de los animales habian muerto antes del período de observación diseñado
k. Muestra pequeña
l. Tiempo de observación corto
m. Ausencia de eventos en grupo de intervención de varios estudios
n. Tiempo de observación muy corto con mortalidad en el grupo experimental similar al de grupos sin ningún tratamiento de otros estudios para el mismo período de observación
Sin embargo, se debe enfatizar sobre la dificultad de extrapolar resultados en animales a humanos, en lo que respecta al momento y utilidad para el apoyo con vasopresores durante el shock hemorrágico[11].
Lo cual, a consideración de los autores, amerita que se desarrollen e implementen estudios clínicos controlados y aleato- rizados en humanos que permitan evaluar la efectividad real del uso de estas drogas como estrategia de tratamiento en los pacientes con shock hemorrágico durante la reanimación inicial.
Una revisión sistemática reciente comparó el uso de vasopresores temprano versus la resucitación habitual estándar en adultos con shock hemorrágico inducido por trauma y resalta la falta de datos confiables en los resultados importantes para respaldar la utilidad del uso de vasopresores en los inicios de las fases de resucitación de trauma en humanos[50].
El tipo de vasopresor y el momento preciso todavía necesitan ser definidos; pues, a pesar de numerosos argumento teóricos en favor del uso temprano de vasopresores en el tratamiento del shock hemorrágico, hay aún insuficientes evidencias clínicas que validen esta estrategia[11].
Debe, además, prestarse especial atención a los efectos deletéreos conocidos, secundarios a la utilización de drogas vasoactivas cuyas consecuencias a corto y largo plazo sobre la supervivencia no fue evaluada en ninguno de los ensayos incluidos en este metaanálisis. La hipercatecolaminemia y disfunción de la medula ósea han sido implicadas en la fisiopatología de la anemia persistente asociada al trauma[51].
Algunas catecolaminas como la noradrenalina aumentan el riesgo de isquemia miocárdica, mesentérica y de extremidades, así como, de arritmias y mortalidad[52].
En relación con lo anterior, es válido destacar que además de las limitaciones ya expuestas que ameritan que se investigue la pertinencia del uso de drogas vasoactivas en la reanimación inicial de los pacientes con shock hipovolémico de causa he- morrágica, existen evidencias de lo eletéreo de su uso, lo cual impone retos desde el punto de vista ético a investigaciones futuras en seres humanos, que permitan evaluar la utilidad clínica real de dichos fármacos en el tratamiento de esta condición.
Un estudio realizado en humanos que evaluó la utilidad de los vasopresores en la reanimación del shock hipovolémico de causa hemorrágica comparado con las estrategias de fluidoterapia y hemoderivados, mostró que la mortalidad general fue significativamente mayor en el grupo vasopresor (60,0% [n = 42] frente a 34,0% [n = 17] grupo fluidoterapia y hemoderivados, p = 0,009)[13]. En dicho estudio la mortalidad aumentó de manera escalonada con el aumento del número de vasopreso- res utilizados durante la reanimación, comenzando en 34,0% para pacientes que no recibieron vasopresores, a 77,8% para pacientes que recibieron 3 vasopresores y 100,0% para pacientes que recibieron 5 o más vasopresores[13].
-
Conclusiones
Se concluye que a pesar de que existe evidencia suficiente de la eficacia de los vasopresores en la reanimación inicial del shock hemorrágico en animales, esta es de calidad moderada para la vasopresina, y muy baja calidad para noradrenalina, ter- lipresina y epinefrina; lo cual resta fuerza a la recomendación de estas drogas (recomendación débil). Por lo que, a pesar del resultado del metaanálisis que evidencia que, el uso de drogas vasoactivas disminuye el riesgo de eventos fatales durante la reanimación inicial de shock hemorrágico en animales, es necesario desarrollar e implementar ensayos clínicos aleatorizados que permitan una evaluación real de la eficacia y seguridad de estas drogas en seres humanos antes de generalizar las recomendaciones para su uso de manera sistemática, como parte de los protocolos de tratamiento de los pacientes en shock hemorrágico.
Fuente de financiamiento: Fondos departamentales.
Conflicto de intereses: Los autores no declaran conflictos de intereses.
Referencias
1. Gulati A, Choudhuri R, Gupta A, Singh S, Ali S, Sidhu G, et al. A multicentric randomized controlled phase III study of centhaquine as a resuscitative agent in hypovolemic shock patients. Circulation. 2020;142:118. https://10.1161/circ.142.suppl_4.118
2. Haan BJ, Cadiz ML, Natavio AM. Efficacy and Safety of Vasopressin as First-Line Treatment of Distributive and Hemorrhagic Shock States. Ann Pharmacother. 2020 Mar;54(3):213–8. https://doi.org/10.1177/1060028019882035 PMID:31625395
3. Gu X, Wang S, Chen J, Cao F, Zhou L. Restricted fluid resuscitation improves the prognosis of patients with traumatic hemorrhagic shock. Clin Exp Med. 2020;13(7):5319–27.
4. Spahn D, Bouillon B, Cerny V, Duranteau J, Filipescu D, Hunt B, et al. the european guideline on management of major bleeding and coagulopathy following trauma fifth edition. Critical Care. 2019;23(98):1-74.
5. Mapstone J, Roberts I, Evans P. Fluid resuscitation strategies: a systematic review of animal trials. J Trauma. 2003 Sep;55(3):571–89. https://doi.org/10.1097/01.TA.0000062968.69867.6F PMID:14501908
6. Ministerio de Salud P. Direccion Nacional de Registros Medicos. Anuario Estadistico de Cuba. La habana Minsap. 2019. Available at:http://temas.sld.cu/estadisticassalud/. Accessed september 12, 2020.
7. Libert N, Chenegros G, Harrois A, Baudry N, Cordurie G, Benosman R, et al. Performance of closed-loop resuscitation of haemorrhagic shock with fluid alone or in combination with norepinephrine: an experimental study. Ann Intensive Care. 2018 Sep;8(1):89–99. https://doi.org/10.1186/s13613-018-0436-0 PMID:30225814
8. Harada MY, Ko A, Barmparas G, Smith EJ, Patel BK, Dhillon NK, et al. 10-Year trend in crystalloid resuscitation: reduced volume and lower mortality. Int J Surg. 2017 Feb;38:78–82. https://doi.org/10.1016/j.ijsu.2016.12.073 PMID:28040501
9. HosseIn M, mAjId moosAvIzAdeH S, moHArArI R, kHAsHAyAr P. Hypertonic saline 5% vs. Lactated ringer for resuscitating patients in hemorrhagic shock. ANESTH. 2008;19(6):1337–47.
10. Gelman S, Mushlin PS, Weiskopf RB. Catecholamine-induced changes in the splanchnic circulation affecting systemic hemodynamics. Anesthesiology. 2004 Feb;100(2):434–9. https://doi.org/10.1097/00000542-200402000-00036 PMID:14739821
11. Beloncle F, Meziani F, Lerolle N, Radermacher P, Asfar P. Does vasopressor therapy have an indication in hemorrhagic shock? Ann Intensive Care. 2013 May;3(1):13–9. https://doi.org/10.1186/2110-5820-3-13 PMID:23697682
12. Sperry JL, Minei JP, Frankel HL, West MA, Harbrecht BG, Moore EE, et al. Early use of vasopressors after injury: caution before constriction. J Trauma. 2008 Jan;64(1):9–14. https://doi.org/10.1097/TA.0b013e31815dd029 PMID:18188092
13. Barmparas G, Dhillon NK, Smith EJ, Mason R, Melo N, Thomsen GM, et al. Patterns of vasopressor utilization during the resuscitation of massively transfused trauma patients. Injury. 2018 Jan;49(1):8–14. https://doi.org/10.1016/j.injury.2017.09.021 PMID:28985912
14. Van Haren RM, Thorson CM, Valle EJ, Guarch GA, Jouria JM, Busko AM, et al. Vasopressor use during emergency trauma surgery. Am Surg. 2014 May;80(5):472–8. https://doi.org/10.1177/000313481408000518 PMID:24887726
15. Poloujadoff MP, Borron SW, Amathieu R, Favret F, Camara MS, Lapostolle F, et al. Improved survival after resuscitation with norepinephrine in a murine model of uncontrolled hemorrhagic shock. Anesthesiology. 2007 Oct;107(4):591–6. https://doi.org/10.1097/01.anes.0000281926.54940.6a PMID:17893455
16. Harrois A, Baudry N, Huet O, Kato H, Dupic L, Lohez M, et al. Norepinephrine decreases fluid requirements and blood loss while preserving intestinal villi microcirculation during fluid resuscitation of uncontrolled hemorrhagic shock in mice. Anesthesiology. 2015 May;122(5):1093–102. https://doi.org/10.1097/ALN.0000000000000639 PMID:25782753
17. Krishnamoorthy V, Rowhani-Rahbar A, Gibbons EF, Rivara FP, Temkin NR, Pontius C, et al. Early Systolic Dysfunction Following Traumatic Brain Injury: A Cohort Study. Crit Care Med. 2017 Jun;45(6):1028–36. https://doi.org/10.1097/CCM.0000000000002404 PMID:28398926
18. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Crit Care Med. 2017 Mar;45(3):486–552. https://doi.org/10.1097/CCM.0000000000002255 PMID:28098591
19. Higgins J, Thomas J, Chandler J, Cumpston M, Li T. Page MJ, Welch VA (editors): Cochrane Handbook for Systematic Reviews of Interventions. Chichester, UK, John Wiley & Sons, 2019. Available at: http://handbook.cochrane.org. Accessed March 14, 2020.
20. McGowan J, Sampson M, Salzwedel DM, Cogo E, Foerster V, Lefebvre C. PRESS Peer Review of Electronic Search Strategies: 2015 Guideline Statement. J Clin Epidemiol. 2016 Jul;75:40–6. https://doi.org/10.1016/j.jclinepi.2016.01.021 PMID:27005575
21. Cochrane: The Cochrane Collaboration’s tool for assessing risk of bias. 2010. Available at: http://handbook.cochrane.org/index.htm#chapter_8/8_assessing_risk_of_bias_in_included_studies.htm. Accessed December 17, 2020.
22. GRADEpro GDT. GRADEpro Guideline Development Tool. 2015. Available at: https://gradepro.org/. Accessed october 22, 2020. . .
23. TSA software. Copenhagen Trial Unit, 2018.
24. Wetterslev J, Thorlund K, Brok J, Gluud C. Trial sequential analysis may establish when firm evidence is reached in cumulative meta-analysis. J Clin Epidemiol. 2008 Jan;61(1):64–75. https://doi.org/10.1016/j.jclinepi.2007.03.013 PMID:18083463
25. Feinstein AJ, Patel MB, Sanui M, Cohn SM, Majetschak M, Proctor KG. Resuscitation with pressors after traumatic brain injury. J Am Coll Surg. 2005 Oct;201(4):536–45. https://doi.org/10.1016/j.jamcollsurg.2005.05.031 PMID:16183491
26. Feinstein A, Cohn S, King D, Sanui M, Proctor K. Early vasopressin improves short-term survival after pulmonary contusion. J T r a u m a. 2005;59:876– 83.
27. Bayram B, Hocaoglu N, Atilla R, Kalkan S. Effects of terlipressin in a rat model of severe uncontrolled hemorrhage via liver injury. Am J Emerg Med. 2012 Sep;30(7):1176–82. https://doi.org/10.1016/j.ajem.2011.09.007 PMID:22100472
28. Raedler C, Voelckel WG, Wenzel V, Krismer AC, Schmittinger CA, Herff H, et al. Treatment of uncontrolled hemorrhagic shock after liver trauma: fatal effects of fluid resuscitation versus improved outcome after vasopressin. Anesth Analg. 2004 Jun;98(6):1759–66. https://doi.org/10.1213/01.ANE.0000117150.29361.5A PMID:15155342
29. Cavus E, Meybohm P, Doerges V, Hugo H, Steinfath M, Nordstroem J, et al. Cerebral ef fects of three resuscitation protocols in uncontrolle d haemorrhagic shock: A randomise d controlle d experimental study. Resuscitation. 20 09;80 567–72.
30. Cavus E, Meybohm P, Doerges V, Hoecker J, Betz M, Hanss R, et al. Effects of cerebral hypoperfusion on bispectral index: a randomised, controlled animal experiment during haemorrhagic shock. Resuscitation. 2010 Sep;81(9):1183–9. https://doi.org/10.1016/j.resuscitation.2010.05.018 PMID:20598424
31. Stadlbauer KH, Wagner-Berger HG, Raedler C, Voelckel WG, Wenzel V, Krismer AC, et al. Vasopressin, but not fluid resuscitation, enhances survival in a liver trauma model with uncontrolled and otherwise lethal hemorrhagic shock in pigs. Anesthesiology. 2003 Mar;98(3):699–704. https://doi.org/10.1097/00000542-200303000-00018 PMID:12606914
32. Voelckel WG, Raedler C, Wenzel V, Lindner KH, Krismer AC, Schmittinger CA, et al. Arginine vasopressin, but not epinephrine, improves survival in uncontrolled hemorrhagic shock after liver trauma in pigs. Crit Care Med. 2003 Apr;31(4):1160–5. https://doi.org/10.1097/01.CCM.0000060014.75282.69 PMID:12682488
33. Dudkiewicz M, Proctor KG. Tissue oxygenation during management of cerebral perfusion pressure with phenylephrine or vasopressin. Crit Care Med. 2008 Sep;36(9):2641–50. https://doi.org/10.1097/CCM.0b013e3181847af3 PMID:18679110
34. Sanui M, King DR, Feinstein AJ, Varon AJ, Cohn SM, Proctor KG. Effects of arginine vasopressin during resuscitation from hemorrhagic hypotension after traumatic brain injury. Crit Care Med. 2006 Feb;34(2):433–8. https://doi.org/10.1097/01.CCM.0000196206.83534.39 PMID:16424725
35. Meybohm P, Cavus E, Dörges V, Weber B, Stadlbauer KH, Wenzel V, et al. Release of protein S100B in haemorrhagic shock: effects of small volume resuscitation combined with arginine vasopressin. Resuscitation. 2008 Mar;76(3):449–56. https://doi.org/10.1016/j.resuscitation.2007.09.002 PMID:17976887
36. Dunberry-Poissant S, Gilbert K, Bouchard C, Baril F, Cardinal AM, L’Ecuyer S, et al. Fluid sparing and norepinephrine use in a rat model of resuscitated haemorrhagic shock: end-organ impact. Intensive Care Med Exp. 2018 Nov;6(1):47. https://doi.org/10.1186/s40635-018-0212-3 PMID:30421022
37. Stadlbauer KH, Wagner-Berger HG, Krismer AC, Voelckel WG, Konigsrainer A, Lindner KH, et al. Vasopressin improves survival in a porcine model of abdominal vascular injury. Crit Care. 2007;11(4):R81. https://doi.org/10.1186/cc5977 PMID:17659093
38. Li T, Fang Y, Zhu Y, Fan X, Liao Z, Chen F, et al. A small dose of arginine vasopressin in combination with norepinephrine is a good early treatment for uncontrolled hemorrhagic shock after hemostasis. J Surg Res. 2011 Jul;169(1):76–84. https://doi.org/10.1016/j.jss.2010.02.001 PMID:20471036
39. Liu L, Tian K, Xue M, Zhu Y, Lan D, Peng X, et al. Small doses of arginine vasopressin in combination with norepinephrine “buy” time for definitive treatment for uncontrolled hemorrhagic shock in rats. Shock. 2013 Nov;40(5):398–406. https://doi.org/10.1097/SHK.0000000000000036 PMID:24089002
40. Lee JH, Kim K, Jo YH, Kim KS, Lee CC, Kwon WY, et al. Early norepinephrine infusion delays cardiac arrest after hemorrhagic shock in rats. J Emerg Med. 2009 Nov;37(4):376–82. https://doi.org/10.1016/j.jemermed.2008.07.004 PMID:19097734
41. Wiggers HC, Goldberg H, Roemhild F, Ingraham RC. Impending hemorrhagic shock and the course of events following administration of dibenamine. Circulation. 1950 Aug;2(2):179–85. https://doi.org/10.1161/01.CIR.2.2.179 PMID:15427205
42. Remington JW, Hamilton WF, Boyd GH Jr, Hamilton WF Jr, Caddell HM. Role of vasoconstriction in the response of the dog to hemorrhage. Am J Physiol. 1950 Apr;161(1):116–24. https://doi.org/10.1152/ajplegacy.1950.161.1.116 PMID:15419307
43. ATLS Subcommittee ACoSCot, International ATLS Working Group. Advanced Trauma Life Support (ATLS(R)) 10th edition. Anesthesiol Clin. 2019.
44. Morales D, Madigan J, Cullinane S, Chen J, Heath M, Oz M, et al. Reversal by vasopressin of intractable hypotension in the late phase of hemorrhagic shock. Circulation. 1999 Jul;100(3):226–9. https://doi.org/10.1161/01.CIR.100.3.226 PMID:10411844
45. Xu J, Liu L. The role of calcium desensitization in vascular hyporeactivity and its regulation after hemorrhagic shock in the rat. Shock. 2005 Jun;23(6):576–81. PMID:15897813
46. Chen SJ, Wu CC, Yang SN, Lin CI, Yen MH. Hyperpolarization contributes to vascular hyporeactivity in rats with lipopolysaccharide-induced endotoxic shock. Life Sci. 2000 Dec;68(6):659–68. https://doi.org/10.1016/S0024-3205(00)00978-4 PMID:11205880
47. Kai L, Wang ZF, Hu DY, Shi YL, Liu LM. Opioid receptor antagonists modulate Ca2+-activated K+ channels in mesenteric arterial smooth muscle cells of rats in hemorrhagic shock. Shock. 2003 Jan;19(1):85–90. https://doi.org/10.1097/00024382-200301000-00016 PMID:12558150
48. Voelckel WG, Wenzel V. Managing hemorrhagic shock: fluids on the way out—drugs on the way in? Crit Care Med. 2003 Oct;31(10):2552–3. https://doi.org/10.1097/01.CCM.0000089944.54391.D6 PMID:14530766
49. Cohn SM, McCarthy J, Stewart RM, Jonas RB, Dent DL, Michalek JE. McCarthy j, Stewart RM, Jonas RB, Dent DL, Michalek JE. Impact of Low-dose Vasopressin on Trauma Outcome: Prospective Randomized Study. World J Surg. 2010;35(2):430–9. https://doi.org/10.1007/s00268-010-0875-8.
50. Hylands M, Toma A, Beaudoin N, Frenette AJ, D’Aragon F, Belley-Côté É, et al. Early vasopressor use following traumatic injury: a systematic review. BMJ Open. 2017 Nov;7(11):e017559. https://doi.org/10.1136/bmjopen-2017-017559 PMID:29151048
51. Loftus TJ, Kannan KB, Carter CS, Plazas JM, Mira JC, Brakenridge SC, et al. Persistent injury-associated anemia and aging: novel insights. J Trauma Acute Care Surg. 2018 Mar;84(3):490–6. https://doi.org/10.1097/TA.0000000000001766 PMID:29466280
52. Zhong L, Ji X, Wang H, Zhao G, Zhou Q, Xie B. Non- catecholamine vasopressors in the treatment of adult patients with septic shock -evidence from meta-analysis and trial sequntial analysis of randomized clinical trial. journal of intensive care. 2020;8:83-94.

 ORCID
ORCID