Guillermo Rafael Prozzi1,*, María Agustina Mucci Marinchevich2 Mariana Soledad Carlson3
Recibido: 21-10-2020
Aceptado: 12-01-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 3 pp. 303-308|https://doi.org/10.25237/revchilanestv5112041059
PDF|ePub|RIS
Tranexamic acid use in postpartum hemorrhage: what should we know?
Abstract
Postpartum hemorrhage is a common cause of death and complications worldwide in women who give birth. In low-income countries, it is the leading cause of maternal death and a significant public health problem. It has been observed that patients with postpartum hemorrhage have an early increase in fibrinolytic activity that could worsen the maternal outcome. Tranexamic acid is an antifibrinolytic drug that has been shown to decrease bleeding and the need for transfusions in various types of surge- ries and to reduce mortality in trauma patients. A recent large clinical trial found that early administration of tranexamic acid after the diagnosis of postpartum hemorrhage decreases mortality from bleeding. Based on this study, the World Health Organization recommends the administration of tranexamic acid to all women with postpartum hemorrhage. Controlled clinical trials and meta-analyzes have evaluated the efficacy of tranexamic acid used prophylactically in women who have a vaginal or cesarean section delivery. Although some results are encouraging now, they are not conclusive. Tranexamic acid is an inexpensive, widely available drug that has been shown to be cost-effective. It is recommended to administer 1 gram of tranexamic acid within the first 3 hours of birth in all women with postpartum hemorrhage regardless of the cause. The preventive use of the drug should be considered in patients with a high risk of bleeding and who must undergo cesarean section.
Resumen
La hemorragia posparto es una causa frecuente de muerte y complicaciones a nivel mundial en mujeres que dan a luz. En los países de bajos ingresos constituye la principal causa de muerte materna y un problema relevante de salud pública. Se ha observado que las pacientes con hemorragia posparto presentan un aumento precoz de la actividad fibrinolítica que podría empeorar el pronóstico materno. El ácido tranexámico es un fármaco antifibrinolítico que ha demostrado disminuir la hemorragia y la necesidad de transfusiones en varios tipos de cirugías y reducir la mortalidad en pacientes con trauma. Un gran ensayo clínico reciente mostró que la administración precoz de ácido tranexámico luego del diagnóstico de hemorragia posparto disminuye la mortalidad por sangrado. Basada en este estudio, la Organización Mundial de la Salud recomienda la administración de ácido tranexámico a toda mujer con hemorragia posparto. Ensayos clínicos controlados y metaanálisis han evaluado la eficacia del uso profiláctico del fármaco en mujeres que presentan un parto vaginal o una cesárea. Aunque algunos resultados son alentadores, por el momento no son concluyentes. El ácido tranexámico es un medicamento barato, ampliamente disponible, que ha demostrado una buena relación costo-efectividad. Se recomienda administrar 1 g de ácido tranexámico dentro de las 3 primeras horas del nacimiento en toda mujer con hemorragia posparto independientemente de la causa. La utilización preventiva del fármaco debería ser considerada en pacientes que presenten alto riesgo de hemorragia y que deban ser sometidas a una cesárea.
-
Introducción
La hemorragia posparto (HPP) es una causa frecuente de muerte y complicaciones graves en mujeres que dan a luz un nacido vivo ya sea por parto o cesárea[1].
En los países de bajos ingresos el 20% de las muertes maternas se deben a la HPP y constituye la principal causa de muerte. En América Latina y el Caribe la mortalidad por HPP oscila entre el 11% y 16%[2]. Se estima que el 8,2% de las mujeres que dan a luz en la región de las Américas sufrirán una HPP grave que requerirá transfusión sanguínea[3].
Existen múltiples definiciones para el diagnóstico de HPP, una ampliamente utilizada en estudios clínicos es la pérdida de sangre > 500 ml después de un parto vaginal o > 1.000 ml después de cesárea. La Sociedad Latinoamericana de Ginecología y Obstetricia sostiene que la definición más aceptada es la “pérdida de cualquier cantidad de sangre que cause signos de inestabilidad hemodinámica en la paciente”[4]. La alteración hemodinámica y la disminución de la oxigenación tisular serán las responsables de la mayoría de las muertes y complicaciones maternas como falla de órganos, histerectomías o coagulopatías.
Disminuir la mortalidad y las complicaciones de la HPP es una prioridad de salud pública, especialmente en regiones de bajos ingresos donde las mejoras en las estrategias de prevención y tratamiento pueden tener mayor impacto. Hasta hace poco tiempo, la única estrategia farmacológica que había demostrado disminuir la frecuencia de HPP era la administración de uterotónicos inmediatamente después del nacimiento[5],[6].
El ácido tranexámico (ATX) es un fármaco antifibrinolítico que ha demostrado disminuir las pérdidas de sangre y la necesidad de transfusiones en varios tipos de cirugías[7], y reducir la mortalidad en pacientes politraumatizados[8]. Recientemente, el uso del ATX ha despertado interés en el manejo de la HPP, debido a la publicación de ensayos clínicos controlados (ECC), revisiones sistemáticas y metaanálisis que han aportado nueva información sobre su eficacia y seguridad.
El objetivo de este trabajo es revisar las evidencias publicadas en los últimos años sobre el uso del ATX, tanto en la prevención como en el tratamiento de la HPP, con el propósito de brindar al anestesiólogo recomendaciones actualizadas para una mejor toma de decisiones en su práctica clínica.
-
Hemorragia posparto, la fibrinólisis y el efecto del ácido tranexámico
La hemorragia severa, tanto traumática como quirúrgica, se ha asociado a un aumento precoz de la actividad fibrinolítica, y ésta con mayor sangrado y coagulopatía[9]. La fibrinólisis, o degradación del coágulo de fibrina, se debe a la acción lítica de la enzima activa plasmina. Como resultado de la lisis del coagulo, aumentan en plasma las concentraciones de los productos de degradación de la fibrina (PDF) entre los que se encuentra el dímero-D un biomarcador de fibrinólisis[10].
La proenzima inactiva plasminógeno se une a la fibrina en sitios donde está presente el aminoácido lisina y por acción del activador tisular del plasminógeno (aTP), liberado del endotelio, es convertido en la forma activa: plasmina (Figura 1 ).
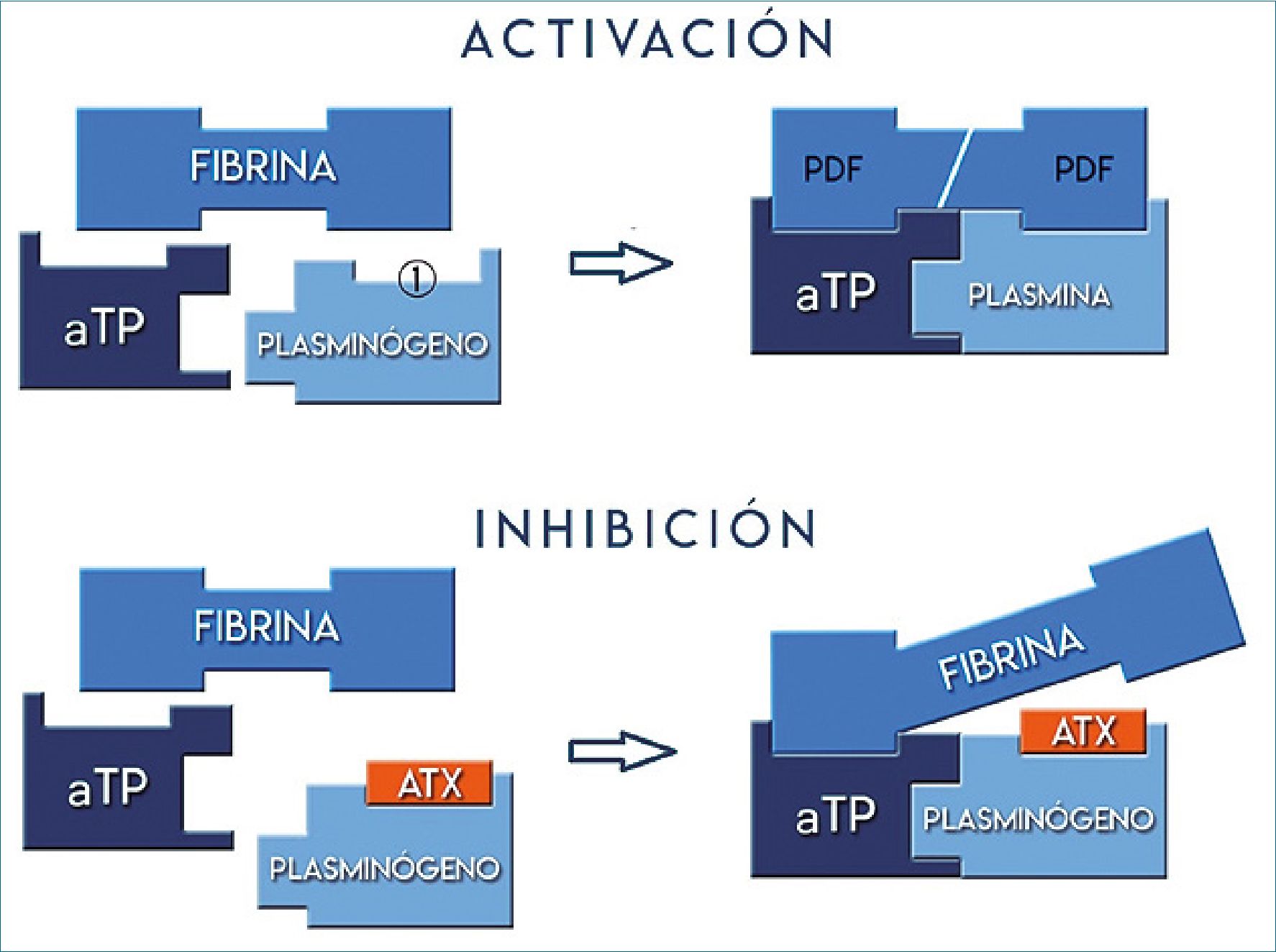
Figura 1 . Fibrinólisis: activación e inhibición. 1 sitio de fijación de la lisina; aTP: activador tisular del plasminógeno; PDF: productos de degradación de la fibrina; ATX: ácido tranexámico.
El ATX es un análogo sintético de la lisina que bloquea de manera competitiva los sitios de unión del plasminógeno a los residuos de lisina presente en la red de fibrina, disminuyendo la actividad de la plasmina y generando un efecto antifibrinolítico, estabilización del coagulo y reducción del sangrado[12].
Así como en el trauma, luego de un parto o cesárea, se observa una duplicación del aTP dentro de la primera hora, y en pacientes con HPP un aumento precoz en los niveles de PDF y del dímero D[||]. Se ha visto que la administración de ATX a estas mujeres logra disminuir los niveles del dimero-D y la actividad fibrinolítica constituyéndose en una intervención terapéutica con el potencial de mejorar la hemostasia y los resultados maternos en la HPP.
-
Ácido tranexámico y el tratamiento de la hemorragia posparto
Hasta el 2017 solo un ECC habían evaluado la eficacia y seguridad del ATX en el tratamiento de la HPP[13]. En ese año, se publica el ensayo World Maternal Antifibrinolytic[14] (WOMAN por sus siglas en inglés), un estudio grande, pragmático, multicéntrico, aleatorio, doble ciego, controlado con placebo cuyos resultados son de suficiente relevancia como para realizar un cambio en la práctica clínica habitual[15].
El estudio fue realizado en 193 hospitales de 21 países, la enorme mayoría de ellos de bajos ingresos. Se reclutaron 20.060 mujeres con diagnóstico clínico de HPP debida a cesárea o parto vaginal. Además de realizarse el tratamiento habitual las mujeres fueron asignadas de manera aleatoria para recibir 1 g de ATX intravenoso (IV) o placebo. Si luego de 30 minutos el sangrado continuaba o si se detenía y recomenzaba dentro de las 24 h posteriores a la primera dosis, se podía administrar una segunda dosis de ATX. Los resultados fueron clínicamente relevantes debido a que la mortalidad por sangrado se redujo significativamente en las mujeres que recibieron ATX. En el grupo que recibió ATX murió el 1,5% vs 1,9% en el grupo placebo (p = 0,045). El beneficio fue mayor cuando se administró el fármaco dentro de las 3 h del nacimiento: 1,2% vs 1,7%, ATX y placebo, respectivamente (p = 0,008). No se observó reducción en las muertes cuando el ATX fue administrado más allá de las 3 h. Por otra parte, el estudio no mostró diferencias estadísticamente significativas entre los grupos en: los efectos adversos, incluidos eventos tromboembólicos (ETE) y convulsiones, las muertes por todas las causas, el número de histerectomías y el número de transfusiones.
Una revisión sistemática posterior confirmó que el ATX por vía IV administrado a mujeres con HPP disminuye la mortalidad materna debida a hemorragia[16].
Basada en los resultados del WOMAN, la Organización Mundial de la Salud (OMS) publicó en el 2017 una actualización en su guía de práctica clínica[17]. Estas nuevas recomendaciones incluyen, además del tratamiento estándar, el uso precoz del ATX por vía IV (dentro de las 3 h del nacimiento), en mujeres con diagnóstico clínico de HPP luego del parto o cesárea.
La guía de la OMS considera como diagnóstico clínico de HPP la definición utilizada en el estudio WOMAN: la pérdida de sangre > 500 ml después de un parto o > 1.000 ml después de una cesárea o cualquier pérdida que genere signos de inestabilidad hemodinámica.
También recomienda que el ATX debiera utilizarse en todos los casos de HPP independientemente de la causa que la origine y, apoya la administración de una dosis fija de 1 g IV durante 10 minutos (100 mg por minuto) y una segunda dosis de 1 g IV, si la hemorragia continúa después de los 30 minutos o si reaparece dentro de las 24 h de la primera dosis. La guía enfatiza la necesidad del uso precoz de la primera dosis del ATX debido a que no se observan beneficios más allá de las 3 h de iniciada la hemorragia. Un metaanálisis de datos individuales de pacientes mostró que el retraso en la administración del ATX puede reducir el beneficio en aproximadamente 10% cada 15 minutos de demora[18].
La OMS sostiene que, independientemente del nivel de atención del sistema de salud, el ATX es una intervención que puede disminuir la mortalidad materna y debería estar disponible en los centros de cuidados de emergencias obstétricas como parte del tratamiento estándar de las HPP. Además, el ATX tiene una buena relación beneficio-costo, es un medicamento barato, ampliamente disponible, estable al calor y no necesita condiciones especiales de transporte ni almacenamiento. Estas características permiten aumentar la accesibilidad al medicamento en las regiones más carenciadas. Un estudio de costo- efectividad, basado en datos del estudio WOMAN, mostró que la utilización del ATX en países de ingresos bajos y medios es altamente costo-efectiva[19].
Aunque el impacto de esta intervención podría ser importante en regiones y países donde la morbimortalidad materna por HPP es elevada, sus beneficios han sido cuestionados para países con baja mortalidad y con sistemas de salud de alta ca
lidad[20],[21]. Sin embargo, recientemente, un consenso multidisci- plinario de organizaciones científicas de países desarrollados de Europa (entre ellas la Sociedad Europea de Anestesiología) en colaboración con la Red para el Avance en el Manejo de Sangre, Hemostasia y Trombosis de los Pacientes (NATA: por sus siglas en inglés) coincide con las recomendaciones de la OMS: el uso precoz de 1 g IV de ATX tan pronto como sea posible dentro de las primeras 3 h de iniciada la HPP[22] (Tabla 1).
| Tabla 1. Uso del ácido tranexámico | |
| Cesárea de alto riesgo de HPP | Considerar el uso de 1 g de ATX IV (administrar preferentemente después del nacimiento) |
| HPP posterior a cesárea o parto vaginal | Administrar 1 g de ATX IV, dentro de las 3 primeras horas y repetir una segunda dosis de 1 gr. IV, si la hemorragia continua luego de 30 minutos o si reaparece dentro de las 24 horas de la primera dosis. |
HPP: hemorragia posparto; ATX: ácido tranexámico; IV: intravenosos; g: gramo.
¿Debemos utilizar el ácido tranexámico como prevención de la HPP?
-
Parto vaginal
Pocos ECC han evaluado el efecto del uso profiláctico del ATX sobre la incidencia de HPP luego de un parto vaginal. El estudio TRAAP (por sus siglas en inglés), el mayor publicado a la fecha, incluyó 3.891 mujeres aleatorizadas a recibir 1 g de ATX o placebo 2 minutos después del nacimiento (además de oxitocina). No mostró una diferencia estadísticamente significativa en la variable principal, la pérdida de al menos 500 ml de sangre, en el grupo ATX 8,1% vs 9,8% en el grupo placebo (P = 0,07). Tampoco la diferencia fue significativa en cuanto a: los valores medios de HPP, la frecuencia de hemorragias severas, los cambios periparto de los niveles de hemoglobina o hematocrito, ni en la necesidad de transfusiones de sangre. Si, se observó una diferencia significativa en variables secundarias, en el grupo ATX fueron menos frecuentes la HPP mayor a 500 ml y el uso adicional de uterotónicos.
Las pacientes fueron seguidas durante 3 meses y no se observaron diferencias en la incidencia de ETE. La frecuencia de náuseas y vómitos en la sala de parto fue mayor en el grupo ATX, pero ninguna fue considerada grave[23].
Un metaanálisis reciente del uso de ATX para la prevención de HPP en partos vaginales, que incluyó el TRAAP y 3 estudios pequeños de baja calidad metodológica, mostró que la administración del fármaco se asocia a una reducción de la pérdida total de sangre, pero no de las HPP severas ni del número de transfusiones de sangre[24].
En resumen, aunque el uso profiláctico de ATX en el parto vaginal podría disminuir la HPP esto debe ser confirmado en ECC grandes. Además, el posible beneficio no se ha traducido en una menor morbilidad materna ni en menor necesidad de transfusiones. Recientes guías de prácticas clínicas sostienen que el ATX no debería utilizarse de rutina como preventivo de la HPP en los partos vaginales[22],[25].
-
Cesárea
Las cesáreas de emergencia o programadas son consideradas un factor de riesgo independiente de la HPP. La frecuencia y severidad del sangrado es significativamente mayor luego de una cesárea que de un parto vaginal[26]. Además, tanto en países desarrollados como en vías de desarrollo se observa en las últimas décadas un aumento del número de cesáreas, lo que incrementa la incidencia de la HPP[27].
El mayor y más reciente metaanálisis de ECC que ha evaluado el efecto del uso preventivo del ATX en las cesáreas incluyó 3.852 pacientes. Comparado con el grupo control, el ATX reduce en forma estadísticamente significativa la hemorragia intraoperatoria, posoperatoria y total en: 155 ml, 27 ml y 185 ml respectivamente. También reduce en aproximadamente 60% los requerimientos de transfusiones, la hemorragia masiva y el uso adicional de uterotónicos[28]. Estos valores son similares a los publicados por una revisión que analizó tres revisiones sistemáticas anteriores[29]. Sin embargo, la mayoría de los ECC incluidos en los análisis fueron pequeños y con fallas metodológicas que deben alertar sobre la validez de los resultados[30].
Aunque la calidad de los datos disponibles es baja, el efecto del uso preventivo del ATX en las cesáreas parecería tener eficacia para la disminución de la hemorragia y las transfusiones. Son necesarios ECC grandes, con adecuados diseños metodológicos, que evalúen variables clínicas relevantes y que confirmen si la relación beneficio-riesgo es favorable, especialmente, cuando el ATX se administra antes del nacimiento.
Actualmente, está en marcha un gran ECC (NCT03364491) que podría cumplir con estos requisitos, aunque el ATX será administrado con posterioridad al clampeo del cordón umbilical y, por lo tanto, no podrá ofrecer información de la exposición neonatal al fármaco. Reclutará alrededor de 11.000 pacientes sometidas a cesáreas y su objetivo principal será evaluar si el uso profiláctico del ATX disminuye la mortalidad materna y la necesidad de transfusiones. Se espera disponer de los resultados en 2021[31].
La evidencia es insuficiente para recomendar el uso universal del ATX como preventivo en las cesáreas, sin embargo, su utilización debería ser considerada en las pacientes de alto riesgo de HPP[22],[25].
-
Riesgos del ácido tranexámico
Administrar un fármaco que inhibe la fibrinolisis a un estado de hipercoagulabilidad sanguínea como el embarazo tiene el riesgo teórico de aumentar la frecuencia de ETE como trombosis venosas, embolia pulmonar, infarto de miocardio o accidente cerebrovascular, y ha sido el principal motivo de preocupación cuando se administra ATX a mujeres embarazadas. Sin embargo, los ECC con mayor poder estadístico (WOMAN y TRAAP) y metaanálisis[32] realizados en pacientes obstétricas no mostraron evidencia de un incremento del riesgo de complicaciones trombóticas con el uso de ATX. Tampoco se observó un aumento del riesgo en poblaciones no obstétricas como en el ensayo CRASH-2 que incluyó más de 20.000 pacientes con trauma[8]. Aunque no puede descartarse un pequeño aumento del riesgo de ETE, los resultados de estos estudios son una buena evidencia de que el ATX es un fármaco seguro. De todas maneras, su uso está contraindicado en presencia de enfermedad trombótica activa y debería evaluarse adecuadamente la relación beneficio-riesgo antes de administrarlo a pacientes de alto riesgo o antecedentes de ETE2[29].
El ATX se ha asociado a un bajo riesgo de convulsiones cuando se administra en dosis altas en el perioperatorio de cirugías cardíacas[33]. Un ECC grande informó que cuando se administraron dosis de 50 y 100 mg/kg a pacientes sometidos a cirugía coronaria, la frecuencia de convulsiones fue de 0,7% en el grupo ATX vs 0,1% en el grupo placebo (P = 0,002) [34]. Con las dosis recomendadas actualmente no hay evidencia que el riesgo de convulsiones aumente en la población de paciente obstétricas. Sin embargo, en mujeres con preeclamsia o antecedentes convulsivos se requiere cautela con su utilización.
Se han publicado series de casos de pacientes con severa HPP que desarrollaron necrosis cortical renal trombótica e insuficiencia renal aguda, asociadas a infusiones prolongadas de ATX > 2 g[]. En los próximos años serán necesarios nuevos estudios y una farmacovigilancia activa para comprobar si el uso de ATX se asocia con esta infrecuente pero grave complicación[30]. El ATX se eliminan sin cambios por filtración glomerular y se recomienda ajustar la dosis en casos de insuficiencia renal[36].
La náuseas y vómitos son los efectos adversos más frecuente asociados al uso de ATX, no son graves y pueden presentarse hasta en el 7% de las pacientes cuando son utilizados en la prevención de la HPP[23].
La seguridad del neonato es un aspecto que requiere una cuidadosa evaluación cuando el ATX es administrado antes del nacimiento. El fármaco pasa a través de la placenta y se encuentra en el cordón umbilical en una concentración similar a la de la sangre materna[37]. Los ECC donde el ATX fue administrado antes del clampeo del cordón umbilical han sido pequeños, realizados en países de bajo desarrollo, y los resultados neonatales no han sido informados, generando incertidumbre sobre sus potenciales riesgos. La falta de datos a corto y largo plazo sobre la seguridad del recién nacido es la principal razón por la que no se recomienda la administración profiláctica de ATX en forma rutinaria antes del nacimiento[30]. Debería evaluarse adecuadamente la relación beneficio-riesgo toda vez que se decida administrar el ATX antes del clampeo del cordón umbilical[10].
El ATX pasa a la leche materna en pequeñas cantidades y aunque su seguridad durante la lactancia no ha sido claramente establecida, estudios observacionales con períodos prolongado de seguimiento no han mostrado aumento del riesgo para los niños[18]. En el estudio WOMAN donde se les administró 1 o 2 dosis de ATX, a más de 10.000 mujeres, tampoco se observó aumento de efectos adversos en los lactantes.
Debido a una mayor disponibilidad y aumento del uso de ATX en el quirófano, se ha incrementado en los últimos años la administración inadvertida por vía espinal, un error con consecuencias devastadoras[39]. Un análisis de una serie de casos mostró que de 21 administraciones subaracnoideas de ATX, por error en la selección de las ampollas, 10 resultaron fatales. De los 7 casos que involucraron cesáreas, 6 terminaron en la muerte de las mujeres, lo que parece indicar una mayor mortalidad en este grupo de pacientes[40]. En aquellos países donde la ampolla de ATX pueda confundirse con la de otros fármacos (anestésicos locales u opioides) todo el personal del quirófano, especialmente los anestesiólogos, deben ser conscientes de este potencialmente mortal error y tomar medidas que tiendan a evitarlo.
-
Conclusiones
La investigación clínica publicada en los últimos años ofrece la esperanza de disminuir la mortalidad y las complicaciones de la HPP. Con este objetivo, además, de las medidas de cuidados establecidas, debería utilizarse ATX en el tratamiento de todos los casos de HPP independientemente de la causa que la origine. Debería administrase en una dosis fija de 1 g IV, dentro de las 3 primeras horas del diagnóstico y repetirse una segunda dosis de 1 g IV, si la hemorragia continua luego de 30 minutos o si reaparece dentro de las 24 h de la primera dosis. El ATX no debería utilizarse de rutina en forma profiláctica. Su utilización preventiva debería ser considerada en las pacientes de alto riesgo de HPP que deban ser sometidas a una operación cesárea.
Agradecimientos: agradecemos a María Victoria Mucci Marinchevich por el diseño de la figura 1.
Conflicto de intereses: ninguno de los autores presenta conflicto de intereses.
Referencias
1. Organización Mundial de la Salud. Recomendaciones de la OMS para la prevención y el tratamiento de la hemorragia posparto 2014. Disponible en: https://www.who.int/reproductivehealth/publications/maternal_perina-tal_health/9789241548502/es/
2. Say L, Chou D, Gemmill A, Tunçalp Ö, Moller AB, Daniels J, et al. Global causes of maternal death: a WHO systematic analysis. Lancet Glob Health. 2014 Jun;2(6):e323–33. https://doi.org/10.1016/S2214-109X(14)70227-X PMID:25103301
3. Panamericana de la Salud O. Organización Mundial de la Salud. Iniciativa de la OPS/OMS busca reducir las muertes maternas por hemorragias en países de las Américas 2015.
4. FLASOG. Hemorragia Postparto. ¿Dónde estamos y hacia dónde vamos? Federación Latinoamericana de Asociaciones de Sociedades de Obstetricia y Ginecología. FLASOG; 2018.
5. Begley CM, Gyte GM, Devane D, McGuire W, Weeks A. Active versus expectant management for women in the third stage of labour. Cochrane Database Syst Rev. 2015 Mar;(3):CD007412. https://doi.org/10.1002/14651858.CD007412.pub4 PMID:25730178
6. Gallos ID, Papadopoulou A, Man R. Athanasopoulos y col. Ute- rotonic agents for preventing postpartum haemorrhage: a net- work meta-analysis. Cochrane Database Syst Rev. 2018;(12):CD011689.
7. Ker K, Edwards P, Perel P, Shakur H, Roberts I. Effect of tranexamic acid on surgical bleeding: systematic review and cumulative meta-analysis. BMJ. 2012 May;344(may17 1):e3054. https://doi.org/10.1136/bmj.e3054 PMID:22611164
8. Shakur-Still H, Roberts I, Bautista R. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial. Lancet. 2010;376(9734):23–32. https://doi.org/10.1016/S0140-6736(10)60835-5 PMID:20554319
9. Brenner A, Ker K, Shakur-Still H, Roberts I. Tranexamic acid for post-partum haemorrhage: What, who and when. Best Pract Res Clin Obstet Gynaecol. 2019 Nov;61:66–74. https://doi.org/10.1016/j.bpobgyn.2019.04.005 PMID:31128974
10. Sentilhes L, Lasocki S, Ducloy-Bouthors AS, Deruelle P, Dreyfus M, Perrotin F, et al. Tranexamic acid for the prevention and treatment of postpartum haemorrhage. Br J Anaesth. 2015 Apr;114(4):576–87. https://doi.org/10.1093/bja/aeu448 PMID:25571934
11. Ducloy-Bouthors AS, Duhamel A, Kipnis E, Tournoys A, Prado-Dupont A, Elkalioubie A, et al. Postpartum haemorrhage related early increase in D-dimers is inhibited by tranexamic acid: haemostasis parameters of a randomized controlled open labelled trial. Br J Anaesth. 2016 May;116(5):641–8. https://doi.org/10.1093/bja/aew021 PMID:27106967
12. Shakur-Still H, Roberts I, Fawole B, Kuti M, Olayemi OO, Bello A, et al. Effect of tranexamic acid on coagulation and fibrinolysis in women with postpartum haemorrhage (WOMAN-ETAC): a single-centre, randomised, double-blind, placebo-controlled trial. Wellcome Open Res. 2018 Aug;3:100. https://doi.org/10.12688/wellcomeopenres.14722.1 PMID:30345385
13. Ducloy-Bouthors AS, Jude B, Duhamel A, Broisin F, Huissoud C, Keita-Meyer H, et al.; EXADELI Study Group. High-dose tranexamic acid reduces blood loss in postpartum haemorrhage. Crit Care. 2011;15(2):R117. https://doi.org/10.1186/cc10143 PMID:21496253
14. Shakur H, Roberts I, Fawole B, Chaudhri R, El-Sheikh M, Akintan A, et al.; WOMAN Trial Collaborators. Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebo-controlled trial. Lancet. 2017 May;389(10084):2105–16. https://doi.org/10.1016/S0140-6736(17)30638-4 PMID:28456509
15. Nualart D, Friedman M, Lacassie HJ. Efectos de la administración temprana de ácido tranexámico en la mortalidad, histerectomías y otras morbilidades en mujeres con hemorragia posparto: un ensayo clínico internacional, aleatorio, doble ciego y controlado contra placebo. Una revisión crítica. Rev Chil Anest. 2019;48(2):97100. https://doi.org/10.25237/revchilanestv48n02.02.
16. Shakur-Still H, Beaumont D, Pavord S, Gayet-Ageron A, Ker K, Mousa HA. Antifibrinolytic drugs for treating primary postpar- tum haemorrhage. Cochrane Database Syst Rev. 2018;(2):CD012964.
17. WHO recommendation on tranexamic acid for the treatment of postpartum haemorrhage. World Health Organization 2017.
18. Gayet-Ageron A, Prieto-Merino D, Ker K, Shakur H, Ageron FX, Roberts I, et al.; Antifibrinolytic Trials Collaboration. Effect of treatment delay on the effectiveness and safety of antifibrinolytics in acute severe haemorrhage: a meta-analysis of individual patient-level data from 40 138 bleeding patients. Lancet. 2018 Jan;391(10116):125–32. https://doi.org/10.1016/S0140-6736(17)32455-8 PMID:29126600
19. Li B, Miners A, Shakur H, Roberts I; WOMAN Trial Collaborators. Tranexamic acid for treatment of women with post-partum haemorrhage in Nigeria and Pakistan: a cost-effectiveness analysis of data from the WOMAN trial. Lancet Glob Health. 2018 Feb;6(2):e222–8. https://doi.org/10.1016/S2214-109X(17)30467-9 PMID:29389542
20. Dennis AT, Griffiths JD. Tranexamic acid for post-partum haemorrhage in the WOMAN trial. Lancet. 2017 Sep;390(10102):1582. https://doi.org/10.1016/S0140-6736(17)31946-3 PMID:28980954
21. Butwick A, Lyell D, Goodnough L. How do I manage severe postpartum hemorrhage? Transfusion. 2020 May;60(5):897–907. https://doi.org/10.1111/trf.15794 PMID:32319687
22. Muñoz M, Stensballe J. Ducloy-Bouthors AS y col. Patient blood management in obstetrics: prevention and treatment of postpar- tum haemorrhage. A NATA consensus statement. Blood Transfus. 2019;17:112–36. PMID:30865585
23. Sentilhes L, Winer N, Azria E, Sénat MV, Le Ray C, Vardon D, et al.; TRAAP Sentilhes L. Winer N, Azria E, Sénat MV, Le Ray C, Vardon D y col. Tranexamic Acid for the Prevention of Blood Loss after Vaginal Delivery. N Engl J Med. 2018;379(8):731–42. https://doi.org/10.1056/NEJMoa1800942.
24. Xia Y, Griffiths BB, Xue Q. Tranexamic acid for postpartum hemorrhage prevention in vaginal delivery: A meta-analysis. Medicine 2020;99:3(e18792). https://doi.org/10.1097/MD.0000000000018792.
25. Sentilhes L, Vayssiere C. Deneux-Tharaux C y col. Postpartum he- morrhage: guidelines for clinical practice from the French College of Gynaecologists and Obstetricians (CNGOF): in collaboration with the French Society of Anesthesiology and Intensive Care (SFAR). Eur J Obstet Gynecol Reprod Biol. 2016;198:12–21. https://doi.org/10.1016/j.ejogrb.2015.12.012 PMID:26773243
26. Oyelese Y, Ananth CV. Postpartum hemorrhage: epidemiology, risk factors, and causes. Clin Obstet Gynecol. 2010 Mar;53(1):147–56. https://doi.org/10.1097/GRF.0b013e3181cc406d PMID:20142652
27. Ceriani Cernadas JM. La epidemia de cesáreas no justificadas, ¿podremos revertirla? Arch Argent Pediatr. 2019 Apr;117(2):66–7. PMID:30869476
28. Wang Y, Liu S, He L. Prophylactic use of tranexamic acid reduces blood loss and transfusion requirements in patients undergoing cesarean section: A meta-analysis. J Obstet Gynaecol Res. 2019 Aug;45(8):1562–75. https://doi.org/10.1111/jog.14013 PMID:31237747
29. Ahmadzia HK, Phillips JM, Katler QS, James AH. Tranexamic Acid for Prevention and Treatment of Postpartum Hemorrhage: An Update on Management and Clinical Outcomes. Obstet Gynecol Surv. 2018 Oct;73(10):587–94. https://doi.org/10.1097/OGX.0000000000000597 PMID:30379320
30. Sentilhes L, Madar H, Mattuizzi A, Froeliger A, Merlot B, Elleboode B, et al. Tranexamic acid for childbirth: why, when, and for whom. Expert Rev Hematol. 2019 Sep;12(9):753–61. https://doi.org/10.1080/17474086.2019.1642744 PMID:31295414
31. ClinicalTrials.gov. Tranexamic Acid for the Prevention of Obstetrical Hemorrhage After Cesarean. Disponible en: https://clinicaltrials.gov/ct2/show/NCT03364491
32. Li C, Gong Y, Dong L, Xie B, Dai Z. Is prophylactic tranexamic acid administration effective and safe for postpartum hemorrhage prevention?: A systematic review and meta-analysis. Medicine (Baltimore). 2017 Jan;96(1):e5653. https://doi.org/10.1097/MD.0000000000005653 PMID:28072700
33. Takagi H, Ando T, Umemoto T; All-Literature Investigation of Cardiovascular Evidence (ALICE) group. Seizures associated with tranexamic acid for cardiac surgery: a meta-analysis of randomized and non-randomized studies. J Cardiovasc Surg (Torino). 2017 Aug;58(4):633–41. https://doi.org/10.23736/S0021-9509.17.09877-9 PMID:28263046
34. Myles PS, Smith JA, Forbes A, Silbert B, Jayarajah M, Painter T, et al.; ATACAS Investigators of the ANZCA Clinical Trials Network. Tranexamic Acid in Patients Undergoing Coronary-Artery Surgery. N Engl J Med. 2017 Jan;376(2):136–48. https://doi.org/10.1056/NEJMoa1606424 PMID:27774838
35. Frimat M, Decambron M, Lebas C, Moktefi A, Lemaitre L, Gnemmi V, et al. Renal Cortical Necrosis in Postpartum Hemorrhage: A Case Series. Am J Kidney Dis. 2016 Jul;68(1):50–7. https://doi.org/10.1053/j.ajkd.2015.11.022 PMID:26786299
36. Earnshaw C, Poole M. Tranexamic Acid. Updat Anaesth. 2020;35:34–8.
37. FDA Tranexamic acid Label. [“Internet”], [acceso 21 julio 2020]. Disponible en: https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/212020lbl.pdf
38. Gilad O, Merlob P, Stahl B, Klinger G. Outcome following tranexamic acid exposure during breastfeeding. Breastfeed Med. 2014 Oct;9(8):407–10. https://doi.org/10.1089/bfm.2014.0027 PMID:25025926
39. Palanisamy A, Kinsella SM. Spinal tranexamic acid – a new killer in town. Anaesthesia. 2019 Jul;74(7):831–3. https://doi.org/10.1111/anae.14632 PMID:30985919
40. Patel S, Robertson B, McConachie I. Catastrophic drug errors involving tranexamic acid administered during spinal anaesthesia. Anaesthesia. 2019 Jul;74(7):904–14. https://doi.org/10.1111/anae.14662 PMID:30985928

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution