Yoel Medina Zambrano 1 , Marcos Bolívar 1 , Martín Toro 1 , Víctor Tortorici 2 ,3,*
Recibido: 23-10-2021
Aceptado: 17-11-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 3 pp. 281-286|https://doi.org/10.25237/revchilanestv5116031115
PDF|ePub|RIS
Abstract
Beyond the temporal-spatial identification of the noxious stimulus and the characterization of its attributes, pain perception involves the retrieval of memories related to previous painful experiences, the use of adaptive learning, as well as the individual’s ability to process and obtain knowledge, which adds a cognitive dimension to this complex sensation. The present review aims to define the neuronal substrates involved in pain processing and cognition, to understand how these processes interact to help modulate pain, and to consider the effect of some analgesic treatments on cognitive performance. Some of the anatomical substrates that are in charge of processing and modulating pain are also involved with certain cognitive processes, such as attention and the generation of expectations, which could be advantageous, and could even represent the foundations of a complemen- tary analgesic option, which eventually might be useful in intolerant or refractory patients or could even help to reduce the prescribed doses of the drugs typically used for pain management.
Resumen
Más allá de la identificación temporo-espacial del estímulo nocivo y de la caracterización de sus atributos, la percepción del dolor supone la recuperación de recuerdos relacionados con experiencias dolorosas previas, el uso de aprendizaje adaptativo, así como la capacidad del individuo para procesar y obtener conocimientos, lo cual añade una dimensión cognitiva a esta compleja sensación. La presente revisión tiene como objetivos definir los sustratos neuronales implicados en el procesamiento del dolor y en la cognición, entender cómo esos procesos interactúan para contribuir a modular el dolor y considerar el efecto de algunos tratamientos analgésicos en el desempeño cognitivo. Parte de los sustratos anatómicos que tienen a su cargo el procesamiento y la modulación del dolor, también están relacionados con ciertos procesos cognitivos, como la atención y la generación de expectativas, lo cual podría resultar ventajoso, e incluso podría representar las bases de una opción analgésica complementaria que, eventualmente sería de utilidad en pacientes intolerantes o fármaco-resistentes, o hasta podría coadyuvar a disminuir las dosis prescritas de los fármacos típicamente empleados para el manejo del dolor.
-
Introducción
Por tratarse de una experiencia subjetiva, que sólo existe en la persona que lo siente, ha sido difícil lograr un consenso en lo relativo a la definición del dolor. El concepto ha sido debatido en tercera persona, e incluso algunas veces malinterpretado. Por esta razón, la Asociación Internacional para el Estudio del Dolor (International Association for the Study of Pain, IASP) en su más reciente revisión[1], lo define como “una experiencia sensorial y emocional desagradable asociada con, o parecida a la asociada con, un daño tisular real o potencial”.
El dolor, per se, implica la recuperación de recuerdos relacionados con experiencias dolorosas previas, con aprendizaje adaptativo, con la toma de decisiones, así como con la capacidad del individuo para procesar, comprender y obtener conocimientos, configurando en base a esto último la llamada dimensión cognitiva-evaluativa del dolor[2]. Algunos de los sustratos neuronales involucrados en estos procesos también están vinculados sinápticamente con los encargados del procesamiento y la modulación endógena del dolor, por lo que podrían regularse de manera recíproca[3]. Es decir, un aumento del dolor podría condicionar y afectar negativamente el funcionamiento de ciertos procesos cognitivos; pero también existe la posibilidad de que, al involucrarse con una tarea cognitivamen- te demandante, un paciente pueda percibir una reducción en la intensidad de su dolor, o pueda tolerarlo de mejor manera.
Por otra parte, el consumo de ciertos analgésicos, al igual que el dolor sostenido, es capaz de inducir acciones en el sistema nervioso central que pueden interferir con la función cog- nitiva[4]. Por ende, comprender la interacción entre el dolor y la cognición permitiría establecer mejores estrategias de tratamiento para pacientes con dolor, particularmente el de características crónicas, disminuyendo la carga que éste representa, al permitir una reinserción social/laboral de forma más rápida y favorecer un mejor desempeño en las actividades diarias. El conocimiento de este tipo de interacción constituye el fundamento de lo que hoy día se conoce como la modulación cognitiva del dolor[5].
La presente revisión tiene como objetivos definir los sustratos neuronales implicados en el procesamiento del dolor y de la cognición, tratar de entender como interactúan dichos sustratos para contribuir a modular el dolor y considerar los efectos ejercidos por algunos agentes analgésicos en el desempeño cognitivo.
-
Sustratos neuronales y regiones cerebrales involucradas con el procesamiento del dolor
Los estímulos que causan dolor (noxas), inciden en el cuerpo procedentes de fuentes internas o externas y son percibidos por los receptores del dolor, también llamados nociceptores, que constituyen las terminaciones periféricas de los aferentes sensoriales primarios. Los nociceptores se encuentran ubicados en la piel, los músculos, las articulaciones, las fascias, los vasos sanguíneos y las vísceras, entre otras localizaciones[2],[3]. En términos generales, se acepta que los nociceptores poseen tres propiedades fisiológicas básicas: se activan frente a estímulos nocivos intensos, codifican la intensidad de los estímulos nocivos y normalmente no poseen actividad espontánea[6].
Por su parte, el procesamiento del dolor se resume en cuatro etapas fundamentales: transducción, transmisión, percepción y modulación[6],[7]. El proceso de transducción consiste en transformar la energía del estímulo nocivo en un código de impulsos eléctricos (potenciales de acción). Este proceso de codificación (generación de cierto número de potenciales de acción en función de la intensidad del estímulo) ocurre en los nociceptores, que tienen la capacidad de diferenciar entre estímulos inocuos y estímulos nocivos[7].
Luego de la transducción, el código de potenciales de acción, que constituye el mensaje nociceptivo, debe iniciar su camino de ascenso, en procura de llegar a las zonas corticales de procesamiento, iniciándose así la fase de transmisión. Para ello, el mensaje nociceptivo viaja a través de las fibras aferentes primarias, que ingresan a la médula espinal, o a los núcleos de relevo sensorial del tallo cerebral, para hacer sinapsis con las neuronas de segundo orden. Los axones de esas neuronas decusan al lado contralateral y terminan en diferentes núcleos talámicos que actúan como aduanas sensoriales y regulan el tráfico de información nociceptiva hacia centros cerebrales superiores, tales como la corteza somato-sensorial primaria (CSSI) y secundaria (CSSII)[8].
Las áreas descritas anteriormente son las que clásicamente han estado vinculadas con el procesamiento del dolor; sin embargo, el estudio a través de neuroimágenes ha permitido añadir nuevas áreas a este esquema tradicional. De esta forma, se suman la corteza prefrontal (CPF), la corteza cingulada anterior (CCA), la corteza insular (CI), la amígdala (AMI), el hipocampo (HIP), el hipotálamo (HIT) y hasta los núcleos de la base (NB)[9]. Estas áreas están involucradas con las características emocionales-afectivas al dolor y en ellas tiene lugar la siguiente etapa del procesamiento de esta sensación, la percepción, que es la respuesta cerebral cortical a las señales nociceptivas.
La CPF es una de las estructuras de mayor importancia en el procesamiento del dolor y se subdivide en varias regiones: medial (CPFm), orbitofrontal (COF), ventrolateral (CPFvl), dorso- lateral (CPFdl) y caudal (CPFc)[3]. Estas áreas establecen conexiones con la CSSI, la CSSII y la CI. Otras estructuras relevantes para el proceso de la percepción del dolor son el HIP, un área involucrada con el aprendizaje y la memoria, así como con la supresión del dolor en momentos de estrés[6], y la AMI, un núcleo que resulta clave en el control de las emociones y sentimientos, particularmente asociados al grado de amenaza y el temor derivado de la percepción del dolor[2],[10].
Además de la vía que cursa en sentido ascendente o centrípeto, existe otra, con características centrífugas o descendentes, que tiene a su cargo el control endógeno del tráfico de la información nociceptiva. De esta manera se incorpora la cuarta fase del procesamiento del dolor, la modulación[6]. Una de las estructuras de mayor importancia en este proceso es la sustancia gris periacueductal (SGPA), ubicada en el mesencéfalo, desde donde se envían proyecciones a la región rostroventromedial del bulbo raquídeo (RRVMB) y al área dorsolateral del tegmento ponto-mescencefálico (ADLTPM). La SGPA está subdividida en las regiones ventral (SGPAv) y dorsal (SGPAd), que liberan en- cefalinas, serotonina, GABA y SP. A través de estudios de imágenes se ha podido evidenciar que la SGPAv está fuertemente conectada a regiones encefálicas, como la CCA y la protuberancia, también involucradas con la modulación descendente del dolor[8]; mientras que la SGPAd está conectada a regiones cerebrales, como la CPF y el HIP, implicadas con las funciones ejecutivas y los procesos cognitivos[11].
En su camino descendente, las conexiones sinápticas entre la SGPA y la RRVMB representan un relevo obligado en la ruta hacia la médula espinal[2]. Desde la RRVMB y la ADLTPM se proyectan neuronas descendentes, a través del fascículo dorsolateral, que llegan al asta posterior de la médula espinal (APME), precisamente a las localizaciones en donde establecen relevos los aferentes sensoriales primarios. De esta manera se liberan en las diferentes láminas de Rexed neurotransmisores que provienen tanto de aportes supraespinales, como de aportes locales, entre ellos serotonina, norepinefrina, encefalinas y endorfinas[6],[10], que regulan la excitabilidad de neuronas nociceptivas específicas y de amplio rango dinámico, logrando de esta manera regular la transmisión del mensaje nociceptivo (Figura 1).
El procesamiento del dolor se resume en 4 etapas fundamentales: transducción, transmisión, percepción y modulación. Inicialmente el estímulo nocivo activa a los receptores del dolor (nociceptores). Esta señal es transducida y enviada al APME, donde la mayoría de las señales decusan al lado contralateral, conformándose así la vía ascendente del dolor. El tálamo representa la siguiente estación de relevo, de donde se enviará la señal a diferentes áreas (CSS I y II, CPF, CCA, CI, AMI, HIP) para el procesamiento del dolor. Entre estas estructuras se establece una interesante interconexión recíproca. A consecuencia del estímulo nocivo, también se activa una vía descendente, cuya función será modular endógenamente al dolor. La SGPA representa una de las estructuras más relevantes de esta vía descendente, enviando proyecciones a la RRVMB y de allí a la APME, justo a nivel de la entrada de las aferencias nociceptivas. Por su parte, los procesos cognitivos derivados de estructuras como la CPF y la CCA también ejercen influencia sobre las estructuras encargadas del procesamiento del dolor, particularmente sobre la SGPA, determinando allí cuánto del mensaje nociceptivo puede proseguir en sentido ascendente. De esta manera se establece una circuitería que permite entender por qué el dolor puede afectar a la cognición, pero también que un estímulo de cierta carga cognitiva pueda coadyuvar en la modulación de ese dolor.
-
Sustratos neuronales y regiones cerebrales involucradas en la cognición
La cognición representa la capacidad del ser humano para procesar información a partir de la percepción, los conocimientos adquiridos con la experiencia y las características subjetivas que permiten valorar dicha información. Partiendo de la importancia que tienen las funciones cognitivas para el ser humano y gracias al avance de las técnicas de neuroimágenes, se han logrado identificar (Tabla 1) regiones cerebrales involucradas estructural y funcionalmente con el control cognitivo[2],[11]. De hecho, estudios recientes[2],[9],[12] ponen en evidencia la asociación entre varias afecciones que cursan con dolor crónico y la disminución del volumen de materia gris en ciertas regiones cerebrales con participación critica en los procesos cognitivos, como la CI, el HIP, la CPFm y la CPFdl.
-
Procesos cognitivos involucrados con la modulación del dolor
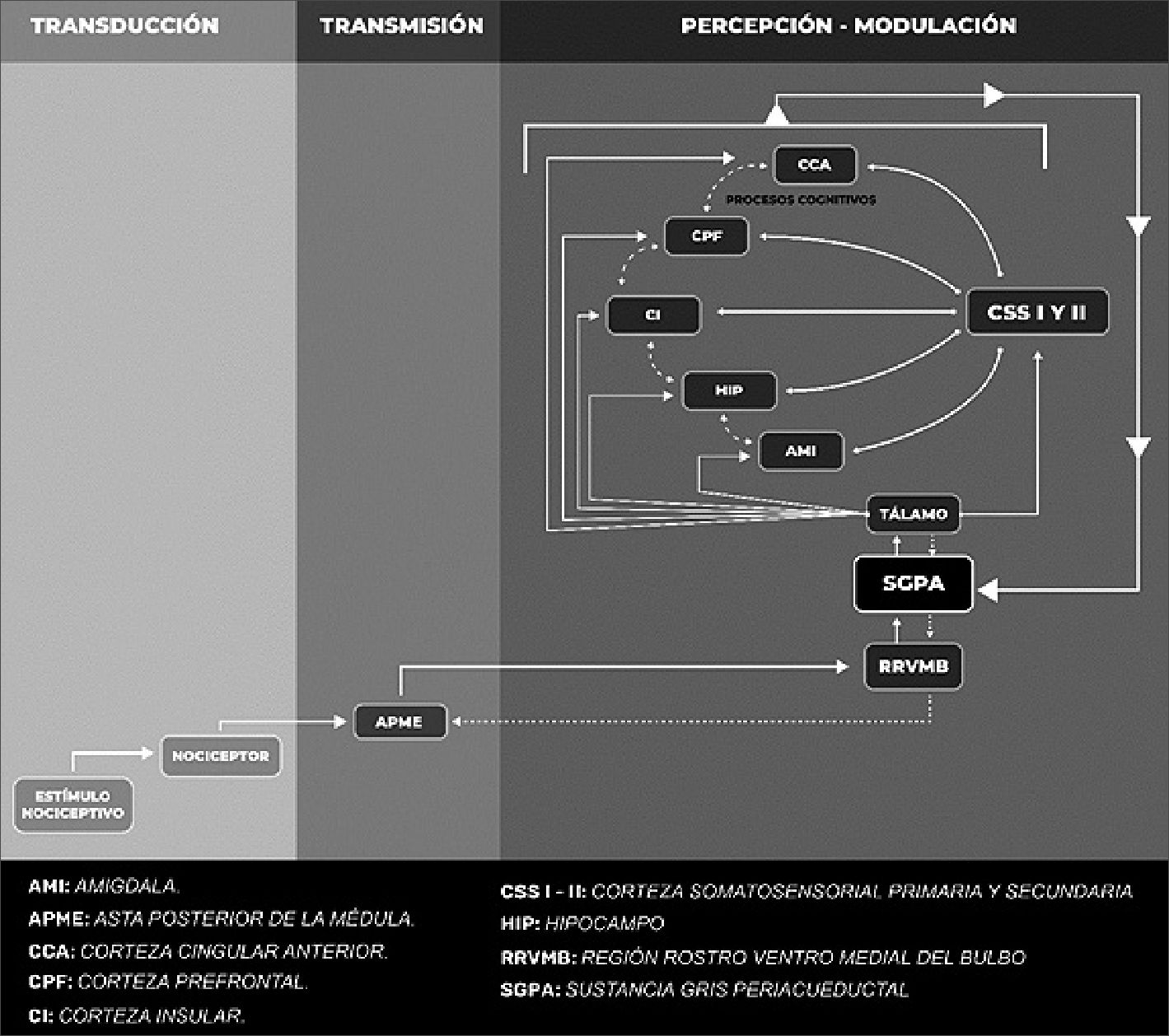
Figura 1. Sustratos neuronales implicados en el procesamiento del dolor y de la cognición.
| Tabla 1. Estructuras cerebrales y su función en el procesamiento cognitivo | |
| Estructura cerebral
Corteza prefrontal dorso lateral (CPFDL) Corteza prefrontal medial (CPFM) Regulación y esfuerzo atencional[3] Corteza orbitofrontal (COF) Hipocampo Amígdala Tálamo Hipotálamo | Función en procesos cognitivos
Análisis de las funciones ejecutivas (control inhibitorio, flexibilidad cognitiva, planificación y organización)[4] Resolución de conflictos Procesamiento y regulación de emociones y estados afectivos. Control de la conducta[3] Memoria episódica, autobiográfica y espacial[3],[4] Valoración de los estímulos emocionales, añade color emocional a las percepciones. Determina el nivel de sensibilidad del individuo ante los eventos ambientales que éste percibe[4] Producción y control de la mayoría de los procesos cognitivos: atención, conciencia, memoria, función ejecutiva[13] Coordinación de conductas esenciales, que permiten la supervivencia del individuo; también contribuye con el estado de alerta y la memoria[6] |
Se conoce que algunos procesos cognitivos operan durante la nocicepción[14]. Más aún, la atención, la expectativa, los fenómenos de aprendizaje-memoria, la velocidad de procesamiento y las funciones ejecutivas podrían usarse para activar respuestas moduladoras endógenas desde estructuras corticales y subcorticales relacionadas con la transmisión del mensaje nociceptivo, y por lo tanto, contribuir a reducir el dolor. Al hacer uso de estos procesos moduladores, se podría contar con una opción analgésica complementaria y distinta al tradicional uso de fármacos, que no solo influyen en el grado de dolor percibido, sino que también tienen la capacidad de afectar el desempeño cognitivo.
-
Atención
La atención es el proceso cognitivo que permite concentrarnos selectivamente en estímulos relevantes y, en consecuencia, responder a ellos de manera efectiva[15]. La atención gobierna nuestra percepción del mundo y el control voluntario de nuestros pensamientos y emociones, y el dolor per se interfiere y tiende a atraer la atención, por lo que rara vez puede ser ignorado; es decir, el dolor promueve un sesgo atencional[16],[17]. En este sentido, es posible que manipulaciones atencionales puedan modular la percepción de dolor y el tiempo de reacción a estímulos nociceptivos (tolerancia al estímulo), especialmente cuando se ejecuta de forma simultánea una tarea no relacionada con dolor que demande un esfuerzo cognitivo[15].
A través del uso de la tomografía por emisión de positrones se han evidenciado áreas cerebrales activadas, preferencial- mente, cuando se presta atención a la ubicación de un estímulo nociceptivo, involucrando entre otras a la CCA, la AMI, la COF, la corteza motora primaria y el HIP; mientras que curiosamente se observa activación a nivel de la CI cuando el individuo enfoca su atención en la intensidad del estímulo[18].
-
Previsión y expectativa
Existen procesos cognitivos como la previsibilidad y la expectativa que alteran anticipadamente las consecuencias de la aplicación de un estímulo nocivo, permitiendo al individuo ajustar los sistemas sensoriales y motores para dar una respuesta neuronal y conductual[11]. Las expectativas, también llamadas “creencias previas”, ayudan a dar sentido a lo que se percibe en el presente, en base a experiencias pasadas similares[19]. Ante un estímulo doloroso las expectativas de disminución de dolor (expectativas positivas), pueden reducir su percepción, mientras que las expectativas de aumento de dolor (expectativas negativas), pueden ejercen un efecto contrario[20]. Durante una estimulación dolorosa, los efectos de las expectativas positivas se observan en conjunto con una intensa actividad en la CCA y el HIP, en comparación con el grupo en el que predominan las expectativas negativas inducidas por el dolor.
-
Memoria y aprendizaje
La memoria puede definirse como el sistema para el mantenimiento temporal y la manipulación de la información, necesaria para la realización de actividades cognitivas tan complejas como la comprensión, el aprendizaje y el razonamiento. Las estructuras cerebrales encargadas de este proceso son la CPF y el HIP, que a su vez están relacionadas con el procesamiento de dolor[21]. Entre las principales quejas de los pacientes con dolor crónico figura la pérdida de la memoria, afectando el rendimiento y el desempeño diario de los afectados[22].
-
Velocidad de procesamiento
La velocidad de procesamiento es una habilidad cognitiva que se define como el tiempo que le toma a una persona realizar una tarea mental[16]. Está relacionado con la velocidad con la que una persona puede comprender y reaccionar a la información que recibe. Los pacientes con dolor crónico muestran tiempos de reacción más lentos, y mientras mayor sea la intensidad del estímulo, más lenta y comprometida resulta la velocidad de procesamiento[2].
-
Funciones ejecutivas
Las investigaciones sugieren que tanto el dolor agudo, como el crónico, pueden influir en las capacidades mentales que están involucradas con el inicio y el mantenimiento del procesamiento fluido de la información en el sistema nervioso central[16]. Estas capacidades son conocidas como funciones ejecutivas y permiten planificar y dirigir comportamientos decididos y flexibles, además de permitir la modificación de comportamientos y pensamientos para responder a una situación similar de manera diferente[23].
-
Efectos de algunos tratamientos analgésicos en el desempeño cognitivo
El logro de un adecuado alivio del dolor, particularmente del dolor crónico, frecuentemente requiere el uso de la llamada terapia multimodal (combinación de dos o más fármacos compatibles) con la finalidad de potenciar la analgesia y reducir los efectos colaterales no deseados.
Las intervenciones farmacológicas pueden estar dirigidas a reducir la inflamación y la sensibilización periférica (que de no regularse conduciría a sensibilización central), a favorecer la modulación endógena del mensaje nociceptivo, o a disminuir el grado de excitabilidad de las neuronas de la vía del dolor, por lo cual tienden a recurrir al uso, individual o combinado, de antiinflamatorios no esteroideos (AINES), opioides, antidepresivos tricíclicos (ADT) y neuromoduladores, entre otros agentes. Algunos de estos fármacos pueden provocar disfunción cognitiva (de novo), o empeorar el deterioro cognitivo existente, que pudiera haber sido causado por el dolor, o por otras comorbilidades asociadas[11].
De todo el arsenal de drogas que se emplean para aliviar el dolor, los opioides, los ADT y los gabapentinoides parecieran tener el mayor impacto en el desempeño cognitivo, particularmente en lo relativo a atención, memoria episódica y de trabajo, concentración y velocidad de respuesta[11],[24]. Sin embargo, algunos estudios no han encontrado efectos cogniti- vos adversos con el uso de estos medicamentos, o incluso han encontrado mejoras en la función cognitiva[25]-[29]. Aparentemente estas inconsistencias estarían asociadas al tiempo de administración de los analgésicos[30], al aumento de la dosis de empleada, al uso de dosis suplementarias[31], al desarrollo concomitante de tolerancia a los efectos cognitivos no deseados, así como a la idea de que el alivio eficaz del dolor puede revertir el deterioro cognitivo inducido por el propio dolor[11].
Igualmente, es importante considerar que el aspecto metodológico de muchos de los estudios que persiguen evaluar el grado de afectación cognitiva medicamentosa no es sencillo. Por ejemplo, la inclusión de grupos de control no siempre posible en investigaciones que involucran a pacientes con dolor crónico, debido a prudentes razones éticas[11]. De esta manera, además de los más típicos efectos colaterales no deseados (alteraciones gastrointestinales, neurológicas, cardiovasculares, respiratorias, endocrinológicas e inmunes), también debería considerarse el posible grado de deterioro cognitivo que pudiera generar la terapia analgésica. Como siempre, una terapia exitosa dependerá del equilibrio entre la efectividad, en este caso analgésica, y toda la gama de posibles efectos adversos que pudieran manifestarse[4].
-
Conclusión
Como ha podido apreciarse en los párrafos anteriores, las regiones cerebrales involucradas en el control cognitivo se relacionan de manera convergente con las redes encargadas del procesamiento de los estímulos nocivos, tanto desde el punto de vista de la transmisión, como de la modulación nociceptiva. Esta correlación anatómica y funcional podría funcionar en diversos sentidos. Por ejemplo, resultaría factible pensar que el buen funcionamiento de los procesos cognitivos podría coadyuvar con el tratamiento farmacológico del dolor. Sin embargo, también sería posible considerar que si un paciente concentra excesivamente su atención en el dolor, terminaría por afectar su desempeño cognitivo.
De lo anterior también se desprende que el uso de recursos que involucren la atención, la expectativa, el aprendizaje, la memoria, la velocidad de procesamiento y/o las funciones ejecutivas, podrían resultar de utilidad para activar las respuestas moduladoras endógenas, reduciendo así el dolor percibido, o al menos aumentando la tolerancia a éste.
Se conoce que los opioides ayudan a controlar el dolor. De hecho, son considerados por muchos, el “gold standard” de la terapia analgésica, pero su uso puede generar eventuales repercusiones a nivel del procesamiento cognitivo, más aún cuando son administrados sin el debido entrenamiento. Estas implicaciones deberían llevarnos a ver al paciente de una manera más integral, buscando un punto de equilibrio, donde no sólo se vigile un adecuado nivel de analgesia, sino que también se mantenga un monitoreo conveniente de las capacidades cognitivas.
Resultaría entonces recomendable que durante el tratamiento farmacológico también se pueda sugerir el uso de alguna distracción de cierta complejidad y evaluar si ésta contribuye a lograr una posible mejoría de los síntomas. Sería de esperar que, para dolores más complejos, de cierto tiempo de instalación y con intensidades más elevadas, se necesiten distractores con mayor carga cognitiva, para que se logre desviar la atención depositada en el dolor hacia la tarea que se impone en simultáneo.
Como inspiración para posibles estudios clínicos, resultaría interesante el tratar de correlacionar el efecto de la ejecución de tareas cognitivamente demandantes con la determinación de componentes pronociceptivos y antinociceptivos endógenos (por ejemplo, a nivel del líquido cefalorraquídeo), a fin de evidenciar si este tipo de maniobras no farmacológicas poseen algún efecto sobre nuestra farmacia endógena y sobre el dolor percibido.
Quizás, en un futuro no muy lejano, una nueva definición de dolor incluya también a lo cognitivo, junto a lo psicofísico y lo emocional. Después de todo el objetivo de cualquier intervención pro-analgésica debe ser el de lograr, de manera integral, una mayor calidad de vida del paciente afectado.
Conflicto de intereses: Los autores manifiestan no tener ningún conflicto de interés que declarar.
Referencias
1. Raja SN, Carr DB, Cohen M, Finnerup NB, Flor H, Gibson S, et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain. 2020 Sep;161(9):1976–82. https://doi.org/10.1097/j.pain.0000000000001939 PMID:32694387
2. Moriarty O, Finn DP. Cognition and pain. Curr Opin Support Palliat Care. 2014 Jun;8(2):130–6. https://doi.org/10.1097/SPC.0000000000000054 PMID:24722475
3. Bushnell MC, Ceko M, Low LA. Cognitive and emotional control of pain and its disruption in chronic pain. Nat Rev Neurosci. 2013 Jul;14(7):502–11. https://doi.org/10.1038/nrn3516 PMID:23719569
4. Kurita GP, Malver LP, Andresen T, Polianskis R, Drewes AM, Christrup L, et al. Does mutual compensation of the cognitive effects induced by pain and opioids exist? An experimental study. Psychopharmacology (Berl). 2015 Apr;232(8):1373–81. https://doi.org/10.1007/s00213-014-3768-y PMID:25345731
5. Allegri N, Mennuni S, Rulli E, Vanacore N, Corli O, Floriani I, et al. Systematic Review and Meta-Analysis on Neuropsychological Effects of Long-Term Use of Opioids in Patients With Chronic Noncancer Pain. Pain Pract. 2019 Mar;19(3):328–43. PMID:30354006
6. Bourne S, Machado AG, Nagel SJ. Basic anatomy and physiology of pain pathways. Neurosurg Clin N Am. 2014 Oct;25(4):629–38. https://doi.org/10.1016/j.nec.2014.06.001 PMID:25240653
7. Eisenberger NI. The neural bases of social pain: evidence for shared representations with physical pain. Psychosom Med. 2012 Feb-Mar;74(2):126–35. https://doi.org/10.1097/PSY.0b013e3182464dd1 PMID:22286852
8. Gutiérrez Jr, Ortiz S, Follioux C, Zamora B, Petra I. Funciones mentales: neurobiología. Departamento de Psiquiatría y Salud Mental, Primera ed, Mexico, 2016, pp.22-33.
9. Fritz HC, McAuley JH, Wittfeld K, Hegenscheid K, Schmidt CO, Langner S, et al. Chronic Back Pain Is Associated With Decreased Prefrontal and Anterior Insular Gray Matter: Results From a Population-Based Cohort Study. J Pain. 2016 Jan;17(1):111–8. https://doi.org/10.1016/j.jpain.2015.10.003 PMID:26476265
10. Garland EL. Pain processing in the human nervous system: a selective review of nociceptive and biobehavioral pathways. Prim Care. 2012 Sep;39(3):561–71. https://doi.org/10.1016/j.pop.2012.06.013 PMID:22958566
11. Moriarty O, McGuire BE, Finn DP. The effect of pain on cognitive function: a review of clinical and preclinical research. Prog Neurobiol. 2011 Mar;93(3):385–404. https://doi.org/10.1016/j.pneurobio.2011.01.002 PMID:21216272
12. Kang D, McAuley JH, Kassem MS, Gatt JM, Gustin SM. What does the grey matter decrease in the medial prefrontal cortex reflect in people with chronic pain? Eur J Pain. 2019 Feb;23(2):203–19. https://doi.org/10.1002/ejp.1304 PMID:30101509
13. Tracey I, Mantyh PW. The cerebral signature for pain perception and its modulation. Neuron. 2007 Aug;55(3):377–91. https://doi.org/10.1016/j.neuron.2007.07.012 PMID:17678852
14. Wiech K, Ploner M, Tracey I. Neurocognitive aspects of pain perception. Trends Cogn Sci. 2008 Aug;12(8):306–13. https://doi.org/10.1016/j.tics.2008.05.005 PMID:18606561
15. Gong W, Fan L, Luo F. Does experimentally induced pain affect attention? A meta-analytical review. J Pain Res. 2019 Feb;12:585–95. https://doi.org/10.2147/JPR.S184183 PMID:30787635
16. Hedges D, Farrer Th, Bigler E, Hopkins R. The Brain at Risk. Springer Nature. Primera ed, Suiza, 2019, pp. 114-121. https://doi.org/10.1007/978-3-030-14260-5.
17. Mao CP, Zhang QL, Bao FX, Liao X, Yang XL, Zhang M. Decreased activation of cingulo-frontal-parietal cognitive/attention network during an attention-demanding task in patients with chronic low back pain. Neuroradiology. 2014 Oct;56(10):903–12. https://doi.org/10.1007/s00234-014-1391-6 PMID:24986218
18. Bingel U, Tracey I, Wiech K. Neuroimaging as a tool to investigate how cognitive factors influence analgesic drug outcomes. Neurosci Lett. 2012 Jun;520(2):149–55. https://doi.org/10.1016/j.neulet.2012.04.043 PMID:22561551
19. Rusu AC, Gajsar H, Schlüter MC, Bremer YI. Cognitive Biases Toward Pain: Implications for a Neurocognitive Processing Perspective in Chronic Pain and its Interaction With Depression. Clin J Pain. 2019 Mar;35(3):252–60. https://doi.org/10.1097/AJP.0000000000000674 PMID:30499835
20. Shih YW, Tsai HY, Lin FS, Lin YH, Chiang CY, Lu ZL, et al. Effects of Positive and Negative Expectations on Human Pain Perception Engage Separate But Interrelated and Dependently Regulated Cerebral Mechanisms. J Neurosci. 2019 Feb;39(7):1261–74. https://doi.org/10.1523/JNEUROSCI.2154-18.2018 PMID:30552181
21. Mazza S, Frot M, Rey AE. A comprehensive literature review of chronic pain and memory. Prog Neuropsychopharmacol Biol Psychiatry. 2018;87(Pt B):183-192. https://doi.org/10.1016/j.pnpbp.2017.08.006.
22. Baird B, Smallwood J, Gorgolewski KJ, Margulies DS. Medial and lateral networks in anterior prefrontal cortex support metacognitive ability for memory and perception. J Neurosci. 2013 Oct;33(42):16657–65. https://doi.org/10.1523/JNEUROSCI.0786-13.2013 PMID:24133268
23. Nadar MS, Jasem Z, Manee FS. The Cognitive Functions in Adults with Chronic Pain: A Comparative Study. Pain Res Manag. 2016;2016:5719380. https://doi.org/10.1155/2016/5719380 PMID:28127233
24. Sjøgren P, Christrup LL, Petersen MA, Højsted J. Neuropsychological assessment of chronic non-malignant pain patients treated in a multidisciplinary pain centre. Eur J Pain. 2005 Aug;9(4):453–62. https://doi.org/10.1016/j.ejpain.2004.10.005 PMID:15979026
25. Boyette-Davis JA, Thompson CD, Fuchs PN. Alterations in attentional mechanisms in response to acute inflammatory pain and morphine administration. Neuroscience. 2008 Jan;151(2):558–63. https://doi.org/10.1016/j.neuroscience.2007.10.032 PMID:18065152
26. Hu Y, Yang J, Hu Y, Wang Y, Li W. Amitriptyline rather than lornoxicam ameliorates neuropathic pain-induced deficits in abilities of spatial learning and memory. Eur J Anaesthesiol. 2010 Feb;27(2):162–8. https://doi.org/10.1097/EJA.0b013e328331a3d5 PMID:19915478
27. Jamison RN, Schein JR, Vallow S, Ascher S, Vorsanger GJ, Katz NP. Neuropsychological effects of long-term opioid use in chronic pain patients. J Pain Symptom Manage. 2003 Oct;26(4):913–21. https://doi.org/10.1016/S0885-3924(03)00310-5 PMID:14527760
28. Millecamps M, Etienne M, Jourdan D, Eschalier A, Ardid D. Decrease in non-selective, non-sustained attention induced by a chronic visceral inflammatory state as a new pain evaluation in rats. Pain. 2004 Jun;109(3):214–24. https://doi.org/10.1016/j.pain.2003.12.028 PMID:15157681
29. Tassain V, Attal N, Fletcher D, Brasseur L, Dégieux P, Chauvin M, et al. Long term effects of oral sustained release morphine on neuropsychological performance in patients with chronic non-cancer pain. Pain. 2003 Jul;104(1-2):389–400. https://doi.org/10.1016/S0304-3959(03)00047-2 PMID:12855350
30. Pask S, Dell’Olio M, Murtagh FE, Boland JW. The Effects of Opioids on Cognition in Older Adults With Cancer and Chronic Noncancer Pain: A Systematic Review. J Pain Symptom Manage. 2020 Apr;59(4):871–893.e1. https://doi.org/10.1016/j.jpainsymman.2019.10.022 PMID:31678462
31. Højsted J, Kurita GP, Kendall S, Lundorff L, de Mattos Pimenta CA, Sjøgren P. Non-analgesic effects of opioids: the cognitive effects of opioids in chronic pain of malignant and non-malignant origin. An update. Curr Pharm Des. 2012;18(37):6116–22. https://doi.org/10.2174/138161212803582522 PMID:22747540

 ORCID
ORCID


 Creative Commons Attribution
Creative Commons Attribution