Julio Burgos 1 ,*, Fernando Salazar 2 , Carlos Mawyin 3 , Yarima Zaldivar 4 , Fernando Aroca 5 , Nancy Palacios 6
Recibido: 15-09-2021
Aceptado: 24-11-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 3 pp. 320-326|https://doi.org/10.25237/revchilanestv5117031646
PDF|ePub|RIS
Abstract
To correlate by ultrasound the diaphragmatic dysfunction in patients with SARS-COVID-19 with the patterns of pulmonary aeration and oxygenation status, as a parameter of orotracheal intubation. Design: Prospective, observational cohort study, carried out between the months of July to September 2020. Setting: emergency area of the “Hospital de Especialidades Dr. Teodoro Maldonado Carbo”. 15 patients with epidemiological link and clinical picture of respiratory failure due to suspected SARS-COVID-19 were included, who underwent the BLUE protocol, measurement of diaphragmatic excursion, thickness and diaphragmatic thickness delta to perform the correlations having as a cohort point a value of < 1.5 cm of diaphragmatic excursion as the main parameter, in addition to PaFi and gradient Aa as measures of oxygenation status. Pulmonary involvement and diaphragmatic dysfunction, state of oxygenation by arterial blood gas. Of the patients studied, 10 were men and 5 women, their average age being 44 years old, the average value of the pulmonary aeration score was 27, diaphragmatic excursion 1.29 cm, both diaphragmatic thickness with Delta of diaphragmatic thickening were not presented greater variation. There was a marked decrease in diaphragmatic excursion in patients with greater compromise of oxygenation and perfusion, demonstrating diaphragmatic dysfunction in the presence of hypercapnia and hypoxia hypoxia with an inverse correlation coefficient of -0.841. It was evidenced that patients with higher pulmonary aeration patterns who had lower diaphragmatic excursion and little variability in the Delta of diaphragmatic thickening ended up in orotracheal intubation, so this parameter can be considered when assessing the severity of patients with SARS-COVID 19 especially when deciding orotracheal intubation.
Resumen
Objetivo: Correlacionar por ultrasonido la disfunción diafragmática en pacientes con SARS-COVID-19 con los patrones de aireación pulmonar y estado de oxigenación, como parámetro de intubación orotraqueal. Estudio de cohorte prospectivo, observacional, realizado entre los meses de julio a septiembre de 2020. Área de emergencia del “Hospital de Especialidades Dr. Teodoro Maldonado Carbo”. Se incluyeron 15 pacientes con nexo epidemiológico y cuadro clínico de insuficiencia respiratoria por sospecha de SARS-COVID-19, a quienes se les realizó el protocolo BLUE, la medición de la excursión diafragmática, el grosor y el delta del grosor diafragmático para realizar las correlaciones, teniendo como punto de cohorte un valor de < 1,5 cm de excursión diafragmática como principal parámetro, además de la PaFi y gradiente A-a como medidas de estado de oxigenación. Compromiso pulmonar y disfunción diafragmática, estado de oxigenación por gasometría arterial. De los pacientes estudiados, 10 eran hombres y 5 mujeres siendo su edad promedio de 44 años de edad. El valor promedio de puntaje de aireación pulmonar fue 27, de excursión diafragmática 1,29 cm, tanto el grosor diafragmático con el Delta de engrosamiento diafragmático no presentaron mayor variación. Existió un descenso marcado de la excursión diafragmática en pacientes con mayor compromiso de oxigenación y perfusión, demostrando la disfunción diafragmática en presencia de hipercapnia e hipoxia con un coeficiente de correlación inversa de – 0,841. Se evidenció que los pacientes con mayores patrones de aireación pulmonar que tenían menor excursión diafragmática y poca variabilidad en el Delta de engrosamiento diafragmático, terminaron en intubación orotraqueal, por lo que este parámetro puede ser considerado al momento de valorar la gravedad de los pacientes con SRAS-COVID-19, sobre todo al momento decidir la intubación orotraqueal.
-
Introducción
El diafragma es considerado el músculo principal de la respiración, y es el responsable de la ejecución del 70% del trabajo respiratorio. Su disfunción provoca falla respiratoria asociada a hipercapnia y en casos más graves podría producir hipoxia[4].
Son varias las causas identificadas que favorecen a la disfunción diafragmática. Entre ellas, tenemos las enfermedades metabólicas, neuromusculares, infecciosas, lesión del nervio frénico o las asociadas al paciente crítico, como las producidas por drogas, polineuropatías o las inducidas por el ventilador, que claramente ha sido estudiado como estrategia del weaning mediante la valoración de la excursión y grosor diafragmático[16].
La disfunción diafragmática es considerada un signo clínico y ecográfico presente en los pacientes con diagnóstico de SARS-COVID-19, caracterizado por agotamiento muscular secundario al estrés oxidativo y procesos inflamatorios que aumentan la necesidad de soporte ventilatorio y la mortalidad del paciente.
La insuficiencia respiratoria aguda en emergencia es una de las principales causas de ingreso, y su diagnóstico y tratamiento va a depender del contexto clínico del paciente, siendo una de las principales interrogantes el momento de decidirse por medios invasivos para mejorar la perfusión y oxigenación del paciente[26]. Estudios realizados por la Facultad de Medicina de la Universidad de Sao Paulo a pacientes con diagnóstico de COVID-19, donde se valoró los patrones de aireación pulmonar a través de la aplicación del protocolo LUS concluyen que el uso de la ecografía pulmonar es de gran utilidad para decidir la internación en UTI, intubación y muerte[15]. En esa investigación se correlacionaron los patrones pulmonares y la gravedad del paciente, de ahí la importancia de este estudio donde se adiciona a la evaluación del patrón de aireación, la valoración de la disfunción diafragmática como parámetro de intubación en pacientes con SARS-COVID-19[15]. Adicional no se encontraron resultado de este estudio en los diferentes buscadores como: Pubmed, Scientific Electronic Library Online (SciELO), Springer Link entre otros.
-
Objetivo
Correlacionar por ultrasonido la disfunción diafragmática en pacientes con SARS-COVID-19 con los patrones de aireación pulmonar y estado de oxigenación, como parámetro de intubación orotraqueal.
-
Pacientes y Métodos
Estudio de cohorte prospectivo, observacional, realizado entre los meses de julio a septiembre de 2020, en el área de emergencia del Hospital de Especialidades Dr. Teodoro Maldo- nado Carbo. Durante la pandemia este hospital fue designado como centro de atención para paciente con COVID-19.
El primer punto de partida de este estudio fueron las muertes registradas desde el inicio de la pandemia, además de los múltiples ingresos a UTI e intubación orotraqueal por falla respiratoria.
Las tomas de muestras de gasometría en este estudio fueron realizas con mascarilla simple de oxígeno.
Población
El número de pacientes estudiados fueron 15, quienes ingresaron al área de emergencia del Hospital de Especialidades Dr. Teodoro Maldonado Carbo durante la pandemia, con cuadro clínico de insuficiencia respiratoria por sospecha de SARS – COVID-19.
Criterios de inclusión
Edad mayor o igual a 18 años de edad con nexo epidemiológico y cuadro clínico de insuficiencia respiratoria por sospecha de SARS – COVID-19.
Criterios de exclusión
Edad menor de 18 años, mujeres embarazadas.
Descripción de la técnica y procedimientos.
La persona encargada de realizar las mediciones ecográficas es Médico de emergencia, Máster en Ecocardiografía Clínica con 3 años de experiencia en este ámbito.
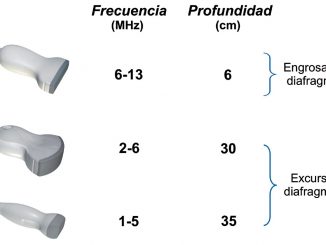
En La exploración ecográfica del diagramática valoramos el movimiento diafragmático que examina la excursión diafragmática con valores normales de 1,5 a 2 cm, y la morfología del diafragma donde se realiza la medición del grosor y del delta del grosor diafragmático con valores normales de 1,8 a 2,2 cm y Atdi > de 30% consecutivamente (Figura 1).
Excursión diafragmática (ED): Se utilizó una sonda convex
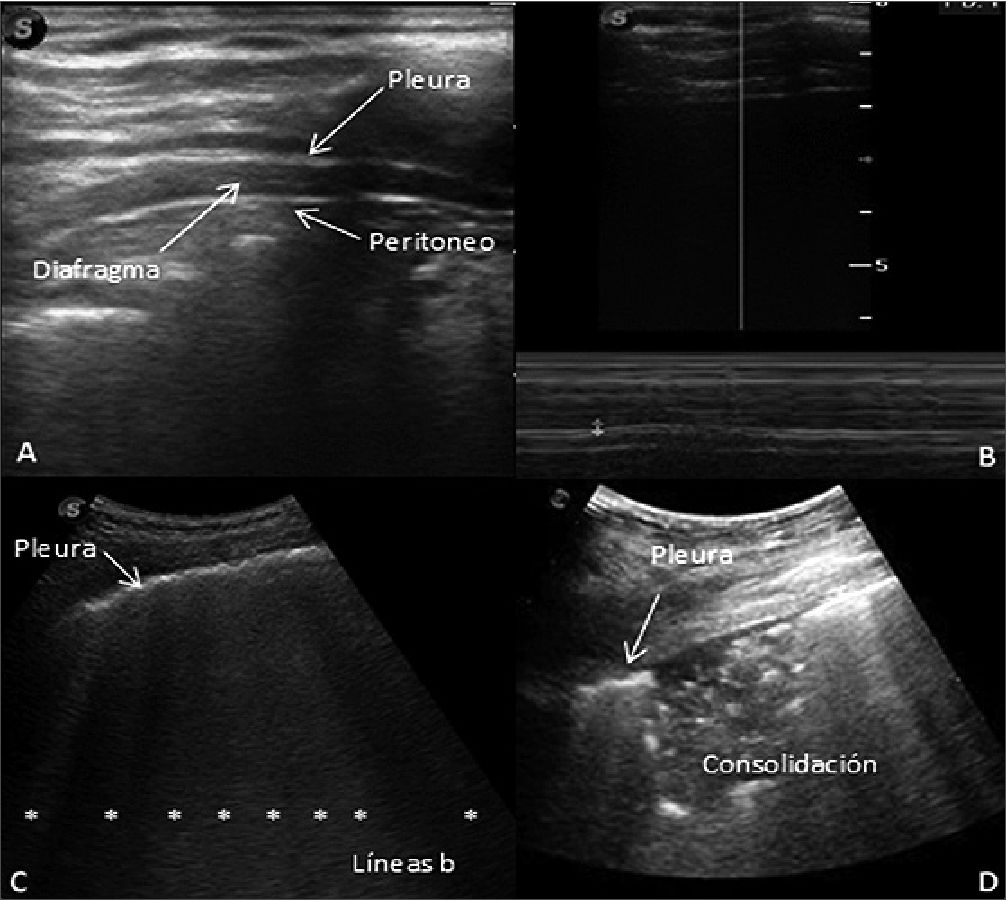
Figura 1. A. Grosor diafragmático modo B, en paciente con respiración espontanea. Se Observa los componentes del emparedado diafragmático, imagen ecogénica (pleura), imagen central no ecogénica (diafragma) y capa subdiafragmática ecogénica (peritoneo); B. Medición de excursión diafragmática modo B, con valor de 1,1 mm; C. Presencia de múltiples líneas b (> 7). D. consolidación subpleural con de pleura aspecto irregular y presencia de línea b.
2-6 MHz, el abordaje fue subcostal anterior en respiración espontánea, con el paciente en decúbito supino se posiciona el transductor a nivel subcostal a la altura de la línea axilar anterior o medio clavicular, y se orienta la muesca en dirección cefálica y posterior, en un ángulo no menor de 70. Los modos empleado fueron el B y el M donde se observa unos movimientos sinusoidales, con ascenso durante la inspiración y descenso en la espiración.
Grosor diafragmático: El abordaje intercostal se realiza con el paciente en decúbito supino; el transductor se coloca en el 8.°-9.° espacio intercostal, en la línea medioaxilar. El haz de US debe ser dirigido perpendicularmente a la caja torácica y se toman medidas del grosor diafragmático en inspiración y espiración. Con estos valores se implementa la siguiente fórmula para obtener el delta del grosor diafragmático:
Atdi % = Grosor al fin de inspiración – grosor al fin de espiración x 100 Grosor al fin de espiración.
La valoración de las lesiones pulmones se realizarón según el protocolo BLUE (Bedside Lung Ultrasound in Emergency) (Figura 2), donde se evidencian patrones como línea a, línea b, consolidaciones y derrame pleural [5],[18],[19],[24].
La exploración se realiza en la posición de decúbito supino, dividiendo cada hemitórax en cuadrantes. Los artículos que evalúan la utilidad de valorar diferentes patrones ecográficos de aireación pulmonar, para obtener una puntuación, analizan seis áreas en cada hemitórax delimitadas por tres líneas longitudinales (eje largo de clavícula a diafragma) a nivel esternal, axilar anterior y axilar posterior; como referencias anatómicas que delimitan tres áreas diferentes: anterior (uno y dos), lateral (tres y cuatro) y posterior (cinco y seis). Trazando una línea transversal a nivel de la mamila estas áreas se dividen en superior e infe rior. De esta forma se determinan seis zonas de exploración torácica. En este sistema de puntuación se utiliza el modelo de exploración de 12 regiones. La puntuación obtenida se calcula sobre la base del peor patrón de ultrasonido detectado en cada una de las 12 regiones o áreas examinadas, asignando un valor de: patrón A = 0 puntos; B1 = 1 punto; B2 = 2 puntos; C = 3 puntos. La puntuación total es la suma de los puntos asignados a cada región (desde 0, puntuación que denotaría el pulmón totalmente aireado, a un máximo de 36, que se considera en un pulmón totalmente condensado) con mayor riesgo de ingreso a unidad de cuidados intensivos, intubación orotraqueal y muerte.
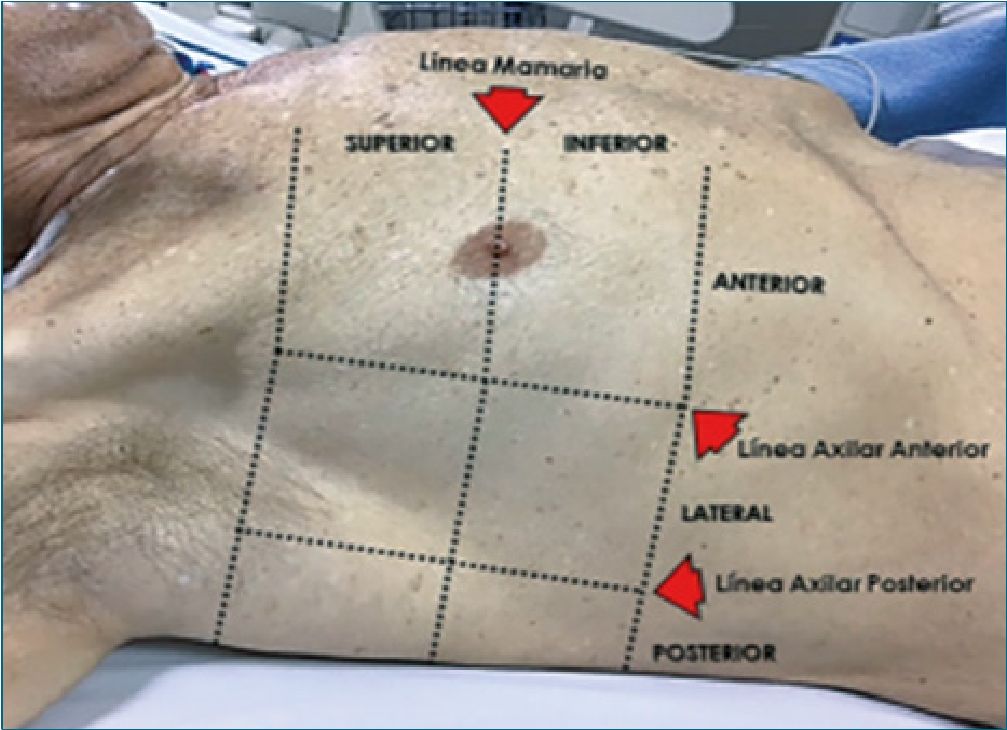
Figura 2. División de cuadrantes según protocolo BLUE.
Se realizó la correlación de la disfunción diafragmática asociado a las lesiones pulmonares eco guiado en paciente con impresión diagnóstica de intubación orotraqueal temprana. SARS – COVID-19, como parámetro de intubación orotraqueal temprana. Se tomaron como valores referenciales de disfunción diafragmática a: Excursión diafragmática < 1,5 cm, grosor dia- fragmático: < 1,8 cm, y un Atdi < de 30%. Como principal dato estado de oxigenación y perfusión se utilizaron el cálculo de la PaFi y la relación de gradiente A-a (alvéolo-alveolar) mediante el estudio gasométrico de ingreso.
-
Resultados
Se incluyeron 15 paciente ingresados en el área de emergencia con signos y síntomas de insuficiencia respiratoria aguda, 10 eran hombres y 5 mujeres. La edad promedio fue de 44 años de edad, a quienes a través del protocolo BLUE, se analizan los patrones de aireación y la presencia o no de disfunción diafragmática según su gravedad obteniendo los siguientes resultados:
En la Tabla 2 se analiza los datos de los paciente estudiados, donde se observa puntajes de aireación pulmonar elevados, en el caso de los pacientes catalogados como graves y menor puntaje para los moderados siendo el valor medio de 27. En relación a la ED solo un paciente (15%) presentó parámetros normales, mientras los otros 14 tienen valores alterados con un valor promedio de 1,29 cm. Tanto el grosor diafragmático con el Atdi no presentaron mayor variación. De los 11 pacientes catalogados como graves, 10 (90%) necesitaron soporte de ventilación invasiva. Se pudo determinar que los pacientes con mayor gravedad y mayor puntaje de aireación con disminución de la ED terminaron en intubación orotraqueal.
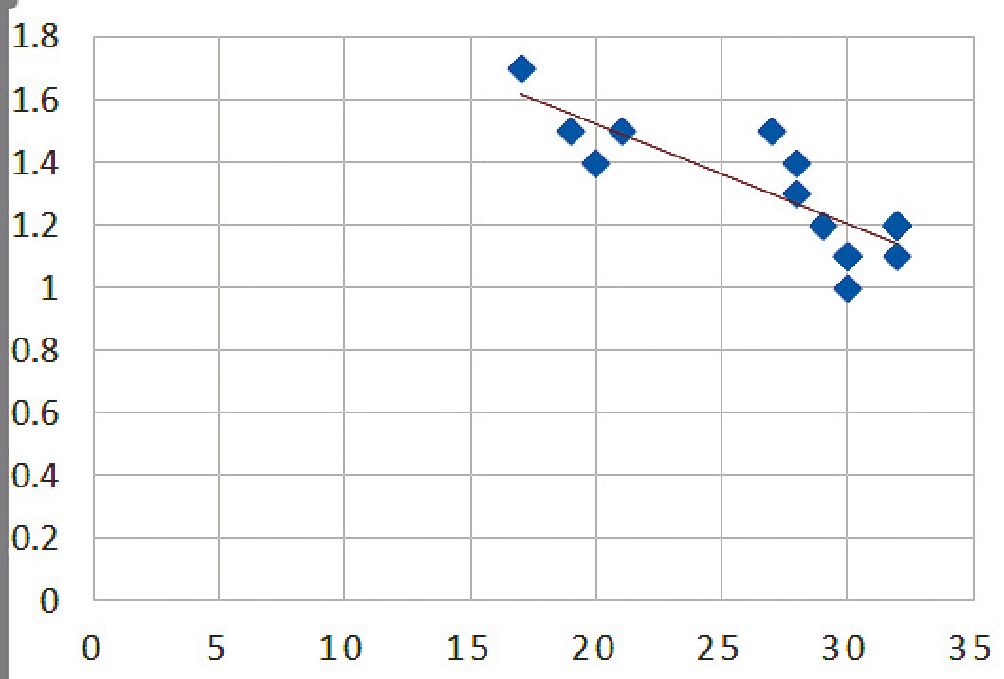
Tabla 1. Correlación entre excursión diafragmática (x) y patrones de aireación pulmonar (y).
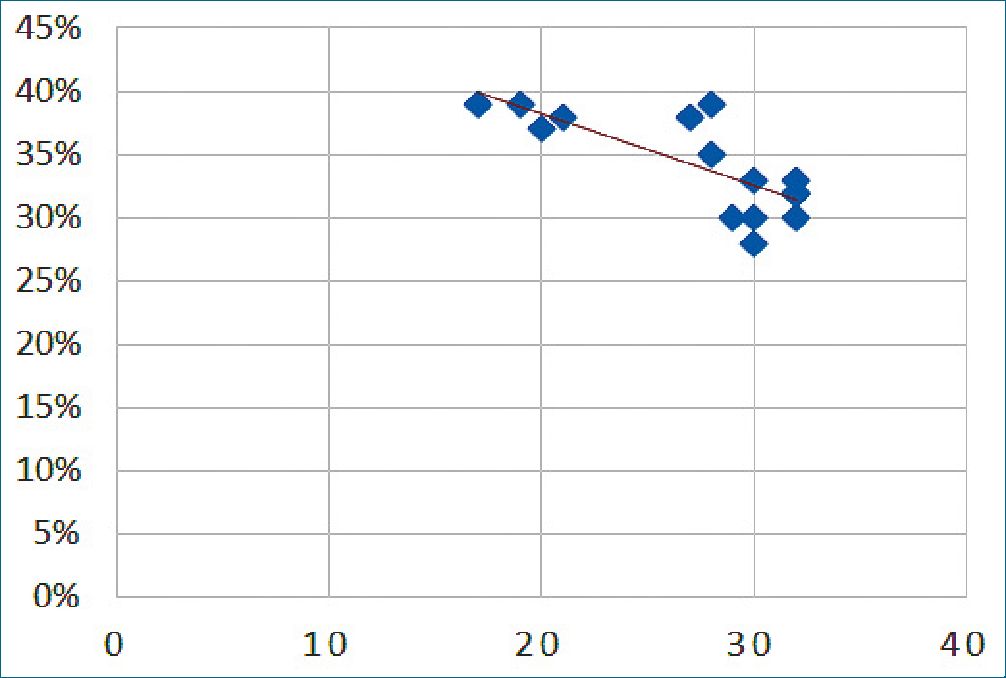
Tabla 2. Correlación entre, Atdi. Delta de Engrasamiento Diafragmático (x) y patrones de aireación pulmonar (y).
La Tabla 3 correlaciona el número de lesiones pulmones a través de los patrones de aireación pulmonar y la medición de la excusión diafragmática. Mientras mayor sea el número de lesiones identificadas, menor será le excursión diafragmática, teniendo, una correlación inversa con un valor de – 0,841. La correlación entre Delta de engrosamiento diafragmático y patrones de aireación (Tabla 4) indica que el porcentaje promedio fue de 34% y en que solo en 4 casos se mantuvo menor o igual de 30%, coincidiendo con el aumento de lesiones pulmonares. En los demás casos estudiados, los valores medidos se mantuvieron dentro de la normalidad, con un valor de correlación inversa de – 0,760, indicando la poca variabilidad del Delta de engrosamiento diafragmático en pacientes graves.
Las mediciones de los patrones de aireación pulmonar y ED con los valores de PaFi y el gradiente A-a obtenidos por gasometría, demuestran que el número y la gravedad de lesiones pulmones se relacionan con los estados de oxigenación y perfusión del paciente, además de un descenso en la ED (Tabla 5).
-
Discusión
Los músculos que intervienen en la respiración son de gran importancia, ya que su contracción produce la expansión de la caja torácica. Los más importantes son los inspiratorios (diafragma, intercostales externos, intercostales paraesternales y músculos inspiratorios accesorios del tronco (pectorales, ester- nocleidomastoideo, serratos, etc.)[14]. El músculo inspiratorio más importante es el diafragma, que desarrolla casi toda la fuerza necesaria para la expansión de la caja torácica, siendo el responsable del incremento del 75% del volumen pulmonar durante una respiración normal, a diferencia de los músculos intercostales, escalenos y esternocleidomastoideo que aportan el 25% restante[4].
Dentro de las causas de disfunción diafragmática Podemos mencionar las enfermedades neuromusculares, las infecciosas, las metabólicas, la lesión del nervio frénico, un posoperatorio de cirugía cardíaca o abdominal, la disfunción diafragmática asociada al paciente crítico secundario a polineuropatías, las drogas, miopatía etc. La ventilación mecánica puede inducir por sí misma la disfunción diafragmática, denominada “disfunción diafragmática inducida por el ventilador”, debido a la a lesión local y posterior atrofia[10],[16],[17].
El estudio del diafragma por ultrasonido se ha convertido en una herramienta necesaria para la evaluación del paciente grave en condiciones que alteran su movilidad, como son la lesión del nervio frénico, enfermedades neuromusculares y el estar bajo ventilación mecánica. La función del diafragma puede ser evaluada midiendo su excursión, además del grosor y su fracción[23]. En pacientes sanos estos parámetros han sido medidos con valores normales en excursión diafragmática de 1,5 a 2 cm. La medición del grosor y del delta del grosor diafragmático con valores normales de 1,8 a 2,2 cm y Atdi > de 30% consecutivamente[1],[2],[8]. Estos parámetros han sido estudiados en varios escenarios clínicos, siendo un gran aporte en el campo aplicado. Por ejemplo en el paciente crítico como predictor de retiro de ventilación mecánica[2],[7],[26], en parálisis del diafragma en pacientes sometidos a cirugías torácica, rehabilitación diafragmática, en drenaje de derrame pleurales paraneoplásicos entre otros.
-
Disfunción diafragmática y patrones pulmones
Existen varias teorías que favorecen a la disfunción diafrag- mática en el paciente grave no ventilado. Entre ellas, las asociadas a la perdida de la elasticidad por un parénquima pulmonar enfermo con aumento de la carga a los músculos de la respiración, en estados asociados hipoxia tisular e hipoperfusión, además del proceso inflamatorio y estrés oxidativo, considerados los principales impulsores de esta disfunción.
a) Disfunción diafragmática por hipoxia tisular e hipoperfusión.
La oxigenación tisular se define como el aporte de oxígeno adecuado a la demanda. La demanda de oxígeno depende de los requerimientos metabólicos de cada tejido[17].
La insuficiencia en la entrega a los tejidos de sustratos me- tabólicos, conlleva a que el paciente entre en fase de metabolismo anaeróbico, acumulación de ácido láctico y finalmente un daño celular irreversible. Sus principales características son hipoxia tisular e hipoperfusión, que llevan a acidosis láctica. El ácido láctico se disocia en H+ y lactato, este aumento en los H+ lleva a acidosis y en respuesta hay hiperventilación para bajar los niveles de CO2. Esto incrementa la carga a la bomba respiratoria; además se presenta un inadecuado aporte de oxígeno al diafragma. Estos dos factores aumentan el riesgo de que se genere fatiga muscular respiratoria. Al presentarse falla muscular se produce acidosis respiratoria, que sumada a la acidosis láctica genera un círculo vicioso en el que el pH desciende rápidamente y el paciente puede progresar al colapso cardiorrespi- ratorio. En pacientes en quienes el choque no es rápidamente corregido, se debe iniciar soporte ventilatorio mecánico para prevenir esta cascada de eventos y además evitar el secuestro de O2 a los órganos vitales, ya que, en estas circunstancias, más del 20% del gasto cardíaco puede ser empleado innecesariamente por el diafragma. Este tipo de pacientes, frecuentemente, requieren que se establezca una vía aérea definitiva, como el tubo orotraqueal, ya que los estados de choque se pueden acompañar de alteraciones en el estado de conciencia y disminución de los reflejos protectores de la vía aérea[13].
b) Disfunción diafragmática por estrés oxidativo.
En los últimos años la comprensión de los mecanismos moleculares y celulares que afectan la dinámica muscular ha sido ampliamente estudiada, hallando que existe un desequilibrio entre la proteólisis y la síntesis de proteínas, resultando en pérdida de proteínas contráctiles[9]. Además, la función proteica muscular se ve alterada por la oxidación y desfosforilación. Considerando que la inflamación y estrés oxidativo son los principales impulsores de esta disfunción (Figura 3)[23].
c) Disfunción diafragmática por pérdida de la elasticidad por un parénquima pulmonar.
En procesos infecciosos donde el parénquima pulmonar se ve afectado y la consecuente respuesta inflamatoria asociada a trasudación de líquido y migración de células efectoras, presencia de fibrina y otras proteínas, tanto en el intersticio como en la luz alveolar, conducen a una disminución de la distensibilidad pulmonar, además de los volúmenes pulmonares, especialmente a expensas de la capacidad residual funcional.
El intercambio gaseoso se ve comprometido en forma característica por alteraciones de la ventilación-perfusión y de cortocircuitos intrapulmonares, como consecuencia del reemplazo del aire alveolar por exudado inflamatorio. Aumenta el trabajo respiratorio como resultado del incremento en la demanda ventilatoria y el aumento de la carga elástica generada por el parénquima pulmonar enfermo[10],[13].
Generalmente, la hipercapnia se presenta debido a una incapacidad de la bomba ventilatoria para mantener un volumen minuto adecuado y lograr la eliminación del CO2. La bomba ventilatoria representada por los músculos respiratorios desarrolla un trabajo determinado, que se opone a la carga mecánica, pero dicha bomba es susceptible de fatigarse posteriormente agotarse[23]. La razón más común de falla de bomba para mantener una adecuada ventilación, es la sobrecarga mecánica, por lo que se ha identificado 2 tipos de sobrecarga mecánica a los músculos respiratorios: La resistencia al flujo de aire y la resistencia a la expansión pulmonar al final de la espiración[13]. Las enfermedades pulmonares (agudas o crónicas) son las causas más comunes para que se desarrolle la falla hipercápnica debido a la carga excesiva de trabajo (Figura 4)[9].
-
Patrones pulmonares
La infección por SARS-COVID-19 se caracteriza por producir en las formas graves, un cuadro de insuficiencia respiratoria que puede evolucionar hacia neumonía y síndrome de distrés respiratorio agudo (SDRA). La ecografía pleuropulmonar puede ser una alternativa diagnóstica válida que permite evaluar el grado de afectación pulmonar, mediante el análisis de patrones ecográficos específicos[3],[18], mediante la aplicación del protocolo BLUE. Estos patrones ecográficos nos permiten establecer la gravedad de las lesiones pulmonares en relación al estado general del paciente. Estas lesiones producen cambios fisiopatológicos en el pulmón, siendo uno de los más importantes el aumento del CO2 e hipoxia por una sobrecarga de la bomba respiratoria, en especial del musculo diafragmático que contribuye con el 75% del trabajo respiratorio[4].
Considerando que la ecografía pulmonar permite proporcionar una representación regional de las diferentes áreas pulmonares, es posible hacer una estimación cuantitativa del grado de pérdida de aireación, independientemente de la etiología. Un sistema de clasificación por ecografía, que se utiliza principalmente en el entorno de la unidad de cuidados intensivos descrito por Soldati G et al[24], el A-BBC score, es una clasificación cuantitativa de los hallazgos en la valoración eco- gráfica que permite predecir la neumonía por el virus SARS- COVID-19, identifica cuatro patrones de pérdida progresiva de aireación[11],[25].
En este sistema de puntuación se utiliza el modelo de exploración de 12 regiones[26]. La puntuación se calcula sobre la base del peor patrón de ultrasonido detectado en cada una de las 12 regiones examinadas, asignando un valor de: patrón A = 0 puntos; B1 = 1 punto; B2 = 2 puntos; C = 3 puntos. La puntuación total es la suma de los puntos asignados a cada región (desde 0, puntuación que denotaría el pulmón totalmente aireado, a un máximo de 36 (Figura 5), que se traduciría en un pulmón totalmente condensado con mayor riesgo de ingreso a UTI, intubación orotraqueal y muerte (6).
-
Estadios de gravedad de la enfermedad
Según los hallazgos ecográficos[6],[12],[21], podemos clasificar la gravedad de la enfermedad como:
– Enfermedad leve: Este patrón se caracteriza por presencia de líneas B, e irregularidad de la línea pleural, además de consolidaciones subpleurales, con áreas preservadas yuxtapuestas a áreas de líneas B.
– Enfermedad moderada: Conforme la enfermedad progresa, se pueden observar un incremento en la cantidad de líneas B y áreas pulmonares comprometidas. Las líneas B pueden confluir formando el signo de la cascada. En varios casos se también se observa derrame pleural, esta etapa correspondería a las opacidades en vidrio deslustrado constatadas en la tomografía axial computarizada.
– Enfermedad grave: Consolidaciones de predominio de áreas posterobasales de aspecto de hepatización con aumento de líneas B que confluyen formando un patrón típico de pulmón blanco[27].
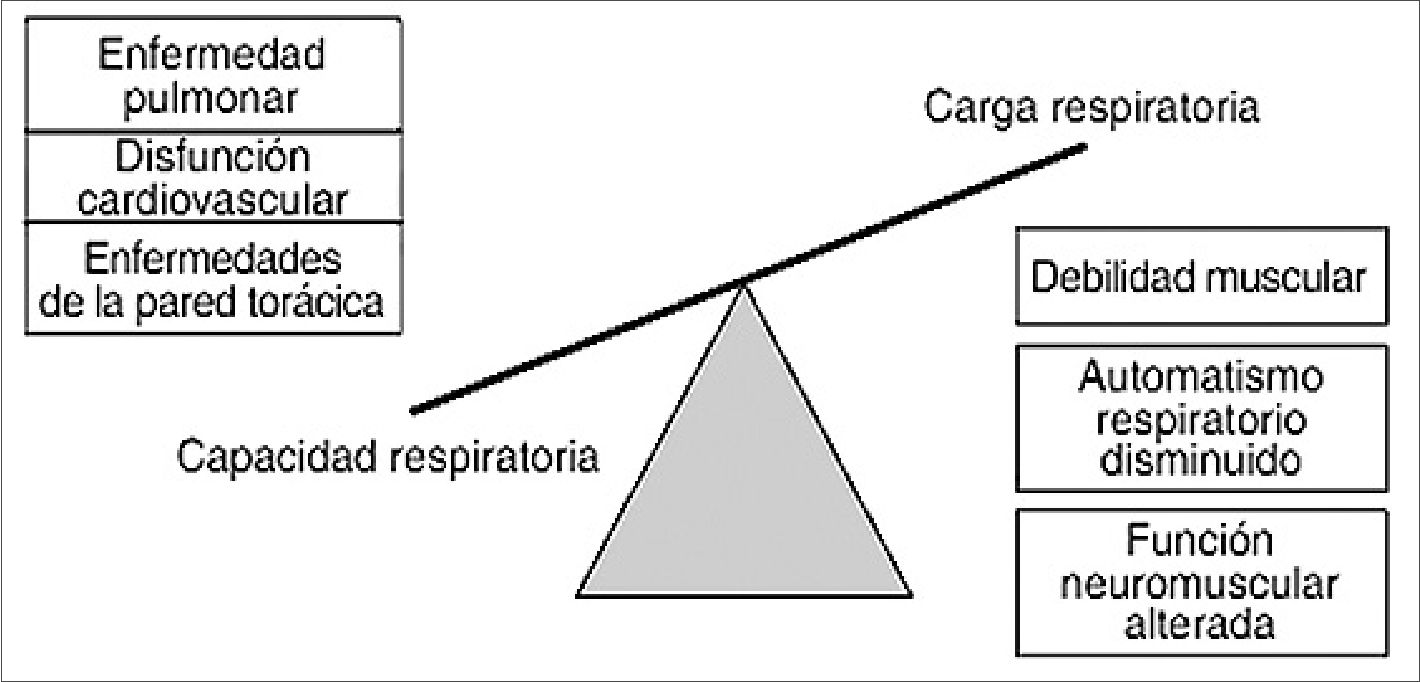
Figura 3. Representación gráfica de condiciones y vías que contribuyen a la debilidad adquirida del diafragma en pacientes en estado crítico. NMBA = Agentes bloqueadores neuromusculares.
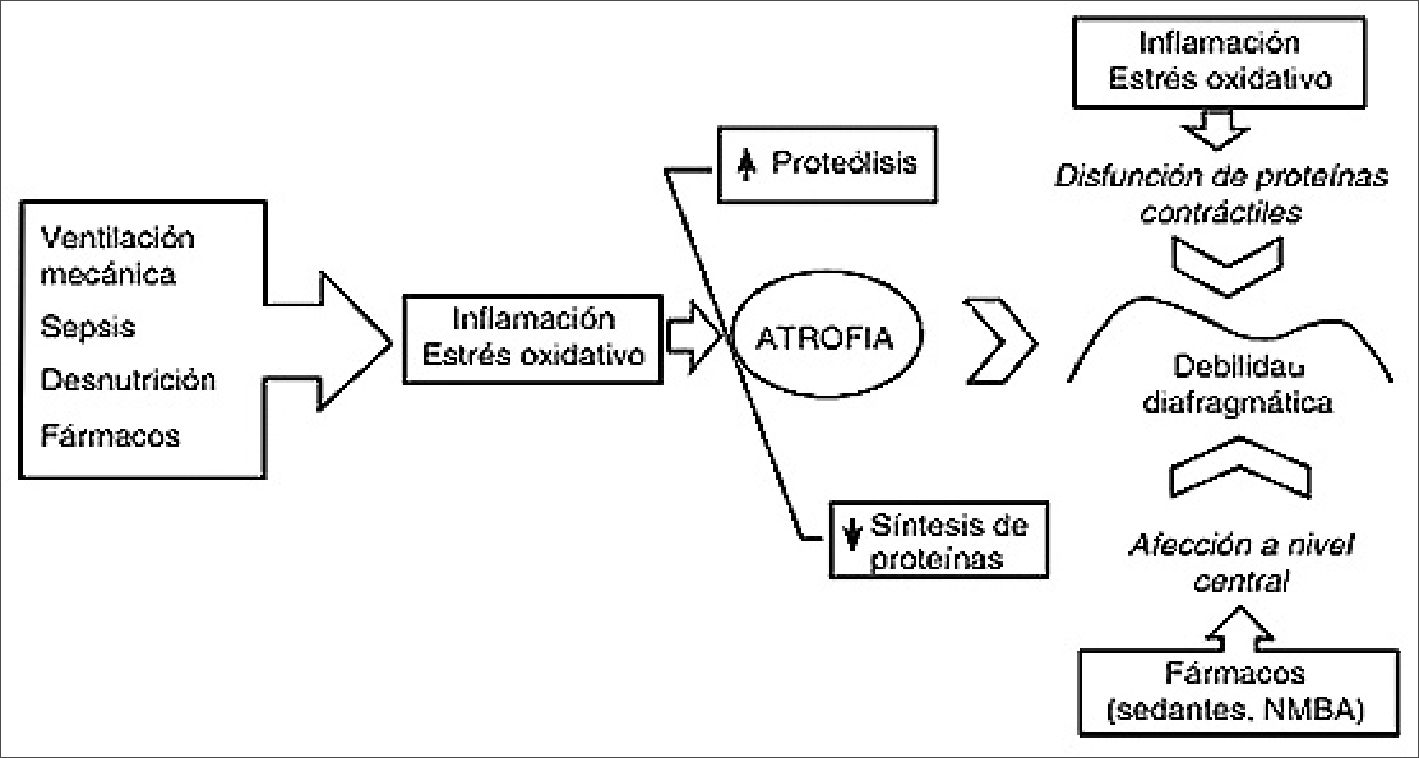
Figura 4. Representación esquemática del desbalance entre las demandas y capacidades del paciente. Cuando las demandas superan las capacidades, es necesaria la ventilación mecánica.
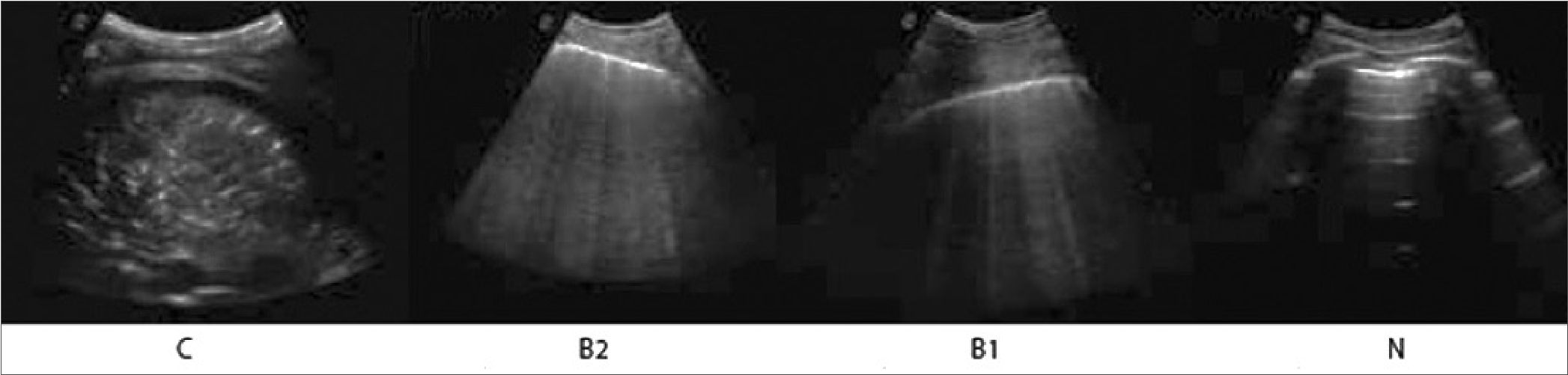
Figura 5. Puntaje de aireación. C: consolidación, pérdida total de la aireación; B2: líneas B confluentes, gran pérdida de la aireación; B1: múltiples líneas B, pérdida moderada de la aireación; N o A: patrón aireación normal.
-
Conclusiones
La disfunción diafragmática puede ser valorada por medio ecográficos a través de la excursión diafragmática y a su vez
correlacionarla con el aumento de lesiones pulmonares al momento de medir la gravedad de la enfermedad por patrones de aireación. En este estudio se evidenció que los pacientes con mayores patrones de aireación tenían menor excursión dia- fragmática y poca variabilidad en el Delta de engrosamiento diafragmático demostrando una correlación inversa. Existió un descenso marcado de la ED en quienes había mayor compromiso en su estado de oxigenación y perfusión, demostrando la disfunción diafragmática en presencia de hipercapnia e hipoxia.
Se pudo determinar que los pacientes con mayor gravedad y mayor puntaje de aireación con disminución de la ED terminaron en Intubación orotraqueal. Por lo que este parámetro (ED) puede ser tomado en cuenta al momento de valorar la gravedad de los pacientes con SARS-COVID-19, sobre todo, al momento decidir la intubación orotraqueal.
-
Comentario
Este estudio amplía el conocimiento sobre el estudio del diafragma y otros grupos musculares que intervienen en el esfuerzo respiratorio, no solo en paciente con SARS-COVID-19, sino también en otras patologías que involucren el estado de oxigenación. Su valoración también podría ser considerada en un futuro en protocolos como: POCUS o FALLS para la valoración del paciente crítico.
Conflictos de interés: Los autores no tienen conflictos de interés
Fuentes de financiamiento: Ninguno.
Referencias
1. Zedan A, William AP. Excursión diafragmática en adultos sanos: valores de normalidad. Estudio de prevalencia analítica. Rev. Colomb. Radiol. 2020;31(3):5374–8. https://doi.org/10.53903/01212095.16.
2. Ángel Augusto Pérez-Calatayud. Raúl Carrillo-Esper y Emilio Arch-Tirado. Propuesta de evaluación cuantitativa en el protocolo ultrasonográfico para retiro de la ventilación mecánica invasiva (GMEMI score). Gac Med Mex. 2016;152:304–12.
3. Bouhemad B, Brisson H, Le-Guen M, Arbelot C, Lu Q, Rouby JJ. Bedside ultrasound assessment of positive end-expiratory pressure-induced lung recruitment. Am J Respir Crit Care Med. 2011 Feb;183(3):341–7. https://doi.org/10.1164/rccm.201003-0369OC PMID:20851923
4. Acosta CM, Urbano MS, Tusman G. Estudio sonográfico del diafragma. Una nueva herramienta diagnóstica para el anestesiólogo. Revista Chilena de Anestesia [Internet]. Asociacion de Medicos Anestesiologos de Chile; 2018 Jun 11;47(2):110–24. http://dx.doi.org/10.25237/revchilanestv47n02.08
5. Daniel A Lichtenstein. Lung ultrasound in the critically ill Lung ultrasound in the critically ill, 2014;4(1)
6. Do Pico, José Luis Parra. et al. Ultrasonografía pulmonar, Ultrasonografía en el paciente crítico, 2019;2:50-53.
7. Ferrari G, De Filippi G, Elia F, Panero F, Volpicelli G, Aprà F. Diaphragm ultrasound as a new index of discontinuation from mechanical ventilation. Crit Ultrasound J. 2014 Jun;6(1):8. https://doi.org/10.1186/2036-7902-6-8 PMID:24949192
8. Glau CL, Conlon TW, Himebauch AS, Yehya N, Weiss SL, Berg RA, et al. Progressive diaphragm atrophy in pediatric acute respiratory failure. Pediatr Crit Care Med. 2018 May;19(5):406–11. https://doi.org/10.1097/PCC.0000000000001485 PMID:29406380
9. Hernández-López GD, Cerón-Juárez R, et al. Retiro de la ventilación mecánica. Med Crit. 2017;31(4):238–45.
10. Gursel G, Inci K, Alasgarova Z. Can Diaphragm Dysfunction Be Reliably Evaluated with Pocket-Sized Ultrasound Devices in Intensive Care Unit? Crit Care Res Pract. 2018 Apr;2018:5192647. https://doi.org/10.1155/2018/5192647 PMID:29808117
11. Henriquez C. Utilidad de la Ecografía Clínica en neumonía vírica por coronavirus. Evidencias en Ecografía Clínica. Especial. 2020 Apr;COVID19:4–11.
12. Huang Y, Wang S, Liu Y, Zhang Y, Zheng C, Zheng Y, et al. A Preliminary Study on the Ultrasonic Manifestations of Peri-pulmonary Lesions of Non-Critical Novel Coronavirus Pneu-monia (COVID-19) [Internet]. Rochester, NY: Social ScienceResearch Network; 2020 Feb [cited 2020 Apr 7].
13. Isabel CC, Zúñiga EC, Sandra XZ, et al. Diagnóstico y manejo de la insuficiencia respiratoria aguda. Neumol Cir Torax. 2008;67(1):24–33.
14. Sauleda Roig J. [Clinical consequences of muscle dysfunction in chronic obstructive pulmonary disease]. Nutr Hosp. 2006 May;21(3 Suppl 3):69–75. PMID:16768033
15. Jorge LC, et al. Usefulness of the diaphragmatic ultrasound in critical patients during detoxification of the artificial mechanical ventilation. Havana-Cuba 2015. Ciencia Digital. 2018;10(4):209–18.
16. de Alencar JC, Marchini JF, Marino LO, da Costa Ribeiro SC, Bueno CG, da Cunha VP, et al.; COVID U. S. P. Registry Team. Lung ultrasound score predicts outcomes in COVID-19 patients admitted to the emergency department. Ann Intensive Care. 2021 Jan;11(1):6. https://doi.org/10.1186/s13613-020-00799-w PMID:33427998
17. Levine S, Nguyen T, Taylor N, Friscia ME, Budak MT, Rothenberg P, et al. Rapid disuse atrophy of diaphragm fibers in mechanically ventilated humans. N Engl J Med. 2008 Mar;358(13):1327–35. https://doi.org/10.1056/NEJMoa070447 PMID:18367735
18. Lichtenstein DA, Mezière GA. Relevance of lung ultrasound in the diagnosis of acute respiratory failure: the BLUE protocol. Chest. 2008 Jul;134(1):117–25. https://doi.org/10.1378/chest.07-2800 PMID:18403664
19. Lichtenstein DA. BLUE-protocol and FALLS-protocol: two applications of lung ultrasound in the critically ill. Chest. 2015 Jun;147(6):1659–70. https://doi.org/10.1378/chest.14-1313 PMID:26033127
20. Pare JR, Camelo I, Mayo KC, Leo MM, Dugas JN, Nelson KP, et al. Point-of-care lung ultrasound is more sensitive than chest radiograph for evaluation of COVID-19. West J Emerg Med. 2020 Jun;21(4):771–8. https://doi.org/10.5811/westjem.2020.5.47743 PMID:32726240
21. Peng QY, Wang XT, Zhang LN; Chinese Critical Care Ultrasound Study Group (CCUSG). Findings of lung ultrasonography of novel corona virus pneumonia during the 2019-2020 epidemic. Intensive Care Med. 2020 May;46(5):849–50. https://doi.org/10.1007/s00134-020-05996-6 PMID:32166346
22. Esper RC, Ángel AP, Carlos AP. Evaluación ultrasonográfica de la función diafragmática mediante doble abordaje en el paciente grave. Rev Asoc Mex Med Crit Ter Intensiv. 2016;30(4):242–5.
23. Esper RC, Talamantes YG. Evaluación ultrasonográfica del diafragma en el enfermo grave. Rev Asoc Mex Med Crit Ter Intensiv. 2014;8(3):187–94.
24. Soldati G, Smargiassi A, Inchingolo R, Buonsenso D, Perrone T, Briganti DF, et al. Proposal for international standardization of the use of lung ultrasound for patients with COVID-19: a simple, quantitative, reproducible Method. J Ultrasound Med. 2020 Jul;39(7):1413–9. https://doi.org/10.1002/jum.15285 PMID:32227492
25. Soldati G, Demi M, Inchingolo R, Smargiassi A, Demi L. On the Physical Basis of Pulmonary Sonographic Interstitial Syndrome. J Ultrasound Med [internet]. 2016 [consultado 31/3/21];35(10):2075-86.
26. V. Fraile Gutiérrez, J.M Ayuela Azcárate. et al. Ecografía en el manejo del paciente crítico con infección por SARS – CoV2 (COVID-19): una revisión narrativa. Rev Med Interne. 2020;44(9):551–65.

 ORCID
ORCID